气体的净化与尾气吸收全解
化学实验基础-常用仪器和基本操作

分析:量筒是专门用来量取液体的,不能用于配制溶液。
(6)(2012·海南高考)硅酸钠溶液应保存在带玻璃塞的试剂瓶
中。( × )
分析:硅酸钠溶液有黏性,能将瓶塞和瓶口黏结,不应保存在带 玻璃塞的试剂瓶中。
(7)(2012·山东高考)盛放NaOH溶液时,使用带玻璃塞的磨口 瓶。( × )
分析:磨口瓶的颈内壁及玻璃塞都是毛玻璃的 ,接触面大,易与
(1)(2012·福建高考)易燃试剂与强氧化性试剂分开放置并远 离火源。( √ ) 分析:易燃试剂往往具有强还原性,易与强氧化性试剂发生氧化 还原反应,故必须分开放置并远离火源。 (2)(2013·福建高考)检验N时,往试样中加入NaOH溶液,微热, 用湿润的蓝色石蕊试纸检验逸出的气体。( × )
(3)烧瓶、烧杯、锥形瓶不可直接加热。
(4)pH试纸不能直接蘸取待测液。
(5)药品不能入口和用手直接接触,实验剩余药品不能放回原处
(K、Na等除外),不能随意丢弃,要放入指定容器中。
(6)中和滴定实验中锥形瓶不能用待测液润洗。
(7)温度计不能代替玻璃棒用于搅拌,测液体温度时不能与容器
内壁接触。
(8)用天平称量药品时,药品不能直接放在托盘上。 (9)量筒不能用来配制溶液或进行化学反应,更不能用来加热或 量取热的溶液。 (10)试纸不能直接用手拿,要用镊子夹取。
C.制备乙酸乙酯的实验中,将导管末端伸入饱和Na2CO3溶液液 面下 D.从试剂瓶中取出金属钠,切下绿豆大小的钠,放入盛有水的烧 杯中,观察钠与水反应
【解题探究】 (1)如何测定溶液的pH? 提示:用玻璃棒蘸取待测液点在pH试纸上,然后把试纸显示的颜 色与标准比色卡比较。 (2)制备乙酸乙酯的实验中,将导管末端伸入饱和Na2CO3溶液液 面下,有什么影响?
2021高考化学一轮复习—第31讲物质的制备
题组二:气体的净化和尾气处理 3.(2020·威海一中联考)下列有关实验室制备气体的说法 中正确的是( A ) A.制氧气时,用Na2O2或H2O2作反应物,可选择相同的 气体发生装置 B.除去CO2中的HCl气体可以用饱和Na2CO3溶液 C.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 D.铜和浓硝酸反应后的气体,可以用水或NaOH溶液吸 收
置→收集装置(性质验证装置)→尾气吸收装置
反应装 置类型
固、固 加热型
反应装置图 适用气体
操作注意事项
①试管要干燥;
②试管口略低于试管底
部;
O2、NH3 等
③加热时先 9 10 固定加热
预热
;
再
④用KMnO4制取O2时,需 在管口处塞一小团棉花
固、液加 热型或 液、液 加热型
①加热烧瓶时要垫石棉 网; Cl2等 ②反应物均为液体时,烧 瓶内要加 11 沸石(或碎瓷片)
题组一:气体的制备 1.(2020·海口市一中模拟)用题给所示装置制备气体,不 能达到目的的是( A )
[解析] 二氧化锰固体与浓盐酸需要在加热条件下反应制 Cl2,A 项不能达到目的。过氧化氢在二氧化锰的催化作用下常 温时即可分解制取 O2,B 项能达到目的。浓硝酸与铜在常温下 发生氧化还原反应可制得 NO2,Na2SO3 与 70%浓硫酸发生复 分解反应可制得 SO2,C、D 项能达到目的。
题组一:无机物的制备 1.(2019·广东深圳调研)用CuCl2·2H2O晶体制取无水 CuCl2的实验装置如图所示,下列说法错误的是( D )
A.通入 HCl 可以抑制 CuCl2 的水解 B.先滴入浓硫酸,再点燃 c 处酒精灯 C.硬质玻璃管内部右侧会出现白雾 D.装置 d 中上层为苯,下层为 NaOH 溶液
高中化学尾气吸收大全

高中化学尾气吸收大全
尾气吸收是化学中非常重要的一个领域,主要用于吸收气体、处理废气和回收有价值的物质。
在高中化学中,尾气吸收主要包括以下几个方面:
1. 氢氧化钠吸收二氧化碳:二氧化碳可以溶解在水中,形成碳酸,然后用氢氧化钠溶液吸收。
氢氧化钠是一种常用的吸收剂,可以吸收二氧化碳,生成碳酸钠和水。
反应方程式为:
CO2 + 2NaOH → Na2CO3 + H2O
2. 硫酸吸收氮氧化物:氮氧化物可以用硫酸吸收,生成硫酸盐和水。
反应方程式为:
NO + SO2 → NO2 + SO3
3. 氢氧化钾吸收二氧化硫:二氧化硫可以溶解在水中,形成硫酸,然后用氢氧化钾溶液吸收。
氢氧化钾是一种常用的吸收剂,可以吸收二氧化硫,生成硫酸钾和水。
反应方程式为:
SO2 + 2KOH → K2SO3 + H2O
4. 活性炭吸收有机物:活性炭是一种非常有效的吸收剂,可以吸收多种有机物,如乙醇、苯和甲醛等。
活性炭吸收有机物的原理是利用其发达的孔隙结构和吸附能力,将有机物吸附在其表面。
除了上述方法外,还有许多其他的尾气吸收方法,如溶液吸收、气体吸收剂等。
在实际应用中,应根据具体情况选择适当的吸收剂和方法。
此外,尾气吸收也是环境保护的重要组成部分,对于处理废气和减少环境污染具有重要意义。
汽车尾气的净化

汽车尾气净化技术
采取的途径主要有两种 一是在不改变 燃料种类的情况下采用清洁燃烧技术 (机内净化)与尾气净化技术(机外净 化);二是利用绿色环保燃料来减少汽 车尾气中有害物的排放。目前国外已运 用的机内净化方法主要有 延迟点火法 、 废气再循环装置、 ECR、 控制燃烧装置 、 CSS、清洁空气装置、 CAP 以及低温等 离子体技术。机内净化只能减少有害气 体的生成量,不能除去已生成的有害气 体 ,因此净化效率不高。
通常所说的光触媒是一类以TiO2为代表的 具有光催化功能的光半导体材料的总称。 光催化降解材料在紫外线的照射下, 其中的TiO2,可产生游离电子及空穴,因 而具有很强的光氧化还原能力,可氧化分 解汽车尾气中的有机化合物和部分无机物。 同时,TiO2受光后生成的氢氧自由基能对 有机物质和有害气体进行氧化还原反应, 将其转化为无害的水、一氧化碳和盐等。 反应过程中,TiO2作为催化剂本身并不直 接参与氧化还原的反应,而只是扮演发生
汽车尾气的 净化
第八组
随着经济的发展,汽车已走进千家万户,而随着汽车 的增加,汽车尾气对环境的影响也日益显著,汽车尾 气中含有多种有害气体,有害颗粒等,对人的身体健 康有很大危害,人们的环保呼声越来越高涨。
因此,降低机动车的废气排 放成为当今社会的热点之一。 尾气处理有多种方法,使用 新能源,改善燃烧装置等, 其中汽车尾气净化催化剂是 控制汽车尾气排放减少污染 的最有效手段。
化合物代替贵金属作催化剂,可以更有效 地解决汽车尾气中一氧化碳和氮氧化物的 污染问题。我国位于江苏无锡国家高新区 内的威孚力达催化净化器有限责任公司, 自主研发国Ⅲ排放标准汽车尾气纳米稀土 催化剂,已成功在奇瑞、沈阳金杯、海马、 北汽福田、吉利美日等车型上通过了国Ⅲ 匹配试验,综合性能在冈内处于领先地位。 2008年起全面配套在国内主要机动整车 上。
高中化学第4章 第24讲 常见气体的实验室制备、净化和收集---2023年高考化学一轮复习(新高考

第24讲 常见气体的实验室制备、净化和收集复习目标 1.了解常见气体制备原理、装置及改进。
2.能根据气体的性质及制备原理设计实验流程。
1.气体制备实验的基本思路2.重要气体的发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类:(1)固体+固体――→△气体 发生装置如图:制备气体:O 2、NH 3、CH 4等。
(2)固体+液体(或液体+液体)――→△气体 发生装置:制备气体:Cl 2、C 2H 4等。
(3)固体+液体(不加热)―→气体 发生装置:制备气体:选择合适的药品和装置能制取中学化学中常见的气体。
3.常见气体典型制备系统举例(1)Cl2的实验室制备(2)SO2的实验室制备(3)NH3的实验室制备4.气体的除杂方法(1)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。
除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体。
(2)气体干燥净化装置类型液态干燥剂固态干燥剂固体,加热装置图ⅠⅡⅢⅣ常见干燥剂浓H2SO4(酸性、强氧化性)无水氯化钙(中性)、碱石灰(碱性)除杂试剂Cu、CuO、Mg等当CO2中混有O2杂质时,应选用上述Ⅰ~Ⅳ中的Ⅳ装置除O2,除杂试剂是Cu粉。
5.气体的收集方法收集方法收集气体的类型收集装置可收集的气体(举例)排水法难溶于水或微溶于水,且不与水反应的气体O2、H2、NO、CO等排空气法向上排空气法密度大于空气且不与空气中的成分反应Cl2、SO2、NO2、CO2向下排空气法密度小于空气且不与空气中的成分反应H2、NH36.集气装置的创新——排液集气装置装置(Ⅰ)从a管进气b管出水可收集难溶于水的气体,如H2、O2等。
若将广口瓶中的液体更换,还可以收集以下气体。
①饱和食盐水——收集Cl2。
②饱和NaHCO3溶液——收集CO2。
③饱和NaHS溶液——收集H2S。
④四氯化碳——收集HCl或NH3。
尾气吸收喷淋塔的工作原理

尾气吸收喷淋塔的工作原理
一、气体分散
尾气吸收喷淋塔的首要工作环节是气体的分散。
通过喷淋装置,将吸收液雾化并均匀地分散在塔内。
这种雾化作用能够大幅度增加气液两相的接触面积,有助于后续的吸收和反应过程的顺利进行。
二、吸收作用
吸收是指气体溶质由气相向液相传递的过程。
在尾气吸收喷淋塔中,吸收液与尾气逆流接触,从而实现对有害气体的吸收。
在吸收过程中,吸收液中的溶质会不断积累,而尾气中的气体溶质则会逐渐减少。
三、化学反应
对于某些特定的有害气体,单纯的物理吸收可能无法达到理想的处理效果。
此时,需要借助化学反应来提高处理效率。
在喷淋塔内,化学反应可能发生在气体溶质、吸收液组分或其它添加物之间。
通过化学反应,能够将有害物质转化为无害或低害物质,从而达到净化的目的。
四、分离过程
完成吸收和反应后,需要对残余的尾气和吸收液进行分离。
分离过程包括液滴的聚结、沉降以及气体的排出。
经过分离,洁净的气体得以排出,而吸收液则可循环利用。
五、循环利用
为了提高资源利用率并降低处理成本,经过分离的吸收液会被循环利用。
在循环过程中,可能需要对吸收液进行适当地补充和再生,以维持其良好的处理性能。
通过以上五个环节的协同作用,尾气吸收喷淋塔能够有效地净化尾气,减少有害物质的排放,保护环境安全。
尾气处理原理

尾气处理原理
尾气处理是指对机动车尾气中的有害气体进行处理的技术。
随着汽车数量的增加,尾气排放对环境造成的影响也越来越大,因此尾气处理技术变得越来越重要。
本文将介绍尾气处理的原理及相关技术。
首先,尾气处理的原理是通过一系列的化学反应将有害气体转化为无害物质,从而减少对环境的污染。
常见的尾气处理技术包括三元催化转化、颗粒捕集器、氮氧化物还原催化剂等。
三元催化转化是目前最常用的尾气处理技术之一。
它利用三元催化剂将一氧化碳、碳氢化合物和氮氧化物转化为二氧化碳、水和氮气,从而减少有害气体的排放。
这种技术在汽车上广泛应用,效果显著。
另一种常见的尾气处理技术是颗粒捕集器。
颗粒捕集器可以捕集柴油车尾气中的颗粒物,防止其排放到大气中。
通过定期清洗或燃烧这些颗粒物,可以有效减少柴油车的尾气排放。
氮氧化物还原催化剂是针对柴油车尾气中氮氧化物排放较多的
问题而设计的。
它利用还原剂将氮氧化物转化为氮气和水,从而减少对环境的影响。
这种技术在柴油车上得到了广泛应用。
除了以上提到的技术外,还有一些新型的尾气处理技术不断涌现,如SCR技术、DPF技术等。
这些技术在不同类型的车辆上有着不同的应用,但它们的核心原理都是通过化学反应将有害气体转化为无害物质。
总的来说,尾气处理技术的发展为环境保护做出了重要贡献。
随着技术的不断进步,尾气处理技术将会变得更加高效、环保。
相信在不久的将来,汽车尾气对环境造成的影响将会得到有效控制。
常见气体的制备、净化、收集、尾气处理

密度比密度比 空气大, 空气大空气小, , 空气小, 向上排向下排 空气法空气法
(2)排水法(难溶于水、也不跟水反应) 排水法(难溶于水、也不跟水反应) 排水法 →
5、尾气处理(有毒气体必须要尾气处理) 、尾气处理(有毒气体必须要尾气处理)
•溶液吸收 溶液吸收 •点燃 点燃 •充袋法 充袋法
极易溶于水的要用防倒吸装置: 极易溶于水的要用防倒吸装置: 如HCl和NH3 和
20.(12分)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饮料添 加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体: ①将5%Na2CO-3溶液加入到盛有一定量废铁悄的烧杯中, 加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤 2~3遍。 ②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在 50~80℃之间至铁屑耗尽; ③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶; ④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用 滤纸将晶体吸干; ⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保 存。 请回答下列问题: (1)实验步骤①的目的是 ,加热的作用是 。 (2)实验步骤①明显不合理,理由是 。 ; 。 (3)实验步骤④中用少量冰水洗涤晶体,其目的是
(3)固(液)体+液体 →气体 ) 液体 气体 反应容器:试管、 反应容器:试管、烧瓶 加液容器: 加液容器:分液漏斗
△
可制备C 可制备 l2、C 2H4等
2、气体的净化装置 、
通入溶液中除杂(洗气): 长进短出 通入溶液中除杂(洗气):
通过固体除杂: 通过固体除杂: 大进小出
怎样把括号内的杂质出去 Cl2(HCl) CO(CO2) ) 饱和NaCl溶液 饱和 溶液
尾气吸收实验操作流程

尾气吸收实验操作流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!Download Tip: This document has been carefully written by the editor. I hope that after you download, they can help you solve practical problems. After downloading, the document can be customized and modified. Please adjust and use it according to actual needs. Thank you!尾气吸收实验操作流程:①实验准备:穿戴好实验防护装备,如实验服、手套、护目镜。
检查实验装置完好,包括气体发生装置、吸收塔、收集瓶等。
②气体产生:根据实验要求,配置反应物溶液,加热或加入催化剂生成目标尾气,如二氧化硫、氨气等,确保气密性良好。
③吸收液配制:根据尾气成分,选择合适的吸收液,如氢氧化钠溶液吸收二氧化碳,稀硫酸溶液吸收氨气,配制至指定浓度。
④连接装置:将气体发生装置产生的尾气导管连接至吸收塔入口,吸收塔底部加入预设体积的吸收液。
⑤开启实验:缓缓开启气体发生装置,调节气体流量,确保尾气稳定进入吸收塔,同时观察吸收液变化。
⑥监测与记录:使用pH试纸、指示剂或气体检测仪监测吸收前后气体成分变化及吸收液性质,记录实验数据。
⑦吸收完毕:当吸收液颜色明显变化或检测到尾气成分基本被吸收时,停止气体输入。
⑧尾气处理:剩余尾气需通过安全途径如碱石灰管、水封等处理,避免直接排放。
⑨拆卸清洗:实验结束后,关闭所有装置,待装置冷却,按规范顺序拆卸,清洗吸收塔和收集瓶,处理废液。
⑩数据分析:整理实验数据,分析吸收效率,撰写实验报告,总结实验经验和改进措施。
高考化学 黄易错点专题汇编 常见气体制备的发生装置与收集
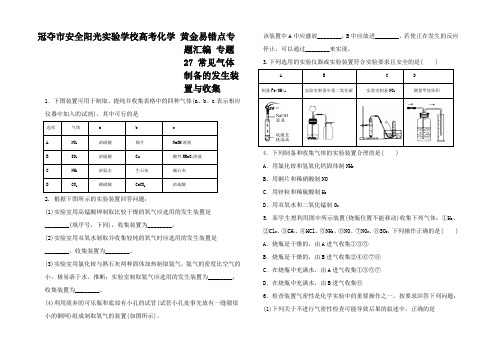
冠夺市安全阳光实验学校高考化学黄金易错点专题汇编专题27 常见气体制备的发生装置与收集1.下图装置可用于制取、提纯并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是选项气体 a b cA NO2浓硝酸铜片NaOH溶液B SO2浓硫酸Cu 酸性KMnO4溶液C NH3浓氨水生石灰碱石灰D CO2稀硝酸CaCO3浓硫酸2. 根据下图所示的实验装置回答问题:(1)实验室用高锰酸钾制取比较干燥的氧气应选用的发生装置是________(填序号,下同),收集装置为________。
(2)实验室用双氧水制取并收集较纯的氧气时应选用的发生装置是________,收集装置为________。
(3)实验室用氯化铵与熟石灰两种固体加热制取氨气,氨气的密度比空气的小,极易溶于水。
推断:实验室制取氨气应选用的发生装置为________,收集装置为________。
(4)利用废弃的可乐瓶和底部有小孔的试管(试管小孔处事先放有一缝隙很小的铜网)组成制取氧气的装置(如图所示)。
该装置中A中应盛放________,B中应放进________,若使正在发生的反应停止,可以通过________来实现。
3.下列选用的实验仪器或实验装置符合实验要求且安全的是( )A B C D制备Fe(OH)2实验室制备少量二氧化碳实验室制备NO2测量甲烷体积4.下列制备和收集气体的实验装置合理的是( )A.用氯化铵和氢氧化钙固体制NH3B.用铜片和稀硝酸制NOC.用锌粒和稀硫酸制H2D.用双氧水和二氧化锰制O25. 某学生想利用图中所示装置(烧瓶位置不能移动)收集下列气体:①H2、②Cl2、③CH4、④HCl、⑤NH3、⑥NO、⑦NO2、⑧SO2,下列操作正确的是( ) A.烧瓶是干燥的,由A进气收集①③⑤B.烧瓶是干燥的,由B进气收集②④⑥⑦⑧C.在烧瓶中充满水,由A进气收集①③⑤⑦D.在烧瓶中充满水,由B进气收集⑥6.检查装置气密性是化学实验中的重要操作之一。
气体的实验室制备、净化和收集

CO2(SO2):________________________。 (4)含有O2杂质的气体 ①CO2(O2):__________;②N2(O2):___________。 (5)HCl(Cl2):____________。
二、气体的发生装置:
(1)固体+固体――△→气体
制备气体:O2、NH3、CH4等 注意事项:粉末状固体应在试管口放一团棉花 ①试管口应稍向下倾斜,以防止产生的水蒸气在试管口 冷凝后倒流,而使试管破裂。
③固体药品应平铺在试管底部。 ④胶塞上的导管伸入试管内不能过长,否则会影响气体导出
⑤如用排水集气法收集气体,当停止制气时,应先从水 槽中把导管撤出,然后再撤走酒精灯,防止水倒吸。
三、气体的除杂方法:
除杂试剂选择的依据:主体气体和杂质气体性质上的差
异,如溶解性、酸碱性、氧化性、还原性、可燃性。
除杂原则:
(1)不损失主体气体, (2)不引入新的杂质气体, (3)在密闭装置内进行, (4)先除易除的气体。
一般可从以下几个方面考虑: ①易溶于水的杂质可用水吸收;
②酸性杂质可用碱性物质吸收;
四、气体的干燥
(1)选用干燥剂应根据气体的性质和干燥剂的性质而定, 其原则是干燥剂只能吸收气体中的水分,而不能与气体 发生反应。
①酸性干燥剂,如浓H2SO4、P2O5、硅胶等。一般用来 干燥酸性或中性气体,而不能用来干燥碱性气体。
②碱性干燥剂,如生石灰、固体NaOH、碱石灰等。碱性 干燥剂不能干燥酸性气体,如碱石灰不能干燥Cl2、CO2、 HCl等。
对尾气的处理方法

对尾气的处理方法
1. 催化转化法:通过在排放口安装催化转化器,使用催化剂将有害气体转化为无害气体,如将NOx转化为N2和水;将CO转化为CO2;将HC转化为水和CO2。
2. 再生式净化法:通过在排放口安装颗粒过滤器等装置,将固体颗粒物捕获,在一定条件下进行脱附,使颗粒物得以再生,减少对环境的污染。
3. 生物处理法:利用微生物的代谢作用将有害气体转化为无害气体,如利用生物反应器去除废气中的VOC。
4. 吸收法:将废气通过溶液中,通过化学反应将有害气体吸收,达到净化的目的。
5. 燃烧法:将有害气体进行燃烧,如CO2、水和无害氧化物,达到净化废气的目的。
6. 分离处理法:将废气中的有害气体和无害气体进行分离处理,如利用膜技术将废气中的VOC进行分离回收。
7. 吸附法:通过对废气进行活性炭吸附、分子筛吸附、氧化亚铁吸附等方法去除有害气体,使废气达到净化的标准。
常见气体的制备、净化、收集与尾气处理
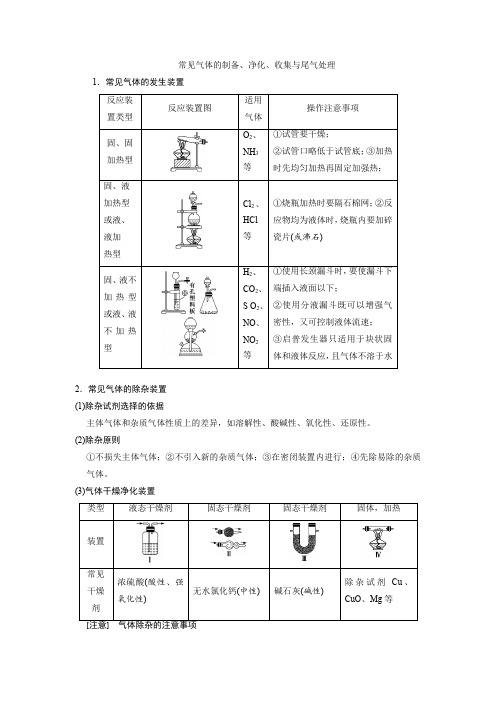
常见气体的制备、净化、收集与尾气处理1.常见气体的发生装置2.常见气体的除杂装置(1)除杂试剂选择的依据主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。
(2)除杂原则①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体。
(3)气体干燥净化装置①需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如氯化氢气体、CO2、SO2等,水蒸气要在最后除去;②除杂选用方法时要保证杂质完全除掉,如除CO2最好用NaOH不用Ca(OH)2溶液。
有时候为了保证气体除尽,还要验证一步,如验证混合气体中既有CO2,又有SO2,通常用品红溶液检验SO2,然后用溴水或酸性KMnO4溶液除去SO2,再用品红溶液检验是否除尽,最后用澄清石灰水检验CO2。
3.常见气体的收集方法4.尾气处理分析对有毒、有害的气体必须用适当的方法予以吸收或点燃变为无毒、无害的气体,再排放到空气中。
[注意][过关训练]1.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置)。
仅用此装置和表中提供的物质完成相关实验,最合理的选项是()解析:选B NH3的密度比空气密度小,应该采用向下排空气法收集,装置c中的导管应改为短进长出,故A错误;浓硫酸可以与Na2SO3反应生成SO2,SO2气体的密度比空气大,能使用向上排空气法,SO2气体能与NaOH溶液迅速反应,所以吸收装置中要防倒吸,图示收集装置和尾气吸收装置都合理,故B正确;铜与浓硝酸反应生成产物为NO2,NO2与水反应生成HNO3的同时,还有NO有毒气体,不能用水进行NO2的尾气吸收,故C错误;用MnO2和浓盐酸制取Cl2时需要加热,故D错误。
2.Cl2O为黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。
一种制取Cl2O的装置如图所示。
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃,Cl2的沸点为-34.6 ℃;HgO+2Cl2===HgCl2+Cl2O下列说法不正确的是()A.装置②、③中盛装的试剂依次是饱和食盐水与浓硫酸B.通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险C.从装置⑤中逸出气体的主要成分是Cl2OD.装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸解析:选C制取Cl2O需要干燥纯净的Cl2,所以②、③中盛装的试剂依次是饱和食盐水与浓硫酸,故A正确;高浓度的Cl2O易爆炸,所以通入干燥空气可以将生成的Cl2O 稀释减少爆炸危险,故B正确;装置⑤是收集Cl2O的装置,所逸出的气体不是Cl2O,故C错误;Cl2O与有机物接触会发生燃烧并爆炸,装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸,故D正确。
中考化学必备复习第五部分化学实验第2节气体的制取、净化与收集

(4)尾气的处理
①点燃尾气法:对可燃性污染(wūrǎn)(有毒)气体,点燃转化 为无污染(wūrǎn)气体(如CO)。 ②溶液吸收法:酸性(或碱性)气体通入碱性(或酸性)溶液 中,与溶液反应生成不具有挥发性盐类(如氢氧化钠吸收
CO2等)。 ③尾气收集法:装置末端接一个气球或其他容器,用 以集中处理污染气体或再利用。
③常见(chánɡ jiàn)气体的除杂方 法
【补充】实验室制取三大气体中常见要除去的杂质:a. 制氧 气要除去的杂质:水蒸气;
b. 制氢气(qīnɡ qì)要除去的杂质:水蒸气、氯化氢气(qīnɡ qì)体; c. 制二氧化碳要除去的杂质:水蒸气、氯化氢气体。
2021/12/8
第十三页,共四十三页。
第十七页,共四十三页。
(2)乙同学认为(rènwéi)装置Ⅰ可作为实验室制取二氧化碳的
发生装置,则Ⅰ的a仪器应加入______,b仪稀器盐中酸应加入 ______________。大理石(或石灰石) (3)如果要用装置Ⅱ收集H2,则应从__管d口进气。
2021/12/8
第十八页,共四十三页。
考点点拨
3.除去O2常用灼热的铜网,除CO2最好(zuì hǎo)用NaOH溶液, 除去水蒸气(干燥)根据被干燥气体的性质可选浓H2SO4、
碱石灰或固体氢氧化钠。
2021/12/8
第三十页,共四十三页。
重难点突破(tūpò)
突破点 多功能瓶的使用(shǐyòng) 典例精练
【例】以下不能达到相应实验目的(mùdì)的装置是 ( ) B
2021/12/8
第三十一页,共四十三页。
变式训练(xùnliàn)
如图5-2-10装置可用于气体的收集、检验、除杂和体积
天然气净化尾气处理
≥99.8
SCOT, BSR/MDEA, Doxosulfreen, ULTRA, Sulfcycle, RAR, Clauspol 150,LTGT, AGE/Dual Solve ELSE, Wellmann-Lord, Aquaclaus
1.尾气处理的目的意义 尾气处理的目的即回收克劳斯硫磺回收装置
尾气中的硫化物,进一步提高装置的总硫回收率。 使尾气排放满足SO2<960mg/m3,符合GB162971996环保规定。
酸性尾天气然气处净理化工工艺艺技介术绍介绍
提纲
第一部分 尾气处理的目的意义 第二部分 尾气处理主要工艺方法 第三部分 SCOT尾气处理工艺 第四部分 普光尾气处理PFD介绍
2.尾气处理工艺方法 目前运用比较多的方法有以下几种
MCRC(亚露点硫回收工艺)
低温克劳斯工艺 CBA(Clod Bed Adsorption)冷床吸附工艺
Clauspol(克劳斯朴尔)
SCOT(斯科特)
还原吸收艺
串级SCOT
公用再生塔 分流式SCOT
RAR
SSR
选择性氧化工艺
Super Super
两级催化转化克劳斯 三级或四级催化转化克劳斯 ER Claus,CBA(三反应器)
Sulfreen,Clauspol 1500,MCRC(三反应器),Clinsulf SDP,SuperClaus99,PRO Claus, CBA(三反应器,2循环),CBA(四反应器,两循环)
99.2~99.7
MCRC(四反应器),CBA(四反应器,四循环),SuperClaus-99.5, Hydrosulfreen, 两段Sulfreen, Carbosulfreen. Oxysulfreen, Clauspol
氮气、一氧化氮、二氧化氮(讲义含答案)

一、氮元素的“位——构——性”元素位置原子结构元素性质第三周期第V A族不容易得失电子,一般通过共用电子对与其他原子结合主要化合价:_______________________【答案】-3、0、+2、+4、+5二、氮元素的存在形式三、自然界中氮的循环第03讲氮气、一氧化氮、二氧化氮知识导航模块一氮气知识精讲四、氮气的物理性质和化学性质物理性质氮气是一种无色无味的气体,难溶于水,密度与空气相近。
化学性质【答案】N 2 + O 2 =====放电2NO N 2 + 3H 2 2NH 3 N 2 + 3Mg =====点燃Mg 3N 2思考与交流:镁条在空气中燃烧,固体产物有几种? 【答案】三种。
Mg 3N 2、MgO 、C (镁条可以在CO 2中燃烧)五、氮的固定1.概念:把空气中游离态的氮转变为氮的化合物的过程。
2.分类:(1)自然固氮:大自然通过闪电释放的能量将空气中的氮气转化为含氮的化合物,或豆科植物根瘤菌将氮气转化为氨。
(2)人工固氮:如工业合成氨。
氮气的性质【例1】下列关于氮气的叙述,正确的是( )经典例题A .氮气性质稳定,即使在高温下也很难跟其他物质发生反应B .氮气比空气轻,且不溶于水C .氮气无氧化性,也无还原性,不跟其他物质反应D .氮气可与许多物质发生化学反应,所以氮气的化学性质活泼 【答案】B氮的循环【例2】氮元素在海洋中的循环是整个海洋生态系统的基础和关键。
海洋中无机氮的循环过程可用下图表示,下列关于海洋中氮循环的说法不正确的是( )A .海洋中的氮循环属于固氮作用的是②B .海洋中的氮循环起始于氮的氧化C .②中的含氮物质转化属于氮的固定化作用D .向海洋排放含-3NO 的废水会影响海洋中+4NH 的含量 【答案】B氮的固定【例3】下列不属于氮的固定的变化是________;属于人工固氮的是_______。
(填序号) ①豆科植物的根瘤菌把空气中的氮气转化为氨 ②氮气和氧气在放电条件下生成NO ③工业上用氨和二氧化碳合成尿素④分离液态空气制氮气⑤工业合成氨 【答案】 ③④;⑤【变3】自然界中时刻存在着氮气的转化。
高中所有气体的制取,净化,干燥和收集

高中所有气体的制取,净化,干燥和收集1.氧气的制取:O2制取原理:①加热高锰酸钾:2KMnO 4K2MnO4+MnO2+O2↑选取装置:固体加热型(试管口塞棉花)②加热氯酸钾:2KClO 32KCl+3O2↑选取装置:固体加热型③分解过氧化氢:2H2O 22H2O+O2↑选取装置:固液常温型检验:带火星的木条(复燃)净化:无需净化干燥剂选择:所有干燥剂(浓硫酸、氢氧化钠、生石灰、碱石灰、无水氯化钙、五氧化二磷、硅胶)收集装置:排水法,向上排空气法尾气处理:无需处理2.氢气的制取:H2制取原理:Zn+H2SO 4ZnSO4+H2↑选取装置:固液常温型检验:点燃,火焰上方罩一个干冷烧杯(淡蓝色火焰,有水雾)净化:无需净化干燥剂选择:所有干燥剂(浓硫酸、氢氧化钠、生石灰、碱石灰、无水氯化钙、五氧化二磷、硅胶)收集装置:排水法,向下排空气法尾气处理:无需处理3.二氧化碳的制取:CO2制取原理:CaCO3+2HCl CaCl2+CO2↑+H2O选取装置:固液常温型检验:澄清石灰水(变浑浊)净化:饱和NaHCO3溶液干燥剂选择:酸性、中性干燥剂(浓硫酸、无水氯化钙、五氧化二磷、硅胶)收集:向上排空气法尾气处理:无需处理4.二氧化硫的制取:SO2制取原理:Na2SO3+H2SO4(70%)Na2SO4+SO2↑+H2O 选取装置:固液常温型检验:品红溶液(褪色)净化:饱和NaHSO3溶液干燥剂选择:酸性、中性干燥剂(浓硫酸、无水氯化钙、五氧化二磷、硅胶)收集:向上排空气法尾气处理:氢氧化钠溶液、高锰酸钾溶液、溴水5.氨气的制取:NH3制取原理:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O选取装置:固体加热型检验:湿润的红色石蕊试纸(变蓝)净化:无需净化干燥:碱性、中性干燥剂(无水氯化钙不行)(氢氧化钠、生石灰、碱石灰、硅胶)收集:向下排空气法尾气处理:稀硫酸、稀盐酸6.氯气的制取:Cl2制取原理:4HCl+MnO 2MnCl2+Cl2↑+2H2O选取装置:固液加热型检验:湿润的淀粉碘化钾试纸(变蓝)净化:饱和食盐水干燥:中性、酸性干燥剂(浓硫酸、无水氯化钙、五氧化二磷、硅胶)收集:向上排空气法尾气处理:氢氧化钠溶液7.卤化氢的制取:HF、HCl、HBr、HI制取原理:①氟化氢:NaF+H2SO4(浓)NaHSO4+HF↑②氯化氢:NaCl+H2SO4(浓)NaHSO4+HCl↑③溴化氢:NaBr+H3PO4(浓)NaH2PO4+HBr↑④碘化氢:KI+H3PO4(浓)KH2PO4+HI↑制取装置:固液加热型(氟化氢需要在塑料容器内制取)检验:硝酸银溶液和稀硝酸(AgCl白色沉淀,AgBr淡黄色沉淀,AgI黄色沉淀)净化:无需净化干燥:酸性干燥剂、中性干燥剂(HBr和HI不能用浓硫酸)(浓硫酸、五氧化二磷、硅胶、无水氯化钙)收集:向上排空气法尾气处理:氢氧化钠溶液、硝酸银溶液8.硫化氢的制取:H2S制取原理:FeS+H2SO 4FeSO4+H2S↑装置:固液常温型检验:硫酸铜溶液(黑色沉淀)净化:无需净化干燥:酸性干燥剂、中性干燥剂(不能用浓硫酸)(五氧化二磷、硅胶、无水氯化钙)收集:向上排空气法尾气处理:氢氧化钠溶液9.氮气的制取:N2制取原理:NaNO2+NH4Cl NaCl+N2↑+2H2O装置:固液常温型检验:燃着的木条(熄灭)净化:无需净化干燥剂选择:所有干燥剂(浓硫酸、氢氧化钠、生石灰、碱石灰、无水氯化钙、五氧化二磷、硅胶)收集:排水法尾气处理:无需处理10.甲烷的制取:CH4制取原理:CH3COONa+NaOH CH4↑+Na2CO3装置:固体加热型检验:点燃,火焰上方罩一个烧杯(有水珠生成,加入澄清石灰水变浑浊)净化:无需净化干燥剂选择:所有干燥剂(浓硫酸、氢氧化钠、生石灰、碱石灰、无水氯化钙、五氧化二磷、硅胶)尾气处理:无需处理11.乙烯的制取:CH2=CH2制取原理:C2H5OH C2H4↑+H2O装置:固液加热型(带温度计)检验:溴水、溴的四氯化碳溶液、高锰酸钾溶液净化:NaOH溶液干燥剂选择:所有干燥剂(浓硫酸、氢氧化钠、生石灰、碱石灰、无水氯化钙、五氧化二磷、硅胶)收集:排水法尾气处理:无需处理12.乙炔的制取:CH ≡CH制取原理:CaC2+2H2O C2H2↑+Ca(OH)2检验:点燃(黄色火焰、浓烈黑烟)净化:NaOH溶液(主要杂质是硫化氢等)干燥剂选择:所有干燥剂(浓硫酸、氢氧化钠、生石灰、碱石灰、无水氯化钙、五氧化二磷、硅胶)收集:排水法、向下排空气法尾气处理:无需处理固体加热型固液加热型固液常温型排水法向上排空气法向下排空气法。
高考化学“气体产生、净化、收集与尾气处理”的实验套装

结 束
第二讲 “气体产生、净化、 收集 与尾气处理”的实验套装
“气体产生、净化、收集与尾气处理”的实验套装
结 束
(一)气体的发生“套装”和收集“套 装”
“气体产生、净化、收集与尾气处理”的实验套装
结 束
气体
O2
反应原理 发生装置 收集装量 △ ①2KMnO4 ===== K2MnO4 + MnO2+O2↑ A或B D或E MnO2 ②2KClO3=====2KCl+3O2↑ △ ③2H2O2MnO22H2O+O2↑
C ____
NH3
A ____
F ____
“气体产生、净化、收集与尾气处理”的实验套装
结 束
注 意
(1)选择气体的发生装置时,应考虑反应物的状态及反应条件,有些 气体可用不同的反应原理来制备,要注意选择不同的发生装置。如 用 KMnO4 与浓盐酸反应制取 Cl2 可选择 B 中②装置。 (2)气体的收集方法要根据气体的化学性质和物理性质 (溶解性、密 度)进行分析选择,对易溶于水的气体除用排空气法收集外,还可用 排其他液体法,如 Cl2 可用排饱和食盐水法收集。 (3)制取氨气还可以用加热浓氨水或浓氨水与生石灰混合的方法。
NH3、HBr、 HI、H2S 等
“气体产生、净化、收集与尾气处理”的实验套装
结 束
(三) 防堵塞“套装”
“气体产生、净化、收集与尾气处理”的实验套装
结 束
分类 液封 式
装置简图
原理及使用方法 若装置通畅,导气管内外的液面 相等;若装置不通畅、堵塞,则 装置中的压强会增大,压迫液体 沿导气管上升 使分液漏斗内的压强与烧瓶内的 压强相同,保证漏斗中液体顺利 流出
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选择
干燥剂
干燥剂状态
气体的酸碱性
干燥装置
保持一致
干燥剂的酸碱性
3、常见干燥剂
酸性干燥剂(如:浓硫酸、P2O5、硅胶等)不能用
来干燥碱性气体; 碱性干燥剂 (如碱石灰、生石灰、固体NaOH等)不能 用来干燥酸性气体如Cl2。 有氧化性的干燥剂(如浓硫酸)不能干燥有还原性 气体(如H2S、HI等)。
常见干燥剂及使用装置
毒气体的处理方法如表所示:
Cl2 SO2 NO2 H2S
CuSO4 溶液或 NaOH 溶液
HCl
NH3
CO
NO
与 O2混 合后通 入NaOH 溶液
NaOH溶液
水
水或 点燃 H2SO4 溶液
1.右图的装置可用于
A.加热NaHCO3制CO2
B
B.用Cu与稀HNO3反应制NO
C.用NH4Cl与NaOH溶液反应制NH3
四、除尾气装置
1、 燃烧法 如CH4、C2H4、C2H2、H2、CO等。 2、碱液吸收法 如Cl2、H2S、CO2、SO2、NO2等。 3、水溶解法 如HCl、NH3等。
4、袋装储存的气体必须用适当的方法予以吸收或点燃变
为无毒、无害的气体,再排放到空气中。实验室中常见有
编 号
A中物 质
B中物 质
C中 气体
有关化学方程式
Na2SO3 +H2SO4(浓) ═ Na2SO4 +SO2↑+H2O
(1) Na2SO3 浓硫酸 SO2 (2)
Cu
Cu + 4HNO3(浓) ═ Cu(NO3)2+ NO 2 浓硝酸 2NO2↑+2H2O
(3) KMnO4
浓盐酸 Cl2
2KMnO4 + 16HCl ═ 2KCl +2MnCl2+5Cl2↑+ 8H2O
5、实验室制取下列气体,所用药品和干燥剂都正
确的是
D
制取的气体
药
品
干燥剂
A. H 2 B.H2S C.HCl
D.NH3
Zn和稀HNO3 FeS和稀盐酸 固体NaCl和稀H2SO4
NH4Cl和熟石灰
浓H2SO4 浓H2SO4 浓H2SO4
碱石灰
6、用下图装置制取和
收集气体,根据装置分 析后填表(写化学式)
液态干燥剂
装 置 常见干燥 浓硫酸 无水CaCl2 剂 可干燥 H2,O2, Cl2, SO2, O2,Cl2,HCl,SO2, CO, N2, CH4 H2, CO,N2,CH4 气体 不可干燥 H2S NH3, HBr, NH3 HI, C2H4 气体 → →
固态干燥剂
碱石灰
H2,O2, N2, CH4, NH3 HX,H2S,SO2, CO2,NO2, Cl2
D.用NaCl与浓H2SO4制HCl
2、下列反应适用于实验室制备氧气的是
c
(1)高锰酸钾热分解2KMnO4═K2MnO4+O2+MnO2
(2)硝酸铵热分解2NH4NO3═4H2O+N2+O2 (3)过氧化氢催化分解2H2O2═H2O+O2 (4)二氧化氮热分解2NO2═2NO+O2 A.只有(1) C.(1)和(3) B.(1)和(2) D.(1)(3)(4)
CO2,Cl2,HCl
H2,NH3
三、净化装置
气体净化装置的设计原则: 根据净化药品的状态和净化条件
液体试剂
固体试剂
干燥管
洗气瓶 进气管应“长进
应大口方向进 气,小口方向 出气
短出”
干燥剂的选择及使用原则
1、选择原则
①气体在被干燥的过程中要不能被减少
②不要引入新的杂质。
2、选择方法
酸、碱性 据气体的 氧化、还原性
气 体 的 制 备
思考:
气体的收集装置和净化装置分别 有几种类型?根据什么原则选择有
关装置?
二、收集装置
气体收集装置的设计原则:
根据气体的溶解性或密度
装置类型
排水法
向上排气法 向下排气法
示意图 气体性质 难溶或微溶 密度大于空 密度小于空 于水的气体 气的气体 气的气体
实例
H2,O2,NO, C2H2,N2,CO
3、按下述实验方法制备气体,合理又实用的是
A.锌粒和稀硝酸反应制备H2
C
B.向饱和氯化钠溶液中滴加浓硫酸制备HCl
C.亚硫酸钠与浓硫酸反应制备SO2
D.大理石和浓硫酸反应制备CO2
4、设计了四种制备气体的方案:(1) 加热稀硫酸和 乙醇制备乙烯;(2) 加热稀盐酸和二氧化锰制备氯 气;(3)用稀硫酸和大理石制备二氧化碳;(4)用稀 硝酸和硫化亚铁制备硫化氢。不宜采用的方案有 哪些? D A.只有(1)和(2) C.只有(3)和(4) B.只有(1)和(3) D.(1) (2) (3)(4)
