第二章 碳-氮键的合成
c-h键活化在全合成中的应用

c-h键活化在全合成中的应用
在全合成中,C-H键活化是一种重要的方法,可以在有机分子中功能化C-H键,以构建有机化合物的特定键和结构。
这种反应方法在合成有机化合物、药物发现和材料科学中都具有广泛的应用。
以下是C-H键活化在全合成中的一些应用:
1. 功能化C-H键:C-H键活化可以用来引入新的官能团到有机分子中。
通过选择性的活化C-H键,可以将碳氢键转化为碳氧键、碳氮键、碳卤键等。
这种方法可以简化合成路径,提高合成效率,并且可以创造新的有机化合物。
2. 碳-碳键形成:C-H键活化可以用来形成碳-碳键。
通过与合适的底物反应,可将C-H键活化的中间体与其他分子进行偶联,形成新的碳-碳键。
这种方法可以有效地构建复杂的有机分子骨架。
3. 不对称合成:C-H键活化可以用来实现不对称合成。
通过选择性地活化手性碳上的C-H键,可以使反应产物具有高度立体选择性。
这种方法在药物合成中特别有用,可以合成具有特定立体结构的药物分子。
4. 天然产物合成:C-H键活化可以用来合成复杂天然产物。
许多天然产物具有复杂的结构和生物活性,传统的合成方法往往效率低下。
通过利用C-H键活化,可以选择性地功能化天然产物中的C-H键,实现高效、可控的全合成。
总之,C-H键活化是一种重要的合成方法,在有机合成中具有广泛的应用。
通过选择性地活化C-H键,可以实现有机分子的功能化、碳-碳键形成、不对称合成和天然产物合成等目标。
这种方法为有机化学家提供了一个强大的工具箱,可以构建复杂的有机分子结构。
碳氮键合成研究进展

碳氮键合成研究进展腾维;安斌;朱鸿博;朱一凡;郭冠军【摘要】含有C-N键的有机化合物广泛存在于自然界,是一类构成生命基础的重要化合物。
含氮化合物,广泛存在具有生物活性的天然产物和药物分子中,并且是很多化工产品的重要原料和组成部分,对我们的生活有着重要的意义。
因此,高效、经济、环保的构建C-N键始终是有机化学的一个研究热点。
发展经济环保的C-N 键构建反应在有机合成中具有重要的意义,将工业和自然界中廉价易得的含氧化合物直接应用于C-N键构建,不仅可以降低生产成本,减少污染,还可以为能源、生态和环境问题的解决提供一个新思路。
%Organic compounds containing C-N bond widely exists in the nature, are important compounds that constitute the basis of life. Nitrogenous compounds, widely exists in natural products and drug molecules with biological activity, is an important raw mate. Therefore, the construction of high efficiency, economy and environmental protection of C-N bond is always a hot research topic in organic chemist. The development of economic and environmental protection of C-N bond to build a reaction in organic synthesis has important significance for many chemical products and components, it plays an important role in our life. Oxygen containing compounds in nature and industry will be cheap and easy to get applied directly to the C-N key construction, can not only reduce production costs, reduce pollution, but also provide a new way for the solution of energy, ecology and environmental problems.【期刊名称】《广州化工》【年(卷),期】2016(044)007【总页数】2页(P27-28)【关键词】碳氮键;偶连反应;环加成反应【作者】腾维;安斌;朱鸿博;朱一凡;郭冠军【作者单位】兰州交通大学化学与生物工程学院,甘肃兰州 730070;兰州交通大学化学与生物工程学院,甘肃兰州 730070;兰州交通大学化学与生物工程学院,甘肃兰州 730070;兰州交通大学化学与生物工程学院,甘肃兰州 730070;兰州交通大学化学与生物工程学院,甘肃兰州 730070【正文语种】中文【中图分类】O629.36碳氮键的构建在有机合成方法学这一领域占有重要的地位,通过合成碳氮键我们可以制备胺及其胺的衍生物、含氮杂环。
高中化学 第二章 分子结构与性质 第1节 共价键(第2课时)夯基提能作业 新人教版选择性必修2

第二章第一节第2课时A 级·基础达标练一、选择题1.(2020·海口高二检测)NH3、NF3、NCl3等分子中心原子相同,如果周围原子电负性大者则键角小。
NH3、NF3、NCl3三种分子中,键角大小的顺序正确的是( C ) A.NH3>NF3>NCl B.NCl3>NF3>NH3C.NH3>NCl3>NF3D.NF>NCl3>NH3解析:因电负性:F>Cl>H,故键角大小为NH3>NCl3>NF3。
2.下列说法中不正确的是 ( A )A.键角的大小与键长、键能的大小有关B.σ键是原子轨道以“头碰头”的方式相互重叠C.2个原子形成多个共价键中,只有一个σ键,而π键可以是一个或多个D.形成共价键时原子轨道重叠程度越大,体系能量越低,键越稳定解析:键角是分子内同一原子形成的两个化学键之间的夹角,与分子结构有关,与键长、键能无关,故A错误;σ键为ss、sp、pp电子“头碰头”,所以σ键是原子轨道以“头碰头”的方式相互重叠,故B正确;2个原子形成多个共价键中,只有一个σ键,其余为π键,所以只有一个σ键,而π键可以是一个或多个,故C正确;形成共价键时原子轨道重叠程度越大,键越稳定,体系能量越低,故D正确。
3.下列说法中能够说明BF3分子中的4个原子位于同一平面的是( D )A.任意两个B—F键间的夹角相等B.3个B—F键键能相等C.3个B—F键键长相等D.任意两个B—F键间的夹角为120°解析:键参数中,键能和键长是用于判断其价键稳定性的依据,而键角是判断分子立体构型的依据。
3个B—F键间的夹角均为120°时,正好构成的一个以B原子为中心的平面结构,因此4个原子共平面。
4.N2的结构可以表示为CO的结构可以表示为其中椭圆框表示π键,下列说法中不正确的是 ( D )A.N2分子与CO分子中都含σ键和π键B.CO分子与N2分子中的π键并不完全相同C.N2与CO中均含有σ键D.N2与CO的化学性质相同解析:从题图可以看出,N2分子与CO分子中均含有σ键和π键,A、C项正确;N2分子中的π键是由每个氮原子各提供两个p电子以“肩并肩”方式形成的,而CO分子中的一个π键是由氧原子单方面提供电子对形成的,B项正确;N2与CO的原子总数和价电子总数均相同,互为等电子体,二者化学性质相似,但并不完全相同,D项错误。
高中化学选修二第二章《分子结构与性质》知识点复习
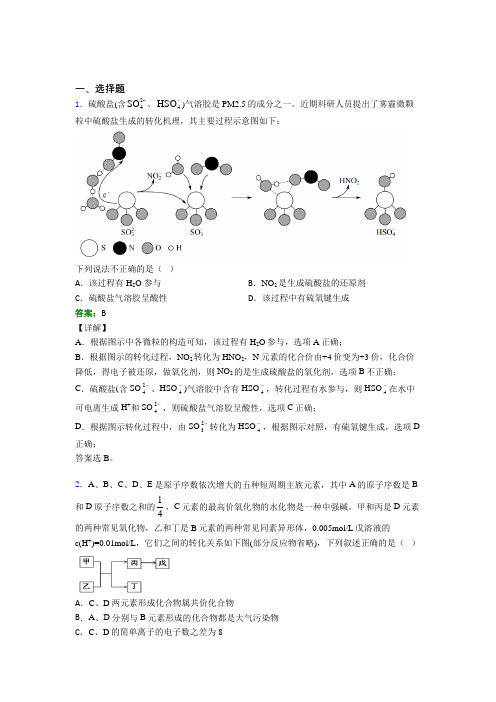
一、选择题1.硫酸盐(含2-4SO 、4HSO -)气溶胶是 PM2.5的成分之一。
近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:下列说法不正确的是( ) A .该过程有 H 2O 参与 B .NO 2是生成硫酸盐的还原剂 C .硫酸盐气溶胶呈酸性 D .该过程中有硫氧键生成答案:B 【详解】A .根据图示中各微粒的构造可知,该过程有H 2O 参与,选项A 正确;B .根据图示的转化过程,NO 2转化为HNO 2,N 元素的化合价由+4价变为+3价,化合价降低,得电子被还原,做氧化剂,则NO 2的是生成硫酸盐的氧化剂,选项B 不正确;C .硫酸盐(含SO 24-、HSO 4-)气溶胶中含有HSO 4-,转化过程有水参与,则HSO 4-在水中可电离生成H +和SO 24-,则硫酸盐气溶胶呈酸性,选项C 正确;D .根据图示转化过程中,由SO 23-转化为HSO 4-,根据图示对照,有硫氧键生成,选项D 正确; 答案选B 。
2.A 、B 、C 、D 、E 是原子序数依次增大的五种短周期主族元素,其中A 的原子序数是B 和D 原子序数之和的14,C 元素的最高价氧化物的水化物是一种中强碱。
甲和丙是D 元素的两种常见氧化物,乙和丁是B 元素的两种常见同素异形体,0.005mol/L 戊溶液的c(H +)=0.01mol/L ,它们之间的转化关系如下图(部分反应物省略),下列叙述正确的是( )A .C 、D 两元素形成化合物属共价化合物B .A 、D 分别与B 元素形成的化合物都是大气污染物C .C 、D 的简单离子的电子数之差为8D.E的氧化物水化物的酸性一定大于D的氧化物水化物的酸性答案:C解析:A、B、C、D、E是原子序数依次增大的五种短周期主族元素,结合甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2,戊为硫酸,可知丙为SO3,甲为SO2,乙为O3,丁为O2,则B为O,D为S,其中A的原子序数是B和D原子序数之和的14,A的原子序数为(8+16)×14=6,可知A为C;C元素的最高价氧化物的水化物是一种中强碱,结合原子序数可知,C为Mg,E为Cl,以此分析解答。
碳氮键合成研究的最新进展

碳氮键合成研究的最新进展马帅帅;吴政【摘要】碳氮键是大量存在于大自然及生命个体的化学键,其合成方法研究的重要性不言而喻,近年来,众多有机化学家对该领域做了大量工作,以期利用无污染的,价格低廉的原料高效构建碳氮化学键,基于此,本文综述了近5年来碳氮键合成方法研究的最新进展.主要包括钯催化的Buchwald-Hartwig偶联,钯催化碳氢键活化胺化,光催化氧化还原胺化,并对部分反应机理做了介绍.【期刊名称】《广州化工》【年(卷),期】2018(046)018【总页数】3页(P28-30)【关键词】Pd催化;Buchwald-Hartwig;碳氢键活化;光催化【作者】马帅帅;吴政【作者单位】康龙化成新药技术有限公司,北京110000;北京服装学院材料科学与工程学院,北京100029【正文语种】中文【中图分类】O622.6含碳氮键的化合物大量存在于人类生命进程中,又是制药领域和化工产品的重要原料,对我们生活有着及其重要的价值。
因此,高效、绿色的构建碳氮键始终是有机化学与合成的研究热点,相比传统的合成方法,钯催化的偶联反应是形成碳氮键最有效的手段之一,自从麻省理工学院Buchwald教授开辟了钯催化构建芳胺碳氮键偶联反应后,新的配体及催化体系也陆续被开发出来[1-4] ,同时,为了提高原子利用率,钯催化碳氢键活化胺化也得到了广泛的发展[5] ,除次之外,有机化学家也将目光投向了一些新颖的合成方法,诸如光催化氧化还原胺化构建碳氮键等[6-8] 。
1 Pd催化Buchwald-Hartwig反应合成碳氮键2012年,Satoshi Ueda等[9] 基于Me4t-BuXPhos配体应用的局限性,设计一种容易制备的新联芳基膦配体Me3(OMe)t-BuXPhos。
以4-甲基咪唑和溴苯的N-芳基化偶联为反应模型(式1)来比较两种配体的活性,结果得到近乎相同的产物选择性和收率。
最后扩展底物范围,发现Me3(OMe)t-BuXPhos配体能很好地催化Me4t-BuXPhos所涉及的绝大多数碳氮偶联反应。
钴催化的碳氮键-概述说明以及解释

钴催化的碳氮键-概述说明以及解释1.引言1.1 概述概述部分将介绍钴催化的碳氮键的背景和重要性。
碳氮键是一种重要的有机官能团,广泛存在于天然产物和药物分子中。
传统的碳氮键的形成方法往往需要高催化剂用量、高温和长时间反应,并且产生了大量废弃物,带来环境问题。
因此,开发高效、环境友好的碳氮键形成方法成为有机合成领域的研究热点。
钴催化的碳氮键形成反应是一种新兴的方法,近年来吸引了广泛的研究兴趣。
钴作为廉价、丰富的过渡金属,具有良好的催化活性和选择性,被广泛应用于有机合成反应中。
相比传统的碳氮键形成反应,钴催化的碳氮键形成方法具有反应温和、反应时间短、废弃物少等优点,对于合成具有碳氮键结构的化合物具有重要的应用价值。
本文将首先介绍钴催化的碳氮键形成反应的基本概念和原理,重点探讨其反应机制以及可能的反应路径。
随后,将对钴催化的碳氮键反应在有机合成中的应用进行概述,包括其在药物合成、天然产物合成等方面的应用前景。
最后,通过对相关研究的总结,对钴催化的碳氮键形成方法进行评估,并对其未来发展方向和挑战进行展望。
综上所述,钴催化的碳氮键形成反应具有广泛的应用前景和重要的研究意义,对于实现高效、环境友好的有机合成具有重要意义。
本文旨在系统地介绍钴催化的碳氮键形成反应的研究进展和应用前景,为相关领域的学者提供参考和借鉴。
1.2文章结构本文主要介绍了钴催化的碳氮键的研究进展和应用前景。
文章结构如下:第一部分为引言,包括对钴催化的碳氮键的概述,文章结构的说明和研究目的的介绍。
第二部分为正文,主要介绍钴催化的碳氮键的原理和机制。
首先介绍了碳氮键的概念和重要性,然后详细阐述了钴催化的反应条件和方法,并探讨了其反应机理和催化剂的种类。
其中包括了不同的反应类型和实现碳氮键形成的关键步骤,以及相关的实验方法和技术。
第三部分为结论,总结了钴催化的碳氮键的应用前景和研究意义。
钴催化的碳氮键具有广泛的应用潜力,在有机合成和药物化学等领域具有重要的地位。
有机合成中的金属催化反应

有机合成中的金属催化反应金属催化反应是有机合成领域中一种重要的合成策略。
通过金属催化反应,可以实现高效、高选择性的化学转化,为有机化学合成提供了广阔的发展空间。
本文将介绍金属催化反应的原理、应用以及一些成功的案例。
一、金属催化反应的原理金属催化反应主要是指在有机化合物的转化过程中,通过金属配合物作为催化剂来促进反应的进行。
金属催化反应的原理可以归结为以下几个关键步骤:1. 活化底物:金属催化剂能够与底物形成键合,从而活化底物,使其更容易进行反应。
这种活化可以发生在底物的氢、氧、氮等原子上,也可以通过有机分子的C-C和C-X键上发生。
2. 氧化还原:金属催化剂在反应过程中可以参与氧化还原反应,促进底物的氧化或还原。
金属催化剂作为氧化剂或还原剂可以转移电子,从而改变底物的电子状态,使其发生化学转化。
3. 配位或成键:金属催化剂与底物之间发生配位或成键反应,形成活性中间体。
这些中间体在反应过程中发挥重要作用,可以进一步催化底物的转化。
二、金属催化反应的应用金属催化反应在有机合成中具有广泛的应用。
能够实现的转化类型包括但不限于碳-碳键、碳-氮键、碳-氧键、碳-硫键以及氢转移反应等。
通过选择合适的金属催化剂以及反应条件,可以高效地合成各种有机化合物。
1. 碳-碳键形成:金属催化反应可以实现碳-碳键的形成,包括交叉偶联反应、烯烃和炔烃的环化反应、直接烷基化等。
这些反应对于药物和天然产物的合成具有重要意义。
2. 碳-氮键形成:金属催化反应在碳-氮键形成反应中也发挥着重要的作用,例如羟胺和羧酸的缩合反应、亲电取代反应以及氨基化反应等。
这些反应可以方便地合成含有氮元素的有机化合物。
3. 碳-氧键形成:金属催化反应可以实现碳-氧键的形成,例如醇和醚的合成、酯和酸的加成反应等。
这些反应对于合成酯、酮等化合物具有重要意义。
4. 碳-硫键形成:金属催化反应还可以实现碳-硫键的形成,包括硫醚的合成以及烯烃和硫醇的环化反应等。
(必考题)高中化学选修二第二章《分子结构与性质》检测(含答案解析)

一、选择题1.(0分)[ID:139542]高效“绿色”消毒剂二氧化氯通常为气体,实验室用 NC13溶液和NaClO2溶液制备ClO2气体,化学方程式为 6NaClO2+NC13 +3H2O=6ClO2↑ +NH3↑+3NaC1+3NaOH。
下列有关说法正确的是()A.根据上面化学方程式,生成 22. 4 L NH3时转移电子数目为 6 N AB.NC13中所有原子都满足8 电子结构C.在 NaClO2和NC13的反应中,氧化剂与还原剂的物质的量之比为 6:1D.ClO2具有还原性,可用于自来水的杀菌消毒2.(0分)[ID:139590]X元素的简单阳离子和Y元素的简单阴离子的核外电子层结构相同,下列叙述正确的是A.简单离子半径:X>Y B.原子半径:X<YC.原子序数:X<Y D.原子最外层电子数:X<Y3.(0分)[ID:139587]SiC纳米材料可望在电场发射材料、储氢、光催化和传感等领域都有广泛的应用前景。
科学家用金属钠还原CCl4和SiCl4制得一种一维SiC纳米棒,相关反应的化学方程式为8Na+CCl4+ SiCl4=SiC+8NaCl。
下列说法不正确的是.A.一维SiC纳米棒“比表面积”大,对微小粒子有较强的吸附能力B.上述反应中SiC既是氧化产物又是还原产物C.每生成l mol SiC转移8 mol电子D.CCl4、SiCl4分子中各原子都达到了8电子稳定结构4.(0分)[ID:139568]N A为阿伏加德罗常数的值。
下列说法正确的是A.在沸水中逐滴加入含10-3mol FeCl3的溶液,使其完全水解,生成Fe(OH)3胶体粒子数为10-3N AB.32g甲醇中含有的共价键数目为4N AC.钢铁发生电化学腐蚀生成0.1mol Fe2O3·nH2O(铁锈),则负极上铁单质失去的电子数为0.6N AD.2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol−1,则1mol[2CO(g)+O2(g)]生成1mol [2CO2(g)]放热566kJ5.(0分)[ID:139566]下列说法正确的是A.PCl3分子呈三角锥形,这是磷原子采取sp2杂化的结果B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混杂形成的4个新轨道C.中心原子采取sp3杂化的分子,其立体构型可能是四面体形或三角锥形或V形D.AB3型分子的立体构型必为平面三角形6.(0分)[ID:139563]V、W、X、Y、Z为五种短周期主族元素。
第二章 核酸的结构与功能(试题及答案)

第二章核酸的结构与功能一、名词解释1.核酸 2.核苷 3.核苷酸 4.稀有碱基 5.碱基对 6.DNA的一级结构 7.核酸的变性 8.Tm值 9.DNA的复性 10.核酸的杂交二、填空题11.核酸可分为 ____和____两大类,其中____主要存在于____中,而____主要存在于____.12.核酸完全水解生成的产物有____、____和____,其中糖基有____、____,碱基有____和____两大类. 13.生物体内的嘌呤碱主要有____和____,嘧啶碱主要有____、____和____.某些RNA分子中还含有微量的其它碱基,称为____。
14.DNA和RNA分子在物质组成上有所不同,主要表现在____和____的不同,DNA分子中存在的是____和____,RNA分子中存在的是____和____。
15.RNA的基本组成单位是____、____、____、____,DNA的基本组成单位是____、____、____、____,它们通过____键相互连接形成多核苷酸链。
16.DNA的二级结构是____结构,其中碱基组成的共同特点是(若按摩尔数计算)____、____、____. 17.测知某一DNA样品中,A=0.53mol、C=0.25mol、那么T= ____mol,G= ____mol。
18.嘌呤环上的第____位氮原子与戊糖的第____位碳原子相连形成____键,通过这种键相连而成的化合物叫____。
19.嘧啶环上的第____位氮原子与戊糖的第____位碳原子相连形成____键,通过这种键相连而成的化合物叫____。
20.体内有两个主要的环核苷酸是____、____,它们的主要生理功用是____.21.写出下列核苷酸符号的中文名称:ATP____、dCDP____。
22.DNA分子中,两条链通过碱基间的____相连,碱基间的配对原则是____对____、____对____。
23.DNA二级结构的重要特点是形成____结构,此结构属于____螺旋,此结构内部是由____通过____相连维持,其纵向结构的维系力是____。
药物合成中的CH键活化研究

药物合成中的CH键活化研究1. 引言CH键活化是有机合成领域中的一个重要研究方向。
传统的有机合成方法中,CH键通常是非活化的,需要通过复杂的转化步骤才能实现功能基团的引入。
而CH键活化研究的发展,为有机合成提供了一种高效、环境友好的策略。
本文将重点介绍药物合成中的CH键活化研究进展,探讨其在药物合成中的应用潜力以及面临的挑战。
2. CH键活化的重要性CH键是有机分子中最常见的键之一,其活化将使得有机合成更加高效、简洁。
CH键活化不仅可以通过在有机分子上直接引入功能基团,还可以实现碳氢键与其他键之间的选择性转化,有机分子的转化新途径使得合成药物的路径更加灵活。
因此,CH键活化研究具有重要的理论和应用价值。
3. CH键活化的反应类型目前,CH键活化研究已涉及多种反应类型。
其中包括碳—碳键活化、碳—氮键活化、碳—氧键活化等。
这些反应不仅可以实现原子经济性高的合成路线,还可以提高反应的选择性和速度,降低副反应的发生。
这些特点使得CH键活化成为一种非常有吸引力的反应。
4. 药物合成中的CH键活化研究案例4.1 药物合成中的碳—碳键活化碳—碳键活化是CH键活化研究的重要领域之一。
通过碳—碳键活化,可以在有机分子中引入新的碳—碳键,从而实现对药物结构的调整和优化。
例如,某些含有两个芳香环的药物分子,可以通过碳—碳键活化,在两个芳香环之间引入新的碳—碳键,增加药物分子的稳定性和活性。
其次,碳—碳键活化还可以在有机分子中引入稳定性较好的碳杂环结构,扩展药物分子的结构空间。
4.2 药物合成中的碳—氮键活化碳—氮键活化是另一个重要的研究方向。
通过碳—氮键活化,可以在有机分子中引入氮原子,从而实现对药物功能基团的引入和调整。
例如,一些药物中常见的酰胺结构,可以通过碳—氮键活化,在有机分子中引入酰胺基团。
这种方法不仅能提高药物的生物利用度和稳定性,还能增加药物分子与靶标的作用力。
4.3 药物合成中的碳—氧键活化碳—氧键活化是具有广泛应用前景的反应类型。
高等有机化学-2立体化学

CHO HO H
H OH
CH2OH (I) (2R, 3S) D-赤藓糖
CH2OH (II) (2S, 3R) L-赤藓糖
CH2OH (III) (2R, 3R) L-苏阿糖
CH2OH
(IV) (2S, 3S) D-苏阿糖
Fischer 投影式: 氧化态高的基团在上端。
赤(藓〕型 (ery-): 相同 原子或基团 碳链 同侧
13.8 15.4 15.4 13.4
•化 合 物 • 杂原子取代物 • CH3—SiH3 • CH3—NH2 • CH3—NHCH3 • CH3—OH • CH3—OCH3
旋 转 能 障(KJ/mol)
7.1 8.3 15.1 4.5 11.3
• 邻位交叉效应:
• 若只从范德华排斥作用考虑,对位交叉式构象Ⅰ应占优
(四) 环状化合物的对映异构
(五)不含手性中心的手性分子
(六) 前手性分子 (Prochiral Molecules) (七 )不对称合成 (Asymmtric Synthesis)
二. 顺反异构 (Cis-Trans Isomerism)
原子或原子团在分子中的排列形式
立体化学 原子在空间的成键形状和顺序 由此引起的物理性质、化学CH3 *
CH3
H* * COOH * Br
H C COOH Br
金刚烷桥头C原子 1, 3, 5, 7位 不同基团 旋光活性
手性中心-N原子: CH2Ph Ph *N C2H5Cl CH3
CH3
C2H5 NO Ph
不同取代开链叔胺分子不具有旋光活性:
R
R' N R"
0、3000、)时,能量最低、最稳定,为交叉式构
有机含氮化合物

有机含氮化合物概述有机含氮化合物是一类含有碳-氮化合键的有机化合物。
这类化合物具有丰富的结构类型和多样的性质,广泛存在于自然界中,也是合成有机化合物的重要起始物质之一。
本文将从有机含氮化合物的分类、合成方法、性质及应用等方面进行探讨。
有机含氮化合物的分类有机含氮化合物根据氮原子的氧化态以及与碳原子的连接方式可以分为以下几类:1. 胺类化合物胺类化合物是最常见的有机含氮化合物之一,其分子中至少含有一个或多个氨基(-NH2)基团。
根据氨基原子的碳原子个数不同,胺类化合物又可分为三类:一级胺、二级胺和三级胺。
一级胺:有一个氨基与两个碳原子相连,例如甲胺(CH3NH2);二级胺:有两个氨基与一个碳原子相连,例如二甲胺(CH3NHCH3);三级胺:有三个氨基与一个碳原子相连,例如三甲胺(CH3N(CH3)2)。
2. 腈类化合物腈类化合物是由碳与氮原子形成三键而构成的化合物,其通式为RC≡N。
腈类化合物具有较高的活性,可用于合成多种有机化合物。
3. 酰胺类化合物酰胺类化合物是由酰基羰基与氨基反应形成的衍生物,其通式为RCONR’2。
酰胺类化合物具有重要的生理活性和药理活性,广泛用于医药和农药等领域。
4. 腙类化合物腙类化合物是碳原子与氮原子通过氧化还原反应形成的化合物,其通式为R2C=NOH。
腙类化合物具有良好的亲电性,可用于合成多种含氮有机化合物。
有机含氮化合物的合成方法有机含氮化合物的合成方法多种多样,下面介绍几种常用的方法:1. 氨解反应氨解反应是通过氨与有机化合物反应生成胺类化合物的方法。
该反应常采用氨气或胺盐与卤代烃、醛、酮等有机化合物反应,生成相应的胺类产物。
2. 脱水胺化法脱水胺化法是通过三氧化二砷、氯化亚砜等试剂将羧酸和胺反应生成酰胺类化合物的方法。
该方法条件温和,适用于大多数羧酸和胺的反应。
3. 加成反应加成反应是将含有双键的有机化合物与胺类化合物反应,生成带有氮原子的化合物。
例如,马达尔反应是将亚硝基化合物与烯烃反应生成胺类化合物。
关于buchwald-hartwig反应机理描述的文章

关于buchwald-hartwig反应机理描述的文章Buchwald-Hartwig反应机理:揭开有机合成的奥秘有机合成是一门重要的化学领域,它涉及到合成有机化合物的方法和过程。
在这个领域中,Buchwald-Hartwig反应机理是一种被广泛应用的方法,它能够有效地构建碳-氮键。
本文将介绍Buchwald-Hartwig反应的机理,并探讨其在有机合成中的重要性。
Buchwald-Hartwig反应是由美国化学家Stephen L. Buchwald和丹麦化学家John F. Hartwig于1994年共同发现并发表的。
这个反应是一种钯催化的氨基取代反应,通过将芳香或烯烃底物与氨基试剂进行偶联,形成新的碳-氮键。
这个反应具有高效、高选择性和广泛适用性等特点,因此在药物合成、材料科学和天然产物合成等领域得到了广泛应用。
Buchwald-Hartwig反应的关键步骤是钯催化剂与底物之间的配位和还原消除。
首先,钯催化剂与底物中的配体发生配位作用,形成一个活性中间体。
然后,在还原剂的作用下,活性中间体发生消除反应,生成新的碳-氮键。
最后,通过再生钯催化剂,使反应循环进行。
Buchwald-Hartwig反应机理的关键在于钯催化剂的选择和配体的设计。
钯催化剂通常是一种含有配体的钯络合物,这个配体能够增强催化剂与底物之间的相互作用。
常用的配体有Phosphine、Phosphite和N-Heterocyclic Carbene 等。
这些配体能够调节反应速率、提高产率和选择性。
Buchwald-Hartwig反应机理还涉及到底物的选择和反应条件的优化。
底物可以是芳香或烯烃类化合物,而氨基试剂可以是胺类或氨类化合物。
通过调节底物结构和反应条件,可以实现不同类型的取代反应,如芳基取代、烯烃胺基化等。
Buchwald-Hartwig反应机理在有机合成中具有重要意义。
首先,它能够高效地构建碳-氮键,这对于合成含有氨基官能团的化合物非常重要。
化学制药工艺学PDF课件合集(中国药科大学)

一、类型反应法
二、分子对称法
三、逐步综合法 四、追溯求源法 �逆合成分析�
工艺路线
一、类型反应法
反应时间对异辛酸铋盐合成的影响
定义和思维方法
利用常见的典型有机化学反应与合成方 法 �按功能基形成的单元反应�比如卤化、 酯化等�把各单元反应串联起来�形成一 条工艺路线 �进行药物合成设计的思考方 法。其中包括应用各类化学结构的有机合 成物的通用合成法�官能团的形成、转换、 保护等合成反应单元以及重要的人名反应。
三、逐步综合法
抗结核药异烟肼�25�的合成
三、逐步综合法
�二�功能基的生成、保护与转化
多功能基药物的合成路线设计
具有多个功能基的药物的合成设计与基团之间 的相互影响�电子效应和立体效应�、各自的 理化特点、功能基引入的先后次序、保护基的 运用、活化部位利用等都有关系。设计时必须 综合考虑反应路线长短、反应顺序及反应条件 等多种因素。
和收率。
• 2、天然物的全合成及结构改造 • 发展有机化学理论和有机合成方法。 • 3、创新药物和已经上市药物�注意知识产
权�的生产。
• 生产的现实性、经济的合理性和技术的先进 性。
生产的现实性
• (1)原材料品种以少为好�并能保障供应。 • (2)原材料价格是否便宜。 • (3)尽可能避免使用有毒、易燃易爆的原材料。 • (4)尽可能简化合成反应及后处理操作,缩短
对于有明显类型结构特点以及官能团特点的化合物�可以 采用此法进行设计。
二、分子对称法
一、类型反应法
二、分子对称法
生物碱鹰爪豆碱�sparteine�16�的合成
2
二、分子对称法
抗麻风病药物克风敏�Clofazimine, 17�
第二章_碳-氮键的合成

第一节 氮原子对饱和碳原子的亲核取代反应 第二节 氮原子对不饱和碳原子的亲核取代反应 第三节 氮原子对不饱和碳原子的亲核脱水缩合反应 第四节 氮原子对不饱和碳原子的亲核加成反应 第五节 亲核性碳原子和亲电性氮原子之间的反应
第一节 氮原子对饱和碳原子的亲核取代反应
形成C-N键的三种方法
第二节 氮原子对不饱和碳原子的亲核取代反应
卤代芳烃在液氨中和氨基钠存在下经过苯炔中间体生 成胺。
第二节 氮原子对不饱和碳原子的亲核取代反应
2.2.1.6 酚类化合物和氨或胺的反应 在加压和催化剂存在下,酚类化合物的羟基能够被氨
基取代。
第二节 氮原子对不饱和碳原子的亲核取代反应
2.2.1.7 活性氢化合物的胺化 吡啶化合物、喹啉、异喹啉、菲啶、噻唑和苯并噻唑
2.1.1.1 伯胺合成方法 由烷基叠氮化合物还原合成伯胺 卤代烃与叠氮化钠生成烷基叠氮化钠,然后用LiAlH4还 原得到伯胺。
第一节 氮原子对饱和碳原子的亲核取代反应
2.1.1.2 醇和氨或胺的反应 一般醇的碳原子活性较低,对亲核氮原子的取代困难, 取代必须在比较强的反应条件下进行。 但将醇转化为磺酸酯或对苯磺酸酯,就很容易发生取 代反应生成胺。
2.3.1 烯胺的合成 由酮和仲胺脱水缩合制得的化合物。其亲核性很强, 同时烯胺具有共振结构,类似于烯酮,β-碳原子带负电, 容易被烷基化试剂和酰基化试剂进攻。
第三节 氮原子对不饱和碳原子的亲核脱水缩合反应 2.3.1 烯胺的合成
第三节 氮原子对不饱和碳原子的亲核脱水缩合反应
烯胺的基本反应
单分子亲核取代反应(SN1) 双分子亲核取代反应(SN2) 这类反应是有机化学中非常重要的一类反应,不论在理论研究中还是
金属催化剂在有机合成中的应用

金属催化剂在有机合成中的应用金属催化剂是有机合成领域中的重要工具,通过催化反应促进化学物质的转化和合成。
金属催化剂的应用广泛,包括有机合成中的碳-碳键形成、碳-氧键形成、碳-氮键形成等重要反应。
本文将探讨金属催化剂在有机合成中的应用以及这些催化反应的优势和挑战。
一、金属催化剂在碳-碳键形成反应中的应用碳-碳键形成反应是有机合成中最基础且最重要的反应之一。
金属催化剂在碳-碳键形成反应中起到关键作用,常用的金属催化剂包括钯、铂、铜等。
例如,钯催化的Suzuki偶联反应可以将芳香环和有机硼酸钾进行交叉偶联,合成目标化合物。
铜催化的Sonogashira偶联反应可以在碳碳三键形成的同时引入取代基,构建复杂有机分子。
二、金属催化剂在碳-氧键形成反应中的应用碳-氧键形成反应在有机合成中也具有重要地位,常见的反应包括醇酯化、醇醛缩合等。
金属催化剂在这些反应中起到催化剂的作用,常用的金属催化剂包括钌、铑等。
例如,钌催化的醇酯化反应可以将醇和酸酐反应得到酯化产物。
铑催化的醇醛缩合反应可以将醇和醛反应得到酯化产物。
三、金属催化剂在碳-氮键形成反应中的应用碳-氮键形成反应是有机合成中的重要反应,常见于氨基酸、药物分子的合成等领域。
金属催化剂在碳-氮键形成反应中起到非常重要的作用,常用的金属催化剂包括钯、铜等。
例如,钯催化的Suzuki-Miyaura偶联反应可以将芳香醚与芳香胺构建成N-芳香醚的键。
铜催化的Buchwald-Hartwig偶联反应可以将苯胺与卤代烃偶联,构建氨基取代的化合物。
金属催化剂在有机合成中的应用不仅提高了反应的选择性和效率,也扩展了有机合成的研究和应用领域。
然而,金属催化剂的应用也面临着一些挑战。
首先,金属催化剂的催化活性和稳定性需要进一步改进,以提高反应效率。
其次,金属催化剂在催化反应中可能会引发副反应,导致产物失活或污染。
此外,金属催化剂的负载和回收利用也是一个挑战,需要开发更高效、可回收的金属催化剂。
2_碳-氮键的合成

芬太尼:属强效麻醉性镇痛药, 镇痛作用产生快,但持续时间较短, 用于麻醉前、中、后的镇静与镇痛, 也用于各种原因引起的疼痛。
四、羧酸和氨或胺的反应
游离羧酸与酸酐、酯相比,羧基碳原子的亲电性低, 直接与胺反应变成酰胺需要长时间的高温加热。
4-氯苯甲醛、甲胺及β-巯基丙酸在苯溶剂中边加热边除水,生 成分子内闭环产物 ,经氧化得到氯美扎酮(chlormezanone)。
度减小,容易接受亲核进攻外,还能
使负离子带来的电荷更加分散,使反 应能以合理的速度进行。
• 丙烯腈容易与含活性氢的氨、伯胺、仲氨 、酰氨、酰亚胺、醇、酚以及含活性α 氢的 醛、酮、丙二酸酯等起加成反应,生成的 产物中含有氰乙基基团,一般称为氰乙基 化反应(cyanoethylation)。
•
Michael反应在天然产物和药物合成中的应用
氯美扎酮 :具有弱安定及肌肉松弛作用。可用于:①精神紧张、恐 惧、精神性神经病、慢性疲劳以及由焦虑、激动和某些疾病引起的烦 躁失眠等。②配合镇痛药治疗背酸、颈硬、骨痛、四肢酸痛、风湿性 关节痛等。③其他:震颤性麻痹、震颤、瘫痪、血管硬化及脑震荡出 血等。
由羧酸合成酰胺首先是羧酸和氨反应生成铵盐,然 后经加热脱水形成酰胺。
二甲基脲和氰基乙酸乙酯在二甲苯中,和乙醇钠或氨 基钠一起加热得到l,3-二甲基-4-氨基尿嘧啶,这是合成 咖啡因(caffeine)的重要中间体。
l,3-二甲基-4-氨基尿嘧啶
三、酰卤和氨或胺的反应
酰氯和氨或胺混合搅拌很容易生成酰胺。但是为了 中和产生的HCl,需要2mol以上的氨(胺)。如果胺的价 格较贵,或在体系中不易去除时,经常采用与吡啶、三 乙胺等叔胺以及与碳酸钠、氢氧化钠等碱性水溶液共存 下搅拌反应的方法。这个反应叫做Schotten-Baumann(肖 登-包曼)反应。
2 碳-氮键的合成

五、氨或胺对卤代苯的芳香族亲核取代反应 虽然氨(胺)对卤代苯的亲核取代反应是相当困难的, 但是如果在卤素的邻位或对位存在强的吸电子基时, 反应有时能够进行。
常见的吸电子基有NO2、N+(CH3)3、CN、SO2H、COOH、 CO和COR等。
下面是该方法在药物合成中的一些常见例子。
利凡诺: 1.可应用于中期妊娠引产。2. 外用杀菌防腐剂,用于各种创伤,渗 出、糜烂的感染性皮肤病及伤口冲洗。
酰氯和胺反应合成酰胺在药物合成工艺中的应用实 例:
利多卡因:1934年由Lofgren首先合成, 并用作局部麻醉剂。 50年代开始用于治疗 手术过程中出现的室性心律失常。由于本 药具有安全有效、作用快、消失快等优点, 目前已广泛用于治疗各种原因所引起的室 性心律失常。
卡马西平:抗癫痫作用,对精神 运动性发作最有效,对大发作、局限 性发作、和混合型癫痫也有效,减 轻精神异常对伴有精神症状的癫痫 尤为适宜。对三叉神经痛、舌咽神 经痛疗效较英妥类纳好,有抗利尿 作用,预防或治疗躁狂抑郁症、抗心 律失常。
呋喃苯胺酸 :主要用于对其他利尿药无效 的严重心原性、肝原性和肾原性水肿病人; 因其利尿作用太强,易致水和电质紊乱,故 一般的水肿病人不宜常规使用。
甲灭酸:同氯灭酸,抗炎作用较氯灭酸、氟灭酸均强。
盐酸肼屈嗪 :中度慢性高血压。
美比唑(依匹唑 , 嘧吡唑 ) :有抗炎镇痛及解热作用,用于 各种炎症性疼痛。 。
如果把醇羟基转变成磺酸酯或对甲苯磺酸酯,就很容 易和胺发生取代反应生成新的胺。
三、环氧化合物和胺的反应 虽然醚对于亲核性氮原子取代没有活性,但是具有一 定张力的环醚如环氧化合物与胺作用容易发生开裂,且 是按照SN2机理反向开裂。氨基攻击立体障碍小的一侧 (取代基少的碳原子),羟基在立体障碍大的碳。
碳氮键活化的新催化反应机理研究

碳氮键活化的新催化反应机理研究碳氮键是一种非常重要的有机化学键,在合成化学中具有广泛的应用。
近年来,随着绿色合成化学的兴起,对碳氮键活化的研究也越来越受到关注。
本文将介绍碳氮键活化的新催化反应机理研究,探讨其中的一些重要发现和应用。
碳氮键活化催化反应机理的研究,旨在寻找一种有效的方法来构建碳氮键形成的关键中间体,以实现高选择性和高效率的合成转化。
近年来,许多催化剂和催化反应体系被开发出来,以解决传统合成方法的局限性。
其中,一种新的机理是通过通过活化碳氮键中的氮原子来实现碳氮键活化。
研究表明,碳氮键活化可以通过两种不同的机理进行。
第一种机理是通过催化剂引发的氮原子的活化,这种活化可以使氮原子参与反应,并形成中间体,进而实现碳氮键的构建。
第二种机理是通过催化剂参与活化碳氮键,催化剂与反应物之间形成的中间物以氮氢化合物的形式存在,并进一步反应形成碳氮键。
这两种机理都对碳氮键活化有重要意义,但每种机理实际应用中有不同的优势和限制。
在碳氮键活化的研究中,一些有机小分子催化剂已经被证明对催化反应起到了重要作用。
例如,钯、铜等过渡金属催化剂在碳氮键活化反应中表现出优异的催化活性。
此外,一些金属有机催化剂也被广泛应用于碳氮键活化反应中。
这些催化剂通过与底物中的氮原子发生反应,并形成中间体,从而催化碳氮键的形成。
除了催化剂的设计和优化外,反应条件的调节也对碳氮键活化反应的效果有重要影响。
温度、溶剂和反应物比例等因素都可能影响反应的选择性和产率。
因此,根据具体反应的需要,合适的反应条件的选择对于碳氮键活化反应的成功至关重要。
在碳氮键活化机理的研究中,理论计算、表征技术和反应动力学的研究也起到了重要的作用。
通过理论计算可以获得反应过程中活化碳氮键的可能机理,并提供对催化剂和反应物之间相互作用的深入理解。
表征技术可以帮助研究人员了解催化剂和反应物之间的结构和变化,从而揭示反应过程中的关键步骤。
反应动力学研究可以提供反应速率常数等重要参数,用于评估反应条件和优化催化剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
提示:Delepine反应随卤代烃的种类不同, 提示:Delepine反应随卤代烃的种类不同,反应活性 反应随卤代烃的种类不同 差别显著,一般烯丙位卤代烃、卤苄等容易反应。 差别显著,一般烯丙位卤代烃、卤苄等容易反应。
-
Br K
+
CH2CH2CH3
第一节 氮原子对饱和碳原子的亲核取代反应 2.1.1.1 伯胺合成方法 Delepine反应 活泼卤代烃与乌洛托品在氯仿中加热反应,生成季铵盐, 再用盐酸水解得到伯胺。
N N N N RCl CH3Cl N R N+ N N ClRNH2 3NH3 6HCHO
第一节 氮原子对饱和碳原子的亲核取代反应 2.1.1.1 伯胺合成方法 Delepine反应 活泼卤代烃与乌洛托品在氯仿中加热反应,生成季铵盐, 再用盐酸水解得到伯胺。
第一节 氮原子对饱和碳原子的亲核取代反应
第一节 氮原子对饱和碳原子的亲核取代反应
第一节 氮原子对饱和碳原子的亲核取代反应
盐酸丁卡因
NH2 ClCH2COCl NHCOCH2Cl NH(CH3)2 NHCOCH2N(CH3)2
利度卡因
提示:芳香胺的反应活性比脂肪族胺弱,故芳香仲胺可通 过单烷基化合成。脂肪族仲胺一般用酰胺还原制备。
第二章 碳-氮键的合成
第一节 氮原子对饱和碳原子的亲核取代反应
第二节 氮原子对不饱和碳原子的亲核取代反应
第三节 氮原子对不饱和碳原子的亲核脱水缩合反应
第四节 氮原子对不饱和碳原子的亲核加成反应
第五节 亲核性碳原子和亲电性碳原子之间的反应
第一节 氮原子对饱和碳原子的亲核取代反应
形成C-N键的三种方法 键 形成
第二节 氮原子对不饱和碳原子的亲核取代反应 Schmidt重排机理
异氰酸酯
第二节 氮原子对不饱和碳原子的亲核取代反应 Schmidt应用
第三节 氮原子对不饱和碳原子的亲核脱水缩合反应 2.3.1 烯胺的合成 由酮和仲胺脱水缩合制得的化合物。其亲核性很强, 由酮和仲胺脱水缩合制得的化合物。其亲核性很强, 同时烯胺具有共振结构,类似于烯酮, 同时烯胺具有共振结构,类似于烯酮,β-碳原子带负 容易被烷基化试剂和酰基化试剂进攻。 电,容易被烷基化试剂和酰基化试剂进攻。
CONH2 Cl2 H3C O N NaOH H3C O N H3C O NH2 NHSO2 N
第二节 氮原子对不饱和碳原子的亲核取代反应 Hofmanm重排的机理
O R C NH2
Br2 -HBr
H R C N
O
Br
OH
O R C N Br
-Br
R
O C
N
O
C N R
H 2O
HO C N HO
HO C N R
NH2CH2CH2OSO3H NH2CH2CH2OH NaOH NH2CH2CH2NHCH2CH2OH
O
CH2OSO2
CH3NH2 O CH2NHCH3
第一节 氮原子对饱和碳原子的亲核取代反应 2.1.1.3环氧化合物和胺的反应 具有环张力的环醚与胺作用容易发生开裂, 具有环张力的环醚与胺作用容易发生开裂,并且按照 SN2机理反向开裂 机理反向开裂。 SN2机理反向开裂。
第一节 氮原子对饱和碳原子的亲核取代反应 2.1.1.1 伯胺合成方法 Gabriel 合成 用具有酸性N-H的邻苯二甲酰亚胺代替氨,卤代烃不会 过量取代,生成伯胺。
O NH O O NCH2CH2CH3 O NH2NH2H2O HCl NaOH KOH ON O O NH NH O CH3CH2CH2NH2 O N O
第一节 氮原子对饱和碳原子的亲核取代反应 2.1.1.1 伯胺合成方法 由烷基叠氮化合物还原合成伯胺 卤代烃与叠氮化钠生成烷基叠氮化钠,然后用LiAlH4还 原得到伯胺。
第一节 氮原子对饱和碳原子的亲核取代反应 2.1.1.2 醇和氨或胺的反应 一般醇的碳原子活性较低,对亲核氮原子的取代困难, 一般醇的碳原子活性较低,对亲核氮原子的取代困难, 取代必须在比较强的反应条件下进行。 比较强的反应条件下进行 取代必须在比较强的反应条件下进行。 但将醇转化为磺酸酯或对苯磺酸酯, 但将醇转化为磺酸酯或对苯磺酸酯,就很容易发生取 代反应生成胺。 代反应生成胺。
R
HO CH OH
H3CO C O NHR
H N
R
△
CO2 + NH2R
HOCH 3
H3CO C OH + NH2R
△
OCH3
O
第二节 氮原子对不饱和碳原子的亲核取代反应 Curtius重排
羧酸经酰氯再与叠氮化钠作用生成叠氮酰,然后重排成异氰酸酯。 羧酸经酰氯再与叠氮化钠作用生成叠氮酰,然后重排成异氰酸酯。
卤代苯中卤素的临位或对位有强吸电子基团,比如NO2,N+(CH3)3, CN, SO2H,COOH,CO,COR等,氨或胺可以与卤代苯进行亲核 取代反应。
第二节 氮原子对不饱和碳原子的亲核取代反应
卤代芳烃在液氨中和氨基钠存在下经过苯炔中间体生 成胺。
第二节 氮原子对不饱和碳原子的亲核取代反应 2.2.1.6 酚类化合物好氨或胺的反应 在加压和催化剂存在下,酚类化合物的羟基能够被氨 基取代。
亲电性碳原子和亲核性氮原子的反应。 亲电性碳原子和亲核性氮原子的反应。 亲核性碳原子和亲电性氮原子的反应 碳自由基和氮自由基的反应
2.1.1卤代烃和氨或胺的反应 卤代烃和氨或胺的反应
胺或氨的氮原子轨道与碳原子的SP3杂化轨道相近,电负性高, 胺或氨的氮原子轨道与碳原子的SP3杂化轨道相近,电负性高, SP3杂化轨道相近 氮原子上的非共用电子对容易与质子结合,显示碱性。 氮原子上的非共用电子对容易与质子结合,显示碱性。这种 非共用电子对与电荷密度低的饱和碳原子键合,形成C 非共用电子对与电荷密度低的饱和碳原子键合,形成C-N键。
第二节 氮原子对不饱和碳原子的亲核取代反应
N
O
CH3CH2CHBrCOOC2H5
N
O COOC2H5
氨水
N
O CONH2
COOC2H5
乙拉西坦
注意:α,β-不饱和羧酸酯在碱性条件下会发生 不饱和羧酸酯在碱性条件下会发生Michael反应。 反应。 注意: 不饱和羧酸酯在碱性条件下会发生 反应
Michael 加成
第二节 氮原子对不饱和碳原子的亲核取代反应 2.2.1.7 活性氢化合物的胺化 吡啶化合物、喹啉、异喹啉、菲啶、噻唑和苯并噻唑 等的2-位由于受到氮原子吸电子影响,电子云密度显著 下降,容易受到阴离子进攻。
第二节 氮原子对不饱和碳原子的亲核取代反应 2.2.1.8 由C-C键向C-N键转换的重排反应 重排反应是指分子内部的原子或原子团移动,化学键 位置发生改变,分子骨架发生变化的反应。 Hofmanm重排 酰胺在碱性条件下与卤素(溴或氯)作用生成少一个 碳的伯胺的反应。
O 1. R"COCl 2. H2O / H+ R C C
O C R"
C R
δ−
C
O 1. R" R O C 2. H2O / H+ O R"
第三节 氮原子对不饱和碳原子的亲核脱水缩合反应
(1) O N H H
+
Br
O
N
(2) H3O+ O (1) CH3C Cl (2) H3O+ CH3 O O
:NH3 NH2 OH OCH2 O NH2CH(CH3)2 HCl/丙酮 OCH2CHCH2NHCH(CH3)2 OH .HCl
O
盐酸普萘洛尔
第一节 氮原子对饱和碳原子的亲核取代反应 2.1.1.4 乙烯亚胺和胺的反应 在路易斯酸等的作用下, 在路易斯酸等的作用下,胺可以和乙烯亚胺进行亲核 取代反应,生成仲胺或伯胺。 取代反应,生成仲胺或伯胺。
机理:
第二节 氮原子对不饱和碳原子的亲核取代反应
应用
NH2
第二节 氮原子对不饱和碳原子的亲核取代反应 Schmidt重排
叠氮酸在Lewis酸或质子酸存在下,与羧酸、醛和酮作用进行重 酸或质子酸存在下,与羧酸、 叠氮酸在 酸或质子酸存在下 排反应。 排反应。 羧酸、醛或酮分别与等摩尔的叠氮酸(HN3)在强酸 硫酸、聚磷酸、 在强酸(硫酸 羧酸、醛或酮分别与等摩尔的叠氮酸 在强酸 硫酸、聚磷酸、 三氯乙酸等)存在下发生分子内重排分别得到胺 腈及酰胺。 存在下发生分子内重排分别得到胺、 三氯乙酸等 存在下发生分子内重排分别得到胺、腈及酰胺。
NHCOCH2Cl
利度卡因
N H O N O
CH2CONH
奈非西坦
第二节 氮原子对不饱和碳原子的亲核取代反应 2.2.1.4 羧酸与氨或胺的反应
注意:羧酸与胺反应需要较长的反应时间,高温加热。
注意:该反应是在氯仿中,加入无水三甲胺和氯甲酸乙酯,形成 酸酐,然后在酰胺化。
第二节 氮原子对不饱和碳原子的亲核取代反应 2.2.1.5 氨或胺对卤代苯的芳香族亲核取代反应
扑米酮
第二节 氮原子对不饱和碳原子的亲核取代反应
提示:分子内同时存在羟基和羧基的化合物,在与酰氯或PCl3反应 形成酰氯时,羟基也会参与反应,此时通常采用酯合成酰胺。
第二节 氮原子对不饱和碳原子的亲核取代反应 2.2.1.3 酰卤与氨或胺的反应
NHCOCH2N(C2H5)2 NHEt2
NH2 ClCH2COCl
第三节 氮原子对不饱和碳原子的亲核脱水缩合反应 2.3.1 烯胺的合成
O
OH
HO
R2NH
N HR2
HONR2+ NhomakorabeaH
+
NR2 + H
H
H2O
NR2
