高中化学竞赛模拟第一套
高中化学竞赛初赛模拟试卷1

高中化学竞赛初赛模拟试卷1第一题(5分)某反应体系中有反应物和生成物共六种:H2C2O4、CO2、(VO2)2SO4、VOSO4、H2SO4、H2O。
1.完成并配平该反应的化学方程式;2.(VO2)2SO4能及过量NaOH溶液反应,写出化学反应方程式;3.VOSO4可使酸性高锰酸钾溶液褪色,写出离子反应方程式。
第二题(10分)己二腈是合成尼龙-66的重要中间体。
1.写出以某常见石油化工产品合成己二腈,再进一步合成尼龙-66的反应流程;2.若以丙烯腈为原料合成时,因多步工艺导致产率不太高,然而用Pb作阳极,以对甲基苯磺酸甲乙胺作电解液,电解丙烯睛可一步完成制备己二睛。
(1)写出它的阴极反应式;(2)加入甲基苯磺酸的作用是什么;(3)计算该反应对于丙烯腈的原子(质量)利用率。
3.有机合成不但可用电解法完成,同时有机合成也可形成原电池,既生产产品,又生产电能。
例如,用烯烃生产卤代烃,约可得到0.5V的电势差。
试以RCH=CHR’+Cl2→RCHClCHClR’为例,制成原电池时,写出其电极反应。
第三题(9分)铜盐和吡啶及水杨酸(邻羟基苯甲酸)能形成单核电中性平面正方形配合物,在pH 4.0~4.5时形成蓝色配合物A;pH为5.0~5.5时形成绿色配合物;A的含铜量为12.8%,B的含铜量高于A。
用氯仿萃取时,A使有机相显蓝色,B仍显绿色。
请问:1.写出蓝色配合物A和绿色配合物B的化学结构式;2.解释形成两种不同结构配合物的原因3.虽然在pH>6时也有绿色沉淀生成,但它不能为氯仿所萃取,为什么?第四题(13分)1.为什么CsBrCl2热分解的反应是CrBrCl2=CsCl+BrCl,而不是CrBrCl=CsBr+Cl2?2.液体BrF5和AsF5都不是良导体,为什么两者混合后却成为导体?3.对下面测定的N、P的氢化物和氟化物的键角的各种相互差异作出解释。
NH3:107° PH3:102° NF3:93° PF3:104°4.比较化合物熔沸点高低并说明理由。
2023年高中化学竞赛初赛模拟试题含答案

高中化学竞赛初赛模拟试卷(09)(时间:3小时满分:100分)第一题(4分)硝酸盐在国计民生各方面有广泛旳用途,例如,含氮量最高旳无机肥是______,用作感光材料旳是_______,在喜庆节日放焰火中发绿色光旳是______,发红色光旳是______。
第二题(4分)将透明容器内旳NO与过量旳O2旳混合气体压缩并使体系旳温度降至-11.2℃时,容器内旳颜色由____色变成____色。
此时容器内旳物种中,具有顺磁性旳是_____________,具有抗磁性旳是_______。
第三题(6分)长期使用劣质香粉,脸上有时出现某些黑色斑点,这是由于在劣质香粉里具有铅白[2PbCO3·Pb(OH)2],它与皮肤中旳硫化物产生了黑色旳硫化铅。
除去这种黑色斑点旳重要措施是选用合适旳氧化剂将其氧化为难溶于水和酸旳白色化合物,供选择旳氧化剂有:①漂白粉、②高锰酸钾、③双氧水。
试回答:1.应选用作氧化剂去掉PbS,理由是。
2.去掉PbS时也许旳化学方程式是。
ﻬ第四题(20分)乙烯是十分重要旳石油化工产品,乙烯旳产量是衡量一种国家石油化工发展水平旳一种指标,其原因是从乙烯出发可以合成为数众多旳有机化工产品。
下面所列旳只是其中旳一小部分,请你在下列空格内填入合适旳试剂、反应条件或产物。
第五题(10分)用0.200mol/L NaOH溶液滴定一份具有H3PO4与NaH2PO4旳混合酸溶液,当加入5.0mLNaOH时测得溶液pH为2.16,而当滴加至15.00mL NaOH时测得溶液pH 为4.68。
试求:1.原混合溶液中,H3PO4与NaH2PO4旳含量各多少mmol?2.为到达第二计量点,所需NaOH总体积多少mL?已知:H3PO4旳Ka1=6.9×10-3Ka2=6.3×10-8,Ka3=4.8×10-13。
第六题(23分)许多有机化合物在碱性条件下有着不一样寻常旳行为,如碳架旳重排和基团旳引入、消去等,如法伏尔斯基重排:;赖默一梯曼反应:等。
全国高中化学竞赛初赛模拟试题一
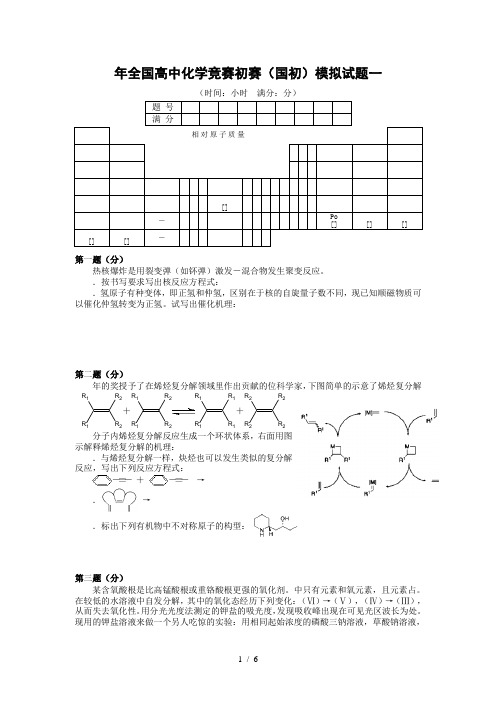
年全国高中化学竞赛初赛(国初)模拟试题一(时间:小时 满分:分)第一题(分)热核爆炸是用裂变弹(如钚弹)激发-混合物发生聚变反应。
.按书写要求写出核反应方程式:.氢原子有种变体,即正氢和仲氢,区别在于核的自旋量子数不同,现已知顺磁物质可以催化仲氢转变为正氢。
试写出催化机理:第二题(分)年的奖授予了在烯烃复分解领域里作出贡献的位科学家,下图简单的示意了烯烃复分解R 1R 1R 2R 2+R 1R 1R 2R 2R 1R 1R 1R 1+R 2R 2R 2R 2分子内烯烃复分解反应生成一个环状体系,右面用图示解释烯烃复分解的机理:.与烯烃复分解一样,炔烃也可以发生类似的复分解反应,写出下列反应方程式:-≡- + -≡- →.→.标出下列有机物中不对称原子的构型:第三题(分)某含氧酸根是比高锰酸根或重铬酸根更强的氧化剂。
中只有元素和氧元素,且元素占。
在较低的水溶液中自发分解,其中的氧化态经历下列变化:(Ⅵ)→(Ⅴ),(Ⅳ)→(Ⅲ),从而失去氧化性。
用分光光度法测定的钾盐的吸光度,发现吸收峰出现在可见光区波长为处。
现用的钾盐溶液来做一个另人吃惊的实验:用相同起始浓度的磷酸三钠溶液,草酸钠溶液,醋酸钠溶液分别和等浓度的钾盐溶液混合,发现的钾盐在三种溶液中的稳定性顺序为:磷酸三钠溶液<草酸钠溶液<醋酸钠溶液。
问题:.写出的化学式,并表明的氧化态。
.预测的钾盐的颜色,说明原因。
.你认为在磷酸三钠溶液,草酸钠溶液,醋酸钠溶液中出现的稳定性顺序的原因是什么?.你认为的实际用途是什么?第四题(分)化合物是一种有毒并有恶臭的金黄色液体,现用催化剂催化氯化得到化合物。
化合物是樱桃红色液体,它与乙烯在一定条件下化合生成一种毒气化合物与在一定条件下作用生成化合物,化合物具有八员杂环的摇篮式结构,其中分子内有个原子间存在比正常化学键弱但却很明显的键合作用,且存在个相同的原子共平面。
.写出、、、的化学式。
.画出、的空间结构,并画出中不平常的键合作用。
2023年高中化学竞赛预赛模拟检测试题

全国化学竞赛初赛模拟试卷一.制备纯净、无水HC N(沸点299K )旳一种措施是:混合磨细旳K CN 和KHS 粉末,适度加热,写出这个反应式。
1.为何要磨细和用粉末? 2.为何要强调适度加热?3.能否阐明HCN旳酸性比H 2S 弱?4.试验室尚有何措施制取HCN ,写出反应方程式。
5.HCN 可与丙烯醛发生1,4加成反应得到A,A 与足量氢气还原得到B,写出A 、B旳构造简式。
二.有关铁生锈旳机理有人提出如下环节:①Fe (固)→Fe 2++2e (e 表达电子) ②H ++e →H ③4H+O 2(气)→2H 2O ④4F e2++O 2(气)+(4+2x)H2O →2(Fe 2O 3·x H2O )(固)+8H +请用上述机理解释:一种柳在钢板上旳铆钉,锈蚀较严重旳部分不是暴露在空气中旳铆钉面,而是在铆钉头与钢板旳重叠部分。
三.右图为水-苯酚旳T-x图,横坐标为苯酚旳质量百分含量,纵坐标为温度,曲线ACB 表达不一样温度下水与苯酚恰好到达互溶时旳构成。
请回答:1.指出点C,曲线AC 、BC ,曲线ACB 与横坐标围成旳部分分别表达旳含义。
2.50℃时,50mL 试管内盛有2m L旳液态苯酚,现逐滴滴加蒸馏水,并摇匀,论述可观测到旳现象。
(已知液态苯酚旳密度为1.07g/cm 3,熔点42℃)3.假如在50℃时,将6g 苯酚与14g 水混合,系统分为两层,计算上下两层溶液旳质量。
(已知点a 、b旳横坐标分别为12、60)四.N O2是一奇电子分子,在413K 如下能二聚成无色旳抗磁性气体N 2O 4,超过423K 时,NO 2发生分解。
N 2O 4被用作第一艘登月飞船旳液体推进系统中旳氧化剂,其重要燃料是肼。
N 2O 4仅在固态时是纯净物质,其熔点为264K,沸点为294K 。
X 射线衍射分析成果表明:N2O 4分子是平面状构造,且所有旳N —O 键长都相等。
当N 2O 4为液态时,可以微弱地解离生成硝酸亚硝酰盐。
{高中试卷}全国化学竞赛初赛模拟试卷[仅供参考]
![{高中试卷}全国化学竞赛初赛模拟试卷[仅供参考]](https://img.taocdn.com/s3/m/bcd6f7e2a32d7375a51780ce.png)
20XX年高中测试高中试题试卷科目:年级:考点:监考老师:日期:20XX年全国化学竞赛初赛模拟试卷(时间:3小时满分:100分)第i题(2分)α-Al2O3既难溶于酸、也难溶于碱,但高温下与某盐反应可转化为可溶物;所得产物溶于适量水可结晶得到明矾。
写出熔解α-Al2O3的反应方程式。
第ii题(4分)将一小块具有规则形状的胆矾晶体投入某温度下的饱和硫酸铜溶液中,甲、乙同学都观察到晶体未发生变化。
甲同学认为:根据现象说明未发生晶体的溶解和结晶。
乙同学认为:虽然未观察到晶体的变化,但存在溶解和结晶的动态平衡。
你同意哪一位同学的分析?请设计2个实验实验证明。
第iii题(7分)氯代有机物通过各种途径进入到环境后会对生态环境和人体健康产生极大的危害。
利用电化学方法去除氯代芳烃污染物是极具应用前景的方法之一。
某研究小组以Ag+为媒质作用进行间接电化学氧化,对大多数氯代芳烃的去除率都可达到99%以上。
具体过程为Ag+在阳极转化为A,A与水反应生成具有高度活性的自由基B,B攻击氯代芳烃分子,并最终将其氧化1.写出电极反应方程式;2.写出A→B的反应方程式;3.以五氯苯酚为例,写出B 将其氧化的方程式;4.Ag +用于氯代芳烃处置的缺点除费用高外,还有1个不足之处是什么?第iv 题(6分)氮化碳结构如右图,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。
1.写出氮化碳的化学式; 2.指出氮化碳的晶体类型;3.请在右图中用粗线画出两种二维晶胞。
第v 题(8分)二亚胺X (结构如右图)广泛地用于聚氨酯、聚酯及聚氨酯塑料的生产,也用于医药、农药、生物化工等领域。
其合成方法如下:A −−→−+2COClB −−→−-HClC −−→−缩合X1.X 中两个苯环是否共平面,为什么?两个苯环对位4个碳原子是否共直线,为什么?2.写出A、B、C的结构简式;3.写出A的名称和C的物质类别;4.C→X的反应中有什么副产物产生?第vi题(6分)研究发现,钒与呋喃-2-甲酸根形成的单核配合物可增强胰岛素降糖作用,它是电中性分子,实验测得其氧的质量分数约为38.8%。
高中化学竞赛初赛模拟试卷

2008高中化学竞赛初赛模拟试卷(5)第[一]题(4 分)美国和俄罗斯科学家组成的一个研究小组10月16日宣布,他们成功制造出了门捷列夫元素周期表中的118号元素。
他们通过设在俄罗斯杜布纳的U400回旋加速器实验设备,两次将许多钙—48离子加速,用来轰击人造元素锎(Cf)—249,从而制造出3颗新原子:每颗新原子的原子核包含118个质子和179个中子。
118号元素原子存在时间仅为0.9毫秒。
研究人员观察到了118号元素原子的“衰变链”过程,证实了新元素的存在。
其衰变过程中依次释放出一种相同的粒子后得到116、114、112号元素,112号元素最终裂变为两颗大小差不多的其他原子。
1 •指出118号元素在周期表中的位置;2•写出合成118号元素的核反应方程式;3•指出衰变过程中112号元素样子的质量数。
第[二]题(10分)为了防止铁制品生绣,可对其表面进行“发蓝”处理:把铁制品浸入热的NaNQ NaNO、NaOH 昆合溶液中,使它的表面氧化成一层致密的Fe sQ氧化膜。
其原理是:①在NaOH溶液中,铁粉与NaNO溶液发生可逆反应,生成A溶液和气体G②在NaOH溶液中,铁粉与NaNO溶液中发生反应,生成B溶液和气体C。
③生成A和B的溶液能继续发生可逆反应,生成Fe3C4。
经研究发现:A和B的焰色反应均为黄色,其导电性实验均为&SQ型。
气体C具有强烈的刺激性气味。
1 •写出并配平化学反应方程式。
2 •实践中发现适当提高温度或增大NaNO溶液的浓度有利于氧化膜增厚,但若NaOH的含量太少或太多,氧化膜的厚度都太薄。
请用化学平衡原理解释发生这种现象的原因。
3. 发蓝层遇光气(COC2),若不及时清洗,则发蓝层的完整性将被破坏。
写出有关的化学反应方程式。
第[三]题(7 分)近期来上海连续发生“瘦肉精”食物中毒事故,波及全市9个区、300多人。
“瘦肉精” 的学名盐酸克仑特罗,用作饲料后,猪吃了它能减肥,人吃了它会中毒甚至死亡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一套
第一题
检出限是痕量无素分析的基本参数之一。
检出限的定义是:在给定方法的精确度一定时,被测元素的最小检出质量。
微饿的测定即为一例。
1927年德国化学家Bergh提出用形成8—羟基喹啉与四碘合铋酸的难溶盐[C9H6(OH)NH][Bil4](相对分子质量M=862.7)的方法沉淀铋。
1—1(1)画出该难溶盐的阳离子和阴离子的结构式。
(2)指明该盐中铋的氧化态。
1—2若该盐的沉淀最小检出质量是50mg,用Bergh方法估算测定秘的最小质量(mg)。
为测定痕量的铋,来自伯明翰的化学家R·Belch等人创立了一种多步法,进行一系列反应后对最终产物进行滴定。
该法的详细描述如下:
步骤1:在冷却条件下向含痕量的Bi3+(≈mL)的经酸化的溶液中加入500mg六硫氰酸合铬(III)酸钾(K3[Cr(SCN)6])使铋定量沉淀。
1—3写出配平的离子方程式
步骤2:沉淀经过过滤后用冷水洗涤,再用5mL10% NaHCO3溶液处理,上述沉淀转化为[(BiO)3CO3]沉淀,同时生成的六硫氰酸合格(III)酸根离子进入溶液中。
1—4 写出配平的离子方程式。
步骤3:将稍加酸化的滤液转移到一个分液漏半中,加入0.5mL含碘的饱和氯仿溶液,激烈振摇,碘将配合物中的配体氧化成ICN和硫酸根离子。
1—5 写出配平的离子方程式
步骤4:5min后向混合物中加入4mL 2M的硫酸溶液,发生化学反应,挥发出碘分子。
1—6 写出配平时发生反应的离子方程式
步骤5:分四次用氯仿定量地萃取碘,把水相转入一个烧瓶,加入1mL溴水,摇匀,放置5min。
1—7 写出加入溴水后发生反应的离子方程式。
注意:过量的溴水可以跟氢氰酸反应,释放出BrCN,碘则被氧化成IO3—。
步骤6:为除去过量的溴,向混合物中加入3mL 90%的甲酸。
1—8写出配平的离子方程式
步骤7:向稍加酸化的溶液中加入过量1.5g的碘化钾。
1—9写出这个反应的配平的离子方程式。
注意,要考虑碘离子会与BrCN反应,正如碘离子会与ICN生成碘分子一样。
步骤8:用0.00200M的Na2S2O3标准溶液滴定上面得到的溶液,所得的结果被用来计算样品中铋的含量。
1—10(1)在原始样品中,每1mol铋要消耗多少mol的Na2S2O3?
(2)假定可靠的测定所用的0.00200M Na2S2O3标准溶液的量不低于1mL,则用此法测定铋的最低量为多少?
1—11 上述多步法比Berch重量法的灵敏度高多少?
第二题(7分)
在液态SO2中用叠氮酸铯与氰气反应定量生成铯的离子化合物。
其阴离子中含氮量为74.47%。
1.试画出该离子化合物中阴离子的结构式;
2.说明每个原子的杂化类型和化学键型。
第三题(8分)
研究发现,氯化钴与6-甲基吡啶-2-甲醇反应形成电中性分子的单核配合物分子,实验测得其钴的质量分数为17.4%。
1.确定该配合物的化学式;
2.画出它的立体结构,指出构型。
3.实际测得该配合物分子以二聚体形式存在,且呈现双螺旋结构。
(1)二聚体分子间的作用力是什么?
(2)画出该配合物的双螺旋结构。
第四题(6分)
金属M的晶格是面心立方,密度为8.90g/cm3,计算:
1.Ni晶体中最邻近的原子之间的距离。
2.能放入Ni晶体空隙中的最大原子半径是多少?
第五题(8分)
某晶体的结构可看作由金原子和铜原子在一起进行(面心)立方最密堆积,它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由4个金原子和2个铜原子构成,另一种由2个金原子和4个铜原子一起构成,两种八面体的数量比是1︰1。
该晶体具有储氢功能,氢原子全部填充在由金、铜原子构成的四面体空隙中。
1.写出该晶体储氢后的化学式。
2.该晶体属于哪种晶系?其四面体空隙由什么原子组成,是否全部等价?
3.画出该晶体的一个晶胞(金原子用大○球,铜原子用大球)。
4.如果该晶体中金、铜原子的排列无序,出现相互代换的现象(按统计原子计),则其晶胞与哪种常见物质的晶胞是相同的?
第六题(10分)
在金的各化合物中,+3价金较为稳定,并且很容易生成配合物,其配位数一般为4,具有平面正方形结构。
1.试写出+3价金的电子排布式。
2.将AuF3和XeF2同F2一起加热到4000C,几小时后只生成了一种化合物A。
经研究发现,A是一种共价型离子化合物,其阴离子基本上呈八面体结构,阳离子的结构可看作是两个八面体
以一个氟原子桥联在一起,且两个八面体中各有一个氙原子同阴离子中的氟原子相连。
(1)试写出A的分子式,写出生成A的化学反应方程式。
(2)画出A的结构。
3.在N2气氛中,在110℃时,将A与CsF反应,可以得到化合物B和C。
已知A的阴离子在反应前后没有发生键的断裂,B是一种具有八面体的二元化合物。
(1)写出B和C的分子式。
(2)写出生成B和C的化学反应方程式。
答案
第一题
1—1(1)
(2)阳离子的氧化态是+3
1-2解析:50mg铋难溶盐对应的摩尔数为50mg/962.7g·mol—1=0.058mmol;则铋的质量为0.058mmol×209.0g·mol—1=12.1mg。
答案Bergh法测定铋的最小检出量是12.1mg。
1-3答案:Bi-3++[Cr(SCN)6]3—→Bi[Cr(SCN)6]
1—4答案:2Bi[Cr(SCN)6]+6HCO3—→(BiO)2CO3+2[Cr(SCN)6]3—+3H2O等
1—6答案:ICN+I—+H+→I2+HCN
1—7答案:(1)3Br2+I—+3H2O→IO3—+6Br—+6H+
(2)3Br2+HCN→BrCN+Br—+H+
1—8答案Br2+HCOOH→2Br—+2CO2+2H+
1—9答案:(1)IO3—+5I—+6H+→3I2+3H2O
(2)BrCN+2I—+H+→I2+HCN+Br
—1——10解析:Na
S2O3标准溶液滴定I2的方程式为:I2+2S2O32—→2I—+2S4O62—
2
设初始溶液中含有1molBi,在2—5中,每个Bi对应形式42molI2,在2—6中消耗了6mol I2,因此2—7(1)中生成了36molIO3—,相应在2—9(1)中生成了36×3=108molI2,需要108×2=216molNa2S2O3标准溶液滴定;
不过,在2—5和2—6中,1molBi还产生6mol HCN.2—7(2)中6molHCN生成BrCN,对应在2—9(2)中又生成6mol I2,需要12mol Na2S2O3标准溶液滴定;
因此共需要Na2S2O3标准溶液216—12=228mo1。
答案228mol
解析:1mL 0.00200M Na2S2O3标准溶液含2.00×10—6mol Na2S2O3,能测定的铋的质量为(2.00×10—6mol/228)×209.02g·mol—1=1.83×10—6g=1.83μg.
答案:1.83μg.
1—11解析:12.1mg/1.83μg=6600
答案:6600
第二题(7分)
1.(4分)
2.环中的N原子和C原子分别采取sp2杂化,端连的C、N原子分别采取sp杂化。
键型有
各原子之间的σ键和一个π键、一个π8
7(或者一个π6
5
和二个π键)(3分)
第三题(8分)
1.CoC14H17N2O2Cl(2分)
2.(2分)四方锥(1分)
3.(1)氢键(1分)(2)(2分)
第四题(6分)
1.一个晶胞中有Ni:8×1/8+6×1/2=4(个)
设晶胞边长为acm
4×58.69/(6.02×1023×a3)=8.90 得a=352.5(pm)
最邻近的Ni原子是顶角与面心的两个N i原子d min=2a/2=249.3(pm)(3分)
2.八面体空隙显然要大于四面体空隙2r Ni=d min,2r x+2r Ni=a,所以rx=51.6(pm)
故最大填隙原子半径为51.6pm 。
(3分)
第五题(8分)
1.AuCuH 4(2分) 2.四方晶系(1分) 2个金原子和2个铜原子一起构成,全部等价(1分)
3.(3分) 4.CaF 2(1分)
第六题(9分)
1.1s 22s 22p 63s 23p 63d 104s 24p 64d 104f 145s 25p 65d 8;
2.(1)A :[Xe 2F 11][AuF 6];AuF 3+XeF 2+F 2−−→−C 0400[Xe 2F 11][AuF 6];
(2)Xe F
F
F F F Xe F F F F Au F F
F F
F ; 3.(1)B :XeF 6;C :Cs[AuF 6];(2)[Xe 2F 11][AuF 6]+CsF −−→−C 01102XeF 6+Cs[AuF 6]。
