北师大无机化学四版习题答案20章d区金属二
20-23章习题答案

第20章 s 区金属20-7.商品氢氧化钠中为什么常含有杂质碳酸纳?怎样用最简便的方法加以检验?如何除去它?答:因为氢氧化钠是强碱,容易吸收空气中的CO 2,反应生成Na 2CO 3。
检验的方法是:取少量商品氢氧化钠溶解,向其中加入饱和CaCl 2溶液,若生成白色沉淀,证明有Na 2CO 3存在。
除去Na 2CO 3的方法是:可先配饱和的NaOH 溶液,在这种溶液中,Na 2C03不溶,静置后,沉淀过滤除去。
20-13 . 已知Mg(OH)2的K sp =1.8×10-11, NH 3·H 2O 的K b =1.8×10-5, 计算下列反应的平衡常数:Mg(OH)2 + 2NH 4+=== Mg 2+ + 2NH 3·H 2O讨论Mg(OH)2在NH 4Cl 溶液中的溶解性。
解:Mg(OH)2 + 2NH 4+====== Mg 2++ 2NH 3·H 2O K 值不是很大,在浓的NH 4Cl 溶液中可溶解。
第21章 p 区金属21-7. 有一白色固体混合物,可能含有SnCl 2、 PbCl 2、 SnCl 4·5H 2O 、 PbSO 4等,从下列实验现象判断哪几种是确实存在的,并用反应式表示实验现象。
①加水生成悬浊液A 和不溶固体B ;②A 中加少量盐酸则澄清,滴加碘淀粉溶液可褪色.③固体B 易溶于稀HCl ,通入H 2S 得黑色沉淀,沉淀与H 2O 2反应转变为白色。
21-8. (1)利用下列数据:① Al 3++ 3e -= Al ϕA θ = -1.662V ② Al(OH)4- + 3e - = Al + 4OH- ϕB θ = -2.30V计算反应 Al 3++ 4OH - = Al(OH)4- 的平衡常数。
(2)用标准电极电势说明下列反应中哪个能正向进行。
计算能正向进行反应的△r G θ和平衡常数。
242232][NH O]H ][NH [Mg ++⋅=K 2bsp K K =056.0)108.1(108.12511=⨯⨯=--① PbO 2 + 4H + + Sn 2+ = Pb 2+ + Sn 4++ 2H 2O ② Sn 4++ Pb 2++ 2H 2O = Sn 2++ PbO 2 + 4H +解(1)①-②得: Al 3++ 4OH - = Al(OH)4-② ∵ ϕA θ (PbO 2/Pb 2+) - ϕA θ(Sn 4+/Sn 2+) = 1.455 - 0.15 = 1.305V >0∴ ①反应可正向进行。
大学无机化学第20章 过渡金属元素习题答案 20120319

第20章d区过渡金属元素习题解答1.为什么过渡元素中,同族元素从上到下高氧化态物质的稳定性升高,而过渡后的p区元素同族自上而下低氧化态的物质趋于稳定?2.自ⅣB族到ⅦB族元素的最高氧化态在溶液中为什么不存在简单的离子M4+、M5+、M6+?3.为什么d区金属的密度、硬度、熔点、沸点一般较高?4.过渡元素的氧化态分布有何特点?5.由MnO2制备锰酸盐应在酸性介质还是碱性介质中进行?欲把Mn2+ 离子氧化为MnO4–离子应选用何种氧化剂?6.Cr3+与Al3+在生成化合物方面有何异同?7.根据下列实验现象,写出相应的化学反应方程式:(1)在酸性K2Cr2O7溶液中加入Na2SO3溶液,颜色由橙红变蓝绿色,此时加入乙醚,并用HNO3酸化,溶液变为深蓝色。
(2)黄色的BaCrO4溶在浓盐酸中,得到的是绿色溶液,写出化学方程式,说明颜色变化。
(3)Fe2(SO4)3溶液与Na2CO3溶液作用,得不到Fe2(CO3)3。
(4)在水溶液中用Fe3+与KI作用,不能制得FeI3。
(5)向Fe3+溶液中加入KSCN后出现红色,若再向溶液中加入Fe粉或NH4F晶体,红色又消失;(6)向CoCl2溶液中加入NaOH溶液,先析出粉红色沉淀,沉淀很快又转为灰绿色至褐色。
8.写出下列反应的化学方程式:(1)TiO2(s) + BaCO3(s) → ;(2)V2O5(s) + HCl(aq) → ;(3)Cr2O72–(aq) + Ag+(aq) + H2O(l) → ;(4)[Cr(OH)4]–(aq) + H2O2(l) + OH–(aq) → ;(5)MnO4–(aq) + Fe2+(aq) + H+(aq) → ;(6)MnO2(s) + HCl(aq,浓) → ;(7)Cr3+(aq) + MnO4–(aq) + H2O(l) → ;(8)Co2O3(s)+ HCl (aq,浓) → ;(9)K3[Fe(CN)6] (aq) + Fe2+(aq) → ;(10)PO43–(aq) + (NH4)2MoO4(aq) + H+(aq) → ;(11)PdCl2(aq) + CO(g) + H2O(l) → ;(12)Pt(s) + HNO3(aq) + HCl(aq) → 。
无机化学第四版(北京师范大学大学等)答案——下册[1].
![无机化学第四版(北京师范大学大学等)答案——下册[1].](https://img.taocdn.com/s3/m/af336a47964bcf84b9d57bdb.png)
第19章金属通论19-1举例说明哪些金属能从(1)冷水,(2)热水,(3)水蒸气,(4)酸,(5)碱中置换出氢气,写出有关的反应式并说明反应条件。
1、解:2Na + 2H2O = 2NaOH+ H2↑Mg+ 2H2O= Mg(OH)2↓ + H2↑3Fe + 4H2O = Fe3O4 + 4H2↑Zn + 2HCl = ZnCl2 + H2↑2Al + 2OH- + 6H2O = 2[Al(OH)4]-19-2 已知在 973K 时,2CO + O2 = 2CO2 ; △r Gθ= -398 kJ.mol-12Ni + O2 = 2NiO; △r Gθ=-314 kJ.mol-1试计算该温度下CO + NiO = Ni +CO2的△r Gθ值,并对照图19-1说明在该温度下能否用CO 还原NiO制取Ni 。
2、解: 2CO + O2 = 2CO (1)2Ni + O2 = 2NiO (2)CO + NiO = Ni + CO2 (3)(3) =2)2()1(-∆rGθ =2) 314(398---= -42kJ•mol-1CO的自由能比NiO的低,∆rGθ< 0 故可以使用CO还原NiO 制取Ni19-3下图是几种金属硫化物的埃林汉姆图。
(1)请解释图中各条线形状变化的意义;(2)据图,若从硫化物中提取金属,适宜的还原剂和温度条件各如何?(1)1/2C + S = 1/2 CS2(2)Hg + S = HgS(3)2/3 Bi +S = 1/3 Bi2S3(4)H2 +S = H2S(5)Pb +S = PbS3、解:线1中,随着温度的升高,刚开始时吉布斯自由能呈上升趋势,但当温度达到一定值后,随着温度的升高,吉布斯自由能反呈下降趋势。
斜率发生了变化,是因为温度升高,发生了相变,出现了熵增,因而∆rGθ下降。
线2线3相似,起始随温度的升高,∆rGθ增加,达到一定温度后,随着温度的增加,∆rGθ增加的速度更快,斜率加大,出现了熵增。
北师大版无机化学习题答案(上、(下册))

第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
《无机化学》习题解析和答案

1、教材《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,2002年8月第4版。
2、参考书《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,1992年5月第3版。
《无机化学》邵学俊等编,武汉大学出版社,2003年4月第2版。
《无机化学》武汉大学、吉林大学等校编,高等教育出版社,1994年4月第3版。
《无机化学例题与习题》徐家宁等编,高等教育出版社,2000年7月第1版。
《无机化学习题精解》竺际舜主编,科学出版社,2001年9月第1版《无机化学》电子教案绪论(2学时)第一章原子结构和元素周期系(8学时)第二章分子结构(8学时)第三章晶体结构(4学时)第四章配合物(4学时)第五章化学热力学基础(8学时)第六章化学平衡常数(4学时)第七章化学动力学基础(6学时)第八章水溶液(4学时)第九章酸碱平衡(6学时)第十章沉淀溶解平衡(4学时)第十一章电化学基础(8学时)第十二章配位平衡(4学时)第十三章氢和稀有气体(2学时)第十四章卤素(6学时)第十五章氧族元素(5学时)第十六章氮、磷、砷(5学时)第十七章碳、硅、硼(6学时)第十八章非金属元素小结(4学时)第十九章金属通论(2学时)第二十章s区元素(4学时)第二十一章p区金属(4学时)第二十二章ds区元素(6学时)第二十三章d区元素(一)第四周期d区元素(6学时)第二十四章d区元素(二)第五、六周期d区金属(4学时)第二十五章核化学(2学时)1 .化学的研究对象什么是化学?●化学是研究物质的组成、结构、性质与变化的一门自然科学。
(太宽泛)●化学研究的是化学物质(chemicals) 。
●化学研究分子的组成、结构、性质与变化。
●化学是研究分子层次以及以超分子为代表的分子以上层次的化学物质的组成、结构、性质和变化的科学。
●化学是一门研究分子和超分子层次的化学物种的组成、结构、性质和变化的自然科学。
第20章d区元素(二)
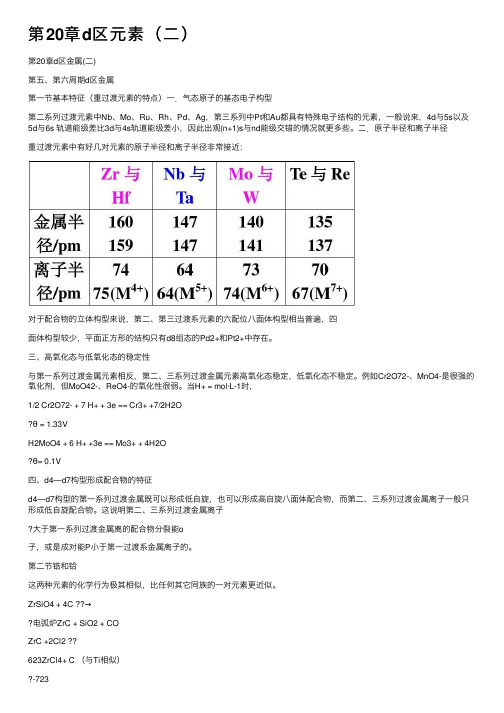
第20章d区元素(⼆)第20章d区⾦属(⼆)第五、第六周期d区⾦属第⼀节基本特征(重过渡元素的特点)⼀.⽓态原⼦的基态电⼦构型第⼆系列过渡元素中Nb、Mo、Ru、Rh、Pd、Ag,第三系列中Pt和Au都具有特殊电⼦结构的元素,⼀般说来,4d与5s以及5d与6s 轨道能级差⽐3d与4s轨道能级差⼩,因此出观(n+1)s与nd能级交错的情况就更多些。
⼆.原⼦半径和离⼦半径重过渡元素中有好⼏对元素的原⼦半径和离⼦半径⾮常接近:对于配合物的⽴体构型来说,第⼆、第三过渡系元素的六配位⼋⾯体构型相当普遍,四⾯体构型较少,平⾯正⽅形的结构只有d8组态的Pd2+和Pt2+中存在。
三、⾼氧化态与低氧化态的稳定性与第⼀系列过渡⾦属元素相反,第⼆、三系列过渡⾦属元素⾼氧化态稳定,低氧化态不稳定。
例如Cr2O72-、MnO4-是很强的氧化剂,但MoO42-、ReO4-的氧化性很弱。
当H+ = mol·L-1时,1/2 Cr2O72- + 7 H+ + 3e == Cr3+ +7/2H2Oθ = 1.33VH2MoO4 + 6 H+ +3e == Mo3+ + 4H2Oθ= 0.1V四、d4—d7构型形成配合物的特征d4—d7构型的第⼀系列过渡⾦属既可以形成低⾃旋,也可以形成⾼⾃旋⼋⾯体配合物,⽽第⼆、三系列过渡⾦属离⼦⼀般只形成低⾃旋配合物。
这说明第⼆、三系列过渡⾦属离⼦⼤于第⼀系列过渡⾦属离的配合物分裂能o⼦,或是成对能P⼩于第⼀过渡系⾦属离⼦的。
第⼆节锆和铪这两种元素的化学⾏为极其相似,⽐任何其它同族的⼀对元素更近似。
ZrSiO4 + 4C ??→电弧炉ZrC + SiO2 + COZrC +2Cl2 ??623ZrCl4+ C (与Ti相似)-723→ZrO2 + 2C + 2Cl2 ??→1173ZrCl4 + 2COKZrCl4(g) + 2Mg(l) ??11502MgCl2(s) + Zr(粗)→KArZr(粗) + 2I2 ??→473ZrI4KZrI4??→1673Zr + 2I2K第⼆节铌和钽(Niobium and Tantalum)铌、钽在空⽓中很稳定,能抵抗除氢氟酸以外的⼀切⽆机酸,包括王⽔。
无机化学练习题(含答案)

无机化学练习题(含答案)第1章原子结构与元素周期系1-1 试讨论,为什么有的元素的相对原子质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离1-2 Br2需要吸收的最低能量子的波长与频率。
1-3 氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁1-4 周期系中哪一个元素的电负性最大哪一个元素的电负性最小周期系从左到右和从上到下元素的电负性变化呈现什么规律为什么1-5 什么叫惰性电子对效应它对元素的性质有何影响1-6 当氢原子的一个电子从第二能级层跃迁至第一能级层时发射出光子的波长是;当电子从第三能级层跃迁至第二能级层时,发射出光子的波长是。
问哪一个光子的能量大1-7 有A,B,C,D四种元素。
其中A为第四周期元素,与D可形成1:1和1:2原子比的化合物。
B为第四周期d区元素,最高氧化数为7。
C和B是同周期元素,具有相同的最高氧化数。
D为所有元素中电负性第二大元素。
给出四种元素的元素符号,并按电负性由大到小排列之。
1-8有A,B,C,D,E,F元素,试按下列条件推断各元素在周期表中的位置、元素符号,给出各元系的价电子构型。
(1)A,B,C为同一周期活泼金属元素,原子半径满足A>B>C,已知C有3个电子层。
(2)D,E为非金属元素,与氢结合生成HD和HE。
室温下D的单质为液体,E的单质为固体。
(3)F为金属元素,它有4个电子层并且有6个单电子。
第2章分子结构2-1 ~ 键可由s-s、s-p和p-p原子轨道“头碰头”重叠构建而成,试讨论LiH(气态分子)、HCl、Cl2分子里的~ 键分别属于哪一种2-2 NF3和NH3的偶极矩相差很大,试从它们的组成和结构的差异分析原因。
2-3 一氧化碳分子与酮的羰基(>C=O)相比,键能较小,键长较小,偶极矩则小得多,且方向相反,试从结构角度作出解释。
北师大无机化学四版习题答案20章d区金属二

第20章 d区金属(二)第五、六周期d区金属20.1 简述第五、第六周期d区金属与第四周期d区金属的主要差别。
答:①由于(n-1)d和ns能级交错的情况更多一些,所以第二、三过渡元素中就出现了多个具有特殊电子构型的元素。
②第三电离能或更高级的电离能与第一电离能或第二电离能之差,则是第一过渡系元素远比第二、三过渡元素的大。
③第五、六周期d区金属元素为d区重过渡元素,第四周期d区金属中Sc、Ti属轻金属。
④第二、三过渡系列元素的高氧化态稳定,低氧化态化合物不常见,而第一过渡系元素的低氧化态稳定。
⑤第二、三过渡元素配合物的配位数较高,形成金属—金属键的元素较多。
⑥第一过渡系元素既可形成高自旋,也可形成低自旋八面体配合物,而第二、三过渡系金属离子一般只形成低自旋化合物。
⑦第二、三过渡系元素磁性要考虑自旋—轨道耦合作用,化合物的磁矩只能按,而第一过渡系元素化合物的磁矩基本符合自旋关系式。
20.2 为什么锆、铪及其化合物的物理、化学性质非常相似,如何分离锆和铪?答:因为锆、铪的外层电子构型相同(n-1)d2ns2,原子半径相等,所以锆、铪及其化合物的物理、化学性质非常相似。
分离锆、铪主要采取离子交换或溶剂萃取法。
1 离子交换法是利用强碱型酚醛树脂R-N(CH3)3+Cl-阴离子交换剂,使Zr和Hf形成的ZrF62-、HfF62-离子与阴离子树脂进行吸附交换,由于锆、铪配离子与阴离子树脂结合能力不同,所以可以用HF和HCl混合液为淋洗剂,使这两种阴离子先后被淋洗下来。
②Zr-Hf的溶剂萃取法就是利用Zr、Hf的硝酸溶液与有机相磷酸三丁酯(TBP)或三锌胺(TDA)的甲基异丁基酮溶液混合振荡萃取的过程,由于锆的配位能力比铪强,比较容易进入有机溶剂相中,因而达到分离效果。
20.3 举出铌、钽化合物性质的主要差别以及分离铌和钽的方法?解:铌、钽化合物性质的主要差别:①Nb2O5和Ta2O5与过量的碱金属氢氧化物或碳酸盐共熔,然后溶于水时,生成同多酸根阴离子的溶液,当pH<7时,Nb产生水合氧化物沉淀,当pH<10时,Ta产生水合氧化物沉淀。
无机化学(北师大等三校编,第四版,高教版, 2003)习题答案

面向二十一世纪教材北京师范大学、华中师范大学、南京师范大学编无 机 化 学(第四版,北京: 高等教育出版社, 2003) 习 题 答 案第一章 原子结构和原子周期系1-1根据原子序数给出下列元素的基态原子的核外电子组态:(a)K (b)Al (c)Cl (d)Ti(Z=22) (e)Zn(Z=30) (f)As(Z=33) 答:(a)[Ar]4s1(b)[Ne]3s23p1(c)[Ne]3s23p5(d)[Ar]3d54s2(e)[Ar] 3d104s1(f)[Ar]4s24p31-2给出下列原子或离子的价电子层电子组态,并用方框图表示轨道,填入轨道的电子用箭头表示。
(a)Be (b)N (c)F (d)Cl- (e)Ne+ (f)Fe3+ (g)As3+1-3 Li+、Na+、K+、Rb+、Cs+的基态的最外层电子组态与次外层电子组态分别如何?1-4以下+3价离子那些具有8电子外壳?Al3+、Ga3+、Bi3+、Mn3+、Sc3+答:Al3+和Sc3+具有8电子外壳。
1-5已知电中性的基态原子的价电子层电子组态分别为:(a)3s23p5(b)3d64s2(c)5s2(d)4f96s2(e)5d106s1试根据这个信息确定它们在周期表中属于那个区、哪个族、哪个周期。
答:(a)p区,ⅦA族,第三周期 (b)d区,Ⅷ族,第四周期 (c)s区,ⅡA族,第五周期 (d)f区,ⅢB族,第六周期 (e)ds区,ⅠB族,第六周期1-6根据Ti、Ge、Ag、Rb、Ne在周期表中的位置,推出它们的基态原子的电子组态。
答:Ti位于第四周期ⅣB族,它的基态原子的电子组态为[Ar]3d24s2;Ge位于第四周期ⅣA族,它的基态原子的电子组态为[Ar]3d104s24p2;Ag位于第五周期ⅠB族,它的基态原子的电子组态为[Kr] 4d105s1;Rb位于第五周期ⅠA族,它的基态原子的电子组态为[Kr] 5s1;Ne位于第二周期0族,它的基态原子的电子组态为[He] 2s22p6。
无机化学第四版(北京师范大学大学等)答案——下册

(a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF7、 解: 4XeF 平面四边形 2XeF 直线形3XeO 三角锥 XeO 直线形13-8用 VSEPR 理论判断XeF 2 、XeF 4、XeF 6、XeOF 4及ClF 3的空间构型。
8、解: 2XeF 直线形 4XeF 平面四边形 6XeF 八面体 4XeOF 四方锥 4ClF 三角锥13-9用化学方程式表达下列化合物的合成方法(包括反应条件): (a) XeF 2 (b) XeF 6 (c) XeO 39、解: )()()(21.0,4002g XeF g F g Xe MPaC −−−−→−+︒ )()(3)(66,3002g XeF g F g Xe MPa C −−−−→−+︒ HF XeO O H XeF 63326+=+13-10 完成下列反应方程式: (1) XeF 2 + H 2O → (2) XeF 4 + H 2O → (3) XeF 6 + H 2O → (4) XeF 2 + H 2 → (5) XeF 4 + Hg → (6) XeF 4 + Xe → 10、解:2424224263262324222222226312232632212XeF Xe XeF HgF Xe XeF Hg HF Xe H XeF HF XeOF O H XeF HF XeO O H XeF HFO Xe XeO O H XeF OH F O Xe OH XeF =++=++=++=++=++++=++++=+--14-5 三氟化氮NF 3(沸点-129℃)不显Lewis 碱性,而相对分子质量较低的化合物NH 3 (沸点-33℃)却是个人所共知的Lewis 碱。
(a )说明它们挥发性差别如此之大的原因;(b )说明它们碱性不同的原因。
5、解:(1)NH 3有较高的沸点,是因为它分子间存在氢键。
(2)NF 3分子中,F 原子半径较大,由于空间位阻作用,使它很难再配合Lewis 酸。
北师大无机化学四版习题答案19章d区金属一

北师大无机化学四版习题答案19章d区金属一第19章 d区金属(一)第四周期d区金属19.1 试以原子结构理论说明:(1)第四周期过渡金属元素在性质上的基本共同点;(2)讨论第一过渡系元素的金属性、氧化态、氧化还原稳定性以及酸碱稳定性变化规律;(3)阐述第一过渡系金属水合离子颜色及含氧酸根颜色产生的原因。
答:(1)①第四周期过渡金属元素都具有未充满的3d轨道,特征电子构型为(n-1)d1~10ns1~2,具有可变的氧化态。
电离能和电负性都比较小,易失去电子呈金属性,故具有较强的还原性。
②与同周围主族元素的金属相比,第一过渡系金属原子一般具有较小的原子半径和较大的密度。
③由于过渡金属的d电子和s电子均可作为价电子参与金属键的形成,金属键较强,因此它们有较大的硬度,有较高的熔、沸点。
(2)第一过渡系元素为Sc 、Ti 、V 、Cr、Mn 、Fe、Co、Ni、Cu、Zn从Sc→Zn,金属性:逐渐减弱;最高氧化态:先逐渐升高,到锰为最高,再逐渐降低;氧化还原性:金属的还原性逐渐减弱,最高氧化态含氧酸(盐)的氧化性逐渐增强;酸碱稳定性:从钪到锰最高氧化态氧化物及其水合物酸性增强、碱性减弱,同一元素不同氧化态氧化物及水合物一般是低氧化态的呈碱性,最高氧化态的呈酸性。
(3)①由于过渡金属离子具有未成对d电子,易吸收可见光而发生d-d跃迁,故过渡系金属水合离子常具有颜色。
②第一过渡系金属含氧酸根离子VO3-、CrO42-、MnO4-,呈现颜色是因为化合物吸收可见光后电子从一个原子转移到另一个原子而产生了荷移跃迁,即电子从主要是定域在配体上的轨道跃迁到主要是定域在金属上的轨道(M←L),对于含氧酸根离子则是发生O22-→Mn+的荷移跃迁。
19.2 Sc2O3在哪些性质上与Al2O3相似,为什么?答:(1)都为碱性氧化物。
在Sc3+、Al3+溶液中加碱得水合氧化物M2O3・nH2O(M=Sc、Al)。
(2)其水合氧化物都是两性的,溶于浓碱NaOH得Na3[M(OH)6],溶于酸得到M3+盐,其水溶液易水解。
北师大无机化学习题解答]_《无机化学》(第四版,吴国庆,高等教育出版社)习题答案
![北师大无机化学习题解答]_《无机化学》(第四版,吴国庆,高等教育出版社)习题答案](https://img.taocdn.com/s3/m/7c4cbdf00b4c2e3f5627631c.png)
第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
无机化学_第四版_北师大版_课后答案(补充:1-11章)_khdaw

第一章原子结构与元素周期系1-14Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
答:∵E=190kJ/mol∴每个分子解离所需要的能量为190×10-3/6.02×1023=3.156×10-19(J)所需吸收光子能量为E=hν=3.156×10-19J∴λ=c/ν=c·h/E=3×108×6.63×10-34/3.156×10-19=6.3×10-7(m)=630(nm)ν=4.76×10141-19氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?答:氢原子莱曼系的跃迁吸收光子的波数公式为ǔ=1/λ=R H·(1/12-1/n2)已知波长λ=103nm=1.03×10-7m∴1/1.03×10-7=R H·(1/12-1/n2),R H=1.09677×10-7∴n=2.95≈3∴相应于氢原子电子从n=1的轨道向n=3的轨道跃迁的过程,即从K 层→M层轨道的跃迁1-21当电子的速度达到光速的20.0%时,该电子的德布罗意波长多大?当锂原子(质量7.02amu)以相同速度飞行时,其德布罗意波长多大?答:对电子,λ=h/mv=6.63×10-34×(9.11×10-31×3×108×20%)-1=1.21×10-11m=12.1(pm)对锂原子,其m=7.02×1.660×10-24×10-3=1.165×10-26(kg)∴λ=h/mv=6.63×10-34×(1.165×10-26×3×108×20%)-1=9.48×10-16m=9.48×10-4(pm)1-23处于K、L、M层的电子最大可能数目各为多少?答:处于K层,即n=1,而每个能层能容纳的最大电子数目为2n2∴第K层:2×12=2(个)第L层:2×22=8(个)第M层:2×32=18(个)1-24以下哪些符号是错误的?(a)6s(b)1p(c)4d(d)2d(e)3p(f)3f答:(a)6s对;(b)1p错(因为n=1,则l只能是0,即s);(c)4d对;(d)2d错(因为n=2,则l可能是0,1,即s,p轨道);(e)3p对;(f)3f错(因为n=3,则l可能是0,1,3即s,p,d轨道)。
《无机化学》(北师大等校第四版)答案

由斥力顺序可知,∠l-O-O>∠O-O-O即∠O-O-O<109o28’ ∠l-O-O>109o28’,但∠O-O-O>90o,因为∠O-O-O<90o时,斥力变大不利于分子的稳定,故O3-的键角应为100o,属于以上范围,很符合VSEPR模型。
1-47.解:氟的电负性最大。铯的电负性最小
1-50 答:ⅣB族,铜,银,金和稀有气体。
1-52答:从上到下,同族元素氧化态稳定性增强,但第五周期非金属的氧化态很不稳定,第六周期的汞,铊,铅,铋的最稳定氧化态不是族序数,而是0,+1,+2,+3,第Ⅷ族从左到右最高氧化态的稳定性下降,从上到下最高正氧化态稳定性增强。
(4)XeF2:由VSEPR模型知,XeF2分子属于AY5型分子,AY5的空间构型为三角双锥体,为保证两个Xe不能垂直。略去电子后,XeF2分子应为角形分子,但夹角一定不为90o,其夹角为120o>∠Xe-F-Xe>90o范围内。
(5)SF6:由VSEPR模型知,SF6属AY6型分子,空间构型为正八面体,即其键角为90o。
第二章分子结构
2-1解:O2:.. .. H2O2: .. ..
: O=O: H—O—O—H
共12e共14e
CO: .. CO2: .. ..
:C=O: :O=C=O:
共10e共16e
NCl3.. SF4
F
Cl|
F—S—F
N ..|
FCl Cl共3来自e共26e2-3答:LiH: Li的电子排布:1s22s1H的电子排布:1s1
当λ=320nm时,则此时光的能量E=5.64×10-19>E最低,所以会解离
北京师范大学、华中师范大学、南京师范大学无机化学教研室《无机化学》章节题库-d区金属(一) 第四周期

圣才电子书 十万种考研考证电子书、题库视频学习平台
27.用氢氧化钠熔融法分解某矿物时,应选用的坩埚为( )。 A.铂坩埚 B.瓷坩埚 C.石英坩埚 D.镍坩埚 【答案】D
28.下列水合物中,加热脱水而不水解的是( )。
【答案】B
29.下列描述
和
A.顺磁、顺磁
D.
在中性溶液中发生歧化
【答案】C
7.下列化合物的颜色,由吸收可见光发生 d-d 跃迁所产生的是( )。
【答案】C
8.要洗净长期盛放过高锰酸钾试液的试剂瓶,应选用( )。 A.浓硫酸 B.硝酸 C.稀盐酸
2 / 82
圣才电子书
D.浓盐酸
十万种考研考证电子书、题库视频学习平台
【答案】B 12.下列化合物的颜色是电荷跃迁引起的是( )。
【答案】D
3 / 82
圣才电子书 十万种考研考证电子书、题库视频学习平台
13.下列反应中,哪一个反应会发生( )。
(D)以上反应都会发生 【答案】D
14.
中的 Cr 原子采取的杂化轨道类型为( )。
【答案】B
3.钛与热浓盐酸反应,产物之一为( )。 A.Ti(Ⅰ) B.Ti(Ⅱ) C.Ti(Ⅲ) D.Ti(Ⅳ) 【答案】C
4.氯化铬酰 A.明矾 B.绿矾 C.溴 D.铜氨溶液
外观似( )。
1 / 82
圣才电子书
【答案】C
十万种考研考证电子书、题库视频学习平台
5.分离溶液中的
【答案】A 23.维生素 的中心金属离子是( )。 A.Fe(Ⅱ) B.Fe(Ⅲ) C.Co(Ⅱ) D.Co(Ⅲ) 【答案】D 24.下列金属离子中,与过量氨水形成配合物的希望最小的是( )。 【答案】B 25.下列物种中,具有顺磁性的是( )。 【答案】B 26.不能氧化浓盐酸的物质是( )。 【答案】C
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第20章 d 区金属(二)第五、六周期d 区金属20.1 简述第五、第六周期d 区金属与第四周期d 区金属的主要差别。
答:①由于(n -1)d 和ns 能级交错的情况更多一些,所以第二、三过渡元素中就出现了多个具有特殊电子构型的元素。
②第三电离能或更高级的电离能与第一电离能或第二电离能之差,则是第一过渡系元素远比第二、三过渡元素的大。
③第五、六周期d 区金属元素为d 区重过渡元素,第四周期d 区金属中Sc 、Ti 属轻金属。
④第二、三过渡系列元素的高氧化态稳定,低氧化态化合物不常见,而第一过渡系元素的低氧化态稳定。
⑤第二、三过渡元素配合物的配位数较高,形成金属—金属键的元素较多。
⑥第一过渡系元素既可形成高自旋,也可形成低自旋八面体配合物,而第二、三过渡系金属离子一般只形成低自旋化合物。
⑦第二、三过渡系元素磁性要考虑自旋—轨道耦合作用,化合物的磁矩只能按)1()1(+++∆=L L S S eff μ,而第一过渡系元素化合物的磁矩基本符合自旋关系式)2(+=n n eff μ。
20.2 为什么锆、铪及其化合物的物理、化学性质非常相似,如何分离锆和铪?答:因为锆、铪的外层电子构型相同(n-1)d 2ns 2,原子半径相等,所以锆、铪及其化合物的物理、化学性质非常相似。
分离锆、铪主要采取离子交换或溶剂萃取法。
① 离子交换法是利用强碱型酚醛树脂R-N(CH 3)3+Cl -阴离子交换剂,使Zr 和Hf 形成的 ZrF 62-、HfF 62-离子与阴离子树脂进行吸附交换,由于锆、铪配离子与阴离子树脂结合能力不同,所以可以用HF 和HCl 混合液为淋洗剂,使这两种阴离子先后被淋洗下来。
②Zr-Hf 的溶剂萃取法就是利用Zr 、Hf 的硝酸溶液与有机相磷酸三丁酯(TBP )或三锌胺(TDA )的甲基异丁基酮溶液混合振荡萃取的过程,由于锆的配位能力比铪强,比较容易进入有机溶剂相中,因而达到分离效果。
20.3 举出铌、钽化合物性质的主要差别以及分离铌和钽的方法?解:铌、钽化合物性质的主要差别:①Nb 2O 5和Ta 2O 5与过量的碱金属氢氧化物或碳酸盐共熔,然后溶于水时,生成同多酸根阴离子的溶液,当pH <7时,Nb 产生水合氧化物沉淀,当pH <10时,Ta 产生水合氧化物沉淀。
②Nb 2O 5和Ta 2O 5溶于HF 和KF 的溶液中,生成的K 2TaF 7是难溶的,而K 2NbOF 5·H 2O 是可溶的。
③NbF 5在弱酸溶液中的水解产物依赖于HF 的量和浓度,可生成M 2NbF 7或M 2NbOF 5;而TaF 5的水解产物是M 2TaF 7。
分离铌和钽,目前常用溶剂萃取法:例如:钽的化合物可被甲基异丁酮从稀的HF 溶液中萃取出来,增加水溶液相的酸度,可使铌的化合物被萃取到新的一批有机物相中去,以此达到分离目的。
20.4 锌汞齐能将钒酸盐中的钒(Ⅴ)还原至钒(Ⅱ),将铌酸盐的铌(Ⅴ)还原至铌(Ⅳ),但不能使钽酸盐还原,此实验结果说明了什么规律性?答:此实验结果说明过渡元素同一族从上到下特征氧化态升高,高价态趋于稳定,20.5 试以钼和钨为例说明什么叫同多酸?何谓杂多酸?举例说明。
答:同多酸:两个或两个以上相同的酸酐和若干水分子组成的酸。
杂多酸:不同的酸酐和若干水分子组成的酸。
例:杂多酸H4[BW12O40] H4[AsMo12O40] H4[SiMo12O40] H3[PMo12O40] 同多酸H2Mo3O10H6W6O21H10W12O4120.6 选择最合适的方法实现下列反应:(1)溶解金属钽;(2)制备氯化铼;(3)溶解WO3。
答:(1)溶解金属钽:将金属钽加入硝酸和氢氟酸的混合液中。
(2)制备氯化铼:铼与氯气直接加热2Re + 5Cl22ReCl5(3)溶解WO3:将WO3加入碱的水溶液中WO3 + 2NaOH Na2WO4 + H2O20.7 选择最合适的制备路线和实验条件制备下列物质:(1)以锆矿石为原料制备金属锆;(2)以铌铁矿为原料制备金属铌;(3)以辉钼矿为原料制备金属钼;(4)以黑钨矿为原料制备金属钨。
解:(1)(2)(3)(4)以黑钨矿为原料制备金属钨。
20.8 依据铂的化学性质指出铂制器皿中是否能进行有下述各试剂参与的化学反应:(1)HF (2)王水(3)HCl + H2O2(4)NaOH + Na2O2(5)Na2CO3(6)NaHSO4(7)Na2CO3 + S (8)SiO2解:(1)HF (√)(2)王水(×)(3)HCl + H2O2 (×)(4)NaOH + Na2O2(×)(5)Na2CO3(√)(6)NaHSO4 (√)(7)Na2CO3 + S (×)(8)SiO2 (×)钯、铂在有氧化剂存在时与碱一起熔融,都会变成可溶性化合物。
20.9 完成有关铂系金属分离图中各步反应方程式。
Pt: 3Pt + 4HNO 3 + 18HCl 3H 2PtCl 6 + 4NO ↑+ 8H 2OAu + 4HCl + HNO 3 HAuCl 4 + NO ↑+2H 2O Pd + 4HCl + 2HNO 3 H 2[PdCl 4] + 2NO 2↑+ 2H 2OHAuCl 4 + 3FeCl 2 3FeCl 3 + Au ↓+ HCl HPtCl 6 + 2NH 4Cl (NH 4)2[PtCl 6]↓ + 2HCl(NH 4)2[PtCl 6] 2Cl 2↑+ 2NH 3↑+ 2HCl ↑+ Pt3Pt + 4HNO 3 + 12HCl + 6NaCl 3Na 2PtCl 6 + 4NO ↑+ 8H 2ONa 2PtCl 6 + 2NH 4Cl (NH 4)2[PtCl 6]↓+ 2NaCl(NH 4)2[PtCl 6] 2Cl 2↑+ 2NH 3↑+ 2HCl + PtPd: H 2PdCl 4 + 2NH 3·H 2O [Pd(NH 3)2Cl 2] + 2HCl + 2H 2O[Pd(NH 3)2Cl 2] Pd + 2NH 3↑+2Cl 2↑Ir: IrO 2 + 4HCl + 2NH 4Cl (NH 4)2[IrCl 6] + 2H 2O(NH 4)2[IrCl 6] + 2H 2 Ir + 2NH 4Cl + 4HClRu: Ru + 3Na 2O 2 Na 2RuO 4 + 2Na 2O[RuO 4]2- + Cl 2 RuO 4 + 2Cl -2RuO 4 + 22HCl 2H 3RuCl 6 + 5Cl 2↑+8H 2OH 3RuCl 6 + 3NH 4Cl (NH 4)3[RuCl 6]+3HCl2(NH 4)3[RuCl 6] + 3H 2 2Ru + 6NH 4Cl + 6HClO s :O s + 8Na 2O 2 + 8H 2O Na 2[O s O 4(OH)2] + 14NaOH+2O 2↑O s O 4 + 4NaOH Na 2[O s O 2(OH)4] + Na 2O 2[O s O 2(OH)4]2-+4NH 4Cl O s O 2(NH 3)4Cl 2 + 4H 2O + 2Cl -O s O 2(NH 3)4Cl 2 + 3H 2 O s + 2NH 4Cl + 2NH 3 + 2H 2ORh: 2Rh + 3NaHSO 4+23O 2 Rh 2(SO 4)3 + 3NaOHRh 2(SO 4)3 + 6NaOH 2Rh(OH)3↓+3Na 2SO 4Rh(OH)3 + 6HCl 3[RhCl 6] + 3H 2OH 3[RhCl 6] + 6NaNO 2 + 3NH 4Cl (NH 4)3[Rh(NO 2)6] + 6NaCl + 3HCl(NH 4)3[Rh(NO 2)6] + 6HCl (NH 4)3[RhCl 6] + 6HNO 22(NH 4)3[RhCl 6] + 3H 2 2Rh + 6NH 4Cl + 6HCl20.10 完成并配平下列反应:(1)ZrCl 4 + 9H 2O2·8H 2O + 2HCl(2)(NH 4)2[ZrF 6] ZrF 4 + 2NH 3↑+2HF(3)Nb 2O 5 + 2NaOH2NaNbO 3 + H 2O(4)MoO 3 + 2NH 3·H 2O (NH4)2MoO 4 + H 2O(5)(NH 4)2MoO 4 + 3H2S +2HCl MoS 3↓+2NH 4Cl + 4H 2O(6)2RuO 4 + 16HCl2RuCl 3 + 8H 2O + 5Cl 2↑(7)3Pt + 4HNO 3 + 18HCl 3H 2PtCl 6 + 4NO ↑+ 8H 2O(8)(NH 4)2PtCl 6 Pt + 2Cl 2↑+ 2NH 4Cl(9)K 2PtCl 6 + K 2C 2O 4 K 2PtCl 4 + 2KCl + 2CO 2(10)PdCl 2 + 2KOH Pd O ∙ H 2O + 2KCl灼烧灼烧灼烧熔融点燃燃烧共熔点燃 ∆ 共溶 ∆20.11 比较铂系元素与铁系元素的异同?答:同:熔点都比较高;氧化态变化相似,和副族一样,不再呈现与族数相对应的最高氧化态;能形成各种类型配合物。
异:铁系元素丰度大而铂系元素为稀有元素;铂系气态原子电子构型特例多,而铁系则不是;铂系金属吸收气体的能力大;铂系金属的化学稳定性很高,铁系是中等活泼金属;铁系元素常用来制造金属材料,铂系金属主要用作催化剂。
20.12 完成下列变化,写出反应方程式:(1)Nb 2O 5−→−NbCl 5−→−NbOCl 3−→−Na 2NbOCl 5; Nb 2O 5 + 5CCl 4 隔绝空气C 270︒ 2NbCl 5 + 5COCl 22NbCl 5 + O 2 2NbOCl 3 + 2Cl 2 NbOCl 3 + 2NaCl Na 2NbOCl 5(2)MoO 3−→−MoO 42-−→−MoCl 3 MoO 3 + 2NH 3·H 2O (NH 4)2MoO 4 + H 2O2MoO 42- + 3Zn + 16H + + 6Cl - 2MoCl 3 + 3Zn 2+ + 8H 2O(3)Pt −→−PtF 6−→−Xe[PtF 6] Pt + 3F 2 Pt F 6PtF 6 + Xe XePtF 6(4)Rh −→−RhCl 3−→−RhI 3 2Rh + 3Cl 2 2RhCl 3RhCl 3 + 3KI RhI 3↓+3KCl(5)Pt −→−H 2PtCl 6−→−(NH 4)2PtCl 6−→−Pt 3Pt + 4HNO 3 + 18HCl 3H 2PtCl 6 + 4NO ↑+ 8H 2OH 2PtCl 6 + 2NH 4Cl (NH 4)2PtCl 6 + 2HCl (NH 4)2PtCl 6 Pt + 2Cl 2↑+ 2NH 4Cl20.13 指出下列化合物的结构:(1)[Nb 6O 19]8- (2)ZrO 2 (3)[Mo 7O 24]6-答:(1)[Nb 6O 19]8-由6个NbO 6八面体聚集起来的八面体结构,中心的氧原子为全体6个八面体共用,在每个NbO 6八面体的6个氧原子中,有4个氧原子分别与4个NbO 6共顶点,第五个氧原子与5个NbO 6共用一个顶点,第六个氧原子本身属于这个NbO 6八面体,所以[Nb 6O 19]8-中M 与O 的组成为:Nb ∶O = 1∶[1+(1×151+)+(4×21)]=1×613=6∶9 (2)在ZrO 2 中,Zr 的配位数为7,Zr 位于立方体的中心,有4个氧位于立方体的底面的4个顶点,另3个氧位于顶面的1个顶点和另2个棱中。
