物理化学第八章表面教学内容
物理化学第8章 表面物理化学

如果要制造防水材料,就要在表面涂憎水的 表面活性剂,使接触角大于90°。
2.增溶作用
定义:非极性有机物如苯在水中溶解度很小, 加入油酸钠等表面活性剂后,苯在水中的溶解度 大大增加,这称为增溶作用。
增溶作用与普通的溶解概念是不同的,增溶 的苯不是均匀分散在水中,而是分散在油酸根分 子形成的胶束中。
2、公式 (1)形式: ⊿p=2ϭ/r
(2)结论: ①凸液面: r >0,则 ⊿p > 0。
液滴越小,附加压力越大
②凹液面 : r< 0,⊿p<0。
③水平液面:r为无穷大, ⊿p= 0。
④对于液泡(如肥皂泡):
⊿p =
4ϭ r
因为肥皂泡有两个气液界面,且两个球形界面的
半径几乎相等,方向均指向液泡中心。
①液体能润湿毛细管(如水能润湿玻璃): 呈凹形曲面,且液面上升一定高度。
p'
p ''
p0
M H2O
N Hg
r g h =⊿ p = 2 ϭ
r
曲率半径 r与毛细管半径R的关系:
R´ = R
cosq
联立以上二式,可得:
2ϭcosq
h=
r gR
②液体不能能润湿毛细管(如汞不能润湿玻璃): 呈凹形曲面,且液面下降一定高度。
可见光的波长约在400~750 nm之间。
二、溶胶的力学性质
主要指: Brown 运动
扩散
沉降和沉降平衡
1、Brown运动(Brownian motion)
通过超显微镜,可以看到胶体粒子不断地 作不规则的“之”字形运动,这就叫布朗运 动。
产生原因:分散介质分子以不同大小和方向 的力对胶体粒子不断撞击而产生的。
物理化学课件:第八章 表面现象

第一节 表面积与表面Gibbs能
比表面(specific surface area)
比表面:指单位质量(或单位体积)的物质所具有的表面积 有两种常用的表示方法:
as
A; m
aV
A V
式中,m 和 V 分别为物质的质量和体积,As为其表面 积。本章的研究对象即是具有巨大比表面积的系统。
液例滴8-1为:球分形割,半试径计为算r的分液割滴后,的使液成滴为总半表径面积r1 A11和r0 原的液小滴液表滴面,积若 A之比。
Tricor (非诺贝特 )
Triglide (非诺贝特 )
降血脂,纳米晶2004.12 NanoCrystal
FDA批准
technology
(Elan/Abbot)
降血脂,纳米晶
NanoCrystal technology
达到nm级的超细微粒,具有巨大的比表面积,因而具有许 多独特的表面效应。
界面现象的本质
克服附加压力Δp所作 的功等于可逆增加表面积 的Gibbs能
ΔG = ΔpdV = dAຫໍສະໝຸດ ΔppgR'
ΔpdV = dA
R ' r dr
V 4 r3,
3
A 4r 2 ,
所以 dV 4r 2dr 所以 dA 8rdr
代入得: p 2
r
球形曲面
Δp
pg
R'
dr
附加压力的大小与曲率半径和液体的表面张力有关
(3)凹液面的曲率半径为负值,因此附加压力也是负值, 凹液面下的液体受到的压力比平液面下的液体受到的压力小。
什么时候考虑Δp? – 依据粒子尺度
室温下小水滴:r=1mm, Δp=200 Pa
r=10nm, Δp=145 atm 当颗粒半径可以用mm描述时,可忽略Δp; 当颗粒半径小至纳米级时,由于Δp巨大,颗粒许多性 质发生改变,与普通液体和固体不同,需考虑Δp 。
物理化学:第08章_电解质溶液
anion anode
返回
2020/11/12
1.电解质溶液的导电机理
在电解池中
阳极上发生氧化作用
-
- 电源 +
e-
+
e-
2Cl aq Cl2(g) 2e
阴
阳
阴极上发生还原作用
极
极
CuCl2
Cu2 aq 2e Cu(s)
电解池
上一内容 下一内容
回主目录
例题
解: 1 Au3+ e = 1 Au
3
3
OH
1 4
O2
1 2
H2O e
(1) Q zF 196500197.01.g20mgol-1 /3 Cmol1
= 1763 C
(2)
t
Q I
1763 C 0.025 A
7.05104
s
(3)
m(O2)
1 4
M
(O2)
=197.01g.20mgol1
返回
2020/11/12
1.电解质溶液的导电机理
在原电池中
阳离子移向阴极
负
负载电阻
正
极
e-
Zn
极
Cu e-
e-
阳 Zn2+ Cu2+ 阴
极 SO24-
SO24- 极
ZnSO4溶液 CuSO4溶液
在阴极上发生还原的是
Cu2 aq 2e Cu(s)
阴离子迁向阳极 在阳极上发生氧化的是
Danill电池
上一内容 下一内容 回主目录
返回
2020/11/12
2. 法拉第定律
人们把在数值上等于1 mol元电荷的电荷量称 为Faraday常数,用F表示。
物理化学第八章表面

物理化学第八章表面一、表面化学的概念表面化学是研究发生在固体表面或液体表面的化学现象的科学。
在处理和制备材料、开发新工艺、研究反应机理以及在工业生产和实验室研究中,常常涉及到表面化学问题。
二、表面张力表面张力是液体表面分子之间的相互吸引力,是液体内部分子之间的相互排斥力。
其大小可以用表面张力系数γ表示。
三、弯曲液面的附加压力由于液面是弯曲的,所以液体在表面层内不仅要承受重力等一般压力,还要承受由于液面弯曲而产生的附加压力。
表面层内任一点上总压力与一般压力之差即为附加压力。
四、润湿现象润湿是指液体与固体接触时,液体会延固体表面铺展开来,这种现象叫做润湿现象。
润湿现象的产生与液体和固体的种类及它们之间的相互作用有关。
不同液体在不同固体表面上发生不同的润湿现象。
五、接触角和粘附功接触角是指液体在固体表面上附着时形成的液体-气体-固体三相交界处的切角。
接触角的大小反映了液体对固体表面的润湿程度。
粘附功是指液体润湿固体表面时,由润湿而在界面上产生的附加压力,其大小可用下式表示:W=2γcosθ(1-cosθ)其中γ为表面张力系数,θ为接触角。
六、降低表面张力的方法1、添加表面活性剂:表面活性剂可以显著地降低溶液的表面张力,并具有很好的润湿和乳化能力。
2、温度升高:温度升高可以增加分子的热运动,从而降低表面张力。
3、改变固体表面的性质:通过改变固体表面的性质(如通过化学吸附或物理吸附),可以降低表面张力。
七、应用表面化学的方法制备微纳米材料通过使用表面化学的方法,可以在固体表面上制备出各种微纳米材料。
例如,通过使用表面活性剂可以制备出纳米颗粒和纳米膜等材料。
通过使用分子束外延等方法可以在固体表面上制备出单层或多层原子膜。
这些技术在材料科学、电子学和生物学等领域中有着广泛的应用。
物理化学第十三章表面物理化学物理化学是化学的一个重要分支,它涉及到分子间的相互作用、物质的结构和性质以及它们之间的转化。
在物理化学的学习中,第十三章的内容是表面物理化学,它主要研究的是液体和气体界面上的分子相互作用和物理现象。
物理化学第八章表面现象

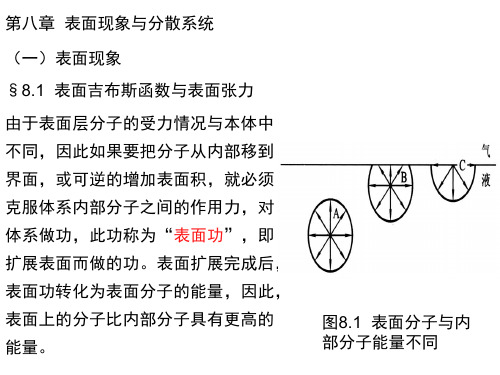
见右图,液体内部分子受到的 力彼此抵销,但表面分子受到指 向液体内部的力,所以表面分子 有进入液体内部的倾向。 这种作用力使表面有自动收缩到最小的趋势,并使 表面层显示出一些独特性质,如表面张力、表面吸附、 毛细现象、过饱和状态等。
二、表面吉布斯函数与表面张力
二、毛细管现象
将毛细管插入液体中,如果液体润湿管壁,则液 面成凹液面,液体将在管内升高;如果液体不润湿 管壁,液面成凸液面,液体将在管内下降。这种现 象称为毛细(管)现象。
h
h
二、毛细管现象
毛细管中液面上升高度可 用下式求算:
2 gh p r
2 cos h gR
θ称为接触角。
2、在凸面上 显然表面张力的合力指向球心, 内部分子所受压力大于表面分子。 ΔP = Pin - Pex >0 3、在凹面上 表面张力的合力仍然指向球心, 但内部分子所受压力小于表面分 子。 ΔP = Pin - Pex <0 ΔP ΔP
一、弯曲表面下的附加压力
1805年Young-Laplace导出了附加压力与曲率半径 之间的关系式:杨-拉普拉斯公式
pex
h
2 2 1.250 7 5 10 (pa) 8 r 5 10
d
压力如此之大,气泡难以存在,但炉壁为多孔砖, 已有半径较大气泡存在,实际附加压力并不很大。
二、毛细管现象
润湿和不润湿: 若液体能够在固体表面铺展,则称该液体对该固体 能够润湿(后面还要讲到)。
润湿
不润湿
一、微小液滴的蒸汽压与人工降雨 二、纯液体的凝固点和过冷现象 三、微小晶粒的溶解度与过饱和溶液 四、过热液体与爆沸现象 五、亚稳状态与金属热处理
(推荐)《物理化学课件》PPT课件

p 1 C1 p
V p*p VmC VmC p*
V—T、p下质量为m的吸附剂吸附达平衡时吸附气体的体积; Vm—T、p下质量为m的吸附剂盖满一层时吸附气体的体积; p*—被吸附气体在温度T时成为液体的饱和蒸气压; C—与吸附第一层气体的吸附热及该气体的液化热有关的常数。
BET公式的重要应用是测定和计算固体吸附剂的比表面积。
lnn1 n2
L RV T(0)(h2h1)g
式中,n1和n2分别是高度为h1和h2处粒子的浓度,ρ和ρ0 分别是分散相和分散介质的密度,V是单个粒子的体积, g是重力加速度。
41
如果分散粒子比较大,布朗运动不足以克服沉降作用时, 粒子就会以一定速度沉降到容器的底部。
f1 43r3(0)g
半径为r,速率为u的球体在粘度系数为η的介质中运动时所 受阻力为
(1)电动现象
在外电场作用下,分散相与分散介质发生相对移动的现象, 称为溶胶的电动现象。
电泳:在电场作用下,固体的分散相粒子在液体介质中作 定向移动。
电渗:在电场作用下,固体的分散相粒子不动,而液体介
质发生定向移动。
43
44
(2)溶胶粒子带电的原因 1.吸附 如果溶液中有少量电解质,那么溶胶粒子就会吸附离子。
K b*
RT
此式表明,吸附量为一恒定值,不再随浓度而变化,吸附 已经达到饱和状态。
1 A
L
31
(4)表面膜 溶液表面正吸附现象不只可以在气-液界面上发生,它可以 在任意两相界面,如气-固、液-液、液-固界面上均可以发 生上述表面活性剂分子的相对浓集和定向排列,其亲水的 极性基朝向极性较大的一相,而憎水的非极性基朝向极性 较小的一相。利用这一特性,可以制备各种具有特殊功用 的表面膜。
表面物理化学

§8-1 表面Gibbs自由能和表面张力
一. 分散度和比表面 界面----- 相邻两相间的一个过渡区域,厚度为单分子层
或几个分子层。
按两相物理状态不同,两相界面可分为5种类型:
l-g、s-g、l-l、l-s、s-s界面,
对l-g界面,s-g界面,常称表面。
物质的表面积的大小与物质被分散的程度有关,物
② 液体沸腾时的过热----亚稳态 沸腾现象是液体从内部形成气泡、剧烈汽化的结 果。 气泡内的蒸气压Pr* 至少要达到外压 P0与气泡所
受附加压力的绝对值之和时,液体才会沸腾,即
P P P 0
* r
当液体中的气泡很小时,Pr* 很小,温度升至正常 的沸点时,Pr* 仍然小于( P0 + ︱△P︱) , 此时 , 液体不 沸腾 ; 当温度继续升高时 , Pr* 增大, 直至 Pr *= P0 + ︱△P︱, 液体才开始沸腾, 此时的温度超过
10103 V0 1.00105 (m3 ) 998.3 m
4 3 4 V r 3.14 (10 9 )3 4.19 10 27 (m3 ) 3 3
V0 1.00 105 N 2.39 1021 (个) V 4.19 10 27
Pr * ---- 弯曲液面上的蒸气压 (Pa)
r
M
---- 弯曲液面的曲率半径
---- 液体的摩尔质量 ---- 液体的密度 ---- 液体的表面张力
(m)
(kg · -1) mol ( kg ·m- 3 ) ( N · -1 ) m
P 2M 1 ln ( ) RT r P
* r * 0
正常的沸点, 液体产生过热现象。
物理化学简明教程第八章山东大学
非离子型
酯类、酰胺类、聚氧乙烯醚类
上一内容 下一内容 回主目录
返回
2020/11/16
§8.5 表面活性剂及其作用
• 2 胶束和临界胶束浓度 • 当浓度大到一定程度时,众多的表面活性剂分
子会结合成很大的集团,形成如图8.13所示的 球状、棒状或层状的“胶束”。
上一内容 下一内容 回主目录
返回
2020/11/16
返回
2020/11/16
§8.4 溶液的表面吸附
(1)浓度很小时,
kc
(2)浓度很大时,
吸附分子的截面积
A 1 ΓL
上一内容 下一内容 回主目录
返回
2020/11/16
§8.4 溶液的表面吸附
• 4 表面膜
• 根据表面活性剂分子的相对浓集和定向排列, 可以制备各种具有特殊功用的表面膜。
• 例如,将一种不溶于水的磷脂酸类化合物溶于 某种挥发性有机溶剂中,然后将该溶液滴在水 面上,任其铺展成很薄的一层。由于表面吸附 作用,磷脂酸类化合物会在两液相的界面上定 向排列,待有机溶剂挥发后,水面上就会留下 一层不溶性表面膜。
上一内容 下一内容 回主目录
返回
2020/11/16
3 BET多分子层吸附等温式
• 在朗格缪尔吸附理论的基础上,1938年勃劳纳
尔(Brunauer)、爱密特(Emmett)和泰勒
(Te11er)三人提出了多分子层的气固吸附理
论,导出了BET公式:
V
VmCp
(p*p)1[(C1)p/p*]
• V与Vm分别是气体分压为p时的吸附量与饱和吸 附量;p*是饱和蒸气压;C是与吸附热有关的
返回
2020/11/16
8.3 气体在固体表面上的吸附
大学物理化学课件 第八章 表面现象

Fdx (2l' dx)
F = •2l '
F 2l '
式中 为比例常数,是作用于液面上单位长度线段上的力,
即表面张力,单位是N·m-1。
表面吉布斯能和表面张力是完全等价的,具有等价的量 纲和相同的数值。
三、影响表面张力的因素
1. 组成表面的物质 物质内部的分子间引力引起表面吉布斯能,分子间作用力越大, 表面吉布斯能越大。
也就是单位表面积上的分子比 相同数量的内部分子“超额”吉布斯自由能,
因此σ称为“表面吉布斯自由能” 或简称为“表面能”
二、表面吉布斯能和表面张力 2. 表面张力 用肥皂液在一个系有线 圈的金属环上形成一个液膜, 由于线圈周围都是相同的液 体,受力均衡,线圈可以在 液膜上自由移动位置。
若将线圈内液膜刺破, 线圈两边受力不再平衡, 立即绷紧成圆形。
二、表面吉布斯能和表面张力
这些现象表明,在液体表面存在一种使液面 收缩的力,称表面张力(surface tension)或界面 张力(interfacial tension)。
表面张力的方向和表面相切, 是垂直作用在表面上单位长度线段上的表面收缩力。
二、表面吉布斯能和表面张力
在温度、压力恒定的条件下,在AB边施加向右的力F,使 AB在可逆的情况下向右移动dx。F和液膜表面边缘的长度l成 正比,因为液膜有正反两个表面,设AB = l′,则
表面功的大小和dA成正比
Байду номын сангаас
W = dA
为比例系数
根据热力学第二定律
d G T , p,nB δW 'r
所以:dGT ,P,nB dA 定义表面吉布斯能
G
A T , p,nB
第八章 表面、相界和晶界

22
(3)清洁表面 清洁表面是指不存在任何吸附、催化反应、杂质扩散等 物理化学效应的表面。这种清洁表面的化学组成与体内 相同,但周期结构可以不同于体内。根据表面原子的排 列,清洁表面又可分为:
13
(2)原因 液膜中不仅有凹面,还有凸面。设凹的曲率半径为
r1,凸面的半径为r2。对于非球面: Ρs=γ(1/r2-1/r1) r :主曲率半径。
当液膜非常薄时, r2»r1 ,或r2=∞, 即为两块相互平行的 平板间的液体液面
Ρ=-γ/r1 负号表示液内压力小,相当于两边给玻璃有正的γ/r1 的推力,这一推力使二块玻璃拉近拉紧。
于B/r3 , 故范得华力只表现出引力作用。
对不同物质,上述三种作用并非均等的。例如对 于非极性分子,定向作用和诱导作用很小,可以忽 略,主要是分散作用。
18
二、固体的表面结构 1.表面结构
(1)静态表面原子状态 1)表面:是指(固体)晶体的三维周期性结构开始破坏一直
到真空之间的整个过渡区域,其厚度一般为几个原子层。 2)静态表面原子状态:是指在0K时,表面原子静止地(无
开尔文公式的结论说明凸面蒸气压>平面>凹面 由于颗粒表面各处的曲率不同,按开尔文公式可
知,各处相应的蒸气压大小也不同。故质点容易从 高能阶的凸处(如表面)蒸发,然后通过气相传递 到低能阶的凹处(如颈部)凝结,使颗粒的接触面 增大,颗粒和空隙形状改变而使成型体变成具有一 定几何形状和性能的烧结体。这一过程也称蒸发冷凝。
多数情况下吸附是介于上述二者之间,即在固体吸附剂 和吸附物之间共有电子,并且经常是不对称的。
物理化学课件-第8章 表面现象与分散系统

分散系统
Байду номын сангаас
溶胶分类
光、力学性质
电性质
溶胶聚沉和絮凝
13
表面现象
表面张力
纯液体表面现象
气固吸附
溶液表面吸附
表面活性剂
Kelvin eq.
RT ln p Vm (l )P(l )
p
pr
pr 2 RT ln Vm (l ) p r
2M pr Vm (l )2 ln RTr p RTr
分散系统
溶胶分类 光、力学性质 电性质 溶胶聚沉和絮凝 16
表面现象
表面张力
纯液体表面现象
气固吸附
溶液表面吸附
表面活性剂
三、液体的润湿与铺展 wetting and spreading
(l-g)
(s-g) O
O
(s-l)
分散系统
溶胶分类
光、力学性质
电性质
溶胶聚沉和絮凝
17
表面现象
表面张力
:单位表面积上的分子比相同数量的内部分子超额 的吉布斯自由能。
分散系统
溶胶分类
光、力学性质
电性质
溶胶聚沉和絮凝
4
表面现象
表面张力
纯液体表面现象
气固吸附
溶液表面吸附
表面活性剂
二、表面张力
单位:Nm-1 物理意义:表面紧缩力。 定义:在相表面的切面上,垂直作用于表面任意 单位长度上的紧缩力。 例如:表面为一平面:肥皂水膜 表面为一曲面:
纯液体表面现象
气固吸附
溶液表面吸附
表面活性剂
§8.1 表面自由能与表面张力
Surface free energy and surface tension 单组分密闭系统: dG = -SdT + Vdp +wr’ 在等温等压条件下:
《物理化学》08 表面现象与分散系统PPT课件

WWWWWWWWWWWW 222222222222
17
§8.1 表面自由能与表面张力
如果在活动边框上挂一重物,使
重物质量W2与边框质量W1所产生的 重力F与总的表面张力大小相等方向
相反,则金属丝不再滑动。
F=(W1W2)g
= 2 l
FW 1W 22l
dGT,P = δW’ dGT,P = σdA δW’ = FdX FdX=σdA=σ(2 l)dX σ= F/ 2 l
(3)温度的影响
温度升高,表面张力下降。因为升高温 度时液体分子间引力减弱。
22
§8.1 表面吉布斯函数与表面张力
由上可知,由于表面分子与相内部分子性质 不同,严格说来完全均匀一致的相是不存在的。 通常情况下可以不考虑这一点,是因为一个物系 如果表面分子在所有分子中所占比例不大,系统 的表面能对系统总吉布斯函数值的影响很小,可 以忽略不计。
属线框架放在肥皂液中,然后取出悬
挂,活动边在下面。由于金属框上的
肥皂膜表面张力作用,可滑动的边会
被向上拉,直至顶部。
16
由于金属框上的肥皂膜的表面张力作用, 可滑动的边会被向上拉,直至顶部。
2222222222222222 llllllllllllllll
F=(W1W2)g
= 2 l 22222222222 lllllllllllW 1
13
§8.1 表面吉布斯函数与表面张力
由于表面层分子受力情况与本体中不同,因此如 要把分子从内部移到界面,或可逆地增加表面积,就 必须克服体系内部分子之间的作用力,对体系做功。
温度、压力和组成恒定时,可逆地使表面积增加 dA所需要对体系作的非膨胀功,称为表面功:
W' dA
第八章 表面现象与分散系统 物理化学教学课件
解:以 对c作图。
在c 1.5g / kg水处作切线, 求得曲线在该点的斜为率:
d (7050)103
dc
4.00.0
5.0103Nm1g1kg水
cd 1 .5 5 .0 1 3 0 3 .1 1 6 m 0m o 2 l Rd Tc 8 .3 1 24 .5 94
(b)归纳溶液表面张力与浓度的解析关系式,然后求微商。
图8.1 表面分子与内 部分子能量不同
p' pp即 pp'p
p'dVpdVpdV
pdVdA 即 pdA
dV
A4r2即dA8rdr V 4r3即dV4r2dr
3
p 8rdr 2 4r2dr r
(拉普拉斯公式 )
图 8.2 附加压力与曲 率半径的关系
空气中(的 凸液 液 ): 滴 面 p' pp 液体中(的 凹气 液 ): 泡 面 p' pp
(3) 吸附曲线
在a,T,P三个因素中固定其一而反映另外两者关系的曲线称为 吸附曲线。 (i)吸附等压线 吸附质平衡分压一定时,反映吸附温度与吸附量之间关系的曲线。 (ii)吸附等量线 吸附量一定时,反映吸附温度与吸附质平衡分压之间关系的曲线。
(lT np)a R a dH T s2m
例1 教材294页例1
( s g ) ( s l) ( l g ) co 0s
cos(sg()l g)(sl)
若接触角小于90°,液体能润湿固体,如水在洁净的玻璃表面。
若接触角大于90°,液体不能润湿固体,如汞在玻璃表面;
若θ=0°完全润湿;θ=180°完全不润湿
若(sg)(sl)(lg)0, 则液体在固体 展表 开面 (完 完全 全润 时湿 取 ) 0 ,
大学物理化学--第八章

返回
2020/8/23
1、弯曲液面附加压力-拉普拉斯方程
弯曲液面凹面一侧压力以p内表示,凸面一侧压力 以p外表示,弯曲液面内外压力差△p称为附加压力。
p p内 p外 pl pg 0 p p内 p外 pg pl 0
表面张力的存在是弯曲液面产生附加压力的根本 原因,附加压力是表面张力存在的必然结果。
上一内容 下一内容 回主目录
返回
2020/8/23
§8.1 界面张力
1.液体表面张力、比表面功、 比表面吉布斯函数
2.界面热力学方程 3.界面张力影响因素
上一内容 下一内容 回主目录
返回
2020/8/23
1、表面张力,比表面功与比表面吉布斯函数
液体表面分子受力情况分析:
液体内部:分子所受的力可以 彼此抵消,合力为零。故内部分子 可无规则运动而不消耗功。 液体表面:分子恒受指向液体 内部的拉力,处于不对称力场。故 表面分子趋向液体内部移动,宏观 表现为液体表面力图缩小到最小。
Va V m
(m 3 kg 1 )
体积要换算成标准状况(0 C ,101.325kPa)
上一内容 下一内容 回主目录
返回
2020/8/23
2、等温吸附
吸附量 f (T , p,吸附剂,吸附质) 吸附剂、吸附质定:V a f (T , p)
吸附等温线:()T:V a f ( p) V a — p线
第八章 界面现象
上一内容 下一内容 回主目录
返回
2020/8/23
基本概念
1.界面和界面现象 2.表面和比表面
上一内容 下一内容 回主目录
返回
2020/8/23
1、界面和界面现象
界面(Interface)
物理化学第八章1

2.界面 的类型
气—液 气—固 液—液 固—液 固—固
表面
严格讲表面应是液体和固体与其 饱和蒸气之间的界面,但习惯上 把液体或固体与空气的界面称为 液体或固体的表面。
界面现象的本质
表面层分子与内部分子相比所处的环境不同 体相内部分子所受四周邻近相同分子的作用力 是对称的,各个方向的力彼此抵销;
G ( )T , p , nB A
2 .物理意义
(1) 从能量的角度
G ( )T , p , nB A
保持温度、压力和组成不变,每增 加单位表面积时,体系Gibbs自由能 的增量。σ称为“比表面Gibbs自由 能” ,或简称表面自由能或表面能, 也可用γ表示,单位为J· m-2。
2
表面张力的实验观察2
如果在金属线框中间系 一线圈,一起浸入肥皂液中, 然后取出,上面形成一液膜。 由于以线圈为边界的两边表 面张力大小相等方向相反, 所以线圈成任意形状可在液 膜上移动。 如果刺破线圈中央的液膜, 线圈内侧张力消失,外侧表 面张力立即将线圈绷成一个 圆形。
表面张力的实验观察3
σVm2/3 =k(Tc-T)
(4) 压力的影响 表面张力一般随压力的增加而下降。 因为压力增加,气相密度增加,表 面分子受力不均匀性略有好转。另 外,若是气相中有别的物质,则压 力增加,促使表面吸附增加,气体 溶解度增加,也使表面张力下降。
§ 8.1
表面自由能与表面张力
一.表面功 二.表面自由能与表面张力 1.定义 2.物理意义 (1). 从能量的角度(表面自由能) (2). 从力的角度(表面张力) 3.影响因素(物质的本性、温度、共存相 和压力、分散度以及运动情况)
昆虫利用表面张力 可以漂浮在水面上
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八章 《表面现象与分散系统》一、选择题1.在一般情况下不考虑表面的存在对系统性质的影响是因为( )。
A. 表面状态复杂;B. 表面不重要;C. 表面分子数比内部分子少得多,表面效应不明显;D. 表面分子与内部分子状态一样。
2. 在一支水平放置的洁净的玻璃毛细管中有一可自由移动的水柱,今在水柱右端微微加热,则毛细管内的水柱将( )。
A. 向右移动;B. 向左移动;C. 不移动;D. 条件不足,无法判断。
3.等温等压条件下的润湿过程是:( )。
A. 表面吉布斯自由能降低的过程;B. 表面吉布斯自由能增加的过程;C. 表面吉布斯自由能不变的过程;D. 表面积缩小的过程。
4.若某液体在毛细管内呈凹液面,则该液体在该毛细管中将( )。
A. 沿毛细管上升;B. 沿毛细管下降;C. 不上升也不下降。
D. 条件不足,无法判断5.液体在能被它完全润湿的毛细管中上升的高度反比于( )。
A. 空气压力;B. 毛细管半径;C. 液体表面张力;D. 液体粘度。
6.当表面活性剂加入溶剂中后, 产生的效果是( )。
A. /0d dc σ< 正吸附;B. /0d dc σ> 正吸附;C. /0d dc σ< 负吸附; D . /0d dc σ> 负吸附。
7.在影响物质表面张力的因素中,下列说法哪个不对?( )。
A. 与压力有关;B. 与温度有关;C. 与共存相有关;D. 与表面积有关。
8. 空气中有一肥皂泡, 直径为2mm, 若其表面张力为0.06 N· m -1, 则泡内附加压力为( )。
A. 0.06×103 Pa ;B. 0.24×103 Pa ;C. 0.12 ×103 Pa ;D. 0.48×103 Pa 。
9.对于一理想的水平液面,下列各量中,何者为零?( )。
A. 表面张力;B. 表面能;C. 附加压力;D. 比表面能。
10.对于化学吸附的描述, 以下说法中不正确的是( )。
A. 吸附力为化学键力;B. 吸附一般有选择性;C.吸附为单层或多层;D.吸附速度较小。
11. 将12 mL 0.02 mol/L 的 NaCl 溶液和 100 mL 0.005 mol/L 的 AgNO 3溶液混合所制得的溶胶电泳时, 胶粒的移动方向是( )。
A. 不移动;B. 向正极;C. 向负极;D. 不能确定。
12. 液体A 和B 的表面张力分别为A σ和B σ,A 和B 不能互溶,它们间的界面张力为A B σ-,液体A 可在液体 B 上铺展的条件为( )。
A. A σ >B σ+A B σ-;B. B σ >A σ+A B σ-;C. A B σ- <A σ+B σ;D. B σ <A σ+A B σ-。
13.弯曲液面所产生的附加压力( )。
A. 一定等于0;B. 一定不等于0;C. 一定大于0;D. 一定小于0。
14.两亲分子作为表面活性剂是因为( )。
A. 在界面上产生负吸附;B. 能形成胶束;C. 在界面上定向排列降低了表面能;D. 使溶液的表面张力增大。
15.下列中不属于溶胶(憎液溶胶)的基本特性的是( )。
A. 高度分散性;B. 聚结不稳定性;C. 多相性;D. 动力稳定性。
16.高分子溶液的丁达尔效应比溶胶的丁达尔效应弱,其主要原因为A. 粒子体积小B. 分散相与分散介质折射率相近C. 粒子半径大于入射光的波长 D . 粒子浓度小17.下列不属于溶胶的动力性质的是( )。
A. 布朗运动;B. 扩散;C. 电泳;D. 沉降平衡。
18. 将2 滴 K 2[Fe (CN )4]水溶液滴入过量的CuCl 2水溶液中形成亚铁氰化铜正溶胶, 下列三种电解质聚沉值最大的是( )。
A. KBr ;B. K 2SO 4;C. K 4[Fe (CN)6]D. Na 3PO 419.以等体积的 0.008 mol·dm -3AgNO 3溶液和0.01 mol·dm -3 KI 溶液混合制得的AgI 溶胶,用电解质MgCl 2、NaCl 、MgSO 4、Na 2SO 4使其聚沉时,其聚沉能力的强弱顺序为:( )。
A. MgCl 2 > MgSO 4 > NaCl > Na 2SO 4B. MgSO 4 > MgCl 2 > NaCl > Na 2SO 4C. NaCl > Na 2SO 4> MgCl 2 > MgSO 4D. Na 2SO 4 >NaCl >MgCl 2 > MgSO 420.表面现象在自然界普遍存在,但有些自然现象与表面现象并不密切相关,例如( )。
A. 气体在固体上的吸附;B. 微小固体在溶剂中溶解;C. 微小液滴自动呈球形;D. 不同浓度的蔗糖水溶液混合。
21.同一体系,比表面吉布斯自由能和表面张力都用σ表示,它们 :A. 物理意义不同,数值相同B. 量纲和单位完全相同C. 物理意义相同,单位不同D. 前者是强度性质量,后者是容量性质量。
22、BET二常数公式的主要用途是:( )。
A.求吸附热;B.判断吸附类型;C.验证多分子层理论;D.求固体的比表面积。
23、用同一滴管分别滴下50cm 3的NaOH 水溶液,纯水、乙醇水溶液,各自的滴数从多到少次序为 。
A. 乙醇水溶液,纯水,NaOH 水溶液B. NaOH 水溶液,纯水,乙醇水溶液C. 纯水,乙醇水溶液,NaOH 水溶液D. 三者一样多24、用比色计和比浊计测定胶体溶液的浓度, 分别利用的光学性质是A. 透射光和折射光,B. 透射光和散射光,C. 透射光和反射光,D. 散射光和反射光25、多孔固体表面易吸附水蒸气,而不易吸附氧气、氮气,主要原因是( )A. 水蒸气分子量比O 2、N 2小B. 水蒸气的凝聚温度比O 2、N 2高C. 水蒸气在空气中含量比O 2、N 2要少D. 水蒸气分子的极性比O 2、N 2要大26、溶胶和高分子溶液:( )A.都是单相多组分系统;B.都是多相多组分系统;C. 大分子溶液是单相多组分系统,溶胶是多相多组分系统;D.大分子溶液是多相多组分系统,溶液是单相多组分系统。
27、某i 物质在溶液表面的吸附达到平衡时,则i 物质在表面的化学势μi (表)与溶液内部i 物质的化学势 μi (内) 的关系是:( )A.μi (表) > μi (内)B. μi (表) < μi (内)C. μi (表) = μi (内)D.难以确定。
28、反应 CaCO 3(s) = CaO(s)+CO 2(g) 在一定温度下达到平衡,不改变温度和CO 2 的分压力,也不改变CaO(s)颗粒的大小,只降低CaCO 3(s)颗粒的直径,增加分散度,平衡将( )A.向左移动;B.向右移动;C.不发生移动D.难以确定29、微小颗粒物质的熔'f T 点与同组成大块物质的熔f T 点的关系是:( )。
A.'f f T T >B. 'f T T =C. 'f f T T <;D.不能确定。
30、纯水的表面张力为σ1,某溶质的表面张力为σ2 ,且σ2>σ1,制成水溶液后,溶质的表面浓度为 c s ,本体浓度为 c ,则A. c s > cB. c s = cC. c s < cD. c s = 031、在等温等压下影响物质的表面吉布斯函数的因素:( )A.是表面积A ;B.是表面张力σ;C. 是表面积A 和表面张力σ ;D.没有确定的函数关系。
32、在等温等压下,水和汞的表面张力分别为σ(H 2O),σ (Hg),水-汞的表面张力为σ(H 2O-Hg),若将水中一个汞球经振荡使之分散,汞球的总表面积增加A ,则该系统的表面吉布斯函数变化 ∆G = ( )。
A. A ·σ(Hg);B. A ·σ(H 2O-Hg);C. A ·[σ(Hg) +σ(H 2O)];D. A ·[σ(Hg) -σ (H 2O)]二、填空题1.液滴越小,饱和蒸气压越 ,而液体中气泡越小,饱和蒸气压越 。
玻璃毛细管水面上的饱和蒸气压⎽⎽⎽⎽⎽⎽同温度下水平的水面上的饱和蒸气压。
2.吉布斯吸附等温式的形式是⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽,当 Γ >0时,表明是⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽吸附。
若固体不能被液体润湿,则相应的接触角θ⎽⎽⎽⎽⎽⎽900。
3. 表面活性剂之所以具有表面活性,是由于其具有⎽⎽⎽⎽⎽⎽⎽⎽⎽基团,极易在水的表面产生定向排列,因而明显降低水的⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。
衡量表面活性剂的重要指标是⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽,其值越⎽⎽⎽⎽⎽⎽⎽⎽⎽,活性越高。
4.在相同温度下,以P 凸,P 平,P 凹表示凸液面,平液面,凹液面上的饱和蒸气压,则三者的关系为5. 通常液体的表面张力是指某液体与其⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽相接触,或者与⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽相接触时的界面张力。
6.胶体分散系统的分散相粒子半径的大小所处范围是 ,在外加电场作用下,胶体粒子被固定,而分散介质移动的现象称为 。
7.气体被固体吸附的过程其熵变∆S ⎽⎽⎽⎽⎽⎽⎽0,焓变∆H ⎽⎽⎽⎽⎽⎽0。
(填 > = <) 8、用活性炭吸附CHCl 3时,0 ℃时的最大吸附量为93.8 dm 3·kg -1 已知该温度下CHCl 3 的分压力为1.34 ×10 4 Pa 时的平衡吸附量为 82.5 dm 3·kg -1 ,朗缪尔吸附等温式中的常数b = ,CHCl 3分压力为 6.67 ×10 3 Pa 时的平衡吸附量为 dm 3·kg -19、200℃时测定O 2 在某催化剂上的吸附作用,当平衡压力为 0.1 MPa 及1 MPa 时,1g 催化剂吸附O 2的量分别为2.5 cm 3及 4.2 cm 3 (STP ,标准状况) ,设吸附作用服从朗缪尔公式,当O 2 的吸附量为饱和吸附量的一半时,平衡压力为 。
10、BET二常数公式适用范围的相对压p/p ﹡在⎽⎽⎽⎽⎽⎽⎽⎽⎽之间。
11、吸附等量线的主要用途是求⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。
物理吸附的吸附热与气体的⎽⎽⎽⎽⎽⎽⎽相近。
12、朗格缪尔等温吸附理论的基本假设为:(1)⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽; (2)⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽;(3)⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽;(4)⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。
13、朗格缪尔吸附等温式的适用条件是14、293 K 时乙醚/水,汞/乙醚,汞/水的界面张力分别为10.7×10 -3 N·m -1,379×10 -3 N·m -1,375×10 -3 N·m -1。
