生物化学实验常用缓冲液的配制方法
硼酸硼砂缓冲液的配制

硼酸硼砂缓冲液的配制
硼酸硼砂缓冲液是一种常用的实验室缓冲液,用于维持溶液的酸碱度在一定范围内。
它主要由硼酸和硼砂的混合物组成,可以在生物化学实验、分子生物学实验等多个领域中广泛使用。
硼酸硼砂缓冲液的配制方法相对简单,以下是一种常见的配制方法:
材料:
- 硼酸 (H3BO3)
- 硼砂 (Na2B4O7·10H2O)
- 蒸馏水或去离子水
步骤:
1. 准备所需材料并确保所有材料都是干净的。
2. 称取适量的硼酸和硼砂。
缓冲液的酸碱度通常由硼酸与硼砂的比例来控制,常见的比例为1:1或4:1。
3. 将硼酸和硼砂分别加入两个不同的容器中。
4. 使用蒸馏水或去离子水将硼酸和硼砂溶解,搅拌溶解直至完全溶解。
5. 将硼酸溶液和硼砂溶液混合在一起,并搅拌均匀。
6. 使用酸碱度计检测溶液的酸碱度,如果需要调整pH值,可以使用酸或碱来进行调节。
7. 最后,将缓冲液转移到一个干净的容器中,并密封保存。
需要注意的是,硼酸硼砂缓冲液的配制过程中要注意实验室安全操作,避免溅出或接触皮肤和眼睛。
此外,配制的缓冲液应尽快使用或在冷藏条件下保存,以确保其稳定性和有效性。
硼酸硼砂缓冲液的pH范围通常在7.0至9.0之间,可根据实际需要
进行调整。
它在许多实验中被用作DNA和RNA的电泳缓冲液、蛋白质分析缓冲液等,其缓冲效果稳定可靠。
总之,硼酸硼砂缓冲液的配制相对简单,但在实验中起到重要的作用。
正确配制并使用该缓冲液可有效维持溶液的酸碱度,确保实验结果的准确性和可重复性。
生物实验中常见buffer的配制
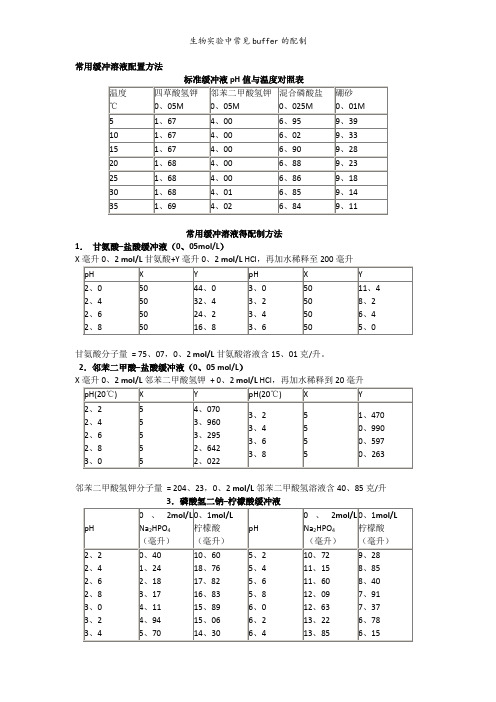
常用缓冲溶液配置方法常用缓冲溶液得配制方法1.甘氨酸–盐酸缓冲液(0、05mol/L)X甘氨酸分子量= 75、07,0、2 mol/L甘氨酸溶液含15、01克/升。
2.邻苯二甲酸–盐酸缓冲液(0、05 mol/L)X邻苯二甲酸氢钾分子量= 204、23,0、2 mol/L邻苯二甲酸氢溶液含40、85克/升Na2HPO4分子量= 14、98,0、2 mol/L溶液为28、40克/升。
Na2HPO4-2H2O分子量= 178、05,0、2 mol/L溶液含35、01克/升。
C4H2O7·H2O分子量= 210、14,0、1 mol/L溶液为21、01克/升。
4①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②5柠檬酸C6H8O7·H2O:分子量210、14,0、1 mol/L溶液为21、01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294、12,0、1 mol/L溶液为29、41克/毫升。
6.乙酸–乙酸钠缓冲液(0、2 mol/L)Na2Ac·3H2O分子量= 136、09,0、2 mol/L溶液为27、22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0、2)Na2HPO4·2H2O分子量= 178、05,0、2 mol/L溶液为85、61克/升。
Na2HPO4·2H2O分子量= 358、22,0、2 mol/L溶液为71、64克/升。
Na2HPO4·2H2O分子量= 156、03,0、2 mol/L溶液为31、21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)Na2HPO4·2H2O分子量= 178、05,1/15M溶液为11、876克/升。
KH2PO4分子量= 136、09,1/15M溶液为9、078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0、05M)X巴比妥钠盐分子量=206、18;0、04M溶液为8、25克/升10.Tris–盐酸缓冲液(0、05M,25℃)50毫升0、1M三羟甲基氨基甲烷(Tris)溶液与X毫升0、1N盐酸混匀后,加水稀释至100毫升。
实验常用试剂缓冲液的配制方法

实验常用试剂缓冲液的配制方法
一、常用试剂和试剂配置
1、氯仿。
将1L 99.7%纯度的氯仿加入水中,调节pH值至7.4,溶解
即可得到0.5mol/L的氯仿溶液。
2、二氧化碳水。
将100mL弱碳酸氢氧化钠溶液(NaHCO3,0.5mol/L)加入1L水中,经过气泡交换,可制得CO2水。
3、磷酸盐缓冲液。
将200mL磷酸盐溶液(K2HPO4,0.5mol/L)加入800mL水中,调节pH值至7.2,搅拌均匀,即可得到0.2mol/L磷酸盐缓
冲液。
4、EDTA标准溶液。
将25.0g EDTA·4Na(C10H14N2O8Na2)加入
1000mL水中,热溶解,调节pH值至7.0,搅拌均匀,得到0.2mol/LEDTA
标准溶液。
5、肌酐标准溶液。
将10.0g肌酐(C10H13N3O8)=14.2H2O)加入
1000mL的水中,搅拌,调节pH值至7.4,搅拌均匀,即可得到0.1mol/L
的肌酐标准溶液。
二、缓冲液的配置
1、弱酸缓冲液。
将3.0mL 0.2mol/L磷酸钠溶液(Na2HPO4)加入到
97mL 0.2mol/L磷酸钙溶液(Ca(H2PO4)2)中,搅拌均匀,即可得到
0.2mol/L的弱酸缓冲液。
2、弱碱缓冲液。
将3.0mL 0.2mol/L磷酸氢氧化钠溶液(NaH2PO4)
加入到97mL 0.2mol/L碳酸氢钙溶液(Ca(HCO3)2)中,搅拌均匀,即可
得到0.2mol/L的弱碱缓冲液。
3、弱盐缓冲液。
2m-kci标准缓冲液的配制

2m-kci标准缓冲液的配制一、概述缓冲液是实验室常用的一种溶液,它可以帮助维持溶液的pH值,从而稳定化学反应的环境。
2m-kci标准缓冲液是一种常用的缓冲液,在生物化学实验中广泛应用。
本文将介绍2m-kci标准缓冲液的配制方法,希望可以帮助读者正确、高效地配制这种缓冲液。
二、材料准备1. 氯化钾(KCl)固体2. 纯水三、配制步骤1. 称取氯化钾固体:根据需要配制的缓冲液总体积,计算所需的氯化钾固体质量。
一般来说,2m-kci标准缓冲液的配制中,需要将氯化钾固体溶解在纯水中,配制成最终浓度为2m的缓冲液。
2. 溶解氯化钾固体:取一定容器,如烧杯或烧瓶,加入适量的纯水,用磁力搅拌器或振荡器将水搅动。
将称取好的氯化钾固体缓慢添加到搅拌的水中,直至氯化钾完全溶解。
3. 调整总体积:在氯化钾全部溶解后,继续加入适量的纯水,使最终的缓冲液体积达到所需的总体积。
4. 搅拌均匀:在调整好总体积后,用搅拌器或振荡器再次充分搅拌缓冲液,确保氯化钾的溶解和溶液的均匀混合。
四、注意事项1. 安全操作:在配制缓冲液的过程中,要注意化学品的安全操作,避免接触皮肤和吸入气体,避免化学品的飞溅。
2. 搅拌均匀:搅拌过程十分重要,确保氯化钾充分溶解,并且溶液充分均匀混合,以保证配制出来的缓冲液浓度均匀。
3. 存储条件:配制好的2m-kci标准缓冲液,需要储存在阴凉、干燥的地方,避免阳光直射或高温环境。
五、总结2m-kci标准缓冲液的配制是实验室常见的操作步骤,正确的配制方法能够保证溶液的质量和浓度,从而保证实验结果的准确性。
希望本文介绍的配制方法能够帮助读者正确、高效地配制2m-kci标准缓冲液。
六、实验应用1. 生物化学实验中的应用:2m-kci标准缓冲液在生物化学实验中有着广泛的应用,例如在蛋白质电泳实验中,用作电泳缓冲液,维持电泳系统中的pH稳定性;在酶动力学实验中,用作酶反应的缓冲液,帮助研究酶在不同pH条件下的活性变化。
生物化学常用缓冲液

生物化学常用缓冲液⑴ 磷酸盐缓冲液磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由於它们是二级解离,有二个pKa值,所以用它们配制的缓冲液,pH范围最宽:NaH2PO4: pKa1=2.12, pKa2=7.21Na2HPO4: pKa1=7.21, pKa2=12.32配酸性缓冲液:用 NaH2PO4,pH=1~4,配中性缓冲液:用混合的两种磷酸盐,pH=6~8,配碱性缓冲液:用 Na2HPO4,pH=10~12。
用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS(十二烷基硫酸钠)会与钾盐生成难溶的十二烷基硫酸钾。
磷酸盐缓冲液的优点为:①容易配制成各种浓度的缓冲液;②适用的pH 范围宽;③pH受温度的影响小;④缓冲液稀释后pH变化小,如稀释十倍后pH的变化小于0.1。
其缺点为:①易与常见的钙Ca++离子、镁Mg++离子以及重金属离子缔合生成沉淀;②会抑制某些生物化学过程,如对某些酶的催化作用会产生某种程度的抑制作用。
⑵Tris(三羟甲基氨基甲烷,N-Tris(hydroxymethyl)aminomethane)缓冲液Tris缓冲液在生物化学研究中使用的越来越多,有超过磷酸盐缓冲液的趋势,如在SDS-聚丙烯酰胺凝胶电泳中已都使用Tris缓冲液,而很少再用磷酸盐。
Tris缓冲液的常用有效pH范围是在“中性”范围,例如:Tris-HCl缓冲液: pH=7.5~8.5Tris-磷酸盐缓冲液: pH=5.0~9.0配制常用的缓冲液的方法有两种:①按书后附录中所列该缓冲液表中的方法,分别配制0.05mol/L Tris和0.05mol/L HCl溶液,然后按表中所列体积混合。
由于标准浓度的稀盐酸不易配制,所以常用另一种方法;②若配1L0.1mol/L的Tris-HCl缓冲液:先称12.11g Tris碱溶于950mL~970mL 无离子水中,边搅拌边滴加4N HCl,用pH计测定溶液pH值至所需的pH值,然后再加水补足到1L。
常见缓冲溶液配制方法

常见缓冲溶液配制方法1.醋酸钠/醋酸酸性缓冲液醋酸钠/醋酸酸性缓冲液适用于pH范围为4.0-6.0的实验。
配制方法如下:- 准备质量浓度为0.1mol/L的醋酸钠溶液和0.1mol/L的醋酸溶液。
-根据所需pH值,按照相应的比例混合醋酸钠溶液和醋酸溶液即可。
2.磷酸/盐酸性缓冲液磷酸/盐酸性缓冲液适用于pH范围为1.0-3.0的实验。
配制方法如下:- 准备0.2mol/L的盐酸溶液。
- 准备分别为0.2mol/L和0.1mol/L的磷酸溶液。
-具体配制时,根据所需pH值,按照相应的比例混合盐酸溶液和磷酸溶液即可。
3.磷酸/氢磷酸二盐酸性缓冲液磷酸/氢磷酸二盐酸性缓冲液适用于pH范围为2.0-7.0的实验。
配制方法如下:- 准备0.2mol/L的盐酸溶液。
- 准备分别为0.2mol/L、0.1mol/L和0.05mol/L的氢磷酸二盐溶液。
-具体配制时,根据所需pH值,按照相应的比例混合盐酸溶液和氢磷酸二盐溶液即可。
4.磷酸盐缓冲液磷酸盐缓冲液适用于pH范围为5.0-8.0的实验。
配制方法如下:- 准备分别为0.2mol/L的梯度磷酸盐溶液。
-根据所需pH值,按照相应的比例混合相应浓度的磷酸盐溶液即可。
5.三氯乙酸/三氯乙酸钠酸性缓冲液三氯乙酸/三氯乙酸钠酸性缓冲液适用于pH范围为3.0-4.6的实验。
配制方法如下:- 准备质量浓度为0.2mol/L的三氯乙酸钠溶液和0.2mol/L的三氯乙酸溶液。
-根据所需pH值,按照相应的比例混合三氯乙酸钠溶液和三氯乙酸溶液即可。
以上是一些常见的缓冲溶液配制方法,具体的配制过程可能会因实验需求和具体试剂而略有不同。
在配制缓冲溶液时,一定要注意使用高纯度的试剂,并按照配制方法进行准确的实验操作。
生物实验中常见buffer的配制

常用缓冲溶液配置方法标准缓冲液pH值与温度对照表常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(L)X毫升 mol/L甘氨酸+Y毫升 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = , mol/L甘氨酸溶液含克/升。
2.邻苯二甲酸–盐酸缓冲液( mol/L)X毫升 mol/L邻苯二甲酸氢钾 + mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = , mol/L邻苯二甲酸氢溶液含克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = , mol/L溶液为克/升。
Na2HPO4-2H2O分子量 = , mol/L溶液含克/升。
C4H2O7·H2O分子量 = , mol/L溶液为克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②5.柠檬酸–柠檬酸钠缓冲液( mol/L)柠檬酸C6H8O7·H2O:分子量, mol/L溶液为克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量, mol/L溶液为克/毫升。
6.乙酸–乙酸钠缓冲液( mol/L)Na2Ac·3H2O分子量 = , mol/L溶液为克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液()Na2HPO4·2H2O分子量 = , mol/L溶液为克/升。
Na2HPO4·2H2O分子量 = , mol/L溶液为克/升。
Na2HPO4·2H2O分子量 = , mol/L溶液为克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)1M溶液为克/升。
Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
11.硼酸–硼砂缓冲液(硼酸根)硼砂Na2B4O7·H2O,分子量=;溶液(=硼酸根)含克/升。
硼酸H2BO3,分子量=,溶液为克/升。
ph5.5的乙酸乙酸钠缓冲液的配制方法

标题:ph5.5的乙酸乙酸钠缓冲液的配制方法一、概述在生物化学和生物实验中,常常需要使用缓冲液来稳定溶液的pH值,使实验条件更加稳定。
乙酸乙酸钠缓冲液是一种常用的缓冲液之一,其pH值通常在4.5-5.5之间。
在本文中,我们将介绍如何配制pH5.5的乙酸乙酸钠缓冲液,希望能为实验工作者提供帮助。
二、准备工作1. 实验室天平2. 蒸馏水3. 乙酸(冰乙酸)4. 碳酸钠5. 磁力搅拌器6. 磁力搅拌棒7. pH计8. 10mL、50mL和100mL三种容量瓶9. 烧杯10. 称量瓶三、配制步骤1. 计算所需物质的量根据所需制备的缓冲液体积和配制所需pH值,使用韦恩图(Henderson-Hasselbalch equation)计算所需的乙酸和乙酸钠的量。
具体计算公式如下:(1)乙酸的质量 = C1*V1*M1其中,C1为所需乙酸的浓度(mol/L),V1为所需溶液的体积(L),M1为乙酸的摩尔质量(g/mol)。
(2)乙酸钠的质量 = C2*V2*M2其中,C2为所需乙酸钠的浓度(mol/L),V2为所需溶液的体积(L),M2为乙酸钠的摩尔质量(g/mol)。
2. 称量乙酸使用天平称量所需的乙酸,并加入10mL容量瓶中。
3. 称量乙酸钠使用天平称量所需的乙酸钠,并加入10mL容量瓶中。
4. 添加蒸馏水分别向乙酸和乙酸钠中加入蒸馏水,使体积达到10mL,摇匀溶解。
5. 调整pH值使用pH计检测溶液的pH值,若不足5.5,逐滴加入盐酸或氢氧化钠调节pH值至所需的5.5。
6. 验证溶液验证调节后的溶液pH值是否达到5.5,确认无误后,将溶液转移到50mL容量瓶中。
7. 验证溶液浓度使用浓度计或pH计验证缓冲液的浓度是否符合预期。
8. 校正体积如有必要,校正缓冲液的体积,使其达到预期的体积。
9. 放置将制备好的缓冲液储存在干燥、阴凉的地方,避免阳光直射。
四、注意事项1. 乙酸和乙酸钠均为腐蚀性物质,使用时需戴手套、护目镜等防护设备。
碳酸氢钠缓冲溶液的配制

碳酸氢钠缓冲溶液的配制碳酸氢钠缓冲溶液是一种常用的缓冲溶液,它可以在生物化学实验中起到重要的作用。
下面将介绍碳酸氢钠缓冲溶液的配制方法。
一、理论基础碳酸氢钠缓冲溶液是一种弱酸弱碱缓冲溶液,其化学式为NaHCO3。
在水中溶解时,NaHCO3会分解成Na+、HCO3-和H2O,其中HCO3-是一种弱酸,可以与OH-反应生成CO32-和H2O,从而起到缓冲作用。
二、配制方法1. 确定所需浓度和体积首先需要确定所需的碳酸氢钠缓冲溶液的浓度和体积。
一般来说,浓度为0.1M的碳酸氢钠缓冲溶液是最常用的,而体积则根据实验需要而定。
2. 计算所需物质的质量根据所需浓度和体积,可以计算出所需的NaHCO3的质量。
NaHCO3的摩尔质量为84.01g/mol,因此可以使用下面的公式计算所需质量:所需质量(g)=浓度(mol/L)×体积(L)×摩尔质量(g/mol)3. 加入适量的水将计算出的NaHCO3质量加入适量的去离子水中,搅拌至完全溶解。
4. 调节pH值由于NaHCO3是一种弱酸,因此在缓冲溶液中,pH值会受到CO2的影响而发生变化。
为了保持缓冲溶液的稳定性,需要将pH值调节到所需范围内。
一般来说,碳酸氢钠缓冲溶液的pH值在8.2左右。
5. 调整体积最后,根据实验需要,可以将缓冲溶液的体积调整至所需的体积。
三、注意事项1. NaHCO3在空气中容易吸收水分和CO2,因此需要保存在干燥的环境中。
2. 在配制缓冲溶液时,需要使用去离子水或高纯度水,以避免杂质对实验结果的影响。
3. 在调节pH值时,可以使用pH计或指示剂来检测pH值。
4. 在调整体积时,需要注意溶液的浓度和体积的准确性,以保证实验结果的可靠性。
综上所述,碳酸氢钠缓冲溶液的配制方法相对简单,但需要注意一些细节问题。
只有在正确的配制下,才能保证实验结果的准确性和可靠性。
常用缓冲溶液配制方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1mol/L溶液为29.41克/毫升。
7.磷酸盐缓冲液242Na 2HPO 4·12H 2O 分子量 = 358.14,0.2 mol/L 溶液为71.628克/升。
NaH 2PO 4·2H 2O 分子量 = 156.01,0.2 mol/L 溶液为31.202克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH 2PO 4: pKa1=2.12,pKa2=7.21; Na 2HPO 4:pKa1=7.21,pKa2=12.32配酸性缓冲液:用NaH 2PO 4,pH =1~4,配中性缓冲液:用混合的两种磷酸盐,pH =6~8, 配碱性缓冲液:用Na 2HPO 4,pH =10~12。
生物实验中常见buffer的配制
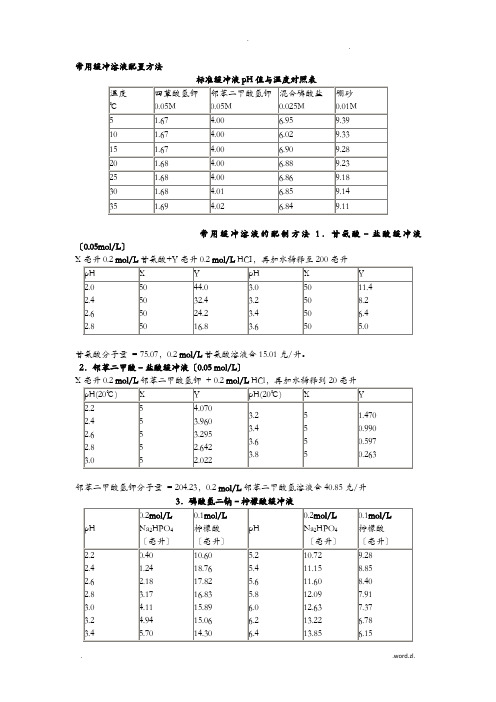
常用缓冲溶液配置方法常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液〔0.05mol/L〕X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液〔0.05 mol/L〕X邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4-2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4①使用时可以每升中参加1克克酚,假设最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②5.柠檬酸–柠檬酸钠缓冲液〔0.1 mol/L〕柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液〔0.2 mol/L 〕Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na2HPO 4·2H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
Na 2HPO 4·2H 2O 分子量 = 178.05,1/15M 溶液为11.876克/升。
tris盐酸配制方法

tris盐酸配制方法简介tris盐酸是一种常用的缓冲液,广泛应用于生物化学、分子生物学和其他实验室中的科研工作。
它由tris(三羟甲基氨基甲烷)和盐酸混合而成,具有稳定pH值的特性,常用于调节溶液的酸碱度。
本文将介绍tris盐酸的配制方法,包括所需材料、步骤和注意事项等内容。
所需材料•tris(三羟甲基氨基甲烷)粉末•盐酸(浓度为1M)•双级纯水步骤1. 准备工作在开始配制tris盐酸之前,请确保实验室环境清洁,并准备好所需材料。
2. 计算所需量根据实验需要和所使用的浓度,计算出所需的tris和盐酸的量。
通常情况下,tris和盐酸的比例为1:9或1:10。
3. 加入适量双级纯水取一个干净的容器,加入适量双级纯水。
根据所需的最终体积,加入适量双级纯水。
注意,双级纯水应该是高纯度的,以避免对实验结果产生干扰。
4. 加入tris粉末将计算好的tris粉末加入到容器中的双级纯水中。
搅拌溶解,直到tris完全溶解为止。
5. 加入盐酸将计算好的盐酸缓慢加入到溶解好的tris溶液中。
同时用玻璃棒或磁力搅拌子轻轻搅拌,以确保盐酸均匀混合。
6. 调节pH值使用pH计测量溶液的pH值。
根据需要,可以通过添加少量盐酸或氢氧化钠(NaOH)来调节pH值。
注意,调节pH值时要小心谨慎,并且每次只添加少量试剂。
7. 最终体积调整根据实验需要和所需的最终体积,通过添加适量双级纯水来调整溶液的最终体积。
8. 检查和储存检查配制好的tris盐酸溶液的pH值是否符合要求。
如果需要,可以进行进一步的调节。
将溶液转移至干净的容器中,并在容器上标明配制日期和浓度等信息。
将溶液储存在适当的条件下,以确保其稳定性和长期保存。
注意事项•在配制tris盐酸溶液时,应注意个人安全。
戴上手套和护目镜,并确保在通风良好的实验室环境中操作。
•tris粉末可能对呼吸道和皮肤有刺激作用,因此在操作时要小心避免直接接触。
•盐酸是一种腐蚀性强的化学物质,应当小心使用并避免与皮肤、眼睛等接触。
实验常用试剂缓冲液的配制方法

实验常用试剂缓冲液的配制方法实验室中经常使用各种试剂和缓冲液进行实验。
下面我将介绍一些常用试剂和缓冲液的配制方法。
1.磷酸盐缓冲液磷酸盐缓冲液一般有三种类型的配方:PBS(磷酸盐缓冲盐溶液)、PBST(含Tween-20的磷酸盐缓冲盐溶液)和TBS(三氯甲烷缓冲盐溶液)。
配制PBS缓冲液:-加入适量的8.0g/L氯化钠和0.2g/L磷酸氢二钠到1L去离子水中。
-调整pH值至7.4,采用10M氢氧化钠(NaOH)或者盐酸(HCl)。
-用去离子水稀释至1xPBS。
配制PBST缓冲液:-配制1xPBS。
- 加入0.1%(v/v)Tween-20。
-混合均匀。
配制TBS缓冲液:-加入2.42g/L三氯甲烷到1L去离子水中。
-加入20g/L三甲基氯化胺到溶液中。
-调整pH值至8.0,采用盐酸(HCl)。
-用去离子水稀释至1xTBS。
2.毛细管电泳缓冲液毛细管电泳缓冲液的配制方法取决于电泳类型,一般包括凝胶和毛细管电泳。
配制凝胶电泳缓冲液:-加入8g/L琼脂糖和0.4g/L硼酸到1L去离子水中。
-用热板搅拌器加热,搅拌至溶解。
-冷却至室温后,调整pH值至8.3,采用盐酸(HCl)或氢氧化钠(NaOH)。
-用去离子水稀释至所需浓度。
配制毛细管电泳缓冲液:-加入10mM氢氧化钠(NaOH)和1mM二硼酸氢钠到500mL去离子水中。
-调整pH值至9.2,采用盐酸(HCl)。
-加入1mM十二烷基硫酸钠。
-用去离子水稀释至所需浓度。
3.蛋白质含量测定蛋白质含量测定一般采用BCA法、Lowry法或Bradford法。
BCA法配制试剂:-在15mL玻璃试管中加入BCA试剂(提取液A)。
-加入0.1M硫酸(提取液B)。
-混合提取液A和提取液B,即得到试剂。
Lowry法配制试剂:-加入白蛋白标准品和Na2CO3/NaOH缓冲液(A液)到250mL锥形瓶中。
-混合硫酸/磷酸/酒精试剂(B液)。
-将A液倒入B液中混合,待用。
Bradford法配制试剂:-加入试剂A到450mL去离子水中。
盐酸胍缓冲溶液的制备

盐酸胍缓冲溶液的制备
盐酸胍缓冲溶液是一种常用于生物化学实验中的缓冲液。
它的制备方
法十分简单,只需准备好适量的盐酸和胍,并按照一定比例混合即可。
下面,就让我们来了解一下具体的制备过程吧。
一、准备材料
制备盐酸胍缓冲溶液所需的材料主要有盐酸、胍和去离子水。
在制备
的过程中还需要使用一些实验器材,如称量器、烧杯、搅拌棒等等。
二、按照一定比例混合盐酸和胍
首先,需要准备好适量的盐酸和胍。
一般来说,盐酸的浓度为
0.1mol/L,胍的浓度为0.2mol/L。
然后将它们按照一定比例混合,使
其成为一种缓冲液。
比如说,可以按照以下配方制备一定量的盐酸胍缓冲溶液:取1mol/L
的盐酸30ml,加入去离子水中,加胍至100ml。
三、调整pH值
在混合盐酸和胍的过程中,会产生一定量的离子,这些离子会影响缓
冲液的pH值。
因此,在制备完成后,需要使用pH计检测缓冲液的pH 值。
如果pH值不符合要求,则需要进行适当的调整。
四、检测缓冲液的质量
制备完成后,还需要进行质量检测。
常用的检测方法包括pH值、离子
浓度、溶液的透明度等等。
如果检测结果不合格,则说明缓冲液存在
质量问题,需要重新制备或调整。
以上就是盐酸胍缓冲溶液的制备过程。
需要注意的是,在制备过程中,要严格按照操作规程进行,避免出现意外情况。
同时,在使用过程中,还需要注意缓冲液的储存和保管,避免其受到污染或损坏。
常用缓冲溶液配制方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
7.磷酸盐缓冲液Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na 2HPO 4·12H 2O 分子量 = 358.14,0.2 mol/L 溶液为71.628克/升。
NaH 2PO 4·2H 2O 分子量 = 156.01,0.2 mol/L 溶液为31.202克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH 2PO 4: pKa1=2.12,pKa2=7.21; Na 2HPO 4:pKa1=7.21,pKa2=12.32配酸性缓冲液:用NaH 2PO 4,pH =1~4,配中性缓冲液:用混合的两种磷酸盐,pH =6~8, 配碱性缓冲液:用Na 2HPO 4,pH =10~12。
硼砂缓冲液配制

硼砂缓冲液配制硼砂缓冲液是一种常用的化学试剂,用于调节溶液的酸碱度。
它由硼砂和适量的酸碱盐组成,能够在一定范围内稳定溶液的pH值,起到缓冲作用。
本文将详细介绍硼砂缓冲液的配制方法、应用领域和优势。
一、硼砂缓冲液的配制方法硼砂缓冲液的配制相对简单,一般遵循以下步骤:1. 准备所需材料:硼砂、酸碱盐(如柠檬酸、硼酸)、去离子水和称量瓶、容量瓶等实验器材。
2. 根据所需的pH值范围选择合适的酸碱盐和硼砂的摩尔浓度。
一般情况下,硼砂的浓度为0.1M,酸碱盐的浓度根据具体需求而定。
3. 使用称量瓶准确称量硼砂和酸碱盐的质量。
4. 将称量好的硼砂和酸碱盐分别溶解在去离子水中,搅拌均匀。
5. 将溶解好的硼砂和酸碱盐混合,继续搅拌至溶液均匀。
6. 将混合好的溶液转移到容量瓶中,加入适量的去离子水,使溶液体积达到容量瓶刻度线处。
7. 用瓶塞密封容量瓶,轻轻摇晃使溶液充分混合。
二、硼砂缓冲液的应用领域硼砂缓冲液在生物化学、分子生物学和生物医学等领域都有广泛的应用。
具体应用包括:1. 实验室中常用于调节酶反应体系的pH值,使其保持在特定的范围内,以确保酶的最佳活性。
2. 在细胞培养和组织工程等生物学实验中,可用作细胞培养液的缓冲剂,维持细胞生长环境的稳定。
3. 在基因工程领域,硼砂缓冲液常用于DNA电泳实验中,用于稳定DNA溶液的pH值,以保证电泳结果的准确性。
4. 在医学领域,硼砂缓冲液可以用于制备药物、疫苗和生物诊断试剂,保证其在制备和储存过程中的稳定性。
三、硼砂缓冲液的优势硼砂缓冲液相比其他缓冲液具有以下优势:1. 稳定性好:硼砂缓冲液能够在一定范围内稳定溶液的pH值,不易受外界因素影响。
2. pH范围广:硼砂缓冲液的pH值范围一般在4-9之间,可以满足大部分实验的需求。
3. 成本低廉:硼砂是一种常见的化学试剂,价格相对较低,制备成本不高。
4. 操作简便:硼砂缓冲液的配制方法简单,不需要复杂的设备和操作技巧,适用于实验室和教学实验。
磷酸盐缓冲液 配制

磷酸盐缓冲液配制摘要:一、磷酸盐缓冲液的概念和作用二、磷酸盐缓冲液的配制方法1.准备工作2.计算所需成分比例3.称量并溶解成分4.调整pH值5.过滤和定容三、磷酸盐缓冲液的注意事项1.储存条件2.使用期限3.适用范围正文:磷酸盐缓冲液是一种在生物化学和分子生物学实验中常用的溶液,具有维持实验环境稳定、调节pH值等重要作用。
本文将详细介绍磷酸盐缓冲液的配制方法及注意事项。
一、磷酸盐缓冲液的概念和作用磷酸盐缓冲液是一种能够稳定维持pH值在特定范围内的溶液。
在生物化学和分子生物学实验中,磷酸盐缓冲液常常用于酶促反应、核酸提取与纯化等过程,以保持实验环境稳定,确保实验结果准确。
二、磷酸盐缓冲液的配制方法1.准备工作:需准备好磷酸盐缓冲液的成分,如磷酸二氢钾、磷酸氢二钠、蒸馏水等。
同时,需检查实验器材,如电子天平、烧杯、玻璃棒、磁力搅拌器等是否齐全。
2.计算所需成分比例:根据实验需求,参照相关文献或标准,计算出磷酸盐缓冲液中各成分的比例。
3.称量并溶解成分:使用电子天平准确称量所需成分,然后将其分别溶解在蒸馏水中。
通常情况下,先将磷酸二氢钾和磷酸氢二钠分别溶解,再将两者混合。
4.调整pH值:根据实验要求,使用酸或碱调整磷酸盐缓冲液的pH值至目标值。
通常使用1M的盐酸或氢氧化钠溶液进行调节。
5.过滤和定容:将调整好pH值的磷酸盐缓冲液过滤,以去除可能影响实验的杂质。
过滤后的磷酸盐缓冲液进行定容,使其达到所需体积。
三、磷酸盐缓冲液的注意事项1.储存条件:磷酸盐缓冲液应存放在密封的容器中,避免阳光直射和高温。
一般情况下,可以在4℃条件下保存较长时间。
2.使用期限:在规定条件下,磷酸盐缓冲液的有效期通常为3-6个月。
在有效期内使用可确保实验结果的准确性。
3.适用范围:磷酸盐缓冲液适用于许多生物化学和分子生物学实验,但在特定实验中,可能需要根据实验要求进行成分和pH值的调整。
通过以上步骤,可以成功配制出磷酸盐缓冲液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生物化学实验常用缓冲液的配制方法1、0.2mol/L 磷酸缓冲液 *组份浓度0.2mol/L (pH 6.0)*配制量1L*配置方法 1. 称取磷酸氢二钠.12水8.82 g。
2. 称取磷酸二氢钠.2水27.34g。
3. 用去离子水溶解并定容至1L。
室温保存。
注意:此为母液,使用时稀释40倍使用。
2、洗脱液*组份浓度0.15mol/L (含0.15mol/L 氯化钠的0.005mol/L pH 6.0的磷酸缓冲液)*配制量10L*配置方法 1.称取氯化钠87.66g。
2.用0.2mol/L pH6.0的磷酸缓冲液250mL溶解。
3.用去离子水稀释至10L。
室温保存。
3、0.3mol/L 磷酸缓冲液*组份浓度0.3mol/L (pH7.8)*配制量0.5L*配置方法 1.准确称取磷酸氢二钠.12水49.150g。
2.磷酸二氢钠.2水2.000g。
3.用去离子水溶解并定容至0.5L。
室温保存。
注意:此为母液,使用时稀释10 倍使用。
4、0.2mol/L 乙酸缓冲液*组份浓度0.2mol/L (pH4.6)*配制量2L*配置方法 1.准确称取乙酸钠.3水54.44g。
2.加入23mL冰乙酸,溶解。
3.用去离子水溶解并定容至2L。
4℃保存。
5、0.2mol/L 磷酸-柠檬酸缓冲液(pH 2.6、4.6、6.6)*组份浓度0.2mol/L *配制量各1L*配置方法 1.母液A(0.2mol/L 的Na2HPO4溶液):称取Na2HPO4.12 水143.256g,用去离子水定容至2L。
2.母液B(0.1mol/L 的柠檬酸溶液):称取柠檬酸.1水42.028g 用去离子水溶解定容至2L。
3. pH2.6、4.6、6.6的三种缓冲液如下表配制:pH值A(mL)B(mL)2.6 109.0 891.04.6 467.5 532.56.6 727.5 272.54.按上表混匀后,4℃保存。
6、20×SSC 缓冲液*配制量1L(pH7.0)*配置方法 1.准确称取175.2g氯化钠。
2.准确称取88.2g柠檬酸钠.2水。
3.溶解于800mL去离子水中。
4.加入数滴10mol/L 氢氧化钠溶液调节pH值至7.0。
5.加去离子水定容至1L。
注意:按实验需要可分装后高压灭菌。
10×SSC、5×SSC、1×SSC 可由20×SSC做相应稀释得到。
7、0.15mol/L 氯化钠-乙二胺四乙酸二钠缓冲液(pH8.0)*组份浓度0.15mol/L *配制量1L*配置方法 1.准确称取氯化钠8.77g。
2.称取乙二胺四乙酸二钠37.2g。
3.溶于800mL去离子水中。
4.用固体的氢氧化钠调pH 值为8.0。
5.加去离子水定容至1L。
8、1/15mol/L 的磷酸盐缓冲液(pH7.6)*组份浓度0.15mol/L *配制量1L*配置方法 1.溶液甲(1/15mol/L 的KH2PO4溶液):称取KH2PO49.078g,用去离子水溶解定容至1L。
2.溶液乙(1/15mol/L 的Na2HPO4溶液):称取Na2HPO4. 2水11.876g(或磷酸氢二钠.12水23.894g)用去离子水溶解定容至1L。
3.pH7.6磷酸盐缓冲液:将①和②按1.4:8.6比例混合即可。
9、5×TrisGlycineBuffer (SDSPAGE电泳缓冲液)*组份浓度0.125M Tris,1.25M Glycine,0.5%(w/v)SDS *配制量1L*配置方法 1.称取下列试剂,置于1L烧杯中。
Tris 15.1gGlycine 94gSDS 5.0g2.加入约800mL的去离子水,搅拌溶解。
3.加去离子水将溶液定容至1L后,室温保存。
10、5×SDSPAGE Loading Buffer *组份浓度250mM TrisHCl(pH6.8)10%(W/V)SDS0.5%(W/V)BPB50%(V/V)甘油5%(W/V)β巯基乙醇*配制量5mL*配置方法 1.量取下列试剂,置于10mL塑料离心管中。
1M TrisHCl1.25mLSDS 0.5gBPB 25mg甘油2.5mL2.加入去离子水溶解后定容至5mL。
3.小份(500μl/份)分装后,于室温保存。
4.使用前将25μl的2-ME加到每小份中。
5.加入2M-E的LoadingBuffer可在室温下保存一个月左右1、1M TrisHCl * 组份浓度1M TrisHCl (pH7.4,7.6,8.0) * 配制量1L* 配置方法 1.称量121.1gTris置于1L烧杯中。
2.加入约800mL的去离子水,充分搅拌溶解。
3.按下表量加入浓盐酸调节所需要的pH 值。
pH值浓HCl 7.4 约70mL7.6 约60mL8.0 约42mL4.将溶解定容至1L。
5.高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
2、1.5M TrisHCl *组份浓度1.5M TrisHCl (pH8.8)*配制量1L*配置方法 1.称取181.7gTris置于1L烧杯中。
2.加入约800mL的去离子水,充分搅拌溶解。
3.用浓盐酸调pH 值至8.8。
4.将溶液定容至1L。
5.高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
3、10×TE Buffer *组份浓度100 mM TrisHCl,10 mM EDTA (pH 7.4,7.6,8.0)*配制量1L*配置方法 1.量取下列溶液,置于1L烧杯中。
1M TrisHClBuffer(pH7.4,7.6,8.0)100mL500 mM EDTA(pH8.0)20mL2.向烧杯中加入约800mL的去离子水,均匀混合。
3.将溶液定至1L后,高温高压灭菌。
4.室温保存。
4、3 M 醋酸钠*组份浓度3M 醋酸钠(pH5.2)*配制量100mL*配置方法 1.称取40.8gNaOAc.3H2O置于100~200mL烧杯中,加入约40mL的去离子水搅拌溶解。
2.加入冰乙酸调节pH值至5.2。
3.加入去离子水将溶液定容至100mL。
4.高温高压灭菌后,室温保存。
5、PBSBuffer *组份浓度137mM NaCl,2.7mM KCl,10 mM Na2HPO4,2 mM KH2PO4 *配制量1L*配置方法 1.称量下列试剂,置于1L烧杯中。
NaCl 8 gKCl 0.2gNa2HPO4 1.42 gKH2PO4 0.27g2.向烧杯中加入约800mL的去离子水,充分搅拌溶解。
3.滴加HCl将pH 值调节至7.4,然后加入去离子水将溶液定容至1L。
4.高温高压灭菌后,室温保存。
注意:上述PBS Buffer中无二价阳离子,如需要,可在配方中补充1mM CaCl2 和0.5mM MgCl2。
6、10 M 醋酸铵*组份浓度10M 醋酸铵*配制量100mL*配置方法 1.称量77.1g 醋酸铵置于100~200 mL烧杯中,加入约30mL的去离子水搅拌溶解。
2.加去离子水将溶液定容至100mL。
3.使用0.22μm滤膜过滤除菌。
4.密封瓶口于室温保存。
注意:醋酸铵受热易分解,所以不能高温高压灭菌。
7、TrisHCl平衡苯酚*配置方法 1.使用原料:大多数市售液化苯酚是清亮无色的,无需重蒸馏便可用于分子生物学实验。
但有些液化苯酚呈粉红色或黄色,应避免使用。
同时也应避免使用结晶苯酚,结晶苯酚必须在160℃对其进行重蒸馏除去诸如醌等氧化产物,这些氧化产物可引起磷酸二酯键的断裂或导致RNA和DNA的交联等。
因此,苯酚的质量对DNA、RNA的提取极为重要,我们推荐使用高质量的苯酚进行分子生物学实验。
2.操作注意:苯酚腐蚀性极强,并可引起严重灼伤,操作时应戴手套及防护镜等。
所有操作均应在通风橱中进行,与苯酚接触过的皮肤部位应用大量水清洗,并用肥皂和水洗涤,忌用乙醇。
3.苯酚平衡:因为在酸性pH条件下DNA分配于有机相,因此使用苯酚前必须对苯酚进行平衡使其pH值达到7.8以上,苯酚平衡操作方法如下:①液化苯酚应贮存于20℃,此时的苯酚呈现结晶状态。
从冰柜中取出的苯酚首先在室温下放置使其达到室温,然后在68℃水浴中使苯酚充分溶解。
②加入羟基喹啉(8Quinolinol)至终浓度0.1%。
该化合物是一种还原剂、RNA酶的不完全抑制剂及金属离子的弱螯合剂,同时因其呈黄色。
有助于方便识别有机相。
③加入等体积的1M TrisHCl(pH8.0),使用磁力搅拌器搅拌15分钟,静置使其充分分层后,除去上层水相。
④重复操作步骤③。
⑤加入等体积的0.1M TrisHCl(pH8.0),使用磁力搅拌器搅拌15分钟,静置使其充分分层后,除去上层水相。
⑥重复操作步骤⑤,稍微残留部分上层水相。
⑦使用pH试纸确认有机相的pH值大于7.8。
⑧将苯酚置于棕色玻璃瓶中4℃避光保存。
8、苯酚/氯仿/异戊醇*配置方法 1.说明:从核酸样品中除去蛋白质时常常使用苯/酚/氯仿/异戊醇(25:24:1)。
氯仿可使蛋白质变性并有助于液相与有机相的分离,而异戊醇则有助于消除抽提过程中出现的气泡。
2.配置方法:将TrisHCl平衡苯酚与等体积的氯仿/异戊醇(24:1)均匀混合后,移入棕色玻璃瓶中4℃保存。
9、10%(W/V)SDS *组份浓度10%(W/V)SDS *配制量100mL*配置方法 1.称量10g高纯度的SDS 置于100~200mL烧杯中,加入约80mL 的去离子水,68℃加热溶解。
2.滴加数滴浓盐酸调节pH值至7.2。
3.将溶液定容至100mL后,室温保存。
10、2 N NaOH *组份浓度2N NaOH *配制量100mL*配置方法 1.量取80mL去离子水置于100~200mL塑料烧杯中(NaOH溶解过程中大量放热,有可能使玻璃烧杯炸裂)。
2.称取8g NaOH 小心地逐渐加入到烧杯中,边加边搅拌。
3.待NaOH完全溶解后,用去离子水将溶液体积定容至100mL。
4.将溶液转移至塑料容器中后,室温保存。
11、2.5N HCl *组份浓度2.5 N HCl *配制量100mL*配置方法 1.在78.4mL的去离子水中加入21.6mL的浓盐酸(11.6N),均匀混合。
2.室温保存。
12、5 M NaCl *组份浓度5M NaCl *配制量1L*配置方法 1.称取292.2gNaCl置于1L烧杯中,加入约800mL的去离子水后搅拌溶解。
2.加去离子水将溶液定容至1L后,适量分成小份。
