武汉大学分子模拟实验第十章化学反应模拟
武汉大学分子模拟实验报告甲酸的故事

甲酸5个单重态垂直激发能1. GAMESS Job: Minimize (Energy/Geometry) RHF/6-31G(d)Total Energy = -118450.0392 Kcal/Mol2.优化后------------ GAMESS Interface ------------GAMESS Job: Compute Properties CIS/6-31G(d)Total Energy = -118289.9693 Kcal/MolCI-SINGLES EXCITATION ENERGIESSTATE HARTREE EV KCAL/MOL CM-1 ---------------------------------------------------------------------1A 0.2550877361 6.9413 160.0700 55985.29 1A 0.3796262262 10.3302 238.2191 83318.33 1A 0.4096510820 11.1472 257.0600 89908.02 1A 0.4161091161 11.3229 261.1124 91325.39 1A 0.4557212412 12.4008 285.9694 100019.252个单重态绝热激发能1.GAMESS Job: Minimize (Energy/Geometry) RHF/6-31G(d)Total Energy = -118450.0392 Kcal/MolFinish @ energy = -118450.039154 Kcal/Mol (-188.762309 Hartrees)2. 212------- GAMESS Interface ------------GAMESS Job: Compute Properties CIS/6-31G(d)Total Energy = -118289.9762 Kcal/MolTotal Energy = -118211.8328 Kcal/Mol(ER)------------------------------------------3. 211 ------------ GAMESS Interface ------------GAMESS Job: Compute Properties CIS/6-31G(d)Total Energy = -118289.9831 Kcal/Mol5个三重态垂直激发能------------ GAMESS Interface ------------GAMESS Job: Minimize (Energy/Geometry) RHF/6-31G(d)Total Energy = -118450.039 Kcal/MolFinish @ energy = -118450.039035 Kcal/Mol (-188.762309 Hartrees)---------------------------------------------------------------------CI-SINGLES EXCITATION ENERGIESSTATE HARTREE EV KCAL/MOL CM-1 ---------------------------------------------------------------------3A 0.2299142604 6.2563 144.2734 50460.35 3A 0.2330888163 6.3427 146.2655 51157.08 3A 0.3721451537 10.1266 233.5246 81676.42 3A 0.3922329539 10.6732 246.1299 86085.18 3A 0.4196082091 11.4181 263.3082 92093.36-CIS- ENERGY TOOK 2.578 SECONDS2个三重态绝热激发能1. GAMESS Job: Minimize (Energy/Geometry) RHF/6-31G(d)Total Energy = -118450.039 Kcal/MolFinish @ energy = -118450.038957 Kcal/Mol (-188.762309 Hartrees)2.232------------ GAMESS Interface ------------GAMESS Job: Compute Properties CIS/6-31G(d)Total Energy = -118303.7788 Kcal/Mol------------------------------------------3.231------------ GAMESS Interface ------------GAMESS Job: Compute Properties CIS/6-31G(d)Total Energy = -118305.7729 Kcal/Mol二.氨基酸化学位移1.优化GAMESS Job: Minimize (Energy/Geometry) RHF/STO-3GTotal Energy = -175148.1027 Kcal/MolFinish @ energy = -175148.102675 Kcal/Mol (-279.116499 Hartrees)2.13C NMR Spectrum70806090503040PPMGIAO CHEMICAL SHIELDING TENSOR (PPM):ISOTROPICX Y Z SHIELDING( ANISOTROPY )1 N1 X 300.3536 13.0702 -0.6556Y 11.8055 290.7676 -11.5700Z 5.5220 -11.9415 288.9114293.3442 EIGENVALS: 309.7195 296.3566 273.9566( 24.5629 )2 C2 X 210.4704 -4.2044 7.7987Y -6.1214 187.2200 -4.8221Z 11.4381 -6.6515 203.3546200.3483 EIGENVALS: 218.7565 197.0427 185.2458( 27.6122 )3 C3 X 76.0376 -78.4573 29.3698Y -99.3570 75.9554 33.8994Z 29.5649 25.3740 150.8898100.9609 EIGENVALS: -22.2780 164.1789 160.9819( 94.8269 )4 O4 X -303.9035 114.6884 286.4237Y 121.4072 -434.7371 -79.0429Z 281.8289 -74.0152 330.8829-135.9193 EIGENVALS: 440.4797 -562.0592 -286.1782( 864.5984 )5 O5 X 150.0711 9.2380 60.1890Y 112.4257 308.5643 -44.3191Z 54.1821 -3.7257 277.4537245.3630 EIGENVALS: 121.7728 299.3266 314.9897( 104.4400 )6 H6 X 42.7763 2.2074 -1.8378Y 1.9070 27.1874 -2.6062Z -1.6550 -2.6781 27.206632.3901 EIGENVALS: 43.3134 29.3047 24.5522( 16.3850 )7 H7 X 30.3811 -0.0241 1.7193Y 0.4842 39.4051 -5.8785Z 2.5940 -5.9082 26.880632.2223EIGENVALS: 30.9890 23.9060 41.7718( 14.3243 )8 H8 X 28.4995 -0.2256 -0.3267 Y 0.1613 29.2181 3.4993 Z -1.7099 4.2640 35.377931.0318 EIGENVALS: 28.3993 27.3942 37.3020( 9.4052 )9 H9 X 28.1168 -0.1392 -0.0938 Y 0.2032 35.1106 -3.4469 Z -0.2077 -4.7690 27.889830.3724 EIGENVALS: 28.1252 26.0653 36.9267( 9.8315 )10 H10 X 31.1909 4.2712 -2.1450 Y 6.0184 26.4524 -2.2512 Z -2.3714 -1.5285 25.599627.7476 EIGENVALS: 35.2872 23.1573 24.7984( 11.3093 ) ..... DONE WITH NMR SHIELDINGS .. (2)IR Spectrum5001000150020002500300035004000Wavenumbers50100TMS C=257.2。
分子模拟实验报告分子光谱模拟
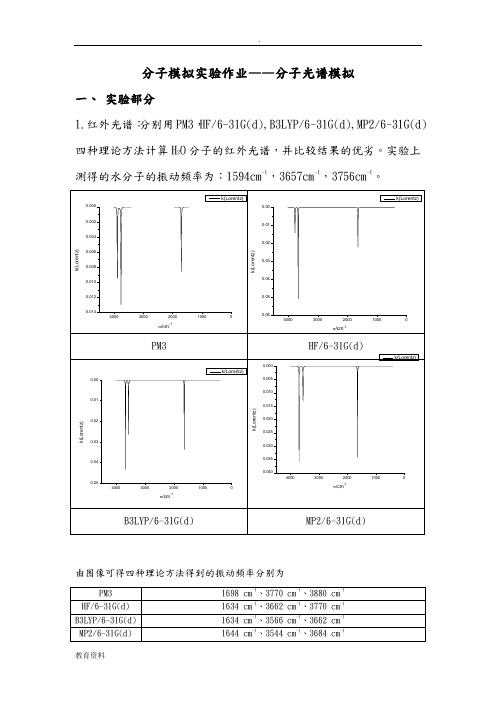
分子模拟实验作业——分子光谱模拟一、实验部分1.红外光谱:分别用PM3,HF/6-31G(d),B3LYP/6-31G(d),MP2/6-31G(d)四种理论方法计算H2O分子的红外光谱,并比较结果的优劣。
实验上测得的水分子的振动频率为:1594cm-1,3657cm-1,3756cm-1。
由图像可得四种理论方法得到的振动频率分别为与标准值1594cm-1,3657cm-1,3756cm-1比较,HF/6-31G(d)最为接近标准值;PM3三个频率都偏大,与标准值符合情况不好;B3LYP/6-31G(d)除1634 cm-1与标准值较接近外,其余两个频率均偏小;MP2/6-31G(d) 1644 cm-1与标准值接近,其余两个频率均偏小。
2.拉曼光谱的模拟HF/6-31G(d)计算的CH4分子的拉曼谱图图中特征波数为3290 cm-1、3189 cm-1、1705 cm-13.紫外可见光谱的模拟计算甲酸分子5个垂直激发的单重态和三重态,2个绝热激发的单重态和三重态,并确定垂直激发和绝热激发波长。
(1)垂直激发---------------------------------------------------------------------CI-SINGLES EXCITATION ENERGIESSTATE HARTREE EV KCAL/MOL CM-1---------------------------------------------------------------------1A 0.2550545872 6.9404 160.0492 55978.011A 0.3796011178 10.3295 238.2033 83312.821A 0.4095383929 11.1441 256.9893 89883.291A 0.4158054412 11.3146 260.9219 91258.751A 0.4554734351 12.3941 285.8139 99964.86HF/6-31G(d)理论水平下HCOOH分子垂直激发波长表(单位:nm)(2)绝热激发E=-118450.0 kcal/mol 基态甲酸分子E=-118309.6kcal/mol 第一个单重激发态ΔE=140.4 kcal/molE=-118260.9 kcal/mol 第二个单重激发态ΔE=189.1 kcal/molE=-118346.9kcal/mol 第一个三重激发态ΔE=103.1 kcal/molE=-118309.6 kcal/mol第二个三重激发态ΔE=103.1 kcal/mol 1S 2S激发波长单位:nm 204 151 1T 2T 277 236可见,垂直激发态中,三重态的波长总体看来大于单重态,因此垂直激发时,单重态的能量要高于三重态的能量,因为单重态中两个单电子的自旋方向相反,而三重态中两个单电子自旋相同。
无机化学实验 武汉大学化学与分子科学学院

无机及分析化学实验无机化学实验参考讲义2011级 下学期目录第一部分 无机化学实验室基本知识、操作技能与常用仪器设备的使用.........1 第二部分 实验部分 (13)实验1 由粗实验制备试剂级氯化钠 (13)实验2 五水硫酸铜的制备及其医药学用途 (18)实验3 由废白铁制备硫酸亚铁和硫酸亚铁铵 (21)实验4 未知物鉴别实验I (24)实验4 未知物鉴别实验II (28)实验 6 茶叶中无机微量元素的分离及鉴别 (31)* 碳酸钠制备实验见《无机及分析化学实验》教材 P139* 如果你对实验讲义有任何意见和建议,欢迎提出来,我们会积极改进。
可与指导老师交流也可写邮件至kaihu@邮箱。
谢谢!第一部分 无机化学实验室基本知识、操作技能与常用仪器设备的使用一常用玻璃仪器的洗涤:1. 洗涤干净的标准除水分子以外无其它任何杂物,洁净透明;附在仪器壁的水不成股流,器壁不挂水珠,表面留有一层均匀而薄的水膜。
2. 洗涤方法(1)用水刷洗:用毛刷刷洗仪器,可以去掉附着的尘土、可溶性物质和易脱落的不溶性杂质。
根据仪器的大小和形状选择合适的毛刷,注意避免毛刷前端的铁丝撞破或损伤仪器。
(2)用去污粉或合成洗涤剂刷洗:去污粉是由碳酸钠、白土、细沙等混合而成的。
它是利用碳酸钠的碱性、细沙的磨擦作用和白土的吸附作用,实现对仪器的清洗。
使用时先将待洗容器用水湿润(必需用少量水),然后用打湿的毛刷沾取少量去污粉擦洗。
仪器内、外壁经擦洗后,先用自来水洗去粘附的去污粉颗粒,然后用蒸馏水洗三次,洗去自来水中带来的钙、镁、铁、氯等离子。
每次蒸馏水的用量要少些,注意节约(采取“少量多次”的原则)。
用合成洗涤剂刷洗玻璃仪器的方法类似。
(3)用洗液洗:在进行精密的定量实验时,对仪器洁净的程度要求很高,或所用仪器容积精确、形状特殊、不能用刷子刷洗时,可用洗液清洗。
通常用的洗液有铬酸洗液、碱性高锰酸钾洗液和以氢氧化钠或碳酸钠为主要成分的强碱洗液。
2024届湖北省武汉市华科附中高三下学期一模考试化学试题含解析

2024年高考化学模拟试卷注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)Ti的说法中,错误的是()1、钛(Ti)常被称为未来钢铁。
下列关于4822A.质子数为22 B.质量数为70 C.中子数为26 D.核外电子数为222、在铁的氧化物和氧化铝组成的混合物中,加入2mol/L硫酸溶液65mL,恰好完全反应。
所得溶液中Fe2+能被标准状况下112mL氯气氧化。
则原混合物中金属元素和氧元素的原子个数之比为( )A.5 : 7 B.4 : 3 C.3 : 4 D.9 : 133、对下列实验的分析合理的是A.实验Ⅰ:振荡后静置,上层溶液颜色保持不变B.实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色保持不变C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内会出现红棕色D.实验Ⅳ:将FeCl3饱和溶液煮沸后停止加热,以制备氢氧化铁胶体4、下列物质中导电能力最差的是()A.熔融态KHSO4B.铜片C.0.1mol/L H2SO4D.固态KCl5、生铁比纯铁()A.硬度低B.易腐蚀C.熔点高D.含碳量低6、将100mL1L•mol-1的NaHCO3溶液分为两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。
两份溶液中c(CO32-)的变化分别是()A.减小、减小B.增大、减小C.增大、增大D.减小、增大7、三种有机物之间的转化关系如下,下列说法错误的是A.X中所有碳原子处于同一平面C H OB.Y的分子式为10162C.由Y生成Z的反应类型为加成反应D.Z的一氯代物有9种(不含立体异构)8、下列各组中的X和Y两种原子,化学性质一定相似的是 ( )A.X原子和Y原子最外层都只有1个电子B.X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2C.X原子的2p能级上有3个电子,Y原子的3p能级上有3个电子D.X原子核外M层上仅有2个电子,Y原子核外N层上仅有2个电子9、将二氧化硫气体通入KIO3淀粉溶液,溶液先变蓝后褪色。
分子模拟实验综合实验
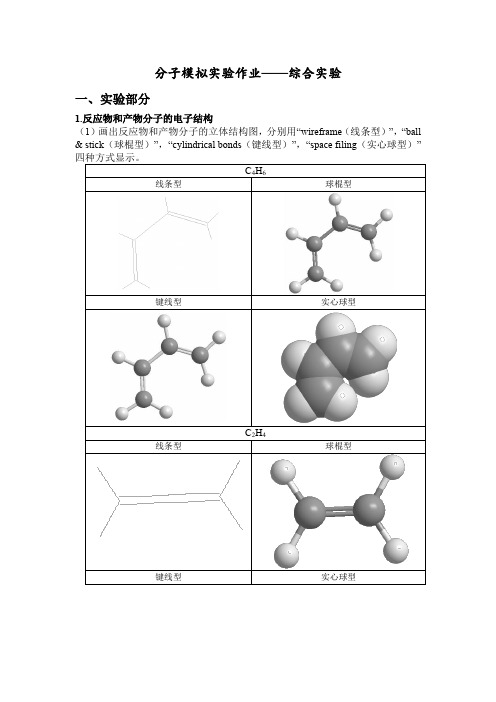
分子模拟实验作业——综合实验一、实验部分1.反应物和产物分子的电子结构(1)画出反应物和产物分子的立体结构图,分别用“wireframe(线条型)”,“ball & stick(球棍型)”,“cylindrical bonds(键线型)”,“space filing(实心球型)”(3)计算分子轨道,并图示各个分子的HOMO和LUMO轨道的形状和能量。
将所有的分子轨道按能级排列次序,并以此分析两反应物的轨道匹配情况。
C4H6LUMO HOMOC2H4LUMO HOMOC6H10LUMO HOMO反应是由1,3-丁二烯的HOMO与乙烯的LUMO反应,故图为分子轨道很匹配,有利于加成反应。
DA反应的反应物分为两部分,双烯体提供共轭双烯,亲双烯体提供不饱和键。
DA反应是由双烯体的HOMO与亲双烯体的LUMO发生作用,反应过程中,电子从双烯体的HOMO流入亲双烯体的LUMO。
C2H4的LUMO轨道与C4H6的HOMO轨道电子云相匹配,正好符合双烯合成的条件,利于反应的进行。
(4)绘制反应物和产物分子的总电子密度图和静电势图,分析两个反应物分子的电性匹配情况。
总电子密度图静电势图总电子密度图静电势图由轨道匹配来说,要使得反应能够顺利进行,必须是同为正或负。
C2H4的静电势图与C4H6的静电势,很匹配,所以有利于加成反应。
2.构象搜索与分子间长程相互作用(1)计算丁二烯分子绕CCCC二面角转动的构象,确定稳定构型,并计算内转动的能垒高度。
(可能不止一个)此时的构型有两种,顺式构型和反式构型。
稳定构型为反式构型,内转动能垒高度:40.58kcal/mol(反式构型)和38.67kcal/mol(顺式构型)。
图1 扫描势能面时的构型能量单位:kcal/mol①势能面图:图2丁二烯分子绕CCCC 二面角转动的构象②相互作用势能线及拟合图选取每个距离下的最低能量,减去MM2优化得到的C2H4和C4H6的能量 C2H4:Total: 0.4267 C4H6:Total: -0.1615 数据表格如下:CCCC 二面角/(°)质心距离/Å质心距离/Å相互作用能量(kc al/图3 C 4H 6与C 2H 4相互作用势能曲线3 反应途径计算(1)在HF/6-31G(d)理论水平上计算两个反应物分子和产物分子的298.15K时标准生成焓。
高分子物理虚拟实验讲义

用软件构建全同立构聚丙烯分子、聚乙烯分子并计算它们末端的直线距离一. 实验目的1.了解用计算机软件模拟大分子的“分子模拟”新趋势2. 学会用“分子模拟”软件构造聚乙烯、聚丙烯大分子3. 计算主链含100个碳原子的聚乙烯、聚丙烯分子末端的直线距离二. 实验原理已经知道,C-C 单键是σ键,其电子云分布具有轴对称性。
因此,σ键相连的两个碳原子可以相对旋转而影响电子云的分布。
原子(或与原子基团)围绕单键内旋转的结果将使原子在空间的排布方式不断地变换。
长链分子主链单键的内旋转赋予高分子以柔性,致使高分子链可任取不同的卷曲程度。
高分子链的卷曲程度可以用高分子链两端点间直线距离—末端距 h 来度量。
高分子链曲越厉害,末端距越短。
高分子长链能以不同程度卷曲的特性称为柔性。
高分子链的柔性是高聚物高弹性的根本原因,也是决定高聚物玻璃化转变温度高低的主要因素。
高分子链的末端距是一个统计平均值,通常采用它的平方的平均,叫做均方末端距2h ,通常是用高分子溶液性能的实验来测定的。
我们知道,C-C 单键(σ键)具有轴对称的电子云。
因此,C-C 单键可以以键向为轴相对地内旋转,即在保持键角ϕ (ϕ= 109°28') 不变的情况下,C 3可处于 C 1 - C 2旋转而成的圆锥的底圆边上的任何位置 (自由内旋转),同样C 4可处在C 2 - C 3旋转而成的圆锥的底圆边上的任何位置,以此类推(图1)。
这种由于围绕单键内旋转而产生的空间排布叫作构象。
高分子链是由成千上万个C-C 单键所组成,•每个单键又都可不同程度地内旋转。
这样,由于分子的热运动,分子中原子在空间的排布可随之不断变化而取不同的构象,表现出高分子链的柔性。
高分子链的柔性是高聚物分子长链结构的产物,是高聚物独特性能——高弹性的依据。
尽管实际高分子链中键角是固定的,内旋转也不是完全自由的,高分子链仍然能够由于内旋转而很大程度地卷曲(图2)。
分子越卷曲,相应的构象数目越多,构象熵就越大。
2024届武汉市重点中学高考化学试题命题比赛模拟试卷(10)含解析

2024届武汉市重点中学高考化学试题命题比赛模拟试卷(10)注意事项:1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
4.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中错误的是A.生成1 mol C5 H12至少需要4 mol H2B.该分子中所有碳原子在同一平面内C.三氯代物只有一种D.与其互为同分异构体,且只含碳碳三键的链烃有两种2、已知2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
该反应中有关物理量的描述正确的是(N A表示阿伏加德罗常数)()A.每生成6.72 L的H2,溶液中AlO2﹣的数目就增加0.2 N AB.每生成0.15 mol H2,被还原的水分子数目为0.3 N AC.当加入2.7 g Al时,转移的电子数目为0.3 N AD.溶液中每增加0.1 mol的AlO2﹣,Na+的数目就增加0.1 N A3、下列有关有机物的说法不正确的是()A.用于纺织的棉花和蚕丝的主要成分是纤维素B.氯乙烯、溴苯分子中的所有原子都处于同一平面上C.甲醛、乙炔、丙烯、裂化汽油都能使溴水和酸性KMnO4溶液褪色D.75%的乙醇溶液可用于医疗消毒,福尔马林可用于浸制生物标本,二者所含原理一样4、既发生了化学反应,又有电解质的溶解过程,且这两个过程都吸热的是A.冰醋酸与NaOH溶液反应B.KNO3加入水中C.NH4NO3加入水中D.CaO加入水中5、用下列实验装置进行相应实验,能达到实验目的的是A .用①装置除去CO 2中含有的少量SO 2B .用②装置蒸干饱和AlCl 3溶液制备AlCl 3晶体C .用③装置加热NH 4Cl 固体制取NH 3D .用④装置分离乙酸乙酯与水的混合液 6、已知:()()()23CO g 2H g CH OH g + 1ΔH 116kJ?mol -=-。
武汉大学分子模拟实验第七章分子结构模型创建和优化计算

武汉大学化学与分子科学学院《分子模拟实验》实验报告分子结构模型创建和优化计算指导老师:侯华姓名:陆文心专业:化学弘毅班学号:2012301040179日期:2014年9月25日一、实验目的无论哪种类型的计算或模拟,第一步的工作就是建模,就是创建所要研究的分子体系的三维空间模型。
这与平常所描绘的2D平面结构图不同,实际计算需要的是3D结构,每一个原子都需要三个空间坐标(x,y,z)。
因此,熟练掌握各种分子模型的创建,是计算化学最基础的技能。
实际的理论模拟计算,无论最终结果是什么,无论采用什么方法,都需要用户为所研究的分子体系提供一个合理的“初始猜测”结构,既是计算的需要,也是保证计算成功的前提之一。
当对一个新型分子体系知之甚少时,当缺乏实验数据参考时,怎么样使创建的分子模型更“合理”,也是进行本实验的目的。
本实验将介绍Chem3D提供的各种分子模型创建方法,同时介绍怎样调整、修改、显示所感兴趣的空间立体分子结构的技巧,直至满足用户的要求为止。
二、实验要求(1)熟悉Chem3D软件各项功能的含义;(2)掌握三维分子结构的创建方法;(3)掌握分子结构的调整和优化技巧;(4)了解复杂分子结构的创建和显示。
三、实验内容(1)建模:几种分子结构输入的方法;(2)处理:加氢饱和价键,加电荷;(3)优化:分子结构参数的最优化;(4)合理化:分子结构的确定。
7.1 建模的三种方式1. 分子式输入直接建模法问题7-1-1 采用该建模方法,尝试得到下列分子的正确结构:CO,CO2,NO2,NO3,C2N2,C2H6,C6H5OH,HCOOH,CH3COCH3,C2H5NO2,HNO3,H3PO4,H2CO3答:2. 化学键建模法3. 利用ChemDraw二维平面图建模4. 其它建模方式问题7-1-2 画“三键链”的结果是什么?答:结果为丙炔。
问题7-1-3 画出多个联苯环的共轭结构。
答:7.2 结构处理1. 加氢饱和价键2. 加电荷7-2-1 画出脯氨酸两种不同结构的分子骨架,并正确加氢、加电荷。
武汉大学 侯华 分子模拟实验报告 2 分子轨道与分析
3.模拟技巧
Origin 是一款功能很强大的数据处理软件, 要学会灵活使用, 找到菜单栏的各种指令,以及运用各种快捷键。基本思路就是想 对图中什么内容进行修改,就选中右键,会有对话框弹出。
9
3、CO 分子的 LUMO 轨道在总电子密度图上的映射
6
五、丙酸自由基电子自旋密度图
7
六、溶剂面(HIV 蛋白酶)
七、收获与感想 1.实验结论 优化构型后,NO 键长比 NO 短,能量比 NO 低。NO 比
NO 稳定。从分子轨道能级图也可以看出来。
+ +
2.理论方法
分子轨道是指分子中的单电子波函数, 一般由不同的原子轨 道相互重叠而成。对于定性分析分子的电性质,成键性质,分子 间相互作用以及化学反应活性, 分子轨道的组成和形状都起着重 要作用。掌握各种分子面的绘制和分析方法,能很好地处理分子 体系并了解分子性质。
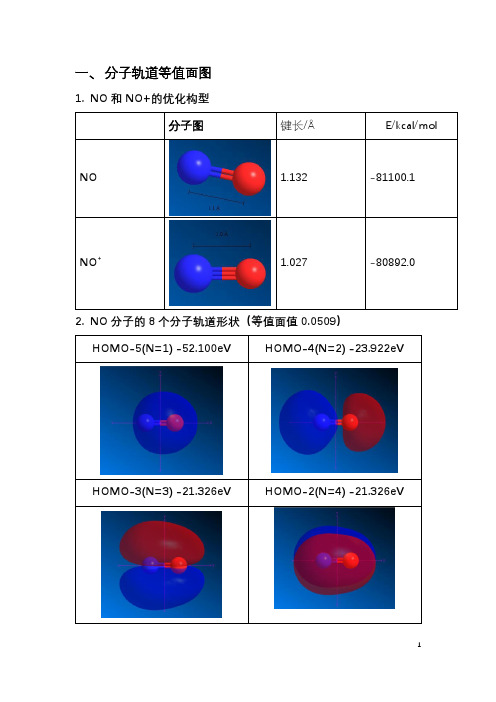
一、 分子轨道等值面图
1. NO 和 NO+的优化构型 分子图 键长/Å E/kcal/mol
NO
1.132
-81100.80892.0
2. NO 分子的 8 个分子轨道形状(等值面值 0.0509) HOMO-5(N=1) -52.100eV HOMO-4(N=2) -23.922eV
等值面值 总电子密度图
0.001
0.002
0.012
3
三、静电势图(等值面值 0.509,分辨率 32) 分子式 静电势图
CO
C2H6
C2H4
C2H2
4
NH2CH2COOH
HOOCCHNH2CH2CONH2
四、静电势、分子轨道对总电子密度的映射图 1.CO 分子在等电子密度面上静电势
武汉大学分子模拟实验作业综合实验

Spectral Analysis:
Vibration 1: Frequency = -920.48 T-Dipole = 0.5510 Travel = 0.0846 Reduced Masses = 2.3325 Effective Masses = 10.2247
114.911
HOMO-4
-22.024
-31.921
-19.809
LUMO+11
74.281
HOMO-5
-22.41
-43.94
-20.395
LUMO+10
237.766
70.667
HOMO-6
-26.313
-21.054
LUMO+9
206.472
60.713
HOMO-7
-28.079
-21.781
2、构象搜索与分子间长程相互作用
(1)计算丁二烯分子绕CCCC二面角转动的构象,确定稳定构型,并计算内转动的能垒高度
内转动能垒高度计算:
E(-100 °)= 8.66 kcal/mol
E(100 °)= 8.68kcal/mol
E(0°)= 2.27kcal/mol
能垒高度:
ΔE1=8.66-2.27= 6.39kcal/mol
C2H4---HOMO= -17.603 eVC2H4---LUMO= -0.416 eV
C6H10---HOMO= -14.873 eVC6H10---LUMO= -1.484 eV
分子轨道能量
C4H6/eV
C2H4/eV
C6H10/eV
武汉大学 侯华 分子模拟实验报告 1分子优化

一、优化常见分子1.0841.3651.7850.9431.3980.9421.0881.182 1.3221.184 1.5271.3161.212二、水的二聚体HF/6-31 -95409.0-95651.6-95871.6-110.4三、收获与感想1.实验结果C-H键长约为1.08 Å,O-H键长约为0.94 Å,C=O键长约为1.18 Å,C-F键长约为1.37 Å,C-Cl键长约为1.79 Å,碳碳单键约为1.53 Å,碳碳双键约为1.32 Å,碳碳三键约为1.21 Å,等等。
水的二聚体实验结果为氢键长度O-O大约为 2.9~3.0Å;氢键强度D~5.0 kcal/mol。
HF/6-31++G(d)方法的计算结果与实验数据最接近。
2.理论方法在求解Hartree-Fock-Roothaan方程时,可以把分子轨道向某一基组(basis set)展开,从而把非线性的微积分方程转化为一组代数矩阵方程,简化计算过程。
3.模拟技巧建模要迅速采用最简便的方法,不要浪费太多时间。
本次实验都是简单分子,都可以采用分子式输入直接建模法。
水的二聚体建模,可以直接输入两个水分子,灵活运用shift键,调整好两个水分子之间的距离(1.8 Å左右)以及取向,右键勾选显示氢键,即可。
每次计算之前都要检查一遍设置选项,特别是五个重要选项,以免运行错误。
文件以及截图保存的文件名命名需要有序且注明内容。
可采取数字编号+分子式的格式。
以免需要再次打开时难以寻找。
湖北省武汉市实验学校2019-2020学年高三化学模拟试题含解析

湖北省武汉市实验学校2019-2020学年高三化学模拟试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下:关于NM-3和D-58的叙述,错误的是A.都能与NaOH溶液反应,原因不完全相同B.都能与溴水反应,原因不完全相同C. 遇FeCl3溶液都显色,原因相同D. 都不能发生消去反应,原因相同参考答案:D略2. 用 N A表示阿伏加德罗常数,下列说法正确的是()A.1molOH-含有电子数为9N AB.在标准状况下,22.4L氯气含有原子数为N AC.常温常压下,4.6 g NO2气体含有6.02×1022个NO2分子D.0.1 mol Na2O2中,阴离子的个数为0.1N A参考答案:D略3. 可以大量共存的离子组是( )A.Na+、Fe2+、NO3-、Cl-B.K+、HCO3-、SO42-、OH-C.ClO-、Cl-、Na+、H+D.Ba2+、K+、SO42-、H+参考答案:A试题分析:离子间如果发生化学反应,则不能大量共存,反之可以。
A、四种离子间不反应,可以大量共存,A正确;B、氢氧根和碳酸氢根反应生成碳酸根和水,不能大量共存,B错误;C、次氯酸根与氢离子结合生成次氯酸分子,不能大量共存,C错误;D、钡离子与硫酸根结合生成硫酸钡沉淀,不能大量共存,D错误,答案选A。
4. 右图是一个一次性加热杯的示意图。
当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。
制造此加热杯可选用的固体碎块是A.硝酸铵 B.生石灰C.氯化镁 D.食盐参考答案:B解析:生成灰能与水放出大量的热。
5. X、Y、Z、W为四种短周期主族元素。
其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。
分子模拟与计算化学方法

分子模拟与计算化学方法在当今科技迅速发展的时代,分子模拟和计算化学方法已经成为研究和解决化学问题的重要工具。
通过模拟分子系统的结构、动力学和性质,人们能够更深入地理解化学反应机理、材料性能等关键问题。
本文将重点介绍分子模拟和计算化学方法的原理、应用及其在相关领域的拓展。
一、分子模拟的原理与方法1. 分子力场模拟分子力场模拟是分子模拟中最常用的方法之一。
它将分子中原子和键的相互作用近似为经典力场,通过求解牛顿运动方程来模拟分子系统的结构和性质。
常见的分子力场包括Amber势函数、CHARMM势函数等。
分子力场模拟适用于研究溶液性质、分子动力学等问题。
2. 量子力场模拟量子力场模拟是一种更精确的计算化学方法。
它通过考虑电子的波动性,利用量子力学原理来描述分子系统的结构和性质。
常见的量子力场方法包括密度泛函理论(DFT)、哈特里-福克(HF)等。
量子力场模拟适用于研究化学反应机理、电子结构等问题。
3. 分子动力学模拟分子动力学模拟是一种基于牛顿力学的模拟方法,可以模拟分子系统在特定条件下的动态行为。
通过求解分子中原子的运动方程,可以获得分子结构的变化过程、热力学性质等信息。
分子动力学模拟在研究固体材料、生物分子等领域具有广泛应用。
二、分子模拟的应用领域1. 材料科学分子模拟在材料科学领域中发挥着重要作用。
通过对材料性质进行模拟和优化,可以帮助科学家设计出更高效、稳定的材料。
例如,利用分子模拟可以研究催化剂的活性位点、孔结构等特性,从而提高催化剂的效率。
2. 药物研发分子模拟在药物研发过程中具有重要的作用。
科学家可以通过模拟分子与靶点的相互作用,预测药物的活性和选择性,从而指导药物设计和优化。
分子模拟还可以研究药物在体内的代谢过程,评估药物的毒性和药效。
3. 环境科学分子模拟在环境科学的研究中也发挥着关键作用。
通过模拟分子在溶液中的行为,可以研究污染物的分离、吸附、转化等过程,为环境保护和治理提供理论指导。
2024届湖北省武汉新区第一学校高考仿真模拟化学试卷含解析

2024届湖北省武汉新区第一学校高考仿真模拟化学试卷注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、选择题(每题只有一个选项符合题意)1、下列仪器不能加热的是()A.B.C.D.2、下列有关我国最新科技成果的说法中错误的是A.北斗卫星的太阳能电池板可将太阳能直接转化为电能B.国产飞机——C919使用的航空煤油可从石油中分馏得到C.高铁“复兴号”使用的碳纤维属于有机非金属材料D.极地考查船“雪龙2号”船身上镀的锌层可减缓铁制船体遭受的腐蚀3、某溶液中只可能含有K+、Al3+、Br-、OH-、CO、SO中的一种或几种。
取样,滴加足量氯水,有气泡产生,溶液变为橙色;向橙色溶液中加BaCl2溶液无明显现象。
为确定该溶液的组成,还需检验的离子是A.Br-B.OH-C.K+D.Al3+4、已知常温下,K a1(H2CO3)=4.3×10-7,K a2(H2CO3)=5.6×10-11。
某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是A.在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)B.等体积、等浓度的NaOH溶液与H2R溶液混合后,此溶液中水的电离程度比纯水小C.在pH=3的溶液中存在2-32-c(R)c(H R)=10c(HR)-⋅D.向Na2CO3溶液中加入过量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR-5、下列反应既属于氧化还原反应,又是吸热反应的是()A.灼热的炭与CO2的反应B .Ba(OH)2·8H 2O 与 NH 4Cl 的反应C .镁条与稀盐酸的反应D .氢气在氧气中的燃烧反应6、利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO (g )+2H 2(g )CH 3OH (g )反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。
武汉大学分子模拟实验作业第十章过渡态的优化

武汉大学分子模拟实验作业第十章过渡态的优化10-3-1采用GAMESS, HF/6-31G(d)计算反应物:气相:Total Energy = -313185.421886 Kcal/Mol溶剂化:Total Energy = -320855.0145 Kcal/Mol气相:Total Energy = -62343.3171 Kcal/Mol溶剂化T otal Energy =-62460.3983 Kcal/Mol反应物总能量:气相-313185.421886 Kcal/Mol+(-62343.3171 Kcal/Mol)=-375528.7389 Kcal/Mol 溶剂化后:-320855.0145 Kcal/Mol+(-62460.3983 Kcal/Mol)=-383315.4128Kcal/Mol 中间体1气相:Total Energy = -375552.4562 Kcal/Mol溶剂化:Total Energy = -544300.1875 Kcal/Mol过渡态气相:E= -375530.237194 Kcal/Mol溶剂化:E= -538290.9905 Kcal/Mol中间体2气相:E= -375611.0735 Kcal/Mol溶剂化:Total Energy = -544428.1875 Kcal/Mol 产物:气相:T otal Energy = -87245.465945 Kcal/Mol 溶剂化Total Energy = -87270.0137 Kcal/Mol气相:energy = -288356.67816 Kcal/Mol 溶剂化 energy = -288473.7594 Kcal/Mol 产物总能量:气相:-87245.465945+(-288356.67816)=-375602.1236 Kcal/Mol 溶剂化后:-87270.0137 +( -288473.7594)=-375743.7731Kcal/Mol气相反应势垒714-375570-375540BA-375528.7389-375552.4562-375530.237194-375611.0735-375602.1236F -+CH 3Cl FCH 3+Cl-中间体2中间体1TS溶剂化反应势垒0714-560000-480000-400000E /(K c a l /M o l )F -+CH 3Cl-383315.4128TS-538290.9905FCH 3+Cl--375743.7731采用Mopac,PM3方法计算气相:Total Energy = -11108.6433 Kcal/Mol溶剂化:Total Energy = -11109.9208 Kcal/Mol气相:Total Energy = -10139.2662 Kcal/Mol溶剂化:Total Energy = -10234.6847 Kcal/Mol反应物总能量:气相:-11108.6433+(-10139.2662)=-21247.9095 Kcal/Mol溶剂化后:-11109.9208+(-10234.6847)=-21344.6055 Kcal/Mol 中间体1:气相:Total Energy = -21258.0499 Kcal/Mol溶剂化:T otal Energy = -21340.9771 Kcal/Mol过渡态:气相:T otal Energy = -21252.5012 Kcal/Mol 溶剂化:Total Energy = -21320.1352 Kcal/Mol中间体2:气相:Total Energy = -21313.8820 Kcal/Mol 溶剂化:Total Energy = -21386.9799 Kcal/Mol产物:Total Energy = -13958.4182 Kcal/Mol溶剂化T otal Energy = -13959.8811 Kcal/Mol气相:Total Energy = -7348.6109 Kcal/Mol溶剂化:Total Energy = -7428.9169 Kcal/Mol 产物总能量:气相:-13958.4182+(-7348.6109)=-21307.0291 Kcal/Mol 溶剂化后:-13959.8811+(-7428.9169)=-21388.7980 Kcal/Mol气相反应势垒714-21300-21270-21240E /(K c a l /M o l )F -+CH 3Cl -21247.9095中间体1TS中间体2FCH 3+Cl--21258.0499-21252.5012 -21313.8820-21307.0291 溶剂化反应势垒714-21390-21360-21330E /(K c a l /M o l )F -+CH 3Cl TS FCH 3+Cl--21344.6055-21320.1352-21388.7980过渡态的优化1、甲酸和水分子形成的络合物的构型优化------------- GAMESS Interface ------------GAMESS Job: Minimize (Energy/Geometry) UHF/6-31G(d)Finish @ energy = -166150.964067 Kcal/Mol (-264.778634 Hartrees) ------------------------------------------2、尿素和水形成氢键------------ GAMESS Interface ------------GAMESS Job: Minimize (Energy/Geometry) UHF/6-31G(d)Finish @ energy = -188258.689979 Kcal/Mol (-300.009567 Hartrees) ------------------------------------------3、3O+2CH2OH平衡键长1.366------------ GAMESS Interface ------------GAMESS Job: Minimize (Energy/Geometry) UHF/6-31G(d)Finish @ energy = -118776.493623 Kcal/Mol (-189.282548 Hartrees) ------------------------------------------扫描----------- GAMESS Interface ------------GAMESS Job: Minimize (Energy/Geometry) UHF/6-31G(d)Finish @ energy = -46927.58803 Kcal/Mol (-74.783934 Hartrees)生成醛的过渡态:------------ GAMESS Interface ------------GAMESS Job: Optimize to Transition State UHF/6-31G(d)Finish @ energy = -118742.639222 Kcal/Mol (-189.228597 Hartrees)------------------------------------------过渡态的确定虚频为272.84 I1 2 3 4 5FREQUENCY: 272.84 I 208.13 26.24 15.82 13.97 REDUCED MASS: 10.74103 5.35183 8.27579 8.31406 8.05505 IR INTENSITY:5.18451 0.06758 0.01497 0.01009 0.034956 7 8 9 10FREQUENCY: 57.81 262.92 297.45 520.05 923.21 REDUCED MASS: 6.68774 3.17727 1.02681 4.63662 1.22834 IR INTENSITY: 0.08217 1.03754 2.85461 0.67520 0.0189411 12 13 14 15FREQUENCY: 1055.85 1157.41 1257.13 1438.30 1639.96 REDUCED MASS: 1.14502 1.25540 1.10513 1.88731 1.79969 IR INTENSITY: 0.17598 0.02378 0.44347 2.26790 1.1595016 17 18FREQUENCY: 3275.58 3389.89 3954.48REDUCED MASS: 1.05075 1.11678 1.06988IR INTENSITY: 0.11542 0.00404 0.58203心得体会:溶剂化效应(1)其相互作用:a.成键作用b.长程相互作用(2)对溶剂化效应的模拟可分为显式溶剂化模型及隐式溶剂化模型。
四川省乐山市武汉大学附属中学2022年高三化学模拟试题含解析

四川省乐山市武汉大学附属中学2022年高三化学模拟试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种。
为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba (NO3)2溶液,有白色沉淀产生。
下列推断正确的是()A、肯定有Al3+、Mg2+、NH4+、Cl-B、可能有K+、Cl-、MnO4-C、肯定有Al3+、Mg2+、SO42-D、肯定有K+、HCO3-、MnO4-参考答案:C略2. 用N A表示阿伏加德罗常数的值,下列叙述正确的是A.含有N A个氦原子的氦气在标准状况下的体积约为11.2 LB.25℃,1.01×105 Pa,64 g SO2中含有的原子数为3N AC.在常温常压下,11.2 L Cl2含有的分子数为0.5 N AD.标准状况下,11.2 L H2O含有的分子数为0.5 N A参考答案:B略3. 下列关于晶体的说法一定正确的是A.分子晶体中都存在共价键B.CaTiO3晶体中每个Ti4+与12个O2-相紧邻C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合D.金属晶体的熔点都比分子晶体的熔点高参考答案:B略4. 取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。
下列物质中不能满足上述结果的是()A.H2B.CO C.C6H12O6D.C12H22O11参考答案:答案:D5. 某品牌化妆品的主要成分Z具有美白功效,原从杨树中提取,现可用如下图所示反应合成。
下列对X、Y、Z的叙述,正确的是A. X、Y和Z均能和NaOH溶液反应B. X和Z均能和Na2CO3溶液反应,但不能和NaHCO3溶液反应C. Y既能发生加聚反应,也能发生缩聚反应D. Y分子中所有原子不可能共平面参考答案:B6. 能用能量判据判断下列过程的方向的是()A.水总是自发地由高处往低处流B.放热反应容易自发进行,吸热反应不能自发进行C.有序排列的火柴散落时成为无序排列D.多次洗牌以后,扑克牌的毫无规律的混乱排列的概率大参考答案:A略7. 下列叙述中正确的是()A.25°时,在pH=0的溶液中,NO3﹣、SO42﹣、I﹣、K+可以大量共存B.物质的量浓度相等的Na2CO3和NaHCO3溶液,其25°时,pH是pH(Na2CO3)<pH(NaHCO3)C.FeBr2溶液中通入少量Cl2时,离子方程式为2Br﹣+Cl2═2Cl﹣+Br2D.醋酸与NaOH发生中和反应时,当c(CH3COO﹣)=c(Na+)时,c(H+)=c(OH?)参考答案:D考点:离子共存问题;盐类水解的应用..专题:离子反应专题.分析:A.25°时,在pH=0的溶液中氢离子浓度为1mol/L,硝酸根离子在酸性条件下具有强氧化性,能够氧化碘离子;B.碳酸的酸性大于碳酸氢根离子,则碳酸氢钠的水解程度小于碳酸钠的,碳酸钠的碱性大于碳酸氢钠;C.氯气少量,亚铁离子还原性大于溴离子,所以亚铁离子优先反应;D.当c(CH3COO﹣)=c(Na+)时,根据电荷守恒可知c(H+)=c(OH?),溶液显示中性.解答:解:A.25°时,在pH=0的溶液中存在大量氢离子,NO3﹣在酸性条件下能够氧化I﹣,在溶液中不能大量共存,故A错误;B.物质的量浓度相等的Na2CO3和NaHCO3溶液,越弱越水解,碳酸的酸性大于碳酸氢根离子,则碳酸钠的水解程度大于碳酸氢钠,则溶液的pH大小为:(Na2CO3)>pH(NaHCO3),故B错误;C.FeBr2溶液中通入少量Cl2时,只有亚铁离子被氯气氧化,反应的离子方程式为:2Fe2++Cl2═2Cl﹣+2Fe3+,故C错误;D.醋酸与NaOH发生中和反应时,如果c(CH3COO﹣)=c(Na+),根据电荷守恒可知:c(H+)=c (OH?),故D正确;故选D.点评:本题考查离子共存、离子方程式的书写判断及盐的水解原理,该题是高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况、离子方程式的书写原则,能够根据电荷守恒判断溶液中离子浓度大小.8. 如图是锌、铜和稀硫酸形成的原电池,下列叙述不合理的是A.溶液中H+向Zn电极移动B.外电路中电流方向为:Cu→ZnC.负极上的电极反应:Zn-2e-===Zn2+D.有1 mol电子流过导线,则Cu电极上产生的H2为11.2 L(标准状况)参考答案:A略9. 草酸是二元弱酸,草酸氢钾溶液呈酸性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
武汉大学化学与分子科学学院《分子模拟实验》实验报告化学反应模拟指导老师:侯华姓名:陆文心专业:化学弘毅班学号:2012301040179日期:2014年11月13日、11月20日(周四下午)一、实验内容问题10-1-1仿照CH4的例子,计算甲基自由基(·CH3)的生成焓(与实验值35kcal/mol 比较)和生成自由能,可采用B3LYP/6-31G(d)理论方法。
①优化自由基结构,获得总能量:E(CH3) = -24977.699059 kcal/mol②在优化结构的基础上,用同一方法计算振动频率,在输出文件中找到:零点能为18.633681 kcal/mol,焓H为21.212 kcal/mol。
对焓进行零点能修正:H298K - H0K = H298K– ZPE = (21.212 - 18.633681) kcal/mol = 2.578319 kcal/mol③从输出文件中找到熵的数据S = 50.463 cal/(mol·K)。
④用同样的理论方法分别计算C 原子和H 原子的能量:E(C) = -23734.548073 kcal/molE(H) = -311.785384 kcal/mol⑤计算绝对零度下甲基自由基的生成焓:∆H f,0K⊝(M )=∑x∆H f,0K ⊝(X )atoms −(∑xE (X )atoms−E (M )−ZPE) = {(1×169.98 + 3×51.63) - [1×(-23734.548073) + 3×(-311.785384) - (-24977.699059) -18.633681]} kcal/mol= 35.7 kcal/mol⑥298K 时的生成焓,根据以下公式计算:∆H f,298K ⊝(M )=∆H f,0K ⊝(M )+(H M 298K −H M 0K )−∑x(H X 298K −H X 0K )std atoms= [35.7 + 2.578319 - (1×0.25+3×1.01)] kcal/mol= 35.0 kcal/mol与实验值(35 kcal/mol )符合得很好。
⑦根据下列公式计算298K 时的生成自由能:∆G f,298K ⊝=∆H f,298K ⊝−298.15K ×(S M ⊝−∑xS X ⊝atoms)= [35.0 - 298.15×(50.463 - 1×1.36 - 3×15.6)/1000] kcal/mol= 34.3 kcal/mol问题10-2 优化搜索过渡态。
1. CH 3CF 3解离生成CH 2CF 2和HF 的反应CH 3CF 3原始结构:经Mopac中的PM3方法优化的CH3CF3过渡态结构:CH3CF3经Mopac中的PM3方法优化后,总能量为-37028.8288 kcal/mol;过渡态经Mopac 中的PM3方法优化后,总能量为-36935.9551 kcal/mol。
故能垒高度为-36935.9551 - (-37028.8288) kcal/mol = 92.8737 kcal/mol。
虚频率为Vibration 1: Frequency = -1865.96,且只有这一个频率为负值,故此过渡态为真正的过渡态。
该反应的能量途径如下:2. 氢抽提反应初始猜测的CH4 +·OH反应的过渡态结构:经HF/6-31G(d)理论水平优化的CH4 +·OH反应的过渡态结构:CH4+·OH反应的过渡态经HF/6-31G(d)理论水平优化后,总能量为-72494.612299 kcal/mol;CH4经HF/6-31G(d)理论水平优化后,总能量为-25222.830261 kcal/mol;·OH经HF/6-31G(d)理论水平优化后,总能量为-47303.052783 kcal/mol。
故能垒高度为-72494.612299 - (-25222.830261 + -47303.052783) kcal/mol = 31.270745 kcal/mol。
虚频率为3176.97,且只有这一个频率后有“I”,故此过渡态为真正的过渡态。
该反应的能量途径如下:3. 乙醇脱水制备乙烯(Mopac中的PM3方法)乙醇原始结构:经Mopac中的PM3方法优化的乙醇过渡态结构:乙醇经Mopac中的PM3方法优化后,总能量为-14378.4277 kcal/mol;过渡态经Mopac 中的PM3方法优化后,总能量为-14314.2688 kcal/mol。
故能垒高度为-14314.2688 - (-14378.4277) kcal/mol = 64.1589 kcal/mol。
虚频率为Vibration 1: Frequency = -1358.83,且只有这一个频率为负值,故此过渡态为真正的过渡态。
该反应的能量途径如下:问题10-3-1仿照所给例子,计算另一个典型的S N2反应的机理和反应能量:F- + CH3Cl →FCH3 + Cl-采用Mopac,PM3方法,计算气相和水溶液中的反应过程。
气相条件下各物质的能量:氟离子------------ Mopac Interface ------------Mopac Job: PM3 1SCF CHARGE=-1 EF GEO-OK GNORM=0.100 MMOK SHIFT=80 Total Energy = -10139.2662 Kcal/MolFinished @ Heat of Formation = -31.23133 Kcal/Mol-----------------------------------------一氯甲烷------------ Mopac Interface ------------Mopac Job: PM3 1SCF CHARGE=0 EF GEO-OK GNORM=0.100 MMOK SHIFT=80 Total Energy = -11108.3099 Kcal/MolFinished @ Heat of Formation = -14.36279 Kcal/Mol-----------------------------------------一氟甲烷------------ Mopac Interface ------------Mopac Job: PM3 1SCF CHARGE=0 EF GEO-OK GNORM=0.100 MMOK SHIFT=80 Total Energy = -13957.9683 Kcal/MolFinished @ Heat of Formation = -53.37140 Kcal/Mol-----------------------------------------氯离子------------ Mopac Interface ------------Mopac Job: PM3 1SCF CHARGE=-1 EF GEO-OK GNORM=0.100 MMOK SHIFT=80 Total Energy = -7348.6109 Kcal/MolFinished @ Heat of Formation = -51.22723 Kcal/Mol-----------------------------------------过渡态------------ Mopac Interface ------------Mopac Job: PM3 1SCF CHARGE=-1 GEO-OK GNORM=0.100 MMOK SHIFT=80 TS Total Energy = -21251.6722 Kcal/MolFinished @ Heat of Formation = -49.69055 Kcal/Mol-----------------------------------------中间体1------------ Mopac Interface ------------Mopac Job: PM3 1SCF CHARGE=-1 EF GEO-OK GNORM=0.100 MMOK SHIFT=80 Total Energy = -21258.0508 Kcal/MolFinished @ Heat of Formation = -56.06918 Kcal/Mol-----------------------------------------中间体2------------ Mopac Interface ------------Mopac Job: PM3 1SCF CHARGE=-1 EF GEO-OK GNORM=0.100 MMOK SHIFT=80 Total Energy = -21312.7297 Kcal/MolFinished @ Heat of Formation = -110.74960 Kcal/Mol-----------------------------------------该反应的能量途径以及各中间体和过渡态的结构如下:能量途径(该图中的数据是用Heat of Formation计算的):中间体1:中间体2:过渡态:水溶液中各物质的能量:氟离子------------ Mopac Interface ------------Mopac Job: PM3 H2O UHF 1SCF CHARGE=-1 EF GEO-OK GNORM=0.100 MMOK SHIFT=80 EPS=78.39Total Energy = -10234.6847 Kcal/MolFinished @ Heat of Formation = -126.65220 Kcal/Mol-----------------------------------------一氯甲烷------------ Mopac Interface ------------Mopac Job: PM3 H2O 1SCF CHARGE=0 EF GEO-OK GNORM=0.100 MMOK SHIFT=80 EPS=78.39Total Energy = -11109.6254 Kcal/MolFinished @ Heat of Formation = -15.67850 Kcal/Mol-----------------------------------------一氟甲烷------------ Mopac Interface ------------Mopac Job: PM3 H2O 1SCF CHARGE=0 EF GEO-OK GNORM=0.100 MMOK SHIFT=80 EPS=78.39Total Energy = -13959.4741 Kcal/MolFinished @ Heat of Formation = -54.87734 Kcal/Mol-----------------------------------------氯离子------------ Mopac Interface ------------Mopac Job: PM3 H2O 1SCF CHARGE=-1 EF GEO-OK GNORM=0.100 MMOK SHIFT=80 EPS=78.39Total Energy = -7428.9169 Kcal/MolFinished @ Heat of Formation = -131.53526 Kcal/Mol-----------------------------------------过渡态------------ Mopac Interface ------------Mopac Job: PM3 H2O 1SCF CHARGE=-1 GEO-OK GNORM=0.100 MMOK SHIFT=80 TS EPS=78.39Total Energy = -21318.295 Kcal/MolFinished @ Heat of Formation = -116.31492 Kcal/Mol-----------------------------------------中间体1------------ Mopac Interface ------------Mopac Job: PM3 H2O 1SCF CHARGE=-1 EF GEO-OK GNORM=0.100 MMOK SHIFT=80 EPS=78.39Total Energy = -21340.4407 Kcal/MolFinished @ Heat of Formation = -138.46113 Kcal/Mol-----------------------------------------中间体2------------ Mopac Interface ------------Mopac Job: PM3 H2O 1SCF CHARGE=-1 EF GEO-OK GNORM=0.100 MMOK SHIFT=80 EPS=78.39Total Energy = -21385.0715 Kcal/MolFinished @ Heat of Formation = -183.09290 Kcal/Mol-----------------------------------------该反应的能量途径以及过渡态的结构如下:过渡态:能量途径(该图中的数据是用Total Energy计算的):二、收获与感想通过本次实验,我学会了使用RHF/DZV水平优化分子结构,并能在输出文件中找到振动频率,并能利用已有数据和优化得到的焓、熵等数据计算分子(包括自由基)的热力学量(生成焓与生成吉布斯自由能);通过对几个典型反应的过渡态的优化,学会了优化搜索过渡态的相关操作,能凭经验猜测过渡态的构型并用“Optimize to transition state”来优化,也通过查看输出文件中的频率来确定此过渡态是否是真正的过渡态;通过对一个S N2反应在气相和水溶液中的反应过程模拟,知道了同一个反应在不同环境下,其反应历程是不同的(溶剂化效应),并使用Origin作出了反应的能量途径。
