2020年高考化学工艺流程试题汇编
2020高考化学工艺流程专题训练
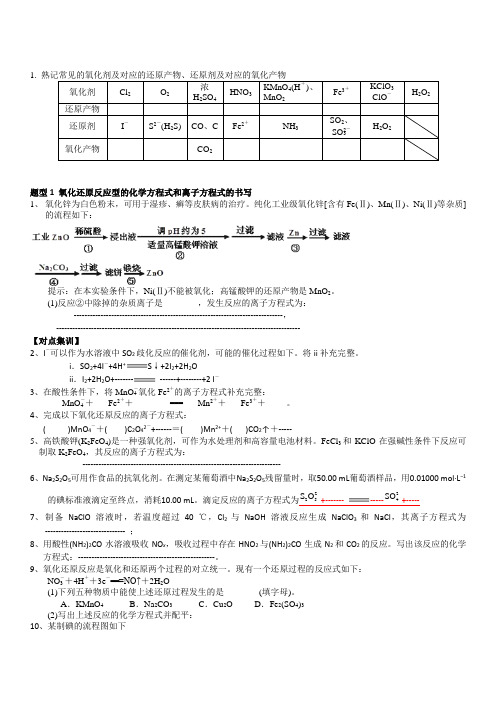
1. 熟记常见的氧化剂及对应的还原产物、还原剂及对应的氧化产物氧化剂Cl2O2浓H2SO4HNO3KMnO4(H+)、MnO2Fe3+KClO3ClO-H2O2还原产物还原剂I-S2-(H2S) CO、C Fe2+NH3SO2、SO2-3H2O2氧化产物CO2题型1 氧化还原反应型的化学方程式和离子方程式的书写1、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
(1)反应②中除掉的杂质离子是__ ,发生反应的离子方程式为:------------------------------------------------------------------------------,-------------------------------------------------------------------------------------------【对点集训】2、I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。
将ii补充完整。
i.SO2+4I-+4H+S↓+2I2+2H2Oii.I2+2H2O+-------------+--------+2 I-3、在酸性条件下,将MnO-4氧化Fe2+的离子方程式补充完整:-----MnO-4+-----Fe2++___-----__===-----Mn2++-----Fe3++-------。
4、完成以下氧化还原反应的离子方程式:( )MnO4-+()C2O42-+------=( )Mn2++( )CO2↑+-----5、高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。
FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:--------------------------------------------------------------------------6、Na2S2O5可用作食品的抗氧化剂。
全国新课标三卷高考化学工艺流程试题分类汇编

全国新课标三卷高考化学工艺流程试题汇编(新课标Ⅲ)2020新课标Ⅲ.某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni 、Al 、Fe 及其氧化物,还有少量其他不溶性物质。
采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO 4·7H 2O):溶液中金属离子开始沉淀和完全沉淀的pH 如下表所示:回答下列问题:(1)“碱浸”中NaOH 的两个作用分别是______________。
为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。
写出该反应的离子方程式______________。
(2)“滤液②”中含有的金属离子是______________。
(3)“转化”中可替代H 2O 2的物质是______________。
若工艺流程改为先“调pH”后“转化”,即“滤液③”中可能含有的杂质离子为______________。
(4)利用上述表格数据,计算Ni(OH)2的K sp =______________(列出计算式)。
如果“转化”后的溶液中Ni 2+浓度为1.0 mol·L −1,则“调pH”应控制的pH 范围是______________。
(5)硫酸镍在强碱溶液中用NaClO 氧化,可沉淀出能用作镍镉电池正极材料的NiOOH 。
写出该反应的离子方程式______________。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______________。
2020新课标Ⅲ.高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。
回答下列问题:相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
2020年高考化学专题复习 化学工艺流程题

2020年高考复习化学工艺流程题题型特点本题型以现代工业生产为基础,与化工生产成本、产品提纯、环境保护等相融合,考查物质的制备、检验、分离、提纯等基本实验原理在化工生产中的实际应用,要求考生依据流程图分析原理、紧扣信息、抓住关键、准确答题。
这类试题具有较强的实用性和综合性,能较好地考查学生信息获取能力、分析问题能力、语言表达能力和计算能力等。
突破点一化工工艺流程题的分析【解题策略】1.粗读试题(1)读题头,得目的。
题头一般是简单介绍该工艺生产的原材料和工艺生产的目的(包括副产品),以及提供需要用到的信息。
(2)读题干、析过程。
题干部分主要用框图形式将原料到产品的主要生产工艺流程表示出来。
题干信息有三个层次:读得懂的;读得不太懂但根据上下文可以勉强懂的;完全读不懂的。
关键是突破第二层次,对于读得不太懂但根据上下文可以勉强懂的部分需要学生运用已有的基础知识,根据学习过的化学反应原理,联系实际工业生产及题目信息等进行知识的整合,最终得到结论。
(3)读题尾、看措施:题尾主要是根据生产过程中涉及的化学知识设计成系列问题,构成一道完整的化学试题。
阅读题尾时要将设问中的提示性信息,用笔画出来,以便在后面精读试题时随时提醒自己与之联系。
2.精读试题在粗读试题的基础上,结合流程图以外的文字描述、表格信息、后续设问中的提示性信息,在流程图上随手画出相关信息,以便在解题时随时进行联系和调用;同时思考几个问题:从原料到产品依次进行了什么反应,利用了什么原理(氧化还原?溶解度?溶液中的平衡?),每一步操作进行到什么程度最佳,每一步除目标物质外还产生了什么杂质或副产物,杂质或副产物用什么方法除去等等,体会出题者设问的角度、意图。
只要掌握了这一题型的一般特点和解题策略,无论流程如何陌生复杂,在高考中即使遇到情境陌生的流程图题,也能够驾驭自如,迎刃而解。
1[2019·全国卷Ⅲ]高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图G2-1所示。
2020届高三化学大题练——化学工艺流程题
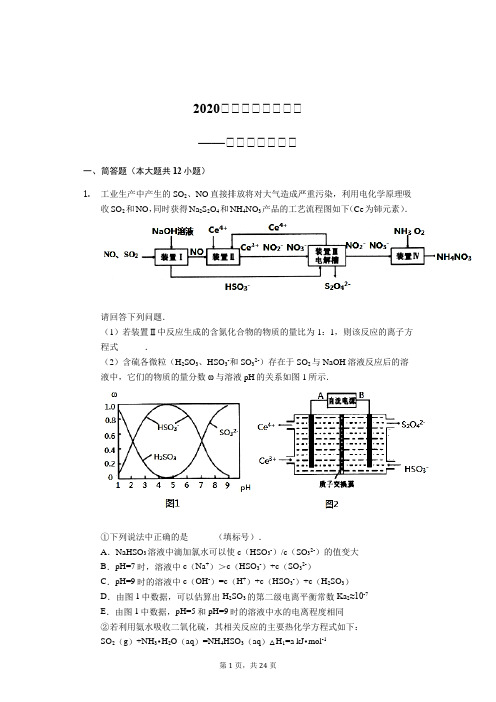
2020届届届届届届届届——届届届届届届届一、简答题(本大题共12小题)1.工业生产中产生的SO2、NO直接排放将对大气造成严重污染,利用电化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素).请回答下列问题.(1)若装置Ⅱ中反应生成的含氮化合物的物质的量比为1:1,则该反应的离子方程式______.(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.①下列说法中正确的是______(填标号).A.NaHSO3溶液中滴加氯水可以使c(HSO3-)/c(SO32-)的值变大B.pH=7时,溶液中c(Na+)>c(HSO3-)+c(SO32-)C.pH=9时的溶液中c(OH-)=c(H+)+c(HSO3-)+c(H2SO3)D.由图1中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7E.由图1中数据,pH=5和pH=9时的溶液中水的电离程度相同②若利用氨水吸收二氧化硫,其相关反应的主要热化学方程式如下:SO2(g)+NH3•H2O(aq)=NH4HSO3(aq)△H1=a kJ•mol-1NH3•H2O (aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=b kJ•mol-1 2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=c kJ•mol-1反应2SO2(g)+4NH3•H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)△H=______kJ•mol-1.③取装置Ⅰ中的吸收液VmL,用cmol/L的酸性高锰酸钾溶液滴定.吸收液溶液应装在______(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法______.(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.图中B为电源的______(填“正”或“负”)极.左侧反应室中发生的主要电极反应式为______.(4)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,该过程中转移电子数目为______.2.2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛.(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为______;(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:①操作Ⅰ的名称是______;操作Ⅱ为洗涤,洗涤操作的具体方法为______;②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式:______;(3)如果煅烧不充分,产品中将有FeO存在,称取3.0g氧化铁产品,溶解,在250mL 容量瓶中定容;量取25.00mL待测溶液于锥形瓶中,用酸化的0.01000mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00mL,①该实验中的KMnO4溶液需要酸化,用于酸化的酸是______(填字母序号).a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸②计算上述产品中Fe2O3的质量分数为______.3.某学习小组利用废旧电池拆解后的碳包滤渣(含MnO2、C、Hg2+等)制取硫酸锰晶体( MnSO4•H2O ),实验流程如下:已知:(1)25℃时,几种硫化物的溶度积常数如下:物质 FeS MnS HgS 溶度积 5×10-18 4.6×10-14 2×10-54(2)25℃时,几种金属氢氧化物沉淀时的PH 如下:Fe (OH )2 Fe (OH )3Mn (OH )2 开始沉淀时的PH 6.3 2.78.3 沉淀完全时的PH 8.43.7 9.8 请回答下列问题:(1)“浸取”时加热的作用是______;写出“浸取”时生成MnSO 4、Fe 2(SO 4)3 反应的离子方程式:______.(2)若“浸取”在25℃时进行,加入足量FeS ,则FeS (s )+Hg 2+(aq )⇌HgS (s )+Fe 2+ (aq )的平衡常数K 为______.(3)过滤I 过程中,需要使用的玻璃仪器有烧杯、______,滤渣I 的主要成分为FeS 、S 和______(化学式).(4)“氧化”时加入MnO 2 的作用是______,也可用H 2O 2 代替MnO 2 ,H 2O 2 的电子式为______.(5)“中和”过程,应该调节溶液PH 为______,写出该过程产生滤渣II 的离子方程式:______(6)获得MnSO 4•H 2O 的“一系列操作”是______、过滤、洗涤、干燥.(7)1150℃时,MnSO 4•H 2O 在氩气氛围中进行焙烧的分解产物是Mn 3O 4、硫的氧化物等,分解反应的化学方程式是:______,在MnSO 4•H 2O 进行焙烧时,除加热仪器外,还需要的仪器中主要成分属硅酸盐的有______.4. 草酸钴用途广泛,可用于指示剂和催化剂制备.一种利用水钴矿[主要成分为Co 2O 3,含少量Fe 2O 3、Al 2O 3、MnO 、MgO 、CaO 等]制取CoC 2O 4•2H 2O 工艺流程如图1:已知:①浸出液含有的阳离子主要有H +、Co 2+、Fe 2+、Mn 2+、Ca 2+、Mg 2+、Al 3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH 见表:沉淀物 Fe (OH )3 Fe (OH )2 Co (OH )2 Al (OH )3 Mn (OH )2完全沉淀的pH3.79.69.2 5.29.8(1)浸出过程中加入Na2SO3的目的是将______还原(填离子符号).(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为______.(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:______.(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是______;使用萃取剂适宜的pH是______.A.接近2.0 B.接近3.0 C.接近4.0(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知K sp(MgF2)=______.=7.35×10-11、K sp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)c(Ca2+)(6)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用cmol/L高锰酸钾溶液去滴定,当溶液由______(填颜色变化),共用去高锰酸钾溶液VmL(CoC2O4的摩尔质量147g/mol),计算草酸钴样品的纯度为______.5.图l表示“侯氏制碱法”工业流程,图2表示各物质的溶解度曲线.回答下列问题:(1)图中X的化学式为______ .(2)沉淀池中发生反应的化学方程式为______ ,该反应先向饱和食盐水中通入______ (填化学式)至饱和,再通入另一种气体,若顺序颠倒,后果是______ .(3)沉淀池的反应温度控制在30~35℃,原因是______ .(4)母液中加入CaO后生成Y的化学方程式为______ .(5)氯碱工业是指电解饱和食盐水,这里的碱是指______ (填化学式),其另外两种气体产物可以用于工业上制取纯硅,流程如图3:①整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应,写出该反应的化学方程式______ .②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%.则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是______ .6.Ⅰ.工业上常利用电解含有铁、钯、铜等金属的粗银棒精炼银,示意图如下:(1)阴极反应式为______。
2020年高考化学最新一模、二模试题分类汇编专题十一 工艺流程综合题(A型题组)(解析版)

2020年高考化学一模、二模试题分类汇编专题十一工艺流程综合题(A型题组)
高考命题动向预测:T
3、T5、T10
1.(东北三省三校2020届高三一模)工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如下:
已知:①VO3-+2H+ VO2++H2O
②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(1)高炉炼铁应用的冶炼方法是____(填标号)
A.热分解法B.热还原法C.电解法
(2)钒渣中的V2O3在焙烧时转化为Ca(VO3)2,写出该反应的化学方程式____________
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因____,浸出液中含钒物质的化学式为____________________________
(4)沉钒过程有气体生成,其反应的离子方程式为
_________________
(5)过滤后用乙醇代替水来洗涤沉淀的原因是__________________
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。
加热到200℃时,得到的固体物质化学式为____,300~350℃放出的气态物质化学式为____。
【答案】(1)B
(2)V2O3+O2+CaCO3Ca(VO3)2+CO2
(3)加入硫酸使VO3-+2H+ VO2++H2O中c(VO3-)降低,Ca(VO3)2溶解平衡
Ca(VO3)2(s)Ca2+(aq)+VO3-(aq)正向移动,Ca(VO3)2溶解(VO2)2SO4
1。
2020年高考化学5-6月最新全国卷模拟题汇编:化学工艺流程(附全解全析)
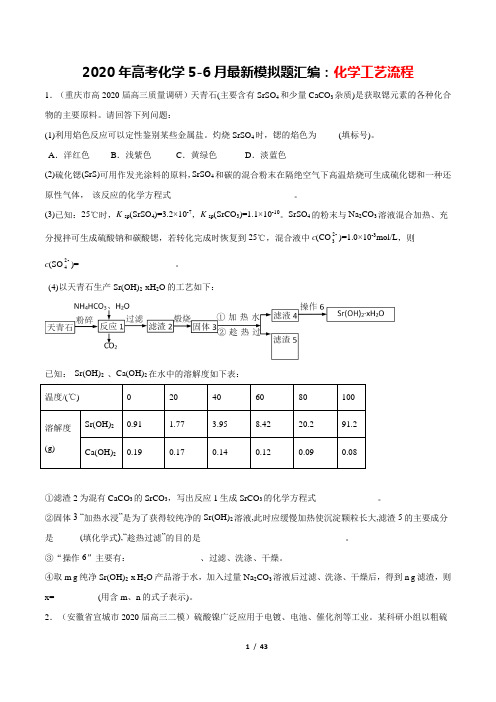
2020年高考化学5-6月最新模拟题汇编:化学工艺流程1.(重庆市高2020届高三质量调研)天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。
请回答下列问题:(1)利用焰色反应可以定性鉴别某些金属盐。
灼烧SrSO4时,锶的焰色为_____(填标号)。
A.洋红色B.浅紫色C.黄绿色D.淡蓝色(2)硫化锶(SrS)可用作发光涂料的原料,SrSO4和碳的混合粉末在隔绝空气下高温焙烧可生成硫化锶和一种还原性气体,该反应的化学方程式____________________________。
(3)已知:25℃时,K sp(SrSO4)=3.2×10-7,K sp(SrCO3)=1.1×10-10。
SrSO4的粉末与Na2CO3溶液混合加热、充分搅拌可生成硫酸钠和碳酸锶,若转化完成时恢复到25℃,混合液中c(CO2-3)=1.0×10-3mol/L,则c(SO2-4)=______________________。
(4)以天青石生产Sr(OH)2·xH2O的工艺如下:已知:Sr(OH)2、Ca(OH)2在水中的溶解度如下表:温度/(℃) 0 20 40 60 80 100溶解度(g) Sr(OH)20.91 1.77 3.95 8.42 20.2 91.2 Ca(OH)20.19 0.17 0.14 0.12 0.09 0.08①滤渣2为混有CaCO3的SrCO3,写出反应1生成SrCO3的化学方程式______________。
②固体3 “加热水浸”是为了获得较纯净的Sr(OH)2溶液,此时应缓慢加热使沉淀颗粒长大,滤渣5的主要成分是______(填化学式),“趁热过滤”的目的是_________________________________。
③“操作6”主要有:________________、过滤、洗涤、干燥。
④取m g纯净Sr(OH)2·x H2O产品溶于水,加入过量Na2CO3溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=__________(用含m、n的式子表示)。
2020高考化学工艺流程题特殊考点汇编
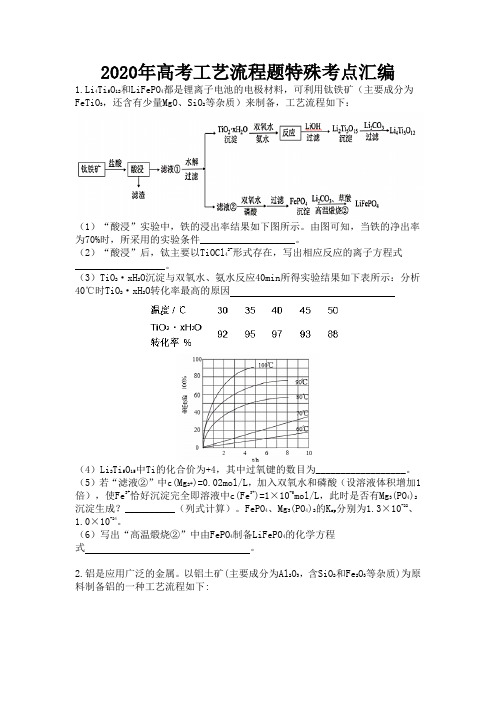
2020年高考工艺流程题特殊考点汇编1.Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:(1)“酸浸”实验中,铁的浸出率结果如下图所示。
由图可知,当铁的净出率为70%时,所采用的实验条件___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:分析40℃时TiO2·xH2O转化率最高的原因(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?__________(列式计算)。
FePO4、Mg3(PO4)2的K sp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式。
2.铝是应用广泛的金属。
以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________(填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。
2019-2020年高考化学复习备考工艺流程试题汇总
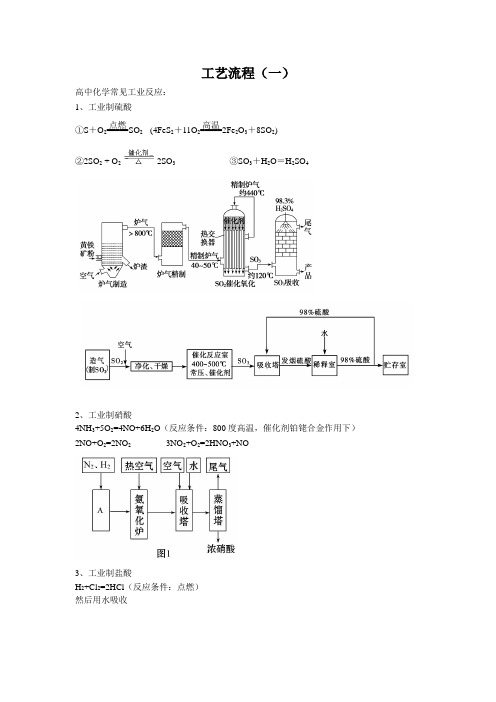
工艺流程(一)高中化学常见工业反应: 1、工业制硫酸①S +O 2=====点燃SO 2 (4FeS 2+11O 2=====高温2Fe 2O 3+8SO 2) ②2SO 2 + O 22SO 3 ③SO 3+H 2O =H 2SO 42、工业制硝酸4NH 3+5O 2=4NO+6H 2O (反应条件:800度高温,催化剂铂铑合金作用下) 2NO+O 2=2NO 2 3NO 2+O 2=2HNO 3+NO3、工业制盐酸H 2+Cl 2=2HCl (反应条件:点燃) 然后用水吸收4、工业制烧碱(氯碱工业)2NaCl+2H 2O=H 2+Cl 2+2NaOH (电解饱和食盐水)5、工业制取漂白粉(漂粉精)、漂白液 2Ca(OH)2+2Cl 2=CaCl 2+Ca(ClO)2+2H 2O 2 NaOH +Cl 2=NaCl+NaClO+H 2O6、工业制纯碱(侯氏).侯氏制碱法 NaCl +NH 3+CO 2+H 2O =NaHCO 3+NH 4Cl 1)NH 3+H 2O+CO 2=NH 4HCO 32)NH 4HCO 3+NaCl=NaHCO 3+NH 4Cl (NaHCO 3结晶析出) 3)2NaHCO 3=====△Na 2CO 3+CO 2↑+H 2O7、工业制金属铝2Al 2O 3===========950~970 ℃通电,Na 3AlF 64Al +3O 2↑利用反应 SiO 2+2C=====高温Si+2CO↑能得到不纯的粗硅。
粗硅需进行精制,才能得到高纯度硅。
首先,使Si 跟Cl 2起反应: Si+2Cl 2=SiCl 4(400 ℃~500 ℃)生成的SiCl4液体通过精馏,除去其中的硼、砷等杂质。
然后,用H 2还原SiCl 4: SiCl 4+2H 2=====高温Si+4HCl 这样就可得到纯度较高的多晶硅。
9.硅酸盐工业(制普通玻璃)生石灰 (高温煅烧石灰石) CaCO 3=====高温CaO+CO 2↑玻璃工业(玻璃窑法) Na 2CO 3 + SiO 2=====高温Na 2SiO 3 +CO 2↑ CaCO 3 + SiO 2=====高温CaSiO 3 +CO 2↑ 10.高炉炼铁3CO +Fe 2O 3=====高温2Fe +3CO 2 11.工业制取水煤气 C+H 2O=====高温CO+H 212.粗铜的精炼 电解:阳极用粗铜阳极:Cu -2e -=Cu 2+阴极:Cu 2++2e -=Cu 13、工业制氨气N 2(g)+3H 2(g) 2NH 3(g)注:催化剂为铁触媒MgCl 2(熔融)Mg +Cl 2↑15.海水提溴Cl 2+2Br -===2Cl -+Br 2Br 2+SO 2+2H 2O===2HBr +H 2SO 416.化石燃料的综合利用石油煤原料 原油煤 原理分馏、裂化、裂解干馏产品溶剂油、汽油、煤油、柴油、重油、润滑油、凡士林、乙烯、丙烯、丁烯等工艺流程(二)1.锌可作为食品锌强化剂的原料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
资料:TiCl4 及所含杂质氯化物的性质
化合物
SiCl4
TiCl4
AlCl3
FeCl3
MgCl2
沸点/℃
58
136
181(升华) 316
1412
熔点/℃
−69
−25
193
304
714
在 TiCl4 中的溶解 互溶
——
微溶
难溶
性
(1)氯化过程:TiO2 与 Cl2 难以直接反应,加碳生成 CO 和 CO2 可使反应得以进行。 已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1 ① 沸腾炉中加碳氯化生成 TiCl4(g)和 CO(g)的热化学方程式:_______________________。 ② 氯化过程中 CO 和 CO2 可以相互转化,根据如图判断:CO2 生成 CO 反应的 ΔH_____0(填 “>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的 HCl 和 Cl2 经吸收可得粗盐酸、FeCl3 溶液,则尾气的 吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗 TiCl4 混合液,则滤渣中含有_____________。
(2)精制过程:粗 TiCl4 经两步蒸馏得纯 TiCl4。示意图如下: 物质 a 是______________,T2 应控制在_________。 3.(15 分)
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣 3 应趁热过滤的原因是___________。
2.(13 分)
TiCl4 是由钛精矿(主要成分为 TiO2)制备钛(Ti)的重要中间产物,制备纯 TiCl4 的流程示意图如 下:
2017 年高考化学《工艺流程》试题汇编
1.以工业生产硼砂所得废渣硼镁泥为原料制取 MgSO4·7H2O 的过程如图所示: 硼镁泥的主要成分如下表:
MgO 30%~40%
SiO2 20%~25%
FeO、Fe2O3 CaO
5%~15%
2%~3%
Al2O3 1%~2%
B2O3 1%~2%
回答下列问题:
(1)“酸解”时应该加入的酸是_______,“滤渣 1”中主要含有_________(写化学式)。
文档从网络中收集,已重新整理排版.word 版本可编辑.欢迎下载支持. (2)滤渣 1 中含量最多的金属元素是____________,滤渣 2 的主要成分是_______________及含硅 杂质。 (3)步骤④调滤液 2 的 pH 使之变____________________(填“大”或“小”),原因是_________ (用离子方程式表示)。 (4)有关物质的溶解度如图所示。向“滤液 3”中加入适量 KCl,蒸发浓缩,冷却结晶,过滤得到 K2Cr2O7 固体。冷却到___________________(填标号)得到的 K2Cr2O7 固体产品最多。 a.80℃ b.60℃ c.40℃ d.10℃ 步骤⑤的反应类型是___________________。 (5)某工厂用 m1 kg 铬铁矿粉(含 Cr2O3 40%)制备 K2Cr2O7,最终得到产品 m2 kg,产率为 _____________。 4.(14 分) 水泥是重要的建筑材料。水泥熟料的主要成分为 CaO、SiO2,并含有一定量的铁、铝和镁等金属的 氧化物。实验室测定水泥样品中钙含量的过程如图所示: 回答下列问题: (1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的 目的是__________,还可使用___________代替硝酸。 (2)沉淀 A 的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为 ____________________________________。 (3)加氨水过程中加热的目的是___________。沉淀 B 的主要成分为_____________、____________ (填化学式)。 (4)草酸钙沉淀经稀 H2SO4 处理后,用 KMnO4 标准溶液滴定,通过测定草酸的量可间接获知钙的含
还含有少量 MgO、SiO2 等杂质)来制备,工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为 70%时,所采用
的实验条件为___________________。
(2)“酸浸”后,钛主要以 TiOCl42-形式存在,写出相应反应的离子方程式__________________。
量,滴定反应为:MnO
4
+H++H2C2O4→Mn2++CO2+H2O。实验中称取
0.400
g
水泥样品,滴定时消耗了
0.0500
mol·L-1 的 KMnO4 溶液 36.00 mL,则该水泥样品中钙的质量分数为______________。
5.(14 分)Li4Ti5O12 和 LiFePO4 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 FeTiO3,
重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 FeO·Cr2O3,还含有硅、 铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:
FeO·Cr2O3+Na2CO3+NaNO3 高温 Na2CrO4+ Fe2O3+CO2+ NaNO2 上述反应配平后 FeO·Cr2O3 与 NaNO3 的系数比为__________。该步骤不能使用陶瓷容器,原因是 ________________。
(3)TiO2·xH2O 沉淀与双氧水、氨水反应 40 min 所得实验结果如下表所示:
温度/℃
30
35
40
45
Байду номын сангаас
50
TiO2·xH2O 转化率%
92
95
97
93
88
分析 40 ℃时 TiO2·xH2O 转化率最高的原因__________________。
(4)Li2Ti5O15 中 Ti 的化合价为+4,其中过氧键的数目为__________________。 (5)若“滤液②”中 c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加 1 倍),使 Fe3+恰
