循环伏安及能级计算
循环伏安法定义+原理+参数设置

一、循环伏安法(Cyclic Voltammetry)一种常用的电化学研究方法。
该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法,可称之为“电化学的谱图”。
本法除了使用汞电极外,还可以用铂、金、玻璃碳、碳纤维微电极以及化学修饰电极等。
1.基本原理如以等腰三角形的脉冲电压加在工作电极上,得到的电流电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化波。
因此一次三角波扫描,完成一个还原和氧化过程的循环,故该法称为循环伏安法,其电流—电压曲线称为循环伏安图。
如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差。
循环伏安法中电压扫描速度可从每秒种数毫伏到1伏。
工作电极可用悬汞电极,或铂、玻碳、石墨等固体电极。
2.循环伏安法的应用循环伏安法是一种很有用的电化学研究方法,可用于电极反应的性质、机理和电极过程动力学参数的研究。
但该法很少用于定量分析。
(1)电极可逆性的判断循环伏安法中电压的扫描过程包括阴极与阳极两个方向,因此从所得的循环伏安法图的氧化波和还原波的峰高和对称性中可判断电活性物质在电极表面反应的可逆程度。
若反应是可逆的,则曲线上下对称,若反应不可逆,则曲线上下不对称。
(2)电极反应机理的判断循环伏安法还可研究电极吸附现象、电化学反应产物、电化学—化学耦联反应等,对于有机物、金属有机化合物及生物物质的氧化还原机理研究很有用。
3、循环伏安法的用途(1)、判断电极表面微观反应过程(2)、判断电极反应的可逆性(3)、作为无机制备反应“摸条件”的手段(4)、为有机合成“摸条件”(5)、前置化学反应(CE)的循环伏安特征(6)、后置化学反应(EC)的循环伏安特征(7)、催化反应的循环伏安特征二、循环伏安法相关问题:1、利用循环伏安确定反应是否为可逆反应(一般这两个条件即可)①.氧化峰电流与还原峰电流之比的绝对值等于1.[有时对同一体系,扫描速率不同也会在一定程度上影响其可逆性的一般而言,扫描速度对峰电位没有影响,但扫描速率越大其电化学反应电流也就越大.]②.氧化峰与还原峰电位差约为59/n mV, n为电子转移量(温度一般是293K).[但是一般我们实验时候不是在这个温度下,因此用这个算是有误差的,一般保证其值在100mv以下都算合理的误差.]2、判断扩散反应或者是吸附反应:改变扫描速率,看峰电流是与扫描速率还是它的二次方根成正比。
循环伏安及能级计算

实验设备与操作
01
3. 设置实验参数,如扫描速率、起始和终点电位等;
02
4. 开始实验,记录电流随电位变化的曲线;
03
5. 分析实验数据,得出结论。
应用领域与限制
应用领域
循环伏安法广泛应用于电化学反应机理研究、电极过程动力学参数测定、电催化剂活性评价等方面。
限制
循环伏安法与光电子能谱的 联用
将循环伏安法与光电子能谱相结合,可以获得电极 材料的光电性能和能级结构等信息。
循环伏安法与扫描隧道显 微镜的联用
通过将循环伏安法与扫描隧道显微镜相结合 ,可以实现原子尺度的电化学性能表征和调 控。
感谢您的观看
THANKS
分子轨道计算需要输入分子的 几何结构和总电荷数、总自旋 磁矩等参数,输出分子轨道能 量和波函数等信息。
电子跃迁能级差计算
01
电子跃迁能级差是指电子从某一能级跃迁到另一能级所需的能 量差值。
02
电子跃迁能级差可以通过分子轨道计算结果进行计算,也可以
通过实验测量获得。
电子跃迁能级差对于理解分子的电子结构和性质具有重要意义,
04
量子力学方法可以精确地描述电子的运动状态,但计 算量大;分子力学方法则可以大大简化计算过程,但 精度相对较低。
03
循环伏安曲线分析
氧化还原峰的识别
氧化峰
在循环伏安曲线上,氧化峰表现 为阳极电流随电位增加而增加的 峰,通常对应于电极材料发生氧 化反应的电位区间。
还原峰
还原峰表现为阴极电流随电位增 加而增加的峰,通常对应于电极 材料发生还原反应的电位区间。
电化学能源转换与储存
燃料电池
通过循环伏安法研究燃料电池的电化学反应过程,优化电极材料 和催化剂,提高电池性能和稳定性。
循环伏安及能级计算

用饱和甘汞电极(SCE)作参比电极,它相对于NHE电位为0.24eV ,则计算能级的公式为: EHOMO=eEox+4.5+0.24=eEox+4.74eV Eg=EHOMO-ELUMO 能还可以由吸收光谱得出隙:Eg= hc/λabs=1240/λabs LUMO=HOMO-Eg ELUMO=eEred+4.5+0.24=eEred+4.74eV
实例一:
The HOMO level for Ir(disppy)3 was estimated on the basis of an oxidation potential of 4.8eV(below vacuum level) for Fc/Fc+ .The onset potential of oxidation for Ir(disppy)3 was determined to be 0.60V (vs Ag/AgCl), corresponding to 0.50V(vs Fc/Fc+)
测氧化时,尽量每扫描一次,打磨一次电极,测出的峰型较好。 测还原时,先通一段时间氮气,然后再测的时候最好保持通氮气,但是不要使溶液有波动,吹 到表面即可,保持小瓶内正压,避免水气进入。 扫描还原时,一次扫描的效果可能不太好,峰型不好,可以扫多次(不是循环扫描,要区别), 扫一次保存一次,然后选其中峰型较好的峰作图。 HOMO= -[ Eox - E(Fc/Fc+) + 4.8 ] eV; LUMO= -[ Ered - E(Fc/Fc+) + 4.8 ] eV。
原理
能带理论中的带隙Eg指价带顶与导带底的能量之差,相应于最高占有分子轨道(HOMO)和最 低未占有分子轨道(LUMO)的能量之差。有机发光材料最高占有分子轨道上的电子失去所需的能 量相应于电离势Ip,此时有机发光材料发生了氧化反应;有机发光材料得到电子填充在最低未占有 分子轨道上所需的能量相应于电子亲合势EA,此时有机发光材料发生了还原反应
循环伏安及能级计算

测试方法
氧化:
所用溶剂为二氯甲烷(5ml),电解质(四丁基六氟磷酸铵)180mg,样品2mg;二氯甲烷经氢 化钙干燥,重蒸。
从图中看出在0.9V到1.1V之间有小的凸起,测试时延长通氮气时间,凸起没有消失,说明不是氧 气。有可能是二氯甲烷中的杂质。
仪器参数设置:High E=3V, Low E= 0V, Scan Rate(V/s)= 0.1, Segment=4, Smpl interval(V)= 0.001, Quiet Time(s)= 4, Sensitivity(A/V)=1e-4
还原:
所用溶剂为四氢呋喃(5ml),电解质(四丁基六氟磷酸铵)180mg,样品2mg;四氢呋喃 经金属钠干燥,二苯甲酮作指示剂,重蒸。
仪器参数设置:High E=0V, Low E= -3.5V, Scan Rate(V/s)= 0.1, Segment=4, Smpl interval(V)= 0.001, Quiet Time(s)= 4, Sensitivity(A/V)=1e-4
操作方便,并能同时给出有机光电材料的全部能带结构参数,因此应用最广泛。
原理
能带理论中的带隙Eg指价带顶与导带底的能量之差,相应于最高占有分子轨道(HOMO)和最 低未占有分子轨道(LUMO)的能量之差。有机发光材料最高占有分子轨道上的电子失去所需的能 量相应于电离势Ip,此时有机发光材料发生了氧化反应;有机发光材料得到电子填充在最低未占有 分子轨道上所需的能量相应于电子亲合势EA,此时有机发光材料发生了还原反应
循环伏安及能级计算

原理
能带理论中的带隙Eg指价带顶与导带底的能量之差,相应于最高占有分子轨道(HOMO)和最 低未占有分子轨道(LUMO)的能量之差。有机发光材料最高占有分子轨道上的电子失去所需的能 量相应于电离势Ip,此时有机发光材料发生了氧化反应;有机发光材料得到电子填充在最低未占有 分子轨道上所需的能量相应于电子亲合势EA,此时有机发光材料发生了还原反应
原理
一般通过测定有机物的氧化电位Eox以直接推算HOMO能级数值,再结合光谱或能谱法测 得的带隙Eg,间接计算出LUMO能级数值。
原理
标准氢电极(NHE)电位相对于真空能级为-4.5eV,所以由电化学结果计算能级的公式为: EHOMO=Ip=eEox+4.5 ELUMO=EA=eEred+4.5
实例:
Eox=0.91eV Ered=-1.39eV
The optical band gap is estimated from the onset of the absorption edge (MLCT) of the thin film.
Eox=0.59eV Ered=-1.43eV
J.Mater.Chem.,2006, 16,1281–1286
电化学及能级计算
目录
Contents
背景介绍 原理
实例分析
背景介绍
有机电致发光材料能带的准确测定对于有机电致发光器件的研究至关重要。 表征有机光电材料能带结构的方法: 紫外吸收光谱法,这种方法只能得到带隙值Eg ; 量化计算的方法,可得到材料的 HOMO和带隙值,只适于结构简单的材料; 光电子发射谱分析可以用于 HOMO的表征,但仪器尚未普及; 电化学方法 (如循环伏安法)兼有上述三种方法的优点,所用仪器设备简单, 操作方便,并能同时给出有机光电材料的全部能带结构参数,因此应用最广泛。
循环伏安法介绍

循环伏安法原理
当工作电极被施加的扫描电压 激发时,其上将产生响应电流。 以该电流(纵坐标)对电位 (横坐标)作图,称为循环伏 安图。典型的循环伏安图如 (Fig.1b)所示。
Fig.1(b) 循环伏安谱
循环伏安法原理
循环伏安图中的重要参数
阳极峰电流(ipa); 阴极峰电流(ipc) 阳极峰电位(φpa); 阴极峰电位(φpc);
确定 i p 的方法是:沿基线 做切线外推至峰下,从峰 顶做垂直线至切线,其间 高度即为ip ,φp可直接从 横轴与封顶对应处读取。
Fig.2
循环伏安法原理
峰电流方程式:
i p 2.6910 n AD v c
5 32 12 12
( 1 )
峰电势方程式:
RT φ p φ1 2 1.1 nF
而苯醌在较负的电位上被 还原为对苯二酚形成峰 3 。
循环伏安法的应用
再一次阳极扫描时,对苯二酚被氧化为苯醌,形成峰 4; 而峰5与峰1的过程相同,即对-氨基苯酚被氧化为对-亚氨 基苯醌。
为证明峰 3和峰 4是苯醌和对苯二酚的还原和氧化过程, 可制备对苯二酚的溶液作循环伏安图加以证实。
循环伏安法的应用
循环伏安法原理
Fig.1(a) 循环电位扫描
循环伏安法是以线性扫描 伏安法的电位扫描到头后,再 回过头来扫描到原来的起始电 位值,所得的电流-电压曲线为 基础的分析方法。其电位与扫 描时间的关系,如 (Fig.1a) 所 示,由图可知,扫描电压呈等 腰三角形。如果前半部扫描 (电压上升部分)为电活性组 分在电极上被还原的阴极过程, 则后半部扫描(电压下降部分) 为还原产物重新被氧化的阳极 过程。因此,一次三角波扫描 完成一个还原过程和氧化过程 的循环,故称为循环伏安法。
循环伏安及能级计算讲解学习

原理
在电化学池中当给工作电极施加一定的正电位相对于参比电极电位时,吸附在电极表面的有机 发光材料分子失去其价带上的电子发生电化学氧化反应,当施加更高的正电位时,电极表面上 电化学氧化反应继续进行。此时工作电极上有机发光材料发生电化学氧化反应的起始电位Eox即 对应于HOMO能级。同样地,当给工作电极施加一定的负电位相对于参比电极电位时,吸附在 电极表面的有机发光材料分子将在其导带上得到电子发生电化学还原反应,当继续增加此负电 位时电极表面上,电化学还原反应继续进行。此时工作电极上有机发光材料发生电化学还原反 应的起始电位Ered即对应于LUMO能级。
循环伏安及能级计算
目录
Contents
背景介绍 原理
实例分析 总结
背景介绍
有机电致发光材料能带的准确测定对于有机电致发光器件的研究至关重要。
表征有机光电材料能带结构的方法: 紫外吸收光谱法,这种方法只能得到带隙值Eg ; 量化计算的方法,可得到材料的 HOMO和带隙值,只适于结构简单的材料; 光电子发射谱分析可以用于 HOMO的表征,但仪器尚未普及; 电化学方法 (如循环伏安法)兼有上述三种方法的优点,所用仪器设备简单,
原 料:二茂铁(Fc)、待测样品
测试仪器
1红
铂丝对电极 CE
2绿
玻璃碳电极(工作电
极) WE
3白 Ag/Ag+(参比电极) RE
4
移液管
5
容量瓶
6
氮气
测试方法
➢三电极系统:
工作电极不 要过长(接绿线)
辅助电极(对电极):铂丝电极;(接红线) 参比电极:银电极(Ag/AgNO3—乙腈溶液),0.01M,避光密封。(禁止超声)(接白线)
实验步骤
循环伏安法
结果呢?用恒电位库仑法测得电金反应的电子数为 2。
通常,
和
判定哪个基团的还原。
还原时均获得2个电子,难以
抗痫灵的循环伏安图如图所示。 起始电位-0.70V (vs.Ag/ AgCl)。搅拌富集时间45s,正扫 得一尖形还原峰,Ep=-0.94V, 反扫无氧化峰(图a),表明电极过 程不可逆。当其它条件相同,正 扫至-1.02V处静止富集lmin时, 反扫也未发现峰(图b);静止富集 时间延长到2min。反扫仍无峰 (图 c)。
例如,四苯基叶啉(TPP) 溶于碳酸乙酰(MC)中,可 得到如图所示的循环伏安 图,出现两个电流响应, 一个是TPP被还原后的阴 离子再被氧化;另一个是 阳离子被还原后再被氧化。
两个电流响应信号表明。 反应得到的阴离子和阳离
图3.3
子均稳定,否则不会得到
循环伏安图上的两个峰.
又例如,由四个铁、 四个五茂环和四个一 氧化碳组成的金属有 机化合 物 ,如将其溶于乙 中,
可逆过程峰电位与标准电极电位的关系,可 由前式得到
标准电极电位等于两个峰电位之和两除以2。只要电极过程可逆,反应 产物稳定,用循环伏安法测定标准电极电位是很方便的。
3.2.2 电极过程产物的鉴别
循环伏安法不仅可发现、 鉴定电极过程的中间产物, 还可获得不少关于中间产 物电化学及其它性质的信 息。
图3.11 CdX-循环伏安图
以实验所得第一波(动力波)的峰电流ip实对按式
计则的i算消p实的耗/峰,ip电其理应流效与果ip理v相的无当比关于值。C与这dX扫相-速当直v于接作C在图d电X。-极如立上前刻还行离原C解d。以X-补离充解C反d2应+在速电率极很表大面, 这种情形应得图中虚线.但实际上,随v增加,峰电流比值下降,如图中
循环伏安法原理及结果分析

循环伏安法原理及结果分析一、循环伏安法的原理循环伏安法是通过控制工作电极的电位,在一个特定的电位范围内以一定的扫描速率进行循环扫描,同时测量电流随电位的变化。
在典型的循环伏安实验中,工作电极(如铂、金、玻碳等)、参比电极(如饱和甘汞电极、Ag/AgCl 电极等)和辅助电极(通常为铂丝)组成三电极体系,置于含有研究对象的电解质溶液中。
电位扫描通常从起始电位开始,向一个方向扫描到终止电位,然后反向扫描回到起始电位,形成一个完整的循环。
在扫描过程中,电极表面发生氧化还原反应,产生电流。
电流的大小与电极表面发生的电化学反应速率以及反应物和产物的浓度有关。
当电位逐渐增加时,若达到某种物质的氧化电位,该物质就会在电极表面发生氧化反应,产生氧化电流。
反之,当电位逐渐降低时,若达到某种物质的还原电位,该物质就会在电极表面发生还原反应,产生还原电流。
通过测量不同电位下的电流值,可以得到循环伏安曲线。
二、循环伏安曲线的特征循环伏安曲线通常呈现出峰形,包括氧化峰和还原峰。
氧化峰对应于物质的氧化过程,还原峰对应于物质的还原过程。
峰电流(ip)是循环伏安曲线中最重要的参数之一。
峰电流的大小与电活性物质的浓度、扫描速率、电极面积以及电化学反应的速率常数等因素有关。
一般来说,电活性物质的浓度越高,峰电流越大;扫描速率越快,峰电流也越大,但峰形可能会变得更尖锐;电极面积越大,峰电流也越大。
峰电位(Ep)是指峰电流对应的电位值。
氧化峰电位(Epa)和还原峰电位(Epc)之间的差值(ΔEp = Epa Epc)可以反映电化学反应的可逆性。
对于可逆的电化学反应,ΔEp 约为 59/n mV(n 为电子转移数);对于不可逆的电化学反应,ΔEp 通常较大。
此外,还可以通过循环伏安曲线计算出其他参数,如半峰电位(E1/2)、峰宽(W)等,这些参数对于分析电化学反应的性质也具有重要意义。
三、结果分析1、定性分析通过循环伏安曲线的峰电位,可以初步判断发生的电化学反应类型以及参与反应的物质。
循环伏安法

富集时间较长时,氧化峰和还原 峰峰电流ip与v呈线性关系,峰电 流iPc与v 呈线性关系,而与v1/2则 成偏离直线向上弯曲,表白电极 过程主要受动力学反应速率控制。
一种常用旳电化学研究措施。该法控制电极电势 以不同旳速率,随时间以三角波形一次或屡次反复扫 描,电势范围是使电极上能交替发生不同旳还原和氧 化反应,并统计电流-电势曲线。属于线性扫描伏安 法一种,循环伏安法旳原理与线性扫描伏安法相同, 只是比线性扫描伏安法多了一种回扫。
关键词:电势(鼓励信号);线性变化;三角波扫描; 电流(响应信号);电流-电势曲线
判断其控制环节
顺铂氧化峰还原峰峰电流与扫描速率旳1/2方成线性 关系,阐明电极过程主要受扩散控制。
一般低扫描 速度下,电 极受到动力 学反应控制 影响,高扫 描速度下电 极受到扩散 控制旳影响。
不同浓度控制环节不同,一般高浓度下,电 极受到动力学反应控制影响,低浓度下电极 受到扩散控制旳影响。
高斯法:合用于差示脉冲等具有高斯分布特征旳 曲线。措施:从起峰前一点向峰后一点拉直线,得 到峰电位Ep、峰电流ip和峰面积Ap数据。起峰前后 旳点一样能够调整。
CV图形解析
CV图形解析
1.3 循环伏安法研究电极旳可逆性
电极反应可逆指某个电极反应旳正向速度和逆向速度相等
Zn2 2e
Zn
对于Zn׀Zn2+电极,平衡指该状态下Zn2+还原速度与 n氧化速度相等,两个方向旳电子和物质互换速度相等。 意味着此时经过电极旳电流接近零。即所谓旳平衡状态,
两个连续过程那一种慢就是受那个控制 扩散控制:扩散过程速度较慢,为整个反应旳控制过
循环伏安法原理及结果分析

循环伏安(fúān)法原理及应用(yìngyòng)小结(xiǎojié) 1 电化学原理(yuánlǐ)1.1 电解池电解池是将电能转化(zhuǎnhuà)为化学能的一个装置,由外加电源,电解质溶液,阴阳电极构成。
阴极:与电源负极相连的电极(得电子,发生还原反应)阳极:与电源正极相连的电极(失电子,发生氧化反应)电解池中,电流由阳极流向阴极。
1.2 循环伏安法1)若电极反应为O+e-→R,反应前溶液中只含有反应粒子O,且O、R在溶液均可溶,控制扫描起始电势从比体系标准平衡电势(φ平)正得多的起始电势(φi)处开始势作正向电扫描,电流响应曲线则如图0所示。
图0 CV扫描电流响应曲线2)当电极电势逐渐负移到(φ平)附近时,O开始在电极上还原,并有法拉第电流通过。
由于电势越来越负,电极表面反应物O的浓度逐渐下降,因此向电极表面的流量和电流就增加。
当O的表面浓度下降到近于零,电流也增加到最大值Ipc,然后电流逐渐下降。
当电势达到(φr)后,又改为反向扫描。
3)随着电极电势逐渐变正,电极附近可氧化的R粒子的浓度较大,在电势接近并通过(φ平)时,表面上的电化学平衡应当向着越来越有利于生成R的方向发展。
于是R开始被氧化,并且电流增大到峰值氧化电流Ipa,随后又由于R的显著消耗而引起电流衰降。
整个曲线称为“循环伏安曲线”1.3 经典三电极体系经典三电极体系由工作电极(WE)、对电极(CE)、参比电极(RE)组成。
在电化学测试过程中,始终以工作电极为研究电极。
其电路原理如图1,附CV图(图2):扫描范围-0.25-1V,扫描速度50mV/S,起始电位0V。
图1 原理图图2 CBZ的循环伏安(fúān)扫描图图2所示CV扫描(sǎomiáo)结果为研究(yánjiū)电极上产生的电流随电位(di àn wèi)变化情况图。
循环伏安法

循环伏安法介绍循环伏安法(Cyclic Voltammetry,简称CV)是一种电化学测试方法,广泛应用于表征电化学反应的动力学、电化学过程的机理和电极材料的性质等方面。
该方法通过不断改变电极电位,并测量对应的电流,来获得电化学反应过程中的电化学信息。
原理循环伏安法基于电化学基础理论和法拉第定律,利用电极材料与电解质溶液之间的电化学反应,在电位范围内,通过施加正向和负向扫描电压,观察电流的变化,得到伏安图。
伏安图表示了电流与电极电位之间的关系,反映了电化学反应的动力学与热力学信息。
实验步骤1.准备工作:清洗电极并将其与计量电位仪连接好。
2.准备电解质溶液:根据实验需求,配置适当浓度的电解质溶液,并使用磁力搅拌器搅拌均匀。
3.实验设置:将电解质溶液注入电解池中,并使电极浸入其中。
根据需要,设置施加电压的扫描范围和扫描速率。
4.实验操作:打开计量电位仪,设置初始电位,并开始扫描。
仪器会逐渐改变电极电位,并记录对应的电流值。
5.数据处理:根据实验结果,绘制伏安图,并分析图形特征。
根据法拉第定律,可以计算电极反应的电荷转移系数、反应速率常数等参数。
应用循环伏安法在电化学和材料科学领域有着广泛的应用。
1.电化学催化研究:循环伏安法可以用于表征电化学催化剂的活性和稳定性,评估催化剂对某种电化学反应的催化效率。
2.电极材料研究:通过循环伏安法可以评估电极材料的电活性表面积、电荷传递速率以及与电解质溶液之间的界面反应。
3.电化学反应动力学研究:利用循环伏安法可以确定电极反应的控制步骤和反应机理,并研究电化学反应速率与温度、扫描速率等因素的关系。
优点和局限循环伏安法具有以下优点:•实验步骤简单,容易操作。
•可以快速获取材料的电活性表面积等信息。
•可以在不同电位下观察电化学反应的动力学与热力学变化。
然而,循环伏安法也存在一些局限性:•无法直接获得电化学反应的反应速率常数等定量信息。
•实验数据分析较为复杂,需要依赖理论模型和数学计算。
循环伏安及能级计算

EHOMO=eEox+4.5+0.24=eEox+4.74eV
ELUMO=eEred+4.5+0.24=eEred+4.74eV
Eg=EHOMO-ELUMO 能还可以由吸收光谱得出隙:Eg= hc/λabs=1240/λabs
LUMO=HOMO-Eg
测试前准备
需准备的仪器:铂丝对极、玻璃碳电极、Ag/Ag+电极、超声仪、吹风机、容量瓶、移液管、长针头、 废液桶,滴膜用注射器,气球(多只,鼓氮用)
0.8
potential vs Ag/Ag+(V)
HOMO=-(0.837+4.8-0.05)=-5.587eV
Eg=1240/λabs=1.98eV LUMO=-(5.587-1.98)=-3.607eV
0.0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
potential vs Ag/Ag+
λabs=625nm
3. 准备电极:玻璃碳电极(WE),铂丝对电极(CE),套装含Ag/AgNO3溶液的参比电极(RE)。
WE处理方法:首先,在玻璃砖上的圆纱布上垂直打磨(画“8”,0.05μm的铝粉和水作为摩 擦剂);其次,清水冲洗掉白铝,使用干净的丙酮超声1分钟,并用洗耳球吹干。
循环伏安法简介及数据分析

实验步骤
(3)分别以5mV•s-1、10mV·s-1、20 mV•s-1、 50 mV•s-1、80 mV•s-1、100 mV•s-1的扫描速 率对5mmol•L-1K3Fe(CN)6+0.5 mol•L-1KCl 体系进行循环伏安实验,求出Δp、Ipc、Ipa, 了解Ipc、Ipa、Δp与扫描速率的关系。
实验原理
(3)Δp=59/n(mV),并pc, pa与扫描 速度υ和无关,为一定值。 其中(2)与(3)是扩散传质步骤控制的 可逆体系循环伏安曲线的重要特征,是检测可 逆电极反应的最有用的判据。
仪器和药品
CHI660A电化学工作站1台;电解池1个; Pt盘电极(研究电极)、Pt片电极(辅助 电极)、饱和甘汞电极(参比电极)各1支。 不同浓度的K3Fe(CN)6溶液。
终止电位时,再反向回
归至某一设定的起始电
位,循环伏安法电位与
时间的关系为(见图a)
图a
实验原理
若电极反应为O+e
R,反应前溶液中只含
有反应粒子O、且O、R
在溶液均可溶,控制扫
描起始电势从比体系标
准平衡电势平0 正得多的
起始电势i处开始势作
正向电扫描,电流响应
图b
曲线则如图b所示。
实验原理
当电极电势逐渐负移到
实验步骤
(2)点击“T”(Technique)选中对话框 中“Cyclic Voltammetry”实验技术,点 击“OK”。点击“░”(parameters) 选择参数,“Init E”为0.5V,“High E” 为0.5V,“Low E”为-0.1V,“Initial Scan”为Negative,“Sensitivity”在扫 描速度大于10mV时选5×10-5,点击 “OK”。点击“►”开始实验。
循环伏安cv 计算电容

循环伏安cv 计算电容现今,电容器是电子工程中使用最广泛的一种元件,把它们用到各种电路中,以满足各种应用的需求。
然而,如何准确地确定电容器的容量是一个重要的问题,因为它们的容量决定了电路的性能。
在一些情况下,可以通过实验来测量电容器的容量,但这种方法不够精确,且耗费时间。
因此,开发一种比较准确的方法来测量电容器的容量是十分重要的。
伏安测量技术是计算并确定电容器容量的一种有效方法。
它是一种利用伏安效应来测量电容器容量的方法。
伏安效应指在交流电压下,电容器内电容量随着交流频率的增加而发生改变。
这意味着如果能够测量电容器在不同频率下的伏安值,就能够确定电容器的容量。
这就是伏安cv计算电容的基本原理。
伏安cv计算电容技术是由英国科学家吉尔伯特卢纳尔多夫在1964年发明的。
卢纳尔多夫指出:在给定的范围内,可以测量2个不同频率的伏安值,通过测量的这2个结果,就可以确定电容器的容量。
这也是伏安cv计算电容的基本原理。
伏安cv计算电容技术为循环伏安法,与其他常见的电容容量测量方法相比,更加精确、快捷且稳定可靠,在实际应用中效果较好。
首先,它可以准确测量电容器的容量,因此可以有效控制电路的性能。
此外,由于可以循环使用伏安cv计算电容,因此在不断变化的电容器容量值的情况下,可以获得和伏安cv测量法一致的结果。
从技术上而言,伏安cv计算电容主要包括以下几个步骤:1.置交流电源,并测量电容器一次通过一段时间后的电流和电压;2.置调节器,测量不同频率的电容器一次通过一段时间后的电流和电压;3.过测量第2步中不同频率时的电容器伏安值,计算电容器的容量;4.过调节调节器,不断调整调节器的相位,循环重复第2步和第3步的操作,以获得不同频率下的电容器容量。
最后,伏安cv计算电容技术因其精确、快捷、稳定可靠的特点,在电子工程中应用得越来越广泛,可以有效地缩短电容容量测量的时间,提高电路的性能。
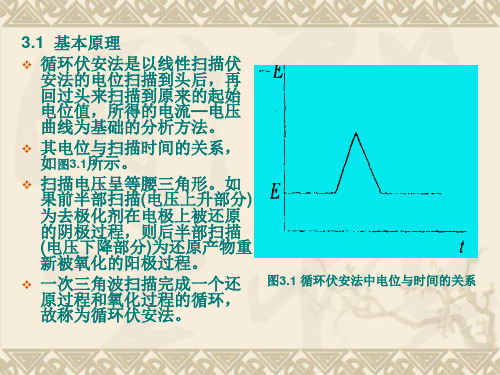
循环伏安法定义+原理+参数设置

循环伏安法定义+原理+参数设置一、循环伏安法(Cyclic Voltammetry)一种常用的电化学研究方法。
该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法,可称之为“电化学的谱图”。
本法除了使用汞电极外,还可以用铂、金、玻璃碳、碳纤维微电极以及化学修饰电极等。
1.基本原理如以等腰三角形的脉冲电压加在工作电极上,得到的电流电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化波。
因此一次三角波扫描,完成一个还原和氧化过程的循环,故该法称为循环伏安法,其电流—电压曲线称为循环伏安图。
如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差。
循环伏安法中电压扫描速度可从每秒种数毫伏到1伏。
工作电极可用悬汞电极,或铂、玻碳、石墨等固体电极。
2.循环伏安法的应用循环伏安法是一种很有用的电化学研究方法,可用于电极反应的性质、机理和电极过程动力学参数的研究。
但该法很少用于定量分析。
(1)电极可逆性的判断循环伏安法中电压的扫描过程包括阴极与阳极两个方向,因此从所得的循环伏安法图的氧化波和还原波的峰高和对称性中可判断电活性物质在电极表面反应的可逆程度。
若反应是可逆的,则曲线上下对称,若反应不可逆,则曲线上下不对称。
(2)电极反应机理的判断循环伏安法还可研究电极吸附现象、电化学反应产物、电化学—化学耦联反应等,对于有机物、金属有机化合物及生物物质的氧化还原机理研究很有用。
循环伏安法

原理: 循环伏安法(CV)是最重要的电分析化学研究方法之一。该方法使用的仪器 简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许 多 研究领域被广泛应用。 循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极), 一支参比电极(监测工作电极的电势),一支辅助(对)电极。外加电压加在工作 电极与辅助电极之间,反应电流通过工作电极与辅助电极。 对可逆电极过程(电荷交换速度很快),如一定条件下的 Fe(CN)63-/4-氧化还原 体系,当电压负向扫描时,Fe(CN)63- 在电极上还原,反应为: Fe(CN)63-+e- → Fe(CN)64- 得到一个还原电流峰。当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为: Fe(CN)64- - e- → Fe(CN)63- 得到一个氧化电流峰。所以,电压完成一次循环扫描后,将记录出一个如图 2 所示 的氧化还原曲线。扫描电压呈等腰三角形。如果前半部扫描(电压上升部分)为去极
ip.a / ip.c ≈ 1
表 1 可逆 性的判据
可逆体系循环伏安法特点: 1. iP 与本体溶液浓度 C 成正比。 2. iP 与υ1/2 成正比,扫描速度越快,流过的 iP 越大。和使用汞电极的极谱分析法中 的极限电流 iP 相比,iP ≈8.7υ1/2 il 。所以当υ=1V/s 时,用循环伏安法可以得到 大约大十倍左右的电流值。 3. EP 与υ和 C 无关,是一定值,偏离 E1/2 仅 28.50/n[mV]。 4. iP 与电极的面积 A 和扩散系数的平方根 D1/2 成正比。 5. iP 与反应电子系数 n 的 n3/2 成正比(极谱分析和旋转圆盘电极中 i 正比于 n) 非可逆体系的循环伏安法特点: 1. 峰电流 ip = 299(αnα)1/2AD1/2υ1/2C (25℃)可知 ip 正Байду номын сангаас于 C(和可逆体系一 样)。 ip 与电位扫描速度υ1/2 成正比。(和可逆体系一样)。如果 n、D、A 等已 知,可以通过上式求出αnα n F 1 / 2 RT D1 / 2 [0.780 ln( ) ln( ) ] 2. 峰电位ΔEp= E1 / 2 n S RT =EP/2-Ep=(1.857RT)/αnαF=47.7/αnα[mv](25℃) 可知 Ep 的大小与扫描速度有关。 当进行还原反应时, Ep 越大越向负电位方向偏 移。 在 25℃时, αnα=1 时, 扫描速度υ增大 10 倍, EP 往负方向的偏移大约 30mV。 Κs 越小,EP 和 E1/2 的偏差越大。Ep - EP/2 的差与υ和 C 无关。υ一定时,Ep 与 C 无关。 3. αnα可以按 ip =299(αnα)1/2AD1/2υ1/2C 求得,以 ip 对υ1/2 作图。αnα和Κs 可以改变υ(在三个数量级的范围内),求出 ip 和 EP 以下式 logip 和 EP 作图
循环伏安及能级计算

测氧化时,尽量每扫描一次,打磨一次电极,测出的峰型较好。 测还原时,先通一段时间氮气,然后再测的时候最好保持通氮气 通氮气,但是不要使溶液有波动,吹 通氮气 到表面即可,保持小瓶内正压,避免水气进入。 扫描还原时,一次扫描的效果可能不太好,峰型不好,可以扫多次 扫多次(不是循环扫描,要区别), 扫多次 扫一次保存一次,然后选其中峰型较好的峰作图。 HOMO= -[ Eox - E(Fc/Fc+) + 4.8 ] eV; ; red - E(Fc/Fc+) + 4.8 ] eV。 LUMO= -[ E 。
原理
能带理论中的带隙Eg指价带顶与导带底的能量之差,相应于最高占有分子轨道(HOMO)和最 低未占有分子轨道(LUMO)的能量之差。有机ቤተ መጻሕፍቲ ባይዱ光材料最高占有分子轨道上的电子失去所需的能 量相应于电离势Ip,此时有机发光材料发生了氧化反应;有机发光材料得到电子填充在最低未占有 分子轨道上所需的能量相应于电子亲合势EA,此时有机发光材料发生了还原反应
测试方法
三电极系统: 三电极系统: 工作电极:铂碳电极,用时要用铝粉打磨;轻拿轻放,禁摔。可以超声除去表面杂质,但超声时间不 要过长(接绿线) 辅助电极(对电极):铂丝电极;(接红线) 参比电极:银电极(Ag/AgNO3—乙腈溶液),0.01M,避光密封。(禁止超声)(接白线)
实验步骤
1. 准备 使用的溶剂 准备CV使用的溶剂 使用的溶剂:还原过程使用THF,氧化过程使用DCM;THF需要钠丝泡过,并回流; DCM需要使用CaH2回流24小时才能使用。(现为回流2小时,即现蒸现用) 2. Ag/AgNO3溶液的参比电极(RE)制备:称取AgNO3(分析纯,黑色包装,进口)9.8mg; 溶液的参比电极( )制备: 溶液的参比电极 (应在黑色包装中称取AgNO3,以防AgNO3见光分解)在棕色瓶中将AgNO3加入5.8ml乙腈溶剂 (HPLC)配成浓度为0.01mol/L的溶液,并用锡纸包起来。(AgNO3溶液放置在阴凉环境下) 3. 准备电极:玻璃碳电极(WE),铂丝对电极(CE),套装含Ag/AgNO3溶液的参比电极(RE)。 准备电极: WE处理方法:首先,在玻璃砖上的圆纱布上垂直打磨(画“8”,0.05µm的铝粉和水作为摩 处理方法: 处理方法 擦剂);其次,清水冲洗掉白铝,使用干净的丙酮超声1分钟,并用洗耳球吹干。 CE处理方法:使用水和丙酮冲洗干净,凉干。 处理方法: 处理方法 RE处理方法:如果使用时间过长,更换Ag/AgNO3溶液(溶液量一般为电极长度的2/3),有 处理方法: 处理方法 机溶剂将表面冲洗干净,凉干(不能使用超声超洗)。 三个电极使用前再使用氮气吹扫。 三个电极使用前再使用氮气吹扫。
循环伏安法原理及结果分析

循环伏安法原理及结果分析循环伏安法(Cyclic voltammetry,CV)是一种电化学分析方法,常用于研究电极上的化学和电化学反应以及物质的电化学行为。
它通过改变电极电位并测量所引起的电流变化,得到一个电流-电压(I-V)曲线,从而分析电化学反应的特性和机理。
CV实验通常使用一个工作电极、一个参比电极和一个辅助电极的电化学电池。
工作电极是用来进行电化学反应的电极,参比电极用来测量工作电极与参比电极之间的电位差,辅助电极用来提供能量以促进电化学反应的进行。
实验中,通过改变工作电极的电位,可以在电化学电池中引起氧化还原反应。
结果是电流的变化,这个变化被记录下来以产生I-V曲线。
CV实验中的结果分析包括几个方面:1.反应的电位范围:通过改变工作电极的电位扫描范围,可以确定反应的电位范围。
通常将电位从一个初始电位线性地扫描到另一个终止电位,然后再返回到初始电位。
扫描速率和电位范围的选择取决于所研究的电化学反应和物质的性质。
2.峰电位和峰电流:CV曲线通常包含多个峰,每个峰对应于一个电化学反应。
峰电位是峰的中心电位,表示氧化和还原反应的临界电位。
峰电流是峰的最大电流值,表示反应速率和物质浓度的关系。
通过测量峰电位和峰电流,可以确定反应的动力学和热力学参数。
3.峰形:CV曲线的峰形可以提供有关反应机理的信息。
对于可逆反应,峰电流正比于扫描速率;对于不可逆反应,峰电流与扫描速率无关。
峰形也可以显示反应的控制步骤,如扩散控制、电极控制或混合控制。
4.电化学反应的类型:通过分析CV曲线的形状和特征,可以确定电化学反应的类型。
例如,CV曲线中的一个峰表示一个氧化还原反应,而CV曲线中的两个峰表示一个两步反应。
5.物质的电化学行为:CV实验也可以用来研究物质在电极上的电化学行为。
通过改变溶液pH、阳离子或阴离子的浓度,可以观察到电化学反应的变化。
此外,还可以测量不同溶液中的CV曲线并进行比较,以了解物质在不同环境中的电化学性质。
循环伏安法定义+原理+参数设置

一、循环伏安法(Cyclic Voltammetry)一种常用的电化学研究方法。
该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法,可称之为“电化学的谱图”。
本法除了使用汞电极外,还可以用铂、金、玻璃碳、碳纤维微电极以及化学修饰电极等。
1.基本原理如以等腰三角形的脉冲电压加在工作电极上,得到的电流电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化波。
因此一次三角波扫描,完成一个还原和氧化过程的循环,故该法称为循环伏安法,其电流—电压曲线称为循环伏安图。
如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差。
循环伏安法中电压扫描速度可从每秒种数毫伏到1伏。
工作电极可用悬汞电极,或铂、玻碳、石墨等固体电极。
2.循环伏安法的应用循环伏安法是一种很有用的电化学研究方法,可用于电极反应的性质、机理和电极过程动力学参数的研究。
但该法很少用于定量分析。
(1)电极可逆性的判断循环伏安法中电压的扫描过程包括阴极与阳极两个方向,因此从所得的循环伏安法图的氧化波和还原波的峰高和对称性中可判断电活性物质在电极表面反应的可逆程度。
若反应是可逆的,则曲线上下对称,若反应不可逆,则曲线上下不对称。
(2)电极反应机理的判断循环伏安法还可研究电极吸附现象、电化学反应产物、电化学—化学耦联反应等,对于有机物、金属有机化合物及生物物质的氧化还原机理研究很有用。
3、循环伏安法的用途(1)、判断电极表面微观反应过程(2)、判断电极反应的可逆性(3)、作为无机制备反应“摸条件”的手段(4)、为有机合成“摸条件”(5)、前置化学反应(CE)的循环伏安特征(6)、后置化学反应(EC)的循环伏安特征(7)、催化反应的循环伏安特征二、循环伏安法相关问题:1、利用循环伏安确定反应是否为可逆反应(一般这两个条件即可)①.氧化峰电流与还原峰电流之比的绝对值等于1.[有时对同一体系,扫描速率不同也会在一定程度上影响其可逆性的一般而言,扫描速度对峰电位没有影响,但扫描速率越大其电化学反应电流也就越大.]②.氧化峰与还原峰电位差约为59/n mV, n为电子转移量(温度一般是293K).[但是一般我们实验时候不是在这个温度下,因此用这个算是有误差的,一般保证其值在100mv以下都算合理的误差.]2、判断扩散反应或者是吸附反应:改变扫描速率,看峰电流是与扫描速率还是它的二次方根成正比。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
测试方法
二茂铁电极电势测定: 所用溶剂为二氯甲烷(5ml),电解质(四丁基六氟磷酸铵)180mg,样品2mg;二茂铁(5mg)
仪器参数设置:High E=1V, Low E= -0.5V, Scan Rate(V/s)= 0.1, Segment=4, Smple interval (V)= 0.001, Quiet Time(s)= 4, Sensitivity(A/V)=1e-4
测试方法
氧化: 所用溶剂为二氯甲烷(5ml),电解质(四丁基六氟磷酸铵)180mg,样品2mg;二氯甲烷经氢 化钙干燥,重蒸。 从图中看出在0.9V到1.1V之间有小的凸起,测试时延长通氮气时间,凸起没有消失,说明不是氧 气。有可能是二氯甲烷中的杂质。 仪器参数设置:High E=3V, Low E= 0V, Scan Rate(V/s)= 0.1, Segment=4, Smpl interval(V)= 0.001, Quiet Time(s)= 4, Sensitivity(A/V)=1e-4 还原:
Inorganica Chimica Acta.362(2009)5017–5022
实例八:
Dyes and Pigments.83(2009)218–224
总结
常用的电解质:四丁基高氯酸铵(TBAP)或 四丁基六氟磷酸盐等 常用的溶剂:无水 乙腈(AN)、DMF、DMSO、DCM、THF、氯仿等 参比电极:玻璃碳电极、SCE、Ag/AgCl、Ag/Ag+
实例一:
The HOMO level for Ir(disppy)3 was estimated on the basis of an oxidation potential of 4.8eV(below vacuum level) for Fc/Fc+ .The onset potential of oxidation for Ir(disppy)3 was determined to be 0.60V (vs Ag/AgCl), corresponding to 0.50V(vs Fc/Fc+)
测氧化时,尽量每扫描一次,打磨一次电极,测出的峰型较好。 测还原时,先通一段时间氮气,然后再测的时候最好保持通氮气,但是不要使溶液有波动,吹 到表面即可,保持小瓶内正压,避免水气进入。 扫描还原时,一次扫描的效果可能不太好,峰型不好,可以扫多次(不是循环扫描,要区别), 扫一次保存一次,然后选其中峰型较好的峰作图。 HOMO= -[ Eox - E(Fc/Fc+) + 4.8 ] eV; LUMO= -[ Ered - E(Fc/Fc+) + 4.8 ] eV。
N+ F F B- F F tetrabutyl ammonium fluoroborate C16H36BF4N Mass: 329.29
原 料:二茂铁(Fc)、待测样品
测试仪器
1红 2绿
铂丝对电极 CE 玻璃碳电极(工作电极) WE
3白
4 5 6
Ag/Ag+(参比电极) RE
移液管 容量瓶 氮气
HOMO=-5.30eV Eg=2.59eV LUMO=-(5.30-2.59)eV=-2.71eV
Organic Electronics.10(2009)1066–1073
实例三:
Organic Electronics 10(2009)247-255
实例四:
Dyes and Pigments.85(2010)143-151
所用溶剂为四氢呋喃(5ml),电解质(四丁基六氟磷酸铵)180mg,样品2mg;四氢呋喃 经金属钠干燥,二苯甲酮作指示剂,重蒸。 仪器参数设置:High E=0V, Low E= -3.5V, Scan Rate(V/s)= 0.1, Segment=4, Smpl interval(V)= 0.001, Quiet Time(s)= 4, Sensitivity(A/V)=1e-4
三个电极使用前再使用氮气吹扫。
实验步骤
4. 准备电解液的配制:称取180 mg的电解质4份;分别量取5ml的(DCM)和(THF)各2份;将4 份电解质分别加入上述4份溶剂中,配成电解液。(电解质溶液浓度为0.11mol/L)
5. 标准物溶液的配制:称取5mg的二茂铁2份;分别将二茂铁加入溶剂为DCM和THF的电解质溶液 中,配成标准物溶液。(大于10-3M即可,可以不用称量)。将配置好的各种溶液用封口膜封口。
7. 称取2mg DPF-C2DAFO样品2份。
8. 取无盖的25×40 mm大小的电解质瓶(与四氟乙烯的测试支架上盖子严格密封);使用前用有机 溶剂清洗并烘干,冷却到室温(可以放在干燥器中冷却或在封口膜的保护下冷却)
9. CV测试: 首先,保证开机、操纵软件正常,线路连接正确。 其次,迅速将三个电极放入待测的电解液中,氮气鼓泡3分钟。然后,正确连接电极与测试系统 (线上有RE、WE、CE的标识)。最后,打开软件系统,设置参数,并开始测试。
原理
在电化学池中当给工作电极施加一定的正电位相对于参比电极电位时,吸附在电极表面的有机 发光材料分子失去其价带上的电子发生电化学氧化反应,当施加更高的正电位时,电极表面上 电化学氧化反应继续进行。此时工作电极上有机发光材料发生电化学氧化反应的起始电位Eox即 对应于HOMO能级。同样地,当给工作电极施加一定的负电位相对于参比电极电位时,吸附在 电极表面的有机发光材料分子将在其导带上得到电子发生电化学还原反应,当继续增加此负电 位时电极表面上,电化学还原反应继续进行。此时工作电极上有机发光材料发生电化学还原反 应的起始电位Ered即对应于LUMO能级。
2. Ag/AgNO3溶液的参比电极(RE)制备:称取AgNO3(分析纯,黑色包装,进口)9.8mg; (应在黑色包装中称取AgNO3,以防AgNO3见光分解)在棕色瓶中将AgNO3加入5.8ml乙腈溶剂 (HPLC)配成浓度为0.01mol/L的溶液,并用锡纸包起来。(AgNO3溶液放置在阴凉环境下) 3. 准备电极:玻璃碳电极(WE),铂丝对电极(CE),套装含Ag/AgNO3溶液的参比电极(RE)。 WE处理方法:首先,在玻璃砖上的圆纱布上垂直打磨(画“8”,0.05μm的铝粉和水作为摩 擦剂);其次,清水冲洗掉白铝,使用干净的丙酮超声1分钟,并用洗耳球吹干。 CE处理方法:使用水和丙酮冲洗干净,凉干。 RE处理方法:如果使用时间过长,更换Ag/AgNO3溶液(溶液量一般为电极长度的2/3),有 机溶剂将表面冲洗干净,凉干(不能使用超声超洗)。
原理
能带理论中的带隙Eg指价带顶与导带底的能量之差,相应于最高占有分子轨道(HOMO)和最 低未占有分子轨道(LUMO)的能量之差。有机发光材料最高占有分子轨道上的电子失去所需的能 量相应于电离势Ip,此时有机发光材料发生了氧化反应;有机发光材料得到电子填充在最低未占有 分子轨道上所需的能量相应于电子亲合势EA,此时有机发光材料发生了还原反应
Fc/Fc+为标准,Ag/Ag+为参比,则:A
Fc/Fc+ b
a
Ag/A
b-a+4.8
测试前要鼓氮除氧 HOMO=eEox+4.5(NHE为参比) HOMO=eEox+4.8(v Ag/Ag+)-EoxFc/Fc+ 能隙Eg可由紫外吸收谱起始位置计算:Eg=hc/λ abs=1240/λabs LUMO可由还原电位Ered计算: HOMO=eEred+4.5 HOMO=eEred+4.8(v Ag/Ag+)-EredFc/Fc+ 或LUMO=HOMO-Eg
实例六:
EHOMO=-(Eoxonset→SCE+4.4eV)=-(Eox+4.4eV+0.34eV) ELUMO=-(Eredonset→SCE+4.4eV)=-(Ered+4.4eV+0.34eV)
J.Phys.Chem.B,Vol.114,No.1,2010.141-150
实例七:
HOMO=-(0.83+4.8-0.49)eV=-5.14eV Eg=2.0eV LUMO=-3.14eV
测试方法
三电极系统:
工作电极:铂碳电极,用时要用铝粉打磨;轻拿轻放,禁摔。可以超声除去表面杂质,但超声时间不 要过长(接绿线) 辅助电极(对电极):铂丝电极;(接红线) 参比电极:银电极(Ag/AgNO3—乙腈溶液),0.01M,避光密封。(禁止超声)(接白线)
实验步骤
1. 准备CV使用的溶剂:还原过程使用THF,氧化过程使用DCM;THF需要钠丝泡过,并回流; DCM需要使用CaH2回流24小时才能使用。(现为回流2小时,即现蒸现用)
电化学及能级计算
目录
Contents
背景介绍 原理
实例分析
总结
背景介绍
有机电致发光材料能带的准确测定对于有机电致发光器件的研究至关重要。 表征有机光电材料能带结构的方法: 紫外吸收光谱法,这种方法只能得到带隙值Eg ; 量化计算的方法,可得到材料的 HOMO和带隙值,只适于结构简单的材料; 光电子发射谱分析可以用于 HOMO的表征,但仪器尚未普及; 电化学方法 (如循环伏安法)兼有上述三种方法的优点,所用仪器设备简单, 操作方便,并能同时给出有机光电材料的全部能带结构参数,因此应用最广泛。
测试前准备
需准备的仪器:铂丝对极、玻璃碳电极、Ag/Ag+电极、超声仪、吹风机、容量瓶、移液管、长针头、 废液桶,滴膜用注射器,气球(多只,鼓氮用) 需准备的溶剂:二氯甲烷、丙酮、去离子水 测试用溶剂:二氯甲烷(DCM)、四氢呋喃(THF)、乙腈(MeCN)等 。实验前须经过无水处理。 电解质:Tetrabutylammonium hexafluorophosphate(四丁基六氟磷酸铵)(0.1M)
用饱和甘汞电极(SCE)作参比电极,它相对于NHE电位为0.24eV ,则计算能级的公式为: EHOMO=eEox+4.5+0.24=eEox+4.74eV Eg=EHOMO-ELUMO 能还可以由吸收光谱得出隙:Eg= hc/λabs=1240/λabs LUMO=HOMO-Eg ELUMO=eEred+4.5+0.24=eEred+4.74eV
