复习题总结无答案
《国家电网公司安全事故调查规程》考试复习总结题1

《国家电网公司安全事故调查规程》考试复习题一、单选题 40题1.与电力生产有关工作过程中发生的事故统计为()事故。
答案:BA.非生产性安全 B.电力生产安全C.重大安全 D.安全2.在非生产性办公经营场所发生的事故统计为()事故。
答案:AA.非生产性安全 B.其它 C.重大安全 D.一般3.由各级政府相关机构调查处理的道路交通、水上交通等事故统计为()事故。
答案:DA.非生产性安全 B.安全 C.重大安全 D.交通4.由火灾引起的事故统计为()事故。
答案:BA.消防 B.火灾 C.社会 D.严重5.公司系统外单位承包系统内工作,发生由系统内单位负同等以下责任的人身事故统计为()事故。
答案:CA.外部 B.内部 C.外包 D.系统外6.一条线路或同一设备由于同一原因在()小时内发生多次跳闸停运构成事故时,可统计为一次事故。
答案:BA.12 B.24 C.36 D.487.公司系统各单位事故发生后,事故现场有关人员应当立即向()报告。
答案:DA.120 B.110 C.单位领导 D.本单位现场负责人8.公司系统各单位事故发生后,情况紧急时,事故现场有关人员可以直接向()报告。
答案:CA.120 B.110 C.本单位负责人 D.本单位现场负责人9.发生()级以上人身、电网、设备和信息系统事故,应立即按资产关系或管理关系逐级上报至国家电网公司。
答案:BA.四 B.五 C.六 D.七10.五级以上的即时报告事故均应在()小时以内以书面形式上报。
答案:CA.6 B.12 C.24 D.3611.发生七级人身、电网、设备和信息系统事件,应立即按资产关系或管理关系上报至()。
答案:AA.上一级管理单位 B.网省公司C.国家电网公司相关分部 D.国家电网公司12.发生()级以上人身事故中断有责单位的安全记录。
答案:B A.四 B.五 C.六 D.七13.()级人身和设备事件由事件发生单位的安监部门或指定专业部门组织调查。
现代制糖工艺理论复习题-总结

现代制糖工艺理论(答案是自己写的,不能确保正确,其中13、14题是今年考的大题)4、现有糖厂为什么要对蔗汁进行清净处理?试分别说明亚硫酸法和碳酸法清净过程的理论基础。
答:(1)混合汁的成分非常复杂,除了含有较多的蔗糖分外,还含有各种无机,有机的非糖分,这些非糖分的存在,势必影响制糖过程蔗糖的提纯及白砂糖的产品质量,因此,对糖汁进行澄清处理以除去糖汁中的非糖分,提高糖汁的纯度,降低糖汁的粘度和色素值,有利于糖汁在制糖过程的输送,蒸发,煮糖,并为结晶提供优质的原料。
(2)亚硫酸法的理论基础亚硫酸法是用石灰石和SO2作为澄清剂的蔗汁澄清方法,并加入磷酸作为辅助澄清剂,具有工艺流程短,设备少和澄清剂用量少等优点,广泛被国内外大小糖厂采用,其理论基础分述如下:①石灰的作用:CaO+H2O=Ca(OH)2A、中和作用:石灰乳能中和混合汁中的有机酸,生成各种可溶或难溶的钙盐。
B、沉淀作用:石灰乳中Ca2+和OH-都能与混合汁中的某些有机和无机糖分发生作用,生成各种沉淀物。
C、分解作用:在碱性条件下,过量的石灰乳分解糖汁中含氮非糖分,还原糖,果胶质,生成对亚硫酸法澄清不利的物质。
D、pH的作用:适合的pH可以形成等电点凝聚,而且可生成不离解的钙盐,此外能起到一定的分解作用。
E、与色素的作用:不同种类的色素对石灰乳有不同的呈色反应。
②SO2的作用:SO2+H2O→H2SO3A、中和混合汁中过量的CaO,从而降低钙盐含量。
在加石灰混合汁中通入SO2进行硫熏,使混合汁中可溶性钙盐转变为CaSO3沉淀除去,从而降低混合汁中钙盐含量,并减少蒸发罐积垢。
B、吸附胶体和色素,在硫熏过程中,新生成的亚硫酸钙沉淀具有一定的吸附能力,能够吸附混合汁中的胶体和色素。
C、将碳酸盐转变为亚硫酸盐:将混合汁中所含的K2CO3、CaCO3变为K2SO3、CaSO3,降低混合汁的碱度,也减少了混合汁的钙盐含量(因为CaSO3溶解度大)。
D、降低糖汁的粘度:SO2通入后,糖汁碱度降低,减少了蔗糖盐的形成,从而降低糖汁的粘度,对沉淀,结晶,分蜜操作均有利。
通用版初中化学综合复习题基础知识点归纳总结

通用版初中化学综合复习题基础知识点归纳总结单选题1、已知碘原子的相对原子质量为127,其原子核内有74个中子,则碘原子核外的电子数为A.74B.53C.54D.72答案:B在原子中,质子数=核外电子数,碘原子的相对原子质量为127,其原子核内有74个中子,相对原子质量≈质子数+中子数,碘原子的质子数为127-74=53,则碘原子核外的电子数为53,故选B。
2、下列图像不能正确反映对应变化关系的是A.等体积等浓度的稀盐酸分别与足量铁粉和镁粉反应B.向一定量氢氧化钠溶液中逐滴加入稀硫酸C.向一定量硫酸铜溶液中加入过量铁粉D.加热一定量高锰酸钾固体制氧气答案:BA、由于镁的活泼性大于铁,所以,等体积等浓度的稀盐酸分别与足量铁粉和镁粉反应,镁用的时间少,生成的氢气的质量相等,不符合题意;B、向一定量氢氧化钠溶液中逐滴加入稀硫酸,开始时溶液的pH大于7,随着稀硫酸的加入,pH逐渐较小,至稀硫酸过量,pH小于7,符合题意;C、向一定量硫酸铜溶液中加入过量铁粉,铁和硫酸铜反应生成硫酸亚铁和铜单质,即若56g铁单质加入溶液中生成64g铜单质,溶液的质量减少,当反应停止时不再减少,不符合题意;D、加热一定量高锰酸钾固体制氧气,开始温度等达不到反应温度,不放出氧气,当反应停止时不再放出氧气,不符合题意。
故选B。
3、有关如图实验的说法正确的是A.点燃氢气前不用检验纯度B.干冷烧杯内壁无明显变化C.b管气体能使带火星木条复燃D.两个实验均可证明水的组成答案:DA、氢气具有可燃性,如果不纯点燃氢气可能发生爆炸的危险,所以点燃前必须检验纯度,不符合题意;B、氢气燃烧生成水,干冷烧杯罩住火焰,内壁有水雾产生,不符合题意;C、电解水时正极产生氧气,负极产生氢气,所以 b管气体是氢气,氢气能燃烧,氢气不能使带火星木条复燃,不符合题意;D、水通电分解生成氢气和氧气,根据质量守恒定律可知水是由氢元素和氧元素组成的;氢气在氧气中燃烧化合生成水,根据质量守恒定律也可知水是由氢元素和氧元素组成的;两个实验均可证明水的组成,符合题意。
2020年中考二轮复习(生物)光合作用和呼吸作用(知识点总结+针对练习)(无答案)
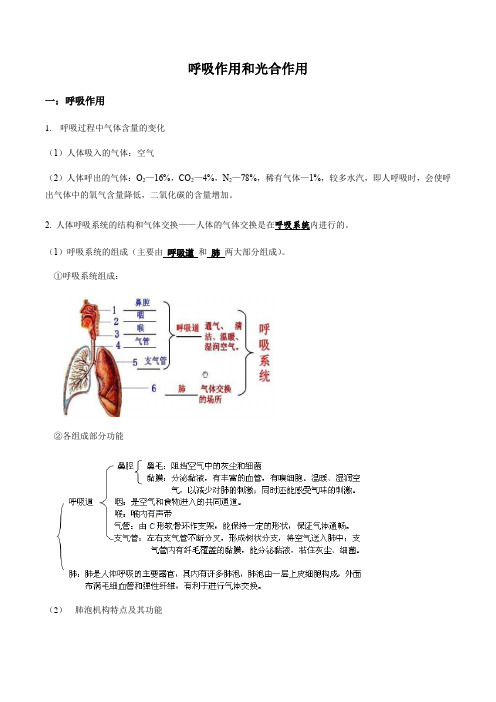
呼吸作用和光合作用一:呼吸作用1.呼吸过程中气体含量的变化(1)人体吸入的气体:空气(2)人体呼出的气体:O2—16%,CO2—4%,N2—78%,稀有气体—1%,较多水汽,即人呼吸时,会使呼出气体中的氧气含量降低,二氧化碳的含量增加。
2. 人体呼吸系统的结构和气体交换——人体的气体交换是在呼吸系统内进行的。
(1)呼吸系统的组成(主要由呼吸道和肺两大部分组成)。
①呼吸系统组成:②各组成部分功能(2)肺泡机构特点及其功能3.呼吸运动(1)人体的气体交换是靠呼吸运动来实现的。
即依靠膈肌和肋间肌的运动来完成。
呼吸运动包括吸气和呼气两个过程。
①吸气:肋间外肌、膈肌收缩肋骨向上向外移动(膈肌顶部下降)胸腔容积扩大肺扩张,导致肺内气压减小外界气体进入肺泡;②呼气:肋间外肌、膈肌舒张肋骨向下向内移动(膈肌顶部回升)胸腔容积缩小肺借本身的弹性回缩,导致肺内气压增大肺内气体排出肺泡;4.(氧气、二氧化碳)的交换过程当毛细血管中的血液流过肺泡时,血液中的二氧化碳通过扩散作用进入到肺泡,同时,肺泡中的氧气进入到毛细血管,红细胞与氧气结合,将氧气输送到全身各处。
二:动植物呼吸作用1.人体生命活动需要的能量是由人体细胞内的有机物与氧气发生氧化反应所提供的。
当有机物为葡萄糖时,人体细胞内氧化反应的过程可以表示为:人体细胞内的有机物与氧反应,最终产生二氧化碳和水或其他产物,同时把有机物中的能量释放出来,供生命活动的需要——这个过程称为呼吸作用(呼吸作用是人体内的一种缓慢进行的氧化反应)。
2.作用类型有氧呼吸(主):有O2参与,彻底分解有机物无氧呼吸(次):无O2参与,不彻底分解有机物(如发酵)3.作用场所线粒体(主)作用:供能细胞质基质(次)4.物的呼吸(1)动物的呼吸在上图所示的装置中,A装置试管中红色水滴指标与橡皮塞的距离逐渐减小,B装置试管中红色水滴指标与橡皮塞的距离不变。
以上实验说明,动物和人一样,也要呼吸,吸人氧气,呼出二氧化碳(2)植物呼吸作用的概念、反应式及场所呼吸作用——植物体吸收空气中的氧,将体内的有机物转化成二氧化碳和水,同时将储存在有机物中的能量释放出来,供给生命活动的需要的过程。
《科学社会主义》复习题总结

《一》1.空想社会主义的历史功绩和局限是什么?2.马克思、恩格斯所创立的科学社会主义的主要原理。
4.“新经济政策”的主要内容是什么?6.列宁的“新经济政策”有何理论意义和现实意义?14. 列宁“新经济政策”对今天的启示4、战时共产主义向新经济政策转变为我们提供了哪些启示?8、新经济政策的特征?主要精神?5.列宁晚年对社会主义建设再认识的主要观点。
6.社会主义国家“个人崇拜”现象发生的主要原因。
7.中国共产党在50年代中期对社会主义道路的探索取得哪些成果。
8.社会主义国家改革的性质、目标和基本内容是什么?9.“民主社会主义”的基本主张和观点。
10.苏东剧变的主要原因和教训是什么?9.苏联解体、东欧剧变的主要原因是什么?我们应从中吸取哪些教训?1.不发达国家建设社会主义的艰巨性和基本经验教训。
十四、试述经济文化落后国家建设社会主义的必然性、长期性和艰巨性。
★试述科学社会主义诞生是历史发展的必然。
3.苏联模式社会主义的主要特征是什么?8.苏联模式的基本内容与主要特征有哪些?2.苏联模式社会主义总体评价。
3. 对苏联模式的成就、利弊分析与评价★试述苏联模式的历史成就、特点和弊病。
6、试述战后社会主义苏联模式多次错过改革机遇及其影响,同时分析苏联失败的原因和教训★如何认识苏联模式失败的根本原因和历史教训。
17、苏联模式的社会主义为什么没能够全面继承资本主义的文明成果,它是如何形成权力过度集中的体制的?3.评社会主义各国优先发展重工业的战略选择。
4.如何理解社会主义的发展过程是一个不断减少空想色彩,增加现实主义精神和科学成分的过程。
5.从社会主义的历史发展看马克思主义与时俱进的理论品格。
★举例说明科学社会主义具有的与时俱进的理论品质6.浅析苏东剧变与苏联模式的联系。
7.从邓小平“三个有利于”标准分析当代社会主义改革。
9.列宁对落后国家建设社会主义的经验总结对今天社会主义建设有什么启示?《二》1、当今科学社会主义主要面临的两大挑战是什么?应如何正确应对这两大挑战?3、科学社会主义的六项基本原则是什么?10、中国特色社会主义道路是什么?什么是中国特色社会主义理论体系?5、经济全球化的定义和标志是什么?1、改革开放前,中国共产党对社会主义的探索有那些宝贵的经验和应当吸取的教训?2、为什么说在当代中国,坚持中国特色社会主义理论体系就是真正坚持马克思主义?4、如何理解当代资本主义的新变化没有改变资本主义必然灭亡的历史规律?5、科学社会主义在当代世界的新战略包括那些要点?16、科学社会主义在当代世界的新战略包括哪些要点?其现实和理论依据是什么?6、落实科学发展观,应当做哪些方面的工作?六、分析题试析当代世界各种社会主义思潮与流派以及世界社会主义运动的基本经验和主要教训。
期末考试错题分析总结范文(精选6篇)

期末考试错题分析总结期末考试错题分析总结范文(精选6篇)总结是指对某一阶段的工作、学习或思想中的经验或情况进行分析研究,做出带有规律性结论的书面材料,它在我们的学习、工作中起到呈上启下的作用,因此十分有必须要写一份总结哦。
总结怎么写才不会千篇一律呢?下面是小编为大家整理的期末考试错题分析总结范文(精选6篇),欢迎阅读与收藏。
期末考试错题分析总结1一、从卷面分析学生具体表现如下:1、综合运用知识的能力较弱,主要表现在学生填空题、选择题、解决问题。
主要原因是学生在学习过程中对新的知识体验不深,头脑中建立不清晰、不扎实。
2、没有形成良好的学习习惯。
表现在有点复杂的数据和文字都对一些能力较弱或较差的学生造成一定的影响。
二、存在的问题1、基础概念的理解不够透彻,造成对基础概念不能灵活运用。
2、计算作为一个基础知识和基础技能,还需加强训练。
3、解决问题时对条件问题的分析综合能力还远远不够。
解决问题策略有待提高。
三、改进措施1、必须劣实数学基础。
一定要重视知识的获得过程。
2、加强学生的学习习惯。
学习态度和学习策略的培养。
要重视培养学生审题意识,培养学生良好的解题习惯。
3、教师要关注学生中的弱势群体。
要坚持做好以下工作;坚持“补心”与“补课”相结合。
消除他们的心理障碍,帮助后进生形成良好的学习习惯。
加强方法指导,严格要求后进生,从最基础的知识抓起,根据学生的差异,进行分层教学,努力使每位学生在原有基础上得到最大限度的发展。
一份耕耘,一份收获。
教学工作苦乐相伴,我们将本着“勤学、善思、实干”的原则,一如既往,再接再厉。
把工作搞得更好!期末考试错题分析总结2一、试卷分析本学期八年语文期末试卷分为三个部分:一、基础(20分);二、阅读(40分);三、作文(40分),满分为100分。
试卷难度适中,考查目标明确,既重视语文基础知识的检测,也重视语文材料的理解、运用能力的考查和对文学作品的初步鉴赏。
从评卷情况来看,总体成绩比较理想,及格率比较高,优良率有所提高,但是还有部分学生的思维与审题不够严密,影响了优良率的提高,反映出来的主要问题有:1、基础部分,学生的语文基本功不扎实,对知识积累不够重视。
人教版七年级英语下册-Unit 12:知识点复习总结+单元测试(word版,无答案)

Unit12 What did you do last weekend?【重点单词】camp v.扎营;扎帐篷lake n.湖,湖泊beach n.海滩,沙滩badminton n.羽毛球运动sheep n.羊,绵羊as adv.&pron.作为,当做natural pron.自然的butterfly n.蝴蝶visitor n.游客;访问者tired adj.疲倦的stay v.停留stay up late深夜不留away adv.离开run away 跑开mouse n.老鼠baby n.幼小的shout v.呼叫,喊叫shout at…冲……大声叫嚷woof v.(狗叫声)汪汪language n.语言fiy v.飞kite n.风筝fiy a kite 放风筝high adj.&adv高的(地)high school中学ago adv.以前India n.印度tent n.帐篷put up 搭起,举起moon n.月亮surprise n.&v.惊奇,惊讶get a surpris 吃惊snake n.蛇scared adj.惊慌的move v.移动shout to… 对……大声喊叫start v.开始,着手jump v.跳跃up and down 上上下下wake v.弄醒,醒into prep.到……里面forest n.森林ear n.耳朵【重点短语】1. last weekend 上周末2. do one’s homework 做作业3. go to the cinema 看电影4. go boating 去划船5. camp by the lake 在湖边露营6. go to the beach 去海滩7. play badminton 打羽毛球8. on Saturday morning 在周六的早上9. study for the English test 为了英语考试学习10. feed some cows 喂一些奶牛11. work as a guide 做为一个导游工作12. Natural History Museum 自然历史博物馆13. butterfly house 蝴蝶馆14. over 200 kinds of butterflies 超过200多种蝴蝶15. tell sb about … 告诉某人关于…16. living habits 生活习惯17. be kind of tired 有点儿累19. stay up 熬夜20. play with sb. 和某人玩21. lose things 丢东西22. run away 跑开23. fly a kite 放风筝24.as a special gift 作为一个特殊的礼物25. take sb. to sp. 把某人带到某地26. go camping 去露营27. put up the tents 搭建帐篷28. make a fire 生火29. keep sb. warm 使某人保持温暖30. on the first night 在第一天晚上31.so...that... 如此…以至于…32. go to sleep 去睡觉33. get a surprise 吃惊34. see sb. doing sth. 看见某人正在做某事35. jump up and down 上蹦下跳36. climb onto one’s back 爬到某人背上37. shout at/shout to 大声喊叫38 wake …up 把...弄醒39. move into… 移入,爬进…中40. a useful lesson 有用的一课【重点句型】1.—What did you do last weekend?Lucy?Lucy,你上周末做了什么?—Well, on Saturday, I played badminton.噢.周六我打羽毛球了。
中考复习力学重难点精析(知识点总结+经典例题)(无答案)

力学重难点集训教学目标:①对中考科学中物理部分有全局的认识②了解力学各个知识点之间的联系,掌握力学模块的核心思维—受力分析电学和电磁学。
力学的核心思维在于受力分析,大部分的题目最终分析出是平衡状态,以此得出等大反向的力,通过已知条件得出力的大小和方向。
对于一些证明推到题,则是根据受力分析,得出某些力是平衡力,等大反向,以此列出等式,进而化简得出需要的推导结果。
一、摩擦力存在下的二力平衡建立在摩擦力和二力平衡条件的基础上,体现对物体的“受力分析”受力分析一般步骤:①确定体系中受力研究对象②从受力少的物体开始入手分析③利用力的作用是相互的,从受力简单物体到受力情况复杂的物体受力分析④根据条件提示和要求得出结论【针对练习】1.如图所示,将弹簧测力计左端固定在墙上,右端用细线与重力为20N的木块相连,木块放在上表面水平的小车上,弹簧测力计保持水平,现用F=10N的力拉动小车沿水平方向做匀速直线运动,木块静止时弹簧测力计的示数为4N,则小车所受地面摩擦力的大小与方向分别是()A.10N,水平向右B.14N,水平向左C.6N,水平向左D.4N,水平向右2.如图甲所示是消防队员小王进行爬杆训练的示意图,他沿杆竖直向上运动的速度v 与时间t 的关系图像如图乙所示,下列判断正确的是()A.0~6 s 内,小王沿杆匀速向上运动B.6~15 s 内,小王沿杆上爬的距离是5.4 mC.0~18 s 内,小王受到的摩擦力方向一直向下D.5~18 s 内,小王受到的摩擦力大小等于重力大小3.(2019七下·丽水月考)如图所示,完全相同的AB两物体叠放一起,在力F的作用下在水平面上作匀速直线运动。
则将AB水平放置且在同样大小的力F作用下在同一水平面上运动时()A.A和B的运动速度将会不断增加B.B在水平方向受到的力是一对平衡力C.A受到的推力F和摩擦力f是一对平衡力D.A对B也有力的作用,大小为F,方向水平向右4.(2019七下·上虞期中)如图所示,用F=6N 水平向右的拉力匀速拉动物块A 时,物块B 静止不动,此时弹簧测力计的示数为4N,则物块B 所受摩擦力的大小及方向为()A.4N,水平向右B.4N,水平向左C.6N,水平向左D.6N,水平向右5.如图甲所示,老李用水平向左的力F推放在水平地面上的箱子,力F的大小以及箱子的运动速度大小v随时间f的变化情况分别如图乙、丙所示。
建筑结构抗震设计复习题完全总结(上)

建筑结构抗震设计试卷一、填空题(每小题1分,共20分)1、天然地震主要有()与()。
2、地震波传播速度以()最快,()次之,()最慢。
3、地震动的三要素:();();()。
4、多层土的地震效应主要取决于三个基本因素:()()()。
5、结构的三个动力特性是:()()()。
6、4.求结构基本周期的近似方法有()()()。
7、框架按破坏机制可分为:()()。
8、柱轴压比的定义公式为:()。
二、判断题(每小题2分,共20分)1、非结构构件的存在,不会影响主体结构的动力特性。
()2、场地类比是根据土层等效剪切波速和场地覆盖层厚度综合确定。
()3、一般工程结构均为欠阻尼状态。
()4、地震动振幅越大,地震反应谱值越大。
()5、当结构周期较长时,结构的高阶振型地震作用影响不能忽略。
()6、多遇地震下的强度验算,以防止结构倒塌。
()7、砌体房屋震害,刚性屋盖是上层破坏轻,下层破坏重。
()8、柱的轴力越大,柱的延性越差。
()9、抗震墙的约束边缘构件包括暗柱、端柱和暗梁。
()10、排架结构按底部剪力法计算,单质点体系取全部重力荷载代表值。
()三、简答题(每小题8分,共40分)1、影响土层液化的主要因素是什么?2、什么是地震反应谱?什么是设计反应谱?它们有何关系?3、什么是时程分析?时程分析怎么选用地震波?4、在多层砌体结构中设置圈梁的作用是什么?5、抗震设计为什么要尽量满足“强柱弱梁”、“强剪弱弯”、“强节点弱构件”的原则?如何满足这些原则?四、问答题(每题10分,共20分)1.“抗震规范”中,“三水准、两阶段的设计方法”是什么?2.多层砌体房屋在抗震设计中,结构的选型与布置宜遵守哪些原则?建筑结构抗震设计试卷标准答案一、填空题(每空1分,共20分)1、构造地震、火山地震2、纵波、横波、面波3、峰值、频谱、持续时间4、覆盖土层厚度、剪切波速、阻尼比5、自振周期、振型、岩土阻抗比6、顶点位移法、能量法、等效质量法7、梁铰机制、柱铰机制8、n=N/(f c A c)二、判断题(每小题2分,共20分)1、×2、√3、√4、√5、√6、×7、√8、√9、× 10、√三、简答题(每小题8分,共40分)1、答案:影响土层液化的主要因素有:地质年代,土层中土的粘性颗粒含量,上方覆盖的非液化土层的厚度,地下水位深度,土的密实度,地震震级和烈度。
【高考必备】高中数学总复习题总结(完整版附答案)

高中数学总复习题总结第一章 集合与函数概念一、选择题1.设全集U ={(x ,y )| x ∈R ,y ∈R },集合M =⎭⎬⎫⎩⎨⎧1=2-3-|),(x y y x , P ={(x ,y )| y ≠x +1},那么C U (M ∪P )等于( ).A .∅B .{(2,3)}C .(2,3)D .{(x ,y )| y =x +1}2.若A ={a ,b },B ⊆A ,则集合B 中元素的个数是( ). A .0B .1C .2D .0或1或23.函数y =f (x )的图象与直线x =1的公共点数目是( ). A .1B .0C .0或1D .1或24.设函数f (x )=2x +3,g (x +2)=f (x ),则g (x )的表达式是( ). A .2x +1B .2x -1C .2x -3D .2x +75. 已知函数f (x )=ax 3+bx 2+cx +d 的图象如图所示,则( ).A .b ∈(-∞,0)B .b ∈(0,1)C .b ∈(1,2)D .b ∈(2,+∞)6.设函数f (x )=⎩⎨⎧00++2 x c x c bx x ,,≤, 若f (-4)=f (0),f (-2)=-2,则关于x 的方程f (x )=x 的解的个数为( ).A .1B .2C .3D .47.设集合A ={x | 0≤x ≤6},B ={y | 0≤y ≤2},下列从A 到B 的对应法则f 不是映(第5题)>射的是( ).A .f :x →y =21x B .f :x →y =31xC .f :x →y =41x D .f :x →y =61x 8.有下面四个命题:①偶函数的图象一定与y 轴相交; ②奇函数的图象一定通过原点; ③偶函数的图象关于y 轴对称;④既是奇函数,又是偶函数的函数一定是f (x )=0(x ∈R ). 其中正确命题的个数是( ). A .1B .2C .3D .49.函数y =x 2-6x +10在区间(2,4)上是( ). A .递减函数B .递增函数C .先递减再递增D .先递增再递减10.二次函数y =x 2+bx +c 的图象的对称轴是x =2,则有( ). A .f (1)<f (2)<f (4) B .f (2)<f (1)<f (4) C .f (2)<f (4)<f (1)D .f (4)<f (2)<f (1)二、填空题11.集合{3,x ,x 2-2x }中,x 应满足的条件是 .12.若集合A ={x | x 2+(a -1)x +b =0}中,仅有一个元素a ,则a =___,b =___. 13.建造一个容积为8 m 3,深为2 m 的长方体无盖水池,如果池底和池壁的造价每平方米分别为120元和80元,那么水池的最低总造价为 元.14.已知f (x +1)=x 2-2x ,则f (x )= ;f (x -2)= . 15.y =(2a -1)x +5是减函数,求a 的取值范围 .16.设f(x)是R上的奇函数,且当x∈[0,+∞)时,f(x)=x(1+x3),那么当x∈(-∞,0]时,f(x)=.三、解答题17.已知集合A={x∈R| ax2-3x+2=0},其中a为常数,且a∈R.①若A是空集,求a的范围;②若A中只有一个元素,求a的值;③若A中至多只有一个元素,求a的范围.18.已知M ={2,a ,b },N ={2a ,2,b 2},且M =N ,求a ,b 的值.19.证明f (x )=x 3在R 上是增函数.20.判断下列函数的奇偶性: (1)f (x )=3x 4+21x ;(2)f (x )=(x -1)xx-+11; (3)f (x )=1-x +x -1;(4)f (x )=12-x +21x -.高一数学必修1第二章单元测试题(A 卷)班级 姓名 分数一、选择题:(每小题5分,共30分)。
语文第一~四单元阶段性综合复习(含答案)+总结(标准版)

第一~四单元阶段性综合复习时间:90分钟满分:100分一、根据语境,看拼音写词语。
(7分)国庆chánɡ jià期间,我们全家去北京lǚ yóu。
香山的fēnɡ yè红了,像一枚枚好看的yóu piào;水果fēnɡ shōu了,xiānɡ tián的qì wèi让人心情舒畅。
二、字词综合练习。
(21分)1.下列加点字的注音完全正确的一项是()(2分)A.增.加(zēn)骨.碌(ɡū)强.烈(qiǎnɡ)B.钥匙.(shi)缩.小(suō)歌吟.(yín)C.方式.(sì)答.应(dā)压.根(yà)D.处.罚(chù)棕.色(zōnɡ)蜡.烛(nà)2.下列四字词语中,不是描写人的动作的一项是()(2分)A.张牙舞爪B.提心吊胆C.手忙脚乱D.摇头晃脑3.“勾”字在字典里有以下几种解释,在“小朋友的脚,常被那香味勾住”这句话中,“勾”的意思是()。
(2分)A.招引,引B.用笔画出符号,表示删除或截取C.结合D.描画,用线条画出形象的边缘4.读句子,选字填空。
(3分)饱跑泡(1)有饭能吃(),有水把茶(),有足快快()。
票漂飘(2)小小的邮()真()亮,随风()到故乡。
5.结合语境,选择恰当的关联词填空。
(4分)虽然……但是……因为……所以……(1)胡萝卜先生()近视,()没有发现漏刮了一根胡子。
(2)()历经磨难,()红军战士最后还是翻过了雪山。
6.将下列四字词语补充完整,再完成练习。
(8分)A.()()累累()()丰登B.四面()()七嘴()()(1)A组词语都是描写_________(季节)的,我还能再写一个这样的四字词语:_____ _____________。
(2分)(2)B组词语都含有_________,我还能再写一个这样的四字词语:_________________。
五年级上册第十课复习题

五年级上册第十课复习题五年级上册第十课复习题五年级上册第十课是一篇关于动物世界的文章,主要介绍了不同动物的特点和生活习性。
本篇文章将通过复习题的形式,对这一课的内容进行回顾和总结。
一、选择题1. 以下哪个不是动物的特点?A. 呼吸B. 运动C. 光合作用D. 生长答案:C. 光合作用解析:光合作用是植物的特点,而不是动物的特点。
2. 以下哪个不属于脊椎动物?A. 鱼类B. 鸟类C. 昆虫D. 哺乳动物答案:C. 昆虫解析:昆虫属于无脊椎动物,而不是脊椎动物。
3. 以下哪个动物是群居动物?A. 狮子B. 大象C. 猴子D. 蛇答案:A. 狮子解析:狮子是群居动物,它们组成了狮群,共同生活和狩猎。
4. 以下哪个动物是食肉动物?A. 猴子B. 大象C. 虎D. 羊答案:C. 虎解析:虎是食肉动物,以其他动物为食。
5. 以下哪个动物是植食动物?A. 狮子B. 鲨鱼C. 猴子D. 羊答案:D. 羊解析:羊是植食动物,以植物为食。
二、填空题1. ______ 是人类的近亲。
答案:猩猩解析:猩猩与人类有着相似的基因,是人类的近亲。
2. ______ 是世界上最大的陆地动物。
答案:大象解析:大象是世界上最大的陆地动物,体型庞大而强壮。
3. ______ 是世界上最快的动物。
答案:猎豹解析:猎豹以其惊人的奔跑速度而闻名,是世界上最快的动物。
4. ______ 是世界上最小的猫科动物。
答案:豹猫解析:豹猫是世界上最小的猫科动物,体型较小但非常灵活。
5. ______ 是世界上最大的鱼类。
答案:鲸鲨解析:鲸鲨是世界上最大的鱼类,体型巨大且生活在海洋中。
三、简答题1. 请简要介绍一下鸟类的特点。
答案:鸟类是脊椎动物,具有羽毛和喙。
它们的前肢演化成了翅膀,可以飞行。
鸟类的骨骼轻巧且空心,有助于减轻体重。
它们的呼吸系统非常发达,能够实现高效的气体交换。
2. 请简要介绍一下昆虫的特点。
答案:昆虫是无脊椎动物,具有外骨骼和六只脚。
公司理财计算题公式总结及复习题答案out

公司理财计算题公式总结及复习题答案out112公司理财计算题第⼆章:财务⽐率的计算(⼀)反映偿债能⼒的指标 1、资产负债率=资产总额负债总额×100% =所有者权益负债长期负债流动负债++×100%(资产=负债+所有者权益)2、流动⽐率=流动负债流动资产×100%3、速动⽐率=流动负债速动资产×100% =流动负债待摊费⽤存货预付账款流动资产---×100%4、现⾦⽐率=流动负债短期投资短期有价证券货币资⾦现⾦)()(+×100%(⼆) 反映资产周转情况的指标 1、应收账款周转率=平均应收账款余额赊销收⼊净额=2--÷+期末应收账款)(期初应收账款销售退回、折让、折扣现销收⼊销售收⼊2、存货周转率=平均存货销货成本=2÷+期末存货)(期初存货销货成本习题:1、某公司20××年末有关财务资料如下:流动⽐率=200%、速动⽐率=100%、现⾦⽐率=50%、流动负债 = 1000万元,该公司流动资产只包括货币资⾦、短期投资、应收账款和存货四个项⽬(其中短期投资是货币资⾦的4倍)。
要求:根据上述资料计算货币资⾦、短期投资、应收账款和存货四个项⽬的⾦额。
2、某公司20××年末有关财务资料如下:流动⽐率=200%、速动⽐率=100%、现⾦⽐率=20%、资产负债率=50%、长期负债与所有者权益的⽐率为25%。
要求:根据上述资料填列下⾯的资产负债表简表。
资产负债表(简)(单位:元)3、某公司年初应收账款56万元、年末应收账款60万元,年初存货86 万元、年末存货90万元,本年度销售收⼊为680万元(其中现销收⼊480万元,没有销售退回、折让和折扣),销货成本为560万元。
要求:根据上述资料计算应收账款周转率和存货周转率。
4、某公司20××年度全年销售收⼊为600万元,其中现销收⼊为260万元,没有销售退回、折让和折扣,年初应收账款为30万元,年末应收账款⽐年初增加了20%,则应收账款周转率应该是多少?5、某公司20××年度全年销货成本为400万元,年初存货为50万元,年末存货⽐年初增加了20%,则存货周转率应该是多少?第三章:货币时间价值1、单利:终值F n=P〃(1+i〃n) 【公式中i为利率,n为计息期数】现值P = F n/(1+i〃n)2、复利:终值F n= P〃CF i,n= P〃(1+i)n 【公式中(1+i)n 称为复利终值系数,简写作CF i,n】现值P= F n〃DF i,n=F n/(1+i)n【公式中1/(1+i)n 称为复利现值系数,简写作DF i,n】3、年⾦:终值F n= R〃ACF i,n【公式中ACF i,n是年⾦终值系数的简写,R为年⾦,n为年⾦个数】现值P = R〃ADF i,n【公式中ADF i,n 是年⾦现值系数的简写】习题:1、某公司从银⾏取得贷款600000元,年利率为6%,按复利计息,则5年后应偿还的本利和共是多少元?(CF0.06,5 =1.338,DF0.06,5=0.747)2、某公司计划在5年后以600000元更新现有的⼀台设备,若年利率为6%,按复利计息,则现在应向银⾏存⼊多少钱?(CF0.06,5 =1.338,DF0.06,5=0.747)3、某公司计划在10年内每年年末将5000元存⼊银⾏,作为第10年年末购买⼀台设备的⽀出,若年利率为8%,则10年后可积累多少资⾦?(ACF0.08,10=14.487,ADF0.08,10=6.710)4、某⼈计划在10年中每年年末从银⾏⽀取5000元以备零⽤,若年利率为8%,现在应向银⾏存⼊多少钱?(ACF0.08,10=14.487,ADF0.08,10=6.710)5、某公司现在存⼊银⾏⼀笔现⾦1000000元,年利率为10%,拟在今后10年内每年年末提取等额现⾦作为职⼯奖励基⾦,则每年可提取多少现⾦?(ACF0.1,10=15.937,ADF0.1,10=6.145)6、某⼈计划从现在起连续10年每年年末存⼊银⾏⼀笔款项,作为5年后买房的资⾦,该资⾦需要1000000元,若银⾏年利率为10%,则从现在起每年年末要存多少钱?(ACF0.1,10=15.937,ADF=6.145)0.1,10第五章1、债券发⾏价格发⾏价格= 年利息×ADF i,n+⾯值×DF i,n=(⾯值×债券票⾯利率)×ADF i,n+⾯值×DF i,n【该公式为分期付息、到期⼀次还本的公式,公式中的i为债券发⾏时的市场利率】2、融资租赁的租⾦(等额年⾦法)年租⾦(R)=设备价值(P)/ ADF i,n【公式中的i为出租费率,i=年利率+⼿续费率】习题:1、某公司发⾏⾯值为100元、票⾯利率为8%的5年期公司债券1000万元,每年年末付息⼀次,到期⼀次还本,发⾏时市场利率为6%,请计算该债券的发⾏价格为多少?2、某公司从租赁公司租⼊⼀套设备,价值为1000万元,租期为8年,合同约定租赁年利率为6%,⼿续费为设备价值的2%,租⾦每年年末⽀付⼀次。
《运筹学》期末复习总结题

一、单项选择题1、下列叙述正确的是()。
A.线性规划问题,若有最优解,则必是一个基变量组的可行基解B.线性规划问题一定有可行基解C.线性规划问题的最优解只能在最低点上达到D.单纯形法求解线性规划问题时,每换基迭代一次必使目标函数值下降一次答案:A2、线性规划的变量个数与其对偶问题的()相等。
A.变量目标函数B.变量约束条件C.约束条件个数D.不确定答案:C3、在利用表上作业法求各非基变量的检验数时,有闭回路法和()两种方法。
A.西北角法B.位势法C.最低费用法D.元素差额法答案:B4、下列各项()不是目标规划的特点。
A.多目标B.单一目标C.具有优先次序D.不求最优答案:B5、下列关于图的说法中,错误的为()。
A.点表示所研究的事物对象B.边表示事物之间的联系C.无向图是由点及边所构成的图D.无环的图称为简单图答案:D6、利用单纯形法求解线性规划问题时,首先需要()。
A.找初始基础可行基B.检验当前基础可行解是否为最优解C.确定改善方向D.确定入变量的最大值和出变量答案:A7、对偶问题最优解的剩余变量解值()原问题对应变量的检验数的绝对值。
A.大于B.小于C.等于D.不能确定答案:C8、当某个非基变量检验数为零,则该问题有()。
A.无解B.无穷多最优解C.退化解D.惟一最优解答案:B9、PERT 网络图中,()表示一个工序。
A.节点B.弧C.权D.关键路线答案:B10、假设对于一个动态规划问题,应用顺推法以及逆推解法得出的最优解分别为P和D,则有()。
A.P>D B.P<DC.P=D D.不确定答案:C11、下列有关线性规划问题的标准形式的叙述中错误的是()。
A.目标函数求极大B.约束条件全为等式C.约束条件右端常数项全为正D.变量取值全为非负答案:C12、线性规划问题的数学模型由目标函数、约束条件和()三个部分组成。
A.非负条件B.顶点集合C.最优解D.决策变量答案:D13、如果原问题有最优解,则对偶问题一定具有()。
中考数学复习----《圆周角定理》知识点总结与专项练习题(含答案)

中考数学复习----《圆周角定理》知识点总结与专项练习题(含答案)知识点总结1.圆心角、弦以及弧之间的关系:①定理:在同圆和等圆中,相等的圆心角所对的弧相等,所对的弦也相等。
②推论:在同圆或等圆中,如果两个圆心角、两条弧、两条弦中有一组量相等,那么它们所对应的其余各组量都分别相等。
说明:同一条弦对应两条弧,其中一条是优弧,一条是劣弧,而在本定理和推论中的“弧”是指同为优弧或劣弧。
2.圆周角的定义:顶点在圆上,并且两边都与圆相交的角叫做圆周角。
3.圆周角定理:在同圆或等圆中,同弧或等弧所对的圆周角相等,都等于这条弧所对的圆心角的一半。
4.圆周角定理的推论:半圆(或直径)所对的圆周角是直角,90°的圆周角所对的弦是直径。
5.圆的内接四边形:①定义:四个顶点都在圆上的四边形叫做圆的内接四边形。
②性质:I:圆内接四边形的对角互补。
II:圆内接四边形的任意一个外角等于它的内对角。
练习题1、(2022•襄阳)已知⊙O的直径AB长为2,弦AC长为2,那么弦AC所对的圆周角的度数等于.【分析】首先利用勾股定理逆定理得∠AOC=90°,再根据一条弦对着两种圆周角可得答案.【解答】解:如图,∵OA=OC=1,AC=,∴OA2+OC2=AC2,∴∠AOC=90°,∴∠ADC=45°,∴∠AD'C=135°,故答案为:45°或135°.2、(2022•日照)一圆形玻璃镜面损坏了一部分,为得到同样大小的镜面,工人师傅用直角尺作如图所示的测量,测得AB=12cm,BC=5cm,则圆形镜面的半径为.【分析】连接AC,根据∠ABC=90°得出AC是圆形镜面的直径,再根据勾股定理求出AC 即可.【解答】解:连接AC,∵∠ABC=90°,且∠ABC是圆周角,∴AC是圆形镜面的直径,由勾股定理得:AC===13(cm),所以圆形镜面的半径为cm,故答案为:cm.3、(2022•永州)如图,AB是⊙O的直径,点C、D在⊙O上,∠ADC=30°,则∠BOC=度.【分析】根据在同圆或等圆中,同弧或等弧所对的圆周角相等,都等于这条弧所对的圆心角的一半求出∠AOC的度数,根据平角的定义即可得到∠BOC=180°﹣∠AOC的度数.【解答】解:∵∠ADC是所对的圆周角,∴∠AOC=2∠ADC=2×30°=60°,∴∠BOC=180°﹣∠AOC=180°﹣60°=120°.故答案为:120.4、(2022•苏州)如图,AB是⊙O的直径,弦CD交AB于点E,连接AC,AD.若∠BAC=28°,则∠D=°.【分析】如图,连接BC,证明∠ACB=90°,求出∠ABC,可得结论.【解答】解:如图,连接BC.∵AB是直径,∴∠ACB=90°,∴∠ABC=90°﹣∠CAB=62°,∴∠D=∠ABC=62°,故答案为:62.5、(2022•湖州)如图,已知AB 是⊙O 的弦,∠AOB =120°,OC ⊥AB ,垂足为C ,OC 的延长线交⊙O 于点D .若∠APD 是AB ⌒所对的圆周角,则∠APD 的度数是 .【分析】由垂径定理得出,由圆心角、弧、弦的关系定理得出∠AOD =∠BOD ,进而得出∠AOD =60°,由圆周角定理得出∠APD =∠AOD =30°,得出答案.【解答】解:∵OC ⊥AB ,∴,∴∠AOD =∠BOD ,∵∠AOB =120°,∴∠AOD =∠BOD =∠AOB =60°,∴∠APD =∠AOD =×60°=30°,故答案为:30°.6、(2022•徐州)如图,A 、B 、C 点在圆O 上,若∠ACB =36°,则∠AOB = .【分析】利用一条弧所对的圆周角等于它所对的圆心角的一半即可得出结论.【解答】解:∵∠ACB =∠AOB ,∠ACB =36°,∴∠AOB =2×∠ACB =72°.故答案为:72°.7、(2022•锦州)如图,四边形ABCD内接于⊙O,AB为⊙O的直径,∠ADC=130°,连接AC,则∠BAC的度数为.【分析】利用圆内接四边形的性质和∠ADC的度数求得∠B的度数,利用直径所对的圆周角是直角得到∠ACB=90°,然后利用直角三角形的两个锐角互余计算即可.【解答】解:∵四边形ABCD内接于⊙O,∠ADC=130°,∴∠B=180°﹣∠ADC=180°﹣130°=50°,∵AB为⊙O的直径,∴∠ACB=90°,∴∠CAB=90°﹣∠B=90°﹣50°=40°,故答案为:40°.8、(2022•雅安)如图,∠DCE是⊙O内接四边形ABCD的一个外角,若∠DCE=72°,那么∠BOD的度数为.【分析】根据邻补角的概念求出∠BCD,根据圆内接四边形的性质求出∠A,根据圆周角定理解答即可.【解答】解:∵∠DCE=72°,∴∠BCD=180°﹣∠DCE=108°,∵四边形ABCD内接于⊙O,∴∠A=180°﹣∠BCD=72°,由圆周角定理,得∠BOD=2∠A=144°,故答案为:144°.9、(2022•甘肃)如图,⊙O是四边形ABCD的外接圆,若∠ABC=110°,则∠ADC=°.【分析】根据圆内接四边形的对角互补即可得到结论.【解答】解:∵四边形ABCD内接于⊙O,∠ABC=110°,∴∠ADC=180°﹣∠ABC=180°﹣110°=70°,故答案为:70.。
铁路运输设备期末复习总结题

《铁路运输设备》期末复习题第一章绪论复习要点:1. 现代交通运输主要运输方式 2.铁路运输业的特点 3.铁路管理机构的设置4.铁路运输的基本设备及其作用自测题1.我国出现的第一条运营铁路是_________年7月建成通车的____至____________的铁路,全长___________ km。
2.现代化运输方式有______、_____、____、____和_____ 。
3.截止于2010年,我国铁路运营历程达到_________Km,电气化里程达到_____Km。
电气化里程跃居世界_____。
4.铁路运输的基本设备包括有______、______、______、______、______和________。
5.___________是全国铁路的主管部门,直接管理、领导忒路运输企业。
第二章铁路线路复习要点:1、铁路线路由什么组成的2、说明铁路线路平面、铁路线路纵断面的组成要素。
3、我国铁路规定的轨距、最小曲线半径和最大限制坡度各多少4、单位曲线阻力和单位坡道阻力的计算。
5、路基的两种基本形式。
6、桥梁的分类、组成及相关名词解释。
7、轨道由什么组成的8、辙岔号数表示什么意思9、名词:无缝线路、轨道爬行、限制坡度10. 铁路线路标志的作用及常见线路标志种类自测题一.填空 1.铁路线路是由___、__和____组成的一个整体工程结构。
2.线路路基有______和____两种基本形式。
3.防止线路爬行的主要设备有____和____两种。
4.道岔号数越大___允许侧向通过道岔的速度就越___。
5、道岔上的_____的存一个重要因素。
6. ___和__构成铁路线路平面的组成要素;平道和坡道成为___的组成要素。
7. 铁路基本限界分为_____限界和_____限界。
8.在铁路线上,直线与圆曲线之间连接的线路,称作_______。
二.判断题 1.列车运行在曲线轨道上曲线部分的轨距都必须加宽。
2.铁路线路根据其在路网中的意义和承担运量的大小3、曲线部分的轨距加宽是为了减小离心力的影响。
通用版初中化学综合复习题知识点总结(超全)

通用版初中化学综合复习题知识点总结(超全)单选题1、某海水淡化系统(如下图)工作时,蒸发腔中的水在光热作用下变为水蒸气,太阳能风扇将水蒸气吹到冷凝腔冷凝,实现海水淡化。
下列说法错误的是A.光热作用下,水分子运动速率加快B.液态水变为水蒸气,水分子间的间隔变大C.水蒸气冷凝为水,水分子本身变小D.海水变为淡水,水分子化学性质不变答案:CA、温度越高分子运动速度越快,故光热作用下,水分子运动速率加快,选项正确;B、液态水变为水蒸气,水分子本身没有改变而是水分子间的间隔变大,选项正确;C、水蒸气冷凝为水,水分子本身没有改变而是水分子间的间隔变小,选项错误;D、海水变为淡水,水分子本身没有改变,分子是保持物质化学性质的最小粒子,故水的化学性质不变,选项正确;答案为:C。
2、在反应A+3B=2C+2D中,28gA与一定质量的B恰好完全反应,生成88gC。
若C、D的相对分子质量之比为22:9,则A与B的相对分子质量之比为A.7:8B.8:7C.7:24D.24:7答案:A解:设C相对分子质量22,D相对分子质量9,设D质量为x,A+3B=2C2×2288g+2D2×9x2×22 2×9=88gx,x=36g根据质量守恒B质量为88g+36g-28g=96g,设A相对分子质量y与B的相对分子质量为z则;A y 28g +3B3z96g=2C+2Dy 3z =28g96g,yz=78故选:A。
3、不同温度下KNO3的溶解度如下表所示。
下列说法正确的是A.20℃时,100gKNO3饱和溶液中溶质质量为31.6gB.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%C.30℃时,将50gKNO3放入100g水中得到150g溶液D.40℃时,100g水最多溶解63.9gKNO3答案:DA、20℃时,硝酸钾的溶解度是31.6g,表示20℃时,100g水中溶解31.6gKNO3达到饱和状态,也就是131.6g的KNO3饱和溶液中的溶质质量为31.6g ,故选项A不正确;B、30℃时,KNO3的溶解度是45.8g,要计算该温度下饱和溶液的溶质质量分数,根据一定温度下,饱和溶液中×100%得,30℃时,100gKNO3饱和溶液的溶质质量分溶质质量分数与溶解度的关系:溶质质量分数=溶解度溶解度+100g×100%≈31.4%,故选项B不正确;数=45.8g45.8g+100gC、30℃时,KNO3的溶解度是45.8g,表示30℃时,100g水中溶解45.8g KNO3达到饱和状态,也就是30℃时,100g水中最多只能溶解45.8gKNO3,所得饱和溶液的质量是145.8g,故选项C不正确;D、40℃时,KNO3的溶解度是63.9g,表示40℃时,100g水中溶解63,9g KNO3达到饱和状态,也就是40℃时,100g水中最多只能溶解63.9gKNO3,故选项D正确;故选:D。
沪教版化学初三上册第一章总复习知识点总结+练习(无答案)

第一章复习知识点1.书写下列文字表达式或符号表达式:(1)碳酸氢铵加热分解:(2)铁生锈:(3)红磷燃烧:(4)碱式碳酸铜加热分解:(5)碱式碳酸铜和盐酸反应:(6)镁燃烧:(7)镁和盐酸反应:(8)氨气和氯化氢反应:(9)碘化钾和硝酸银反应:2.碳酸氢铵受热分解(1)如图所示的装置能用于______类物质加热,其中的物质可能是______或______.(2)若试管中的药品是碳酸氢铵,发现固体,闻到气体,管壁有______,如将产生的气体通人澄清石灰水中将会看到.(3)写出编号仪器的名称:A______,B______,C______.(4)若要收集产生的气体,在试管口需增加______和______.(5)文字或符号表达式:(6)实验结论:。
保存时应。
【思考】食品膨化剂中碳酸氢铵的作用?3.铜绿受热分解小欣同学在做完“探究铜绿的性质”实验后,要填写如下实验报告,请协助他。
实验目的:探究铜绿的性质实验仪器:略实验过程及现象记录:(1)观察铜绿的颜色和状态等物理性质:铜绿是______色______;(2)将铜绿粉末用______分别加到两支试管中;(3)用______向一支试管中逐滴滴加稀盐酸,观察到铜绿______,溶液呈______色,同时有大量______产生;(4)将另一支试管在酒精灯的______焰上加热(注意:加热时要先______,加热时______加热),一段时间后,观察到绿色粉末逐渐变成______色,试管口有______出现。
结论:铜绿具有的化学性质是(Ⅰ)______;(Ⅰ)______.【思考】加热铜绿时试管口为什么要向下倾斜?4.铁丝生锈(1)取一块废旧的铁丝网,将铁丝网剪成几小片,用稀盐酸除去铁锈后,放入锥形瓶中。
向锥形瓶中加入3∼4mL浓食盐水,塞紧带导管的单孔塞,导管的另一端伸入滴有红墨水的水中。
一段时间后,可观察到除去铁锈后的银白色铁丝表面,同时。
说明。
(2)根据此实验的现象,并结合“热胀冷缩”原理,可知在密封体系内,气压变小的原因可能是;气压变大的原因可能是.(填序号)①密封体系内气体总量增多②密封体系内气体总量减少③密封体系内的温度升高④密封体系内的温度降低。
中考英语时态复习:一般现在时(知识点总结、练习 无答案)
一般现在时在英语语法中,“时“指动作发生的时间,”态“指动作的样子和状态。
时态:一般时,进行时,完成时时段:现在,将来,过去教学过程一、一般现在时表达方法主要通过谓语动词的变化和用时间词语来表示,其中最主要的是谓语动词的变化。
一般现在时动词变化的规则是:当主语为非第三人称单数,谓语动词用原型。
当主语为第三人称单数,谓语动词用第三人称单数形式。
e.g.1. We often get up early in the morning.2. My father often gets up early in the morning.二、英语中第三人称在一般现在时中,当主语是第三人称单数时,谓语动词要用第三人称单数形式,即写一写:watch ________ arrive ________ grow ________match ________ let ________ make ________stay ________ try ________ pass ________study ________ have ________三、第三人称有哪些?用一句话概括:“非你、非我、非复数”如he, she, it, my father, my mother, my sister, our English teacher, Tom, Mike, Liu Jia, China, my book, etc.一、人称代词he, she, it是第三人称单数。
如:He likes watching TV. 他喜欢看电视。
She has lunch at twelve. 她十二点吃午餐。
It looks like a cat. 它看起来像只猫。
二、单个人名、地名或称呼作主语;是第三人称单数。
如:①Han Mei looks like her mother.韩梅看起来像她的母亲。
②Beijing is in China.北京在中国。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.溴元素的相对原子质量为80, 它有两种同位素, 原子的质量分数约各为50%, 已知一种溴 原子核内中子数为44, 则另一种溴原子核内中子数为(A)80 (B)44 (C)45 (D)462.元素性质发生周期性变化的根本原因是( )A 、元素原子的核电荷数逐渐增加,元素的主要化合价发生周期性变化。
B 、元素原子的电子层数逐渐增加,元素的原子半径发生周期性变化。
C 、金属和非金属交替出现。
D 、元素原子的核外电子排布呈现周期性变化。
3.下列关于主族元素性质递变规律叙述不正确的是( )A 、同主族元素从上下到,原子半径逐渐变大,金属性逐渐变强。
B 、同周期元素从左到右,非金属性逐渐增强。
C 、同周期元素从左到右,气态氢化物稳定性逐渐增强。
D 、同主族元素从上到下,原子半径越小,越容易失去电子。
4.主族元素原子失去最外层电子形成阳离子,主族元素的原子得到电子填充在最外层形成阴离子。
下列各原子或离子的电子排布式错误的是( )A 、Ca 2+ 1s 22s 22p 63s 23p 6B 、O 2- 1s 22s 23p 4C 、Cl - 1s 22s 22p 63s 23p 6D 、Ar 1s 22s 22p 63s 23p 65. M 、N 两种元素的原子,当它们每个原子获得两个电子形成稀有气体元素原子的电子层结构时,放出的能量M 大于N ,由此可知( )A 、M 的氧化性强于NB 、M 的氧化性弱于NC 、N 2-的还原性弱于M 2-D 、不能确定M 、N 的氧化性强弱6. 某主族元素原子的第一、二、三、四各级电离能依次为:899KJ/mol 、1757KJ/mol 、14840KJ/mol 、 18025KJ/mol ,试分析该元素所在的族序数为( )A 、IA 族B 、ⅡA 族C 、ⅢA 族D 、IVA 族7. 下列各项中表述正确的是( )A .F -的离子结构示意图:B .CO 2的分子模型示意图:C .CO 2的电子式:··O ······C ······O ······D .N 2的结构式:··N ≡N ··8. 下列物质的分子中既有σ键又有π键的是( )①HCl ②H 2O ③N 2 ④H 2O 2 ⑤C 2H 4 ⑥C 2H 2A .①②③B .③④⑤⑥C .①③⑤D .③⑤⑥9. 下列关于极性键的叙述不正确的是( )A .是由不同元素原子形成的共价键B .共价化合物中必定存在极性键C .极性键中电负性大的原子显正电性D.共用电子对必然偏向吸引电子能力强的原子一方10.(2011年安徽蚌埠高二月考)最近,中国科学技术大学的科学家们将C60分子组装在一单层分子膜表面,在-268 ℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间共价键的分子图象。
下列化合物分子中一定既含σ键又含π键的是() A.HClO B.C2H6OC.COCl2D.H2O211.下列说法中不正确的是()A.σ键比π键重叠程度大,形成的共价键键能大B.两个原子之间形成共价键时,最多有一个σ键C.气体单质中,一定有σ键,可能有π键D.N2分子中有一个σ键,两个π键12.已知次氯酸分子的结构式为H—O—Cl,下列有关说法正确的是()A.O原子发生sp1杂化B.O原子与H、Cl都形成σ键C.该分子为直线形分子D.该分子电子式是:13.(2011年安徽亳州高二四校联考)下列各组分子中都属于含极性键的非极性分子的是()A.CO2、H2S B.C2H4、CH4C.Cl2、C2H2D.NH3、HCl14..根据价电子对互斥理论,判断下列分子或者离子的空间构型不是三角锥形的是() A.PCl3B.H3O+C.HCHO D.PH315.下列有关金属键的叙述错误的是()A.金属键没有饱和性,没有方向性B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用C.金属键中的电子属于整块金属D.金属的物理性质和金属固体的形成都与金属键有关16.)A. a与f——B.c与g——离子键——离子化合物C.d与f——共价键——共价化合物D.b与c——金属键——合金17.(2011年陕西榆林高二月考)下列物质中,存在的化学键的种类最多的是() A.NaOH B.HClOC.MgCl2D.NH4Cl18.以下叙述中错误的是()A.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强B.在氯化钠中,除氯离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用C.任何离子键在形成的过程中必定有电子的得失D.钠与氯反应生成氯化钠后,体系能量降低19.(2011年福建南平一中高二质检)下列物质中,不含离子键的是()①NH4HCO3②NH3③BaSO4④CuSO4·5H2O⑤Ba(OH)2⑥H2SO4A.①④⑥B.②③⑤C.④⑤D.②⑥20.(2011年河南周口高二质检)下列配合物的水溶液中加入硝酸银不能生成沉淀的是() A.[Co(NH3)4Cl2]Cl B.[Co(NH3)3Cl3]C.[Co(NH3)6]Cl3 D.[Cu(NH3)4]Cl221.下列关于金属的叙述中,不正确的是()A.金属键是金属阳离子和自由电子这两种带异性电荷的微粒间的强烈相互作用,其实质与离子键类似,也是一种电性作用B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性C.金属键是带异性电荷的金属阳离子和自由电子间的相互作用,故金属键无饱和性和方向性D.构成金属的自由电子在整个金属内部的三维空间中做自由运动22.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象说法正确的是()A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+C.向反应后的溶液中加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道22.(2011年烟台高二质检)下列物质中不存在氢键的是()A.冰醋酸中醋酸分子之间B.液态氟化氢中氟化氢分子之间C.一水合氨分子中的氨分子与水分子之间D.可燃冰(CH4·8H2O)中甲烷分子与水分子之间23..在解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的变化规律是()A.H2O、H2S、H2Se、H2Te的热稳定性依次减弱B.熔点:Al>Mg>Na>KC.NaF、NaCl、NaBr、NaI的熔点依次降低D.CF4、CCl4、CBr4、CI4的熔、沸点逐渐升高24.(2011年安徽宿州高二检测)下列物质发生变化时,所克服的粒子间相互作用属同种类型的是()A.金属钠与晶体硅分别受热熔化B.氯化铵与苯分别受热变为气体C.氯化钠与氯化氢分别溶解在水中D.碘与干冰分别受热变为气体25.下列各组物质中,按熔点由低到高排列的是(双选)()A .O 2、I 2、HgB .CO 2、KCl 、Al 2O 3C .Na 、K 、RbD .H 2S 、H 2Se 、H 2O26. 已知磷酸分子中三个氢原子都可以跟重水分子(D 2O)中D 原子发生氢交换,又知次磷酸(H 3PO 2)也能跟D 2O 进行氢交换,但次磷酸钠(NaH 2PO 2)却不能再跟D 2O 发生氢交换,由此可推断出次磷酸分子的结构是( )27. 下列晶体中由原子直接构成的单质有 ( )A .白磷B .氦C .金刚石 D28. 下列说法不正确的是( )A .金属单质的熔点一定比非金属单质高BC .在含有阳离子的晶体中,一定含有阴离子D 29离子晶体熔点的高低决定于晶体中阳离子与阴离子之间的静电引力,静电引力大则熔点高,引力小则反之。
试根据你学到的电学知识,判断KCl 、NaCl 、CaO 、BaO 四种晶体熔点的高低顺序( )A .KCl>NaCl>BaO>CaOB .NaCl>KCl>CaO>BaOC .CaO>BaO>NaCl>KClD .CaO>BaO>KCl>NaCl30. 如图是CsCl 晶体的晶胞(晶体中最小重复单元),已知晶体中两个最近的Cs + 核间距为a cm ,氯化铯的式量为M ,N A 为阿伏加德罗常数,则氯化铯晶体的密度为( )A. B.C. D.31. .A 、B 、C 、D 四种元素的原子序数都小于20, A 与B 同主族, B 与C 同周期, 0.2 mol 的C 单质与足量稀H 2SO 4反应时放出H 2 6.72L(标准状况), A 原子最外层上的电子数比次外层上的电子数多5个, C 与D 的原子序数之和为32.(A)A 、B 、C 、D 的元素符号分别为:______ ______ ______ _______。
(2)A 的离子结构示意图为___ _ __, C 的原子的电子排布式为_ _____.33A cm g a N 8M -⋅3A 3cm g 8N Ma -⋅33A cm g a N M -⋅3A 3cm g N Ma -⋅(3)B原子的电子式为______, A与D的化合物的电子式为_______.(4)C的高价氧化物对应水化物的化学式为_________; 它跟盐酸反应的离子方程式是________________________________________; 跟烧碱溶液反应的离子方程式是____________________________.32.、(10分)下表是第二周期元素的第一电离能(I1)数据:(1)第一电离能最大的元素是____,最小的元素是____,电离能变化趋势是____,元素性质的变化趋势是____。
(2)Be、N的第一电离能比相邻的两种元素都大,从结构方面分析原因________。
32.(4分)已知有关物质的熔、沸点数据如下表:请参考上述数据回答下列问题:(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。
为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?答________________。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是________。
