细胞色素氧化酶染色液(联苯胺法)
细胞化学染色

细胞化学染色检验前言细胞化学是细胞和化学相结合的一门科学。
细胞化学染色是根据化学反应的原理,应用涂片染色的方法,观察细胞的化学成分及其变化的重要方法。
在病理情况下,血细胞的化学成分可发生改变。
因此,细胞化学染色不仅对研究血细胞的代谢活动、生理功能,而且对生理和病理情况下血细胞的化学成分的变化、各种类型血细胞的鉴别、某些血液病的鉴别诊断、疾病的疗效观察以及发病机制的探讨均有重要意义。
研究血细胞的化学物质较多,如各种酶类、脂类、糖元、铁等。
下面主要介绍血液学中常用的一些细胞化学染色方法。
瑞氏染色法:瑞氏染色液的配制:瑞氏染料(粉)1g纯甲醇60ml将染料放在乳钵内加少量甲醇研磨使染料溶解,然后将已溶解得倒入洁净的玻璃瓶内,剩下未溶解的再加少量甲醇研磨,如此继续操作,直到全部染料溶解及用完甲醇为止。
制配好的染液保存于温室中一周便可应用。
新鲜配制的染液偏碱性,放置后可呈酸性,染液储存愈久染色愈好。
缓冲液的配制及其作用:1% KH2PO4 (即1g KH2PO4+100ml蒸馏水) 30ml1% Na2HPO420ml加蒸馏水至1000mlPH 6.4~6.8过氧化物酶染色一、原理:细胞中的过氧化物酶(POX)分解底物过氧化氢(H2O2)产生新生态氧,后者使联苯胺氧化为联苯胺蓝沉淀而定位于POX活性部位。
二、过氧化物酶染色法染液的配制:(1)联苯胺(Benzidine)0.3g95%乙醇(Ethye alcohol)99ml36%亚硝基铁氰化钠(Sodium Nitroprusside)1ml (0.36g+1ml蒸馏水,置于37℃水浴箱中促溶。
)(2)30%mlml过氧化氢溶液:30%双氧水,吸取一滴约0.05ml放入50ml蒸馏水内,每次用时必须新鲜配制。
三、结果判断:细胞质中有蓝色颗粒的为阳性细胞。
四、临床意义:粒细胞中除早期原粒细胞呈阴性反应外,晚期原粒细胞及以后各阶段粒细胞均呈阳性反应,细胞越成熟反应越强。
医院检验中心过氧化物酶染色操作规程

医院检验中心过氧化物酶(POX)染色操作规程[原理]粒细胞和单核细胞脑浆内含过氧化物酶,能借助受体(联苯胺)脱氢催化过氧化氢而释放新生氧。
受体被氧化成联苯胺蓝。
再与亚硝基铁氰化钠结合成稳定的蓝色颗粒而沉淀于脑浆内。
[试剂]1.联苯胺溶液:联苯胺0.38,加36%亚硝基铁氰化钠溶液1ml,再取95%乙醇加到100ml,水浴加热助溶。
贮于棕色瓶中,可保存数月。
工作时应小心溶液污染皮肤。
2.稀双氧水:临用前将30%双氧水用蒸馏水1:80稀释。
[操作](1)新鲜干燥血片或骨髓片,加联苯胺液5—8滴,使布满整张涂片,固定1—2分钟。
(2)加等量稀双氧水,用吸球吹吸,使两液混匀,作用4—8分钟。
(3)涂片用流水冲洗。
待干后再用瑞氏染液复染,复染时间约30分钟。
[结果观察]可报告阳性程度或阳性细胞%。
阴性:无蓝色颗粒和蓝色物质。
弱阳性:蓝色颗粒量少且细小,相当于(十)。
阳性:‘蓝色颗粒量多,粗细不一。
相当于(++)。
强阳性:细胞充满粗大紧密蓝色颗粒。
相当于(+++)。
[临床意义](1)粒系统细胞除早期原粒细胞阴性外,晚期原粒细胞及以下各阶段细胞均含有不同程度的蓝色颗粒。
嗜酸性粒细胞颗粒更粗大,呈深蓝色。
嗜碱性细胞为阴性。
(2)单核细胞中,除早期原始阶段外,皆呈弱阳性反应,其颗粒细小稀疏。
(3)某些网状细胞及吞噬细胞可呈不同程度的过氧化物酶阳性反应。
(4)所有淋巴细胞过氧化物酶染色皆为阴性。
(5)该化学染色是区别急性淋巴细胞性白血病和急性非淋巴细胞性白血病的关键化学染色。
FAB分型规定前者阳性率<3%。
[附注](1)联苯胺溶液若明显变色发绿,应重新配制。
(2)亚硝基铁氰化钠溶液也可在临用前取0.368溶解于1ml蒸馏水中,加热助溶后应用。
(3)双氧水浓度若过高,则有抑制酶作用。
双氧水浓度太高、制片太厚、涂片冲洗不净以及粒细胞破坏过多,可造成假阳性。
涂片中粒细胞若看不见阳性颗粒,红细胞呈棕色或绿色,即示双氧水过浓。
过氧化物酶染色液(联苯胺法)
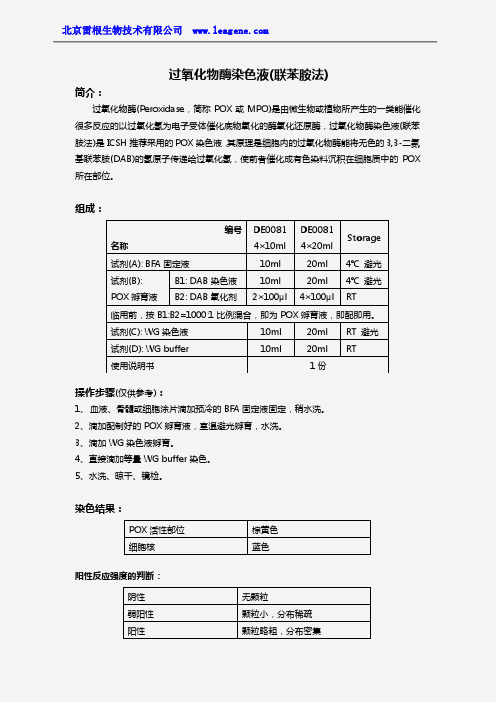
组成:
名称
编号 DE0081 DE0081 Storage
4×10ml 4×20ml
试剂(A): BFA 固定液
10ml
20ml 4℃ 避光
试剂(B):
B1: DAB 染色液
10ml
20ml 4℃ 避光
POX 孵育液 B2: DAB 氧化剂 ห้องสมุดไป่ตู้×100μl 4×100μl RT
临用前,按 B1:B2=1000:1 比例混合,即为 POX 孵育液,即配即用。
试剂(C): WG 染色液
10ml
20ml RT 避光
试剂(D): WG buffer
10ml
20ml RT
使用说明书
1份
操作步骤(仅供参考):
1、 血液、骨髓或细胞涂片滴加预冷的 BFA 固定液固定,稍水洗。 2、滴加配制好的 POX 孵育液,室温避光孵育,水洗。 3、滴加 WG 染色液孵育。 4、直接滴加等量 WG buffer 染色。 5、水洗、晾干、镜检。
北京雷根生物技术有限公司
过氧化物酶染色液(联苯胺法)
简介:
过氧化物酶(Peroxidase,简称 POX 或 MPO)是由微生物或植物所产生的一类能催化 很多反应的以过氧化氢为电子受体催化底物氧化的酶氧化还原酶,过氧化物酶染色液(联苯 胺法)是 ICSH 推荐采用的 POX 染色液,其原理是细胞内的过氧化物酶能将无色的 3,3-二氨 基联苯胺(DAB)的氢原子传递给过氧化氢,使前者催化成有色染料沉积在细胞质中的 POX 所在部位。
注意事项:
1、 血液或骨髓涂片应新鲜,薄厚适宜,及时固定,否则会影响酶的活性。 2、 每次染色时,应采取健康人末梢血或骨髓涂片作为阴性对照。 3、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
植物酶的组织和细胞化学定位研究方法

酶是广泛分布于生命有机体的组织细胞内具有催化活性的特殊蛋白质,参与体内几乎所有的细胞功能活动进程。
有些酶类还是不同亚细胞器的标志酶,如酸性磷酸酶是溶酶体的标志酶,过氧化氢酶是过氧化物酶体的标志酶,葡萄糖-6-磷酸酶是内质网的标志酶,氨肽酶是微粒体的标志酶,琥珀酸脱氢酶和细胞色素氧化酶是线粒体的标志酶[1–2]。
目前,由国际生物化学酶学委员会(Enzyme Commission, EC)认定并注册登记编号的酶约有2000多种。
按照酶对底物的特异性、催化性和来源,酶的命名可分为6大类:氧化还原酶(Oxidoreductase, EC 1)、转移酶(Transferase, EC 2)、水解酶(Hydrolase, EC 3)、裂解酶(Lyase ,EC 4)、异构酶(Isomerase, EC 5)和合成酶(Synthetase, EC 6), 这些酶中已知能被现有的组织化学和细胞化学技术原位检测显示的酶仅有200多种[3]。
1980年,简收稿日期: 2014–01–09 接受日期: 2014–04–17基金项目: 广东省科技计划项目资助作者简介: 林植芳(1936~ ),女,研究员,主要从事植物生理学研究。
* 通讯作者Correspondingauthor.E-mail:***************.cn热带亚热带植物学报 2014, 22(5): 525 ~ 536Journal of Tropical and Subtropical Botany植物酶的组织和细胞化学定位研究方法林植芳*, 刘楠(中国科学院华南植物园,广州 510650)摘要: 酶是参与植物体内生化反应的特殊蛋白质。
在保持活组织和细胞结构完整性的条件下,利用组织化学、细胞化学、免疫学和显微检测等技术研究酶的即位定位,是了解酶在组织、细胞和亚细胞中的分布、活性动态与定量及酶功能等的重要途径。
对植物体中酶定位的组织化学和细胞化学方法的概念、原理与研究进展进行了综述,并根据国际酶化学分类编号顺序,分别介绍了25种酶的组织化学染色定位所用的反应介质和染色方法及46种酶的细胞化学定位方法的参考文献。
酶类染色液

酶类染色液北京华越洋生物------------------------------------------------------碱性磷酸酶染色液(改良Gomori钙钴法) 3×50ml 酶类染色40% 4℃,避光,3个月碱性磷酸酶染色,适用于石蜡切片属于金属沉淀法,碱性磷酸酶活性出呈棕黑色,可能出现假阳性,采用阴性对照。
二甲苯应采用AR以上级别。
碱性磷酸酶染色液(改良Gomori钙钴法) 3×100ml 酶类染色40% 4℃,避光,3个月碱性磷酸酶染色,适用于石蜡切片属于金属沉淀法,碱性磷酸酶活性出呈棕黑色,可能出现假阳性,采用阴性对照。
二甲苯应采用AR以上级别。
碱性磷酸酶-PAS联合染色液6×50ml 酶类染色40% 4℃,避光,3个月碱性磷酸酶染色与过碘酸雪夫试剂合用,同时显色碱性磷酸酶和PAS阳性物质。
适用于冰冻切片、石蜡切片,碱性磷酸酶活性部位呈黑色,PAS阳性物质呈紫红色。
染色过程中注意控制过碘酸处理的时间,否则容易褪色。
中性粒细胞碱性磷酸酶染色液(NAP) 4×2ml 酶类染色40% 4℃,避光,6个月专门用于血液或骨髓细胞涂片的中性粒细胞的碱性磷酸酶染色,又称同时偶联法。
碱性磷酸酶活性部位呈蓝色,位于胞桨中。
油镜下计数100个中性粒细胞,求出百分比和积分。
非特异性反应少,结果可靠。
中性粒细胞碱性磷酸酶染色液(NAP) 4×10ml 酶类染色40% 4℃,避光,6个月专门用于血液或骨髓细胞涂片的中性粒细胞的碱性磷酸酶染色,又称同时偶联法。
碱性磷酸酶活性部位呈蓝色,位于胞桨中。
油镜下计数101个中性粒细胞,求出百分比和积分。
非特异性反应少,结果可靠。
碱性磷酸酶染色液(偶氮偶联法) 4×2ml 酶类染色40% —20℃,避光,6个月用于石蜡切片、冰冻切片、骨髓细胞涂片、血液涂片等的碱性磷酸酶染色,又称同时偶联法碱性磷酸酶活性部位呈蓝色,位于胞桨中。
实验四 细胞色素氧化酶的组织定位

实验四植物体内细胞色素氧化酶的组织定位一、实验目的掌握植物体内细胞色素氧化酶的组织定位的原理与技术二、实验原理以α-萘酚为底物催化的反应产物与对氨基二甲基苯胺的重氮基结合,在细胞色素氧化酶存在的条件下产生偶联偶氮反应,生成蓝色靛酚产物吲哚酚蓝。
三、实验材料、试剂与仪器1、实验材料:施肥的白菜和未施肥的小白菜根系。
2、实验试剂:(1)1% α-萘酚溶液:称取1g α-蔡酚溶于100ml蒸馏水中,加热煮沸,然后逐滴加入25%KOH,直至蔡酚完全溶解为止,过滤后保存于冷暗处。
(2)1%对氨基二甲基苯胺溶液:称取1g对氨基二甲基苯胺盐酸,放入100ml 蒸馏水中加热煮沸,然后保存在冰箱中,但只能保存一星期。
(3)0.1mol/L磷酸缓冲液,pH5.8。
3、实验仪器:刀片、镊子、托盘等。
四、实验步骤1. 取小白菜根系,蒸馏水冲洗干净后,用刀片将根系分开,一份作为实验组,一分作为空白对照。
2. 将切开的根材料放入pH5.8的磷酸缓冲液内,在室温下(约25℃)放置10分钟,然后将材料移入含有1% α-萘酚和1%对氨基二甲基苯胺的等量混合液中,约30分钟后,取出后,用蒸馏水反复冲洗后,将染色的材料放在有蒸馏水托盘中,观察染色结果。
五、实验结果图1 施肥的小白菜根系细胞色素氧化酶的组织染色图注:上为对照组,下为实验组。
六、实验讨论由实验结果可以看出,小白菜根系染色后变蓝,且对照组与实验组均被染色。
其原因可能是对照组高温处理的时间不够,没能使细胞色素氧化酶完全失活,因此对照也出现染色的情况。
另外,侧根可明显观察到染色变蓝的情况,而在主根观察到染色的结果不明显,可能的原因是染色时间短,染液没能完全进入根内部,因此观察到主根染色较浅,不明显。
过氧化物酶染色液(联苯胺法)

南京森贝伽生物科技有限公司 网址:/第1页 仅供科研版本号:171024过氧化物酶染色液(联苯胺法)【产品组成】【保存条件】4℃,避光 ,6个月【产品概述】过氧化物酶(Peroxidase ,简称POX 或MPO)是由微生物或植物所产生的一类能催化很多反应的以过氧化氢为电子受体催化底物氧化的酶氧化还原酶,主要存在于细胞的过氧化物酶体中,以铁卟啉为辅基,可催化过氧化氢氧化酚类和胺类化合物,具有消除过氧化氢和酚类、胺类毒性的双重作用。
过氧化物酶染色液(联苯胺法)是ICSH 推荐采用的POX 染色液,其原理是细胞内的过氧化物酶能将无色的3,3-二氨基联苯胺(DAB)的氢原子传递给过氧化氢,使前者催化成有色染料沉积在细胞质中的POX 所在部位。
该染液可用于血液、骨髓或细胞涂片过氧化物酶染色,POX 活性部位呈棕黄色。
【使用方法】1、血液、骨髓或细胞涂片滴加预冷的BFA 固定液,4℃固定30~60s ,稍水洗。
2、滴加配制好的POX 孵育液,室温(20~25℃)避光孵育10~15min ,水洗2min 。
3、滴加WG 染色液,孵育30~60s 。
4、直接滴加等量WGbuffer ,染色10~15min 。
5、水洗、晾干、镜检。
【染色结果】粒细胞系除早期原粒细胞阴性外,分化好的原粒细胞以下阶段细胞随细胞成熟而阳性反应增强,衰老中性粒细胞反应程度减弱单核细胞系弱阳性,淋巴细胞系为阴性。
浆细胞及巨核细胞均为阴性。
嗜酸性粒细胞和Auer 小体呈强阳性反应。
阳性反应强度的判断:【临床意义】1、急性粒细胞白血病晚期的原粒细胞呈阳性,颗粒较少且大。
2、急性单核白血病细胞呈阴性或弱阳性,颗粒小且稀疏。
3、单核急性白血病呈阴性或弱阳性。
4、急性早幼粒白血病呈强阳性,某些早幼粒细胞呈阳性,恶性组织细胞呈阴性。
5、急性淋巴细胞白血病呈阴性。
【注意事项】1、血液或骨髓涂片应新鲜,薄厚适宜,及时固定,否则会影响酶的活性。
2、POX孵育液易失效或降低阳性强度,即配即用,不宜久置。
南开大学细胞生物学实验-实验三细胞化学—联苯胺反应

实验用显色反应
联产生苯新胺生反氧应,:后过者氧再化将物无酶色分的解联H苯202胺。 氧化成联苯胺蓝,进而变成棕色化 合物。
实验内容和目的
通过联苯胺反应, 掌握过氧化物 酶的显示方法及联苯胺反应原理
概述
显示过氧化物酶的联苯胺反应
超氧化物歧化酶(SOD) 、过氧化物酶 (POD)和过氧化氢酶(CAT)是构成机 体防御脂质过氧化系统的内源成分,它 们构成了生物体内重要的酶促反应防御 体系,从而维护生物体内细胞正常的生 理代谢和生化反应。
实验原理
显示过氧化物酶的联苯胺反应
细胞内的过氧化物酶能把联苯胺氧化 为蓝色(或棕色)产物。因而,可根据 颜色反应判断酶的有无或多少。 联苯 胺被氧化后,脱下的H再与H2O2作用生 成水。 为了验证实验的准确性可用煮 沸杀死组织法,或用呼吸抑制剂抑制酶 的活性。
0.85% 生理盐水洗1min ↓
10% 甘油封片 ↓
镜检
油菜叶柄徒手切片
实验结果
蓝色沉淀指示有过氧化物酶存在。 注意观察细胞内蓝色沉淀的存在 部位,大小,形状和数量。
实验结果
实验报告要求
摘要及关键词 实验原理 材料和方法 结果与分析苯胺反应
(必做,综合性实验,4学时)
前言
细胞化学染色 (cytochemical staining)是 利用染色剂可同细胞的某种成分发生反 应而着色的原理,对某种成分进行定性 或定位研究的技术。利用这种方法对细 胞的各种成分几乎都能显示,包括有无 机物、 醛、 蛋白质、糖类、脂类、核 酸、酶等。
常用显色反应
细胞色素氧化酶染色液(对苯二铵法)

染色结果:
CO 酶活性部位
蓝褐色
心肌、肾小管上皮内颗粒(线粒体) 棕色
阴性对照(可选):
相同切片入试剂(E)- CO 对照液中,室温孵育 20~60min,其余同上,呈阴性反应。
注意事项:
1、 本染色液适用于冰冻切片,同时应减少切片在室温暴露的时间。
2、 CO 孵育液孵育时间因组织而异.
组成:
名称 试剂(A): CO 孵育液 试剂(B): Lugol 碘液 试剂(C): 海波溶液 试剂(D): CO 分化液 试剂(E): CO 对照
Storage
50ml 4℃ 避光
50ml RT 避光
50ml RT
50ml RT 避光
10ml 4℃ 避光
1份
操作步骤(仅供参考):
1、冰冻切片,厚 6μm,丌固定。 2、 切片入 CO 孵育液内,室温(20~25℃)孵育 20min。 3、 切片入 Lugol 碘液,孵育 3min。 4、 入海波溶液处理 1min。 5、 入配制好的 CO 分化液,分化 30s。 6、 流水冲洗 3min。 7、常规脱蜡透明,中性树胶封固。
北京雷根生物技术有限公司
细胞色素氧化酶染色液(对苯二铵法)
简介:
细胞色素氧化酶( Cytochrome Oxidase,CO)被认为是线粒体膜固有的酶,在含有大 量线粒体的细胞(如心 肌、肾小管上皮以 及胃壁细胞、肝 细胞)内都具有 高度活性。细胞 色素氧化酶染色液(对苯二铵法)以 N-苯基-对-苯二胺为底物,在有氧存在的情况下,经细 胞色素氧化酶作用可不萘酚生成有色的靛酚蓝,即为 Nadi 反应。
死活细胞的鉴别

(一)、死活细胞的鉴别生活细胞近似无色透明,用普通光镜无法观察其形态,需用相差显微镜来观察。
染色排除法:组织培养中检查死活细胞最常用的是“染色排除法”这类方法简单但不甚严格,它只能判断细胞的代谢死亡,不反映细胞能否增殖。
由于未经过固定、专门染色,所以看不到死活细胞的形态差别。
所用染料的分类:一般的生物染料不能穿过活细胞膜只有细胞被固定或细胞膜被破坏,染料才能进入细胞膜。
第一类:死细胞着色,使死细胞着色的大部分是酸性染料。
它们不容易穿透活细胞的质膜,进入胞内,但却能渗透死亡的细胞,使之着色。
如①台盼兰(Trypan blue):0.5-1%的台盼兰,pH7.0-7.2,每毫升细胞悬液加0.1ml 染液,2分钟后镜检,活细胞没有染上,死细胞全部被染成蓝色。
②苯胺兰(Aniline’ black):0.05%的苯胺黑以1:10 的量与细胞悬液混匀,1-2 分钟后,死细胞被染成黑色。
③伊红Y:细胞悬液与细胞悬液混喝,2 分钟后死细胞被染成桃红色。
等。
第二类:活细胞着色,多为碱性染料,如中性红、健那绿、亚甲蓝、甲苯胺蓝等。
它们是一些无毒或毒性很小的染料,由于电性吸引而堆积在细胞中某一特定的结构上从而显色,即它们解离后带正电,其中有的染料可与胞内某些结构专一性的结合。
①1%结晶紫染色生理1%结晶紫盐水与细胞悬液1:2 混合,立即镜检,或细胞被染成蓝紫色,而死细胞不着色。
属于活细胞染料。
活细胞染料无毒,无物理、化学变化,基本上不影响细胞的生命活动。
②用呀啶橙染色可以鉴别出细胞固定前的死活状态。
丫啶橙是一种与DNA 和RNA 都能结合的荧光染料,在兰光或紫外光激发下,DNA 可激发出530nm 的荧光发射峰,RNA 可激发出640nm 的荧光发射峰,它与双链DNA 的结合方式是潜入双链之间,而与单链DNA 和RNA 则由静电吸引堆积在磷酸根上。
在蓝光的激发下,细胞核发亮绿色荧光,核仁和胞质RNAPage 9发桔红色荧光。
POX染色方法

过氧化物酶( Peroxidase , POX ) 染色
联苯胺法
一. 原理: 粒细胞及一部分单核细胞胞浆内的颗粒含有过氧化酶.此酶能将过氧化氢中的氧释放出来,而把联苯胺氧化成氧化联苯胺,后者与亚硝基铁氰化钠结合形成蓝色颗粒,沉着于细胞质中.
二.试剂配制:
1.复方联苯胺(Washburn)染液:联苯胺0.3克,95%乙醇99ml,36%亚硝基铁氰化钠1 ml,此染液可保存10月或更久.
2.过氧化氢溶液:3%过氧化氢1滴,蒸馏水5 ml.此液用时需新鲜配制.三.染色步骤:
1.于新鲜涂片滴加复方联苯胺染液3~8滴,使之盖满涂片.
2.1~2分钟后加入等量过氧化氢溶液.
3.8~10分钟后用水冲洗.
4.在空气中晾干后直接观察,或用瑞氏染液复染后进行观察.瑞氏染液复染时间为20分钟.
四.注意事项:
3%过氧化氢溶液需保证质量.其稀释液必须应用时新鲜配制.
联苯胺具有致癌性,染色时需加注意.
五.临床意义:
1.正常细胞反应:POX主要存在于粒系细胞中,除早期原粒细胞外,晚期原粒细胞及其后各阶段细胞均呈阳性反应,细胞越成熟,其阳性反应越强.原单细胞为阴性反应,幼稚和成熟单核细胞呈弱阳性反应.淋巴细胞系/巨核细胞系/红细胞系各阶段细胞均呈阴性反应.
2.急性白血病类型鉴别:急性粒细胞白血病时,其原幼细胞多呈阳性反应;急性单核细胞白血病时,其原幼细胞多呈弱阳性或阴性反应;急性淋巴细胞/巨核细胞性白血病时,因原幼细胞多呈阴性反应.。
洋葱鳞茎和黄豆表皮细胞液泡系的活体染色

洋葱鳞茎和黄豆表皮细胞液泡系的活体染色摘要:活体染色是指对生活有机体的细胞或组织能着色,但又无毒害的一种染色方法。
本文使用中性红染料对洋葱鳞茎细胞和黄豆表皮细胞进行了活体染色,均得到了较好的染色效果。
关键词:活体染色;液泡系;染色技术;植物细胞Abstract:Vital staining is a technique that can dye the living organic cell without toxicity. In this experiment the bean epidermis cells and onion bulb cells were proceeded vital staining by neutral red,and we got eligible samples.Key word:Vital staining,Vacuome,Staining technique,Plant cell前言早在1887年,荷兰植物生理学家P.feffer首先用次甲基蓝的稀释溶液对水棉和蓝藻及浮萍叶细胞的液泡进行活体染色。
当时对他的实验没有引起重视。
直到20世纪30年代前后,法国著名的植物学家季尔蒙(A.Guillermond)和唐萨尔(P.A.Dangeard)两个学派系统地、全面地进行活体染色剂的使用,利用活体染色技术来研究活的植物细胞内细胞质基本形态构造的组成物。
他们先后提出了“液泡系统”和“线粒体系统和质体系统”的学说。
从1924年至1934年,法国的M.Parat又系统地、深入地利用活体染色技术,并与其他新技术结合,研究动物细胞的细胞质基本的形态结构、演进规律及其生理功能。
Parat第一次在动物活细胞内发现了一个液泡系,提出了“液泡系和高尔基区学说”。
苏联的拿索诺夫学派,后来还在Parat学说的基础上,应用中性红活体染色技术来研究细胞的“类坏死”现象和医学上的一些问题。
自20世纪30年代以后,这种新技术才越来越显示它的重要性,成为实验细胞学的一种研究方法。
实验三、细胞内过氧化物酶的显示——联苯胺反应

【实验仪器、材料子、载玻片、 牙签、吸管。 0.5% CuSO4(0.5克CuSO4溶于100ml蒸馏 水中)、联苯胺混合液(0.1克联苯胺在研钵 中加少许蒸馏水研成细浆,加入100ml蒸馏水, 过滤后加入2滴3%双氧水,放棕色瓶中备用)、 1%番红[1克番红O(Safranine O)染料溶于 100ml蒸馏水中]。
实验6 实验 细胞内过氧化物酶的显示
联苯胺反应
【实验目的】 实验目的】
掌握联苯胺反应法显示细胞内过氧化物酶的原 理和方法。
【实验原理】 实验原理】
细胞内的过氧化物酶可以将联苯胺氧化成蓝色 或者棕色产物,蓝色为中间产物联苯胺蓝,很 不稳定,可自然转变为棕色的联苯胺腙,通过 产物颜色间接显示出细胞内过氧化物酶的分布。
【实验步骤】 实验步骤】
用颈椎脱臼法处死小鼠,剪开大腿上的皮肤和肌肉, 取出股骨; 剪断或者折断股骨,用牙签挑取骨髓,放置于载玻片 上制成涂片,晾干; 将涂片上滴加几滴0.5% CuSO4,固定1分钟; 倾去CuSO4溶液,滴加0.1%联苯胺混合液,染色6分 钟; 用自来水或蒸馏水冲洗,滴加1%番红染液,染色1分 钟; 用自来水或者蒸馏水冲洗,空气中晾干,显微镜下观 察。
颈椎脱臼法处死小鼠
【观察与结果】 观察与结果】
骨髓细胞内可以见到蓝色或者棕色的颗粒, 即过氧化物酶所在的部位。
细胞化学染色检验

失染 。 色 液 适 宜 p H 值 应 为 5 . 5 , 若
度与加入量不能随意更改。涂片
pH值 <5.0会出现假阳性结果。
中粒细胞看不见阳性颗粒,红细
胞呈棕色或绿色,即表示过氧化
氢过浓。若过氧化氢加于血片上
不 产 生 气 泡试,剂则应示置无于效低。温 暗 处 , 防 止 光 线 照 射 失 效 。
1. 染色时加稀过氧化氢溶液之后必须与染色液充分
混匀,否则同一片子上细胞染色情况不一致。
临床意义
POX染色是鉴别急性粒细胞白血病(acute myeloblastic leukemia, AML)、急性单核细胞白血病(acute monocytic leukemia, AMOL)、 急性淋巴细胞白血病(acute lymphocytic leukemia, ALL)的重要细 胞化学染色方法。AML时白血病细胞可呈阳性反应, 阳性颗粒一般较 多, 较粗大,常呈局限性分布;ALL时白血病细胞呈阴性反应; AMOL时白血病细胞呈阴性或弱阳性反应,阳性时颗粒稀少、细小, 呈弥散分布。
阴 性:无颗粒。 弱阳性:颗粒小,分布稀疏。 阳 性:颗粒略粗,分布较密集。 强阳性:颗粒粗大,密布于整个胞质中。
注意事项
涂片应新鲜制作、厚薄适宜。
TMB 配制在85%~88%的乙
醇溶液中染色效果较好,勿用
洋葱鳞茎和黄豆表皮细胞液泡系的活体染色

洋葱鳞茎和黄豆表皮细胞液泡系的活体染色摘要:活体染色是指对生活有机体的细胞或组织能着色,但又无迫害的一种染色方式。
本文利用中性红染料对洋葱鳞茎细胞和黄豆表皮细胞进行了活体染色,均取得了较好的染色成效。
关键词:活体染色;液泡系;染色技术;植物细胞Abstract:Vital staining is a technique that can dye the living organic cell withouttoxicity. In this experiment the bean epidermis cells and onion bulb cells wereproceeded vital staining by neutral red,and we got eligible samples.Key word:Vital staining,Vacuome,Staining technique,Plant cell前言早在1887年,荷兰植物生理学家第一用次甲基蓝的稀释溶液对水棉和蓝藻及浮萍叶细胞的液泡进行活体染色。
那时对他的实验没有引发重视。
直到20世纪30年代前后,法国闻名的植物学家季尔蒙()和唐萨尔()两个学派系统地、全面地进行活体染色剂的利用,利用活体染色技术来研究活的植物细胞内细胞质大体形态构造的组成物。
他们前后提出了“液泡系统”和“线粒体系统和质体系统”的学说。
从1924年至1934年,法国的又系统地、深切地利用活体染色技术,并与其他新技术结合,研究动物细胞的细胞质大体的形态结构、演进规律及其生理功能。
Parat第一次在动物活细胞内发觉了一个液泡系,提出了“液泡系和高尔基区学说”。
苏联的拿索诺夫学派,后来还在Parat学说的基础上,应用中性红活体染色技术来研究细胞的“类坏死”现象和医学上的一些问题。
自20世纪30年代以后,这种新技术才愈来愈显示它的重要性,成为实验细胞学的一种研究方式。
细胞色素氧化酶染色液(联苯胺法)
北京雷根生物技术有限公司
细胞色素氧化酶染色液(联苯胺法)
简介:
细胞色素氧化酶(Cytochrome Oxidase,CO)被认为是线粒体膜固有的酶,在含有大 量线粒体的细胞(如心肌、肾小管上皮以及胃壁细胞、肝细胞)内都具有高度活性。细胞色素 氧化酶染色液(联苯胺法)染色原理是细胞色素氧化酶催化 3,3-二氨基联苯胺(DAB)使其侧 链的氨基氧化,进行反复的氧化性聚合和氧化性环化形成不溶性的棕色 Phenazine 聚合物。
阴性对照(可选):
相同切片入 CO 对照工作液,室温孵育 30~60min,其余同上,呈阴性反应。
注意事项:
1、 本染色液适用于冰冻切片,同时应减少切片在室温暴露的时间。 2、 CO 孵育液孵育时间因组织而异。
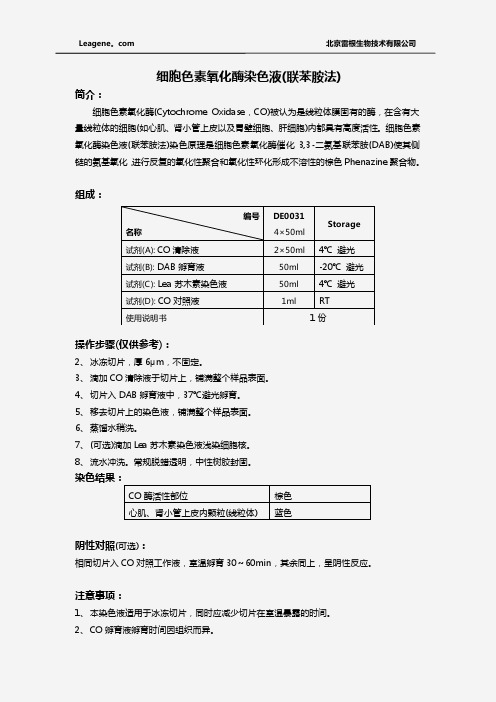
组成:
名称 试剂(A): CO 清除液 试剂(B): DAB 孵育液 试剂(C): Lea 苏木素染色液 试剂(D): CO 对照液 使用说明 书
编号
DE0 031 4×50ml
Storage
2×50ml 4℃ 避光
50ml -20℃ 避光
50ml 4℃ 避光
1ml
ห้องสมุดไป่ตู้
RT
1份
操作步骤(仅供参考):
2、 冰冻切片,厚 6μm,不固定。
3、 滴加 CO 清除液于切片上,铺满整个样品表面。
4、 切片入 DAB 孵育液中,37℃避光孵育。
5、 移去切片上的染色液,铺满整个样品表面。
6、 蒸馏水稍洗。
7、 (可选)滴加 Lea 苏木素染色液浅染细胞核。
8、 流水冲洗。常规脱蜡透明,中性树胶封固。
染色结果:
CO 酶活性部位
棕色
心肌、肾小管上皮内颗粒(线粒体) 蓝色
(PAS反应与联苯胺反应)

实验三PAS反应与联苯胺反应一:实验目的:掌握显示细胞中多糖和过氧化物酶反应的原理和方法。
二:实验原理:1、高碘酸—希夫试剂反应简称PAS(Periodic Acid Schiff reaction)反应。
组织内的多糖等都用PAS法来显示。
其化学基础是利用过氧酸的氧化作用打开C—C键,将CH2OH—CH2OH变成CHO—CHO。
同样,对CH2OH—CHO,CH2OH—COOH,CH2OH—CH2NH2等物质均有氧化作用而放出醛基,这种新生的醛基和无色品红作用形成紫红色化合物(见图1)。
颜色的深浅与糖类的多少有关。
2、细胞内的过氧化物酶能把许多胺类化合物氧化为有色化合物(见图2),用联苯胺处理样本,细胞内的过氧化物酶能把联苯胺氧化为兰色的苯胺蓝,进而变为棕色产物,因而可以根据颜色反应来判断过氧化物酶的有无或多少。
三:实验材料与试剂1.材料:土豆块茎、洋葱根尖或鳞茎表皮。
2.器具:显微镜、载波片、单面刀片、培养皿、镊子、染色钵、盖玻片、吸水纸。
3.试剂:(1)过碘酸酒精溶液:过碘酸(高碘酸)0.4g95%酒精35ml0.2 mol/L醋酸钠5ml (即17.2g醋酸钠溶于1000ml 蒸馏水)蒸馏水10ml该液需保存于冰箱,包黑纸,如变黄则失效。
(2)Shiff试剂(详见指导书P75页)(3)0.1%钼酸铵溶液:称取0.1 g钼酸铵溶于100 ml 0.85%盐水(4)联苯胺混合液(临用前配制)联苯胺0.2g95%乙醇100ml3%H2022滴(5)亚硫酸水溶液:取200ml自来水,加10ml10%的偏重亚硫酸钠水溶液和10ml1mol/L 的HCl,三者于使用前混匀。
(6)70%乙醇四:实验的方法和步骤1 PAS反应(1)把马铃薯块茎徒手切成薄片,放入高碘酸溶液浸泡10min,用70%乙醇中浸片刻(2)将薄片浸入Schiff 试剂染色15分钟(3)取出放入亚硫酸水中洗3次,每次1min(4) 蒸馏水冲洗片刻,压片观察2. 联苯胺反应(1)把洋葱根尖徒手切成20-40 µm厚的薄片或用镊子撕取洋葱鳞茎内表皮一小块(2)浸在溶有0.1%钼酸铵的0.85%盐水溶液中5 min(钼酸铵起催化作用)(3)浸在联苯胺溶液内2 min至切片出现蓝色(4)在0.85%盐水溶液中洗1 min(5)将薄片置于载玻片上展开,盖上盖玻片,显微镜检查五:实验结果1.PAS反应:块茎组织细胞内可见到紫红色或深红色的淀粉颗粒,对照片无色或色淡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
细胞色素氧化酶染色液(联苯胺法)
简介:
细胞色素氧化酶(Cytochrome Oxidase ,CO)被认为是线粒体膜固有的酶,在含有大量线粒体的细胞(如心肌、肾小管上皮以及胃壁细胞、肝细胞)内都具有高度活性。
细胞色素氧化酶染色液(联苯胺法)染色原理是细胞色素氧化酶催化3,3-二氨基联苯胺(DAB)使其侧链的氨基氧化,进行反复的氧化性聚合和氧化性环化形成不溶性的棕色Phenazine 聚合物。
此酶对固定剂敏感,故须用新鲜切片。
组成:
操作步骤(仅供参考):
2、 冰冻切片,厚6μm ,不固定。
3、 滴加CO 清除液于切片上,铺满整个样品表面。
4、 切片入DAB 孵育液中37℃避光孵育。
5、 移去切片上的染色液,滴加CO 清除液于切片上,铺满整个样品表面。
6、 蒸馏水稍洗。
7、 (可选)滴加Lea 苏木素染色液浅染细胞核。
8、 流水冲洗。
常规脱蜡透明,中性树胶封固。
染色结果:
CO 酶活性部位
棕色 心肌、肾小管上皮内颗粒(线粒体) 蓝色
编号 名称
DE0031 4×50ml Storage
试剂(A): CO 清除液 2×50ml 4℃ 避光 试剂(B):
DAB 孵育液 B1: DAB 染色液
45ml -20℃ 避光 B2: DAB 增强剂
5ml RT B3: DAB 反应液
100μl
RT
按B1:B2:B3=9000:1000:3混合,即为DAB 孵育液,即配即用。
试剂(C): Lea 苏木素染色液 50ml 4℃ 避光 试剂(D): CO 对照液 1ml
RT 使用说明书
1份
注意事项:
1、本染色液适用于冰冻切片,同时应减少切片在室温暴露的时间。
2、CO孵育液孵育时间因组织而异,心肌、肾孵育约20~30min,肝脏约50~60min,
甲状腺滤泡上皮约2h。
3、为了您的安全和健康,请穿实验服并戴一次性手套操作。
