阿托伐他汀钙杂质分析
阿托伐他汀钙杂质列表-杂质对照品
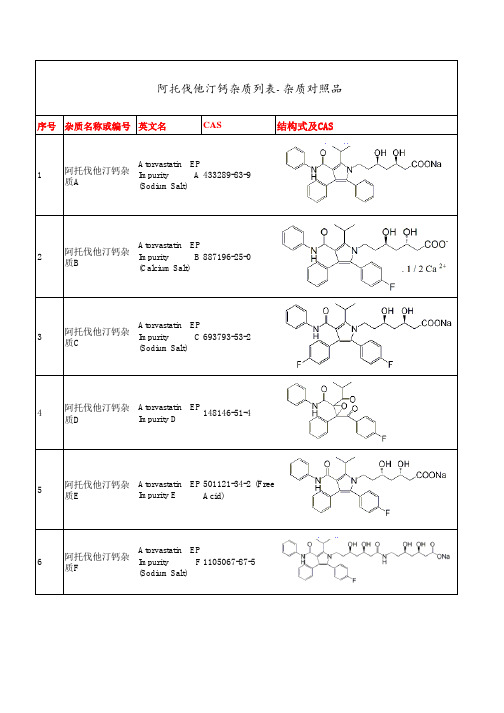
阿托伐他汀钙杂质列表-杂质对照品序号杂质名称或编号英文名CAS结构式及CAS1阿托伐他汀钙杂质A Atorvastatin EPImpurity A(Sodium Salt)433289-83-92阿托伐他汀钙杂质B Atorvastatin EPImpurity B (Calcium Salt)887196-25-03阿托伐他汀钙杂质C Atorvastatin EPImpurity C(Sodium Salt)693793-53-24阿托伐他汀钙杂质D Atorvastatin EPImpurity D148146-51-45阿托伐他汀钙杂质E Atorvastatin EPImpurity E501121-34-2 (FreeAcid)6阿托伐他汀钙杂质F Atorvastatin EPImpurity F(Sodium Salt)1105067-87-57阿托伐他汀钙杂质G Atorvastatin EPImpurity G(Sodium Salt)887196-29-48阿托伐他汀钙杂质H Atorvastatin EPImpurity H125995-03-19阿托伐他汀钙杂质I Atorvastatin EPImpurity I125971-95-1相关杂质1、阿考替胺杂质2、维格列汀杂质3、厄洛替尼杂质4、利伐沙班杂质5、索拉非尼杂质6、阿伐那非杂质7、替卡格雷杂质8、阿哌沙班杂质9、米格列奈杂质10、普拉克索杂质11、氨氯地平杂质12、非不司他杂质13、托法替尼杂质14、达比加群酯杂质15、埃索美拉唑钠杂质16、盐酸氨溴索杂质 17、卡格列净杂质 18 索菲布韦杂质 19、依托考昔杂质及代理其他品牌杂质标准品(EP、USP、LGC、TRC、TLC、MC、SINCO)等。
联系电话:0755 - 89483656深圳菲斯—专注标准品。
阿托伐他汀钙质量研究方案

阿托伐他汀钙片研究方案产品名称:阿托伐他汀钙片申报类别:六类英文名:Atorvastatin Calcium Tablets商品名:进口,立普妥(Lipitor);国产,阿乐、尤佳。
原研企业:华纳-兰伯特(现并入辉瑞)研发背景:阿托伐他汀钙是全合成、高纯化、高选择性抑制HMG-CoA还原酶的药物,美国华纳-兰伯特(现并入辉瑞)研制,于1997年率先在英国,美国上市,为第三代他汀类新药。
国内共有原料生产厂家5个,制剂生产厂家3个,剂型有片剂与胶囊两种,规格分别有10,20,40mg共三种。
专利情况:美国辉瑞制药拥有原料晶型Ⅰ的专利权(不确定)参比制剂:选用原研厂家美国辉瑞制药生产的阿托伐他汀钙片,商品名:立普妥;规格分别有10,20,40mg共三种。
批准文号:国药准字20051407(10mg);生产企业:辉瑞制药有限公司大连经济技术开发区大庆路22号;执行标准:JX20000048 生产日期:生产批号:有效期至:目前有阿托伐他汀钙原料的进口注册标准(JX20020147),氨氯地平阿托伐他汀钙片的进口注册标准(JX20070048),以及自拟的阿托伐他汀钙原料质量标准,阿托伐他汀钙原料与片剂的新药转正标准(三十六册),标准比较结果见表:若购买到阿托伐他汀钙片剂的进口注册标准,则参考此标准进行质量研究;若不能,就参考原料的新药转正标准和(自制的原料药质量标准)进行研究,有关物质分两部分进行研究:手性异构体单独控制,高效液相等度法控制其它杂质,同时采用此方法测定含量。
溶出度方法对新药转正标准片剂的紫外分光度法和复方制剂进口注册标准的液相色谱法进行方法学对研究以确定采用何种方法。
一、首先对被仿制样品立普妥进行研究,时间---------性状,鉴别:参照片剂的进口注册标准(JX20000048)检验;其他检查项:应符合片剂项下有关的各项规定(参照中国药典2010年版二部附录);含量均匀度:参照含量测定项下的方法测定(中国药典2010年版二部附录)有关物质:参考片剂的新药转正标准中的有关物质检测方法与片剂的进口注册标准有关物质检测方法,对两种方法进行对比研究,均作方法学验证。
阿托伐他汀钙报告

阿托伐他汀钙报告介绍阿托伐他汀钙是一种广泛使用的药物,用于降低胆固醇水平和预防心血管疾病的发生。
本报告将对阿托伐他汀钙进行综合分析,包括其药物特性、适应症、副作用、药物相互作用等各个方面的内容。
药物特性阿托伐他汀钙是一种他汀类药物,属于HMG-CoA还原酶抑制剂。
它通过抑制肝脏内的胆固醇合成,从而降低血液中的胆固醇水平。
在药物的作用下,血液中的低密度脂蛋白(LDL)水平下降,高密度脂蛋白(HDL)水平上升,并能够降低三酰甘油的水平。
适应症阿托伐他汀钙一般用于治疗高胆固醇和高血脂症,包括家族性高胆固醇血症、非家族性高胆固醇血症以及混合型高血脂症等。
此外,阿托伐他汀钙还可以用于预防心血管疾病,例如心肌梗死、冠心病、脑卒中等。
副作用虽然阿托伐他汀钙是一种相对安全的药物,但它也会引起一些副作用,如:•肌肉疼痛•肌肉无力•肝损伤•胃肠道不适•头痛•失眠在服用阿托伐他汀钙期间,如果出现以上症状,应及时咨询医生。
药物相互作用阿托伐他汀钙可以与其他药物相互作用,从而影响其疗效或增加其副作用的风险。
具体来说,阿托伐他汀钙可能会与以下药物产生相互作用:•免疫抑制剂:如环孢素、依托肽、沙利度胺等。
•抗凝剂:如双香豆素、华法林等。
•抗真菌药物:如伊曲康唑、氟康唑等。
•抗生素:如红霉素、克拉霉素等。
在服用以上药物时,应向医生咨询,避免产生不良反应。
注意事项在使用阿托伐他汀钙前,有一些需要注意的事项:•避免酗酒,同时要跟医生告知自己的饮酒情况。
•如果怀孕或正在哺乳,应在医生指导下使用药物。
•定期检查肝功能,避免肝损伤的发生。
•注意药物相互作用,避免产生不良反应。
•如果出现副作用,应及时联系医生。
阿托伐他汀钙是一种有效的药物,可以降低血液中的胆固醇水平,预防心血管疾病的发生。
在使用药物期间,要注意遵循医嘱,避免出现不良反应等问题。
阿托伐他汀杂质研究总结
Atorvastatin Impurity 1
2165770-84-1
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
阿托伐他汀杂质 11
2
Atorvastatin Impurity 2
1116118-82-1
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
阿托伐他汀杂质 12
内酯
Dehydro Lactone
注册申报
100mg
其他
阿托伐他汀 EP 杂 Atorvastatin EP
5
质C
Impurity C
693794-20-6
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
10mg
25mg
阿托伐他汀 EP 杂 Atorvastatin EP
项目研发
6
项目研发 注册申报
项目研发 注册申报
125988-01-4
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
阿托伐他汀杂质 25
16
Atorvastatin Impurity 16
134395-00-9
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
阿托伐他汀杂质 26
项目研发 注册申报
阿托伐他汀杂质 36
27
Atorvastatin Impurity 27
10mg
25mg
项目研发
N/A
50mg
注册申报
100mg
其他
阿托伐他汀杂质 37
28
Atorvastatin Impurity 28
阿托伐他汀钙片 药品质量标准

阿托伐他汀钙片药品质量标准正式名:阿托伐他汀钙片汉语拼音:Atuofatatinggai标准号:WS-386(X-338)-99拉丁文或英文:Atorvastatin主要活性成分:本品含阿托伐他汀钙盐(2:1)三水合物((C33H34FN2O5)2Ca·3H2O性状:本品为白色薄膜衣片,除去膜衣后显白色。
鉴别:(1)取本品的细粉适量(约相当于C33H35FN2O5 10mg),加乙醇5ml,振摇使阿托伐他汀钙溶解,滤过,滤液作为供试品的溶液;另取阿托伐他汀钙对照品,用乙醇配制成每1ml含2mg C33H35FN2O5的溶液,作为对照品溶液。
照薄层<aclass="channel_keylink" href="/product/list.asp?sortid=36">色谱</a>法(中国药典1995年版二部附录V B)试验,吸取上述两种溶液各5(l,分别点于同一硅胶GF254薄层板上,以二氯甲烷-甲醇-甲酸(80:5:1)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品溶液所显主斑点的颜色和位置应与对照品溶液的主斑点相同。
(2)取含量测定项下的溶液,照分光光度法(中国药典1995年版二部附录IV A)测定,在247nm的波长处有最大吸收。
检查:有关物质照阿托伐他汀钙含量测定项下的方法。
称取本品的细粉中华人民共和国国家药品监督管理局发布北京市药品检验所审核国家药品监督管理局药品审评委员会审订北京红惠<a class="channel_keylink" href="/">制药</a>有限公司提出本标准自1999年9月29日起试行,试行期2年。
保护期8年,保护期内,其它单位不得仿制。
适量(约相当于C33H35FN2O512.5mg)于25ml量瓶中,加适量乙腈-0.05mol/L柠檬酸铵溶剂(0.05mol/L柠檬酸用氨水调pH值7.4)(50:50),超声5分钟使阿托伐他汀钙溶解,冷却,用上述溶剂稀释至刻度,摇匀,用0.45(滤膜过滤,取滤液作为供试品溶液;精密量取供试品溶液适量,加上述溶剂稀释成每1ml中含15(g的溶液,作为对照溶液;取对照溶液20(l注入液相<a class="channel_keylink"href="/product/list.asp?sortid=36">色谱</a>仪,调节检测灵敏度,使主成分<a class="channel_keylink"href="/product/list.asp?sortid=36">色谱</a>峰的峰高为记录满标度的25%,再精密量取供试品溶液与对照溶液各20(l,分别注入液相色谱仪,记录色谱图至主成分保留时间的3倍。
氨氯地平阿托伐他汀钙片标准

氨氯地平阿托伐他汀钙片Anlüdiping Atuofatatinggai pianAmlodiping Besylate and Atorvastatin Calcium Tablets 本品含苯磺酸氨氯地平按氨氯地平(C20H25N2O5Cl)计应为标示量的95.0%~105.0%,含阿托伐他汀钙按阿托伐他汀(C33H34FN2O5)计应为标示量的95.0%~105.0%。
【性状】本品为白色薄膜衣片,除去包衣显白色或类白色。
【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液两主峰的保留时间应与对照品溶液相应的两主峰的保留时间一致。
(2)采用二极管阵列检测器检测,在含量测定项下记录的色谱图中,供试品溶液两主峰的紫外吸收光谱图应与对照品溶液相应的两主峰的紫外吸收光谱图一致。
【检查】有关物质取本品5片,置50ml量瓶(5mg/10mg)或100ml量瓶(5mg/20mg)中,加稀释溶液约量瓶体积的一半,振摇使崩解,加稀释溶液稀释至刻度,摇匀,放入搅拌子搅拌20分钟,放置,使大部分辅料沉淀后,取上清液,用0.45µm的滤膜过滤,取续滤液作为供试品溶液(临用新制)。
取苯磺酸氨氯地平对照品14mg和阿托伐他汀钙对照品27mg,精密称定,同置100ml量瓶中,加稀释液溶解并稀释至刻度,摇匀,再精密量取1ml,置50ml量瓶,用稀释液稀释至刻度,摇匀,作为对照品溶液①,再精密量取对照品溶液①5ml,用稀释溶液稀释至100ml,为对照品溶液②。
照高效液相色谱法(中国药典2010 年版二部附录V A)试验。
用氰基键合硅胶为填充剂(Agilent ZORBAX SB-CN 柱适用),以乙腈-0.05mol/L乙酸铵溶液(用冰醋酸试液调节pH值至5.0)(25∶75)为流动相A,以为乙腈-0.05mol/L乙酸铵溶液(用冰醋酸试液调节pH值至5.0)(50∶50)为流动相B,照下表进行梯度洗脱,流速为每分钟1ml,柱温40℃;检测波长为240nm。
阿托伐他汀钙片剂制剂及质量控制概述

TECHNOLOGY AND INFORMATION医疗与信息化科学与信息化2020年7月中 133阿托伐他汀钙片剂制剂及质量控制概述刘磊哈药集团技术中心 黑龙江 哈尔滨 150025摘 要 阿托伐他汀钙是新一代他汀类降血脂药,它不仅能降低胆固醇,而且也能降低甘油三酯,临床作用显著。
本文对其有关物质进行了系统的研究,制定出完善的制剂质量标准草案,从而使本品制剂的安全性、有效性和产品的均一性得到保证。
关键词 阿托伐他汀钙片剂;制剂;质量1 阿托伐他汀钙研究现状在阿托伐他汀钙片质量标准研究中,最容易忽略的是对产品中非对映光学异构体和对映光学异构体的研究。
在大多厂家提供的有关物质研究资料中,有关物质检查的色谱条件并不能很好的分离他汀类药物的对映光学异构体(某些色谱条件仅能分离非对映光学异构体),因此需要采用手性色谱条件进行研究。
在制定质量标准时需要注意有关物质、非对映光学异构体和对映光学异构体应单独设定质控限度[1]。
2 阿托伐他汀钙片剂制剂工艺研究阿托伐他汀钙原研厂家(美国辉瑞)的说明书显示对照药品使用的辅料有碳酸钙、微晶纤维素、一水乳糖、交联羧甲基纤维素钠、吐温-80、羟丙基纤维素、硬脂酸镁,参照对照药品的处方并结合自身的处方工艺研究,最终确定的处方中所使用的辅料:碳酸钙、微晶纤维素、乳糖、交联羧甲基纤维素钠、吐温-80、羟丙基纤维素、硬脂酸镁,辅料与原研厂家一致。
参照阿托伐他汀钙市售品处方,确定其工艺如下:(1)原辅料准备:阿托伐他汀钙过120目筛备用;碳酸钙、微晶纤维素、一水乳糖、交联羧甲基纤维素钠,过80目筛备用。
(2)混料:称取处方量的阿托伐他汀钙、碳酸钙、微晶纤维素、一水乳糖及1/2处方量的交联羧甲基纤维素钠,混匀。
(3)黏合剂制备:称取处方量的吐温-80,加入到60mL 水中,50℃加热溶解后将加入处方量的羟丙基纤维素,搅拌混合后放置4小时左右,制成含羟丙基纤维素5%的水溶液。
(4)制粒:用上述溶液制软材,过24目筛制粒。
高效液相色谱法测定阿托伐他汀钙片中阿托伐他汀钙的含量

高效液相色谱法测定阿托伐他汀钙片中阿托伐他汀钙的含量汪秋兰;王文清;施春阳;谢斌;林蒙;方建国【摘要】目的建立高效液相色谱(HPLC)法测定阿托伐他汀钙片中阿托伐他汀钙含量的.方法色谱柱为Apollo C18(250 mm×4.6 mm,5μm),以醋酸盐缓冲液(称取醋酸铵1.54 g,加水溶解并稀释至1 000 mL,用冰醋酸调节pH至4.50±0.05)-乙腈(60:40)为流动相,检测波长:244 nm,进样量:10 μL.结果阿托伐他汀钙的线性范围为46.84~936.80 μg·mL-1(r=0.999 95,n=6);平均回收率为100.68%,RSD为0.78%(n=9).结论该方法快速、准确、重复性好,适用于阿托伐他汀钙片的质量控制.【期刊名称】《医药导报》【年(卷),期】2013(032)003【总页数】3页(P366-368)【关键词】阿托伐他汀钙;含量测定;色谱法,高效液相【作者】汪秋兰;王文清;施春阳;谢斌;林蒙;方建国【作者单位】华中科技大学同济医学院附属同济医院药学部,武汉430030【正文语种】中文【中图分类】R972.6;R927.2阿托伐他汀钙为他汀类血脂调节药,是3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl-coenzymeA,HMG-CoA)还原酶的选择性、竞争性抑制药,通过抑制肝脏内HMG-CoA还原酶和胆固醇的合成从而降低血浆中胆固醇和脂蛋白水平,并通过增加细胞表面的低密度脂蛋白(low density lipoprotein,LDL)受体以增加LDL的摄取和代谢。
用于原发性高胆固醇血症和混合性高脂血症,降低升高的总胆固醇、低密度脂蛋白胆固醇、载脂蛋白B及三酰甘油水平[1-2]。
笔者参考部颁标准[3]、《美国药典》第34版原料药标准[4]及文献[5],采用高效液相色谱(HPLC)法,对本品的含量进行研究,方法专属性强,重复性好,准确度高,能有效地用于本品质量的控制。
GC法测定阿托伐他汀钙关键中间体ATS-9

GC法测定阿托伐他汀钙关键中间体ATS-9吕一甫;徐桂清;郝乐辰;曾淑芸;李杰;贾淑红;姜玉钦;李伟【摘要】建立了一种检测阿托伐他汀钙关键中间体(ATS-9)含量的气相色谱法.采用Agilent DB-624(30 m×0.32 mm,1.8μm)毛细管气相色谱柱,高纯氮为载气,氢火焰离子化检测器检测,程序升温,1,2-二氯乙烷为稀释溶剂,正十六烷为内标物.ATS-9在0.8128~4.0638 mg·mL-1(r=0.9995)范围内,线性关系良好,平均回收率为99.68%,RSD为1.26%.【期刊名称】《合成化学》【年(卷),期】2018(026)009【总页数】4页(P695-698)【关键词】阿托伐他汀钙中间体;ATS-9;气相色谱;含量测定【作者】吕一甫;徐桂清;郝乐辰;曾淑芸;李杰;贾淑红;姜玉钦;李伟【作者单位】天方药业有限公司,河南驻马店 463000;河南师范大学化学化工学院,河南新乡 453007;河南师范大学化学化工学院,河南新乡 453007;河南师范大学化学化工学院,河南新乡 453007;河南师范大学化学化工学院,河南新乡 453007;河南师范大学化学化工学院,河南新乡 453007;天方药业有限公司,河南驻马店 463000;河南师范大学化学化工学院,河南新乡 453007;河南师范大学化学化工学院,河南新乡 453007【正文语种】中文【中图分类】O657.7+1阿托伐他汀钙(atorvastatin calcium, 1),商品名为立普妥(Lipitor),是HMG-CoA还原酶选择性、竞争性抑制剂,属于第三代全合成的他汀类调血脂药。
1的合成方法繁多[1-4],但Paal-Knorr法目前仍是经典合成方法[5-6],其核心是将关键中间体(4R,6R)-6-胺乙基-2,2-二甲基-1,3-二氧六环-4-乙酸叔丁酯(ATS-9)和4-氟-α-(2-甲基-1-氧代丙基)-γ-氧代-N,β-二苯基苯丁酰胺(M-4)[7]进行缩合,再经脱保护、水解、成盐等反应得到1。
阿托伐他汀钙片进口标准JX20070073

国家食品药品监督管理局进口药品注册标准标准号:JX20070073阿托伐他汀钙片Atuofatatinggai pianAtorvastatin Calcium Tablets本品含阿托伐他汀钙以阿托伐他汀(C33H34FN2O5)计应为标示量的94.5%-105.0%。
【性状】本品为白色薄膜衣片。
【鉴别】(1)取本品的细粉适量(相当于阿托伐他汀10mg),置50ml量瓶中,加乙腈-水(1:1)混合液适量,充分振摇30分钟,使阿托伐他汀溶解,加乙腈-水(1:1)混合液稀释至刻度,将该溶液离心10分钟,取上清液作为供试品溶液。
另取阿托伐他汀钙对照品适量,加乙腈-水(1:1)混合液制成每1ml约含阿托伐他汀0.2mg的溶液,作为对照品溶液。
照薄层色谱法(中国药典2005年版二部附录ⅤB)试验,取上述供试品溶液与对照品溶液各20μl,分别点于同一高效硅胶GF254薄层板上,以乙酸乙酯-己烷-乙腈-甲醇-乙酸(10:8:1:0.5:0.3)为展开剂,展开后,晾干,置紫外灯254nm下检视。
供试品溶液所显主斑点的颜色与位置应与阿托伐他汀钙对照品溶液主斑点相同。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与阿托伐他汀钙对照品溶液主峰的保留时间一致。
【检查】有关物质照含量测定项下的方法测定。
取含量测定项下的样品溶液作为供试品溶液。
取上述溶液1ml,置500ml量瓶中,加混合溶剂稀释至刻度,摇匀,作为对照溶液。
取对照溶液20μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为记录仪满量程的20%-25%。
取供试品溶液与对照溶液各20μl分别注入液相色谱仪,记录色谱图至主峰保留时间的3倍,所显示的杂质峰,其中PD140728、PD130694、PD153824、PD148996和PD139884(相对保留时间分别为0.9、1.3、1.7、1.9和2.3)的峰面积不得大于对照溶液的主峰面积的2.5倍(0.5%),单个未知杂质峰面积不得大于对照溶液的主峰面积(0.2%),各杂质峰面积的和不得大于对照溶液的主峰面积的10倍(2.0%)。
探讨阿托伐他汀钙中间体中残留溶剂残留量的分析方法

探讨阿托伐他汀钙中间体中残留溶剂残留量的分析方法摘要:目的:探究阿托伐他汀钙中间体中残留溶剂残留量的分析方法。
方法:应用气相色谱法测定阿托伐他汀钙中间体中二氯甲烷和异丙醇的残留量,色谱柱选用DB-FFAP毛细管,柱长30mm,固定相选用硝基对苯二甲酸改性的聚乙二醇,以氮气作为载气,其流速设置为1.5mL/min,初始柱温设置为35℃,维持该温度6min后,再遵循20℃/min的程序进行升温处理,直到150℃,维持8.25min),进样口温度设置为200℃,检测器温度设置为250℃,分流比设置为30:1,进样量为1mL。
结果:二氯甲烷与异丙醇分离良好,线性系数均为0.9999,二氯甲烷的线性范围为2.05~45.2μg/mL,异丙醇的线性范围为42.26~253.56μg/mL;二氯甲烷定量限为2.05μg/mL,检测限为0.72μg/mL;异丙醇定量限为6.70μg/mL,检测限为2.68μg/mL;精密度、稳定性与重复性实验的RSD均不超过 2.89%。
结论:气相色谱法可用于阿托伐他汀钙中间体中残留溶剂残留量分析,操作便捷,检测灵敏度高,检测线性范围广,值得推广。
关键词:阿托伐他汀钙;中间体;残留溶剂前言:阿托伐他汀钙降脂效果显著,用药后不良反应少,为心脑血管类疾病常用药[1]。
在阿托伐他汀钙生产中,应用多种溶剂,中间体主环中可能残留二氯甲烷和异丙醇两种溶剂,残留溶剂的残留量过多,会增强用药的不良反应,出现更多毒副作用[2]。
就此,为提高药物生产质量,应严格控制残留溶剂,做好残留量检测工作。
目前常用气相色谱法测定药物残留溶剂的残留量,不同色谱条件检测效果不同,本文以本院阿托伐他汀钙为样本,开展如下分析:1资料与方法1.1 一般资料实验器材:Aglient气相色谱仪(型号:7890B,生产厂家:美国Aglient公司),配置FID检测器(型号:G1888,生产厂家:美国Aglient公司)实验试剂:二氯甲烷,异丙醇,均为色谱纯;阿托伐他汀钙中间体M4(批号:5313-180421,5313-180424,5313-180425,生产厂家:河南豫辰药业)1.2 方法在阿托伐他汀钙中间体中残留溶剂残留量测定时,实验流程如下:1.称量二氯甲烷与异丙醇,要求精密称定,二者质量分别为60mg、200mg,分别加入至100mL容量瓶中,向容量瓶内加入适量DMF(N-N二甲基甲酰胺),轻轻晃动容量瓶,使试剂溶解,再使用DMF定容至刻度,获得对照组贮备液;用DMF将对照组贮备液稀释20倍,制备对照品溶液。
阿托伐他汀钙杂质研究

阿托伐他汀钙杂质研究一、基本情况⏹阿托伐他汀钙(Atorvastatin Calcium)是一种人工合成的HMG-CoA还原酶抑制剂,是临床常用降血脂药⏹原研发企业为辉瑞公司(Pfizer)⏹目前国内有原研发企业产品及仿制药上市⏹原料药及其制剂质量标准收载于国家新药转正标准、USP33、EP7.1收载原料药二、杂质限度要求⏹最大日剂量:口服80mg/天四、杂质谱分析⏹工艺杂质:杂质A(去氟阿托伐他汀)⏹杂质C(双氟阿托伐他汀)、杂质F、杂质G⏹工艺杂质及降解产物⏹杂质B(非对映异构体)⏹杂质E(对映异构体)⏹降解产物:杂质D(环氧化物)⏹杂质H(内酯化降解产物)⏹EP中8个已知杂质结构五、本品常用制备工艺为先分别合成主环和侧链,然后缩合、脱保护、成盐。
在常规条件下前述8个杂质均可能出现可作为杂质研究的重要参考依据⏹ 需要注意存在的杂质并不限于前述8个已知杂质六、原料药杂质研究思路⏹ 以EP 标准中的检验方法及限度为参考依据,进行必要的方法验证⏹ 试制样品杂质检查结果符合EP 标准要求,无超过鉴定限度的其它杂质——达到研究目标 ⏹ 若杂质谱与EP 标准一致,但杂质量超过限度要求——完善工艺(精制:优化工艺参数;控制起始原料及中间体质量)⏹ 出现超过鉴定限度(0.1%)的新杂质——鉴定结构,分析原因,修改完善工艺,降低杂质量至0.1%以下。
⏹ 若新杂质不超过质控限度(0.15%),且经鉴定结构明确不是毒性 杂质,可订入质量标准中进行控制七、制剂杂质研究思路⏹ 应选择质量符合要求的原料药⏹ 若原料药质量符合要求,制剂杂质研究重点考察降解产物⏹ 关注降解途径及降解产物⏹ 阿托伐他汀主要降解途径为内酯化降解及氧化降解,氧化降解产物除环氧化物(杂质D )外,尚有其它降解产物。
⏹ EP 、USP 等未收载制剂。
与原研厂产品的对比研究对评价杂质检查方法及限度合理性的尤其重要八、申报品种的杂质研究情况⏹ 已有多家企业申报,研究工作的系统性和深入性参差不齐,有的品种差距较大 ⏹ 有以下几种情况⏹ 仅按照国家标准进行有关物质检查⏹ 在国家标准基础上,增加了对映异构体检查⏹ 在分析杂质谱的基础上,对各已知杂质、光学异构体均进行了研究与控制,并与上市产品进行了质量对比。
一种阿托伐他汀钙有关物质的测定方法[发明专利]
![一种阿托伐他汀钙有关物质的测定方法[发明专利]](https://img.taocdn.com/s3/m/0e5fc4f1227916888586d76a.png)
专利名称:一种阿托伐他汀钙有关物质的测定方法专利类型:发明专利
发明人:张晓峰,陈立云,邓凤霞,曾玉玲
申请号:CN201510178001.X
申请日:20150415
公开号:CN104931599A
公开日:
20150923
专利内容由知识产权出版社提供
摘要:本发明涉及一种阿托伐他汀钙有关物质的测定方法,包括以下步骤:步骤1,供试品溶液的配制:取阿托伐他汀钙适量,加溶剂溶解并定量稀释制成每1ml中约含1mg的溶液,作为供试品溶液;步骤2,混合对照品溶液的配制:称取杂质A、杂质B、杂质C、杂质D、杂质E的对照品与阿托伐他汀钙对照品各适量,加上述溶剂溶解并定量稀释制成每1ml中约含杂质A 3μg,杂质B、杂质C、杂质D、杂质E各2μg与阿托伐他汀钙10μg的溶液,作为混合对照品溶液,步骤3,高效液相色谱HPLC 分析:取供试品溶液与混合对照品溶液各20μl,分别注入液相色谱仪,记录色谱图至梯度洗脱程序结束,根据色谱图的峰面积计算各成分的含量。
申请人:北京嘉林药业股份有限公司
地址:100121 北京市朝阳区双桥东路
国籍:CN
代理机构:北京华科联合专利事务所(普通合伙)
更多信息请下载全文后查看。
HPLC法测定阿托伐他汀钙原料药含量

阿托伐他汀钙为3一羟基 一3一甲基一戊二酰辅酶 A (HMG—CoA)还 原 酶抑 制 剂 ,主 要通 过 抑 制 HMG—CoA还原酶的合成 ,从而抑制体 内胆固醇的合 成 ,由于细胞 内总胆固醇含量的减少 ,刺激细胞合 成低密度脂蛋 白 (LDL)受体加速 ,使肝脏表面LDL 受体数 目增多及 活性增强 ,从而促进LDL、极低密 度脂蛋白 (VLDL)和VLDL残粒通过受体降解途径 , 降低 血清 LDL含量 1-12]。
35℃,the injection volume was 20 uL,the mobile phase A was acetate bufer(3.9 g ammonium acetate,1 000 mL water, adjusting the pH to 5.0、Ⅳith glacial acetic acid):acetoniWile:tetrahydrofuran(wit hout inhibitor): 67:21:12.the mobile phase B was acetate bufer:acetonitrile:tetrahydrofuran(without inhibitor)=27:6l:12.the elution Wa s carried out according
方法符合方 法学 验证 的要 求 ,可 以满足含量 的检测 。
关 键 词 :阿托伐他汀钙 ;高效液相色谱法 ;含量 ;方 法学验证
中图分类号 :R927.2
文献标识码 : A
文章编号 : 1671—0460(2018)09—1983—04
D eterm inati0n of Content of Atorvastatin Calcium Raw M aterial by H PLC
AAS法测定阿托伐他汀钙原料药中锂的含量

AAS法测定阿托伐他汀钙原料药中锂的含量2浙江华海药业股份有限公司,浙江省临海市,317016摘要目的采用原子吸收光谱法(AAS)测定阿托伐他汀钙原料药中锂含量,为阿托伐他汀钙原料药中金属锂的质量控制提供依据。
方法波长670.78nm,乙炔流量 2.5L/min;空气流量10.0L/min,以盐酸-水-甲醇(2:25:75)为稀释液。
结果专属性:锂加标回收率97.2%;线性回归方程Y=0.1636X+0.001(R2=0.9999);准确度:回收率为95.0%~101.8%;精密度RSD=0.19%(n=6);定量限为1.2ppm,检出限为0.4ppm。
结论本方法简便、快速、准确、重复性好、灵敏度高,适用于阿托伐他汀钙原料药锂元素的含量测定。
关键词:阿托伐他汀钙,锂,二异丙基氨基锂,AASDetermination of Lithium in Atorvastatin Calciumby AASZhu Zhenxing1, Sun meiling1,kuang xiaxia2, Lin Jingjing1,Lou Xiya1, Wu xianqiu1,zhu danni1,(1 Zhejiang Hongyuan Pharmaceutical Co.,Ltd., Zhejiang Province, Linhai City 317016, China)(2 Zhejiang Huahai Pharmaceutical Co.,Ltd., Zhejiang Province, Linhai City 317016, China)ABSTRACTOBJECTIVE:An AAS method was established for Determinationof Lithium of Atorvastatin Calcium. METHODS: The wave-length was670.78nm, the flow rate of acetylene was 2.5L/min, the flow rate ofair was 10.0L/min.The diluent was hydrochloric acid-water-Methanol(2:25:75). RESULTS:Specificity was good, the recovery was 97.2%. The linearregression equation was Y=0.1636X+0.001(R2=0.9999).Accuracy:the recoveries were between 95.0% and 101.8%. Precision: RSD of Li was0.19%(n=6). The limit of quantitation was 1.2ppm, the limit ofdetection was 0.4ppm . CONCLUTIONS: The method wassimple,rapid,accurate and shows good precision, so it was suitable for the determination of Lithium in Atorvastatin Calcium.KEY WORDS: Atorvastatin Calcium,Li,Lithium diisopropylamide,AAS阿托伐他汀钙[1-2],商品名LIPITOR,是HMG-CoA还原酶的选择性、竞争性抑制剂,通过抑制肝脏内HMG-CoA还原酶和胆固醇的合成从而降低血浆中胆固醇和脂蛋白水平,并通过增加细胞表明的肝脏LDL受体以增强LDL的摄取和代谢;适用于高胆固醇血症和冠心病,是全球第1个年度销售额超过百亿美元的重磅新药。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阿托伐他汀钙杂质分析
本篇通过文献摘录了常用的3条工艺路线,并对可能产生的杂质进行了分析。
一.简要内容
路线1:
工艺杂质:7-氨基-3,5-二羟基庚酸钙、二酮中间体、缩合物中间体、二胺、二氟阿托伐他汀钙、去氟阿托伐他汀钙、阿托伐他汀叔丁酯、阿托伐他汀甲酯、阿托伐他汀乙酯、阿托伐他汀钙非対映体、阿托阿伐他汀钙对映体降解杂质:阿托伐他汀内酯
路线2:
工艺杂质:由中间体引入的杂质与“路线1”不同。
即:增加“氧代中间体”,剔除“7-氨基-3,5-二羟基庚酸钙”、“二酮中间体”、“缩合物中间体”、“二胺”。
降解杂质:阿托伐他汀内酯
路线3:
工艺杂质:由中间体引入的杂质与“路线1”不同。
即增加“阿托伐他汀苯乙酰胺”、“苯乙胺”,剔除“7-氨基-3,5-二羟基庚酸钙”、“二酮中间体”、“缩合物中间体”、“二胺”。
降解杂质:阿托伐他汀内酯
二、合成路线概述及相应杂质分析
1、合成路线概述
若以基本化工原料为起始物,阿托伐他汀钙的合成步骤长,且有许多种不同的合成路线。
原料药中有关物质、特别是定性限以上杂质的引入往往与原料药合成的最后三步反应关系密切,根据最后三步反应可将文献中常见的阿托伐他汀钙合成路线概括为以下三条:
路线1:
H N O
O O
+
H 23)3
O
O
F
3)3
二酮中间体
合物中间体
阿托伐他汀叔丁酯
路线2:
氧代中间体
阿托伐他汀叔丁酯
1. NaOH
2. CaCl 2
3)3
Atorvastatin calcium
路线3:
+
阿托伐他汀内酯
阿托伐他汀内酯
2. 工艺引进杂质分析
一般而言,上述工艺路线中给出的各中间体、试剂均有可能向原料药中引入有关物质。
因“路线1”极有可能为普遍采用的工艺路线,故以它为主分析原料药中可能杂质。
在“路线1”中,若“缩合物中间体”中含有“胺酯中间体”,在后续酸解、碱解、成盐过程中理论上应转化为7-氨基-3,5-二羟基庚酸钙;若含有“二酮中间体”,理论上也有可能引入原料药中。
据物性推断,实际生产中通过控制缩合物质量等措施,原料药中这两种杂质的含量应易控制在定性限以下。
“胺酯中间体”常含少量“胺酯二胺”杂质,可向原料药中引入相应地“二胺”杂质;“缩合物中间体”水解常不完全,在原料药中常可检出;“缩合物中间体”常含少量“二氟缩合物”、“去氟缩合物”,很可能会将“二氟阿托伐他汀钙”和“去氟阿托伐他汀钙”引入原料药;作为酸解一步的中间体,“阿托伐他汀叔丁酯”也有可能引入原料药中。
酸解和碱解过程中,部分阿托伐他汀还可转化为“阿托伐他汀内酯”;缩合物的酸解和碱解常采用“甲醇-水”为混合溶剂,可通过“阿托伐他汀叔丁酯”的酯交换反应向原料药中引入“阿托伐他汀甲酯”,阿托伐他汀钙的纯化中有可能用到乙醇溶剂、可能将“阿托伐他汀乙酯”引入原料药中。
胺酯中间体常含光学异构体,可相应地将光学异构体引入缩合物及原料药内,阿托伐他汀钙非対映体还可能因碱解时少量阿托伐他汀(或叔丁酯)消旋而引入。
从原子经济学角度看,“路线2”不及“路线1”。
作为“路线2”的中间体,“氧代中间体”有可能引入原料药中。
“路线3”以(R)-苯乙胺为拆分剂,由(R,R)/(S,S)-阿托伐他汀内酯获得手性纯的(R,R)-阿托伐他汀内酯,该路线成本明显高于其它两条路线,可能很少用于工业化大生产。
作为“路线3”的中间体,“阿托阿伐他汀苯乙酰胺”、苯乙胺均可能引入原料药内。
