药品说明书规范格式及书写要求
药品说明书格式范文

药品说明书格式范文文章一:药品说明书格式范文作为药品使用者,我们需要了解如何正确使用药品,药品说明书是我们获取药品相关信息的最主要途径之一。
药品说明书格式是规范化的,下面就为大家介绍一些药品说明书格式的范文。
药品名称:阿司匹林【成份】每片含阿司匹林 100毫克。
【适应症】1. 镇痛、解热:适用于缓解感冒、发热、头痛、舒缓关节痛等症状。
2. 抗血栓防治:适用于预防心肌梗塞、脑梗死等血栓性疾病的再通,防止血小板聚集。
【规格】100片/瓶。
【用法用量】口服。
镇痛、解热:每次1-2片,每日3-4次;抗血栓防治:每日1-2片。
【注意事项】1. 本品含有阿司匹林,过敏体质者禁用。
2. 妊娠早期及哺乳期妇女慎用。
3. 心、肝、肾功能不全者应在医师监护下使用。
【不良反应】1. 可引起胃部不适、恶心、呕吐等症状。
2. 长期大量服用,可增加出血倾向性。
【贮藏】密封,置于阴凉干燥处。
【有效期】两年。
药品名称:盐酸氨溴索软胶囊【成份】每粒装盐酸氨溴索 50毫克。
【适应症】1. 适用于肌肉痉挛性疼痛:如背痛、颈肩痛、腰痛、关节疼痛等。
2. 适用于呼吸系统疾病:如支气管痉挛、哮喘等。
【规格】0.05克/粒,每盒装3板,每板10粒。
【用法用量】口服。
成人一次1-2粒,一日3次。
【注意事项】1. 有过敏体质者禁用。
2. 妊娠早期及哺乳期妇女禁用。
3. 心血管疾病、肝、肾功能不全者应在医师指导下使用。
【不良反应】1. 可引起恶心、呕吐等胃肠道不适。
2. 长期使用可引起头晕、心悸等神经系统反应。
【贮藏】密封,置于阴凉干燥处。
【有效期】24个月。
药品名称:利巴韦林滴眼液【成份】每瓶装利巴韦林 0.1克及辅料。
【适应症】1. 适用于病毒性眼炎、结膜炎、角膜炎等疾病。
2. 适用于keratoconjunctivitis及herpeskornege跟其他病毒性角膜炎。
【规格】3毫升/瓶。
【用法用量】滴眼。
成人一次1滴,一日3-4次;儿童用量应减少。
化学药品说明书格式

国家药品监督管理局二○○一年六月二十二日附件1(一)化学药品说明书格式××××说明书【药品名称】通用名:曾用名:商品名:英文名:汉语拼音:本品主要成分及其化学名称为:其结构式为:(注:复方制剂应写为:“本品为复方制剂,其组分为:”)【性状】【药理毒理】【药代动力学】【适应症】【用法用量】【不良反应】【禁忌症】【注意事项】【孕妇及哺乳期妇女用药】【儿童用药】【老年患者用药】【药物相互作用】【药物过量】【规格】【贮藏】【包装】【有效期】【批准文号】【生产企业】企业名称:地址:邮政编码:电话号码:传真号码:网址:(二)化学药品说明书规范细则(暂行)总体要求一、说明书应按不同剂型编写;“×××说明书”的“×××”须与通用名一致,且包括盐类和剂型名称。
二、“化学药品说明书格式”中所列【药品名称】、【性状】、【适应症】、【用法用量】、【规格】、【贮藏】、【有效期】项的内容均应按各品种的国家药品标准书写。
【批准文号】、【生产企业】项的内容按批准的内容书写。
三、关于【药理毒理】、【药代动力学】、【适应症】、【用示用量】、【不良反应】、【禁忌症】、【注意事项】、【孕妇及哺乳期妇女用药】、【儿童用药】、【老年患者用药】【药物相互作用】和【药物过量】等项的内容,应在既往国家药品监督管理部门已批准国内生产或进口的使用说明书的基础上,参照原开发厂的使用说明书书写,并参考《中华人民共和国药典2000年版二部临床用药须知》(国家药典委员会编,化学工业出版社出版,以下简称“临床用药通知”)、《新编药物学》、PDR(PYSICIANS DES REFERENCE)及有关该品不良反应报道、该品药物相互作用的研究,对上述项目进一步充实完善。
四、“化学药品说明书格式”中所列【孕妇及哺乳期妇女用药】、【药物相互作用】两项不可缺少,应如实填写,如缺乏可靠的实验或文献依据,应注明“尚不明确”。
药品说明书的具体格式、内容和书写要求

药品说明书的具体格式、内容和书写要求药品说明书是指药品生产企业为了向医生、药师和患者提供药品的使用信息和注意事项,而编写的一种文献资料。
药品说明书的格式、内容和书写要求都是非常严格的,以确保药品的安全使用和有效性。
具体格式:药品说明书的格式通常包括以下几个部分:1. 封面:封面应列明药品名称、规格和批准文号等信息。
2. 目录:目录应按照章节序号列出各部分的名称和页码。
3. 说明书正文:说明书正文应包括药品的适应症、用法用量、禁忌症、注意事项、不良反应、药物相互作用和药物过量等内容。
4. 附录:附录包括药品的化学成分、制剂和包装、药品稳定性、药理和毒理学等内容。
5. 版权页:版权页应列明药品说明书的版权所有者和出版日期等信息。
内容要求:药品说明书的内容应包括以下几个方面:1. 药品的适应症:药品适应症应准确明确,以便医生和患者正确使用药品。
2. 用法用量:应明确药品的用法、用量和使用方法。
3. 禁忌症:药品的禁忌症应清晰明确,避免不必要的风险和损害。
4. 注意事项:应明确药品的注意事项,避免因药品的使用不当而引起的不良反应和风险。
5. 不良反应:应包括药品的不良反应和预防措施等信息。
6. 药物相互作用:应列明药品与其他药品的相互作用和注意事项。
7. 药物过量:应列明药品过量使用的症状和处理方法。
书写要求:药品说明书的书写要求如下:1. 语言简练明了,用词准确规范,避免使用晦涩难懂的术语和生僻词汇。
2. 用黑色字体书写,字迹清晰,字号统一,行距适宜。
3. 应使用标准的符号和缩写,以方便医生和患者阅读和理解。
4. 介绍药品的药理和毒理学时,应根据不同读者的阅读水平,采用不同的表述方式。
总之,药品说明书是药品安全性和有效性的重要保障,药品生产企业应严格按照规定编写药品说明书,确保使用者正确、安全地使用药品。
药品说明书规范格式及书写要求
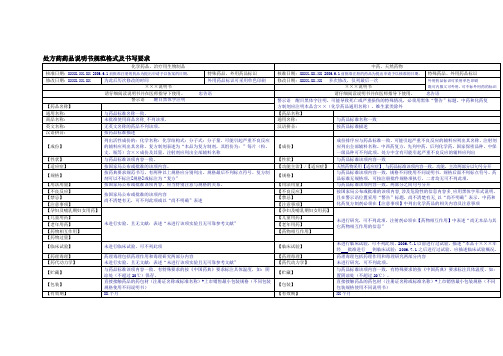
直接接触药品的药包材(注册证名称或标准名称)+上市销售最小包装规格(不同包装规格使用不同说明书)
【有效期】
XX个月
【有效期】
XX个月
【执行标准】
标准名称、版本或编号
【执行标准】
标准名称、版本或编号
【批准文号】
【批准文号】
【说明书修订日期】
经批准使用该说明书的日期
【说明书修订日期】
经批准使用该说明书的日期
特殊药品、外用药品标识
核准日期:XXXX.XX.XX2006.6.1前批准注册的药品为提出申请予以核准的日期。
特殊药品、外用药品标识
修改日期:XXXX.XX.XX
为此后历次修改的时间
外用药品标识可采用单色印刷
修改日期:XXXX.XX.XX 多次修改,仅列最后一次
外用药品标识可采用单色印刷
既可内服又可外用,可不标外用药的标识
【药物相互作用】
未进行实验,且无文献:注明“未进行该项实验且无可靠参考文献”。必须注明“如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。”
【药物相互作用】
未进行实验,且无文献:注明“未进行该项实验且无可靠参考文献”。必须注明“如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。”
【生产企业】
【生产企业】
企业名称:
与《药品生产许可证》一致
企业名称:
与《药品生产许可证》一致
生产地址:
生产地址:
邮政编码:
邮政编码:
电话号码:
须注明区号
电话号码:
须注明区号
传真号码:
传真号码:
网 址:
如无网址可不写,此项不保留
网 址:
国家食品药品监督管理局关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知

国家食品药品监督管理局关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2006.06.22•【文号】国食药监注[2006]283号•【施行日期】2006.06.22•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知(国食药监注[2006]283号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):为贯彻实施《药品说明书和标签管理规定》(国家食品药品监督管理局令第24号,以下简称《管理规定》),规范中药、天然药物处方药说明书的书写和印制,国家局制定了《中药、天然药物处方药说明书格式》(以下简称《说明书格式》)、《中药、天然药物处方药说明书内容书写要求》(以下简称《内容书写要求》)以及《中药、天然药物处方药说明书撰写指导原则》(以下简称《指导原则》),现予以印发,并就有关事项通知如下:一、自2006年7月1日起,国家局将按照《管理规定》、《说明书格式》、《内容书写要求》以及《指导原则》,对申请注册的中药、天然药物的说明书进行核准和发布,药品生产企业应当按照国家局核准的说明书进行印制。
二、2006年7月1日之前已经批准注册的中药、天然药物,药品生产企业应当根据《管理规定》、《说明书格式》、《内容书写要求》以及《指导原则》,并按《药品注册管理办法》修订说明书的申报资料要求,提交修订说明书的补充申请。
对于拟修订的说明书样稿(与原批准的说明书内容相比)不增加【孕妇及哺乳期妇女用药】、【儿童用药】、【老年用药】、【药物相互作用】、【临床试验】、【药理毒理】、【药代动力学】项目的,以及注射剂品种拟在【药物相互作用】项下仅表述为“尚无本品与其他药物相互作用的信息”的,药品生产企业应当向所在地省级食品药品监督管理局提交补充申请,省级食品药品监督管理局应当在60个工作日内完成审查,对符合要求的,发给《药品补充申请批件》并附核准后的说明书,同时报国家局备案。
化学药品非处方药说明书格式

附件1:化学药品非处方药说明书规范细则一、化学药品非处方药说明书格式非处方药、外用药品标识位置X X X说明书请仔细阅读说明书并按说明使用或在药师指导下购买和使用警示语位置【药品名称】【成份】【性状】【作用类别】【适应症】【规格】【用法用量】【不良反应】【禁忌】【注意事项】【药物相互作用】【贮藏】【包装】【有效期】【执行标准】【批准文号】【说明书修订日期】【生产企业】如有问题可与生产企业联系二、化学药品非处方药说明书各项内容书写要求非处方药、外用药品标识非处方药、外用药品标识在说明书首页右上角标注。
外用药品专用标识为红色方框底色内标注白色“外”字。
药品说明书如采用单色印刷,其说明书中外用药品专用标识亦可采用单色印刷。
非处方药专有标识按《关于公布非处方药专有标识及管理规定的通知》规定使用。
说明书标题“XXX说明书”中的“XXX”是指该药品的通用名称。
请仔细阅读说明书并按说明使用或在药师指导下购买和使用该忠告语必须标注,采用加重字体印刷。
警示语是指需特别提醒用药人在用药安全方面需特别注意的事项。
有该方面内容,应当在说明书标题下以醒目的黑体字注明。
无该方面内容的,不列该项。
【药品名称】按下列顺序列出:通用名称:属《中国药典》收载的品种,其通用名称应当与药典一致;药典未收载的品种,其名称应当符合药品通用名称命名原则。
商品名称:未批准使用商品名称的药品不列该项。
英文名称:无英文名称的药品不列该项。
汉语拼音:【成份】处方组成及各成份含量应与该药品注册批准证明文件一致。
成份含量按每一个制剂单位(如每片、粒、包、支、瓶等)计。
单一成份的制剂须写明成份通用名称及含量,并注明所有辅料成份。
表达为“本品每X 含XXXXXX。
辅料为:XXXXXXX”。
复方制剂须写明全部活性成份组成及各成份含量,并注明所有辅料成份。
表达为“本品为复方制剂,每X含XXXXXXX。
辅料为:XXXXXXX”。
【性状】包括药品的外观(颜色、外形)、气、味等,依次规范描述。
药品说明书格式

药品说明书格式【篇一:药品说明书规范格式及书写要求】【篇二:化学药品说明书的正确格式】化学药品说明书的正确格式一份合格的化学药品说明书,应该符合下面的格式:(左上角)核准和修改日期?特殊药品、外用药品标识位置x x x说明书请仔细阅读说明书并在医师指导下使用。
警示语位置【药品名称】按顺序列出通用名称、商品名称、英文名称和汉语拼音。
其中中国药典收载的品种,其通用名称应当与药典一致;药典未收载的品种,其名称应当符合药品通用名称命名原则。
【成份】1. 列出活性成份的化学名称、化学结构式、分子式、分子量。
并按下列顺序分行书写:化学名称、化学结构式、分子式、分子量。
2. 复方制剂可以不列出每个活性成份化学名称、化学结构式、分子式、分子量内容。
本项可以表达为“本品为复方制剂,其组份为:”。
组份按一个制剂单位(如每片、粒、支、瓶等)分别列出所含的全部活性成份及其量。
3. 多组份或者化学结构尚不明确的化学药品或者治疗用生物制品,应当列出主要成份名称,简述活性成份来源。
4. 处方中含有可能引起严重不良反应的辅料的,该项下应当列出该辅料名称。
5. 注射剂应当列出全部辅料名称。
【性状】包括药品的外观、臭、味、溶解度以及物理常数等。
【适应症】根据该药品的用途,采用准确的表述方式,明确用于预防、治疗、诊断、缓解或者辅助治疗某种疾病(状态)或者症状。
【规格】指每支、每片或其他每一单位制剂中含有主药(或效价)的重量或含量或装量。
生物制品应标明每支(瓶)有效成分的效价(或含量及效价)及装量(或冻干制剂的复溶后体积)。
表示方法一般按照中国药典要求规范书写,有两种以上规格的应当分别列出。
【用法用量】包括用法和用量两部分。
需按疗程用药或者规定用药期限的,必须注明疗程、期限。
详细列出该药品的用药方法,准确列出用药的剂量、计量方法、用药次数以及疗程期限,并应当特别注意与规格的关系。
用法上有特殊要求的,应当按实际情况详细说明。
【不良反应】实事求是地详细列出该药品不良反应,并按不良反应的严重程度、发生的频率或症状的系统性列出。
化学药品说明书的正确格式

化学药品说明书的正确格式一份合格的化学药品说明书,应该符合下面的格式:(左上角)核准和修改日期特殊药品、外用药品标识位置X X X说明书请仔细阅读说明书并在医师指导下使用。
警示语位置【药品名称】按顺序列出通用名称、商品名称、英文名称和汉语拼音。
其中中国药典收载的品种,其通用名称应当与药典一致;药典未收载的品种,其名称应当符合药品通用名称命名原则。
【成份】1. 列出活性成份的化学名称、化学结构式、分子式、分子量。
并按下列顺序分行书写:化学名称、化学结构式、分子式、分子量。
2. 复方制剂可以不列出每个活性成份化学名称、化学结构式、分子式、分子量内容。
本项可以表达为“本品为复方制剂,其组份为:”。
组份按一个制剂单位(如每片、粒、支、瓶等)分别列出所含的全部活性成份及其量。
3. 多组份或者化学结构尚不明确的化学药品或者治疗用生物制品,应当列出主要成份名称,简述活性成份来源。
4. 处方中含有可能引起严重不良反应的辅料的,该项下应当列出该辅料名称。
5. 注射剂应当列出全部辅料名称。
【性状】包括药品的外观、臭、味、溶解度以及物理常数等。
【适应症】根据该药品的用途,采用准确的表述方式,明确用于预防、治疗、诊断、缓解或者辅助治疗某种疾病(状态)或者症状。
【规格】指每支、每片或其他每一单位制剂中含有主药(或效价)的重量或含量或装量。
生物制品应标明每支(瓶)有效成分的效价(或含量及效价)及装量(或冻干制剂的复溶后体积)。
表示方法一般按照中国药典要求规范书写,有两种以上规格的应当分别列出。
【用法用量】包括用法和用量两部分。
需按疗程用药或者规定用药期限的,必须注明疗程、期限。
详细列出该药品的用药方法,准确列出用药的剂量、计量方法、用药次数以及疗程期限,并应当特别注意与规格的关系。
用法上有特殊要求的,应当按实际情况详细说明。
【不良反应】实事求是地详细列出该药品不良反应,并按不良反应的严重程度、发生的频率或症状的系统性列出。
化学药品说明书的正确格式

化学药品说明书的正确格式化学药品说明书是指对于药品的组成、性状、药理作用、适应症、用法用量、不良反应、禁忌症、注意事项等进行详细描述和说明的文档。
它对于使用者来说是非常重要的参考资料,确保了药品的安全和正确使用。
以下是化学药品说明书的正确格式,以确保它们的清晰度、准确性和易读性。
1. 标题在说明书的顶部,应列出药品的名称作为标题。
标题应居中并使用粗体字体,以便于阅读和识别。
同时,还应在标题下方标注药品的通用名称(如果适用),并使用普通字体。
2. 药品信息在说明书的正文之前,应提供药品的基本信息。
这些信息包括药品的批准文号、生产厂商、生产日期、有效期等。
这些信息将帮助使用者识别药品的真实性和有效性。
3. 组成成分在正式介绍药品之前,应列出药品的主要成分和含量。
这些信息应以清晰的表格形式呈现,包括每种成分的名称、化学结构、含量百分比等详细信息。
4. 药理作用在说明书的开始部分,应对药品的药理作用进行详细说明。
这里应包括药品的作用机制、生物转化、药代动力学等相关信息,以便使用者了解药品的作用原理。
5. 适应症接下来,对药品的适应症进行详细描述。
适应症是指药品可用于治疗或预防的疾病或病症。
在说明书中,应列出适应症的范围、病情的具体描述以及使用药品的相关注意事项。
6. 用法用量在说明书中,应明确指出药品的正确用法和用量。
使用者应能够清楚地了解该药品的正确使用方法以及每次使用的剂量。
同时,还应根据患者的年龄、体重、病情等因素,提供详细的用药指导。
7. 不良反应药品说明书应详细列出可能的不良反应。
这些不良反应可能包括常见的和严重的不良反应,以及使用药品时需要特别注意的潜在风险。
此外,还应提供处理不良反应的建议和指导。
8. 禁忌症在说明书中,应明确列出药品的禁忌症。
禁忌症是指特定的人群或情况,在这些情况下,该药品被严格禁止使用。
同时,还应提供相关的警示和注意事项。
9. 注意事项在使用药品时,还应告知用户一些特别注意事项。
药品说明书格式范文

药品说明书格式范文篇一:药品说明书格式范文药品说明书在临床治疗中扮演着至关重要的角色。
它是一份详细清晰的指南,旨在帮助医生和患者正确使用药品,确保治疗的安全和有效。
本篇文章将介绍药品说明书的基本格式和范例,以供大家参考。
1. 标题页药品说明书的第一页通常包括以下内容:药品名称:药品的正式名称,包括通用名称和品牌名称。
规格:药品的规格,通常会包括药量、剂型、颜色等信息。
药品分类:药品所属的分类,如抗生素、止痛药等。
生产厂商:生产药品的公司或实验室名称。
批准日期:药品批准上市的日期。
2. 组成药品说明书的第二部分详细说明药品的成分和配方。
这个部分应如实反映药品中所含的活性成分以及它们的浓度和单位。
此外,还应包括药品所含的非活性成分和其分量。
3. 适应症该部分解释该药物所针对的病症或疾病。
这个部分是非常重要的,在这里需要好好阐述药品的主要作用,说明它的优点和缺点。
也需说明真实的临床试验结果,以证明其治疗效果。
4. 用法用量这个部分详细说明了使用该药物的方法。
这包括给药途径、药物的起始剂量以及治疗后的维持剂量。
此外,还应说明使用药物的时间以及应该如何停止使用药品。
5. 不良反应这个部分列出了使用该药物可能会导致的不良反应和副作用。
这些反应可能是轻微的,例如头晕和恶心,也可能是严重的,例如呼吸困难和过敏反应。
行文过程中要扪心自问,严格遵守事实性原则,不可夸大其词。
6. 禁忌症药品说明书还应该明确规定不适用该药品的病症或情况。
这可能是因为该药物与其他药物或疾病产生潜在的不利反应或危险。
这个部分对于正确使用药品是至关重要的。
医生和病人必须非常小心地遵守这个部分规定。
7. 注意事项药品说明书的这一部分包括使用该药物时应注意的方面,例如在使用药物时需要解决的注意事项。
这可能包括一个人是否可以开车或需要避免类似的活动。
此外,它可能还包括对使用该药物用户进行血液测试和其他监测的建议。
8. 孕妇和哺乳期使用注意事项针对孕妇和哺乳期母亲的临床测试通常少,因此必须在药品说明书中予以说明。
药品生产技术《非处方药药品说明书规范格式及书写要求》

列出全部处方组成和辅料,所含成份及药味排序与药品标准一致
【性状】
应符合药品标准该项内容
【性状】
应符合药品标准该项内容
【作用类别】
按国家局公布该项内容书写
【适应症】
按国家局公布该项内容书写
【功能主治】
按国家局公布该项内容书写
【规格】
每一单位制剂中含有主药的重量、含量或装量,计量单位必须以中文表示,每一说明书只能写一种规格。药品标准或注册批件项与二者内容相同,但表达方式不同的,可按药品标准或注册批件项内容表述。
【生产企业】
【生产企业】
企业名称:
与?药品生产许可证?一致
企业名称:
与?药品生产许可证?一致
生产地址:
生产地址:
邮政编码:
邮政编码:
号码:
须注明区号
号码:
须注明区号
号码:
号码:
网 址:
如无可不写,此项不保存
网 址:
如无可不写,此项不保存
如有问题可与生产企业联系
加重字体
如有问题可与生产企业联系加重字体
非处方药药品说明书标准格式及书写要求
化学药品
中成药
非处方药、外用药品标识
非处方药、外用药品标识
×××说明书
非处方药、外用药品标识可采用单色印刷
×××说明书
非处方药、外用药品标识可采用单色印刷
请仔细阅读说明书并按说明使用或在药师指导下购置和使用。忠告语采用加重字体
请仔细阅读说明书并按说明使用或在药师指导下购置和使用。忠告语采用加重字体
【规格】
按药品标准该项内容书写,计量单位必须以汉字表示,每一说明书只能写一种规格。药品标准或注册批件项与二者内容相同,但表达方式不同的,可按药品标准或注册批件项内容表述。
药品说明书规范格式及书写要求

药品说明书规范格式及书写要求一、引言药品说明书是为了提供药品的正确使用方法、注意事项、副作用等信息而编写的一份重要文献。
准确的药品说明书能够帮助患者正确使用药品,避免不必要的风险。
本文将介绍药品说明书的规范格式和书写要求。
二、药品说明书的基本结构药品说明书一般由以下几个部分组成:1. 产品名称和剂型在药品说明书的开头,应明确标明产品的名称和剂型,以便患者正确识别和使用药品。
2. 成分药品说明书中应清晰地列出药品的活性成分以及辅助成分,以帮助患者了解药品的组成和可能的特定成分过敏风险。
3. 批准文号和生产商药品说明书中应包含药品的批准文号和生产商的相关信息,以确保患者明确了解所使用药品的来源和合法性。
4. 适应症说明药物可以治疗的疾病或症状,患者可以根据自身情况判断是否适用。
5. 用法和用量明确指导患者正确使用药物的方法和剂量,并注明是否需要配合饮食等特殊要求。
6. 不良反应列出药物可能引起的不良反应和副作用,以便患者提前了解及时采取相应的措施。
7. 禁忌症说明对某些人群禁用的情况,帮助患者避免因药物使用而产生更大的风险。
8. 注意事项提醒患者使用药物时需要注意的事项,如禁忌食物、禁止饮酒等,以确保药物的安全有效使用。
9. 药物相互作用说明该药物与其他药物、食物或饮料可能发生的相互作用,以免出现不良的药物反应。
10. 药物储存指导患者正确储存药物的方法和环境要求,以确保药物的有效性和安全性。
11. 包装规格和有效期介绍药物的包装规格和有效期限,患者可根据有效期限合理选择药物使用。
12. 生产批号和生产日期药品说明书应包含药品的生产批号和生产日期等信息,以方便患者追溯药物的生产工艺和质量。
三、药品说明书的书写要求除了合理安排药品说明书的结构外,还有一些书写要求需要重视:1. 简明扼要药品说明书应该尽量用简洁明了的语言,避免使用过于专业或复杂的词汇,方便患者容易理解。
2. 字体和字号应使用清晰易读的字体和合适的字号,确保患者能够清晰辨认每个字和每一行的内容。
电子药品说明书(完整版)格式要求(征求意见稿)

附件3
电子药品说明书(完整版)格式要求
(征求意见稿)
一、标题
标题用二号黑体、加粗、居中
二、警示语位置
警示语置于说明书标题下应设标题和正文两部分。
标题应直指问题实质而不用中性语言。
各项警告前置黑体圆点并设小标题。
各项末用括号注明对应的详细资料的说明书项目。
全文用四号黑体、加粗、居中
三、正文
正文是警示语之后,是说明书的核心部分。
正文用三号字体,页边距(上下2.54厘米,左3.14厘米,右2.54厘米),文档网络(每页44行,每行44个字)。
中文使用黑体或者宋体,英文及数字使用“文使用黑体New Roman黑字体。
段落设置,行距固定值30磅。
1.项目名称如【药品名称】:黑体、三号、顶格、独立成行、行距30磅。
—1—
2.项目内容:
(1)项目内容位于项目名称之后,全文用三号宋体、独立成行,行距30磅,首行缩进2字符。
(2)如有多项内容,用阿拉伯数字“1.2.3…”进行分段,独立成行。
(3)涉及多项内容的,相应小标题可加粗,加下划线以示区分。
3.表:表包括表序、表题、表头、表格、表注等,表应简洁,表序以阿拉伯数字连续编号。
4.数字和单位:凡是可以使用阿拉伯数字的地方,均应使用阿拉伯数字。
5.汉字和标点:要严格执行国家有关规定,用字要规范,标点要适当。
四、电子化功能要求
电子说明书应支持缩放功能,适用于不同的电子设备,不同电子设备之间不能有明显字体、版式的变化和差异。
—2—。
药品说明书的具体格式、内容和书写要求

药品说明书的具体格式、内容和书写要求
药品说明书是指对于一种药品的详细说明,包括药品的名称、规格、适应症、用法用量、不良反应、注意事项等内容,是药品生产企业必须提供的重要文献资料。
药品说明书的格式、内容和书写要求对于保障药品使用者的健康安全至关重要。
一、药品说明书的格式要求
药品说明书的格式应该按照国家药品注册要求,一般包括:
1. 封面:药品名称、规格、通用名称、批准文号等
2. 目录:药品说明书的内容清单
3. 说明书正文:各种说明内容的详细描述
4. 附录:包括药品相关的数据、研究报告、文献引用等
5. 后记:药品生产企业的联系信息等
二、药品说明书的内容要求
药品说明书是为了保障药品使用者的健康安全而设立的,因此内容应包括以下要求:
1. 药品的名称、规格、通用名称、批准文号等基本信息
2. 药品的适应症、用法用量等使用说明
3. 药品的不良反应、禁忌症、特别注意事项等安全提示
4. 药品的药物相互作用、药理作用等详细说明
5. 药品的贮藏、保质期等使用要求
6. 药品生产企业的联系信息等其他信息
三、药品说明书的书写要求
药品说明书的书写要求非常严格,一般应该遵循以下规定:
1. 语言表达要简明扼要,内容清晰明了
2. 要遵循医学术语和规范化表达方式
3. 应该使用标准的药品名称和单位
4. 避免使用过多的术语缩写和文字缩写
5. 常用剂量、使用频率等数据应该标明单位
6. 药品名称、规格等信息应该使用统一的格式
总之,药品说明书作为药品生产企业向公众提供的重要文献数据,其格式、内容和书写要求都非常重要,必须严格遵循国家规定,确保药品使用者的健康安全。
处方药说明书

篇一:药品说明书规范格式及书写要求篇二:关于印发中药、天然药物处方药说明书格式、内容书写要求及撰写指导原则的通知关于印发中药、天然药物处方药说明书格式、内容书写要求及撰写指导原则的通知(征求意见稿2006.6.2)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):为贯彻实施《药品说明书和标签管理规定》(国家食品药品监督管理局令第24号,以下简称《管理规定》),加强中药、天然药物处方药说明书的规范和管理,我局制定了《中药、天然药物处方药说明书格式》(附件一)、《中药、天然药物处方药说明书内容书写要求》(附件二)以及《中药、天然药物处方药说明书撰写指导原则》(附件三),现予以印发,并就有关事项通知如下:一、对已批准注册的中药、天然药物处方药,应当按照《中药、天然药物处方药说明书格式》和《中药、天然药物处方药内容书写要求》印制说明书。
申请注册中药、天然药物的,以及按补充申请提出说明书修订的,应按照《中药、天然药物处方药说明书撰写指导原则》起草说明书样稿。
二、关于“核准日期”。
对于2006年6月日前批准注册的中药、天然药物,其“核准日期”项下的日期应为按照《关于实施<药品说明书和标签管理规定>有关事宜的公告》提出补充申请后,药品监督管理部门予以核准的日期。
三、关于“外用药”。
外用药系指(待定)的药物。
外用药品标识为红色方框底色内标注白色“外”字,样式:用药品标识可以单色印制。
对于既可内服,又可外用的中药、天然药物,可不标注外用药品标识。
四、关于【成份】。
对于药品处方已列入国家秘密技术项目的品种,应与原核准并使用的说明书【成份】或【主要成份】项下内容一致,原核准说明书不包括【成份】或【主要成份】项的,可不列此项。
五、关于【功能主治】/【适应症】。
对于2006年6月日前批准注册的中药、天然药物,应按原核准使用的说明书中的该项内容表述。
六、关于【规格】。
对于2006年6月日前批准注册的中药、天然药物,如该品种所执行的药品标准中无【规格】项,可不列此项。
药品说明书规范格式及书写要求

药品说明书规范格式及书写要求药品说明书规范格式及书写要求1、一般要求1.1 标题:药品名称、规格、剂型1.2 字体:宋体,字号10-12号,标题使用加粗字体1.3 行距.1.5倍行距1.4 页边距:上边距留白,左右边距2.5厘米,下边距2厘米1.5 页面编号:页码位于页面右下角2、药品适应症2.1 药品适应症名称2.2 说明:详细描述药物用于治疗的疾病及其症状,包括疾病名称、症状描述等。
3、药品成分3.1 主要成分3.2 含量:描述各主要成分的含量以及其他辅料和溶剂。
4、药品剂型4.1 剂型描述:详细描述药品的剂型,如片剂、胶囊、注射剂等。
5、药物性状5.1 外观:描述药物外观特征,如颜色、形状、包装等。
5.2 气味:描述药物是否有特殊气味。
5.3 纯度:说明药物的纯度和质量标准。
6、药品作用机制6.1 作用机制:描述药物的作用机制。
6.2 药效作用:详细说明药物的主要药效作用。
7、药品用法用量7.1 用法:描述药物的正确使用方法。
7.2 用量:详细说明每次使用的剂量、频率和使用时机。
8、药物不良反应8.1 常见不良反应:常见的不良反应。
8.2 严重不良反应:描述严重的不良反应,并给出处理建议。
8.3 使用禁忌:说明哪些人群禁止使用该药。
9、注意事项9.1 适应症限制:说明适应症的具体限定范围。
9.2 药物相互作用:可能发生的药物相互作用。
9.3 孕妇及哺乳期妇女:说明该药对孕妇及哺乳期妇女的安全性。
9.4 儿童用药:对儿童用药进行特别说明。
9.5 老年患者:特别说明老年患者使用该药的注意事项。
10、药物储存10.1 储存条件:详细说明药物的储存条件,如温度、湿度、光照等。
11、包装11.1 包装材料:描述药物包装材料的种类和性质。
11.2 包装规格:不同规格的包装,包括药品的数量、单位等。
11.3 过期日期:说明药物的有效期及注意事项。
附件:本文档无附件。
法律名词及注释:1、适应症:指药物使用于治疗某种特定疾病的证据或效果。
药品说明书的具体格式、内容和书写要求

药品说明书的具体格式、内容和书写要求
药品说明书是一种重要的医疗文献,它是为了向患者和使用者介绍药品的性质、用途、使用方法、注意事项和不良反应等信息而编写的。
药品说明书的格式、内容和书写要求是十分重要的,下面我们来具体了解一下。
一、格式要求
药品说明书的格式要求一般分为页眉、页脚和正文三部分。
页眉包括药品名称、规格、生产厂家等信息,页脚则包括页码和日期等信息。
正文部分分为目录、说明、禁忌、注意事项、不良反应、药物相互作用、药理作用、药物过量等多个章节。
二、内容要求
1. 药品名称、成分、规格、适应症、用法用量、注意事项、不良反应、贮藏、有效期等。
2. 禁忌、孕妇哺乳期患者、儿童、老年人等特殊人群的使用注意事项。
3. 药品相互作用、与其他药品或食品等的相互作用。
4. 药理作用、药物过量等。
三、书写要求
1. 语言要求简明易懂,文字表述要准确、全面。
2. 利用图表、表格等形式直观地呈现药品信息。
3. 书写要规范,字迹清晰,排版整齐,页码和章节要清晰标注。
4. 确保说明书内容与药品实际情况相符,不得虚假宣传或片面夸大功效。
总之,药品说明书是保障患者用药安全的重要文献,其格式、内容和书写要求都必须严格遵照标准,确保说明书信息的准确性、全面性和可读性。
同时,药品生产企业也应该认真履行药品说明书的编写和更新工作,并及时对说明书中出现的错误进行修正,以保障患者的权益和用药安全。
药品说明书和标签管理规定-国家食品药品监督管理局令第24号

药品说明书和标签管理规定正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 国家食品药品监督管理局令(第24号)《药品说明书和标签管理规定》于2006年3月10日经国家食品药品监督管理局局务会审议通过,现予公布,自2006年6月1日起施行。
局长:邵明立二○○六年三月十五日药品说明书和标签管理规定第一章总则第一条为规范药品说明书和标签的管理,根据《中华人民共和国药品管理法》和《中华人民共和国药品管理法实施条例》制定本规定。
第二条在中华人民共和国境内上市销售的药品,其说明书和标签应当符合本规定的要求。
第三条药品说明书和标签由国家食品药品监督管理局予以核准。
药品的标签应当以说明书为依据,其内容不得超出说明书的范围,不得印有暗示疗效、误导使用和不适当宣传产品的文字和标识。
第四条药品包装必须按照规定印有或者贴有标签,不得夹带其他任何介绍或者宣传产品、企业的文字、音像及其他资料。
药品生产企业生产供上市销售的最小包装必须附有说明书。
第五条药品说明书和标签的文字表述应当科学、规范、准确。
非处方药说明书还应当使用容易理解的文字表述,以便患者自行判断、选择和使用。
第六条药品说明书和标签中的文字应当清晰易辨,标识应当清楚醒目,不得有印字脱落或者粘贴不牢等现象,不得以粘贴、剪切、涂改等方式进行修改或者补充。
第七条药品说明书和标签应当使用国家语言文字工作委员会公布的规范化汉字,增加其他文字对照的,应当以汉字表述为准。
第八条出于保护公众健康和指导正确合理用药的目的,药品生产企业可以主动提出在药品说明书或者标签上加注警示语,国家食品药品监督管理局也可以要求药品生产企业在说明书或者标签上加注警示语。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
处方药药品说明书规范格式及书写要求化学药品、治疗用生物制品中药、天然药物核准日期:XXXX.XX.XX 2006.6.1 前批准注册的药品为提出申请予以备案的日期。
特殊药品、外用药品标识核准日期:XXXX.XX.XX 2006.6.1 前批准注册的药品为提出申请予以核准的日期。
特殊药品、外用药品标识修改日期:XXXX.XX.XX 为此后历次修改的时间外用药品标识可采用单色印刷修改日期:XXXX.XX.XX 多次修改,仅列最后一次外用药品标识可采用单色印刷×××说明书×××说明书既可内服又可外用,可不标外用药的标识【药品名称】请仔细阅读说明书并在医师指导下使用。
忠告语请仔细阅读说明书并在医师指导下使用。
忠告语警示语醒目黑体字注明警示语醒目黑体字注明。
可能导致死亡或严重损伤的特殊情况,必须用黑体“警告”标题。
中药和化药复方制剂应注明本品含××(化学药品通用名称),维生素类除外通用名称:与药品标准名称一致。
【药品名称】商品名称:未批准使用商品名称,不列该项。
通用名称:与药品标准名称一致英文名称:无英文名称的药品不列该项。
汉语拼音:按药品标准描述汉语拼音:按药品标准描述【成份】列出活性成份的:化学名称:化学结构式:分子式:分子量。
可能引起严重不良反应的辅料应列出其名称。
复方制剂表述为“本品为复方制剂,其组份为:”每片(粒、支、瓶等)含××成份及其量。
注射剂应列出全部辅料名称【成份】成份排序应与药品标准一致,可能引起严重不良反应的辅料应列出其名称,注射剂应列出全部辅料名称。
中西药复方,先列中药,后列化学药。
国家保密品种、中保一级品种可不列此项。
处方中含有可能引起严重不良反应的辅料应列出【性状】与药品标准该项内容一致。
【性状】与药品标准该项内容一致【适应症】按国家局公布或批准的该项内容。
【功能主治】/【适应症】天然药物采用【适应症】,与药品标准该项内容一致。
功能、主治两部分以句号分开【规格】按药典要求规范书写,有两种以上规格应分别列出。
规格最后不列标点符号。
复方制剂可以不标注[规格]或标注为“复方”【规格】与药品标准该项内容一致,规格不同使用不同说明书。
规格后面不列标点符号。
药品标准无规格项,可按注册批件规格项执行,二者均无可不列此项。
【用法用量】按国家局公布或批准该项内容,应当特别注意与规格的关系。
【用法用量】与药品标准该项内容一致。
两部分之间句号分开【不良反应】按国家局公布或批准的该项内容【不良反应】按国家局公布或批准的该项内容,涉及危险性的信息内容多, 应用黑体字形式说明,【禁忌】尚不清楚有无,可不列此项或以“尚不明确”表述【禁忌】且在警示语位置采用“警告”标题。
尚不清楚有无,以“尚不明确”表示。
中药和化药复【注意事项】【注意事项】方制剂必须在【注意事项】中列出化学药品的相关内容及注意事项【孕妇及哺乳期妇女用药】【孕妇及哺乳期妇女用药】【儿童用药】【儿童用药】未进行研究,可不列此项。
注射剂必须在【药物相互作用】中表述“尚无本品与其【老年用药】未进行实验,且无文献:表述“未进行该项实验且无可靠参考文献”【老年用药】它药物相互作用的信息”【药物相互作用】【药物相互作用】【药物过量】【临床试验】未进行临床试验,可不列此项【临床试验】未进行临床试验,可不列此项。
2006.7.1 以前进行过试验,描述“本品于×××年经批准进行例临床试验;2006.7.1 之后进行过试验,应描述临床试验概况。
【药理毒理】药理毒理包括药理作用和毒理研究两部分内容【药理毒理】药理毒理包括药理作用和毒理研究两部分内容【药代动力学】未进行实验,且无文献:表述“未进行该项实验且无可靠参考文献”【药代动力学】未进行研究,可不列此项。
【贮藏】与药品标准该项内容一致,有特殊要求的按《中国药典》要求标注具体温度,如:阴凉处(不超过20 ℃)保存。
【包装】直接接触药品的药包材(注册证名称或标准名称)+上市销售最小包装规格(不同包装规格使用不同说明书)【贮藏】与药品标准该项内容一致,有特殊要求的按《中国药典》要求标注具体温度。
如:置阴凉处(不超过20℃)。
【包装】直接接触药品的药包材(注册证名称或标准名称)+上市销售最小包装规格(不同包装规格使用不同说明书)【有效期】【执行标准】XX 个月国家药品标准的名称、版本及编号或名称及版本,或名称及编号【有效期】【执行标准】XX 个月国家药品标准的名称、版本及编号或名称及版本,或名称及编号【批准文号】【生产企业】国药准字HXXXXXXXX 【批准文号】【生产企业】国药准字ZXXXXXXXX企业名称:生产地址:与《药品生产许可证》内容一致企业名称:生产地址:与《药品生产许可证》内容一致邮政编码:邮政编码:电话号码:电话号码:注册地址:药品生产许可证注册地址网址:如无网址可不写,此项不保留网址:如无网址可不写,此项不保留非处方药药品说明书规范格式及书写要求化学药品中成药非处方药、外用药品标识非处方药、外用药品标识×××说明书非处方药、外用药品标识可采用单色印刷×××说明书非处方药、外用药品标识可采用单色印刷请仔细阅读说明书并按说明使用或在药师指导下购买和使用。
忠告语采用加重字体请仔细阅读说明书并按说明使用或在药师指导下购买和使用。
忠告语采用加重字体警示语醒目黑体字注明警示语醒目黑体字注明【药品名称】【药品名称】通用名称:与药品标准名称一致通用名称:与药品标准该项内容一致商品名称:未批准使用商品名称, 不列该项汉语拼音:英文名称:无英文名称药品不列该项汉语拼音:【成份】单一成份制剂:表述为“本品每×含××(成×份通用名称及含量),辅料为×××”复方制剂:表述为“本品为复方制剂,每×含××(×成份通用名称及含量), 辅料为×××”【成份】列出全部处方组成和辅料,所含成份及药味排序与药品标准一致【性状】应符合药品标准该项内容【性状】应符合药品标准该项内容【作用类别】按国家局公布该项内容书写【适应症】按国家局公布该项内容书写【功能主治】按国家局公布该项内容书写【规格】每一单位制剂中含有主药的重量、含量或装量,计量单位必须以中文表示,每一说明书只能写一种规格。
药品标准或注册批件[规格]项下无内容,可按生产实际规格描述,说明书范本[ 规格]项与二者内容相同,但表达方式不同的,可按药品标准或注册批件[ 规格]项内容表述。
【规格】按药品标准该项内容书写,计量单位必须以汉字表示,每一说明书只能写一种规格。
药品标准或注册批件[ 规格]项下无内容,可按生产实际规格描述,说明书范本[ 规格] 项与二者内容相同,但表达方式不同的,可按药品标准或注册批件[规格]项内容表述。
【用法用量】重量、容量单位必须以汉字表示,用法可根据药品具体情况在国家局公布的非处方药用法用量、适应症的范围内描述【用法用量】重量、容量单位必须以汉字表示,用法可根据药品具体情况在国家局公布的非处方药用法用量、功能主治的范围内描述【不良反应】国家局公布的该项内容不得删减,目前尚无内容,以“尚不明确”表述。
【不良反应】国家局公布的该项内容不得删减,目前尚无内容,以“尚不明确”表述。
【禁忌】国家局公布的该项内容不得删减,采用加重字体。
目前尚无内容,以“尚不明确”表述。
【禁忌】国家局公布的该项内容不得删减,采用加重字体,目前尚无内容,以“尚不明确”表述。
【注意事项】国家局公布的该项内容不得删减,采用加重字体,必须注明“对本品过敏者禁用,过敏体质者慎用。
”“本品性状发生改变时禁止使用。
”“请将本品放在儿童不能接触的地方。
”可用于儿童的药品必须注明“儿童必须在成人监护下使用”,处方中含兴奋剂的品种应注明“运动员慎用”,特殊人群尚不明确的必须注明“孕妇(哺乳期妇女、儿童、老人)应在医师指导下使用”【注意事项】国家局公布的该项内容不得删减,采用加重字体, 必须注明“对本品过敏者禁用,过敏体质者慎用”“本品性状发生改变时禁止使用”“请将本品放在儿童不能接触的地方”可用于儿童的药品必须注明“儿童必须在成人监护下使用”,处方中含兴奋剂的品种应注明“运动员慎用”,特殊人群尚不明确的必须注明“孕妇(哺乳期妇女、儿童、老人)应在医师指导下使用”,中西复方制剂应注明“本品含××(化学药品通用名称),并列出××相关内容应注意事项。
【药物相互作用】未进行实验,且无文献:注明“未进行该项实验且无可靠参考文献”。
必须注明“如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。
”【药理作用】按国家局公布内容书写【贮藏】按药品标准该项内容书写,有特殊要求的按药典要求注明具体温度,如:置阴凉处(不超过20℃)。
【包装】直接接触药品的药包材(注册证名称或标准名称)+ 上市销售最小包装规格(不同包装规格使用不同说明书)【药物相互作用】未进行实验,且无文献:注明“未进行该项实验且无可靠参考文献”。
必须注明“如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。
”【贮藏】按药品标准该项内容书写,有特殊要求的按药典要求注明具体温度,如:置阴凉处(不超过20 ℃)。
【包装】直接接触药品的药包材(注册证名称或标准名称)+上市销售最小包装规格(不同包装规格使用不同说明书)【有效期】XX 个月【有效期】XX 个月【执行标准】标准名称、版本或编号【执行标准】标准名称、版本或编号【批准文号】【批准文号】【说明书修订日期】经批准使用该说明书的日期【说明书修订日期】经批准使用该说明书的日期【生产企业】【生产企业】企业名称:与《药品生产许可证》一致企业名称:与《药品生产许可证》一致邮政编码:邮政编码:电话号码:传真号码:须注明区号电话号码:传真号码:须注明区号网址:如无网址可不写,此项不保留网址:如无网址可不写,此项不保留如有问题可与生产企业联系加重字体如有问题可与生产企业联系加重字体Welcome To Download !!!欢迎您的下载,资料仅供参考!。
