常见氧化剂和还原剂-铁
氧化还原反应的氧化剂与还原剂

氧化还原反应的氧化剂与还原剂氧化还原反应,又称为氧化还原反应,是化学中一种重要的反应类型。
它涉及到物质中电子的转移,将有机物或无机物中的元素在化学反应中氧化或还原。
在氧化还原反应中,氧化剂和还原剂起着至关重要的作用。
本文将围绕氧化剂和还原剂展开讨论。
一、氧化剂氧化剂是指在氧化还原反应中能够接受电子,并使其他物质发生氧化的化合物或离子。
它们常常具有高的电子亲和力,能够迅速接受其他物质的电子,使得其他物质失去电子而发生氧化。
1. 氧气(O2):氧气是一种常见的氧化剂,可以与其他物质发生反应,将它们氧化为相应的氧化物。
例如,将铁暴露在空气中,氧气将铁氧化为铁氧化物,形成铁锈。
2. 过氧化氢(H2O2):过氧化氢是一种强氧化剂,可在许多反应中发挥重要作用。
它能够将其他物质氧化成相应的氧化物,并自身还原为水。
3. 高氯酸盐(例如高氯酸钠):高氯酸盐是一种常见的氧化剂,可以氧化许多物质,并在反应中自身还原。
二、还原剂还原剂是指在氧化还原反应中能够失去电子,并使其他物质发生还原的化合物或离子。
它们往往具有较低的电子亲和力,能够轻易失去电子,转移给其他物质而发生还原。
1. 金属:许多金属具有良好的还原性能,在氧化还原反应中充当还原剂。
例如,铁可以将铜离子还原成铜金属。
2. 还原酶:还原酶是生物体内的一类酶,具有良好的还原剂性质。
它们参与许多生物氧化还原反应,帮助将某些化学物质还原为它们的原始形态。
3. 有机还原剂:一些有机物也具有还原剂性质,能够提供电子给其他物质,将其还原。
例如,酚类和醛类化合物常常具有还原剂性质。
总结:氧化还原反应是化学反应中一类重要的反应类型,需要氧化剂和还原剂的参与。
氧化剂能够接受电子并使其他物质发生氧化,而还原剂能够失去电子并使其他物质发生还原。
常见的氧化剂包括氧气、过氧化氢和高氯酸盐,而金属、还原酶和有机还原剂则常常充当还原剂的角色。
通过深入了解氧化剂和还原剂的性质及其在氧化还原反应中的作用,我们能够更好地理解和应用氧化还原反应,并在化学实验和工业生产中充分发挥其作用。
常见氧化剂还原剂和催化剂的应用
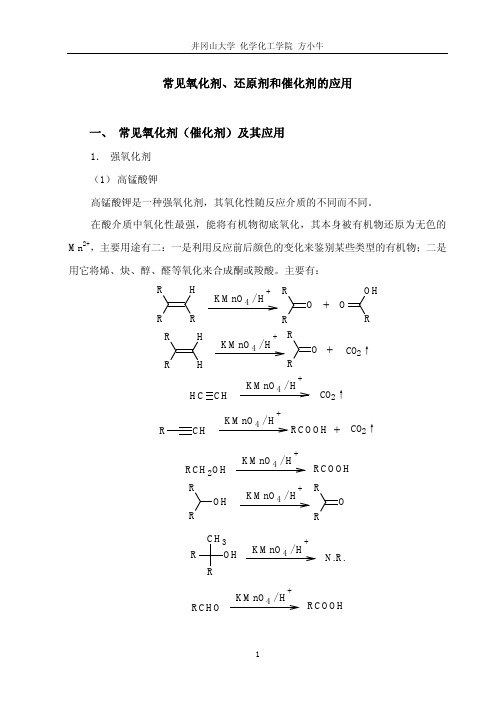
常见氧化剂、还原剂和催化剂的应用一、 常见氧化剂(催化剂)及其应用1. 强氧化剂 (1) 高锰酸钾高锰酸钾是一种强氧化剂,其氧化性随反应介质的不同而不同。
在酸介质中氧化性最强,能将有机物彻底氧化,其本身被有机物还原为无色的Mn 2+,主要用途有二:一是利用反应前后颜色的变化来鉴别某些类型的有机物;二是用它将烯、炔、醇、醛等氧化来合成酮或羧酸。
主要有:R H KMnO 4 / H+OROR OH+ R RHH KMnO 4 / H++O RRCO 2↑KMnO 4 / H+C H CH CO 2↑KMnO 4 / H++CHRCO 2↑RCOOHKMnO 4 / H+RCOOHRCH 2OHOH RRKMnO 4 / H+O RROHRR CH 3KMnO 4 / H+N.R.KMnO 4 / H+RCOOH RCHOKMnO 4 / H +N.R.RCOR' KMnO 4 / H+CO 2↑COOH COOH高锰酸钾在中性或碱性介质中的氧化性稍弱,在控制条件下可以将 π 键氧化而不断裂 σ 键,主要用于从烯烃制备邻二醇(反应的立体化学特征是顺式加成)。
四氧化锇的作用与此类似。
OO MnO(2) 重铬酸钾K 2Cr 2O 7 / H 2SO 4溶液的氧化性能与KMnO 4 / H +相似,用途也相似。
除用以氧化醇、醛等含氧衍生物外,主要用于将芳环氧化成醌。
如:O OCrO 3-H 2SO 4CrO 3-H 2SO 4OOK 2Cr 2O 7 / H 2SO 4RCH 2OHRCHO 边氧化边蒸馏(3) 稀硝酸稀硝酸具有强氧化性,它可以将芳环的侧链氧化和将醇氧化,如:Ar-CH 3Ar-COOH 稀HNO 3稀HNO 3OHO△HO 2C-(CH 2)4-CO 2H2. 温和氧化剂 (1) 二氧化锰MnO 2-H 2SO 4是一种中强氧化剂,可将甲苯氧化成苯甲醛:C 6H 5-CH 3C 6H 5-CHOMnO 2-H 2SO 4活性MnO 2则是一种温和的氧化剂,能将烯丙式醇氧化成醛而不影响C=C 双键:CH 3CH 3CH 3CHOMnO 2石油醚(2) 三氧化铬-吡啶络合物三氧化铬-吡啶络合物(CrO 3-C 5H 5N )又称为Sarett 试剂,是一种温和的氧化剂,能将醇(尤其是烯丙式的)氧化成为醛,而不影响其它基团。
铁的氧化性和还原性

常见的氧化剂
活泼非金属单质:Cl2、O2、Br2、I2 含有较高价态无素的含氧酸:HClO、HNO3、 浓H2SO4 含有高价或较高价态元素的盐:FeCl3、 MnO2、KClO3、KMnO4、K2Cr2O7 过氧化物:Na2O2、H2O2 高价金属阳离子:Fe3+、Cu2+
〖迁移· 应用〗
Fe3+
的 氧 化 性
红色消失 生成FeCl2
证明
Fe3+具有氧化性
FeCl2溶液
验 证
KSCN溶液
浅绿色溶液
+Cl2 + O 2 +HNO3 氧化剂
Fe2+
的 还 原 性
红色溶液 生成FeCl3
证明
Fe2+具有还原性
[小结]
0
“铁三角”
氧化剂 还原剂
+2
Fe
Fe
+3
Fe
Fe
弱氧化剂 -2e
2+: 3+、H+、Cu2+、I 、S → Fe Fe 2
1.Fe3+的检验
方法1:滴加氢氧化钠溶液,若生成红褐色沉淀, 说明有Fe3+存在。 Fe3++3OH-=Fe(OH)3↓ 方法2:滴加KSCN或者NH4SCN溶液,若溶液由 黄色变为红色,说明Fe3+存在。 Fe3++3SCN-=Fe(SCN)3(红色)
2.Fe2+的检验
方法1:滴加氢氧化钠溶液,生成白色絮状沉淀, 该沉淀迅速变为灰绿色,最后变为红褐色,说明 有亚铁离子存在。 Fe2++2OH-=Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 方法2:滴加KSCN溶液,无明显现象,再加入新 制氯水,溶液立即变为红色,说明有亚铁离子存 在。 2Fe2++Cl2=2Fe3++2ClFe3++3SCN-=Fe(SCN)3(红色)
常见的氧化剂和还原剂

常见的氧化剂和还原剂1、常见的氧化剂:1活泼的非金属单质F2、Cl2、Br2、I2、O2、O3等;①金属活动性顺序为基准氧气与除铂、金外的其它金属均可反应;钾、钙、钠在空气中极易和氧气反应Na燃烧时形成过氧化物、K 燃烧生成超氧化物;钾~~锡在空气中燃烧;铅~~汞在空气中不能燃烧,但加热可以反应,如铜在空气中加热生成氧化铜;O2可以氧化NO、SO2、CO、Na2SO3、KI、H2S、H2SO3、NH3、Fe2+ 等还原性强的物质或微粒;H2S点燃生成SO2,缓慢氧化生成S单质;亚铁盐和亚硫酸盐溶液易被氧化,所以实验中要现配现用;②氟、氯可以氧化所有金属;溴、碘可以氧化除铂、金金属以外的所有金属,碘与铁生成的二价的碘化亚铁FeI2;③Cl2可以氧化Na2S、SO2、Na2SO3、 H2S 、 I―、S2―、 Br―、Fe2+、NH3等物质或微粒;产物Cl2→Cl—,氧化产物化合价升至相邻价态,I―→I2→IO3―;④Br2可以氧化Na2S、SO2、Na2SO3、H2S、I―、S2-、Fe2+、等还原性物质或微粒;产物Br2→Br—⑤I2可以氧化Na2S、SO2、Na2SO3、H2S 、S2―、等还原性强的物质或微粒;产物I2→I—Cl2, Br2 , I2 , Fe3+在水溶液中都能把SO32-氧化成SO42-2元素处于高价时的含氧酸硝酸、浓硫酸①HNO3可以氧化:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Fe2+、一些金属单质、非金属单质等;②浓硫酸可以氧化: H2S、 HI、HBr、一些金属单质、非金属单质等;3元素处于高价时盐:KClO3、KMnO4、FeCl3①KMnO4H+可以氧化:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Br-、Cl-、Fe2+、H2O2等;产物KMnO4H+→Mn2+②Fe3+可以氧化:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Fe、Cu、Zn等;产物Fe3+→Fe2+4过氧化物H2O2、Na2O2①H2O2可以氧化;:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Fe2+;5其它HClO2、常见还原剂金属单质:K、Na、Mg等;非金属单质:H2、C、Si等;低价态的化合物:CO、H2S、HI、Fe2+、NH3等;★还原剂:H2—→H+、H2O;CO—→CO2、CH4—→H2O、CO2;活泼金属—→M n+;H2S、Na2S、S2-—→S或高价S;SO2、H2SO3、Na2SO3—→SO3、H2SO4、Na2SO4;HI—→I2;Fe2+—→Fe3+氧化性、还原性强弱的比较1. 通过化学反应比较:氧化性——氧化剂>氧化产物还原性——还原剂>还原产物2. 依据金属活动性顺序3. 依据元素周期表:同周期;同主族4. 依据非金属活泼性的判断5. 依据反应条件:是否加热、有无催化剂、反应温度、反应物的浓度6. 依据相近似的反应:氯气、硫与铜、铁的反应7. 同一种元素,一般价态越高其氧化性越强,但要注意特例;8. 依据电化学原理等;★常见氧化剂的相对强弱:MnO4-H+>HClO>Cl2>浓硝酸>浓硫酸>Br2>稀硝酸>Fe3+>I2Fe3+>Cu2+>Fe2+。
常见的氧化剂和还原剂

常见的氧化剂和还原剂在化学反应中,氧化剂和还原剂是两种常见的重要概念。
氧化剂可以接受电子,使得其他物质失去电子而被氧化,还原剂则相反,它们可以提供电子,使得其他物质接受电子而被还原。
在本文中,我们将介绍一些常见的氧化剂和还原剂。
氧化剂氧气氧气是最常见的氧化剂之一,它可以参与许多氧化反应。
例如,在可燃物燃烧时,氧气就是典型的氧化剂。
氧气也可以氧化一些金属和非金属物质,使它们失去电子。
由于氧气极易与其它物质反应,加热或提高压力可以促进其反应活性。
高锰酸钾高锰酸钾(KMnO4)是一种强氧化剂,可以参与许多氧化反应,常用于工业和化学实验室中。
它可以氧化有机物和无机物,包括金属离子和离子化合物。
在有机化学中,高锰酸钾也被用于氧化剂。
双氧水双氧水(H2O2)是一种弱氧化剂,在化学反应中被广泛使用。
它可以将一些有机物转化为更易于处理的化合物,并且常用于消毒和漂白。
双氧水也可以用作氧化铁和氧化锰的原料,以及化学合成过程中的还原剂。
还原剂金属在化学反应中,金属是最常见的还原剂之一,由于其外层电子结构的特殊性质,金属具有提供电子的能力。
铁和钢铁是在建筑和机械工程中常用的金属还原剂。
氢气氢气(H2)是一种常用的还原剂,主要是因为它极易与氧气反应,从而释放出大量的能量。
在一些化学反应中,两种反应要素之一是氧化剂和还原剂。
在某些情况下,氢气可以被用作还原剂,提供电子给其他物质。
亚硫酸盐亚硫酸盐是一类含有亚硫酸根离子(SO32-)的离子化合物。
它们可以提供电子给其他物质,从而发挥还原剂的作用。
关于亚硫酸盐作为还原剂的应用,最常见的例子是在染料、药物和食品加工工业中,其中亚硫酸盐可以被用作脱色剂和防腐剂。
氧化剂和还原剂在化学反应中起着重要作用。
常见的氧化剂包括氧气、高锰酸钾和双氧水。
而在还原剂方面,金属、氢气和亚硫酸盐是其中最常见的几种。
这些物质的化学特性使得它们可以用于许多不同类型的反应,并为化学工业和实验室提供了广泛的应用。
常见的氧化剂和还原剂

常见的氧化剂和还原剂1、常见的氧化剂:(1)活泼的非金属单质(F2、CI2、B「2、丨2、Q、Q等);①(金属活动性顺序为基准)氧气与除铂、金外的其它金属均可反应。
钾、钙、钠在空气中极易和氧气反应(Na燃烧时形成过氧化物、K燃烧生成超氧化物);钾~~锡在空气中燃烧;铅~~汞在空气中不能燃烧,但加热可以反应,如铜在空气中加热生成氧化铜。
O2 可以氧化NO SO、CO Na z SQ、KI、fS、fSQ、Nf Fg+等还原性强的物质或微粒。
H t S点燃生成SO,缓慢氧化生成S单质。
亚铁盐和亚硫酸盐溶液易被氧化,所以实验中要现配现用。
②氟、氯可以氧化所有金属。
溴、碘可以氧化除铂、金金属以外的所有金属,碘与铁生成的二价的碘化亚铁Fe"。
③Cl2可以氧化N Q S、SQ、N Q SO、H2S、I —、S2—、Br —、Fe2*、NH等物质或微粒。
产物Cl2-Cl—,氧化产物化合价升至相邻价态,I T I 2(。
3 。
④B「2可以氧化Na^S、SQ、Na^SQ、H2S、I—、S2-、Fe2+、等还原性物质或微粒。
产物Br? T Br—⑤I 2可以氧化N^S、SQ、N Q SQ、H2S、S2—、等还原性强的物质或微粒。
产物I 2T I —CI2, Br2 , I 2 , Fe 3+在水溶液中都能把SQ2-氧化成SQ2-(2)元素处于高价时的含氧酸(硝酸、浓硫酸)①HNO可以氧化:S2―、Hi、H2S、SQ2-、HSQ-、SQ、I ―Fe2+> 一些金属单质、非金属单质等。
②浓硫酸可以氧化:H2S、HI、HBr、一些金属单质、非金属单质等。
⑶元素处于高价时盐:(KCIO3、KMnO、FeCl3)①KMn(4(H+)可以氧化:S2—、HS-、fS、SQ2 -、HSQ-、SQ、I —、Br-、Cl -、Fe2+、fQ 等。
产物KMn QH+) _ Mrf+②Fe3+可以氧化:S2-、HS-、H2S、SQ2-、HSQ—、SQ、I-、Fe、Cu Zn 等。
常见氧化剂和还原剂

NO3—、MnO4—、ClO3—等在酸性(H+)条件下有很强的氧化性,不能与Fe2+、—、S2—、HS—、SO32—等离子共存,请同学们做离子共存题目时一定要注意。
亲,你能hold住下面化学反应的配平吗?请自己先写出化学方程式,再配平。
尝试指出氧化剂和还原剂,并自选几个化学方程式分别用“双线桥”和“单线桥”标明电子的转移方向和数目。
常见强还原性的离子:Fe2+、I—、S2—、HS—、SO32—、Br—等。
常见强氧化性的离子:NO3—、MnO4—、ClO4—(高氯酸根)、ClO3—(氯酸根)、ClO—(次氯酸根)、Fe3+、Ag+、Hg2+等。
另外,NO3—、MnO4—、ClO4—、ClO3—、ClO—等在酸性(H+)条件下具有很强的氧化性,亲们一定要留心哦!例如:1、能被NO3-在酸性条件下(H+)氧化的离子有:I-、Br-、S2-、HS-、SO32-、HSO3-、S2O32-、Fe2+;2、能被ClO-在酸性条件下(H+)氧化的离子有:I-、Br-、S2-、SO32-、HSO3-、S2O32-、Fe2+、Cl-等;3、能被MnO4-在酸性条件下(H+)氧化的离子有:除I-、Br-、S2-、SO32-、HSO3-、2O32-、Fe2+、Cl-等。
+(酸性条件)不与OH-、AlO2-、CO32-、HCO3-、SO32-、HSO3-、S2-、HS-、F-、-、CH3COO-、SiO32-等弱酸酸根共存;- (碱性条件)不与HCO3-、HSO3-、HS-、H2PO4-、HPO42-、NH4+、Cu2+、Al3+、3+、Mg2+等共存Ag+与Cl-不能共存。
3、在pH=1的无色透明溶液中,能大量共存的离子组是:A.Na+、Fe3+、Cl-、SO42-B.HCO3-、K+、Na+、NO3-C.MnO4-、K+、SO42-、NH4+C.Cl-、Na+、NO3-、NH4+上述题目参考答案依次为:C、C、D、C、A、A、AC、B、A、AC、C、B、B、A、AD、A、CD、D。
什么是氧化剂和还原剂?

什么是氧化剂和还原剂?一、氧化剂的定义和特点氧化剂是指能够接受电子或氧化其他物质的化学物质。
其本质是具有很强的氧化能力,能够使其他物质失去电子或与氧原子结合,从而引发化学反应。
氧化剂通常具有以下特点:1. 强氧化性:氧化剂能够提供氧原子或接受电子,使其他物质发生氧化反应。
常见的氧化剂包括高锰酸钾、过氧化氢等。
2. 毒性较大:由于其强氧化性,氧化剂对人体和环境具有较大的毒性。
因此,在使用氧化剂时需要十分小心,防止接触或吸入。
3. 易燃易爆:一些氧化剂具有易燃易爆的性质,如过氧化氢、高锰酸钾等。
在储存和使用时需要特别注意防止火灾和爆炸事故的发生。
二、还原剂的定义和特点还原剂是指能够给予电子或使其他物质发生还原反应的化学物质。
其本质是具有较强还原能力,能够使其他物质接受电子或与氢原子结合,从而引发化学反应。
还原剂通常具有以下特点:1. 易氧化:还原剂能够将电子转移给其他物质,自身被氧化。
常见的还原剂包括亚硫酸氢钠、铁粉等。
2. 燃烧性强:由于其易氧化的特性,很多还原剂具有较强的燃烧性。
因此,在使用还原剂时需要注意防止火灾和爆炸事故的发生。
3. 具有还原性:还原剂能够还原其他物质,使其失去氧原子或电子。
在很多化学反应中,还原剂被广泛应用于还原金属氧化物、还原有机化合物等。
三、氧化剂与还原剂的关系氧化剂和还原剂是化学反应中重要的概念,它们之间存在着密切的关系。
在氧化还原反应中,氧化剂接受了被氧化物质的电子,而还原剂提供了给予氧化剂的电子。
可以用下面的方程式来表示:氧化剂 + 还原剂→ 还原剂的氧化物 + 氧化剂的还原物在这个方程式中,氧化剂接受了还原剂的电子和氧原子,而还原剂给予了氧化剂一部分的电子。
四、常见的氧化剂和还原剂1. 常见的氧化剂有:高锰酸钾、过氧化氢、氯气、臭氧等。
这些物质能够与其他物质反应,使其发生氧化反应。
2. 常见的还原剂有:亚硫酸氢钠、铁粉、氢气等。
这些物质能够给予其他物质电子,使其发生还原反应。
常见氧化剂和还原剂铁

升失氧
降得还
2
复习·回顾
编辑课件
中学化学中常见的氧化剂: 中学化学中常见的还原剂:
1、活泼非金属单质
1、金属单质
如:O2、Cl2 2、氧化性酸
如:Na、Fe、Cu 2、某些非金属单质
如:HNO3、浓H2SO4、HClO 如:H2、C
3、含有较高价态元素的盐
3、低价态的氧化物
如:Fe3+、MnO44、过氧化物
1mol失电子量
2×(6-x) ×2 = 2×6
得电子
失电子
x=3
29
知识总结
编辑课件
“铁三角”
Fe
氧化剂:
氧化剂:
如稀H2SO4等 还原剂: 还原剂:
HNO3 , Cl2等
Zn,Mg等 C,Zn,Mg等
Fe2+
氧化剂: HNO3, 氯水等 还原剂: Fe, Cu等
Fe3+
19
编辑课件
迁移·应用
1.保存FeSO4等亚铁盐时向其中加入铁粉, 为什么?
2 FeCl3+Fe=3FeCl2
2.除杂:FeCl2(FeCl3) FeCl3(FeCl2)
2 FeCl3+Fe=3FeCl2 2FeCl2+ Cl2== 2FeCl3
20
将化学学习放眼生活
编辑课件
井水+茶叶=墨水? 我家的井水在“变魔术”?
21
将化学学习放眼生活
编辑课件
“井里抽出的水清澈见底,烧开了变得昏黄,一 泡茶就像墨汁一样黑”
FeCl3+3NaOH=
Fe(OH)3↓+3NaCl
28
电子转移守恒
编辑课件
常见的氧化剂和还原剂完整版本

常见的氧化剂和还原剂1、常见的氧化剂:(1)活泼的非金属单质(F2、CI2、B「2、I2、。
2、O3等);①(金属活动性顺序为基准)氧气与除铂、金外的其它金属均可反应。
钾、钙、钠在空气中极易和氧气反应(Na燃烧时形成过氧化物、K燃烧生成超氧化物);钾~~锡在空气中燃烧;铅~~汞在空气中不能燃烧,但加热可以反应,如铜在空气中加热生成氧化铜。
02可以氧化NO、S02、CO、Na2SO3、KI、H2S、H2SO3、NH 3、Fe2+等还原性强的物质或微粒。
H2S点燃生成SO2,缓慢氧化生成S单质。
亚铁盐和亚硫酸盐溶液易被氧化,所以实验中要现配现用。
②氟、氯可以氧化所有金属。
溴、碘可以氧化除铂、金金属以外的所有金属,碘与铁生成的二价的碘化亚铁Feb。
③Cl2可以氧化Na2S、SO2、Na2SO3、H2S、1一、S2—、Br —、Fe2+、NH3等物质或微粒。
产物CD-Cl—,氧化产物化合价升至相邻价态,I—J2T I03—。
④Br2可以氧化Na2S、S02、Na2SO3、H2S、l —、S2-、Fe2+、等还原性物质或微粒。
产物Br2- Br —⑤I2可以氧化Na2S、S02、Na2SO3、H2S、S2―、等还原性强的物质或微粒。
产物I2-1—CI2, Br2 , I2 , Fe3+在水溶液中都能把SO32-氧化成SO42-(2)元素处于高价时的含氧酸(硝酸、浓硫酸)①HNO3可以氧化:S2—、HS―、H2S、SO32-、HSO3-、S02、丨―、Fe2+、一些金属单质、非金属单质等。
②浓硫酸可以氧化:H2S、HI、HBr、一些金属单质、非金属单质等。
⑶元素处于高价时盐:(KCIO 3、KMnO 4、FeCl 3)①KMn0 4(H+)可以氧化:S2—、HS一、H2S、SO32 —、HSO3—、SO2、I—、Br -、Cl -、Fe2+、H2O2等。
产物KMnO 4(H+)_Mn 2+②Fe3+可以氧化:S2 —、HS—、H2S、SO32-、HSO3-、SO2、l —、Fe、Cu、Zn 等。
高中氧化还原反应对应的物质

高中氧化还原反应对应的物质
高中氧化还原反应对应的物质主要包括氧化剂、还原剂、氧化产物和还原产物。
1.氧化剂:是能够接受电子的物质,通常具有较高的氧化态。
常见的氧化剂
包括活泼的金属离子(如Cu²⁺、Fe³⁺等)、氧气、过氧化物、高锰酸钾等。
2.还原剂:是能够提供电子的物质,通常具有较低的氧化态。
常见的还原剂
包括活泼的金属单质(如Na、Mg、Fe等)、非金属单质(如H₂、C等)以及处于低价态的离子或化合物(如SO₂、H₂S等)。
3.氧化产物:是还原剂在反应中失去电子后生成的物质,其氧化态比原来高。
4.还原产物:是氧化剂在反应中接受电子后生成的物质,其氧化态比原来低。
在氧化还原反应中,氧化剂和还原剂通过电子的转移实现氧化还原过程,即氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物。
这种电子转移通常伴随着能量的变化,表现为热量的释放或吸收。
氧化还原反应的氧化剂和还原剂

氧化还原反应的氧化剂和还原剂氧化还原反应是化学中常见的反应类型之一,也被称为红ox反应。
在这种反应中,物质的氧化态和还原态发生变化,同时伴随着电子转移的过程。
其中,氧化剂接受电子,被还原,而还原剂失去电子,被氧化。
本文将着重探讨氧化还原反应中的氧化剂和还原剂,并给出一些具体的例子。
一、氧化剂氧化剂是指在氧化还原反应中,能够接受电子或者从其他物质中夺取电子的物质。
它使得其他物质被氧化。
下面我们列举一些常见的氧化剂:1. 氧气(O2)作为最常见的氧化剂,氧气在大气中广泛存在,并与许多物质发生氧化反应。
例如,金属与氧气反应形成金属氧化物(例如铁与氧气反应生成氧化铁)。
2. 过氧化氢(H2O2)过氧化氢是一种强氧化剂,常用于工业、医疗和日常生活中的消毒和漂白。
它可以将许多有机物氧化为无机酸或无机盐。
3. 高锰酸钾(KMnO4)高锰酸钾是一种强氧化剂,常用于化学实验室中。
它可以与还原剂反应,将其氧化为相应的酸或酸性氧化物。
4. 氯气(Cl2)氯气是一种常见的氧化剂,用于水处理、漂白和消毒等领域。
它能够将许多物质氧化,形成相应的氯化物。
5. 卤素(F2、Br2、I2)卤素也是一类常见的氧化剂,具有较强的氧化性。
例如,氟气可以氧化许多物质,形成氟化物。
二、还原剂还原剂是在氧化还原反应中能够失去电子或者从其他物质中提供电子的物质。
它使得其他物质被还原。
下面我们列举一些常见的还原剂:1. 氢气(H2)氢气是一种常见的还原剂,具有较强的还原性。
在许多反应中,氢气可以被氧化剂从物质中夺取电子,而自身被氧化剂还原为水。
2. 金属许多金属(如锌、铝等)在反应中能够提供电子,作为还原剂参与氧化还原反应。
它们可以与氧、酸等氧化剂反应,被氧化为阳离子形式。
3. 有机物许多有机物具有较强的还原性,可以在氧化还原反应中作为还原剂。
例如,葡萄糖在呼吸作用中被氧气氧化为二氧化碳和水,同时释放出能量。
4. 亚硫酸盐(SO32-)亚硫酸盐具有较强的还原性,可以在氧化还原反应中充当还原剂。
常用氧化剂及还原剂

常用氧化剂及还原剂1.氧化剂氧化剂是一类能够接受电子,从而氧化其他物质的化学物质。
常用的氧化剂有以下几种:氧气(O₂):氧气是最常见的氧化剂,能与其他物质发生氧化反应。
例如,铁(Fe)与氧气反应产生铁锈。
高锰酸钾(KMnO₄):高锰酸钾是一种强氧化剂,能与许多有机物和无机物发生氧化反应。
它常用于分析化学中的氧化反应,如酸性环境下氧化苯酚生成苯醌。
高氯酸(HClO₄):高氯酸也是一种强氧化剂,常用于有机合成反应中。
它能氧化许多有机物,如将乙醛氧化为醋酸。
过氧化氢(H₂O₂):过氧化氢是一种常见的氧化剂,也是许多化学反应的关键物质。
它可以与多种物质发生氧化反应,例如与二硫化碳反应产生二硫化碳酰。
重铬酸(H₂CrO₄):重铬酸是一种强氧化剂,可以氧化多种有机和无机物。
它可以将酒精氧化为醛和酸等。
2.还原剂还原剂是一类能够给予电子,从而还原其他物质的化学物质。
常用的还原剂有以下几种:氢气(H₂):氢气是最常见的还原剂,能与其他物质发生还原反应。
例如,氢气可以还原氧气生成水。
亚硫酸氢钠(NaHSO₃):亚硫酸氢钠是一种常用的还原剂,能将许多氧化剂还原为较低的氧化态。
例如,它可以将高锰酸钾还原为二价锰。
硫酸亚铁(FeSO₄):硫酸亚铁是一种常见的还原剂,可以还原许多氧化剂。
它常用于分析化学中的还原反应,如将硝酸银(AgNO₃)还原为硝酸银。
亚硫酸钠(Na₂SO₃):亚硫酸钠是一种常用的还原剂,可以将许多氧化剂还原为较低的氧化态。
它在染料工业和食品工业中有广泛应用。
亚硝酸钠(NaNO₂):亚硝酸钠是一种常见的还原剂,可以与氨反应生成氮气。
它在食品加工中常用作食品保鲜剂。
以上是常用的氧化剂和还原剂的简要介绍。
在化学实验和工业生产中,准确选择和使用适当的氧化剂和还原剂是非常重要的,它们可以促进许多化学反应的进行。
但同时需要注意安全操作,以避免意外事故的发生。
常见的氧化剂和还原剂

常见的氧化剂和还原剂 Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998常见的氧化剂和还原剂1、常见的氧化剂:(1)活动的非金属单质(F2、Cl2、Br2、I2、O2、O3等);①氧气与除铂、金外的其它金属均可反应。
钾、钙、钠在空气中极易和氧气反应(Na燃烧时形成过氧化物、K燃烧生成超氧化物);钾―锡在空气中燃烧;铅―汞在空气中不能燃烧,但加热可以反应,如铜在空气中加热生成氧化铜。
O2可以氧化NO、SO2、CO、Na2SO3、KI、H2S、H2SO3、NH3、Fe2+ 等还原性强的物质或微粒。
H2S点燃生成SO2,缓慢氧化生成S单质。
亚铁盐和亚硫酸盐溶液易被氧化,所以实验中要现配现用。
②氟、氯可以氧化所有金属。
溴、碘可以氧化除贵金属以外的所有金属,碘与铁生成的二价的碘化亚铁。
③Cl2可以氧化Na2S、SO2、Na2SO3、 H2S 、 I―、S2―、 Br―、Fe2+、NH3等物质或微粒④Br2可以氧化Na2S、SO2、Na2SO3、H2S、I―、S2-、Fe2+、等还原性物质或微粒⑤I2可以氧化Na2S、SO2、Na2SO3、H2S 、S2―、等还原性强的物质或微粒Cl2, Br2 ,I2 ,Fe3+在水溶液中都能把SO32-氧化成SO42-(2)元素处于高价时的含氧酸(硝酸、浓硫酸)①HNO3:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Fe2+、一些金属单质、非金属单质等。
②浓硫酸: H2S、 HI、HBr、一些金属单质、非金属单质等。
(3)元素处于高价时盐:(KClO3、KMnO4、FeCl3)①KMnO4(H+):S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Br-、Cl-、Fe2+、H2O2等。
②Fe3+:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Fe、Cu、Zn等。
(4)过氧化物(H2O2、Na2O2)①H2O2:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Fe2+(5)其它(HClO)2、常见还原剂金属单质:K、Na、Mg等;非金属单质:H2、C、Si等;低价态的化合物:CO、H2S、HI、Fe2+、NH3等。
高中化学五大氧化剂四大还原剂

高中化学五大氧化剂四大还原剂
有很多的同学是非常想知道,高中化学五大氧化剂四大还原剂是什幺,
小编整理了相关信息,希望会对大家有所帮助!
1 常见的氧化剂和还原剂有哪些
常见氧化剂
1、活泼的非金属单质:O2, Cl2, Br2, I2
2、高价金属阳离子:Fe3+, Cu2+
3、高价或者较高价的含氧化物:
KMnO4, K2Cr2O7,浓H2SO4,HNO3, KClO3, HClO3, HClO, CuO , Fe2O3, MnO2
常见还原剂
1、活泼或较活泼的金属单质:
K , Na , Mg , Fe , Al , Zn
2、低价金属阳离子:Fe2+, Cu+
3、非金属阴离子:Cl-, Br-, I-, S2-
4、较低价的化合物:
CO , SO2, H2SO3, Na2SO3, NH3
既做氧化剂又做还原剂
在含有变价元素的化合物中,具有中间价态元素的物质(单质或化合物既。
高中有机推断中常见的氧化还原剂

高中有机推断中常见的氧化还原剂
在高中有机化学中,常见的氧化剂包括:
1. 高锰酸钾(KMnO₄):在酸性条件下,KMnO₄是一个强氧化剂,可以将醇氧化成酮或羧酸,将烯烃氧化成二醇或羧酸,还能将硫化物氧化成硫酸盐。
2. 重铬酸钾(K₂Cr₂O₇):在酸性溶液中,K₂Cr₂O₇作为氧化剂,可以将醇氧化为相应的羧酸,将烯烃氧化成二醇,也能将亚硫酸盐氧化为硫酸盐。
3. 过氧化氢(H₂O₂):过氧化氢是一种温和的氧化剂,可以在某些条件下氧化醇为醛或酮,氧化硫化物为硫酸盐。
4. 氧气(O₂):氧气在催化剂存在下或高温条件下可以氧化许多有机化合物,如将醇氧化为醛或酮。
常见的还原剂包括:
1. 氢气(H₂):氢气在催化剂存在下可以还原许多有机化合物,例如将酮、醛还原为醇,将酯还原为醇,还能将羧酸还原为醇。
2. 金属氢化物,如氢化钠(NaBH₄)和氢化铝锂(LiAlH₄):这些金属氢化物在醇溶液中作为还原剂,可以将醛、酮还原为相应的醇,还能还原酯和酰胺。
3. 亚硫酸钠(Na₂SO₃)和亚硫酸氢钠(NaHSO₃):在酸性条件下,这些亚硫酸盐可以将酮、醛还原为相应的醇,还能将硝基化合物还原为胺。
4. 铁粉(Fe):铁粉在酸或碱性条件下可以作为还原剂,用于还原某些硝基化合物、卤代烃等。
在有机推断题中,识别这些氧化还原剂及其可能的反应类型对于推断未知化合物的结构和反应路径至关重要。
水处理中常用的氧化剂和还原剂

水处理中常用的氧化剂
和还原剂
Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT
氧化还原电位不同的两种物质都可以相对地成为氧化剂或还原剂,但在废水处理实践中能够使用的氧化剂或还原剂必须满足以下要求:
①对废水中希望去除的污染物质有良好的氧化或还原作用,
②反应后生成的物质应当无害以避免二次污染,
③价格便宜、来源可靠,
④能在常温下快速反应、不需要加热,
⑤反应时所需的pH值最好在中性,不能太高或太低。
在废水处理中常用的氧化剂有:
①在接受电子后还原变成带负电荷离子的中性原子,如O2、Cl2、O3等;
②带正电荷的原子,接受电子后还原成带负电荷的离子,比如在碱性条件下,漂白粉、次氯酸钠等药剂中的次氯酸根OCl-中的CL+和二氧化氯中的Cl4+接受电子还原成Cl-;
③带高价正电荷的原子在接受电子后还原成带低价正电荷的原子,例如三氯化铁中的Fe3+和高锰酸钾中的Mn7+在接受电子后还原成Fe2+和Mn2+。
在废水处理中常用的还原剂有:
①在给出电子后被氧化成带正电荷的中性原子,例如铁屑、锌粉等;
②带负电荷的原子在给出电子后被氧化成带正电荷的原子,例如硼氢化钠中的硼元素为负5价,在碱性条件下可以将汞离子还原成金属汞,同时自身被氧化成正三价。
③金属或非金属的带正电的原子,在给出电子后被氧化成带有更高正电荷的原子。
例如硫酸亚铁、氯化亚铁中的二价铁离子Fe2+在给出一个电子后被氧化成三价铁离子Fe3+;二氧化硫SO2和亚硫酸盐SO32-中的四价硫在给出两个电子后,被氧化成六价硫,形成SO42-。
给出几个常见的还原剂和氧化剂的例子

给出几个常见的还原剂和氧化剂的例子常见的还原剂和氧化剂的例子如下:
还原剂:
1. 氢气(H2):氢气是一种常见的还原剂,因为它具有较高的还原能力,能够还原多种金属氧化物和硫化物。
2. 碳(C):碳也是一种常见的还原剂,例如在炼铁工业中,碳与氧气反应生成一氧化碳,一氧化碳进一步还原铁矿石。
3. 一氧化碳(CO):一氧化碳是另一种还原剂,它可以通过与金属氧化物反应生成金属和二氧化碳来还原金属。
氧化剂:
1. 氧气(O2):氧气是常见的氧化剂之一,它能够与多种物质反应,例如燃烧反应中氧气与可燃物反应生成氧化物。
2. 硝酸(HNO3):硝酸是一种强氧化剂,它能够与多种物质反应,例如与金属反应生成硝酸盐和氮气。
3. 高锰酸钾(KMnO4):高锰酸钾是一种强氧化剂,它能够氧化多种物质,例如在实验室中常用高锰酸钾来氧化有机物。
氧化还原反应的氧化剂与还原剂的选择

氧化还原反应的氧化剂与还原剂的选择氧化还原反应是化学反应中常见的一类反应,也是我们生活中和工业生产中广泛应用的一种反应类型。
在进行氧化还原反应时,我们需要选择合适的氧化剂和还原剂,以保证反应能够顺利进行并达到预期的结果。
一、氧化剂的选择1. 氧气(O2)氧气是最常见的氧化剂,在大多数氧化反应中都可以使用。
例如,燃烧反应中,氧气是燃料燃烧的必需氧化剂。
同时,氧气还可以参与许多有机物的氧化反应,使其氧化为相应的酮、醛、羧酸等。
2. 金属氧化物金属氧化物也常被用作氧化剂,常见的如二氧化锰(MnO2),二氧化锰可参与有机物的氧化反应,还能参与许多无机物的氧化反应。
3. 高价氧化物高价氧化物如过氧化氢(H2O2)、臭氧(O3)等常被用作强氧化剂。
过氧化氢是常见的漂白剂,可用于家庭清洁和消毒。
臭氧则广泛用于水处理和空气净化以消除有机物和有害污染物。
二、还原剂的选择1. 金属还原剂金属通常具有较低的电负性,易失去电子形成正离子,因此许多金属可用作还原剂。
常见的金属还原剂有锌(Zn)、铁(Fe)、铝(Al)等。
金属还原剂在冶金反应、有机合成反应中应用广泛。
2. 非金属还原剂非金属还原剂有亚硫酸盐(如二氧化硫)、亚磺酸盐(如亚硫酸钠)、氢气(H2)等。
这些还原剂在化学反应中能够失去电子,被氧化剂接受电子,从而发挥还原剂作用。
3. 有机还原剂有机还原剂在有机合成反应中广泛应用。
例如,氢气在加氢反应中是主要的有机还原剂,能够与烯烃、醛、酮等发生加成反应。
三、选择氧化剂和还原剂的要点1. 根据反应需要选择氧化剂和还原剂,确保反应能够快速进行,并达到预期的结果。
2. 考虑反应物的特性,选择合适的氧化剂和还原剂。
例如,对于含有氧的有机物,通常选择氧化剂进行反应;而对于亲电性较强的有机物,通常选择还原剂进行反应。
3. 考虑安全性和经济性,选择合适的氧化剂和还原剂。
有些氧化剂具有强氧化性,如高价金属氧化物,使用时需要小心操作,确保安全。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
知识积累
如何检验溶液中Fe3+ (呈棕黄色) 的存在?
1、取待测溶液于试管中,加入KSCN溶液, 溶液呈现血红色,则溶液中含有Fe3+离子。 2、取待测溶液于试管中,加入NaOH溶液, 产生红褐色沉淀,则溶液中含有Fe3+离子。
知识积累
如何检验溶液中Fe2+(呈浅绿色) 的存在?
1、取待测溶液于试管中,加入NaOH溶液, 产生白色沉淀,白色沉淀迅速变成灰绿色 沉淀,最终变成红褐色沉淀。
4Fe(OH)3
转化
制备
4Fe(OH)2+O2+2H2O=4Fe(OH)3
FeCl2+2NaOH= Fe(OH)2↓+2NaCl FeCl3+3NaOH= Fe(OH)3↓+3NaCl
电子转移守恒 2mol的K2Cr2O7 溶液,恰好与6mol的Na2SO3溶液完 全反应,则Cr元素在还原产物中的化合价为( )。 A.+6 B.+3 C.+2 D.0
2、取待测溶液于试管中,加入KSCN溶液后, 无明显现象;再滴加氯水得血红色溶液。
知识总结
“铁三角”
Fe
氧化剂: 如稀H2SO4等
还原剂: 还原剂: Zn,Mg等 C,Zn,Mg等 氧化剂: HNO3 , Cl2等
Fe2+
氧化剂: HNO3, 氯水等
还原剂: Fe, Cu等
Fe3+
迁移· 应用
1.保存FeSO4等亚铁盐时向其中加入铁粉, 为什么?
2 FeCl3+Fe=3FeCl2
2.除杂:FeCl2(FeCl3) FeCl3(FeCl2)
2 FeCl3+Fe=3FeCl2
2FeCl2+ Cl2== 2FeCl3
将化学学习放眼生活
井水+茶叶=墨水? 我家的井水在“变魔术”?
将化学学习放眼生活
“井里抽出的水清澈见底,烧开了变得昏黄,一 泡茶就像墨汁一样黑” ----眉山市新星村200农户水井旁喊"渴"
将化学学习放眼生活
琥珀酸亚铁片
(1)琥珀酸亚铁片的表面要包一层薄膜,除去薄膜后会变
为暗黄色?薄膜的作用是什么?
(2)药物相互作用:与维生素C同服,可增加本品吸收,
维生素C可能具有什么性质?
了解身边的化学
(参考课本56页和58页有关内容,回答下列问题)
1、你知道哪些富含铁元素的食品? 2、天然食品中的铁通常显几价? 人体吸收的铁元素价态是多少? 怎样补铁才是科学的? 3、我们是否需要每天大量地补铁? 哪些人群需要摄入较多的铁元素?
1、探究铁单质的还原性
2、探究 Fe3+的氧化性
3、探究 Fe2+的 氧化性和还原性
硫酸铜溶液 KSCN溶液
实验· 探究
铁单质的还原性
实验方案: 往Fe粉中加入稀H2SO4,观察现象。
Fe+2H+=Fe2++H2↑ 现象:铁粉溶解,有无色气体生成, 溶液由无色变成淡绿色 结论:铁单质只有还原性
实验· 探究
Fe3+的氧化性
实验方案:往FeCl3溶液中加入Fe粉
2 FeCl3+Fe=3FeCl2 (溶液由棕黄色变为浅绿色)
思考:往FeCl3溶液中加入Cu粉,如何反应?
2FeCl3+Cu=2FeCl2+CuCl2
实际生活应用: 利用FeCl3溶液腐蚀Cu箔制造印刷线路板。 结论: Fe3+具有氧化性,一般被还原为 Fe2+
升失氧
降得还
复习· 回顾
中学化学中常见的氧化剂: 1、活泼非金属单质 如:O2、Cl2 中学化学中常见的还原剂: 1、金属单质 如:Na、Fe、Cu 2、某些非金属单质
2、氧化性酸
如:HNO3、浓H2SO4、HClO 3、含有较高价态元素的盐 如:Fe3+、MnO44、过氧化物
如:H2、C
3、低价态的氧化物 如:CO、SO2 4、含有较低价态元素的酸或盐 如:Fe2+、I-、S2-、SO32-
1mol得电子量
解析:反应中Cr元素的化合价变化为2×(6-x),
S元素的化合价变化为6-4=2。
1mol失电子量
2×(6-x) ×2 = 2×6
得电子
失电子 x=3
第二章 元素与物质世界
第3节 (第2课时) 探究铁及其化合物的氧化性或还原性
对应课本53页至56页内容
复习回顾
有关概念及相互关系
还原剂→还原 性→化合价升高 →失 电子→被 氧化→氧化反应→ 氧化产物 ↑ ↑ ↑ ↑ ↑ ↑ ↑ 反应物→性质 → 特征 → 实质 →元素→ 反应 → 生成物 ↓ ↓ ↓ ↓ ↓ ↓ ↓ 氧化剂→氧化 性→化合价降低 →得 电子→被还原 → 还原反应→ 还原产物
实验· 探究
Fe2+的氧化性和还原性
实验方案:①往锌粉中加入FeCl2溶液
Zn+ FeCl2=ZnCl2+Fe(有铁析出)
②往FeCl2溶液中先加氯水再滴加
硫氰酸钾溶液(KSCN溶液)
2FeCl2+ Cl2= 2FeCl3
(溶液由浅绿色变为棕黄色,最后溶液变为血红色)
结论:Fe2+ 既有氧化性又有还原性
寻找具有还原性 的物质,通过实 验证实两者能发 生氧化还原反应
实验· 探究
铁及其化合物的氧化性和还原性 研究对象:Fe、 FeCl2 、 FeCl3
预测:
Fe
只有还原性
Fe3+ 只有氧化性 Fe2+ 既有氧化性又有还原性
实验· 探究
工具栏 实验试剂: 铁粉 FeCl2溶液 FeCl3溶液 氯水 铜粉 锌粒 稀硫酸
氢氧化物对比
Fe(OH)2
色态 溶解性 稳定性
Fe(OH)3 红褐色 固 不
2Fe(OH)3==Fe2O3+3H2O Fe(OH)3+3HCl= FeCl3+3H2O
△
白色 固 不
Fe(OH)2=======FeO+2H2O
隔绝空气 △
与HCl
与O2
Fe(OH)2+2HCl= FeCl2+2H2O 4Fe(OH)2+O2+2H2O=
资料在线 自然界中游离态的铁
新疆陨铁
南极洲陨铁
自然界中化合态的铁赤铁矿(FBiblioteka 2O3)磁铁矿(Fe3O4)
黄铁矿(FeS2)
常见的铁及其化合物
铁粉 Fe
Fe2O3
Fe(OH)3 沉淀 Fe(OH)2 沉淀
FeSO4· 7H2O 又称绿矾
FeCl2溶液
FeCl3· 6H2O FeCl3溶液
常见的铁及其化合物的分类
合 理 选 择 饮 食
根据课本内容,思考下列问题: 1、地壳中含量处于前四位的元素是哪些? 2、铁在自然界中的存在形态如何? 3、你知道哪些含铁化合物? 4、利用价态律推测:在铁及其化合物中, 哪些具有氧化性? 哪些具有还原性? 哪些既具有氧化性,又具有还原性?
氧化物对比
FeO
俗名 色态 价态
如:H2O2、Na2O2
有人的地方,就有江湖
功了古 上江代 活湖, 着的铁 。天以 地刀 。剑 铁的 在形 侠式 客, 的开 武辟
现代:用途广泛的铁
95 式 突 击 步 枪 联 合 收 割 机 奇 瑞 汽 车
锅 碗 瓢 盆
现代:生活中的铁
人体需要的是铁单质吗?铁怎样转化为能
被吸收的铁元素呢?
酸式现 甜问代 苦津, 辣着铁 香生以 。活锅 ,和 尝铲 遍的 了形
化合价
氧化性 +3 还原性 氧化性
Fe2O3 FeO Fe
Fe(OH)3 Fe(OH)2
FeCl3 Fe2(SO4)3 FeCl2 FeSO4
+2 0
还原性
单质
氧化物
碱
盐
物质类别
方法强化
探究方法
探究物质具 有还原性 探究物质具 有氧化性
寻找具有氧化性 的物质,通过实 验证实两者能发 生氧化还原反应
Fe2O3 赤铁矿 红棕色 固 +3
Fe2O3+6HCl= 2FeCl3+3H2O
Fe3O4 磁铁矿 黑色 固
+3(2个)、+2(1个)
Fe3O4+8HCl= 2FeCl3+FeCl2+4H2O
黑色 固
+2
FeO+2HCl= FeCl2+H2O
与HCl
高温/△ 高温/△ 高温/△ 与还原剂 FeO+CO/H2====== Fe2O3+3CO/3H2==== Fe3O4+4CO/4H2==== 反应(H2、 3Fe+4CO2/4H2O 2Fe+3CO2/3H2O Fe+CO2/H2O CO)
