高中化学常用试剂大全
化学试剂种类

化学试剂种类
化学试剂是化学实验中必不可少的物质,它们可以用于分析、合成、检测等多种化学实验。
下面我们来介绍一些常见的化学试剂种类。
1. 酸碱指示剂
酸碱指示剂是一种可以根据溶液的酸碱性质而改变颜色的物质。
常见的酸碱指示剂有酚酞、甲基橙、溴酚蓝等。
它们在酸性溶液中呈现不同的颜色,而在碱性溶液中则呈现另一种颜色。
酸碱指示剂可以用于酸碱滴定、酸碱中和等实验。
2. 氧化还原指示剂
氧化还原指示剂是一种可以根据溶液的氧化还原性质而改变颜色的物质。
常见的氧化还原指示剂有淀粉碘化物、二氧化锰、铁离子等。
它们在还原性溶液中呈现不同的颜色,而在氧化性溶液中则呈现另一种颜色。
氧化还原指示剂可以用于氧化还原滴定、电化学实验等。
3. 沉淀试剂
沉淀试剂是一种可以与溶液中的离子反应而生成沉淀的物质。
常见的沉淀试剂有氯化银、氯化铁、氢氧化钠等。
它们可以用于检测溶液中的离子种类和浓度。
4. 硫酸
硫酸是一种常用的强酸,可以用于酸化反应、脱水反应等实验。
但是硫酸具有强腐蚀性,需要注意安全使用。
5. 氢氧化钠
氢氧化钠是一种常用的强碱,可以用于中和反应、沉淀反应等实验。
但是氢氧化钠也具有强腐蚀性,需要注意安全使用。
以上是常见的化学试剂种类,它们在化学实验中起着重要的作用。
在使用化学试剂时,需要注意安全使用,避免对人体和环境造成危害。
2024年高考化学实验常用试剂性质总结

2024年高考化学实验常用试剂性质总结如下:
1. 硫酸(H2SO4):无色液体,常用作酸性催化剂和脱水剂。
具有强烈的腐蚀性,能与多种物质反应,生成硫酸盐。
2. 氢氧化钠(NaOH):白色固体,常用作强碱。
具有腐蚀性,能与酸反应生成盐和水。
3. 硝酸银(AgNO3):白色固体,常用作试剂进行氯离子的检验。
具有毒性和腐蚀性,能与氯离子反应生成白色沉淀。
4. 氯化铁(FeCl3):黄褐色固体,常用作试剂进行酚类物质的检验。
能与酚类物质反应生成深色溶液或沉淀。
5. 硫酸铜(CuSO4):蓝色结晶固体,常用作试剂进行水的检验和铜离子的检验。
能与水反应生成蓝色溶液,能与铁离子反应生成红棕色沉淀。
6. 硝酸钾(KNO3):白色结晶固体,常用作氧化剂。
能与还原剂反应,放出氧气。
7. 氯化钠(NaCl):白色晶体,常用作试剂进行氯离子的检验。
具有易溶性,能与银离子反应生成白色沉淀。
总的来说,以上试剂在化学实验中常用于酸碱中和、氧化还原反应、离子的检验等。
在使用这些试剂时,需要注意其腐蚀性和毒性,避免对人体和环境造成损害。
在实验中要严格遵守实验操作规程,正确进行试剂的使用与处理。
第 1 页共 1 页。
高一高二化学试剂知识点

高一高二化学试剂知识点化学试剂是化学实验中必不可少的物质,它们可以用来进行各种化学反应,实现我们想要的化学变化。
在高一和高二的化学学习中,我们会接触到许多不同种类的化学试剂,每种试剂都有其独特的特性和用途。
本文将介绍一些高一高二化学课程中常见的试剂知识点,帮助大家更好地理解和应用这些试剂。
一、酸和碱1. 盐酸(HCl):盐酸是无机酸的一种,常见于实验室中。
它具有刺激性气味,可以溶解许多金属,如锌、铁等,产生相应的盐和氢气。
盐酸也可以与碱反应生成盐和水。
2. 硫酸(H2SO4):硫酸是化学实验中常用的强酸,无色透明的液体。
它具有强腐蚀性和强酸性,在实验中需注意安全使用。
硫酸可以与金属反应,生成相应的盐和氢气。
3. 氢氧化钠(NaOH):氢氧化钠是一种常见的碱。
它是白色固体,易吸湿,在水中能够完全溶解。
氢氧化钠可以与酸反应生成相应的盐和水。
二、指示剂1. 酚酞指示剂:酚酞是一种常用的酸碱指示剂,它呈现出不同的颜色在不同酸碱条件下。
在酸性溶液中,酚酞呈现出无色状态,而在碱性溶液中会变成粉红色。
2. 中性纸:中性纸是一种简单易用的酸碱指示剂。
它会根据被测试溶液的酸碱性质变化颜色,便于判断溶液的性质。
中性纸在中性溶液中呈现出绿色。
三、气体试剂1. 氧气(O2):氧气是一种无色、无味的气体。
它是燃烧的必需品,可以维持燃烧过程中的能量供应。
氧气也是生物呼吸的必需气体。
2. 氢气(H2):氢气是一种无色、无味的气体。
它是化学实验中常用的还原剂,可以与氧气反应生成水。
氢气也是可再生能源的一种。
四、沉淀试剂1. 氯化银(AgCl):氯化银是一种无色沉淀,它可以通过加入氯离子与银离子反应生成。
氯化银在阳光下暴露会转变为紫色。
2. 氢氧化铜(Cu(OH)2):氢氧化铜是一种蓝色沉淀,具有明显的颜色特征。
它可以通过加入铜离子与氢氧化物离子反应生成。
五、指示气体试剂1. 氯气(Cl2):氯气是一种黄绿色气体,有刺激性气味。
化学反应试剂

化学反应试剂化学反应试剂是化学实验中常用的一种工具,它能够促进化学反应的进行,改变反应速率或产物的性质。
本文将介绍几种常见的化学反应试剂及其在实验中的应用。
一、酸碱试剂1. 盐酸(HCl)盐酸是一种强酸,它在实验室中常被用作酸化试剂。
它可以与碱性物质反应,生成相应的盐和水,并且可以用于酸碱中和反应。
例如,在实验中加入盐酸可以将NaOH中和生成氯化钠和水的反应表达为:NaOH + HCl → NaCl + H2O2. 硫酸(H2SO4)硫酸是另一种常见的酸性试剂,也是一种强酸。
它具有较高的酸度,可以用于酸化反应和脱水反应。
在实验中,硫酸可以与醇反应,进行酸催化的醇脱水反应:C2H5OH + H2SO4 → C2H4 + H2O二、氧化还原试剂1. 过氧化氢(H2O2)过氧化氢是一种强氧化剂,可以用于氧化反应或酸碱中和反应。
在实验室中,过氧化氢常被用作漂白剂、消毒剂以及化学反应的催化剂。
例如,过氧化氢可以与二氧化锰反应,产生氧气:2 H2O2 → 2 H2O + O22. 二氧化硫(SO2)二氧化硫是一种常见的还原剂,可以用于还原反应。
它可以与氧气反应,生成三氧化硫。
在实验室中,二氧化硫可用于还原碘酸钠:5 NaIO3 +6 SO2 + 10 H2O → 5 NaIO6 + 10 H2SO4三、沉淀试剂1. 氯化银(AgCl)氯化银是一种常见的沉淀试剂,可以用于检测氯离子的存在。
它与氯化物反应,生成白色沉淀。
例如,当氯化银与氯化钠反应时,会生成白色的氯化银沉淀:AgCl + NaCl → AgCl↓ + NaCl2. 溴化钡(BaBr2)溴化钡是一种常用的沉淀试剂,可以用于检测硫酸根离子的存在。
它与硫酸盐反应,生成黄色的硫酸钡沉淀。
例如,溴化钡与硫酸钠反应时会生成黄色的硫酸钡沉淀:BaBr2 + Na2SO4 → BaSO4↓ + 2 NaBr在化学实验中,合适的化学反应试剂能够提高实验效果,促进反应的进行。
化学实验中的常见化学试剂

化学实验中的常见化学试剂化学实验是学习化学科学的重要环节之一,而化学试剂是进行化学实验所必需的物质。
下面将介绍一些常见的化学试剂及其用途。
一、酸碱指示剂酸碱指示剂是一种用来检测溶液酸碱性质的试剂。
它可以根据溶液的pH值显示不同的颜色。
常见的酸碱指示剂有酚酞、溴甲酚、甲基橙等。
二、中和指示剂中和指示剂是用于判断酸碱中和反应终点的试剂。
它们在酸性和碱性条件下的颜色不同。
常用的中和指示剂有酚酞、溴甲酚、甲基橙等。
三、还原剂还原剂是一种用于还原反应的试剂。
它们可以向其他物质捐赠电子,使其他物质发生一系列的化学反应。
常见的还原剂有亚硫酸钠、氢气等。
四、氧化剂氧化剂是一种用于氧化反应的试剂。
它们可以夺取其他物质的电子,使其他物质发生一系列的化学反应。
常见的氧化剂有高锰酸钾、过氧化氢等。
五、络合剂络合剂是一种可以与金属离子形成络合物的试剂。
它们具有很强的亲金属特性,可以用于沉淀分析和配位化学等实验。
常见的络合剂有乙二胺四乙酸酸钠、硫氰酸铵等。
六、沉淀剂沉淀剂是一种用于沉淀反应的试剂。
它们可以与溶液中的离子发生反应,生成沉淀。
常见的沉淀剂有氢氧化钠、氢氧化铵等。
七、指示剂指示剂是用于判断反应终点的试剂。
它们可以通过改变颜色或其他物理性质来提示反应是否完成。
常见的指示剂有淀粉溶液、硫酸铜溶液等。
八、溶剂溶剂是一种用于溶解其他物质的试剂。
它们可以改变物质的溶解性质,使其被完全溶解或分散。
常见的溶剂有水、醇类、醚类等。
九、催化剂催化剂是一种可以加速反应速率的物质。
它们通常以很小的量加入反应体系中,能够提供反应的新途径,降低反应的活化能,使反应更容易进行。
常见的催化剂有酶、过渡金属离子等。
十、指示剂指示剂是一种用于检测成分或物性的试剂。
它们可以通过颜色变化或其他物理性质的变化来提示所需成分的存在。
常见的指示剂有凡纳滨、邻苯二胺等。
十一、缓冲溶液缓冲溶液是一种具有稳定pH值的溶液。
它们能够在一定程度上抵抗外界酸碱变化,用于稳定实验体系。
2024年高中化学实验常用试剂性质总结范本(2篇)

2024年高中化学实验常用试剂性质总结范本随着科技的发展和实验条件的改善,高中化学实验仪器和试剂也不断更新。
预计在2024年,高中化学实验的常用试剂会有以下几种,并对其性质进行总结。
1. 盐酸(HCl)盐酸是一种无色透明的液体,有强烈的刺激性气味。
其化学性质活泼,在常温下能与金属反应产生氢气,与碱反应生成相应的盐。
在实验中常用盐酸进行中和反应,同时也可以用作酸性溶液的制备。
2. 硝酸(HNO3)硝酸为无色透明的液体,具有强烈的刺激性气味。
它具有强氧化性,在与很多物质接触时会发生剧烈的化学反应。
在实验中,硝酸可用来进行金属的腐蚀实验,以及一些气体的制备等。
3. 硫酸(H2SO4)硫酸为无色透明的液体,具有高度的腐蚀性。
它是一种强酸,在与金属反应时会放出大量的氢气、二氧化硫等气体。
在实验中,硫酸常用于酸碱反应的中和,以及某些实验中的酸性介质。
4. 碳酸氢钠(NaHCO3)碳酸氢钠为白色结晶性粉末,具有较弱的碱性。
它可以和酸反应产生二氧化碳气体,并且在加热时会分解释放出二氧化碳和水。
在实验中,碳酸氢钠常用于测定酸碱度、制备二氧化碳气体等实验。
5. 氢氧化钠(NaOH)氢氧化钠为白色结晶性固体,具有强烈的腐蚀性。
它是一种强碱,在与酸反应时会发生中和反应,并放出大量的热。
在实验中氢氧化钠常用于酸碱滴定实验,以及一些有机合成反应的催化剂。
6. 氧气(O2)氧气是一种无色、无味、无臭的气体,是空气的主要成分之一。
它是一种强氧化剂,在与可燃物质接触时会发生剧烈的燃烧反应。
在实验室中,氧气常用于进行燃烧实验和氧化反应。
7. 乙醇(C2H5OH)乙醇为无色透明的液体,具有特殊的酒精气味。
它是一种易燃液体,可以在空气中燃烧,在实验中经常用作溶剂和试剂。
乙醇在实验室中常用于制备溶液、提取物质等。
8. 二氧化硫(SO2)二氧化硫为无色刺激性气体,具有特殊的刺激性气味。
它是一种还原剂,在与氧气接触时会发生剧烈的氧化反应。
在实验中,二氧化硫常用于制备一些化学试剂,如亚硫酸铵等。
化学实验室中的常用试剂

化学实验室中的常用试剂在化学实验室中,常常使用各种试剂来进行实验。
这些试剂在化学研究和分析中起着至关重要的作用。
本文将介绍化学实验室中常用的一些试剂,包括它们的性质、用途以及相应的注意事项。
1. 水(H2O)水是最常用的试剂之一。
在实验中,水一般用作反应溶剂、洗涤剂以及配制其它试剂的溶剂。
同时,水还可以用来冷却实验器皿和样品。
2. 乙醇(C2H5OH)乙醇是一种无色、易挥发的液体,并具有良好的溶解性。
它常被用作消毒剂、清洁剂和溶剂。
此外,乙醇还可用于制备酯类、醚类和酮类有机化合物。
3. 盐酸(HCl)盐酸是一种无色液体,具有较强的腐蚀性。
它常被用作试剂的酸性调节剂、清洗剂和消毒剂。
同时,盐酸还可用于溶解金属、去除垢垢以及中和碱性废物。
4. 硝酸(HNO3)硝酸是一种强酸,无色或带黄色的液体。
它可溶于水,并具有强氧化性。
硝酸广泛应用于实验室中的化学分析和合成反应。
但由于其强腐蚀性,操作时需要严格控制浓度和数量,避免造成伤害。
5. 二氧化硫(SO2)二氧化硫是一种无色气体。
它常作为还原剂、脱色剂和防腐剂使用。
此外,二氧化硫还可用于制备亚硫酸盐和硫酸。
6. 氯化铁(FeCl3)氯化铁是一种黄褐色固体,常用于金属离子检测、氧化反应以及制备其他化学试剂。
当氯化铁溶液和酚类物质反应时,可生成蓝、紫色溶液,用于指示某些化学反应。
7. 氢氧化钠(NaOH)氢氧化钠是一种白色固体,具有强碱性。
它常用于中和酸性试剂、沉淀反应和调节试剂溶液的pH值。
氢氧化钠要小心操作,以免腐蚀皮肤和眼睛。
8. 硫酸(H2SO4)硫酸是一种无色液体,具有强酸性。
它广泛用于分析化学、有机合成等领域。
硫酸非常腐蚀,使用时需戴上防护眼镜和手套。
同时,应注意避免与有机物或易燃物混合,以免引发危险。
9. 碳酸氢钠(NaHCO3)碳酸氢钠是一种无色晶体,常用作中和酸性溶液或生成气体,如二氧化碳。
此外,碳酸氢钠还可用于调节试剂溶液的pH值。
10. 甲醇(CH3OH)甲醇是一种无色挥发液体,常用于制备有机化合物、清洗实验器皿以及提供燃料。
高中生物各种试剂及其应用总结

高中生物各种试剂及其应用总结高中生物是一门重要的学科,其中试剂是不可或缺的一部分。
试剂是指在生物实验中用于检测、分离、纯化、定量、定性等目的的化学物质。
本文将对高中生物中常用的试剂及其应用进行总结。
1. 氢氧化钠(NaOH)氢氧化钠是一种强碱性试剂,常用于调节溶液的酸碱度。
在DNA 提取、蛋白质电泳等实验中,需要使用氢氧化钠来调节溶液的pH 值。
此外,氢氧化钠还可以用于清洗实验器皿。
2. 氯化铁(FeCl3)氯化铁是一种常用的试剂,可以用于检测苯酚、酚类化合物等。
在生物实验中,氯化铁可以用于检测蛋白质的存在。
当蛋白质与氯化铁反应时,会产生紫色的化合物,可以通过比色法进行定量分析。
3. 碘酸钾(KIO3)碘酸钾是一种氧化剂,可以用于检测淀粉质。
在淀粉质检测实验中,需要将样品加入碘酸钾溶液中,如果样品中含有淀粉质,则会产生蓝黑色的化合物。
4. 氯仿(CHCl3)氯仿是一种有机溶剂,可以用于提取脂质。
在脂质提取实验中,需要将样品加入氯仿中,通过离心等方法将脂质分离出来。
5. 氯化钠(NaCl)氯化钠是一种常用的盐类试剂,可以用于制备缓冲液、生理盐水等。
在细胞培养实验中,需要使用生理盐水来维持细胞的生长环境。
6. 碳酸氢钠(NaHCO3)碳酸氢钠是一种碱性试剂,可以用于制备缓冲液。
在细胞培养实验中,需要使用缓冲液来维持细胞的生长环境。
7. 氢氧化钾(KOH)氢氧化钾是一种强碱性试剂,可以用于调节溶液的酸碱度。
在DNA 提取、蛋白质电泳等实验中,需要使用氢氧化钾来调节溶液的pH 值。
8. 硫酸(H2SO4)硫酸是一种强酸性试剂,可以用于制备缓冲液、清洗实验器皿等。
在DNA提取实验中,需要使用硫酸来分离DNA。
9. 氢氧化铜(Cu(OH)2)氢氧化铜是一种碱性试剂,可以用于检测蛋白质的存在。
当蛋白质与氢氧化铜反应时,会产生蓝色的化合物,可以通过比色法进行定量分析。
10. 碘化钾(KI)碘化钾是一种常用的试剂,可以用于检测淀粉质。
高中生物常见试剂大全

高中生物常见试剂大全1.斐林试剂:成分:0。
1g/ml NaOH(甲液)和0.05g/ml CuSO4(乙液)。
用法:将斐林试剂甲液和乙液混合,再将混合后的斐林试剂倒入待测液,水浴加热,如待测液中存在还原糖,则呈砖红色。
2.班氏糖定性试剂:为蓝色溶液。
和葡萄糖混合后沸水浴会出现砖红色沉淀.用于尿糖的测定。
3.双缩脲试剂:成分:0.1g/ml NaOH(甲液)和0。
01g/ml CuSO4(乙液)。
用法:向待测液中先加入2ml甲液,摇匀,再向其中加入3~4滴乙液,摇匀.如待测中存在蛋白质,则呈现紫色。
4。
苏丹Ⅲ:用法:取苏丹Ⅲ颗粒溶于95%的酒精中,摇匀.用于检测脂肪。
可将脂肪染成橘黄色(被苏丹Ⅳ染成红色)。
5。
二苯胺:用于鉴定DNA.DNA遇二苯胺(沸水浴)会被染成蓝色。
6.甲基绿:用于鉴定DNA。
DNA遇甲基绿(常温)会被染成蓝绿色.吡罗红:检测RNA,呈红色7、50%的酒精溶液:用于洗去苏丹Ⅲ在脂肪上的浮色.8、70%的酒精溶液:用于医学临床上的消毒灭菌。
9、95%的酒精溶液:DNA不溶于酒精,尤其是体积分数为95%的冷冻酒精,而细胞中的某些物质可以溶解于酒精10、15%的盐酸:和95%的酒精溶液等体积混合可用于解离根尖,使细胞分离开来.“有丝分裂观察”和“低温诱导染色体加倍”中15%盐酸能够使洋葱细胞的细胞壁软化,并使细胞间的中胶层物质溶解,从而达到分离细胞的目的。
洗去卡诺氏液8%盐酸:(1)盐酸能改变细胞膜的通透性,加速染色剂的跨膜运输; (2)盐酸使染色体中的DNA与蛋白质分离,便于DNA与染色剂的结合11. 龙胆紫溶液或醋酸洋红:碱性染料,用于染色体染色时,前者呈深蓝色,后者呈红色改良苯酚品红染液:检测染色体,红色健那绿:检测线粒体,专一性让线粒体染色呈蓝绿色12.20%的肝脏、3%的过氧化氢、3。
5%的氯化铁:用于比较过氧化氢酶和Fe3+的催化效率。
(新鲜的肝脏中含有过氧化氢酶)13、3%的可溶性淀粉溶液、3%的蔗糖溶液、2%的新鲜淀粉酶溶液:用于探索淀粉酶对淀粉和蔗糖的作用实验。
高中生物常见试剂大全

高中生物常见试剂大全1.斐林试剂:成分:ml NaOH(甲液)和ml CuSO4(乙液)。
用法:将斐林试剂甲液和乙液混合,再将混合后的斐林试剂倒入待测液,水浴加热,如待测液中存在还原糖,则呈砖红色。
2.班氏糖定性试剂:为蓝色溶液。
和葡萄糖混合后沸水浴会出现砖红色沉淀。
用于尿糖的测定。
3.双缩脲试剂:成分:ml NaOH(甲液)和ml CuSO4(乙液)。
用法:向待测液中先加入2ml甲液,摇匀,再向其中加入3~4滴乙液,摇匀。
如待测中存在蛋白质,则呈现紫色。
4.苏丹Ⅲ:用法:取苏丹Ⅲ颗粒溶于95%的酒精中,摇匀。
用于检测脂肪。
可将脂肪染成橘黄色(被苏丹Ⅳ染成红色)。
5.二苯胺:用于鉴定DNA。
DNA遇二苯胺(沸水浴)会被染成蓝色。
6.甲基绿:用于鉴定DNA。
DNA遇甲基绿(常温)会被染成蓝绿色。
吡罗红:检测RNA,呈红色7、50%的酒精溶液:用于洗去苏丹Ⅲ在脂肪上的浮色。
8、70%的酒精溶液:用于医学临床上的消毒灭菌。
9、95%的酒精溶液:DNA不溶于酒精,尤其是体积分数为95%的冷冻酒精,而细胞中的某些物质可以溶解于酒精10、15%的盐酸:和95%的酒精溶液等体积混合可用于解离根尖,使细胞分离开来。
“有丝分裂观察”和“低温诱导染色体加倍”中15%盐酸能够使洋葱细胞的细胞壁软化,并使细胞间的中胶层物质溶解,从而达到分离细胞的目的。
洗去卡诺氏液8%盐酸:(1)盐酸能改变细胞膜的通透性,加速染色剂的跨膜运输;(2)盐酸使染色体中的DNA与蛋白质分离,便于DNA与染色剂的结合11. 龙胆紫溶液或醋酸洋红:碱性染料,用于染色体染色时,前者呈深蓝色,后者呈红色改良苯酚品红染液:检测染色体,红色健那绿:检测线粒体,专一性让线粒体染色呈蓝绿色%的肝脏、3%的过氧化氢、%的氯化铁:用于比较过氧化氢酶和Fe3+的催化效率。
(新鲜的肝脏中含有过氧化氢酶)13、3%的可溶性淀粉溶液、3%的蔗糖溶液、2%的新鲜淀粉酶溶液:用于探索淀粉酶对淀粉和蔗糖的作用实验。
化学试剂种类

化学试剂种类
化学试剂是指用于化学实验、分析、检测等领域的化学品。
根据其用途和性质不同,化学试剂可以分为多种类型。
下面将介绍几种常见的化学试剂。
1. 酸碱指示剂
酸碱指示剂是一种用于检测溶液酸碱性质的试剂。
常见的酸碱指示剂有酚酞、甲基橙、溴酚蓝等。
它们的颜色会随着溶液的酸碱性质发生变化,可以通过颜色变化来判断溶液的酸碱性质。
2. 挥发性试剂
挥发性试剂是指在常温下能够挥发的化学试剂。
常见的挥发性试剂有乙醚、氯仿、苯等。
它们通常用于有机合成反应中,可以作为溶剂或反应物。
3. 氧化还原试剂
氧化还原试剂是一种用于氧化还原反应的化学试剂。
常见的氧化还原试剂有硫酸铜、高锰酸钾、硝酸银等。
它们可以作为氧化剂或还原剂参与反应,用于分析、检测等领域。
4. 染料试剂
染料试剂是一种用于染色的化学试剂。
常见的染料试剂有甲基橙、
甲基紫、伊红等。
它们可以用于细胞染色、组织染色等领域,用于研究生物学、医学等方面。
5. 缓冲液
缓冲液是一种用于调节溶液酸碱度的化学试剂。
常见的缓冲液有磷酸盐缓冲液、三羟甲基氨基甲烷缓冲液等。
它们可以用于生物学、化学等领域,用于调节溶液的酸碱度,保持反应的稳定性。
以上是几种常见的化学试剂,它们在不同领域有着不同的应用。
在使用化学试剂时,需要注意安全,遵守实验室规定,正确使用试剂,避免发生意外。
化学试剂名称

化学试剂名称一、单质的的化学式氦气He、氖气Ne、氩气Ar、氪气Kr、氙气Xe、氡气Rn金Au、银Ag 、铜Cu、铁Fe、铝Al 、钙Ca 、钠Na、钾K碳C、磷P 、硫S、硅Si、硼B、砷As、氢气H2、氧气O2、氮气N2、氟气F2、氯气Cl2、溴水Br2、碘I2臭氧O3 、白磷P4二、氧化物的化学式一氧化碳CO 、二氧化碳CO2 、二氧化硫SO2、三氧化硫SO3水H2O 、双氧水H2O2、五氧化二磷P2O5、一氧化氮NO、二氧化氮NO2氧化钠Na2O 、氧化钾K2O、氧化银Ag2O氧化汞HgO 、氧化铜CuO、氧化镁MgO、氧化钙CaO、氧化锌ZnO、氧化亚铁FeO氧化铁Fe2O3、氧化铝Al2O3二氧化钛TiO2 、二氧化锰MnO2四氧化三铁Fe3O4三、酸的化学式盐酸HCl 、硝酸HNO3氢硫酸H2S、亚硫酸H2SO3、硫酸H2SO4 、碳酸H2CO3、磷酸H3PO4乙酸(醋酸)CH3COOH四、碱的化学式氢氧化钾KOH、氢氧化钠NaOH 、氨水NH3·H2O氢氧化钙Ca(OH)2、氢氧化钡Ba(OH)2 、氢氧化铜Cu(OH)2↓、氢氧化镁Mg(OH)2↓、氢氧化亚铁Fe(OH)2↓氢氧化铁Fe(OH)3↓、氢氧化铝Al(OH)3↓五、盐的化学式氯化银AgCl↓、氯化钾KCl 、氯化钠NaCl氯化铜CuCl2、氯化镁MgCl2、氯化钙CaCl2、氯化锌ZnCl2、氯化钡BaCl2、氯化亚铁FeCl2氯化铁FeCl3、氯化铝AlCl3、氯化钴CoCl3硫酸钠Na2SO4 、硫酸钾K2SO4硫酸钡BaSO4↓、硫酸铜CuSO4、硫酸锌ZnSO4 、硫酸钙CaSO4、硫酸镁MgSO4、硫酸亚铁FeSO4硫酸铁Fe2(SO4)3、硫酸铝Al2(SO4)3碳酸钠Na2CO3、碳酸钾K2CO3、碳酸铵(NH4)2CO3碳酸钙CaCO3↓、碳酸镁MgCO3、碳酸钡BaCO3↓、碳酸铜CuCO3↓、碳酸锌ZnCO3↓、碳酸亚铁FeCO3 碳酸铁Fe2(CO3)3、碳酸铝Al2(CO3)3硝酸钠NaNO3、硝酸银AgNO3、硝酸钾KNO3硝酸铜Cu(NO3)2、硝酸镁Mg(NO3)2、硝酸钙Ca(NO3)2、硝酸锌Zn(NO3)2、硝酸钡Ba(NO3)2硝酸铁Fe(NO3)3、硝酸铝Al(NO3)3氯化铵NH4Cl、硝酸铵NH4NO3、碳酸铵(NH4)2CO3、硫酸铵(NH4)2SO4硫化钠Na2S、硫化亚铜Cu2S、碘化钾KI 、溴化锌ZnBr、氯酸钾KClO3、高锰酸钾KMnO4 、锰酸钾K2MnO4、甲烷(天然气)CH4、乙醇(酒精) C2H5OH铜锈Cu2(OH)2CO3、铁锈Fe2O3.nH2O氧气O2氢气H2氮气N2氯气Cl2氧化镁MgO二氧化碳CO2氯化氢HCl氢氧化钠NaOH碳酸钙CaCO3硫酸铜CuSO4硝酸银AgNO3氯化钠NaCl三氧化铝AlCl3碳酸氢钠NaHCO3碳酸氢铵NH4HCO3高锰酸钾KMnO4二氧化锰MnO2甲烷CH4乙醇C2H水H2O一、硫酸盐类:1.皓矾:ZnSO4.7H2O2.钡餐,重晶石:BaSO43.绿矾,皂矾,青矾:FeSO4.7H2O4.芒硝,朴硝,皮硝:Na2SO4.10H2O5.明矾:KAl(SO4)2.12H2O6.生石膏:CaSO4.2H2O 熟石膏:2CaSO4.H2O7.胆矾、蓝矾:CuSO4.5H2O8.莫尔盐:(NH4)二、矿石类:1.莹石:CaF22.光卤石:3.黄铜矿:CuFeS24.矾土:Al2O3.H2O、Al2O3.3H2O和少量Fe2O3 、SiO25.磁铁矿石:Fe3O46.赤铁矿石:Fe2O37.褐铁矿石:2Fe2O3.3H2O8.菱铁矿石:Fe2CO39.镁铁矿石:Mg2SiO410.苏口铁:碳以片状石墨形式存在11.白口铁:碳以FeC3形式存在12.高岭石:Al2(Si2O5)(OH)4 或(13.正长石:KAlSi3O814.石英:SiO215.硼砂:Na2B4O7.10H2O16.脉石:SiO217.刚玉(蓝宝石.红宝石):天然产的无色氧化铝晶体18.黄铁矿(愚人金):FeS219.炉甘石:ZnCO320.智利硝石:NaNO321.滑石:22.大理石(方解石、石灰石):CaCO323.孔雀石:CuCO3.Cu(OH)224.白云石:MgCO3.CaCO325.冰晶石:Na3AlF626.高岭土:27.锡石:SnO228.辉铜矿:Cu2S三、气体类:1.高炉煤气:CO,CO2等混合气体2.水煤气:CO,H23.天然气(沼气):CH44.液化石油气:C3H8,C4H10为主5.焦炉气:CH4,CO,H2,C2H4为主6.裂解气:C2H4为主7.爆鸣气:H2和O28.笑气:N2O9.裂化气:C1~C4的烷烃、烯烃10.电石气:C2H2(通常含H2S、PH3等)四、有机类:1.福尔马林(蚁醛):HCHO2.蚁酸:HCOOH3.尿素:(NH4CNO)或CO(NH2)24.氯仿:CCl45.木精(工业酒精):CH3OH6.甘油:CH2OH-CHOH- CH2OH7.硬脂酸:C17H35COOH8.软脂酸:C15H31COOH9.油酸:C17H33OH10.肥皂:C17H35COONa11.银氨溶液:[Ag(NH3)2]+12.乳酸:CH3-CHOH-COOH13.葡萄糖:C6H12O614.蔗糖:C12H22O1115.核糖:CH2OH-(CHOH)3CHO16.脱氧核糖:CH2OH-(CHOH)2CH2-CH317.淀粉:(C6H10O5)n18.火棉,胶棉:主要成份都是[(C6H7O2)-(ONO2)3]n 只是前者含N量高19.尿素:CO(NH2)2 NH4CNO为氰酸铵(互为同分异构体)20.氯仿:CHCl321.油酸:C17H33COOH22.银氨溶液:[Ag(NH3)2]OH23.脱氧核糖:CH2OH-(CHOH)2CH2-CHO五、其他类:1.白垩:CaCO32.石灰乳、熟石灰:Ca(OH)23.熟石膏:2CaSO4.H2O4.足球烯:C605.铜绿:Cu2(OH)2CO36.纯碱(碱面):Na2CO37.王水:HCl,HNO3 (3:1)8.水玻璃(泡火碱) :Na2SiO39.小苏打:NaHCO310.苏打:Na2CO311.大苏打(海波):Na2S2O312.盐卤:MgCl2.6H2O13.雌黄:As2S314.雄黄:As4S415.朱砂:HgS16.石棉:17.砒霜:As2O318.泻盐:MgSO4.7H2O19.波尔多液:CuSO4+Ca(OH)220.钛白粉:TiO2。
四大高考化学实验必备试剂归纳及使用

四大高考化学实验必备试剂归纳及使用第一篇:四大高考化学实验必备试剂归纳及使用四大高考化学实验必备试剂归纳及使用化学实验重要的额就是对实验过程和实验中的细节进行把握,其中,了解高考化学实验必备试剂是提高化学实验水平的一个部分。
一、干燥剂根据干燥剂的性质可将干燥剂分为酸性干燥剂、碱性干燥剂和中性干燥剂等。
具体内容请点击:高考化学实验常用的干燥剂二、催化剂。
中学化学实验中用到的催化剂有:二氧化锰、硫酸、铁粉、氧化铝等。
1、二氧化锰催化剂。
如,①KClO3分解制取氧气的实验;②过氧化氢分解实验。
2、硫酸催化剂。
如,①乙烯的实验室制取实验;②硝基苯的制取实验;③乙酸乙酯的制取实验;④纤维素硝酸酯的制取实验;⑤乙酸乙酯的水解实验;⑥糖类(包括二糖、淀粉和纤维素)水解实验。
其中①-④的催化剂为浓硫酸,浓硫酸同时还作为脱水剂,⑤⑥的催化剂为稀硫酸,其中⑤也可以用氢氧化钠溶液做催化剂3、铁催化剂。
如溴苯的制取实验(实际上起催化作用的是溴与铁反应后生成的溴化铁)。
4、氧化铝催化剂。
如石蜡的催化裂化实验。
三、指示剂。
1、酸碱指示剂。
常用的酸碱指示剂有石蕊试剂、酚酞试剂和甲基橙试剂。
具体内容请点击:高考化学实验:酸碱指示剂??2、褪色指示剂。
品红试剂将品红溶入水而制得。
主要用于某些褪色性的物质检验,如SO2、Cl2(HClO)、H2O2、Na2O2等。
四、氧化剂。
中学化学实验室中的常用氧化剂有:KMnO4溶液、溴水、氯水等。
1、KMnO4溶液将KMnO4晶体溶入水中制得,其浓度一般为0.1%,这种氧化剂主要用来检验有机化学中的不饱和烃(如烯烃、炔烃等)和带有烃基的单环芳香烃(如甲苯、二甲苯等),因为KMnO4?溶液可以氧化不饱和烃的不饱和键及烃基芳香烃的侧链而使本身褪色。
2、溴水(或溴的CCl4溶液)(1)?氧化I-,生成单质碘。
(2)?氧化不饱和脂肪烃(如烯烃、炔烃等),用溴的褪色来检验不饱和脂肪烃的存在。
(3)?氧化苯酚,产生白色的三溴苯酚沉淀,此反应特别灵敏,常用来定性或定量的测定苯酚的存在。
高中化学实验项目名称及所需试剂和器材
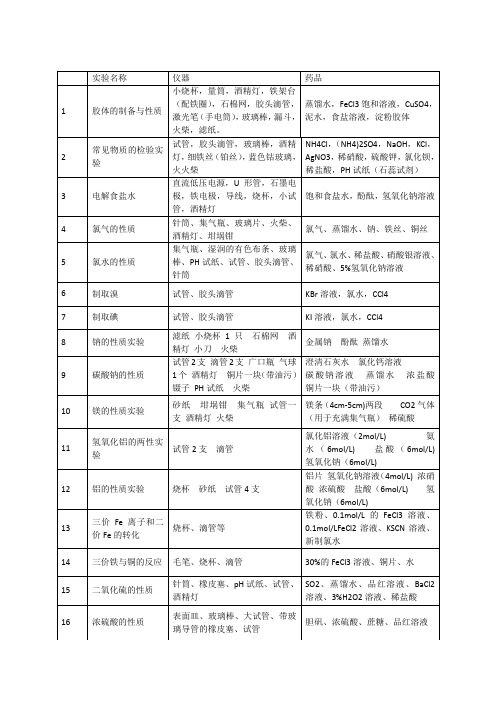
乙烯气体、酸性高锰酸钾溶液、溴的四氯化碳溶液
33
苯的性质
试管三支、胶头滴管、玻璃棒、酒精灯、火柴
苯、酸性高锰酸钾溶液、溴水
34
乙醇的性质
酒精灯、火柴、烧杯一只,试管一支、铁架台、石棉网、温度计一支、胶头滴管
钠、无水乙醇、铜丝(螺旋状)
33
乙酸的性质
酒精灯、火柴、铁架台、试管四支、玻璃导管一根、胶头滴管
10%氢氧化钠溶液、5%硫酸铜溶液、10%葡萄糖溶液、碘水、淀粉溶液、、硫酸溶液
稀醋酸溶液、石蕊溶液、碳酸钠溶液、冰醋酸、乙醇
34
制取肥皂
玻璃棒、小烧杯一只、酒精灯、火柴、试管两支、试管夹
5g新鲜动物脂肪(如牛油)、95%乙醇、40%氢氧化钠溶液、饱和食盐水、滤纸
35
葡萄糖的银镜实验
铁架台、石棉网、烧杯一只、试管五支、酒精灯、火柴、胶头滴管
葡萄糖、蔗糖、淀粉、纤维素、2%硝酸银溶液、2%稀氨水、10%葡萄糖溶液
26
化学反应中的热量变化
试管一支、砂纸、100ml烧杯、玻璃棒
镁条、2mol·L-1盐酸、经研磨的氢氧化钡晶体[Ba(OH)2·8H2O]、氯化铵晶体
27
化学能转化为电能
烧杯、导线、灵敏电流计
锌片、铜片、稀硫酸
28
化学电源
直流电源、发光二极管、导线、烧杯、多孔碳棒
铜片、铝片、锌片、纯碱、0.5mol/L硫酸钠溶液
6
制取溴
试管、胶头滴管
KBr溶液,氯水,CCl4
7
制取碘
试管、胶头滴管
KI溶液,氯水,CCl4
8
钠的性质实验
滤纸小烧杯1只石棉网酒精灯小刀火柴
金属钠酚酞蒸馏水
高中生物实验常用化学试剂

⾼中⽣物实验常⽤化学试剂 ⽣物试剂(Biochemical reagent)是指有关⽣命科学研究的⽣物材料或有机化合物,以及临床诊断、医学研究⽤的试剂。
由于⽣命科学⾯⼴、发展快,因此该类试剂品种繁多、性质复杂。
下⾯列举⼀些⾼中⽣物实验常⽤试剂。
1、斐林试剂:成分:0.1g/ml NaOH(甲液)和0.05g/ml CuSO4(⼄液)。
⽤法:将斐林试剂甲液和⼄液等体积混合,再将混合后的斐林试剂倒⼊待测液,⽔浴加热或直接加热,如待测液中存在还原糖,则呈砖红⾊。
2、班⽒糖定性试剂:为蓝⾊溶液。
和葡萄糖混合后沸⽔浴会出现砖红⾊沉淀。
⽤于尿糖的测定。
3、双缩脲试剂:成分:0.1g/ml NaOH(甲液)和0.01g/ml CuSO4(⼄液)。
⽤法:向待测液中先加⼊2ml甲液,摇匀,再向其中加⼊3-4滴⼄液,摇匀。
如待测中存在蛋⽩质,则呈现紫⾊。
4、苏丹Ⅲ:⽤法:取苏丹Ⅲ颗粒溶于95%的酒精中,摇匀。
⽤于检测脂肪。
可将脂肪染成橘黄⾊(被苏丹Ⅳ染成红⾊)。
5、⼆苯胺:⽤于鉴定DNA.DNA遇⼆苯胺(沸⽔浴)会被染成蓝⾊。
6、甲基绿:⽤于鉴定DNA.DNA遇甲基绿(常温)会被染成蓝绿⾊。
7、50%的酒精溶液:在脂肪鉴定中,⽤苏丹Ⅲ染液染⾊,再⽤50%的酒精溶液洗去浮⾊。
8、75%的酒精溶液:⽤于杀菌消毒,75%的酒精能渗⼊细胞内,使蛋⽩质凝固变性。
低于这个浓度,酒精的渗透脱⽔作⽤减弱,杀菌⼒不强;⽽⾼于这个浓度,则会使细菌表⾯蛋⽩质迅速脱⽔,凝固成膜,妨碍酒精透⼊,削弱杀菌能⼒。
75%的酒精溶液常⽤于⼿术前、打针、换药、针灸前⽪肤脱碘消毒以及机械消毒等。
9、95%的酒精溶液:冷却的体积分数为95%的酒精可⽤于凝集DNA. 10、15%的盐酸:和95%的酒精溶液等体积混合可⽤于解离根尖。
11、龙胆紫溶液:(浓度为0.01g/ml或0.02g/ml)⽤于染⾊体着⾊,可将染⾊体染成紫⾊,通常染⾊3-5分钟。
高中阶段常用的试剂

高中阶段常用的试剂1、斐林试剂配制:1)甲液质量浓度为0.1g/ml,取10gNaOH溶于蒸馏水,稀释至100ml 2)乙液质量浓度为0.05g/ml,取5gCuSO4溶于蒸馏水,稀释至100ml临用时将甲、乙液等量混合作用:鉴定还原性糖:C6H12O6、果糖、麦芽糖、乳糖等。
还原性糖与斐林试剂发生作用,生成砖红色沉淀。
如用于鉴定组织液中有否还原性糖、糖尿病人尿成分分析、酶专一性探索等。
2、班氏尿糖定性试剂配制:称取17.4克无水硫酸铜(CuSO4)溶解于100毫升热蒸馏水中,冷却后,稀释到150毫升。
称取柠檬酸钠173克及无水碳酸钠(Na2CO3)100克,加蒸馏水600毫升,加热使之溶解,冷却后,稀释到850毫升。
把硫酸铜溶液倾入柠檬酸钠及碳酸钠溶液中,搅匀后即为班氏尿糖定性试剂。
用细口瓶贮存备用(为了防止氢氧化铜沉淀的生成,故加入柠檬酸钠。
柠檬酸钠是一种亲水性掩蔽性络合物形成剂,它能与铜离子形成可溶性络盐)。
使用方法同斐林试剂,所不同的是班氏试剂可长期使用。
3、双缩脲试剂配制:A液:质量浓度为0.1g/ml,取10gNaOH溶于蒸馏水,稀释至100ml B液:质量浓度为0.01g/ml,取1gCuSO4溶于蒸馏水,稀释至100ml使用时,先加A液,后加B液作用:鉴定蛋白质,蛋白质与双缩脲试剂发生作用,可产生紫色反应。
也可用于鉴定多肽。
4、苏丹Ⅲ配制:取0.1g苏丹Ⅲ,溶解在100ml95%酒精中作用:鉴定脂肪,脂肪可以被苏丹Ⅲ染成橘黄色(或被苏丹Ⅳ染成红色)。
5、质量分数为15%的盐酸和体积分数为95%的酒精溶液的混合液(1:1)。
作用:用于洋葱根尖的解离,即使组织中的细胞相互分离开来。
能杀死细胞固定。
6、质量浓度为0.01g/mL的或0.02g/mL龙胆紫溶液(或醋酸洋红溶液)配制:是将龙胆紫溶解在质量分阶段数为2%的醋酸溶液中配制而成作用:使细胞核内的染色体着色,便于观察。
7、质量浓度为0.3g/ml的蔗糖溶液作用:观察成熟植物细胞质分离时用。
高中化学实验除杂试剂

高中化学实验除杂试剂
一说化学大家就会觉得化学很繁多,其实在学习化学中,还是需要积累的,小编整理了高中化学实验除杂试剂,希望能帮助到大家。
常见除杂试剂
浓硫酸(除水、碱性气体、还原性气体,性质为酸性、吸水性、强氧化性),
饱和氯化钠溶液(除氯化氢,一般用于收集氯气,利用HCl溶解度大),
饱和碳酸氢钠(除SO2、SO3、NO2、HCl等酸性气体,一般用来收集CO2,利用碳酸的弱酸性和碳酸氢钠的弱碱性),
水(除氨气、氯化氢等高溶解度的气体,起溶解作用),
O2(除NO2中的NO,性质为氧化性),
NaOH(除酸性气体,碱性),
碱石灰(除水、酸性气体,碱性、和水反应)
除杂设计原则
在实验设计方面主要考查实验的可行性及反应原理是否正确,反应所需条件是否能够达到;实验的有效率,即原材料取得的难易,实验中有效物质的分离难易和产率的高低。
实验副产物对环境的影响,即是否尽量少或不产生污染源或采用了有效的方法处理了污染物。
遇到这类题时,同学们一定要注意题目的要求,看在原料上是否有限制,包括原料的选择和转换,还要看在方法上是否有限制。
因此一般要选择易得价廉的原材料;条件尽可能低易达到;注意有效成份的净化分离容易,尽可能做到原料的综合利用;必须考虑有害成分的处理。
全部整理就在这里啦,希望能帮助到大家。
四大高考化学实验必备试剂归纳及使用

四大高考化学实验必备试剂归纳及使用化学实验重要的额就是对实验过程和实验中的细节进行把握,其中,了解高考化学实验必备试剂是提高化学实验水平的一个部分。
一、干燥剂根据干燥剂的性质可将干燥剂分为酸性干燥剂、碱性干燥剂和中性干燥剂等。
具体内容请点击:高考化学实验常用的干燥剂二、催化剂。
中学化学实验中用到的催化剂有:二氧化锰、硫酸、铁粉、氧化铝等。
1、二氧化锰催化剂。
如,①KClO3分解制取氧气的实验;②过氧化氢分解实验。
2、硫酸催化剂。
如,①乙烯的实验室制取实验;②硝基苯的制取实验;③乙酸乙酯的制取实验;④纤维素硝酸酯的制取实验;⑤乙酸乙酯的水解实验;⑥糖类(包括二糖、淀粉和纤维素)水解实验。
其中①-④的催化剂为浓硫酸,浓硫酸同时还作为脱水剂,⑤⑥的催化剂为稀硫酸,其中⑤也可以用氢氧化钠溶液做催化剂3、铁催化剂。
如溴苯的制取实验(实际上起催化作用的是溴与铁反应后生成的溴化铁)。
4、氧化铝催化剂。
如石蜡的催化裂化实验。
三、指示剂。
1、酸碱指示剂。
常用的酸碱指示剂有石蕊试剂、酚酞试剂和甲基橙试剂。
具体内容请点击:高考化学实验:酸碱指示剂??2、褪色指示剂。
品红试剂将品红溶入水而制得。
主要用于某些褪色性的物质检验,如SO2、Cl2(HClO)、H2O2、Na2O2等。
四、氧化剂。
中学化学实验室中的常用氧化剂有:KMnO4溶液、溴水、氯水等。
1、KMnO4溶液将KMnO4晶体溶入水中制得,其浓度一般为0.1%,这种氧化剂主要用来检验有机化学中的不饱和烃(如烯烃、炔烃等)和带有烃基的单环芳香烃(如甲苯、二甲苯等),因为KMnO4?溶液可以氧化不饱和烃的不饱和键及烃基芳香烃的侧链而使本身褪色。
2、溴水(或溴的CCl4溶液)(1)?氧化I-,生成单质碘。
(2)?氧化不饱和脂肪烃(如烯烃、炔烃等),用溴的褪色来检验不饱和脂肪烃的存在。
(3)?氧化苯酚,产生白色的三溴苯酚沉淀,此反应特别灵敏,常用来定性或定量的测定苯酚的存在。
中学化学试剂归纳

中学化学试剂归纳
的变质、糖类的发酵、脂类的酸败等)的物质。
中学化学中的防腐剂有:无机防腐剂如亚硫酸盐、焦亚硫酸盐及二氧化硫等;有机防腐剂如苯甲酸(安息香酸)及其盐类、对羟基苯甲酸酯类 . 9.吸附剂:固体物质表面对气体或液体分子的吸着现象称为吸附。
其中被吸附的物质称为吸附质,固体物质称为吸附剂。
吸附剂有活性炭,活性氧化铝,硅胶,分子筛等。
10.脱水剂:指按水的组成比脱去纸屑、棉花、锯末等有机物中的氢、氧元素的物质。
脱水剂有:浓硫酸等。
11.灭火剂:指能够灭火的物质。
中学化学中的灭火剂有:干粉灭火剂、泡沫灭火剂(Al2(SO4)3、NaHCO3)等。
12.定影剂:硫代硫酸钠、硫代硫酸铵。
12.磺化剂:指硫酸,在与有机物发生取代反应时提供磺酸基(—HSO3)。
13.净水剂:能除去水中的杂质使水净化的试剂。
化学中的净水剂有:明矾(K2Al2 (SO4)4·12H2O)、FeCl3等。
14.铝热剂:指铝与金属氧化物的混合物,可发生铝热反应制取金属。
15.原子反应堆的导热剂:钠和钾的合金在常温下呈液态,称为钠钾齐,用作原子反应堆的导热剂。
16.防冻剂:丙三醇17. 收敛剂:七水硫酸锌。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学常用试剂大全
1.盐酸(HCl):是一种强酸,常用于酸碱中和反应、金属的酸性溶解以及气体的吸收。
2.硫酸(H2SO4):也是一种强酸,常用于催化剂的制备、溶液的稀释以及有机合成反应中的脱水剂。
3.氢氧化钠(NaOH):是一种强碱,常用于酸碱中和反应、沉淀的析出以及调节溶液pH值。
4.氨水(NH3·H2O):是一种碱性气体的溶液,常用于金属离子的沉淀以及与某些金属离子形成络合物。
5.碘酒(I2):含有碘的酒精溶液,常用于检验淀粉的存在以及氧化还原反应中的指示剂。
6.硝酸银(AgNO3):常用于检验卤素离子的存在,如氯离子、溴离子和碘离子。
7.硝酸钾(KNO3):常用于火药的制备以及氧化还原反应中的氧化剂。
8.碳酸氢钠(NaHCO3):常用于酸碱中和反应、放出二氧化碳气体以及调节溶液pH值。
9.硫酸铜(CuSO4):常用于检验还原剂的存在以及水合物的蓝色溶液可以作为指示剂。
10.硫酸亚铁(FeSO4):常用于检验氧化剂的存在以及滴定分析中的还原剂。
11.氯化铁(FeCl3):常用于检验酚类化合物的存在以及某些有机反应的催化剂。
12.碳酸钙(CaCO3):常用于酸碱中和反应、沉淀的析出以及热分解反应的中间产物。
13.硝酸(HNO3):是一种强酸,常用于金属的酸性溶解以及氧化还原反应中的氧化剂。
14.氧化铜(CuO):常用于氧化还原反应中的催化剂以及某些有机合成反应的氧化剂。
15.硫酸钠(Na2SO4):常用于沉淀的析出以及调节溶液浓度。
16.碳酸钠(Na2CO3):常用于沉淀的析出以及酸碱中和反应。
17.氯化钠(NaCl):常用于制备氯气、调节溶液浓度以及酸碱中和反应。
18.硫化氢(H2S):是一种有毒气体,常用于金属离子的沉淀以及与某些金属形成硫化物。
19.氧化亚铁(Fe2O3):常用于氧化还原反应中的催化剂以及某些有机合成反应的氧化剂。
20.水(H2O):常用于溶解试剂、稀释溶液以及参与化学反应中的溶剂。
这只是高中化学常用试剂的一小部分,希望对你有所帮助。
如有需要,可以进一步了解每种试剂的性质、用途和注意事项。
