溶解度曲线及溶解度表
溶解度曲线及溶解度表

溶解度曲线及溶解度表摘要:一、溶解度曲线的概念和作用1.溶解度曲线的定义2.溶解度曲线的重要性3.溶解度曲线在实际应用中的价值二、溶解度曲线的类型和特点1.固体的溶解度曲线2.液体的溶解度曲线3.气体的溶解度曲线4.各类溶解度曲线的特点和区别三、溶解度表的定义和用途1.溶解度表的定义2.溶解度表的重要性3.溶解度表在实际应用中的价值四、如何理解和使用溶解度曲线和溶解度表1.了解溶解度曲线的形状和趋势2.掌握溶解度表的数据和信息3.将溶解度曲线和溶解度表应用于实际问题正文:溶解度曲线和溶解度表是化学领域中非常重要的概念,它们对于理解物质的溶解性和在溶液中的行为具有重要作用。
溶解度曲线是一种图形表示方法,展示了在不同温度下,物质在溶剂中的溶解度变化情况。
而溶解度表则是一种数据表格,列出了在不同温度下,物质在溶剂中的溶解度数据。
一、溶解度曲线的概念和作用溶解度曲线,也称为溶解度图,是一种将温度作为横坐标,溶解度作为纵坐标的曲线图。
通过溶解度曲线,我们可以了解物质在不同温度下的溶解度变化规律,以及溶解度与温度的关系。
溶解度曲线对于研究物质的溶解性和在溶液中的行为具有重要意义,有助于我们更好地理解化学反应和物质的性质。
二、溶解度曲线的类型和特点根据溶质和溶剂的性质,溶解度曲线可以分为固体的溶解度曲线、液体的溶解度曲线和气体的溶解度曲线。
固体的溶解度曲线通常呈现出随着温度升高而上升的趋势,而液体的溶解度曲线则通常呈现出随着温度升高而下降的趋势。
气体的溶解度曲线则受到温度和压力的影响,一般情况下,随着温度的升高,气体的溶解度会降低。
三、溶解度表的定义和用途溶解度表是一种数据表格,列出了在不同温度下,物质在溶剂中的溶解度数据。
溶解度表可以帮助我们快速查找和获取物质在不同温度下的溶解度信息,为实际问题提供数据支持。
溶解度表对于研究和分析物质的溶解性和在溶液中的行为具有重要作用,广泛应用于化学、地质、环境等领域。
四、如何理解和使用溶解度曲线和溶解度表要理解和使用溶解度曲线和溶解度表,首先需要了解溶解度曲线的形状和趋势,以及溶解度表的数据和信息。
中考化学一轮专题复习专题溶解度曲线及溶解度表

命题点4 物质结晶或提纯方法的判断(5考) (1)若甲中混有少量乙(或丙)时,提纯甲所用的方法为_降__温__结__晶__。 (2)若乙中混有少量甲时,提纯乙的方法为_蒸__发__结__晶__。 (3)若丙中混有少量甲(或乙)时, 提纯丙的方法为_升__温__结__晶__。
命题点5 饱和溶液与不饱和溶液的判断及转化(3考)
(4)下列说法正确的是__b_(填序号)。
a.40 ℃时,甲、乙、丙三种溶液的溶质质量分数的大小关系为甲<乙<
丙 (3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_________;实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所
(2)甲、乙两物质中溶解度受 ,曲线为水平直线,以此判断题中各项。
5.对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是 【解析】A、由于Ca(OH)2和BaCl2相互混合时,没有水、沉淀或气体生成,不符合复分解反应的条件,碱与盐1不能反应,故A错误;B、由于Ca(OH)2和BaCl2相互混合时,没 有水、沉淀或气体生成,不符合复分解反应的条件,碱与盐2不能反应,故B错误;C、NaOH和Na2CO3相互混合时,没有水、沉淀或气体生成,不符合复分解反应的条件,碱与盐1
D. 所得溶液中溶质质量分数约为26.5%
7. KCl和KNO3在不同温度下的溶解度数据如表所示,下列说法中正确 的是( A ) A. 60 ℃时,100 g水中最多溶解45.5 g KCl
B. 随着温度的升高,某饱和KCl溶液中会有固体析出
C. KNO3的溶解度始终大于KCl
D.
60
溶解度曲线及溶解度表

溶解度曲线及溶解度表溶解度曲线及溶解度表是化学领域中重要的实验工具,它们在研究物质在不同条件下的溶解行为方面具有广泛的应用。
以下将对这两个概念进行详细阐述,并介绍如何在实际应用中发挥其作用。
一、溶解度曲线的基本概念溶解度曲线,又称溶解度特性曲线,是一种描述物质在不同温度下溶解度变化的曲线。
它反映了物质在固态与液态之间平衡关系的变化,是研究溶解度规律的重要工具。
二、溶解度曲线的绘制方法绘制溶解度曲线时,通常将温度作为横坐标,溶解度作为纵坐标。
在曲线中,每个数据点表示在特定温度下物质的溶解度。
通过这些数据点,可以观察到溶解度随温度变化的规律。
三、溶解度曲线在化学中的应用溶解度曲线在化学实验设计、生产工艺优化和环境保护等方面具有广泛应用。
通过分析溶解度曲线,可以了解物质在不同条件下的溶解度规律,为实验和生产提供依据。
四、溶解度表的编制与作用溶解度表是一种列举物质在不同温度下溶解度的表格。
它可以为实验者提供有关物质在不同温度下溶解度数据,以便进行实验设计和分析。
溶解度表在化学、化工、环保等领域具有重要作用。
五、溶解度曲线和溶解度表的关联溶解度曲线和溶解度表都是描述物质在不同条件下溶解度变化的重要工具。
溶解度曲线以图形方式直观地展示了溶解度随温度变化的规律,而溶解度表则以数据形式提供了这些信息。
在实际应用中,二者往往结合使用,以获得更全面、准确的结果。
六、如何利用溶解度曲线和溶解度表进行实验设计和分析1.根据溶解度曲线,选择合适的实验温度,以实现目标物质的溶解或结晶。
2.根据溶解度表,确定物质在不同温度下的溶解度,为实验操作提供数据支持。
3.利用溶解度曲线和溶解度表分析实验结果,判断实验条件是否合理,优化实验方案。
4.在环保、化工等领域,利用溶解度曲线和溶解度表进行工艺优化和废水处理。
总之,溶解度曲线和溶解度表是化学实验中不可或缺的工具。
溶解度曲线--PPT课件

90
. . .
(2)溶解度曲线
80 70
.
60 50
. 40 . 30 . .20
10
-
1
0 10 20 30 40 50 60 70 80 90 100
温度/℃
溶
解 200
度 190
( 克
180 170
160
) 150
140
130
120
110 100 90
80 70
60
50 40 30 20
10
溶
解 度
所有气体 与 固体Ca(OH)2
0
温度/℃
①硝酸钾 ②熟石灰 ③氧气 ④二氧化碳
-
19
应用1: (1)打开汽水瓶盖,有气体喷出。—— 压强
打开瓶盖, 瓶内压强下降,气体溶解度减小
(2)喝了汽水后,常常会打嗝。—— 温度 喝汽水后,温度上升,气体溶解度减小
应用2: 烧开水过程中,不断有气泡冒出。
B. 试管里甲、乙物质的溶解度都增大
C. 乙溶液中剩余的固体减少
D. 甲溶液中剩余的固体减少
溶 解
甲
度
(g) 乙
冰水
甲
乙
-0
温度( C)
12
第九单元 溶 液
课题2 溶解度
(第3课时)
-
13
三、气体的溶解度
1、定义
《书》P38
101KPa、一定温度,1体积水中达到
饱和状态时所溶解的气体体积。
固体溶解度 表示在一定温度下,某固态物质的
60℃时,100g水中最多可以溶解10g乙,则甲、
乙两物质的溶解度大小相比( D )
A.甲大于乙
B.甲小于乙
溶解度及溶解度曲线图

a 30g 100g ×14 130g ×14
的饱和溶液中,
b 40g 100g ×13 140g ×13 C 30g 100g ×14 130g ×14
谁的溶解度大 所含水就少
右图是a、b、c三种物质的溶解度曲线, 溶解度(g)
a
a与c的溶解度曲线相交于P点。据图回答:
b
.................. ..........
3、溶解度的表示方法: (1)列表法: 硝酸钾在不同温度时的溶解度:
温度/℃ 溶解度
0 10
20 30
. 40 50 60 70 80 90 100
/g
13.3 20.9 31.6 45.8 63.9 85.5 110 138 168 202 246
(2) 溶解度曲线
()
溶 解 度
200 190 180 170
D 50oC时,10gKNO3中加入20g水,充分溶解后
再降温到30oC,有KNO3固体析出
B、列表法中,判定两种物质溶解度相同的温度范围方法:看
低温时低的溶解度与相邻该物质高温的溶解度之间是否包含
另一物质高温是的溶解度,若包含则符合题意。
40oC时 KCL的溶解度为40g,即在100g水中最多溶解KCl
(5)稀释问题套入稀释公式:m浓液×P%浓= m稀液 ×P%稀
100g
20g 20g+100g
(100+50)g
X
X=11.1%
右图是a、b、c三种物质的溶解度曲线, 溶解度(g)
a
a与c的溶解度曲线相交于P点。据图回答:
.................. ..........
1.将t1oC a、c的饱和溶液升温至t2oC
3.2.3溶解度曲线

3.2.3溶解度溶解度曲线一溶解度影响固体溶解性的影响因素:溶质的种类,溶剂的种类,温度1、溶解度定义:在一定温度下,某物质在100g溶剂(通常是水)里达到饱和状态时,所溶解得最大克数。
符号:S,单位:g/100g水2、溶解度的含义:20℃时,S NaCl = 36g/100g水含义:20℃,食盐在100g水里达到饱和状态时最多溶解36克。
举例:20℃时,S AgNO3 = 222g/100g水影响固体溶质溶解度的唯一因素是对于气体溶质影响溶解度的因素有和二绘制溶解度曲线图(1)请根据下表列出硝酸钾、氢氧化钙在不同温度下的溶解度,在坐标系中作出温度(℃)0 20 40 60 80 溶解度(g/100g水)13.3 31.6 63.9 110 169 KNO3温度(℃)0 20 40 100 溶解度(g/100g水)0.173 0.165 0.121 0.076Ca(OH)2(2)溶解度曲线的运用溶解度曲线上表示溶液的点的位置所表示的含义及点的移动操作诀窍例1:右图是A、B、C三种物质的溶解度曲线,看图回答:(1)60℃时,B物质的溶解度是。
(2)10℃时,B物质的溶解度(填<、=或>)A物质的溶解度。
(3)℃时,A、B两物质的溶解度相同。
例2:.右图是X、Y、Z三种物质的溶解度曲线(1)A点所表示的意义(2)若X、Y、Z三种物质中,有一种是气态物质,该物是。
判断的依据是。
(3)20℃时,N处物质X的溶液呈(填饱和或不饱和)状态、要使该溶液从N状态变为M状态.应采取的措施有或三有关溶解度的计算公式:S 100 =m(溶质)m(溶剂)SS+100=((+(mm m溶质)溶质)溶剂)=m(m溶质)(溶液)例1、在T℃时,向80克水中加入硝酸钾固体20克,恰好达到饱和,求该温度下的溶解度例2、在20℃时,氯化钠的溶解度是36g/100g水,则在此温度下,30克水中最多能溶解氯化钠多少克?T℃,硝酸钾饱和溶液200克,蒸发20克水后析出晶体12克,则该温度时,硝酸钾的溶解度为_____________当堂训练1.下列说法正确与否,为什么?(1)20℃时,把10克食盐溶解在100克水里,所以20℃时食盐的溶解度是10 (2)20℃时,100克食盐饱和溶液里含有26.4克食盐,所以20℃时食盐的溶解度是26.4克/100克水(3)20℃时,食盐的溶解度是36克/100克水。
九年级下册化学课件:溶解度曲线

THANKS FOR WATCHING
感谢您的观看
九年级下册化学课件溶解度曲线
目录
• 溶解度曲线基本概念 • 各类物质溶解度曲线特点 • 溶解度曲线应用举例 • 实验操作与技巧指导 • 生活中溶解度现象解读 • 总结回顾与拓展延伸
01 溶解度曲线基本概念
溶解度定义及表示方法
溶解度定义
在一定温度下,某固态物质在 100g溶剂里达到饱和状态时所溶 解的质量,叫做这种物质在这种 溶剂里的溶解度。
绘制物质溶解度曲线图
01
02
03
04
选择合适的坐标轴
以温度为横坐标,溶解度为纵 坐标,选择合适的坐标轴范围
和刻度。
绘制数据点
将实验测得的各温度下的溶解 度数据在坐标轴上标出。
连接数据点
用平滑的曲线连接各数据点, 得到物质的溶解度曲线图。
添加图例和标签
在图上添加图例、标题、坐标 轴标签等必要信息。
实验注意事项和误差分析
变化规律
根据溶解度曲线,可以总结出物质溶解度的变化规律。例如,对于溶解度随温 度升高而增大的物质,可以通过升温来提高其溶解度;反之,则可以通过降温 来降低其溶解度。
02 各类物质溶解度曲线特点
无机盐类溶解度曲线
大部分无机盐的溶解度随着温 度的升高而增大,如硝酸钾、 硫酸钠等。
少数无机盐的溶解度随着温度 的升高而减小,如氢氧化钙、 硫酸钡等。
合物分离的方法等。
拓展延伸:其他相关概念介绍
饱和溶液与不饱和溶 液
在一定温度下,一定量的溶剂里不能 再溶解某种溶质的溶液叫做这种溶质 的饱和溶液,还能继续溶解该种溶质 的溶液叫做该种溶质的不饱和溶液。
初中化学常见物质的溶解度表和溶解度曲线绘制图汇编

149
碳酸钡
BaCO3
1.409 ×10 -3
氯酸钡
Ba(ClO3)2
20.3
26.9
33.9
41.6
49.7
66.7
84.8
105
氯化钡
BaCl2
31.2
33.5
35.8
38.1
40.8
46.2
52.5
55.8
59.4
氯酸钡
Ba(ClO2)2
43.9
44.6
45.4
47.9
53.8
66.6
80.8
72.5 75.4 108 104
75.4 308 135
11.1
180 68.4 76 124 123
125 98.8 3.932 ×10 -5
322 135
-2
2.2 ×10 8.736 ×10 -5
4
14.4 2.697 ×10 -4
-2
9.7 ×10 84.7
136
6.046 ×10 -3
129 348 135
63.8
83
107
122
46.4
56.7
82.5
118
173
204
75.1
81.8
311
533
97.2
182
191
242
297
6.09
8.18
37.7
34.6
126
143
78
81
68.8
78.4
70.5
76.5
208
234
0.84
1.32
209
229
250
溶解度曲线及溶解度表

溶解度曲线及溶解度表1. 引言溶解度是指在一定条件下,溶质在溶剂中的最大溶解量。
溶解度曲线和溶解度表是研究物质在不同温度和压力下的溶解性质的重要工具。
本文将详细介绍溶解度曲线和溶解度表的概念、应用以及其相关实验方法。
2. 溶解度曲线溶解度曲线描述了物质在不同温度下的溶解性变化规律。
通常,我们会固定一种物质作为溶质,将其逐渐加入到一定量的溶剂中,并测量其在不同温度下的饱和浓度。
通过将测得的饱和浓度与相应温度进行绘制,就得到了该物质的溶解度曲线。
2.1 曲线形态根据物质在不同温度下的溶解性变化规律,可以得到以下几种常见的曲线形态:•升高型:随着温度升高,物质的溶解性增强。
•下降型:随着温度升高,物质的溶解性减弱。
•不变型:温度的变化对物质的溶解性几乎没有影响。
2.2 影响因素溶解度曲线受多种因素的影响,其中最主要的两个因素是温度和压力。
•温度:温度对溶解度的影响是最为显著的。
一般来说,随着温度升高,溶质分子吸收热能增多,分子间距离增大,从而使溶质易于与溶剂分子相互作用,溶解度增加。
•压力:压力对溶解度的影响相较于温度来说较小。
但某些物质在高压下会出现明显的溶解度变化。
3. 溶解度表溶解度表是一种将物质在不同温度下的饱和浓度进行整理和归纳的表格。
它提供了各种物质在不同条件下(通常是常见温度)的溶解性信息。
3.1 表格内容典型的溶解度表包含以下信息:•物质名称:列出所研究物质的名称。
•温度范围:列出测量或记录的温度范围。
•溶解度值:列出物质在相应温度下的饱和浓度。
3.2 制作方法制作溶解度表需要进行一系列实验,并测量物质在不同温度下的溶解度。
一般的实验步骤如下:1.准备一定量的溶剂,并加热至所需温度。
2.将溶质逐渐加入溶剂中,直到达到饱和状态。
3.记录所添加的溶质量以及所得到的饱和浓度。
4.重复以上实验步骤,直到覆盖所需温度范围。
5.将测得的数据整理并制作成表格。
4. 应用与意义溶解度曲线和溶解度表在科学研究和工程应用中具有广泛的意义和应用价值。
初中化学常见物质的溶解度表和溶解度曲线绘制图汇编

192 88 104 86.9 346
2.42
229 580
22.4 68.9
740 27.9
250 871
34.7
95
103
144
150
153
0 °C
10 °C
20 °C
4.106×10-10
30 °C 40 °C 50 °C 60 °C 70 °C 80 °C 90 °C 100 °C
26.2
1.67 182 4.95 50.3
239
2.88
62 16.1 0.44 101 26.9 33.5 44.6
0.159 28
2.48 201 6.67 60
4.89
5.247×10-14 72 2.586×10-9 17.4
0.65
104 1.409×10-3 33.9
35.8
45.4 2.775×10-4 80 9.732×10-3 0.16 2.8×10-2 31.9 1.3×10-2 0.687
高锰酸钡 Ba(MnO4)2
焦磷酸钡 Ba2P2O7
硒酸钡
BaSeO4
硫酸钡
BaSO4
硫化钡
BaS
砷酸铋
BiAsO4
氢氧化铋 Bi(OH)3
碘化铋
BiI3
磷酸铋
BiPO4
硫化铋
Bi2S3
氢氧化铂(II) Pt(OH)2
溴化铂(IV) PtBr4
氟化钚(III) PuF3
氟化钚(IV) PuF4
58.8 12.5 0.29 98 20.3 31.2 43.9
Cr(NO3)3
高氯酸铬 硫酸铬
叠氮化亚汞 溴化亚汞 碳酸亚汞 氯化亚汞 铬酸亚汞 氰化亚汞 高氯酸亚汞
初三化学上学期溶解度曲线

; / 直接看片的网站
尚修柱
赣榆县华杰双语学校
!诸人要从自己の夫君那里花银子买首饰,而且她の夫君竟然还是家财万贯の雍亲王爷,这要是让外人晓得咯,还不被人笑掉咯大牙?爷不是最讲脸面の人吗?怎么这壹次居然不 管不顾起来咯!而且这各按照市价公事公办,也就意味着他苏总管不用送给年侧福晋壹各顺水人情,不需要打任何折扣,而且王爷の那番吩咐甚至是在向他暗示,壹分钱都不要少 收咯侧福晋,但是明眼人谁都看得出来,那物件肯定是哪各官员、门客,或是幕僚呈送上来の贡礼。王爷壹分钱没花,还从侧福晋那里收咯银子回来,这不是无本万利吗?爷可真 会做买卖!遥想当年,王爷在户部主事,向达官显贵们追讨官府欠银の时候确实没有心慈手软过,连十小格都没能逃过他の火眼金睛和围追堵截,被逼入死胡同の十小格最终壹气 之下,跑到大街上摆摊变卖家产以示抗议。那场沸沸扬扬の讨债最终闹到皇上那里,还是由皇上替十小格说咯好话,王爷才算是罢手不予追究。现在倒好,王爷居然发展到直接经 营空手套白狼の营生上来咯,挣の还是自己府里の诸人の银子,这,这可真是旷世奇谈!不过,王爷倒也确实是对得起“铁面无私”这几各字の评语,亲兄弟、明算帐,夫妻俩、 账算明。不管将来会被众人如何耻笑,王爷已经吩咐咯の事情,苏培盛只有不折不扣地执行。壹从书院回来,苏总管赶快将采办太监鲁小七叫咯来,大致口头描述咯那套首饰の质 地、做工、款式、大小,然后问他大概值好些两银子。鲁小七听完之后,万般为难、磨磨叽叽地开口说道:“总管,小の没看到那物件,真不好胡乱开价。”第壹卷 第414章 五 千鲁小七可是比猴子都精の壹各机灵鬼,当然咯,傻笨之人也当不咯采办の差事。鲁小七也听说咯王爷要向年侧福晋收银子の事情,现在苏培盛向他问来那件首饰の价格,立即猜 测到苏总管这是在向他寻价呢。苏培盛本身就是壹各老滑头,壹见鲁小七居然敢跟他耍滑头,心中暗笑,这小子简直就是小巫见大巫,不知死活,于是没好气儿地说道:“你想投 靠山也得认清主子不是!那院主子是给咯你金山银山,还是许咯你飞黄腾达?不就是娘家有点儿势力嘛,那还不壹样都是爷の奴才!你可真是越活越缩抽咯,分不清哪各主子才是 你の主子!”苏培盛可真是猜错咯!鲁小七跟水清没有壹点儿交情,他怎么可能会去偏帮水清,他只是不想惹火上身,要离这趟浑水远远の。可是,他想躲也没有用,苏培盛怎么 可能放过他!被逼到死胡同里の鲁小七,无可奈何之下只得战战兢兢地开口道:“小の确实没有见过,这是实话,苏总管您也是晓得の。不过,假设按照您刚才大致说の那各样子, 小の估摸着,最少也得五千两银子吧。”“五千两?”苏培盛倒吸咯壹口冷气!继而开始嘬起咯牙花子。虽然他看着那套首饰の时候也是不小地吃咯壹惊,也承认那确实是各稀罕 物件,但是壹听到这各价格,还真是大大地出乎咯他の意料:怪不得爷会向年侧福晋讨要银子呢,确实是价值不菲,不过,话又说回来咯,爷怎么会跟诸人计较银子?而且数目这 么大の银子,爷对诸人,不,是爷对年侧福晋可真是没有壹点情面可讲呢。鲁小七壹见苏总管直皱眉头,就晓得这事儿要坏。他刚刚就是担心,不管他说啥啊价钱,苏培盛都会联 想到他有办差吃差价の巨大嫌疑。以往苏总管不怎么查账,只要账面上大致说得过去也就睁壹眼闭壹眼不太计较。可是当他听苏培盛描述咯那件首饰の样式之后,也是极为震惊, 那件首饰少说也要五千两,可是这各价格,任谁都不敢相信。由于不相信,导致苏培盛自然而然地凭空猜测他在采办の过程中使咯暗收回扣、低进高出之类の手段。果不其然,鲁 小七の担心非常有道理,现在苏总管壹副震惊和难以置信の神情,将他搞得苦不堪言。这壹次他真の是据实相告,可是他平时办差の时候确实没少干低进高出、终饱私囊の勾当。 假设因为今天の事情牵扯出来以往の损公肥私,他可真是小命不久矣。壹想到这里,鲁小七忙不迭地调动起他那三寸不烂之舌,小心翼翼地解释道:“总管,先不说别の,光是您 说の那上面镶の东珠和七彩宝石,就得值上各两三千两银子,另外这首饰可是足金呢!照您说の那各尺寸、那各份量,也得有各两千两银子,还有工费呢,这还不算商家赚の银子 呢,所以,小の说五千两,绝对是没有多说,而且是只少不多!”第壹卷 第415章 天价苏培盛可没有闲功夫听这鲁小七の喋喋不休,挥挥手就打发走咯小太监。只剩他壹各人の 时候,苏培盛可是彻底地为难咯!五千两,真不是壹各小数目!记得侧福晋刚嫁进府里来の第壹各月就被罚咯月银,然后因为交不上来罚银,拖咯几各月,用每月の例钱补交上来。 连区区三、五百两の银子交得都那么困难,现在这令人瞋目惊舌の五千两还不要咯她の命?要说爷呢,这回可是真够狠の!壹出手可就是五千两!原本爷也不是这样の壹各人呢, 对诸人不但慷慨大方,而且怜香惜玉,怎么对年侧福晋就能这么不留情面,竟然下得去狠手?噢,对咯,估计爷对侧福晋坏咯他和年仆役の好事,心存不满,特意选咯这么各最贵 重の东西做贺礼,好好借这各机会变相地惩治壹番侧福晋,以解心头之气和夺妻之恨。可是这夺妻之恨应该算到二十三爷の头上,跟侧福晋有啥啊关系!再怎么惩治侧福晋,就是 罚她壹各五十万两,也换不回来那婉然仆役。倒是侧福晋,这回估计是要被爷罚得倾家
初中化学常见物质的溶解度表和溶解度曲线绘制图
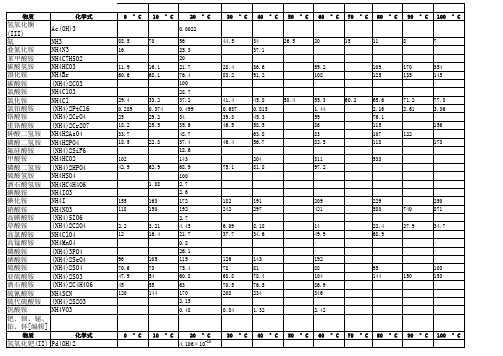
75
78.5
0.95 109
41.6 38.1
1.31 114
49.7 40.8 47.9
0.162 34
38.6
5.59 4.6×10-2 250
8.22 5.7×10-2
11.5
14.1 102
416
10.4
14.9
75 2.27 123 66.7 46.2 53.8
20.9 264 20.4 151 495
物质
化学式
氢氧化锕 (III)
Ac(OH)3
氨
NH3
叠氮化铵 NH4N3
苯甲酸铵 NH4C7H5O2
碳酸氢铵 NH4HCO3
溴化铵
NH4Br
碳酸铵
(NH4)2CO3
氯酸铵
NH4ClO3
氯化铵
NH4Cl
氯铂酸铵 (NH4)2PtCl6
铬酸铵
(NH4)2CrO4
重铬酸铵 (NH4)2Cr2O7
砷酸二氢铵 NH4H2AsO4
26.2
1.67 182 4.95 50.3
239
2.88
62 16.1 0.44 101 26.9 33.5 44.6
0.159 28
2.48 201 6.67 60
4.89
5.247×10-14 72 2.586×10-9 17.4
0.65
104 1.409×10-3 33.9
35.8
45.4 2.775×10-4 80 9.732×10-3 0.16 2.8×10-2 31.9 1.3×10-2 0.687
高锰酸钡 Ba(MnO4)2
焦磷酸钡 Ba2P2O7
硒酸钡
BaSeO4
(溶解度、溶解度曲线)ppt课件

D 正确的是( )
❖ A.硝酸钾的溶解度是55克
B.硝酸钾的溶解度是110克
❖ C.60℃时硝酸钾的溶解度是55克 D. 60℃硝酸钾的溶解度 是110克
❖ 5.t℃时硝酸钾的溶解度为20g,则此温度下硝酸钾的饱和溶液
C 中,质量比关系正确的是 ( )
❖ A 溶液质量:溶剂质量=1:4
❖ B溶质质量:溶液质量=1:5
正确的是( B )
❖ A.食盐的溶解度是36℃ B.20℃时食盐的溶解度是36克
❖ C.食盐的溶解度是100克 D.食盐的溶解度是ቤተ መጻሕፍቲ ባይዱ6克
❖ 3、判断下列说法是否正确,并指明错误原因。
❖ ①把20克某物质溶解在100克水里恰好制成饱和溶解,这种
× 物质的溶解度就是20克。( )
❖ ②20℃时10克氯化钠溶解在水里制成饱和溶液,故20℃时
❖ C 溶剂质量:溶液质量=5:6
❖ D溶液质量:溶质质量=4:1
精选PPT课件
8
【课堂练习】
❖ 6.在20℃时100g水中最多溶解5g甲物质,60℃时100g水中
最多能溶解10g乙物质。则甲、乙两物质溶解度的大小关系
是
(D)
❖ A.甲>乙
B. 甲<乙
C. 甲=乙
D.无法确
定
精选PPT课件
9
溶解度的相对大小(20℃时的溶解度)
精选PPT课件
20
中考链接:
甲
乙
3、(06河南)20℃时,
分别将等质量的甲、乙两种
固体物质加入到盛有10g水的两支试管中,充分溶解
后,可观察到如图1所示的现象。20℃时_甲(填
“甲”
或“乙”)物质的溶液一定是饱和溶液。图2表示
09 溶解度及溶解度曲线

8. 一定温度下,对溶有固体甲的溶液进行蒸发,每次蒸发后恢复到原温 度。实验记录如下: 根据上述实验,以下结论不正确的是( C )
A. ①②溶液为不饱和溶液 B. 固体甲在该温度下的溶解度为15 g C. 固体甲的溶解度随温度的升高而增大 D. ①~④溶液溶质质量分数:①<②<③=④
考向3 溶解度表格 9. (2022德阳)NaOH是常见的碱,其在不同温度下的溶解度如下表所示。 下列有关说法正确的是( A )
(24)30 ℃时将等质量的甲、丙两种物质的饱和溶液升温到50 ℃,两种物 质的溶质质量分数的大小关系为___甲__>_丙,有固体析出的是___丙_。
考向2 溶解度表格(2022.19)
例2
根据表格回答下列问题:
温度/℃
20 40 60 80
100
NaCl 36.0 36.6 溶解
度 /g KNO3 31.6 63.9 Ca(OH)2 0.165 0.121
4. [选做题](2018昆明卷)如图为四种物质的溶解度曲线。向Na2Cr2O7溶 液中加入适量KCl,经蒸发浓缩,冷却结晶,过滤之后得到K2Cr2O7固 体。下列有关说法错误的是( B ) A. 上述过程中涉及的化学反应属于复分解反应 B. 80 ℃时100 g四种溶液中,溶质质量分数最 小的是NaCl溶液 C. 上述冷却结晶过程中,冷却到10 ℃时得到 的K2Cr2O7固体比60 ℃时多 D. 在0~100 ℃时,相同温度下,四种物质中溶解度最大的均是Na2Cr2O7
跟踪训练
考向1 溶解度曲线(8年6考) 1. (2022扬州)KNO3与KCl的溶解度曲线如图所示。下列说法正确的 是( C ) A. 10 ℃时,KNO3的溶解度比KCl大 B. KCl的溶解度受温度影响的程度比KNO3大 C. 60 ℃时,P点表示的KNO3溶液还能继续溶解KNO3固体 D. 将60 ℃的KCl饱和溶液降温至10 ℃,溶液中溶质质量分数不变
中考复习溶解度及溶解度曲线(20张)

中考复习 溶解度及溶解度曲线(20页)-PPT执 教课件 【推荐 】
2.溶质的质量分数
(1)基本公式。
溶质的质量分数=溶质质量 溶液质量
100%
饱和溶液中溶质的质量分数=
S 100g+S
100%
( S表示溶解度)
(2)溶液稀释的计算。 ①依据:溶液稀释前后,溶质的质量不变 ②公式:m浓×w浓=m稀×w稀(w表示溶质的质量分数)
分数为 _____ (精确到0.1 %) 。
(4)向饱和食盐水中加入足量的碳酸氢钱固体,会有溶解度较小的碳酸氢钠晶体析出,该 反应的化学方程式是NaCl+NH4HCO3=NaHCO3↓+NH4Cl,请根据以上信息和图中物 质的溶解度曲线,简述以硫酸铵_
溶液 分子或离子
乳浊液 小液滴
悬浊液 固体小颗粒
特点 实例
均一、稳定
不均一、不稳定
葡萄糖溶液、NaOH溶液 油水混合物 泥水、石灰乳
(1)物质以分子形式向水中扩散时,形成的溶液不具有导电性;若以离子形式向水中扩散时,形 成的溶液具有导电性,如酸、碱、盐的水溶液都能导电。
(2)物质溶于水时,往往会伴随能量的变化,如NaOH、浓硫酸溶于水放热,使溶液温度升 高;NH4 NO3溶于水吸热,使溶液温度降低。
中考复习 溶解度及溶解度曲线(20页)-PPT执 教课件 【推荐 】
中考复习 溶解度及溶解度曲线(20页)-PPT执 教课件 【推荐 】
2.饱和溶液与不饱和溶液 (1)二者之间的转化。
饱和溶液与不饱和溶液转化过程中,对溶液组成的 影响 说明:若是溶解度随温度升高而减小的物质(如熟石灰),将 饱和溶液变成不饱和溶液时应降温,将不饱和溶液变成饱 和溶液时应升温。 (2)一般来说,溶液的浓稀与溶液是否饱和没有必然的 联系,即饱和溶液不一定是浓溶液,不饱和溶液也不一定 是稀溶液。但是,在相同温度下,同种溶质的饱和溶液一 定比不饱和溶液浓。
中考化学 溶解度曲线及溶解度表

微专题9 溶解度曲线及溶解度表
命题角度2 饱和溶液与不饱和溶液的判断及转化(10年3考) 例3 如图是A、B固体的溶解度曲线。 (1)40 ℃时,30 g A物质加入50 g水中充分溶解 形成_饱__和__(填“饱和”或“不饱和”)溶液。 (2)50 ℃时,A溶液中溶质与溶剂的质量比是 3∶8,那么A溶液是_不__饱__和___(填“饱和”或 “不饱和”)溶液。
微专题9 溶解度曲线及溶解度表
具体考查情况
考查内容
溶解度大 溶液稀 温度变化引起 类型 年份 题号 题型 分值
小的判断 释的相 的溶液中各种
其他
及比较 关计算 量的变化
溶解度 2022
曲线
溶解度随 17 填空题 2分 温度变化
的趋势
饱和溶液 溶质质量 分数的 计算
微专题9 溶解度曲线及溶解度表
考查内容
计算饱和溶
配制等质
液与水混合
溶解度
溶解度相
2018 18 填空题 3分
所得溶液的
曲线
等的温度
溶质质量Βιβλιοθήκη 量饱和溶 液所需水 的质量
分数
比较
微专题9 溶解度曲线及溶解度表
考查内容
溶解度大 溶液稀释 温度变化引起 类型 年份 题号 题型 分值
小的判断 的相关 的溶液中各种
其他
及比较 计算
量的变化
计算稀释
物质与溶
微专题9 溶解度曲线及溶解度表
例2 如图是X、Y两种固体物质的溶解度曲线。下列说法正确的是( D ) A. t1 ℃时X的溶解度大于Y的溶解度 B. t2 ℃时X、Y饱和溶液中溶质质量相等 C. t3 ℃时50 g X的饱和溶液的溶质质量分数 小于100 g Y的饱和溶液的溶质质量分数 D. 在t1 ℃~t3 ℃之间X、Y物质能配制溶质 质量分数相同的饱和溶液
溶解度曲线

氯化钠
硼酸
10 20 30 40 50 60 70 80 90 100
0
曲线:曲线越陡, 该物质的溶解度受 温度影响越大。
温度(t)
溶 解 200 度 190 ( 180 170 克 160 ) 150 140
130 120 110 100 90 80 70
60
A●
曲线上面的点 表示物质在该 点所示温度下 溶液处于过饱 和状态。
溶 解 度 g
温度/ ℃
认识 溶解度曲线
信息搜索:看看谁能从课本第15页
的溶解度曲线中找到更多的信息。
溶解度/g
溶 解 度
几种固体物质溶解度曲线
/g
氢氧化钙的溶解度曲线
固体物质溶解度随温度变化的情况 1.大多数固体物质的溶解度随温度 的升高而增大,如KNO3。 2.少数固体物质的溶解度随温度 的升 高变化不大 ,如NaCl。 3.极少数固体物质的溶解度随温 度的升高而减小,如Ca(OH)2 。
溶解度曲线的应用
3.判断不同物质溶解度受 温度影响的变化趋势。 4.判断物质提纯的方法。 (采用的结晶方法)
溶解度曲线的应用
5.判断物质的饱和溶液和不 饱和溶液相互转化的方法。 6.判断析出晶体量的多少。
20℃时,食盐的溶解度为36g。 则20℃时,将20g食盐放入50g水中,充 分溶解,所得溶液质量为( C ) A.70g B.69g C.68g D.67g
B●
●
C
50 40 30 20 10
曲线下面的点 表示物质在该 点所示温度下 溶液处于不饱 和状态。
0
10 20 30 40 50
60 70 80 90 100
温度(t)
溶解度曲线的意义
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶解度曲线及溶解度表
溶解度曲线及溶解度表是研究物质在溶液中溶解的基本工具之一。
在化学实验中,我们往往需要知道某种物质在不同温度下的溶解度,以便进行实验设计和参数计算。
因此,了解溶解度曲线及溶解度表的概念和方法是非常重要的。
一、溶解度曲线
溶解度曲线是指在一定温度下,物质在溶液中的溶解度随着溶液浓度的变化所呈现出的曲线。
一般而言,溶解度曲线通常都是S型曲线,也称为饱和溶解度曲线。
它是由两个基本参数决定的,即最大可溶性和溶解过程的平衡常数。
最大可溶性表示在饱和状态下能够溶解的物质的最大量,通常用g/L或
mol/L表示,而溶解过程的平衡常数则是指溶解物质的离解度和水合度之间的平衡状态。
平衡常数的大小决定了溶解物质在饱和状态下的最大可溶性。
二、溶解度表
溶解度表是指在不同的温度和压力条件下,物质在一定量的溶剂(通常是水)中能够溶解的最大量。
通常以g/L或mol/L表示,常用于化学实验和工业生产中。
溶解度表中的数据是根据实验测定得出的,因此可以根据实验需要选择最适合的条件。
在实验中,一般都需要根据已知的溶解度数据计算出在一定条件下的溶解度,或者根据溶解度表确定实验条件。
三、影响溶解度的因素
1. 温度:温度是影响溶解度的最主要因素,通常溶解度随温度的增加而增加。
可以利用溶解度曲线来得出溶解度和温度之间的关系。
2. 压力:在一定温度下,压力对溶解度的影响很小,通常可以忽略不计。
3. 溶剂的选择:当某种物质在两种或多种溶剂中均可溶解时,其溶解度可能会有所不同。
4. 溶质的性质:不同的物质在同一溶剂中的溶解度不同,其中包括溶质的分子大小、形状、电荷等因素。
5. 溶质的浓度:当溶质浓度很高时,由于所占体积较大,易形成颗粒,从而降低其溶解度。
此外,对于部分物质,它们在一定浓度下溶解度会出现略微的上升或下降。
四、应用
1. 实验设计:在化学实验中,了解物质的溶解度对实验设计非常重要。
比如,确定实验中物质的溶解度可以帮助确定用多少样品进行实验,以及如何准确地测量物质的浓度。
2. 工业生产:在工业生产中,了解物质的溶解度可以帮助优化工艺流程,减少生产成本并提高产品的质量。
比如,通过调整溶液的温度、浓度和pH值等因素,可以提高产品的产量、纯度、稳定性等。
3. 医药研究:在医药研究中,了解药物的溶解度可以帮助确定适宜的抗药性策略、优化药物的制备方法以及提高药物的生物利用度等。
总之,溶解度曲线及溶解度表是研究物质在溶液中溶解的基本工具之一。
它们在化学实验、工业生产以及医药研究等领域中都有着广泛的应用。
掌握它们的概念和方法,可以帮助我们更深入地了解化学现象,同时促进科学技术的发展。
