降压物质检查原始记录
药品检验原始记录

原始记录的基本要求
如发现记录有误,可用单线划去并保持原有记 录可辨,不得擦抹涂改;并在修改处签名或盖 章。
检验或试验结果无论成败(包括必要的复试), 均应详细记录和保存。对废弃的数据或失败的 实验,应及时分析其可能的原因,并在原始记 录上注明。
原始记录的基本要求
检验中使用的标准品、对照品或对照药材,应 记录其来源、批号、含量和使用前的处理;用 于含量或效价测定的,应注明其含量或效价。
[检查]
含氮量:记录采用氮测定法第×法,供试品 的称量(平行试验2份),消解及蒸馏的过程, 硫酸滴定液的浓度(mol/L),样品与空白试验 消耗滴定液的毫升数,计算式与结果。
pH值(包括原料药与制剂采用pH值检查的“酸 度、碱度或酸碱度”):记录仪器型号,室温, 定位用标准缓冲液的名称,校准用标准缓冲液 的名称及其校准结果,供试溶液的制备,测定 结果。
吸收系数:记录仪器型号与狭缝宽度,供试品的称量 (平行试验2份)及其干燥失重或水分,溶剂名称与检查 结果,供试液的溶解稀释过程,测定波长(必要时应附 波长校正和空白吸收度)与吸收度值(或附仪器自动打 印记录),以及计算式与结果等。
酸值(皂化值、羟值或碘值):记录供试品的称量(除酸 值外,均应作平行试验2份),各种滴定液的名称及其 浓度(mol/L),消耗滴定液的毫升数,空白试验消耗滴 定液的毫升数,计算式与结果。
[鉴别]
薄层色谱(或纸色谱):记录室温及湿度,薄层 板所用的吸附剂(或层析纸的预处理),供试品 的预处理,供试液与对照液的配制及其点样量, 展开剂、展开距离、显色剂,色谱示意图;必 要时,计算出Rf值。
[鉴别]
气(液)相色谱:如为引用检查或含量测定项下 所得的色谱数据,记录可以简略;但应注明检 查(或含量测定)项记录的页码。
原始记录规范

原始记录的书写细则(针对分析检验记录)原始记录是出具资料的依据,是进行科学研究和技术总结的原始资料;为保证药品研究工作的科学性和规范化,原始记录必须做到:记录原始、真实,内容完整、齐全,书写清晰、整洁。
1、检验记录的基本要求:1.1 原始记录应采用统一印制的活页记录纸、实验记录本和各类专用检验记录表格(见附件),并用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。
凡用微机打印的数据与图谱,应剪贴于记录上的适宜处,并有操作者签名;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。
1.2 检验人员在检验前,应逐一查对检品的编号、品名、规格、批号和效期,生产单位或产地,检验目的和收检日期,以及样品的数量和封装情况等,并将样品的编号与品名记录于记录纸上。
1.3 原始检验记录,应先写明检验的依据。
凡按中国药典、部颁标准、地方药品标准或国外药典检验者,应列出标准名称、版本和页数;凡按送验者所附检验资料或有关文献检验者,应先检查其是否符合要求,并将前述有关资料的影印件附于检验记录之后,或标明归档编码。
1.4 检验过程中,可按检验顺序依次记录各检验项目,内容包括:项目名称,检验日期,操作方法(如系完全按照1.3检验依据中所载方法,可简略扼要叙述;但如稍有修改,则应将改变部分全部记录),实验条件(如实验温度,仪器名称型号和校正情况等),观察到的现象(不要照抄标准,而应是简要记录检验过程中观察到的真实情况;遇有反常的现象,则应详细记录,并鲜明标出,以便进一步研究),实验数据,计算(注意有效数字和数值的修约及其运算,详见《中国药品检验标准操作规范》第414页)和结果判断等;均应及时、完整地记录,严禁事后补记或转抄。
如发现记录有误,可用单线划去并保持原有的字迹可辩,不得擦抹涂改;并应在修改处签名或盖章,以示负责。
检验或试验结果,无论成败(包括必要的复试),均应详细记录、保存。
对废弃的数据或失败的实验,应及时分析其可能的原因,并在原始记录上注明。
降压物质检查法操作规程

降压物质检查法操作规程:1简述本法系比较必然量的组织胺对照品与供试品引发麻醉猫血下降的程度,以确信供试品中降压物质的含量是不是符合规定的一种方式。
2 实验材料及用具天平精度或对照品或供试品称量用精度1mg 试剂称用量精度10g 动物称重用血压记录装置记录仪、汞柱血压计、压力传感器或记纹鼓、描记杠杆、汞柱血压计。
实验用具手术台、注射器(1ml精度,5ml精度)吸管、移液管、容量瓶、带塞小瓶、安瓶、测量尺、三通开关、脱脂棉、绳、线。
手术用器械剪毛剪、手术剪、眼科直镊、眼科弯镊、手术刀、止血镊、气管插管、动静脉夹及插管。
试剂氯化钠、苯巴比妥钠、戊巴比妥钠、肝素钠及其他试剂。
3 溶液配制10%苯巴比妥钠溶液称取苯巴比妥钠适量,加水配成10%溶液(必要时加热溶解)。
5%戊巴比妥钠溶液称取戊巴比妥钠适量,加水配成5%溶液(必要时加热溶解)。
或用其他适当浓度试剂。
生理盐水称取氯化钠适量,加水配成%溶液。
肝素钠溶液称取肝素钠适量,乘以每毫克标示效价单位,得肝素总单位数,加生理盐水配成1000u/ml溶液。
对照品溶液取磷酸组织胺对照品,放置至室温。
割开对照品小管,(注射勿使玻屑掉入)周密称量磷酸组织按适量。
将称取的毫克数乘以,换算出组胺的实际重量(mg)。
加水将组胺溶解配成ml的对照品溶液,分装于安瓶中,熔封,置4~8℃保留用,在确保降压活性符合要求的前提下,可在3个月内利用。
实验当日,掏出组按溶液,放置至室温。
割开安瓶,周密量取组胺溶液适量,用生理盐水配成ml的稀释液。
供试品溶液按中国药典正文规定的剂量,配成适当浓度的供试品溶液。
实验时,一样要求供试品溶液与对照品稀释液的注入体积相等。
4 实验动物健康无伤,体重2kg以上的猫,雌雄都可,雌者无孕。
5 检定法麻醉动物和手术5.1.1 将动物称重用注射器吸取10%苯巴比妥钠溶液(kg)和5%戊巴比妥钠(kg)混匀,腹腔注射麻醉动物。
也可用其他麻醉药品麻醉动物。
动物麻醉后,仰卧固定于手术台上(动物需维持体温,必要时采取保温方法),沿颈部正中线切开,分离气管,并插气管插管,必要时可接人工呼吸机。
耐电压测试仪检定原始记录
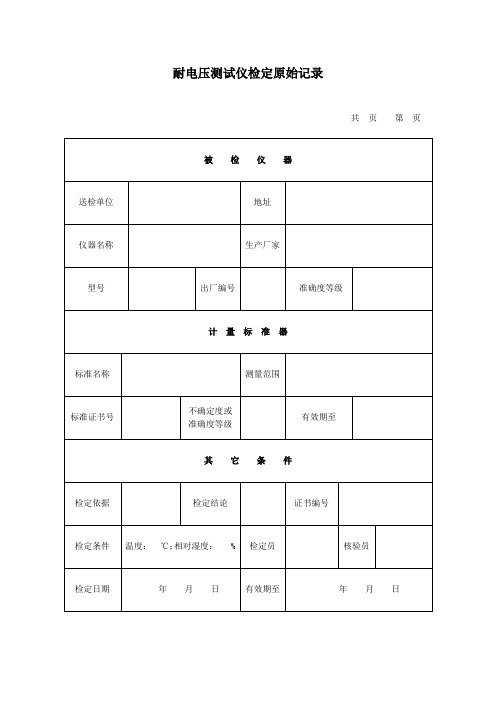
七、实际输出容量:
八、绝缘电阻:
九、工频耐压试验:
十、备注:
二、击穿报警电流
量程 /mA 示值 /mA 实测值(AC) /mA 平均值 /mA 误差 ( ) 实测值(DC) /mA 平均值 /mA 误差 ( )
共
页
第 页
三、电压持续时间:
量程/s
示值/s
实测值/s
平均值/s
误差( )
四、外观和通电检查:
五、交流输出电压的失真度:
六、直流输出电压的纹波系数:
耐电压测试仪检定原始记录
共
页
第 页
被
检
仪
器
送检单位
地址
仪器名称
生产厂家
型号
出厂编号
准确度等级
计
量 标
准
器
标准名称
测量范围
标准证书号
不确定度或 准确度等级
有效期至
其
它
条
件
检定依据
检定结论
证书编号
检定条件
温度:
℃; 相对湿度:
%
检定员
核验员
检定日期
年Байду номын сангаас
月
日
有效期至
年
月
日
共
页
第 页
一、输出电压
量程 /kV 示值 /kV 实测值(AC) /kV 平均 值/kV 误差 ( ) 实测值(DC) /kV 平均 值/kV 误差 ( )
药品检验记录与检验报告书的书写细则

药品检验记录与检验报告书的书写细则检验记录是出具检验报告书的依据,是进行科学研究和技术总结的原始资料;为保证药品检验工作的科学性和规范化,检验记录必须做到:记录原始、真实,内容完整、齐全,书写清晰、整洁。
药品检验报告书是对药品质量作出的技术鉴定,是具有法律效力的技术文件;药检人员应本着严肃负责的态度,根据检验记录,认真填写“检验卡”,经逐级审核后,由所领导签发“药品检验报告书”。
要求做到:依据准确,数据无误,结论明确,文字简洁,书写清晰,格式规范;每一张药品检验报告书只针对一个批号。
1 检验记录的基本要求:1.1 原始检验记录应采用统一印制的活页记录纸和各类专用检验记录表格(见附件),并用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。
凡用微机打印的数据与图谱,应剪贴于记录上的适宜处,并有操作者签名;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。
1.2 检验人员在检验前,应注意检品标签与所填检验卡的内容是否相符,逐一查对检品的编号、品名、规格、批号和效期,生产单位或产地,检验目的和收检日期,以及样品的数量和封装情况等。
并将样品的编号与品名记录于检验记录纸上。
1.3 检验记录中,应先写明检验的依据。
凡按中国药典、部颁标准、地方药品标准或国外药典检验者,应列出标准名称、版本和页数;凡按送验者所附检验资料或有关文献检验者,应先检查其是否符合要求,并将前述有关资料的影印件附于检验记录之后,或标明归档编码。
1.4 检验过程中,可按检验顺序依次记录各检验项目,内容包括:项目名称,检验日期,操作方法(如系完全按照1.3检验依据中所载方法,可简略扼要叙述;但如稍有修改,则应将改变部分全部记录),实验条件(如实验温度,仪器名称型号和校正情况等),观察到的现象(不要照抄标准,而应是简要记录检验过程中观察到的真实情况;遇有反常的现象,则应详细记录,并鲜明标出,以便进一步研究),实验数据,计算(注意有效数字和数值的修约及其运算,详见《中国药品检验标准操作规范》第414页)和结果判断等;均应及时、完整地记录,严禁事后补记或转抄。
药品检验原始记录及报告的规范化要求

5
编辑版ppt
原始记录的基本要求
检验过程中,可按顺序依次记录各检验项目,内容包 括项目名称、检验日期、操作方法(如系完全按照法 定标准中所载检验方法,可简略扼要的叙述;但如稍 有修改,则应将改变部分如实全部记录)、实验条件 (如实验室温湿度、实验仪器名称型号)、观察到的 现象(不要照抄标准,而应记录实验过程中观察到的 真实现象;如遇反常现象,应详细记录,鲜明标出, 以便进一步研究)、实验数据、计算、结果判断等。 均应及时、完整的记录,严禁事后补记或转抄。
9
编辑版ppt
对各检验项目记录的要求
项目名称应按标准规范书写,不得采用习用语, 如“重量差异”记成“片重差异”、“崩解时 限”记成“崩解度”。
外观性状:应根据检验中看到的情况如实描述 药品的外观,不可照抄标准上的规定。
如:标准规定中描述为“应为白色或类白色 的结晶或结晶性粉末”,可依观察结果记录为 “白色结晶性粉末”。
21
编辑版ppt
[检查]
含氮量:记录采用氮测定法第×法,供试品 的称量(平行试验2份),消解及蒸馏的过程, 硫酸滴定液的浓度(mol/L),样品与空白试验 消耗滴定液的毫升数,计算式与结果。
pH值(包括原料药与制剂采用pH值检查的“酸 度、碱度或酸碱度”):记录仪器型号,室温, 定位用标准缓冲液的名称,校准用标准缓冲液 的名称及其校准结果,供试溶液的制备,测定 结果。
重金属(或铁盐):记录采用的方法,供试液的制备, 标准溶液的浓度和用量,比较结果。
砷盐(或硫化物):记录采用的方法,供试液的制备, 标准溶液的浓度和用量,比较结果。
25
原始记录模板(有关物质)

二、溶液的制备:
溶剂:
1.系统适用性溶液:g —→ml进样量:μl
2.供试品溶液:供试品g —→ml(mg/ml)
3..对照溶液(1%):取供试液1ml―→100ml
三、结果:
积分条件:
系统适用性试验结果
名称
保留时间
对称因子
(≤)
理论塔板数
(N≥)
检品
名称
检品
来源
送检
日期
批号
检验
依据
申报标准、内控标准
或标准号
检验项目
有关物质
检验
日期
规格
温度:湿度:
有关物质
标准:
一、色谱条件
仪器:高效液相色谱仪,检测器:DAD、VWD、MWD,电子天平:
色谱柱)
流动相A(%)
流动相B(%)
B:
梯度:
流速:ml/min波长:nm柱温:℃进样量:μl
分离度
(≥)
检品
名称
检品
来源
送检
日期
批号
检验
依据
申报标准、内控标准
或标准号
检验项目
有关物质
检验
日期
规格
温度:湿度:
计算公式:有关物质(%)=(A杂/A对)×1%
批号
称样量,g
最大单一杂质,%
总杂质,%
(结果详见所附的Excel表)
四、结论:
药品检验原始记录书写范例

XXX食品药品检验所《质量手册》作业指导书版本号:
执行日期:2005年12月01日
标题检验记录书写范例
共88页第18页
第1版第0次修订
于仪器的样品光路中,扣除用同法制成的空白溴化钾片的背景,录制光谱图。
(红外吸收图谱附后见页)
结果:供试品红外光吸收图谱与《药品红外光谱集》1990年版醋酸泼尼松对照图谱(光谱号549)一致, 符合规定。
2.3【检查】
2.3.1 含氟量:记录氟对照溶液的浓度,供试品的称量(平行试验2份),供试品溶液的制备,对照溶液与供试溶液的吸光度,计算结果。
例:
含氟量:检验日期:2005.08.08 t:28℃
按《中国药典》2005年版二部(附录ⅧE)方法检验
仪器型号:AE-240型电子天平(№008)
UVIKON XL型双光束扫描紫外/可见分光光度计(№。
降压物质检查原始记录xh
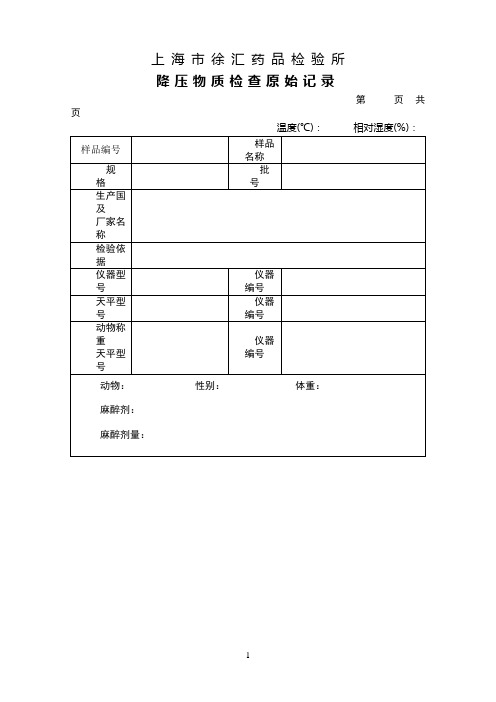
磷酸组胺对照品灵敏度试验:
基础血压: 走纸速度:
样品降压物质检查:
标准规定
结 论
□(均)符合规定 □(均)不符合规定
检验者: 校对者: 审核者:
日 期: 日 期: 日 期:
上海市徐汇药品检验所
降压物质检查原始记录
第 页 共 页
温度(℃): 相对湿度(%):
样品编号
样品名称
规 格
批 号
生产国及厂家名称检验 Nhomakorabea据仪器型号
仪器编号
天平型号
仪器编号
动物称重
天平型号
仪器编号
动物: 性别: 体重:
麻醉剂:
麻醉剂量:
溶液制备
麻醉剂:
抗凝剂:
磷酸组胺对照品:批号: 来源:
样品溶液制备:
药物检验原始记录的格式大全

一、化学鉴别法药品检验原始记录检品名称:检验日期:批号:规格:【鉴别】/结果:□呈正反应□不呈正反应结论:□符合规定□不符合规定检验者: 复核者: 第页二、TLC鉴别法药品检验原始记录检品名称:检验日期:批号:规格:[鉴别]供试品溶液的制备:对照品(或对照药材、对照提取物)溶液的制备:对照物质来源:□均为中国药品生物制品检定所提供□其他:No:薄层色谱条件与结果详见附图()。
结论:□符合规定□不符合规定(规定:在供试品色谱中,在与对照品(或对照药材、对照提取物)色谱相应位置上,显相同颜色的斑点。
)检验者: 复核者: 第页三、TLC图薄层色谱检验记录图号:检品名称:检品编号: 检验日期:天气:室温:湿度:薄层板:展开温度:展开剂:显色剂及检视方法:点样量( l):点样顺序: 1 2结论:检验者: 复核者: 第页四、 相对密度药品检验原始记录检品名称: 检品编号: 检验日期: 规格: 批号 室温: 湿度: 相对密度(比重瓶法)照相对密度测定法(中国药典2010年版A V I AV II 二部附录一部附录)测定。
测定方法: □比重瓶法 □韦氏比重称法 (规定测定温度为20℃)。
天平: 实验温度: 空瓶重(W 1): 瓶+供试品重(W 2): 供试品重(W 2-W 1): 瓶+水重(W 3): 水重(W 3-W 1):结果计算:计算公式:相对密度 = 水重量供试品重量结论: (规定 ) 检验者: 复核者: 第 页五、PH值测定法药品检验原始记录检品名称:检品编号: 检验日期:批号:规格:温度:湿度:pH值照pH值测定法(《中国药典》2010年版一部附录VII G)测定。
仪器:校正仪器用标准缓冲液:邻苯二甲酸氢钾标准缓冲液(pH4.00)磷酸盐标准缓冲液(pH6.86)其它:供试品溶液的制备:pH值测定结果:结论:□符合规定□不符合规定(规定: ) 检验者: 复核者: 第页六、重量差异检查之一药品检验原始记录检品名称:检验日期:批号:规格:重量差异按《中国药典》2010年版一部附录I D片剂项下检查法取供试品20片,分别精密称定每片的重量。
设备试验原始记录表格-高压 可直接使用!
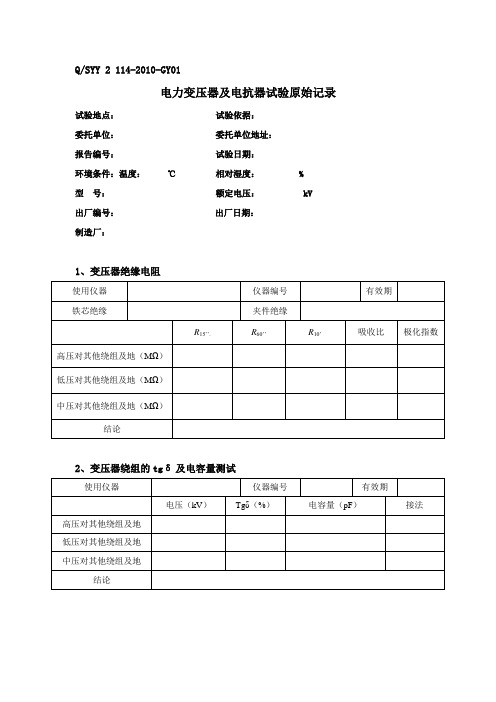
Q/SYY 2 114-2010-GY01电力变压器及电抗器试验原始记录试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: %型号:额定电压: kV出厂编号:出厂日期:制造厂:1、变压器绝缘电阻2、变压器绕组的tgδ及电容量测试4、变压器接线组别检查7、变压器空载损耗、短路损耗8、工频耐压试验9、变压器感应耐压10、变压器感应耐压带局部放电试验11、变压器绕组变形试验负责人:试验人员:记录人员:审核:Q/SYY 2 114-2010-GY02电压互感器试验原始记录一、电磁式电压互感器绝缘试验试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: % 型号:额定电压: kV 出厂编号:出厂日期:制造厂:1、绝缘电阻试验(MΩ)2、变比检查试验试验负责人:试验人员:记录人员:审核:二、电容式电压互感器绝缘试验试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: % 型号:额定电压:kV 出厂编号:出厂日期:制造厂:3、电容量及介质损耗测试试验负责人:试验人员:记录人员:审核:Q/SYY 2 114-2010--GY03电流互感器试验原始记录试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: % 型号:额定电压:kV 出厂编号:出厂日期:制造厂:1、绝缘绕组(MΩ)2、变比、极性检查3、介质损耗与电容量测试4、交流耐压试验试验负责人:试验人员:记录人员:审核:Q/SYY 2 114-2010-GY04断路器试验原始记录试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: % 型号:额定电压:kV 出厂编号:出厂日期:制造厂:1、辅助和控制回路绝缘电阻与交流耐压(MΩ)2、断口及对地绝缘电阻试验3、导电回路电阻(μΩ)4、机械特性(ms)5、断口并联电容器的电容量和介质损耗角正切6、最低动作电压(V)7、断路器交流耐压试验负责人:试验人员:记录人员:审核:Q/SYY 2 114-2010-GY05隔离开关试验原始记录试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: % 型号:额定电压:kV 出厂编号:出厂日期:制造厂:1、辅助和控制回路绝缘电阻与交流耐压(MΩ)2、主回路绝缘电阻(MΩ)3、导电回路电阻(μΩ)4、交流耐压试验负责人:试验人员:记录人员:审核:Q/SYY 2 114-201-GY06电力电缆试验原始记录试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: % 型号:额定电压:kV 出厂编号:出厂日期:制造厂:1、绝缘电阻( MΩ)2、导体电阻(mΩ)3、主绝缘交流耐压试验4、外护层直流耐压试验负责人:试验人员:记录人员:审核:套管试验原始记录试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: % 型号:额定电压:kV 出厂编号:出厂日期:制造厂:1、绝缘电阻测量(MΩ)2、介质损耗及电容量测试试验负责人:试验人员:记录人员:审核:无间隙金属氧化物避雷器试验原始记录试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: %型号:额定电压:kV出厂编号:系统运行电压:出厂日期:制造厂:1、绝缘电阻和直流试验2、底座绝缘电阻(MΩ)3、运行电压下阻性电流测量4、放电计数器检查试验负责人:试验人员:记录人员:审核:耦合电容器试验原始记录试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: %型号:额定电压:kV出厂编号:出厂日期:制造厂:1、绝缘电阻测量(MΩ)2、电容量及介质损耗测试试验负责人:试验人员:记录人员:审核:接地装置接地电阻试验原始记录试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: %地网对角线D的长度:接地电阻测量结果:电压极位置pl - p2x距离(km)U0(V)U1(V)I1(A)U2(V)I2(A)阻值(试验负责人:试验人员:记录人员:审核:绝缘子测试原始记录试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: % 型号:额定电压:kV 出厂日期:制造厂:1、绝缘子等值盐密2、绝缘电阻测量(MΩ)3、耐压试验试验负责人:试验人员:记录人员:审核:Q/SYY 2 114-2010-GY12发电机试验原始记录试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: % 型号:额定电压:kV 出厂编号:出厂日期:制造厂:1、定子绕组的绝缘电阻、吸收比或极化指数(MΩ)2 、定子绕组直流电阻测量(mΩ)3、定子绕组直流耐压试验及泄漏电流测量(μA)4、转子绕组绝缘电阻测量(MΩ)5、转子绕组直流电阻测量(mΩ)6、转子绕组交流阻抗测量7、轴电压试验负责人:试验人员:记录人员:审核:Q/SYY 2 114-2010-GY13绝缘操作杆试验原始记录检测/验地点:高压试验大厅报告编号:共页第页委托单位:检测/验日期:有效期:环境条件:温度:℃相对湿度: % 海拔高度: m检测/验主要依据标准:检测/验仪器设备:共页第页检测/验结论:检测/验人员:校核人员:共页第页检测/验结论:检测/验人员:校核人员:Q/SYY 2 114-2010-GY14带电作业用绝缘绳索试验原始记录检测/验地点:高压试验大厅报告编号:共页第页委托单位:检测/验日期:有效期:环境条件:温度:℃相对湿度: % 海拔高度: m检测/验主要依据标准:检测/验仪器设备:带电作业用绝缘绳索工频耐压试验记录共页第页检测/验结论:检测/验人员:校核人员:带电作业用绝缘绳索冲击试验记录共页第页检测/验结论:检测/验人员:校核人员:Q/SYY 2 114-2010-GY15带电作业硬梯试验原始记录检测/验地点:高压试验大厅报告编号:共页第页委托单位:检测/验日期:有效期:环境条件:温度:℃相对湿度: % 海拔高度: m检测/验主要依据标准:带电作业硬梯耐压试验记录共页第页检测/验结论:检测/验人员:校核人员:Q/SYY 2 114-2010-GY16高压试验设备送检原始记录送检单位送检单位地址报告/证书编号被检测设备名称型号编号等级制造厂测量范围 . 标准设备名称型号编号 . 等级标准测量范围 . 标准证书号有效期 . 温度湿度检测/校准依据检测/校准地点检定结论 . 检测/校准人员检测/校准核验员检测/校准日期 .Q/SYY 2 114-2010-GY17高压现场试验通用原始记录试验地点:试验依据:委托单位:委托单位地址:报告编号:试验日期:环境条件:温度:℃相对湿度: % 型号:额定电压:kV 出厂编号:出厂日期:制造厂:试验负责人:试验人员:记录人员:审核:。
血压测量记录表
血压测量记录表
测量日期时间高压低压是否正常是否服药备注早上 是 否 是 否
中午 是 否 是 否
晚上 是 否 是 否
早上 是 否 是 否
中午 是 否 是 否
晚上 是 否 是 否
早上 是 否 是 否
中午 是 否 是 否
晚上 是 否 是 否
早上 是 否 是 否
中午 是 否 是 否
晚上 是 否 是 否
早上 是 否 是 否
中午 是 否 是 否
晚上 是 否 是 否
早上 是 否 是 否
中午 是 否 是 否
晚上 是 否 是 否
早上 是 否 是 否
中午 是 否 是 否
晚上 是 否 是 否
早上 是 否 是 否
中午 是 否 是 否
晚上 是 否 是 否
早上 是 否 是 否
中午 是 否 是 否
晚上 是 否 是 否
早上 是 否 是 否
中午 是 否 是 否
晚上 是 否 是 否。
压力表检定原始记录

文件名称压力表检定原始记录
文件编号SB-JL-002版本号2013-05 制定人制定日期制定部门质量保证部部门审核人审核日期颁发部门质量保证部QA审核人审核日期颁发日期
批准人批准日期生效日期
分发部门质量保证部
复制份数复制号
发放人发放部门
接收人接收部门
主要内容:
仪表编号、仪表名称、测量范围、制造厂、检定温度、出厂编号、允许误差、级别、分度值、外观检查、参考的检定规程、标准压力、被校表轻敲后的示值、轻敲指针变动量、回程误差
标准规定:
1.环境温度:(20±5)℃
2.环境湿度:不大于85%
3.允许误差=±量程×级别%,轻敲后的示值误差、回程误差应小于允许误差,轻敲
指针变动量应小于允许误差的1/2。
变更历史
序号文件名称文件编号版本号
1 压力表检定记录SB-JL-00
2 2008-01
2 压力表检定记录SB-JL-002 2011-02
3 压力表校准记录SB-JL-002 2011-03
4 压力表检定(或校准)原始记录SB-JL-002 2013-04
压力表检定原始记录
证书编号:
送检单位
仪器名称型号规格结论
生产厂家器具编号准确度等级
检定地点环境温度℃相对湿度%RH 检定日期检定人员核验员
检定依据:JJG52-1999《弹簧管式一般压力表、压力真空表和真空表检定规程》
外观检查指针平稳性分度值允许误差
单位:
标准值
被检表轻敲后的示值轻敲指针变动量
回程误差升压降压升压降压
备注:。
药品降压物质检查

药品降压物质检查目的:讨论药品降压物质检查。
方法:判定供试品中所含降压物质的限度是否符合规定。
结论:如dT所致的反应值均不大于ds所致反应值的一半,即认为供试品的降压物质检查符合规定。
标签:药品降压物质检查本法系比较组胺对照品(S)与供试品(T)引起麻醉猫(或狗)血压下降的程度,以判定供试品中所含降压物质的限度是否符合规定。
1.仪器与材料1.1仪器用具1.1.1分析天平、动物天平、血压记录装置(记录仪或其他装置)。
1.1.2注射器(1ml,精度0.0lml)、吸管、移液管、容量瓶、安瓿、测量尺、三通开关、脱脂棉等实验用具。
1.1.3手术台、剪毛剪、手术剪、眼科镊、止血镊、手术刀、气管插管、动静脉夹及插管等手术用具。
1.2溶液配制1.2.1 10%苯巴比妥钠溶液:称量苯巴比妥钠适量,加水配成10%溶液(必要时加热溶解)。
1.2.2 5%戊巴比妥钠溶液:称量戊巴比妥钠适量,加水配成5%溶液(必要时加热溶解)。
1.2.3 0.9%氯化钠溶液:称量氯化钠适量,加水配成0.9%溶液。
1.2.4 肝素钠溶液:称量肝素钠适量,乘以每毫克标示效价单位,得肝素总单位数,加生理盐水配成1000μm/ml溶液。
1.2.5 对照品溶液:取放置至室温的磷酸组胺对照品,精密称量磷酸组胺适量,将称量的毫克数乘以0.362,即换算出组胺的实际质量。
按组胺的实际质量加水,将组胺溶解配成1.0 mg/ml的对照品溶液,分装于安瓿中,熔封,置4~8℃保存。
如无沉淀析出。
可在3个月内使用。
实验当日,取出对照品溶液,放置至室温,精密称量对照品溶液适量,用生理盐水配成0.5μ/ml的稀释液。
1.2.6 供试品溶液:按《中国药典》正文规定的剂量,配成适当浓度的供试品溶液。
实验时,一般要求供试品溶液与对照品稀释液的注入体积相等。
2.实验动物健康无伤、体重2kg以上的猫,或体重5kg以上的狗,雌雄均可,雌者无孕。
3.检定法将动物称重,用适宜的麻醉剂腹腔注射麻醉动物。
血压记录表

2020年8月2日
2020年8月3日
服药前 血压心率 151/101
124/92;78 133/101;74 140/99;75 135/110;79 124/99;83 130/97;79 134/97;81 132/94;72 131/98;76 133/94;79 141/99;72 128/94;73 148/112;68 123/99;76 135/96;71
2020年6月24日 6:50
2020年6月25日 7:28
2020年6月26日 8:39
2020年6月27日 7:11
2020年6月28日 7:02
2020年6月29日 7:10
2020年6月30日 7:09
2020年7月1日 6:54
2020年7月2日 6:43
2020年7月3日 7:21
2020年7月4日 7:13
141/103;77 129/97;75
132/98;72
131/95;75
时间 8:30 8:59 7:33 9:42 15:04
8:50 9:21 15:17 11:14 9:02 8:58 8:53
8:30 10:00 9:16 10:58
9:26
7:52
8:06
血压心率 135/95;86 129/95;80 141/99;76 135/92;82 133/95;87
2020年7月5日 7:54
2020年7月6日 6:57
2020年7月7日 7:33
2020年7月8日
2020年7月9日
2020年7月10日
2020年7月11日
2020年7月12日
2020年7月13日 7:00
2020年7月14日 6:45
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
上海市药品检验所
降压物质检查原始记录
第页共页
温度(℃):相对湿度(%):样品编号样品名称
规格批号
生产国及
厂家名称
检验依据
仪器型号仪器编号
天平型号仪器编号
动物称重
仪器编号
天平型号
动物:性别:体重:
麻醉剂:
麻醉剂量:
溶液制备麻醉剂:
抗凝剂:
磷酸组胺对照品:批号:来源:样品溶液制备:
实验结果磷酸组胺对照品灵敏度试验:
基础血压:走纸速度:样品降压物质检查:
标准规定
结论□ (均)符合规定□ (均)不符合规定
检验者:校对者:审核者:日期:日期:日期:。
