细菌生长曲线
细菌生长曲线的测定的实验步骤
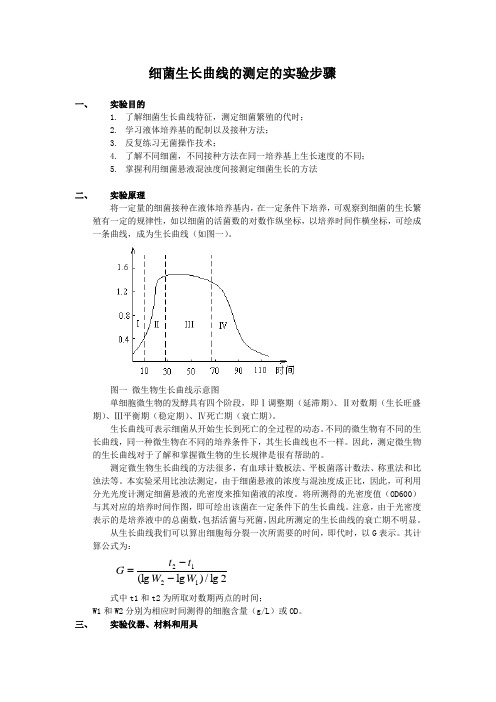
细菌生长曲线的测定的实验步骤一、实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1.实验材料:大肠杆菌,枯草杆菌菌液及平板;2.培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃ 200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基, 37 ℃ 200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 110rpm取1.0ml大肠杆菌接种到100ml培养基, 30 ℃ 200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 30 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。
第六章 微生物的生长 一、名词解释 01. 细菌生长曲线(growth curve

第六章微生物的生长一、名词解释01.细菌生长曲线(growth curve):当细菌在适宜的环境条件下培养时,如果以培养的时间为横座标,以细菌数量变化为纵坐标,根据细菌数量变化与相应时间变化之间的关系,作出一条反应细菌在培养期间菌数变化规律的曲线,这种曲线称为生长曲线。
02.菌落形成单位(colony forming unit, cfu):通过浇注或涂布等方法使菌样的微生物单细胞分散在平板上(内),待培养后,每一个活细胞就形成一个单菌落,即为菌落形成单位。
03.比生长速率(specific growth rate):单位数量的细菌或物质在单位时间(h)内的增加量。
04.同步培养(synchronous culture):是一种培养方法,它能使群体中的所有细胞变成处于同时进行生长和分裂的群体细胞。
05.连续培养(continuous culture):是在微生物的整个培养时间内,通过一定的方式使微生物能以恒定的比生长速率生长并能持续下去的一种培养方式。
06.连续发酵(continuous fermentation):连续培养如果应用于生产实践上,就称为连续发酵。
07.分批培养:将微生物置于一定容积的培养基中,经过培养生长,最后一次收获,此称为分批培养。
08.二元培养:是纯培养的一种特殊形式。
根据寄生微生物的生活特点,必须将寄生微生物和寄主微生物培养在一起,同时排除其它杂菌。
例如培养苏云金杆菌及其噬菌体,需先在平板培养基上培养细菌,然后在菌苔上接种其噬菌体,经培养后,出现噬菌体感染的透明空斑,这种培养方法称为二元培养。
09.高密度培养(high cell-density culture, HCDC):有时也称高密度发酵,一般指微生物在液体培养中细胞群体密度超过了常规培养10倍以上时的生长状态或培养技术。
10.致死时间(thermal death time, TDT):是指在特定的条件和特定的温度下(如60℃),杀死某微生物水悬乳液群体所需要的最短时间。
微生物生长曲线细菌生长曲线的区别

微生物生长曲线细菌生长曲线的区别微生物生长曲线是描述微生物在特定时间内生长数量变化的一种图形表示方法。
它是微生物学研究中非常重要的概念,可以帮助我们更深入地了解微生物的生长规律,帮助我们预测微生物在不同环境下的生长情况。
在微生物学中,我们常常会听到微生物生长曲线这个概念,但是不同类型的微生物可能具有不同的生长规律,因此我们也常常会听到细菌生长曲线的概念。
那么微生物生长曲线和细菌生长曲线有什么区别呢?接下来,我们将从深度和广度两个方面来探讨这个问题。
深度方面来看,微生物生长曲线是一个更加宏观和综合的概念,它可以用来描述不仅仅是细菌,还可以用来描述真菌、古菌等各种微生物在不同环境下的生长规律。
微生物生长曲线一般分为四个阶段:潜伏期、指数期、对数期和平稳期。
在潜伏期,微生物适应环境、增殖准备;指数期是细胞增殖最为迅速的时期;对数期是细胞数量以对数倍增长的时期;平稳期是细胞数量维持在一个相对稳定的阶段。
而细菌生长曲线则是微生物生长曲线中的一种特殊情况,它更多地指代细菌在不同环境中的生长规律,通常也分为潜伏期、指数期、对数期和平稳期。
但需要注意的是,不同类型的细菌在不同环境中的生长曲线可能会有所不同,因此在研究细菌生长曲线时需要具体问题具体分析。
广度方面来看,微生物生长曲线涉及到的范围更加广泛,包含了各种不同类型的微生物在不同环境下的生长规律。
而细菌生长曲线则更偏向于研究细菌在不同环境下的生长规律,更具体、更细致。
在实际的微生物学研究中,我们常常会根据具体的研究对象和研究目的选择使用微生物生长曲线还是细菌生长曲线来进行研究,以更好地满足研究的需要。
总结来看,微生物生长曲线和细菌生长曲线在深度和广度上有一定的区别。
微生物生长曲线更宏观、更综合,适用于研究各种类型的微生物在不同环境下的生长规律;而细菌生长曲线则更具体、更针对性,适用于研究细菌在不同环境下的生长规律。
在实际研究中,需要根据具体问题和研究目的来选择使用哪种生长曲线进行研究,以更好地帮助我们深入理解微生物的生长规律。
细菌的生长曲线

|
INFO@
|
+12 34 567 890
|
LONG STREET 12345, CITY, COUNTRY
Company name
Company slogan here
5
迟缓期
迟缓期(lag phase):又叫调整 期。细菌接种至培养基后,对新 环境有一个短暂适应过程。此期 曲线平坦稳定,因为细菌繁殖极 少。迟缓期长短因素种、接种菌 量、菌龄以及营养物质等不同而 异,一般为1~4小时。此期中细 菌体积增大,代谢活跃,为细菌 的分裂增殖合成、储备充足的酶、 能量及中间代谢产物。
|
INFO@
|
+12 34 567 890
|
LONG STREET 12345, CITY, COUNTRY
Company name
Company slogan here
8
衰亡期
衰亡期(decline phase):随着稳定期发 展,细菌繁殖越来越慢, 死亡菌数明显增多。活菌 数与培养时间呈反比关系, 此期细菌变长肿胀或畸形 衰变,甚至菌体自溶,难 以辨认其形。生理代谢活 动趋于停滞。故陈旧培养 物上难以鉴别细菌。
|
INFO@
|
+12 34 567 890
|
LONG STREET 12345, CITY, COUNTRY
Company name
Company slogan here
4
细菌生长时期
.
迟缓期
对数期
稳定期
衰亡期
Company slogan here
Company name细菌的生长曲线汇报人:动科1401 袁霞
测定细菌生长曲线

实验七 测定细菌生长曲线一、实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1. 实验材料:大肠杆菌,枯草杆菌菌液及平板;2. 培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基,37 ℃200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃110rpm取1.0ml大肠杆菌接种到100ml培养基,30 ℃200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基,37 ℃200rpm取1.0ml枯草杆菌接种到100ml培养基,30 ℃200rpm取1.0ml枯草杆菌接种到100ml培养基,37 ℃110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。
细菌生长曲线

对数期的细胞生长, 红色表示直接的细 胞数量,蓝色表示 细胞的对数生长
作图法确定微生物代时 (Generation time)
用群体生长数据对处于对数 期的时间横坐标作图 群体数量加倍时间可以直接 从曲线上读出.
稳定期(Stationary Phase)
特征: 细胞总数达到最大,新增加的细胞数量和死亡的细胞数量平衡 细胞能量代谢和生物合成功能正常 细胞生长速率降低为零 有些细胞死亡,芽孢形成,合成代谢产物
生长曲线计算应用举例
某处于对数期的大肠杆菌培养物的细胞浓度为 100个/ml,经过400分钟培养,细胞的浓度增加 到10亿个/ml 求大肠杆菌的代时和繁殖代数 n=lgy-lgx/lg2=lg109-102/0.3010=23.1 代时G=17.3 结果:代时是17.3分钟,400分钟内繁殖了23.1代
根据微生物生长曲线, 如何判断杀菌、抑菌 和溶菌
思考题:
1பைடு நூலகம் 研究微生物生长曲线的意义
2. 对数期的细胞有何特点,在实际中的意义
3. 生长曲线中各时期的特点:
延滞期(Lag Phase)
现象:没有细胞的分裂繁殖及生长
实质:细胞内代谢活跃,进行DNA复制,蛋白质 及酶的合成,做好细胞分裂的准备 这个时期的长短与细胞的遗传特性和培养条件有关
对数生长期 (Exponential phase )
微生物的生长速率最大,并且是个常数
细菌生长曲线(growth curve)
1. 微生物群体生长 (Population Growth)
生长:微生物生长包括个体体积的增加及细胞数量 的增多 生长速率(Growth rate)是指单位时间内细胞数量或 质量增加的量 从一个细胞变成两个细胞的时间间隔称代时 (generation time)
细菌生长曲线

稳定期
• 该期的生长菌群总数处于平坦阶段,但细菌群体 活力变化较大。由于培养基中营养物质消耗、毒 性产物(有机酸、H2O2等)积累ph下降等不利 因素的影响,细菌繁殖速度渐趋下降,相对细菌 死亡数开始逐渐增加,此期细菌增殖数与死亡数 渐趋平衡。细菌形态、染色、生物活性可出现改 变,并产生相应的代谢产物如外毒素、内毒素、 抗生素、以及芽胞等。
调整期
• 细菌接种至培养基后,对新环境有一个短 暂适应过程(不适应者可因转种而死亡) 。此期曲线平坦稳定,因为细菌繁殖极少 。迟缓期长短因菌种、接种菌量、菌龄以 及营养物质等不同而异,一般为1~4小时
。
• • • •
该期的特点为: 1 生长速率常数为零 2 细菌形态变大或增长,许多杆菌可长成丝状 3 细菌内的RNA尤其是rRNA含量增高,原生质呈 嗜碱性 • 4 合成代谢十分活跃,核糖体、酶类和ATP的合成 加速,易产生各种诱导酶 • 5 对外界不良条件如NaCl溶液浓度、温度和抗生素 等理、化因素反应敏感
细菌的生长特性
组长:苏冠 组员: 李建永 马少帅 李一平 张彭方 庞静 贺小玉 刘红艳 王玉红 高丽芳
细菌繁殖规律
• 细菌在一定的营养成分、适宜的温度和酸碱度、 有氧或无氧等环境中才能生长繁殖。细菌靠扩散 与吸附作用摄取营养,借助菌体酶系统分解营养 物质产生能量以维持生长。
生长曲线
• 细菌生长曲线是专指单细胞微生物的。它是将少 量的单细胞微生物接种到一定容积的液体培养基 后,在适宜的条件下培养,定时取样测定细胞数 量。以细胞增长数目的对数做纵坐标,以培养时 间做横坐标,绘制一条曲线,我们称这条曲线为 细菌的生长曲线。
微生物的生长曲线名词解释

微生物的生长曲线
微生物生长曲线是以微生物数量(活细菌个数或细菌重量)为纵坐标,培养时间为横坐标画得的曲线。
一般说,微生物(细菌)重量的变化比个数的变化更能在本质上反应出生长的过程。
微生物生长曲线可分为三个阶段即生长率上升阶段(对数生长阶段)、生长率下降阶段及内源呼吸阶段。
微生物在适宜的环境条件下,不断地吸收营养物质,并按照自己的代谢方式进行代谢活动,如果同化作用大于异化作用,则细胞质的量不断增加,体积得以加大,于是表现为生长。
简单地说,生长就是有机体的细胞组分与结构在量方面的增加。
微生物的生长曲线是微生物生态学和生物工程学等领域中非常重要的研究内容之一。
通过观察和分析微生物的生长曲线,可以了解微生物的生长特性、适应能力以及它们在不同生长条件下的表现。
这些信息对于研究和应用微生物具有重要的意义。
细菌生长曲线的测定的实验步骤

细菌生长曲线的测定的实验步骤一、实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1.实验材料:大肠杆菌,枯草杆菌菌液及平板;2.培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃ 200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基, 37 ℃ 200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃ 110rpm取1.0ml大肠杆菌接种到100ml培养基, 30 ℃ 200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 30 ℃ 200rpm取1.0ml枯草杆菌接种到100ml培养基, 37 ℃ 110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。
细菌生长曲线测定实验方法的研究

细菌生长曲线测定实验方法的研究一、本文概述细菌生长曲线测定实验方法的研究对于深入了解细菌的生长规律、生长环境、生长条件以及生长过程中的代谢变化等方面具有重要意义。
本文旨在探讨细菌生长曲线测定的实验方法,包括实验原理、实验步骤、实验条件的选择与优化等方面,以期为提高细菌生长曲线测定的准确性和可靠性提供理论支持和实践指导。
本文将介绍细菌生长曲线测定的基本原理,包括细菌生长曲线的定义、特点以及影响因素等。
在此基础上,本文将详细阐述细菌生长曲线测定的实验步骤,包括实验材料的准备、实验条件的设置、实验过程的操作以及实验结果的记录与分析等。
本文将重点讨论实验条件的选择与优化。
实验条件是影响细菌生长曲线测定结果的关键因素,包括培养基的成分、温度、pH值、接种量等。
本文将通过对比实验和数据分析,探讨不同实验条件对细菌生长曲线的影响,从而确定最佳的实验条件组合。
本文将总结细菌生长曲线测定实验方法的优缺点,并提出改进意见和建议。
通过本文的研究,将为细菌生长曲线测定的实验方法提供更为准确、可靠的理论支持和实践指导,有助于推动细菌学研究的深入发展。
二、细菌生长曲线的理论基础细菌生长曲线测定实验方法的理论基础主要源自微生物生长动力学。
微生物生长动力学描述了微生物在特定环境下的生长规律,其中包括细菌生长曲线的形成机制。
细菌生长曲线是反映细菌群体生长状态的重要指标,通过对细菌生长曲线的分析,可以了解细菌生长的不同阶段,以及影响细菌生长的各种因素。
细菌生长曲线通常可分为四个主要阶段:延迟期、对数生长期、稳定期和衰亡期。
在延迟期,细菌适应新的生长环境,进行必要的代谢准备,此阶段细菌数量增长缓慢。
进入对数生长期后,细菌以指数方式迅速增长,这是细菌生长最为旺盛的阶段。
稳定期时,由于营养物质的消耗和代谢产物的积累,细菌增长速率逐渐减缓,细菌数量趋于稳定。
进入衰亡期,细菌由于营养物质的耗尽和代谢产物的毒性作用,生长速率急剧下降,细菌大量死亡。
细菌的典型生长曲线

细菌的典型生长曲线1. 引言细菌是一类微生物,其数量庞大且广泛分布于地球上的各个环境中。
细菌的生长对于人类和环境具有重要影响,因此了解细菌的典型生长曲线对于研究微生物学和应用领域具有重要意义。
本文将介绍细菌的典型生长曲线,包括不同阶段的特征、影响因素以及应用。
2. 细菌的典型生长曲线概述细菌的典型生长曲线通常可以分为四个阶段:潜伏期、指数期、平台期和死亡期。
这些阶段反映了细菌在特定条件下的数量变化。
2.1 潜伏期在潜伏期,细菌适应新环境并准备进行繁殖。
在这个阶段,细菌数量相对稳定,并且没有明显增加或减少。
这是由于细胞进行代谢调整和适应新环境所需时间。
2.2 指数期指数期是细菌最快速增殖的阶段。
在这个阶段,细菌数量呈指数增长,也被称为对数增长。
细菌在此期间以最快的速度进行分裂和繁殖,每个细菌细胞通过二分裂产生两个新的细胞。
2.3 平台期平台期是指当细菌数量达到一定水平后,其增殖速率减缓并趋于稳定的阶段。
在这个阶段,细菌数量保持相对稳定,并且新生细菌数量与死亡细菌数量之间达到平衡。
2.4 死亡期死亡期是指当环境条件恶化或资源耗尽时,细菌数量开始减少的阶段。
在这个阶段,死亡速率超过了新生产生的速率,导致总体上细菌数量下降。
3. 影响细菌生长曲线的因素3.1 温度温度是影响细菌生长曲线的主要因素之一。
不同类型的细菌对于温度有着不同的适应范围和最适生长温度。
通常来说,较低温度下会延缓细菌繁殖速率,而较高温度下会加速细菌繁殖速率。
3.2 pH值pH值是指环境的酸碱度,也是影响细菌生长曲线的重要因素。
不同类型的细菌对于pH值有着不同的适应范围和最适生长pH值。
极端酸性或碱性条件下会抑制细菌生长。
3.3 营养物质营养物质是细菌繁殖所需的重要资源。
不同类型的细菌对于营养物质有着不同的需求。
营养物质的浓度和可用性会直接影响细菌生长曲线。
3.4 氧气浓度氧气浓度对于许多细菌而言也是一个重要因素。
有些细菌需要氧气进行呼吸作用,被称为需氧菌;而另一些则不能在氧气存在下进行繁殖,被称为厌氧菌。
最新测定细菌生长曲线

实验七 测定细菌生长曲线一、实验目的1. 了解细菌生长曲线特征,测定细菌繁殖的代时;2. 学习液体培养基的配制以及接种方法;3. 反复练习无菌操作技术;4. 了解不同细菌,不同接种方法在同一培养基上生长速度的不同;5. 掌握利用细菌悬液混浊度间接测定细菌生长的方法二、 实验原理将一定量的细菌接种在液体培养基内,在一定条件下培养,可观察到细菌的生长繁殖有一定的规律性,如以细菌的活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,成为生长曲线(如图一)。
图一 微生物生长曲线示意图单细胞微生物的发酵具有四个阶段,即Ⅰ调整期(延滞期)、Ⅱ对数期(生长旺盛期)、Ⅲ平衡期(稳定期)、Ⅳ死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程的动态。
不同的微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的。
测定微生物生长曲线的方法很多,有血球计数板法、平板菌落计数法、称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与混浊度成正比,因此,可利用分光光度计测定细菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(OD600)与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测定的生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G 表示。
其计算公式为:2lg /)lg (lg 1212W W t t G --=式中t1和t2为所取对数期两点的时间;W1和W2分别为相应时间测得的细胞含量(g/L )或OD 。
三、 实验仪器、材料和用具1. 实验材料:大肠杆菌,枯草杆菌菌液及平板;2. 培养基:牛肉膏蛋白胨葡萄糖培养基3.实验仪器:取液器(5000ul, 1000ul 各一支);培养箱, 摇床,722s分光光度计;4.实验用具:无菌1000ul吸头80个;无菌5000ul吸头2个;比色皿9个+共用参比杯一个.四、实验步骤1.准备菌种:将细菌接种到牛肉膏蛋白胨葡萄糖三角瓶培养基中,37℃振荡培养18h,另外准备单菌落平板各1块2.分为三个小组:第(1)小组取1.0ml大肠杆菌菌液接种到100ml培养基, 37 ℃200rpm取3.0ml大肠杆菌菌液接种到100ml培养基,37 ℃200rpm取5.0ml大肠杆菌菌液接种到100ml培养基,37 ℃200rpm第(2)小组取一个大肠杆菌菌落接种到100ml培养基,37 ℃200rpm取1.0ml大肠杆菌菌液接种到100ml培养基,37 ℃110rpm取1.0ml大肠杆菌接种到100ml培养基,30 ℃200rpm第(3)小组取1.0ml枯草杆菌接种到100ml培养基,37 ℃200rpm取1.0ml枯草杆菌接种到100ml培养基,30 ℃200rpm取1.0ml枯草杆菌接种到100ml培养基,37 ℃110rpm每培养一小时取样一次(2.5h,3.5h加测1次). 对照组测量起始pH,所有瓶子测量发酵9h结束测pH.3.测量:选用600nm波长,以蒸馏水作为参比,开始培养前测定每组培养液的OD值作为起始点。
细菌生长曲线的测定实验报告

细菌生长曲线的测定实验报告竭诚为您提供优质文档/双击可除细菌生长曲线的测定实验报告篇一:细菌生长曲线实验九测定细菌生长曲线[实验目的]1.了解细菌生长曲线特征:2.学习液体培养基的配制以及注意事项。
3.学习液体种子和固体种子的不同接种方法和注意事项。
4.利用细菌悬液浑浊度间接测定细菌生长。
[仪器和材料]1.实验材料(1)大肠杆曲,枯草杆曲培养液及大肠杆菌平板。
(2)牛肉膏蛋门胨葡萄糖培养基(150ml/250ml三角瓶x4瓶/大组),配方:牛肉膏5g,蛋白胨10g,nacl5g,葡萄糖10g,加水至1000ml,ph7.5。
2.实验仪器取液器(5000μl,1000μl,200tμl各一支);培养箱.摇床,722s 分光光度汁;1000μl无菌吸头100个;5000μl 无菌吸头2(:细菌生长曲线的测定实验报告)个;1ml或4ml玻璃或塑料比色皿4个,共用参比杯一个。
[实验原理]将一定量的细菌接种在液体培养基内.在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,称为生长曲线(图91)。
单细胞微生物发酵具有4个阶段,即调整(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的.测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与浑浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(测oD550或oD620或oD600或oD420,可任选一波长)与对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测生长曲线的衰亡期不明显。
细菌生长曲线的测定

细菌生长曲线的测定1 目的1.1 了解细菌生长曲线特点及测定原理1.2 学习用比浊法测定细菌的生长曲线2 原理将少量细菌接种到一定体积的、适合的新鲜培养基中,在适宜的条件下进行培养,定时测定培养液中的菌量,以菌量的对数作纵坐标,生长时间作横坐标,绘制的曲线叫生长曲线。
它反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。
依据其生长速率的不同,一般可把生长曲线分为延缓期、对数期、稳定期和衰亡期。
这四个时期的长短因菌种的遗传性、接种量和培养条件的不同而有所改变。
因此通过测定微生物的生长曲线,可了解各菌的生长规律,对于科研和生产都具有重要的指导意义。
测定微生物的数量有多种不同的方法,可根据要求和实验室条件选用。
本实验采用比浊法测定,由于细菌悬液的浓度与光密度(OD值)成正比,因此可利用分光光度计测定菌悬液的光密度来推知菌液的浓度,并将所测的OD值与其对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线,此法快捷、简便。
3 材料3.1菌种大肠杆菌3.2培养基肉膏蛋白胨培养基3.3 仪器和器具721分光光度计,比色杯,恒温摇床,无菌吸管,试管,三角瓶。
4 流程种子液→标记→接种→培养→测定5 方法5.1种子液制备取大肠杆菌斜面菌种1支,以无菌操作挑取1环菌苔,接入肉膏蛋白胨培养液中,静止培养18h作种子培养液。
5.2标记编号取盛有50mL无菌肉膏蛋白胨培养液的250mL三角瓶11个,分别编号为0、1.5、3、4、6、8、10、12、14、16、20h。
5.3接种培养用2mL无菌吸管分别准确吸取2mL种子液加入已编号的11个三角瓶中,于37℃下振荡培养。
然后分别按对应时间将三角瓶取出,立即放冰箱中贮存,待培养结束时一同测定OD 值。
5.4生长量测定将未接种的肉膏蛋白胨培养基倾倒入比色杯中,选用600nm波长分光光度计上调节零点,作为空白对照,并对不同时间培养液从0h起依次进行测定,对浓度大的菌悬液用未接种的牛肉膏蛋白胨液体培养基适当稀释后测定,使其OD值在0.10.~0.65以内,经稀释后测得的OD值要乘以稀释倍数,才是培养液实际的OD值。
细菌生长曲线

三、稳定期(stationary phase) 又称恒定期或最高生长期。处于稳定期的微生物, 新增殖的细胞数与老细胞的死亡数几乎相等,整个培养 物中二者处于动态平衡,此时的生长速度又逐渐趋向零。
特 点: 1.培养物中细胞总数最高。如果为了获得大量菌体就 应在此阶段收获。
(一) 抗代谢物(antimetabolites)
在结构上与生物体所必需的代谢产物很相似 ,以至 可以和特定的酶结合,从而阻碍了酶的功能 , 干扰了 代谢的正常进行,这些物质称为抗代谢物。磺胺类药 物 是最常用的化学治疗剂,它可抑制大多数革兰氏阳 性细菌和某些革兰氏阴性细菌的生长繁殖,能治疗多 种疾病。
连续培养(continuous cultivation)是指在一个恒 定容积的流动系统中培养微生物,一方面以一定速率 不断地加入新的培养基,另一方面又以相同的速率流 出培养物(菌体和代谢产物),以使培养系统中的细 胞数量和营养状态保持恒定,即处于稳态。 连续培养可分为:恒浊连续培养和恒化连续培养。
(二)电离辐射
X射线、α射线、β射线和 γ射线均为电离辐射。 电离辐射的杀菌作用主要是间接地通过射线本身引起 环境中水分子和细胞中水分子在吸收能量后导致电离 所产生的自由基起作用,如H20-、OH.、OH-等,上述离 子常与液体内存在的氧分子作用,产生一些具强氧化 性的过氧化物,如H2O2与HO2等使细胞内某些重要的蛋 白质和酶发生变化,如使酶蛋白的-SH基氧化,从而使 细胞受到损伤或死亡。
离心沉降分离法
处于同一生长阶段的同步细胞,其体积和质量大致相等, 处于不同生理阶段的细胞,体积和质量大小不等,子细胞与成 熟细胞大小差别较大,通过离心沉降,易于分开。然后用相同 大小的细胞进行培养便可获得同步培养物。
细菌生长曲线

2.细胞内开始积累储藏物,如肝糖、异染颗粒、脂肪 粒等。
3.大量积累代谢产物,如放线菌发酵形成大量抗生素。 在生产上可通过补料,调节pH与温度等措施,延长稳 定期,以积累更多的代谢产物。 4.大多数芽孢细菌在此阶段形成芽孢。
四、衰亡期(decline phase) 细菌死亡率逐渐增加,以致死亡数大大超过新生数, 群体中活细菌的数目急剧下降,出现“负生长”,此阶 段叫衰亡期,又称死亡期。
同步生长能否无限的维持下去?
由于同步群体内细胞个体之间的差异,同步生长 不能无限的维持,往往会逐渐破坏,最多能维持 2~3 个世代后,群体内的各个细胞个体就会因为生长周期 的代时差异而处于不同的生长阶段,出现非同步生长。
细菌的同步生长与非同步生长
第四节 环境因素对微生物生长的影响
微生物的生长受到它们所处环境理化因素的极大影 响。了解环境因素对微生物生长的影响,有助于说明微 生物在自然界的分布,还可帮助我们采用相应的方法控 制微生物的活动。
特点: 1.死亡期中有一段时间, 活菌数按几何级数下降, 称 为“对数死亡阶段”。
2.菌体细胞产生或释放出一些产物。如氨基酸、转化 酶、抗生素等。 3.菌体细胞有的开始自溶,有的呈现多种形态,有的 产生畸形,细胞大小悬殊,有的细胞内多液泡,有的 细胞革兰氏反应阳性变成阴性反应等。
第二节 连续培养
温 度
温度是影响微生物生长的一个重要因子。 每种微生物都有3种基本温度。 最低生长温度:低于这个温度以下不再生长。 最适生长温度:在此温度时生长速度最快。 最高生长温度:在此温度以上不可能生长。
微生物按其生长温度范围可分为三类: 低温微生物、中温微生物、高温微生物。
微生物的三种类型(温度)
低温的应用?
干 燥
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验九测定细菌生长曲线
[实验目的] 1.了解细菌生长曲线特征:2.学习液体培养基的配制以及注意事项。
3.学习液体种子和固体种子的不同接种方法和注意事项。
4.利用细菌悬液浑浊度间接测定细菌生长。
[仪器和材料]
1.实验材料
(1)大肠杆曲,枯草杆曲培养液及大肠杆菌平板。
(2)牛肉膏蛋门胨葡萄糖培养基(150ml/250ml 三角瓶X 4瓶/大组),配方:牛肉膏5g,蛋白胨10g,NaCl 5g,葡萄糖10g,加水至1000ml,pH7.5。
2.实验仪器
取液器(5000μl,1000μl,200tμl 各一支);培养箱.摇床,722s分光光度汁;1000μl 无菌吸头100个;5000μl 无菌吸头2个;1ml或4ml玻璃或塑料比色皿4个,共用参比杯一个。
[实验原理]
将一定量的细菌接种在液体培养基内.在一定的条件下培养,可观察到细菌的生长繁殖有一定规律性,如以细菌活菌数的对数作纵坐标,以培养时间作横坐标,可绘成一条曲线,称为生长曲线(图9 1)。
单细胞微生物发酵具有4个阶段,即调整(迟滞期)、对数期(生长旺盛期)、平衡期(稳定期)、死亡期(衰亡期)。
生长曲线可表示细菌从开始生长到死亡的全过程动态。
不同微生物有不同的生长曲线,同一种微生物在不同的培养条件下,其生长曲线也不一样。
因此,测定微生物的生长曲线对于了解和掌握微生物的生长规律是很有帮助的.
测定微生物生长曲线的方法很多,有血细胞计数法,平板菌落计数法,称重法和比浊法等。
本实验采用比浊法测定,由于细菌悬液的浓度与浑浊度成正比,因此,可以利用分光光度计测定菌悬液的光密度来推知菌液的浓度。
将所测得的光密度值(测OD550或OD620或OD600或OD420,可任选一波长)与对应的培养时间作图,即可绘出该菌在一定条件下的生长曲线。
注意,由于光密度表示的是培养液中的总菌数,包括活菌与死菌,因此所测生长曲线的衰亡期不明显。
从生长曲线我们可以算出细胞每分裂一次所需要的时间,即代时,以G表示。
其计算公式为;
G=(t2-t1)/[(1gW1—lgW2)/lg2]
式中tl和t2为所取对数期两点的时间;w1和w2分别为相应时间测得的细胞含量(g/L)或OD。
[实验步骤]
1.准备菌种:将大肠杆菌,枯草杆菌分别接种到装有牛肉膏蛋白胨葡萄糖培养基的三角瓶中,37℃,200r/min振荡培养14-18h.另外准备大肠杆菌单菌落平板l块(37'C培养24h)。
2.接种:分别将1.5ml(1%接种量)和4-5ml(3%接种量)大肠杆菌菌液和一个大肠杆菌单菌落接人含150ml培养液的三角瓶中.37℃,200r/min振荡培养;把4.5ml枯草杆菌(3%接种量)接入含150ml培养液的三角瓶中,37℃,200r/min振荡培养。
3.测量;每培养1h取样一次.净培养(不包括取样时间)10h结束培养,测量培养液pH值。
零小时也要测。
如果选用4ml比色皿取500μl培养液到2000μl蒸馏水中(稀释5倍),以蒸馏水为对照,测OD650。
或OD620或OD600或OD420任选一波长),如果选用lml比色皿,可以取1000μl培养液,以蒸馏水为对照,直接测OD620 、OD600或OD420(任选一波长),当OD值大于0.6时,下一样品要稀释1倍测量.
[实验结果].
B.subtilis 3% 61.72; E.coli (plate) 35.61 。
②液体种子比较均匀,用相同的液体培养基转接后条件变化小,因此迟缓期几乎没有出现;实验结果代时长于理论值,主要是实验条件的影响,培养基、接种量、培养容器、温度条件等均影响到理论值。
[试验讨论]
(1)
全班同时取样,时间以教室挂钟为准,取样时间越短越好,要求在10~15min 内完成),同时开始振荡,取样期间假定细菌暂停生长.取样时间从发酵总时间中扣除.
(2)为减少误差,须固定参比杯,不要旋动波长旋钮;每组固定同一台分光光度计,固定同一取液器 E.coli/B.subtilis 生长曲线比较00.20.40.60.811.21.41.61.81234567891011时间(h)O D (600n m )。
