十二烷基硫酸钠2010年版药典 检验标准
2010版药典内容

乙基纤维素Yiji XianweisuEtbylcellulose本品为乙基醚纤维素。
按干燥品计算,含乙氧基(—OC2H5)应为44.0%~51.0%。
【性状】本品为白色颗粒或粉末:无臭,无味。
本品5%悬浮液对石蕊试纸呈中性。
本品在甲苯或乙醚中易溶,在水中不溶。
【鉴别】取本品5g,加乙醇-甲苯(1:4)溶液100ml,振摇,溶液为透明的微黄色溶液,取上述溶液适量,倾注在玻璃板上,俟溶液蒸发后,形成一层有韧性的膜,该膜可以燃烧。
【检查】黏度精密称取本品2.5g(按干燥品计),置具塞锥形瓶中,精密加乙醇-甲苯(1:4)溶液50ml,振摇至完全溶解,静置8~10小时,调节温度至20℃±0.1℃,测定动力黏度(附录ⅥG第一法),标示黏度大于或等于10mPa·s者,黏度应为标示黏度的90.0%~110.0%,标示黏度在6~l0mPa·s之间者,黏度应为标示黏度的80.0%~120.0%,标示黏度小于或等于6mPa·s者,黏度应为标示黏度的75.0%~140.0%。
干燥失重取本品,在105℃干燥2小时,减失重量不得过3.0%(附录ⅧL)。
炽灼残渣取本品1.0g,依法检查(附录ⅧN),遗圈残渣不得过0.4%。
重金属取炽灼残渣项下遗留的残渣,依法检查(附录ⅧH第二法),含重金属不得过百万分之二十。
砷盐取本品0.67g,加氢氧化钙1.0g,混合,加水搅拌均匀,干燥后,先用小火灼烧使炭化,再在500~600℃炽灼使完全灰化,放冷,加盐酸8ml与水23ml,依法检查(附录ⅧJ第一法),应符合规定(0.0003%)。
【含量测定】乙氯基照甲氧基、乙氧基与羟丙氧基测定法(附录ⅦF)测定。
如采用第二法(容量法),取本品适量(相当于乙氧基10mg),精密称定,将油液温度控制在150~160℃,加热时间延长到1~2小时,其余同法操作。
每1ml硫代硫酸钠滴定液(0.1mol/L)相当于0.7510mg的乙氧基。
2010药典第3增补本

一部修订附录ⅨT 甲醇量检查法ⅨU 二氧化硫残留量测定法ⅨQ 农药残留量测定法XVIII J-中药材DNA条形码分子鉴定法指导原则-新增二部修订附录附录I A 片剂(增订口崩片)附录Ⅱ药用辅料附录Ⅵ G 黏度测定法附录Ⅸ B 澄清度检查法附录Ⅹ A 崩解时限检查法(增订口崩片检查法)附录ⅩK 锥入度测定法附录ⅩⅨ F 药品杂质分析指导原则二部新增附录附录ⅩⅨR 药用辅料性能指标研究指导原则附录ⅩⅧ J中药材DNA条形码分子鉴定法指导原则1本法用于中药材(包括药材及部分药材饮片)及基原物种的鉴定。
DNA条形码分子鉴定法是利用基因组中一段公认的、相对较短的DNA序列来进行物种鉴定的一种分子生物学技术,是传统形态鉴别方法的有效补充。
由于不同物种的DNA序列是由腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)、胸腺嘧啶(T)四种碱基以不同顺序排列组成,因此对一定长度的DNA序列进行分析即能够区分不同物种。
中药材DNA条形码分子鉴定是以核糖体DNA第二内部转录间隔区(ITS2)注1为主体条形码序列鉴定中药材的方法体系,其中植物类中药材选用ITS2为主体序列,以叶绿体psbA-trnH 注2为辅助序列,动物类中药材采用细胞色素c氧化酶亚基I(COI)注3为主体序列,ITS2为辅助序列。
一、仪器的一般要求所用仪器有电子天平、离心机、聚合酶链式反应(Polymerase Chain Reaction,PCR)仪、电泳仪和测序仪。
DNA序列测定用测序仪,是一台具有自动灌胶、自动进样、自动数据收集分析等全自动电脑控制的测定DNA片段中碱基顺序或大小,以及定量用精密仪器。
测序方法主要采用双脱氧链终止法,又称Sanger法,传统Sanger法采用同位素标记,目前常用的自动测序仪是基于毛细管电泳和荧光标记技术的DNA测序仪,从而大大提高了DNA测序的速度和准确性。
4种双脱氧核苷酸(ddNTP)的碱基分别用不同的荧光进行标记,在通过毛细管时,不同长度的DNA片段上的4种荧光基团被激光激发,发出不同颜色的荧光,被电荷藕合元件图像传感器(charge-coupled device,CCD)检测系统识别,并直接翻译成DNA序列,获得供试品的峰图文件和序列文件。
中国药典2010年版--化学鉴别

特点:1.仅适用于鉴别药物的真伪. 2.它是对已知物的确证试验。 3.鉴别试验是个别分析,而不是系统分析。 4.对药物制剂进行鉴别时,要注意消除制剂中 辅料的干扰。 5.对原料药还要检查其外观及其它物理常数, 如:熔点,比旋度,吸收系数,酸值,碘值, 皂化值等。
化学鉴别只பைடு நூலகம்药物鉴别试验的方法之
※有机药物大都采用典
型的官能团反应
如三氯化铁呈色反应、 茚三酮反应、众氮化-偶 合显色反应等。
茚三酮反应:具有此反应的药物,一
般在其化学结构中都含有脂肪氨基结 构。 如: α-氨基酸、多肽、蛋白质与茚三酮试 液反应生成蓝紫色、红紫色或紫色。
氨基糖苷类抗生素因具有α-氨基苷结
构,可与茚三酮缩合成蓝紫色化合物。
维生素C与硝酸银的反应:维生素C分子中含 有二烯醇基结构,具有很强的还原性,可被 硝酸银氧化生成银的黑色沉淀。 方法:取本品0.2g,加水10ml溶解,取该液 5ml,加硝酸银试液0.5ml,生成银的黑色沉 淀。
与重金属Pb2+、Cu2+等离子的反应
硫酸阿托品的水溶液,加醋酸铅试液,生成 白色沉淀,但沉淀在醋酸或氢氧化钠试液中 溶解。
钠的火焰试验反应灵敏度高最低能检出量约为01ng的钠离子若由于试药和所用仪器引入微量钠盐时均能出现鲜黄色火焰故应在测试前将铂丝烧红趁热浸入盐酸中如此反复处理直至火焰不现黄色再蘸取试样进行试验
化学鉴别
药物的鉴别试验:根据药物的分 子结构、理化性质,采用化学、 物理化学或生物学的方法来判 断药物真伪的试验方法。
磺胺甲噁唑与硫酸铜成盐的鉴别试验: 取本品约0.1g,加水与0.4 %氢氧化钠溶液各3ml , 振摇使溶解,滤过,取滤液加硫酸铜试液 1滴, 即生成草绿色沉淀。注意NaOH溶液不可过量。
十二烷基硫酸钠毛细管凝胶电泳法(CE-SDS法)标准操作规程SOP

颁发部门:质量保证部分发部门:分析研究部拷贝号:NO. /目录1目的 (4)2范围 (4)3定义 (4)4环境、健康和安全 (4)5培训 (4)6职责 (4)7程序(内容) (4)7.1原理 (4)7.2实验材料 (4)7.3操作步骤 (5)7.4结果分析 (9)7.5判定标准 (9)7.6注意事项 (9)8相关文件 (10)9参考文献 (10)10流程图 (10)11附录 (10)十二烷基硫酸钠毛细管凝胶电泳法(CE-SDS法)测定记录 (1)十二烷基硫酸钠毛细管凝胶电泳法(CE-SDS法)测定记录(适用于多个样品) (1)1目的规范十二烷基硫酸钠毛细管凝胶电泳法(CE-SDS法)检验的操作过程。
2范围本规程适用于常规十二烷基硫酸钠毛细管凝胶电泳检验,涉及到蛋白质纯度相关指标的测定。
3定义3.1CE-SDS:十二烷基硫酸钠毛细管凝胶电泳。
4环境、健康和安全还原电泳中使用的巯基乙醇为挥发性液体,具有较强烈的刺激性气味,会刺激眼睛、呼吸系统和皮肤,吞食有害,与皮肤接触有毒,取液时穿戴适当的防护服、手套和护目镜或面具。
如不慎与眼睛接触后,请立即用大量清水冲洗并征求医生意见。
该液体对水体环境能产生长期污染等不良影响,切勿倒入下水道,应倒入废液桶,由专业部门回收。
与空气混合、受热、明火可爆,如其燃烧可用二氧化碳、干粉类灭火剂。
储存库房应通风低温干燥,与氧化剂、食品分开储运。
5培训5.1培训部门:分析研究部。
5.2培训对象:分析研究部相关人员。
5.3培训方式和时数:自学,0.5小时。
5.4考核方式:问答。
6职责6.1质量保证部:负责监督本文件的执行。
6.2分析研究部:负责严格执行本规程规定。
7程序(内容)7.1原理该方法是指以弹性石英毛细管为分离管道,以高压直流电场为驱动力,通过目标蛋白在含有胶的溶液中的迁移速率不同而得到分离,较小分子量的分子迁移速度更快则其迁移时间短,较大分子的迁移速度慢则其迁移时间更长。
2020年药典十二烷基硫酸钠质量标准

1、目的:建立十二烷基硫酸钠质量标准2、范围:本标准适用于企业十二烷基硫酸钠质量管理。
3、责任:质量管理部4、程序4.1引用标准:《中国药典》2020年版四部。
5、本品为以十二烷基硫酸钠(C12H25NaO4S)为主的烷基硫酸钠混合物。
6、性状:本品为白色至谈黄色结晶或粉末;有特征性微臭。
本品在水中易溶,在乙醚中几乎不溶。
7、鉴别:7.1本品的水溶液(1→10)显钠盐的鉴别反应(通则0301)7.2本品的水溶液(1→10)加盐酸酸化,缓缓加热沸腾20分钟,溶液显硫酸盐的鉴别反应(通则0301).8、检查:8.1碱度:取本品1.0g,加水100ml溶解后,加酚红指示液2滴,用盐酸滴定液(0.1mol/L)滴定。
消耗盐酸滴定液(0.1mol/L)不得过0.5ml。
8.2氯化钠:取本品约5g,精密称定,加水50ml使溶解,加稀硝酸中和(调节PH 值至6.5-10.5),加铬酸钾指示液2ml,用硝酸银滴定液(0.1mol/L)滴定,每2ml硝酸银滴定液(0.1mol/L)相当于5.844mg的NaCI。
8.3硫酸钠:取本品约1g,精密称定,加水10ml溶解后,加乙醇100ml,加热至近沸2小时,趁热滤过,滤渣用煮沸的乙醇100ml洗涤后,再加水150ml溶解,并洗涤容器,水溶液加盐酸10ml加热至沸,加25%氯化钡溶液10ml,放置过夜,滤过,滤渣用水洗至不再显氯化物的反应,并在500-600℃炽灼至恒重,每1mg残渣相当于0.6086mg的Na2SO4。
氯化钠与硫酸钠的总量不得过8.0%。
8.4未酯化醇:取本品约10g,精密称定,加水100ml溶解后,加乙醇100ml,用正己烷提取3次,每次50ml,必要时加氯化钠以助分层,合并正己烷层,用水洗涤3次,每次50ml,再用不无水硫酸钠脱水,滤过,滤液在水浴上蒸干后,在105℃干燥30分钟,冷却,称量。
本品含未酯化醇不得过4.0%。
8.5重金属:取本品1.0g,依法检查(通则0821第二法),含重金属不得过百万分之二十。
中国药典2010年版三部_凡例试题及答案

中国药典2010年版三部_凡例试题及答案《中国药典》2010版三部凡例试题时间: 部门: 姓名: 分数: 分一、填空题(50分)1、《中华人民共和国药典》2010年版实行日期年月日。
2、任何违反GMP 或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其规定。
3、《中国药典》的英文名称为Pharmacopoeia of The People’s Republic of China;英文简称Chinese Pharmacopoeia;英文缩写为。
4、设施与生产质量管理应符合现行版中《》要求。
5、直接用于生产和检定生物制品的、、来自人和动物的细胞、DNA重组工程菌及工程细胞,均须经国务院药品监督管理部门批准。
6、生产用培养基不得含有可能引起人体的物质。
生产过程使用的过滤介质,应为无的介质。
7、抗生素的使用(1)除另有规定外,不得使用青霉素或其他类抗生素。
(2)成品中严禁使用抗生素作为。
(3)生产过程中,应尽可能避免使用抗生素,必须使用时,应选择安全性风险相对较低的抗生素,使用抗生素的种类不得超过种,且产品的后续工艺应保证可有效去除制品中的抗生素,去除工艺应经验证。
病毒性疫苗生产中应仅限于在细胞制备过程中使用抗生素。
(4)生产过程中使用抗生素时,成品检定中应检测抗生素残留量,并规定残留量。
8、生产及检定用动物a、用于制备注射用活疫苗的动物细胞应来源于 (SPF级)动物;用于制备口服疫苗和灭活疫苗的动物细胞应来自或以上动物。
所用动物应符合实验动物微生物学和寄生虫学检测要求(附录XIII B、XIII C)的相关规定)。
b、培养细胞用牛血清应来源于无牛海绵状脑病地区的,其质量应符合本版药典的有关规定。
c、消化细胞用的胰蛋白酶应证明无外源性或内源性污染。
d、用于制备鸡胚或鸡胚细胞的鸡蛋,除另有规定外,应来自的鸡群。
第 1 页共 10 页《中国药典》2010版三部凡例试题e、生产用马匹应符合“免疫血清生产用马匹检疫和免疫规程”要求。
十二烷基硫酸钠检验标准操作规程
题目:十二烷基硫酸钠检验标准操作规程
编码:SOP-QC-205-A
起草:
日期:
审核:
日期:
批准:
日期:
生效日期:
颁发部门:质控部
分发部门:检验室
变更记载修改号
批准日期执行日期
变更原因及目的
标准依据:《中国药典》2005版二部
目的:建立十二烷基硫酸钠检验操作规程。
范围:本规程适用于十二烷基硫酸钠的检验。
3.4未酯化醇
取本品约10g,精密称定,加水100ml溶解后,加乙醇100ml,用正已烷提取3次,每次50ml,必要时加氯化钠以助分层,合并正已烷层,用水洗涤3次,每次50ml,再用无水硫酸钠脱水,滤过,滤液在水浴上蒸干后,在105℃干燥30分钟,冷却,称重。本品含未酯化醇不得过4.0%为符合规定。
3.3硫酸钠
取本品约1g,精密称定,加水10ml溶解后,加乙醇100ml,加热至近沸2小时,趁热滤过,滤渣用煮沸的乙醇100ml洗涤后,再加水150ml溶解,并洗涤容器,水溶液加盐酸10ml加热至沸,加25%化钡溶液10ml,放置过夜,滤过,滤渣用水洗至不再显氯化物的反应,并在500~600℃炽灼至恒重,遗留残渣与氯化钠的总量不得过8.0%为符合规定。
3.[检查]
3.1碱度
取本品1.0g,加水100ml溶解后,加酚红指示液2滴,并用盐酸滴定液(0.1mol/L)滴定。消耗盐酸滴定液(0.1mol/L)不得过0.60ml为符合规定。
3.2氯化钠
取本品约5g,精密称定,加水50ml使溶解,加稀硝酸中和(调节PH值至6.5~10.5)加铬酸钾指示液2ml,用硝酸银滴定液(0.1mol/L)滴定。每1ml硝酸银滴定液(0.1mol/L)相当于5.844mg的NaCl。
GC与GC-MS测定十二烷基硫酸钠纯度与含量

GC/GC-MS测定十二烷基硫酸钠纯度与含量刘建祯1*,程奇蕾2,张启明2(1. 山西省药品检验所,太原030001;2. 中国药品生物制品检定所,北京100050)摘要目的:研究十二烷基硫酸钠的质量问题。
方法:采用HP-5(30 m×0.53 mm,1.50 μm)毛细管柱,以氮气为载气,FID检测,程序升温,直接进样,采用面积归一化法测定十二烷基硫酸钠水解产物十二烷醇的气相纯度,外标法以十二烷醇为对照品测定十二烷基硫酸钠的含量。
结果:十二烷醇在6.16 μg·mL-1~6.16 mg·mL-1的浓度范围内具有良好的线性关系,相关系数为0.9999。
不同企业的相同标示含量的产品纯度存在较大差异。
结论:本方法简便,结果准确,重现性好,可用于十二烷基硫酸钠气相纯度和含量的测定。
关键词:GC;GC-MS;十二烷基硫酸钠;毛细管柱;气相纯度;含量测定Quality control research of SDSLIU Jian-zhen1,2,CHENG Qi-lei1,HANG Tai-jun3,ZHANG Qi-ming1*(1 . National Institute for the Control of Pharmaceutical and Biological Products , Beijing 100050 , China;2 . Shanxi Institute for Drug Control , Taiyuan 030001 ,China;3.Department of Pharmaceutical Analysis,China Pharmaceutical University,Nanjing 210009,China)Abstract Objective:To research quality problem of SDS by capillary gas chromatography. Method:The capillary column was HP-5(30 m×0.53 mm,1.50 μm).The carrier gas was nitrogen and FID as detector,temperature programming and direct sample injection. To determine impurity of 1-Dodecanol which is hydrolysate of SDS by peak area normalization, to determine content of SDS by external standard method in which 1-Dodecanol is reference substance. Results:Under the above condition,there was good linear relationship in the concentration range of 6.16 μg·mL-1~6.16 mg·mL-1,r=0.9999. There were relatively great differences in impurity over products of different manufacturers which have same labeled content. Conclusion:The method is simple,accurate,reproducible and suitable for determination of GC impurity and content of SDS.Key words:gas chromatography;sodium lauryl sulfate;capillary column;GC impurity;assay 十二烷基硫酸钠(Sodium Dodecyl Sulfate.简写SDS),别名为月桂醇硫酸钠,是一种重要的阴离子表面活性剂。
十二烷基硫酸钠质量标准
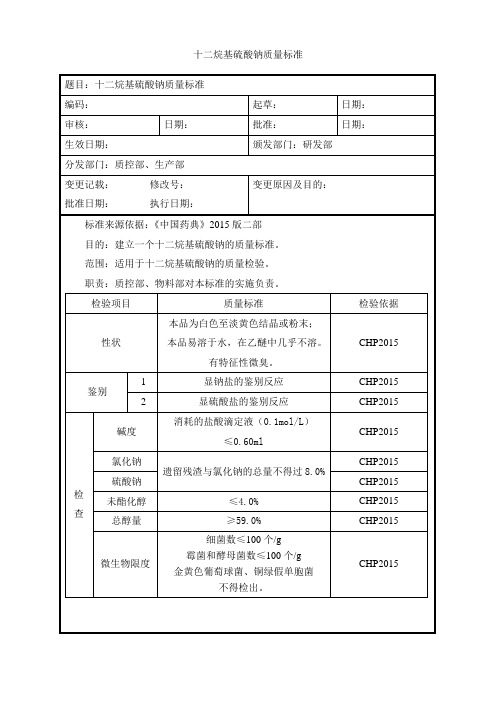
检验项目
质量标准
检验依据
性状
本品为白色至淡黄色结晶或粉末;
本品易溶于水,在乙醚中几乎不溶。
有特征性微臭。
CHP2015
鉴别
1
显钠盐的鉴别反应Biblioteka CHP20152显硫酸盐的鉴别反应
CHP2015
检查
碱度
消耗的盐酸滴定液(0.1mol/L)
≤0.60ml
CHP2015
氯化钠
遗留残渣与氯化钠的总量不得过8.0%
CHP2015
硫酸钠
CHP2015
未酯化醇
≤4.0%
CHP2015
总醇量
≥59.0%
CHP2015
微生物限度
细菌数≤100个/g
霉菌和酵母菌数≤100个/g
金黄色葡萄球菌、铜绿假单胞菌
不得检出。
CHP2015
十二烷基硫酸钠质量标准
题目:十二烷基硫酸钠质量标准
编码:
起草:
日期:
审核:
日期:
批准:
日期:
生效日期:
颁发部门:研发部
分发部门:质控部、生产部
变更记载:修改号:
批准日期:执行日期:
变更原因及目的:
标准来源依据:《中国药典》2015版二部
目的:建立一个十二烷基硫酸钠的质量标准。
范围:适用于十二烷基硫酸钠的质量检验。
中国药典(2010版)

4附录XIX C 原料药与药物制剂稳定性试验指导原则稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。
影响因素试验用1批原料药或1批制剂进行。
加速试验与长期试验要求用3批供试品进行。
(2)原料药供试品应是一定规模生产的,供试品量相当于制剂稳定性试验所要求的批量,原料合成工艺路线、方法、步骤应与大生产一致。
药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。
药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10000片,胶囊剂至少应为10000粒。
大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据情况另定。
(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的包装应与上市产品一致。
(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的3批规模生产的产品仍需进行加速试验与长期稳定性试验。
本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。
4.1一、原料药原料药要进行以下试验。
4.1.1(一)影响因素试验此项试验是在比加速试验更激烈的条件下进行。
其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。
供试品可以用1批原料药进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤1 0mm厚的薄层,进行以下试验。
中国药典2010年版第二增补本----酸枣仁

酸枣仁色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-O.05m o l/L磷酸二氢钾溶液(50:50) (每100m l中加十二烷基硫酸钠0.4g.再以磷酸调节p H值为4.0)为流动相;检测波长为345nm。
理论板数按盐酸小檗碱峰计算应不低于5000。
对照品溶液的制备取盐酸小檗碱对照品适置,精密称定,加甲醇制成每〗m l含90.5埤的溶液,即得。
供试品溶液的制备取本品粉末(过二号筛)约0.2g,精密称定,置具塞锥形瓶中,精密加人甲醇-盐酸(100:1)的混合溶液50m l,密塞,称定重量,超声处理(功率250W.频率40k H z)30分钟,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液2m l,置10m l量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
测定法分别精密吸取对照品溶液与供试品溶液各10M1,注人液相色谱仪,测定,以盐酸小檗碱对照品的峰面积为对照,分别计算小檗碱、表小檗碱、黄连碱和巴马汀的含量,用待测成分色谱峰与盐酸小檗碱色谱峰的相对保留时间确定。
表小檗喊、黄连碱、巴马汀、小檗碱的峰位,其相对保留时间应在规定值的±5%范围之内,即得。
相对保留时间见下表:待测成分(蜂)相对保留时间表小檗碱0. 71黄连碱0. 78巴马汀0. 91小檗碱 1. 00本品按干燥品计算.,以盐酸小檗碱(C^H u C l N C X)计,含小檗碱(C^H n N C U不得少于5.5%,表小檗碱(^。
叶7~04)不得少于0.80%,黄连碱((:1943:^04)不得少于1.6%,巴马汀(C21H21 N04)不得少于1.5%。
雅连按干燥品计算,以盐酸小檗碱(C^H uC lN O,)计,含小檗碱(Q。
H17 N04)不得少于4. 5%。
云连按干燥品计算,以盐酸小檗碱(C2Q H1B C1N(^)计,■含小檗碱(C2。
H17 NO, )_[i T i E]不得少于7. 0%。
十二烷基硫酸钠检验记录

MБайду номын сангаасVmlWmg
W=
M
结果:
(3)未酯化醇
取本品约10g,精密称定,加水100ml溶解后,加乙醇100ml,用正已烷提取3次,每次50ml,必要时加氯化钠以助分层,合并正已烷层,用水洗涤3次,每次50ml,再用无水硫酸钠脱水,滤过,滤液在水浴上蒸干后,在105℃干燥30分钟,冷却,称重。
辅料检验记录
检验人:复核人:
品名
十二烷基硫酸钠
检品编号
规格
批号
数量
厂牌来源
取样日期
年月日
检验日期
年月日
检验依据
《中国药典》2005版二部
检验目的
检验项目
检验内容
性状
外观
本品为。
结果:
鉴别
供试液的制备:。
(1)钠盐
1.取铂丝,用盐酸湿润后,蘸取上述供试品溶液,在无色火焰中燃烧,火焰显
。结果
2.取上述中性溶液,加醋酸氧铀锌试液,。
空蒸发皿恒重:第1次.第2次第3次
供试品重:加样干燥后重量
遗留残渣占=结果:
(4)总醇量
取本品约5g,精密称定,加水150ml溶解后,加盐酸50ml,小心加热回流4小时,冷却,溶液用乙醚提取2次,每次75ml,合并乙醚层,在水浴上蒸干后,在105℃干燥30分钟,冷却,称重。
空蒸发皿恒重:第1次.第2次第3次
检查
(2)氯化钠
取本品约5g,精密称定,加水50ml使溶解,加稀硝酸中和(调节PH值至6.5~10.5)加铬酸钾指示液2ml,用硝酸银滴定液(0.1mol/L)滴定。每1ml硝酸银滴定液(0.1mol/L)相当于5.844mg的NaCl。
十二烷基硫酸钠标准

十二烷基硫酸钠标准十二烷基硫酸钠(Sodium Dodecyl Sulfate,SDS)是一种常用的表面活性剂,广泛应用于化学、生物化学、生物医学等领域。
它是一种阴离子表面活性剂,具有良好的表面活性和乳化性能,能够在水溶液中形成稳定的泡沫。
在实验室中,十二烷基硫酸钠常被用作蛋白质电泳的离子型表面活性剂,也被用于细胞裂解和DNA提取等实验操作中。
此外,十二烷基硫酸钠还被广泛用于洗涤剂、沐浴露、洗发水等日常化学品中。
十二烷基硫酸钠的结构式为C12H25SO4Na,是一种白色结晶性粉末,在常温下易溶于水。
它是由十二烷基硫酸和氢氧化钠反应得到的,是一种离子型表面活性剂。
在水溶液中,十二烷基硫酸钠的分子结构呈现出亲水性和疏水性的特点,使其能够在水中形成胶束结构,从而具有良好的表面活性和乳化性能。
在生物化学实验中,十二烷基硫酸钠常被用作蛋白质电泳的离子型表面活性剂。
它能够使蛋白质样品获得负电荷,从而在电场中向阳极迁移,实现蛋白质的分离和检测。
此外,十二烷基硫酸钠还被用于细胞裂解和DNA提取等实验操作中,帮助研究人员获取目标蛋白质和核酸样品。
在日常化学品中,十二烷基硫酸钠也有着广泛的应用。
它常被用作洗涤剂、沐浴露、洗发水等清洁用品的成分之一。
由于其良好的表面活性和乳化性能,能够有效清洁油污和污垢,因此被广泛应用于日常生活中的清洁用品中。
总的来说,十二烷基硫酸钠作为一种常用的表面活性剂,在化学、生物化学、生物医学等领域都有着重要的应用价值。
它的良好表面活性和乳化性能,使其成为实验室中不可或缺的试剂之一,也为日常生活提供了便利和舒适。
希望未来能够有更多的研究能够发掘十二烷基硫酸钠的更多潜在应用价值,为人类的生活和科学研究带来更多的便利和进步。
十二烷基硫酸钠质量标准

取本品1.0g,置炽灼至恒重的坩埚中,精密称定,缓缓炽灼至完全炭化后,逐渐升高温度至600~700℃,使完全灰化并恒重,灰分不得超过0.3%。
取本品0.ቤተ መጻሕፍቲ ባይዱ0g,加稀盐酸4ml与水16ml,振摇5分钟,滤过,用少量水洗涤,合并滤液与洗液,加过硫酸铵50mg,用水稀释成35ml后,依法检查,与标准铁溶液1.0ml制成的对照液比较,不得更深(0.002%)。
(3)取本品,用甘油醋酸试液制片,在显微镜下观察,为原淀粉和残片的聚集体,外形失去淀粉粒原有的球形,表面为不规则的颗粒。
(4)取本品,在偏光显微镜下观察,其部分颗粒的偏光十字完全消失。
取本品10g,加中性乙醇10ml,摇匀,再加经煮沸放冷的水100ml,电磁搅拌5分钟,取上清液,依法测定,pH值应为4.5~7.0。
标题
汉语拼音名
英文名
分子式
性状
鉴别
检查
酸度
干燥失重
灰分
铁盐
二氧化硫
氧化物
类别
贮藏
标准依据
正文
Shier Wanji Liusuanna
C12H25NaO4S
本品为以十二烷基硫酸钠为主的烷基硫酸钠混合物。
本品为白色或
(1)取本品约1g,加水15ml,煮沸,放冷,即成半透明类白色的凝胶状物。
(2)取本品约0.1g,加水20ml,混匀,加碘试液数滴,即显蓝色或蓝黑色,加热后逐渐褪色,放冷,蓝色复现。
赋形剂。
在干燥处保存。
2000版中国药典二部。
取本品20g,置具塞锥形瓶中,加水200ml,充分振摇,滤过,取滤液100ml,加淀粉指示液2ml,用碘滴定液(0.01mol/L)滴定,消耗的碘滴定液不得过2.50ml(0.008%)。
《中国药典》2010年版附录部分内容

紫外-可见分光光度法 1、波长校正 增加了高氯酸钬溶液的校正(以10% 高氯酸为溶剂,配制含4%氧化钬的溶液) λmax nm:241.13,278.10,287.18,333.44, 345.47,361.31,416.28,451.30, 485.29,536.64,640.52nm。 2、波长允差 紫外区 ±1nm 500nm ±2nm 700nm ±4.8nm
通用检测方法和指导原则主要增修订内容
酸败度检查法 羰基值的原计算公式有误 A 羰基值= 854 ×W V ×1000 V 1、854的各种醛的2,4-二硝基苯腙的ε ,而不是mε 2、V1 供试品稀释总体积 V2 测定用供试品稀释液体积 S 25ml
2 1
5ml
25ml
3、修改为 125 ×A 羰基值= 854 ×W ×1000
⒋
直接接种法删除β-内酰胺类或磺氨类供 试品。
2010年版无菌检查法增修订内容
表1 、表2 、表3增修订
表1 (第3列)接种每种培养基改为所需的最少检验数量 表2 (表题)上市抽验样品(液体制剂)的最少检验数量修改 为液体制剂最少检验量及上市抽验样品的最少检验数量 第二列每支样品接入每管培养基的最少样品量修改为每支供 试品接入每管培养基的最少样品量 第三列最少检验数量(瓶或支)≤1 全量 20 ① 修改为供 试品最少检验数量(瓶或支) 10 ① 注① 每种培养基各接种10支供试品修改为若供试品每个容器 内的装量不够接种两种培养基,那么表中的最少检验数量加 倍。
通用检测方法和指导原则主要增修订内容 2、原子吸收与光焰光度法 无实质修改 3、等离子体质谱 修订附录 完善了原附录 增加了干扰与校正,样品溶液的制备以及 测定方法中增加了标准加入法等段落。 本法是重金属测定中最灵敏的一个方法(10-12~10-15) 4、等离子体发射光谱 新增附录 本法灵敏(10-9~10-12)、准确、线性范围宽、元素覆盖 范围宽、可实现多种元素同时测定。 5、离子色谱 新增附录 可实施金属的形态与价态分析 6、原子荧光 未收载 与ICP-MS和ICP-AES比 差 与AA比相仿
十二烷基硫酸钠 化学试剂标准

十二烷基硫酸钠化学试剂标准十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)是一种常用的化学试剂标准,被广泛应用于生物化学、分子生物学和生物医学研究中。
它是一种阴离子表面活性剂,常用于裂解细胞膜蛋白,提取蛋白质,以及进行电泳实验。
本文将从深度和广度方面对SDS进行全面评估,并撰写一篇有价值的文章,以帮助您更全面地了解这一化学试剂标准。
一、SDS的物理性质SDS是一种白色结晶粉末,在常温下易溶于水,并具有良好的表面活性。
其分子式为C12H25NaO4S,化学结构中含有十二烷基链和硫酸根团,这使得它在生物化学实验中起到了重要的作用。
二、SDS在蛋白质电泳中的应用在蛋白质电泳中,SDS作为变性剂可以使蛋白质失去生物活性,同时使其带负电荷,从而使蛋白质在电场中运动时呈现出线性的电荷质量比。
这种特性使得蛋白质在电泳实验中可以被准确地分离和检测。
三、SDS在蛋白质提取中的作用在蛋白质提取过程中,SDS可以破坏细胞膜,使细胞内的蛋白质得以释放出来,为后续的实验操作提供了便利。
SDS的表面活性也有助于蛋白质的溶解和稳定,保证实验结果的准确性和可靠性。
四、SDS的安全性及注意事项尽管SDS在生物化学实验中有着重要的应用,但其毒性也不可忽视。
在使用过程中,需严格遵守实验室安全操作规程,避免与皮肤和眼睛接触,并保证在通风良好的环境下操作。
五、个人观点与总结作为一种常用的化学试剂标准,SDS在蛋白质研究领域发挥了重要作用,帮助科研人员更准确地进行实验操作。
然而,我认为在使用过程中也需要高度重视其安全性,并严格按照操作规程进行操作,以避免意外发生。
SDS作为一种化学试剂标准,为生物化学和分子生物学领域的研究提供了重要的支持和帮助。
在本文中,我们深入探讨了SDS的物理性质、在蛋白质电泳和蛋白质提取中的应用,以及其安全性及注意事项。
通过对这一化学试剂标准的全面评估,相信您对SDS有了更深入的了解。
希望本文能够帮助您在生物化学研究中更加灵活、深刻地运用SDS,为科研工作提供更多可能性。
2010版中国药典标准变更情况--辅料部分
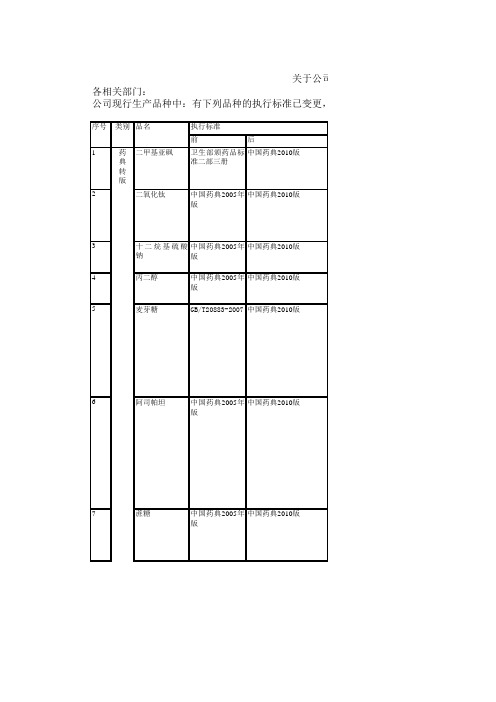
前后1二甲基亚砜卫生部颁药品标准二部三册中国药典2010版2二氧化钛中国药典2005年版中国药典2010版3十二烷基硫酸钠中国药典2005年版中国药典2010版4丙二醇中国药典2005年版中国药典2010版5麦芽糖GB/T20883-2007中国药典2010版6阿司帕坦中国药典2005年版中国药典2010版7蔗糖中国药典2005年版中国药典2010版药典转版关于公司生各相关部门:公司现行生产品种中:有下列品种的执行标准已变更,各品种的生产工艺、检验参照执行,同序号类别品名执行标准8磷酸二氢钾GB1274-93中国药典2010版9磷酸氢二钠YY0237-1996中国药典2010版10磷酸氢二钾中国生物制品主中国药典2010版要原辅材料质控标准2000年版11乙醇中国药典2005年中国药典2010版版12硫代硫酸钠中国药典2005年中国药典2010版版13聚维酮K30中国药典2005年中国药典2010版版公司生产品种部分标准变更情况的通知标准已变更,各品种的生产工艺、检验参照执行,同时各包装标签进行相应修订:变更情况前1、【性状】凝点不得低于18.2℃2、【鉴别】化学3、【检查】光吸收、水分、二甲基砜1、【检查】1、【鉴别】化学(2);2、【检查】1、【鉴别】IR;2、【检查】1、【性状】2、【鉴别】3、【检查】4、【含量测定】1、【性状】比旋度2、【含量测定】取本品约0.3g,精密称定,加甲醇3ml与冰醋酸50ml,溶解后,加结晶紫指示液2滴,立即用高氯酸滴定液(0.1mol/l)滴定至溶液显蓝色,并将滴定液的结果用空白实验校正。
每1ml高氯酸滴定液(0.1mol/l)相当于29.43mg的C14H18N2O51、【性状】比旋度不得少于+66°2、【鉴别】化学/化学3、【检查】溶液的颜色 …..与黄色6号标准比色液比较不得更深1、【性状】本品为无色结晶。
2、【鉴别】3、【检查】溶液澄清度,氯化物0.05%、硫酸盐0.05%、水中不溶物0.005%、干燥失重0.3%、铁盐0.05%、重金属50ppm、砷20ppm4、【含量测定】称取5g于105±2℃干燥至恒重的试样,精确至0.0001g,溶于100ml无二氧化碳的水中,用校正过的酸度计,以玻璃电极为指示电极,饱和甘汞电极为参比电极,用氢氧化钠滴定溶液(1mol/l)滴定至PH9.1为终点。
十二烷基硫酸钠质量标准
XXXXXXXXX有限公司
一、目的:建立十二烷基硫酸钠质量标准,确保所用十二烷基硫酸钠的质量。
二、范围:本规定适用于十二烷基硫酸钠质量控制。
三、责任:
四、内容:
1.标准来源:《中国药典》2015年版四部
2.技术要求
十二烷基硫酸钠质量标准版本号:
3.贮存条件:密闭保存。
4.相关标准操作规程:十二烷基硫酸钠检验标准操作规程(SOP-ZL-JG(FL)-035)、物料取样标准操作规程(SOP-ZL-QA-001)。
5.企业统一指定的物料名称:与《中国药典》2015年版四部一致
6.内部使用的物料代码:1102018。
7.经批准的供应商:见合格供应商目录。
8.印刷包装材料的实样或样稿:无此项内容。
9.注意事项:密闭。
10.有效期:按厂家规定执行。
11.文件附件:共0份。
12.修订及变更历史:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
十二烷基硫酸钠
Shier Wanji Liusuanna
Sodium Lauryl Sulfate
[151-21-3] 本品为以十二烷基硫酸钠( C12H25NaO4S)为主的烷硫酸钠混合物。
【性状】本品为白色至淡黄色结晶或粉末;有特征性微臭。
本品在水中易溶,在乙醚中几乎不溶。
【鉴别】(1)本品的水溶液(1→10)显钠盐的鉴别反应(附录Ⅲ)。
(2)本品的水溶液(1→10)加盐酸酸化,缓缓加热沸腾20分钟,溶液显硫酸盐的鉴别反应(附录Ⅲ).
【检查】碱度取本品1.0g,加水100ml溶解后,加酚红指示液2滴,用盐酸滴定液(0.1mol/L)滴定。
消耗盐酸滴定液(0.1 mol/L)不得过0.60ml。
氯化钠取本品约5g,精密称定,加水50ml使溶解,加稀硝酸中和(调节pH值至6.5~10.5),加铬酸钾指示液2ml,用硝酸银滴定液(0.1mol/L)滴定。
每1ml硝酸银滴定液(0.1mol/L)相当于5.844mg 的NaCl。
硫酸钠取本品约1g,精密称定,加水10ml溶解后,加乙醇100ml,加热至近沸2小时,趁热滤过,滤渣用煮沸的乙醇100ml洗涤后,再加水150ml溶解,并洗涤容器,水溶液加盐酸10ml加热至沸,加25%氯化钡溶液10ml,放置过夜,滤过,滤渣用水洗至不再
显氯化物的反应,并在500~600℃炽灼至恒重,遗留残渣与氯化钠的总量不得过8.0%。
未酯化醇取本品约10g,精密称定,加水100ml溶解后,加乙醇100ml,用正己烷提取3次,每次50ml,必要时加氯化钠以助分层,合并正己烷层,用水洗涤3次,每次50ml,再用无水硫酸钠脱水,滤过,滤液在水浴上蒸干后,在105℃干燥30分钟,放冷,称重。
本品含未酯化醇不得过4.0%。
重金属取本品1.0g,依法检查(附录ⅧH第二法),含重金属不得过百万分之二十。
总醇量取本品约5g,精密称定,加水150ml溶解后,加盐酸50ml,缓缓加热回流4小时,放冷,溶液用乙醚提取2次,每次75ml,合并乙醚层,在水浴上蒸干后,在105℃干燥30分钟,放冷,称量。
本品含总醇量不得少于59.0%。
【类别】药用辅料,湿润剂和乳化剂等.
【贮藏】密封保存。
