北京市中考化学总复习:化学反应方程式
北京初中化学方程式全面复习大全

北京初中化学方程式大全化合反应1、镁在空气中燃烧:2Mg+O22MgO2、铁在氧气中燃烧:3Fe+2O2 Fe3O43、铝在空气中燃烧:4Al+3O2 2Al2O34、氢气在空气中燃烧:2H2+O2 2H2O5、红磷在空气中燃烧:4P+5O2 2P2O56、硫粉在空气中燃烧:S+O2SO27、碳在氧气中充分燃烧:C+O2 CO28、碳在氧气中不充分燃烧:2C+O22CO9、二氧化碳通过灼热碳层:C+CO2 2CO10、一氧化碳在氧气中燃烧:2CO+O2 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O==H2CO312、生石灰溶于水:CaO+H2O==Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl22NaCl分解反应15、实验室用双氧水制氧气:2H2O22H2O+O2↑16、加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O2H2↑+O2↑18、碳酸不稳定而分解:H2CO3==H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3CaO+CO2↑置换反应20、铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4==ZnSO4+H2↑22、镁和稀盐酸反应:Mg+2HCl==MgCl2+H2↑23、氢气还原氧化铜:H2+CuO Cu+H2O24、木炭还原氧化铜:C+2CuO 2Cu+CO2↑25、水蒸气通过灼热碳层:H2O+C H2+CO26、焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑其他27.氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO428、甲烷在空气中燃烧:CH4+2O2CO2+2H2O29、酒精在空气中燃烧:C2H5OH+3O22CO2+3H2O30、一氧化碳还原氧化铜:CO+CuO Cu+CO231、一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO232、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O33、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO2==Na2CO3+H2O34、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl==CaCl2+H2O+CO2↑35、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+2HCl==2NaCl+H2O+CO2↑一.物质与氧气的反应:⑴单质与氧气的反应:1. 镁在空气中燃烧:2Mg+O22MgO2. 铁在氧气中燃烧:3Fe+2O2 Fe3O43. 铜在空气中受热:2Cu+O22CuO4. 铝在空气中燃烧:4Al+3O2 2Al2O35. 氢气中空气中燃烧:2H2+O2 2H2O6. 红磷在空气中燃烧:4P+5O22P2O57. 硫粉在空气中燃烧:S+O2 SO28. 碳在氧气中充分燃烧:C+O2 CO29. 碳在氧气中不充分燃烧:2C+O2 2CO⑵化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2 2CO211. 甲烷在空气中燃烧:CH4+2O2 CO2+2H2O12. 酒精在空气中燃烧:C2H5OH+3O2 2CO2+3H2O 二.几个分解反应:13. 水在直流电的作用下分解:2H2O2H2↑+O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 2CuO+H2O+CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO32KCl+3O2↑16. 加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑17. 碳酸不稳定而分解:H2CO3==H2O+CO2↑18. 高温煅烧石灰石:CaCO3CaO+CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+CuO Cu+H2O20. 木炭还原氧化铜:C+2CuO2Cu+CO2↑21. 焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑22. 焦炭还原四氧化三铁:2C+Fe3O43Fe+2CO2↑23. 一氧化碳还原氧化铜:CO+CuO Cu+CO224. 一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO225. 一氧化碳还原四氧化三铁:4CO+Fe3O4 3Fe+4CO2 四.单质、氧化物、酸、碱、盐的相互关系⑴金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸Zn+H2SO4==ZnSO4+H2↑27. 铁和稀硫酸Fe+H2SO4==FeSO4+H2↑28. 镁和稀硫酸Mg+H2SO4==MgSO4+H2↑29. 铝和稀硫酸2Al+3H2SO4==Al2(SO4)3+3H2↑30. 锌和稀盐酸Zn+2HCl==ZnCl2+H2↑31. 铁和稀盐酸Fe+2HCl==FeCl2+H2↑32. 镁和稀盐酸Mg+2HCl==MgCl2+H2↑33. 铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑⑵金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu35. 锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu36. 铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg⑶碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O38. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O39. 氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O40. 氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O41. 氧化镁和稀硫酸反应:MgO+H2SO4==MgSO4+H2O42. 氧化钙和稀盐酸反应:CaO+2HCl==CaCl2+H2O⑷酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O 45.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O 46.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O47. 消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O⑸酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O49. 盐酸和氢氧化钾反应:HCl+KOH==KCl+H2O50.盐酸和氢氧化铜反应:2HCl+Cu(OH)2==CuCl2+2H2O51. 盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl2+2H2O52. 盐酸和氢氧化铁反应:3HCl+Fe(OH)3==FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl3+3H2O54.硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4+2KOH==K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2==CuSO4+2H2O57.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==Fe2(SO4)3+ 6H2O58.硝酸和烧碱反应:HNO3+NaOH==NaNO3+H2O⑹酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸反应: Na2CO3+2HCl==2NaCl+H2O+CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3+2HCl==MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+AgNO3==AgCl↓+HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl⑺碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 66.氢氧化钠与氯化铁:3NaOH+FeCl3==Fe(OH)3↓+3NaCl 67.氢氧化钠与氯化镁:2NaOH+MgCl2==Mg(OH)2↓+2NaCl68. 氢氧化钠与氯化铜:2NaOH+CuCl2==Cu(OH)2↓+2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH⑻盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO3 71.硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓+2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+H2O==H2CO373.生石灰溶于水:CaO+H2O==Ca(OH)274.氧化钠溶于水:Na2O+H2O==2NaOH75.三氧化硫溶于水:SO3+H2O==H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O CuSO4+5H2O77.无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O化学方程式反应现象应用2Mg+O2 2MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O22HgO银白液体、生成红色固体拉瓦锡实验2Cu+O22CuO红色金属变为黑色固体4Al+3O22Al2O3银白金属变为白色固体3Fe+2O2 Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热C+O2 CO2剧烈燃烧、白光、放热、使石灰水变浑浊S+O2SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 2H2O淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2 2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2 2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3 2KCl+3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgO2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO32CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3 NH3↑+H2O+CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4==ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4==FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4==MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4==Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H22Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H23Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2W+3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2Mo+3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2 2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl22HCl 苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C+O2 2CO煤炉中常见反应、空气污染物之一、煤气中毒原因2CO+O2 2CO2蓝色火焰煤气燃烧C+CuO 2Cu+CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C4Fe+3CO2↑冶炼金属Fe3O4+2C 3Fe+2CO2↑冶炼金属C+CO22COCO2+H2O==H2CO3碳酸使石蕊变红证明碳酸的酸性H2CO3 CO2↑+H2O石蕊红色褪去Ca(OH)2+CO2==CaCO3↓+H2O澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2==Ca(HCO3)2白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2CaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3Na2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 CaO+CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl==CaCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4==Na2SO4+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl==2NaCl+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl==MgCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO+CO Cu+CO2黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO2Fe+3CO2冶炼金属原理Fe3O4+4CO3Fe+4CO2冶炼金属原理WO3+3CO W+3CO2冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2 2CO2+4H2OC2H5OH+3O2 2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4==Cu+FeSO4银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4==Fe+MgSO4溶液由浅绿色变为无色Cu+Hg(NO3)2==Hg+Cu(NO3)2Cu+2AgNO3==2Ag+Cu(NO3)2红色金属表面覆盖一层银白色物质镀银Zn+CuSO4==Cu+ZnSO4青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl==2FeCl3+3H2O铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl==2AlCl3+3H2O白色固体溶解Na2O+2HCl==2NaCl+H2O白色固体溶解CuO+2HCl==CuCl2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HCl==ZnCl2+H2O白色固体溶解MgO+2HCl==MgCl2+H2O白色固体溶解CaO+2HCl==CaCl2+H2O白色固体溶解NaOH+HCl==NaCl+H2O白色固体溶解Cu(OH)2+2HCl==CuCl2+2H2O蓝色固体溶解Mg(OH)2+2HCl==MgCl2+2H2O白色固体溶解Al(OH)3+3HCl==AlCl3+3H2O白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl==FeCl3+3H2O红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl==CaCl2+2H2OHCl+AgNO3==AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4==Al2(SO4)3+3H2O白色固体溶解CuO+H2SO4==CuSO4+H2O黑色固体溶解、溶液呈蓝色ZnO+H2SO4==ZnSO4+H2O白色固体溶解MgO+H2SO4==MgSO4+H2O白色固体溶解2NaOH+H2SO4==Na2SO4+2H2OCu(OH)2+H2SO4==CuSO4+2H2O蓝色固体溶解Ca(OH)2+H2SO4==CaSO4+2H2OMg(OH)2+H2SO4==MgSO4+2H2O白色固体溶解2Al(OH)3+3H2SO4==Al2(SO4)3+3H2O白色固体溶解2Fe(OH)3+3H2SO4==Fe2(SO4)3+3H2O红褐色沉淀溶解、溶液呈黄色Ba(OH)2+H2SO4==BaSO4↓+2H2O生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+H2SO4==BaSO4↓+2HCl生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4==BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3==2NaNO3+H2O白色固体溶解CuO+2HNO3==Cu(NO3)2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HNO3==Zn(NO3)2+H2O白色固体溶解MgO+2HNO3==Mg(NO3)2+H2O白色固体溶解CaO+2HNO3==Ca(NO3)2+H2O白色固体溶解NaOH+HNO3==NaNO3+H2OCu(OH)2+2HNO3==Cu(NO3)2+2H2O蓝色固体溶解Mg(OH)2+2HNO3==Mg(NO3)2+2H2O白色固体溶解Al(OH)3+3HNO3==Al(NO3)3+3H2O白色固体溶解Ca(OH)2+2HNO3==Ca(NO3)2+2H2OFe(OH)3+3HNO3==Fe(NO3)3+3H2O红褐色沉淀溶解、溶液呈黄色3NaOH+H3PO4==3H2O+Na3PO43NH3+H3PO4==(NH4)3PO42NaOH+CO2==Na2CO3+H2O 吸收CO、O2、H2中的CO22NaOH+SO2==Na2SO3+H2O 2NaOH+SO3==Na2SO4+H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH==Fe(OH)3↓+3NaCl溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH==Al(OH)3↓+3NaCl有白色沉淀生成MgCl2+2NaOH==Mg(OH)2↓+2NaClCuCl2+2NaOH==Cu(OH)2↓+2NaCl溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O==Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2==CaSO3↓+H2O有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3==CaCO3↓+2NaOH有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3==BaCO3↓+2NaOH有白色沉淀生成Ca(OH)2+K2CO3==CaCO3↓+2KOH有白色沉淀生成CuSO4+5H2O==CuSO4·H2O蓝色晶体变为白色粉末CuSO4+H2O CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl==AgCl↓+NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2+Na2SO4==BaSO4↓+2NaCl白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3==CaCO3↓+2NaCl有白色沉淀生成MgCl2+Ba(OH)2==BaCl2+Mg(OH)2↓有白色沉淀生成CaCO3+2HCl==CaCl2+H2O+CO2↑MgCO3+2HCl==MgCl2+H2O+ CO2↑NH4NO3+NaOH==NaNO3+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+KOH==KCl+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体。
北京市中考必考化学方程式归纳总结

北京市中考必考化学方程式大全(最新版) 化 学 反 应化 学 方 程 式1红磷在空气中燃烧 4 P + 5 O点燃 2 P2O522硫在空气中燃烧S + O点燃 SO223铝在氧气中燃烧 4 Al + 3 O2 点燃 2 Al2O34碳在空气中燃烧 C + O点燃 CO225铁在氧气中燃烧 3 Fe + 2 O点燃 Fe3O426过氧化氢分解制氧气 2 H2O2 MnO2 2 H2O + O2↑7实验室用高锰酸钾制氧气2KMnO△ K2MnO4+ MnO2+ O2↑48水通电分解 2 HO通电2 H2↑+ O2↑29氧化汞受热分解 2 HgO △ 2 Hg + O2↑10铁和硫酸铜反应Fe + CuSO=FeSO4 + Cu411镁在空气中燃烧 2 Mg + O2点燃 2 MgO12氢气还原氧化铜H2 + CuO △ Cu + H2O13镁和氧化铜反应Mg + CuO △ Cu + MgO14氢气在空气中燃烧 2 H2 + O2点燃2 H2O15硫酸铜和氢氧化钠反应CuSO4 + 2NaOH== Cu(OH)2↓+ Na2SO4 16氯酸钾分解制氧气 2 KClO3 MnO2 2 KCl + 3 O2↑17用石灰石烧生石灰CaCO3高温 CaO + CO2↑18碳在空气中不充分燃烧 2 C + O2 ( 不足 )点燃2 CO19碳还原氧化铜 C + 2 CuO高温 2 Cu + CO2↑20碳还原氧化铁 3 C + 2 Fe2O3高温 4 Fe + 3 CO2 ↑21碳酸易分解H2CO3==== CO2 ↑+ H2O22实验室制二氧化碳CaCO3+ 2 HCl == CaCl2 + CO2↑+ H2O 23二氧化碳溶于水CO2 + H2O === H2CO324二氧化碳和石灰水反应CO2 + Ca(OH)2 = CaCO3↓+ H2O (检验CO2)25一氧化碳在空气中燃烧 2 CO + O2点燃 2 CO226一氧化碳还原氧化铜CO +CuO 加热Cu + CO227甲烷(沼气)在空气中燃烧CH4 + 2 O2点燃CO2 + 2 H2O28酒精(乙醇)在空气中燃烧C2H5OH + 3 O2点燃2 CO2 + 3 H2O29镁和盐酸反应Mg + 2HCl == MgCl2 + H2↑30镁和硫酸反应Mg + H2SO4 ==MgSO4 + H2↑31锌和盐酸反应Zn + 2HCl == ZnCl2 + H2↑32实验室制氢气Zn + H2SO4==ZnSO4 + H2↑33铁和盐酸反应Fe + 2HCl==FeCl2 + H2↑34铁和硫酸反应Fe + H2SO4 == FeSO4 + H2↑35铝和硫酸铜反应 2 A l + 3 CuSO4 == Al2(SO4)3 + 3Cu 36铜和硝酸银反应Cu + 2 AgNO3 == Cu(NO4)2 + 2 Ag 37一氧化碳还原三氧化二铁 3 CO +Fe2O3高温2 Fe + 3 CO238铁锈溶解在盐酸中Fe2O3+6HCl==2FeCl3+3H2O39三氧化二铁与硫酸反应Fe2O3+3H2SO4==Fe2(SO4)3+3H2O40生石灰化成熟石灰CaO+H2O ==Ca(OH)241氢氧化钠与二氧化碳反应2NaOH+CO2==Na2CO3+H2O42氢氧化钠与二氧化硫反应2NaOH+SO2==Na2SO3+H2O43氢氧化钠与盐酸反应NaOH+HCl==NaCl+H2O44氢氧化钙与盐酸反应Ca(OH)2+2HCl==CaCl2+2H2O45氢氧化钙与硫酸反应Ca(OH)2+H2SO4==CaSO4+2H2O46电解饱和食盐水2NaCl+ 2H2O通电2NaOH+Cl2↑+H2↑47用碳酸钠制取氢氧化钠Na2CO3+ Ca(OH)2 ==CaCO3↓+2NaOH48碳酸钙与二氧化碳\水反应CaCO3+CO2+ H2O== Ca(HCO3)249碳酸氢钙遇热或减压分解Ca(HCO3)2==CaCO3↓+ H2O+ CO2↑50碳酸氢钠与足量石灰水反应NaHCO3+ Ca(OH)2 == CaCO3↓+2NaOH+ H2O2NaHCO3+ Ca(OH)2 == CaCO3↓+ 2H2O+ 51碳酸氢钠与少量石灰水反应Na2CO352碳酸钠与少量盐酸反应NaCO3+HCl== NaHCO3 +NaCl253碳酸氢钠与稀盐酸反应NaHCO+HCl==NaCl+H2O+CO2↑354碳酸钠与足量稀盐酸反应NaCO3+2HCl==2NaCl+H2O+CO2↑255电解氯化镁MgCl通电Mg+Cl2↑2。
化学知识点初三总结化学方程式

化学知识点初三总结化学方程式一、化合反应。
1. 镁在空气中燃烧。
- 化学方程式:2Mg + O_2{点燃}{===}2MgO- 现象:剧烈燃烧,发出耀眼白光,生成白色固体。
2. 铁在氧气中燃烧。
- 化学方程式:3Fe + 2O_2{点燃}{===}Fe_3O_4- 现象:剧烈燃烧,火星四射,生成黑色固体。
3. 铜在空气中受热。
- 化学方程式:2Cu+O_2{}{===}2CuO- 现象:红色固体逐渐变黑。
4. 铝在空气中氧化。
- 化学方程式:4Al + 3O_2===2Al_2O_3(铝在常温下与氧气反应,表面生成一层致密的氧化铝薄膜)5. 氢气在空气中燃烧。
- 化学方程式:2H_2+O_2{点燃}{===}2H_2O- 现象:产生淡蓝色火焰,放出热量,在火焰上方罩一个干冷的烧杯,烧杯内壁有水珠生成。
6. 红磷在空气中燃烧。
- 化学方程式:4P + 5O_2{点燃}{===}2P_2O_5- 现象:产生大量白烟,放出热量。
7. 硫粉在空气中燃烧。
- 化学方程式:S+O_2{点燃}{===}SO_2- 现象:在空气中发出淡蓝色火焰,在氧气中发出蓝紫色火焰,生成有刺激性气味的气体。
8. 碳在氧气中充分燃烧。
- 化学方程式:C + O_2{点燃}{===}CO_2- 现象:发出白光,放出热量,生成能使澄清石灰水变浑浊的气体。
9. 碳在氧气中不充分燃烧。
- 化学方程式:2C+O_2{点燃}{===}2CO二、分解反应。
1. 实验室用双氧水制氧气。
- 化学方程式:2H_2O_2{MnO_2}{===}2H_2O+O_2↑- 现象:有气泡产生,反应速率适中。
2. 加热高锰酸钾制氧气。
- 化学方程式:2KMnO_4{}{===}K_2MnO_4+MnO_2+O_2↑- 现象:紫黑色固体逐渐变为黑色,生成能使带火星木条复燃的气体。
3. 加热氯酸钾制氧气(有二氧化锰作催化剂)- 化学方程式:2KClO_3{MnO_2}{{===}{}}2KCl + 3O_2↑4. 水在直流电的作用下分解。
【初中化学】中考化学必背方程式:复分解反应

【初中化学】中考化学必背方程式:复分解反应1、碱性氧化物+酸→盐+h2ofe2o3+6hcl=2fecl3+3h2o fe2o3+3h2so4=fe2(so4)3+3h2ocuo+h2so4=cuso4+h2o zno+2hno3=zn(no3)3+h2o2.碱+酸→ 盐+水cu(oh)2+2hcl=cucl2+2h2o cu(oh)2+h2so4=cuso4+2h2onaoh+hcl=nacl+h2o 2naoh+h2so4=na2so4+2h2onaoh+hno3=nano3+h2o mg(oh)2+2hno3=mg(no3)2+2h2oba(oh)2+h2so4=baso4↓+2h2oal(oh)3+3hcl=alcl3+3h2o白色固体溶解胃舒平治疗胃酸过多3.酸+盐→ 新盐+新酸caco3+2hcl=cacl2+h2o+co2↑实验室制取co2、除水垢Na2co3+2hcl=2nacl+h2o+co2。
气体泡沫灭火器的原理是澄清石灰水的浊度。
hcl+agno3=agcl↓+hno3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子H2SO4+BaCl2=BaSO4↓ + 2HCl形成白色沉淀,不溶于稀硝酸。
SO42的测试原理-ba(no3)2+h2so4=baso4↓+2hno3生成白色沉淀、不溶解于稀硝酸检验ba2+的原理Nahco3+hcl=nacl+h2o+co2。
气体泡沫灭火器的原理是澄清石灰水的浊度。
4、盐1+盐2→新盐1+新盐2kcl+agno3=agcl↓+kno3nacl+agno3=agcl↓+纳米3na2so4+bacl2=baso4↓+2nacl bacl2+2agno3=2agcl↓+ba(no3)25.盐+碱→ 新盐+新碱cuso4+2naoh=cu(oh)2↓+na2so4蓝色沉淀FeCl3+3naoh=Fe(OH)3↓ + 3nacl红棕色沉淀物溶解,溶液呈黄色ca(oh)2+na2co3=caco3↓+2naoh有白色沉淀生成工业制烧碱、实验室制少量烧碱NaOH+NH4Cl=NaCl+NH3↑ + H2O产生的气体使湿石蕊试纸变蓝,用于测定溶液中的铵离子。
北京市中考必考化学方程式(最新版)!

CaO+H2O ==Ca(OH)2
41
氢氧化钠与二氧化碳反应
2NaOH+CO2==Na2CO3+H2O
42
氢氧化钠与二氧化硫反应
2NaOH+SO2==Na2
NaOH+HCl==NaCl+H2O
44
氢氧化钙与盐酸反应
Ca(OH)2+2HCl==CaCl2+2H2O
17
用石灰石烧生石灰
CaCO3高温CaO + CO2↑
18
碳在空气中不充分燃烧
2 C+ O2 (不足)点燃2 CO
19
碳还原氧化铜
C + 2 CuO高温2 Cu + CO2↑
20
碳还原氧化铁
3 C+ 2 Fe2O3高温4 Fe + 3 CO2↑
21
碳酸易分解
H2CO3==== CO2↑+ H2O
22
北京市中考必考化学方程式(最新版)
化学反应
化学方程式
1
红磷在空气中燃烧
4 P + 5 O2点燃2 P2O5
2
硫在空气中燃烧
S + O2点燃SO2
3
铝在氧气中燃烧
4 Al + 3 O2点燃2 Al2O3
4
碳在空气中燃烧
C + O2点燃CO2
5
铁在氧气中燃烧
3 Fe + 2 O2点燃Fe3O4
6
过氧化氢分解制氧气
36
铜和硝酸银反应
Cu + 2 AgNO3== Cu(NO4)2+ 2 Ag
37
一氧化碳还原三氧化二铁
中考化学常考化学方程式汇总

中考化学常考化学方程式汇总化学方程式是化学反应过程中化学物质之间的符号表示法。
在中考化学中,化学方程式的掌握是非常重要的。
下面是中考化学中常考的化学方程式的汇总:1.酸碱中和反应:酸+碱→盐+水例如:HCl+NaOH→NaCl+H2O2.金属与非金属氧化反应:金属+非金属氧化物→金属氧化物例如:2Cu+O2→2CuO3.金属与酸反应:金属+酸→盐+氢气例如:2Al+6HCl→2AlCl3+3H24.非金属与酸反应:非金属+酸→盐+水例如:2H2S+4HCl→4H2O+2Cl2+S5.金属与硫酸反应:金属+硫酸→硫酸盐+氢气例如:Zn+H2SO4→ZnSO4+H26.金属与盐酸反应:金属+盐酸→盐+氢气例如:Mg+2HCl→MgCl2+H27.金属氧化物与酸反应:金属氧化物+酸→盐+水例如:CaO+2HCl→CaCl2+H2O8.羧酸与碱反应:羧酸+碱→盐+水例如:CH3COOH+NaOH→CH3COONa+H2O9.碳酸盐分解反应:碳酸盐→金属氧化物+二氧化碳例如:CaCO3→CaO+CO210.金属与非金属反应:金属+非金属→锐钝相反应例如:2Al+3Cl2→2AlCl311.高锰酸钾与硫酸反应:高锰酸钾+硫酸→锰酸锰+二氧化硫+水例如:2KMnO4+3H2SO4→2Mn(SO4)3+K2SO4+3H2O+5[O]12.碳氢化合物燃烧反应:碳氢化合物+氧气→二氧化碳+水例如:C2H5OH+O2→CO2+H2O13.金属与卤素反应:金属+卤素→金属卤化物例如:2Na+Cl2→2NaCl14.酸与碳酸盐反应:酸+碳酸盐→盐+水+二氧化碳例如:HCl+Na2CO3→2NaCl+H2O+CO215.特殊气体反应:氢气和氧气反应生成水例如:2H2+O2→2H2O16.二氧化硫与水反应生成亚硫酸:SO2+H2O→H2SO3以上是中考化学中常考的化学方程式的汇总,希望对你的学习有所帮助。
记住,掌握这些常考的化学方程式是中考化学的基础,多做相关的习题和实验,加深对化学方程式的理解和运用。
北京市中考化学复习资料 化学方程式总结

化学方程式总结一、三个置换反应规律1.酸+金属==盐+氢气(反应必须是在溶液中进行)反应条件:①酸不能用强氧化性酸,如硝酸、浓硫酸,(常用稀硫酸、盐酸等)②金属必须位于氢以前(常用Mg、Al、Zn、Fe)Mg+ 2HCl==MgCl2+H2↑ Mg+ H2SO4==MgSO4+H2↑2Al+6 HCl== 2AlCl3+3H2↑ 2Al+3 H2SO4== 2Al2(SO4)3+3H2↑Zn+ 2HCl==ZnCl2+ H2↑ Zn+ 2H2SO4==ZnSO4+ H2↑Fe+ 2HCl==FeCl2+H2↑ Fe+H2SO4===FeSO4+H2↑2.盐+金属==新盐+新金属 (反应必须是在溶液中进行)反应条件:①盐(反应物)必须溶于水(初中阶段认为难溶性盐在水中没有离子,不反应)②金属单质(反应物)比盐中金属活泼,不用钾、钙、钠(它们是先和水反应生成可溶性碱再和某些盐(可溶性铜盐、铁盐、镁盐等反应生成难溶性碱。
Fe+CuSO4==FeSO4+Cu 2Al+3CuSO4==Al2(SO4)3+3CuZn+CuSO4==ZnSO4+Cu Cu+2AgNO3==Cu(NO3)2+2AgCu+Hg(NO3)2==Cu(NO3)2+Hg3.补充反应:非溶液置换反应:还原性单质和氧化物的反应(参照:五之二)条件:○1单质为氢气、单质碳○2氧化物为氧化铜、氧化亚铁、氧化铁、四氧化三铁等H2+CuO Cu+H2O C+CuO Cu+CO2↑H2+FeO Fe+H2O C+FeO Fe+CO2↑3H2+Fe2O3 2Fe+3H2O 3C+2Fe2O3 4Fe+3CO2↑规律:金属氧化物+H2金属+H2O 金属氧化物+C 金属+CO2二、三个分解反应规律1.酸(含氧酸)==非金属氧化物+水H2CO3 === H2O+CO2↑ H2SO3 === H2O+SO2↑要求:二氧化碳、二氧化硫等2.碱(难溶性碱)==金属氧化物+水(可溶性碱没有这个反应)Cu(OH)2 CuO+H2O 2Fe(OH)3 Fe2O3+3H2O3.碳酸盐(难溶性)==金属氧化物+二氧化碳CaCO3 CaO+ CO2↑(可溶性碳酸盐没有这个反应)三、四个化合反应规律1.金属+氧气 == 金属氧化物2 Mg+O2 2MgO 3Fe+2 O2 Fe3O4 2Cu+ O2 2CuO2.金属氧化物+水 == 碱(可溶性)(难溶性碱没有这个反应)CaO+H2O==Ca(OH)2 Na2O+H2O==2NaOH3.非金属+氧气==非金属氧化物S+O2 SO2 4P+5O2 2P2O5 C+O2 CO2 (碳充分燃烧)2 C+O2 2CO (碳不充分燃烧) 2H2+O2 2H2O4.非金属氧化物+水==酸CO2+H2O==H2CO3 SO3+O2==H2SO4 SO2+O2== H2SO3(亚硫酸)四、五个复分解反应规律(其中的微溶于水的物质一般是指氢氧化钙(Ca(OH)2)、至少是指一定要有一种生成物符合条件,两种也行、生成物要求至少有一种是水、气体或沉淀)1.酸+碱==盐+水 [初中讲到的所有酸(即硅酸除外)和碱都能反应]Cu(OH)2+2HCl==CuCl2+H2O Al(OH)3+3HCl==AlCl3+3H2OCu(OH)2+H2SO4==CuSO4+2H2O Mg(OH)2+2HNO3==Mg(NO3)2+2H2O2.酸+盐==新酸+新盐反应条件:符合复分解反应发生的条件(实际反应条件很复杂)盐必须要溶于水或者要溶于和它反应的酸)生成物:盐只能是沉淀,初中酸可以是分解成气体CaCO3+2HCl==CaCl2+H2O+CO2↑ Na2CO3+2HCl==2NaCl+H2O+CO2↑AgNO3+HCl==AgCl↓+HNO3Na2CO3+H2SO4==Na2SO4+H2O+CO2↑ H2SO4+BaCl2==2HCl+BaSO4↓H2SO4+Ba(NO3)2==2HNO3+BaSO4 ↓3.盐+碱==新盐+新碱反应条件:反应物都溶于水或微溶于水,生成物:生成物至少有一种不溶(前溶后沉)也可以是气体(初三通常是氨气)CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 FeCl3+3NaOH==Fe(OH)3↓+3NaClNa2CO3+Ca(OH)2==2NaOH+CaCO3↓ CuSO4+Ba(OH)2==Cu(OH)2↓+BaSO4 ↓2NH4Cl+ Ca(OH)2 CaCl2+ 2NH3↑+2H2O4.盐+盐==新盐+新盐反应条件:反应物都溶于水或微溶于水,生成物:生成的新盐、新碱至少有一种不溶(前溶后沉)NaCl+AgNO3==NaNO3+AgCl↓ Na2SO4+BaCl2==2NaCl+BaSO4 ↓Na2SO4+Ba(NO3)2==2NaNO3+BaSO4 ↓5.酸+金属氧化物==盐+水Fe2O3+6HCl==2FeCl3+3H2O Fe2O3+3H2SO4==Fe2(SO4)3+3H2OCuO+2HCl==CuCl2+H2O CuO+ H2SO4==CuSO4+H2OM gO+2HNO3==Mg(NO3)2+H2O五、其它反应1.碱+非金属氧化物==盐+水(不属于四种化学反应基本类型)反应条件:碱要溶于水或微溶于水。
中考必考的26个化学方程式

中考必考的26个化学方程式中考是中小学教育过程中最重要的一个考试,考生在取得好成绩之前,必须认真备考、有条不紊地学习,以便在考试中取得好成绩。
在化学方面,考生必须掌握中考的必考的26个化学方程式,这是中考成绩的重要保证。
下面是中考考生必须掌握的26个化学方程式:1.酸铜和硝酸反应:CuSO4 + 4HNO3>Cu(NO3)2 + SO2 + 2H2O2.氧化钠和水反应:NaOH + H2O> Na+ + OH-3.性高锰酸钾和氯气反应:KMnO4 + Cl2> KCl + MnO2 +Cl2O4.气和氧气反应:2H2 + O2> 2H2O5.解铝热量反应:Al +3H2O> Al2O3 + 3H26.化钾和水反应:KF + H2O> KOH + HF7.酸钠和氢氧化钠反应:Na2CO3 + 2NaOH> 2Na2CO3 + H2O8.气和氢气反应:Cl2 + 2H2> 2HCl9.化氢和氢氧化钾反应:HCl + KOH> KCl + H2O10.气和氢气反应:Cl2 + H2> 2HCl11.气和空气反应:Cl2 + O2> 2ClO12.气和氧气反应:2H2 + O2> 2H2O13.化钠和水反应:NaCl + H2O> NaOH + HCl14. 乙酸和硫酸反应:CH3COOH + H2SO4> CH3COOHSO4 + H2O15.酸和硝酸反应:H2SO4 + 2HNO3> SO2 + 2H2O + 2NO216.酸和氯气反应:HNO3 + Cl2> NOCl + HCl + H2O17.酸钠和氯气反应:Na2CO3 + Cl2> 2NaCl + CO2 + H2O18.氧化钾和水反应:KOH + H2O> K+ + OH-19.酸磷和水反应:H3PO4 + H2O> H3PO3 +H3O+20.盐和硝酸反应:NH4NO3 + H2SO4> N2 + H2O + H2SO421.氟酸和氧气反应:2HF + O2> H2O + 2F222.气和乙醇反应:Cl2 + CH3CH2OH> CH3CH2Cl + HCl + H2O23.酸铵和氢氧化钠反应:NH4NO3 + NaOH> NaNO3 + NH4OH24.氧化铝和水反应:Al(OH)3 + H2O> Al3+ +3OH-25.酸和碳酸钡反应:H2SO4 + BaCO3> BaSO4 + CO2 + H2O26.酸钠和氢氧化钾反应:NaNO3 + KOH> KNO3 + NaOH以上就是今年中考考生必须掌握的26个化学方程式,这些方程式不仅对中考的成绩有重要意义,而且还是学习化学的基础。
36个北京中考必记化学方程式--练习及答案讲解

【化合反应】36 个北京中考必记化学方程式1、镁在空气中燃烧:2、铁在氧气中燃烧:3、铝在空气中燃烧:4、氢气在空气中燃烧:5、红磷在空气中燃烧:6、硫粉在空气中燃烧:7、碳在氧气中充分燃烧:8、碳在氧气中不充分燃烧:9、二氧化碳通过灼热碳层:10、一氧化碳在氧气中燃烧:11、二氧化碳和水反应:12、生石灰溶于水:13、无水硫酸铜作干燥剂:14、钠在氯气中燃烧:【分解反应】15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法: 【置换反应】20、铁和硫酸铜溶液反应:21、锌和稀硫酸反应(实验室制氢气:22、镁和稀盐酸反应:23、氢气还原氧化铜:24、木炭还原氧化铜:25、甲烷在空气中燃烧:26、水蒸气通过灼热碳层:27、焦炭还原氧化铁:【其他】28、氢氧化钠溶液与硫酸铜溶液反应:29、甲烷在空气中燃烧:30、酒精在空气中燃烧:31、一氧化碳还原氧化铜:32、一氧化碳还原氧化铁:33、二氧化碳通过澄清石灰水(检验二氧化碳:34、氢氧化钠和二氧化碳反应(除去二氧化碳:35、石灰石(或大理石与稀盐酸反应(二氧化碳的实验室制法: 36、碳酸钠与浓盐酸反应(泡沫灭火器的原理 :【水哥聊中考】大水老师36个北京中考必记化学方程式【化合反应】1、镁在空气中燃烧:2Mg +O 22MgO 2、铁在氧气中燃烧:3Fe +2O 2Fe 3O 43、铝在空气中燃烧:4Al + 3O 22Al 2O 34、氢气在空气中燃烧:2H 2+O 22H 2O 5、红磷在空气中燃烧:4P + 5O 22P 2O 56、硫粉在空气中燃烧:S + O 2SO 27、碳在氧气中充分燃烧:C + O 2CO 28、碳在氧气中不充分燃烧:2C + O 22CO 9、二氧化碳通过灼热碳层:C + CO 22CO 10、一氧化碳在氧气中燃烧:2CO + O 22CO 211、二氧化碳和水反应:CO 2+ H 2O === H 2CO 312、生石灰溶于水:CaO + H 2O === Ca(OH213、无水硫酸铜作干燥剂:CuSO 4+ 5H 2O ===CuSO 4•5H 2O14、钠在氯气中燃烧:2Na + Cl 22NaCl 【分解反应】15、实验室用双氧水制氧气:2H 2O 22H 2O+ O 2↑ 16、加热高锰酸钾:2KMnO 4K 2MnO 4+ MnO 2+ O 2↑17、水在直流电的作用下分解:2H 2O2H 2↑ + O 2↑ 18、碳酸不稳定而分解:H 2CO 3=== H 2O + CO 2↑19、高温煅烧石灰石(二氧化碳工业制法:CaCO 3CaO + CO 2↑【置换反应】20、铁和硫酸铜溶液反应:Fe + CuSO 4===FeSO 4+ Cu【水哥聊中考】大水老师21、锌和稀硫酸反应(实验室制氢气:Zn + H 2SO 4===ZnSO 4+ H 2↑22、镁和稀盐酸反应:Mg + 2HCl === MgCl 2+ H 2↑23、氢气还原氧化铜:H 2+ CuO Cu + H 2O24、木炭还原氧化铜:C + 2CuO 2Cu + CO 2↑25、甲烷在空气中燃烧:CH 4+ 2O 2CO 2+ 2H 2O26、水蒸气通过灼热碳层:H 2O + C H 2+ CO27、焦炭还原氧化铁:3C + 2Fe 2O 34Fe + 3CO 2↑【其他】28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO 4== Cu(OH2↓+ Na 2SO 429、甲烷在空气中燃烧:CH 4+ 2O 2CO 2+ 2H 2O30、酒精在空气中燃烧:C 2H 5OH + 3O 22CO 2+ 3H 2O31、一氧化碳还原氧化铜:CO + CuO Cu + CO 232、一氧化碳还原氧化铁:3CO + Fe 2O 32Fe + 3CO 233、二氧化碳通过澄清石灰水(检验二氧化碳:Ca(OH2+ CO 2===Ca CO 3↓ + H 2O34、氢氧化钠和二氧化碳反应(除去二氧化碳:2NaOH + CO 2===Na 2CO 3+ H 2O35、石灰石(或大理石与稀盐酸反应(二氧化碳的实验室制法: CaCO 3+ 2HCl === CaCl 2+ H 2O + CO 2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理:Na 2CO 3+ 2HCl === 2NaCl + H 2O + CO 2↑。
九年级中考化学复习资料化学方程式93-137(含答案)

反应类型
93
三大强酸 与 四大强碱 反应
HCl+NaOH=NaCl+H2O
复分解反应
94
盐酸
HCl+KOH=KCl+H2O
复分解反应
95
硫酸
2HCl+Ba(OH)2=BaCl2+2H2O
复分解反应
96
硝酸
2HCl+Ca(OH)2=CaCl2+2H2O
复分解反应
97
H2SO4+2NaOH=Na2SO4+2H2O
复分解反应
98
H2SO4+2KOH=K2SO4+2H2O
复分解反应
99
氢氧化钠
H2SO4+Ba(OH)2=BaSO4↓+2H2O
复分解反应
100
氢氧化钾
H2SO4+Ca(OH)2=CaSO4+2H2O
复分解反应
101
氢氧化钡
HNO3+NaOH=NaNO3+H2O
复分解反应
102
氢氧化钙
HNO3+KOH=KNO3+H2O
复分解反应
103
2HNO3+Ba(OH)2=Ba(NO3)2+2H2O
复分解反应
104
2HNO3+Ca(OH)2=Ca(NO3)2+2H2O
复分解反应
105
十大沉淀的生成
氢氧化镁
MgCl2+2NaOH=2NaCl+Mg(OH)2↓
复分解反应
106
Fe(OH)2+2HCl=FeCl2+2H2O
复分解反应
119
氢氧化铝
Fe(OH)3+3HCl=FeCl3+3H2O
复分解反应
120
氢氧化锌
Cu(OH)2+2HCl=CuCl2+2H2O
九年级所有化学方程式总汇全

九年级所有化学方程式总汇全一、化学反应类型1. 置换反应金属置换反应:例如,铁与硫酸铜反应硫酸亚铁和铜。
Fe + CuSO₄ → FeSO₄ + Cu非金属置换反应:例如,氯气与溴化钠反应氯化钠和溴。
Cl₂ + 2NaBr → 2NaCl + Br₂2. 复分解反应中和反应:例如,氢氧化钠与盐酸反应氯化钠和水。
NaOH + HCl → NaCl + H₂O盐与盐的反应:例如,硫酸钠与氯化钡反应硫酸钡和氯化钠。
Na₂SO₄ + BaCl₂ → BaSO₄↓ + 2NaCl3. 分解反应热分解:例如,碳酸钙在高温下分解氧化钙和二氧化碳。
CaCO₃ → CaO + CO₂↑光解:例如,氯酸钾在光照下分解氯化钾和氧气。
2KClO₃ → 2KCl + 3O₂↑4. 合成反应燃烧反应:例如,碳与氧气反应二氧化碳。
C + O₂ → CO₂氢化反应:例如,氮气与氢气反应氨气。
N₂ + 3H₂ → 2NH₃二、化学方程式实例1. 氢气与氧气反应水2H₂ + O₂ → 2H₂O2. 铁与硫酸铜反应硫酸亚铁和铜Fe + CuSO₄ → FeSO₄ + Cu3. 氢氧化钠与盐酸反应氯化钠和水NaOH + HCl → NaCl + H₂O4. 碳酸钙在高温下分解氧化钙和二氧化碳 CaCO₃ → CaO + CO₂↑5. 氯酸钾在光照下分解氯化钾和氧气2KClO₃ → 2KCl + 3O₂↑6. 氮气与氢气反应氨气N₂ + 3H₂ → 2NH₃7. 碳与氧气反应二氧化碳C + O₂ → CO₂8. 氯气与溴化钠反应氯化钠和溴Cl₂ + 2NaBr → 2NaCl + Br₂9. 硫酸钠与氯化钡反应硫酸钡和氯化钠 Na₂SO₄ + BaCl₂ → BaSO₄↓ + 2NaCl 10. 氢气与氯气反应氯化氢H₂ + Cl₂ → 2HCl九年级所有化学方程式总汇全三、氧化还原反应1. 氧化反应例如,铁在氧气中燃烧四氧化三铁。
3Fe + 2O₂ → Fe₃O₄2. 还原反应例如,氧化铜在氢气中还原铜和水。
中考必考的26个化学方程式

中考必考的26个化学方程式每年的中考都会考及化学方程式知识,而这26个化学方程式是考生必须掌握的重要知识点。
以下就是中考必考的26个化学方程式:1.氧化钠与水反应:NaOH + H2O Na+ + OH- + H22.酸氢钠与水反应:NaHCO3 + H2O Na+ + HCO3- + H23.氧化钾与水反应:KOH + H2O K+ + OH- + H24.氧化钙与水反应:Ca(OH)2 + H2O Ca2+ + 2OH- + H25.水与硝酸反应:NH3 + HNO3 NH4+ + NO3-6.酸钾与水反应:KClO3 + H2O K+ + ClO3- + H27.化钠与水反应:NaCl + H2O Na+ + Cl- + H28.化铵与水反应:NH4Cl + H2O NH4+ + Cl- + H29.化钙与水反应:CaCl2 + H2O Ca2+ + 2Cl- + H210.氧化铵与水反应:NH4OH + H2O NH4+ + OH- + H211.酸钠与水反应:Na2SO4 + H2O 2Na+ + SO42- + H212.氧化钠与碳酸反应:NaOH + CO2 Na+ + HCO3-13.氧化钾与碳酸反应:KOH + CO2 K+ + HCO3-14.氢氧化钠与水反应:NaClO + H2O Na+ + ClO- + H2O15.氢氧化钾与水反应:KClO + H2O K+ + ClO- + H2O16.化锂与水反应:LiCl + H2O Li+ + Cl- + H217.氧化钠与硝酸反应:NaOH + HNO3 Na+ + NO3- + H218.氧化钾与硝酸反应:KOH + HNO3 K+ + NO3- + H219.化锂与硫酸反应:LiCl + H2SO4 Li+ + SO42- + 2HCl20.化铵与硫酸反应:NH4Cl + H2SO4 NH4+ + SO42- + 2HCl21.氢交换反应:Na2SO4 + 2HCl 2NaCl + SO42- + H222.氢交换反应:K2SO4 + 2HCl 2KCl + SO42- + H223.化钠与硝酸反应:NaCl + HNO3 Na+ + NO3- + HCl24.化钾与硝酸反应:KCl + HNO3 K+ + NO3- + HCl25.氧化铝与水反应:Al(OH)3 + H2O Al3+ + 3OH- + H226.氧化镁与水反应:Mg(OH)2 + H2O Mg2+ + 2OH- + H2以上就是中考必考的26个化学方程式,须掌握的知识点。
化学课程—北京专题-专题三化学方程式-中考化学

专题三化学方程式化学方程式这部分知识的考查在北京中考试卷中较为分散,贯穿于整套试卷之中,但最为典型的是考2道选择题和填空题中陌生方程式书写、质量守恒定律的应用共约占3分;总分值为5分左右。
题型的特点是:选择题通常考1道化学方程式正误判断题和1道质量守恒定律应用题,这两道题分别属于基本概念考查题(简单题)和能力应用题(中等难度题)。
填空题通常考查用微粒的观点对质量守恒定律作出解释、根据信息写出陌生方程式等,均属于中档题。
化学方程式这部分知识的考查难度基本不变,只要对质量守恒定律的定义理解到位,会配平化学方程式,考试就能迎刃而解。
解题策略:注重审题,将关键词画圈,特别是质量守恒定律应用于写陌生情境之中,一定要多思考找出之前见过的模型,然后解题;还有就是这类题会与相对分子质量的相关计算综合考查,一定要配平化学方程式后再列式计算。
专题教学策略:这部分知识的考查整体难度不大且题型模式单一,只要细心、仔细就能牢牢抓住这5分。
专题复习流程:第一步,教师重点阅读专题导语和学习目标、方法突破三个模块,课前根据学生实际情况精选试题,明确授课流程。
第二步,指导学生填写必备知识模块,可以是学生填写老师纠错,也可以是学生和老师一起回顾知识,一定要做到先复习再练习。
只有扎实的基础才能出高分。
第三步,基础过关后,根据题型分类来指导学生做题,做题的过程中发现问题要及时指导学生修正并标识,总结易错点、重难点等记录在我的记录空间,以备课后复习。
第四步,选取相关练习题来强化训练,也可以根据学生的具体情况进行限时训练。
特别是简单题,一定要提高正确率。
第五步,回顾总结,可以是没有掌握好的概念、也可以是做错的题目。
例如,化学方程式的配平、忘记了气体沉淀符号、没有配平就列式计算、质量守恒定律中的守恒关系不明确、对概念理解不到位(质量守恒定律只限于化学变化)等等。
最后留出课后作业,作业根据学生实际情况,选留30分钟到40分钟的题目。
1. 依据质量守恒定律,说明化学反应中的质量关系。
北京初中化学方程式总结计划大全

北京初中化学方程式大全化合反响1、镁在空气中焚烧:2Mg+O 22MgO2、铁在氧气中焚烧:3Fe+2O2Fe3O43、铝在空气中焚烧:4Al+3O 22Al 2O34、氢气在空气中焚烧: 2H 2+O 22H2O5、红磷在空气中焚烧:4P+5O 22P2O56、硫粉在空气中焚烧:S+O2SO27、碳在氧气中充足焚烧:C+O 2CO28、碳在氧气中不充足焚烧:2C+O22CO9、二氧化碳经过灼热碳层:C+CO 22CO10、一氧化碳在氧气中焚烧:2CO+O 22CO211、二氧化碳和水反响(二氧化碳通入紫色石蕊试液): CO2+H 2O==H 2CO312、生石灰溶于水: CaO+H 2O==Ca(OH) 213、无水硫酸铜作干燥剂:CuSO4+5H 2O==CuSO 4·5H 2O14、钠在氯气中焚烧: 2Na+Cl 22NaCl分解反响15、实验室用双氧水制氧气: 2H 2O22H2 O+O2↑16、加热高锰酸钾: 2KMnO4K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O2H2↑ +O2↑18、碳酸不稳固而分解:H2CO3==H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法): CaCO3CaO+CO2↑置换反响20、铁和硫酸铜溶液反响:Fe+CuSO4==FeSO4+Cu21、锌和稀硫酸反响(实验室制氢气):Zn+H2SO4==ZnSO4+H2↑22、镁和稀盐酸反响:Mg+2HCl==MgCl2+H2 ↑23、氢气复原氧化铜:H2+CuO Cu+H2O24、木炭复原氧化铜:C+2CuO2Cu+CO2↑25、水蒸气经过灼热碳层:H2O+C H2+CO26、焦炭复原氧化铁:3C+2Fe2O34Fe+3CO2↑其余27.氢氧化钠溶液与硫酸铜溶液反响:2NaOH+CuSO4==Cu(OH)2↓ +Na2SO428、甲烷在空气中焚烧:CH4+2O2CO2+2H2O29、酒精在空气中焚烧:C2H5OH+3O22CO2+3H2O30、一氧化碳复原氧化铜:CO+CuO Cu+CO231、一氧化碳复原氧化铁:3CO+Fe2O32Fe+3CO232、二氧化碳经过澄清石灰水(查验二氧化碳):Ca(OH)2+CO2==CaCO3↓ +H2O33、氢氧化钠和二氧化碳反响(除掉二氧化碳):2NaOH+CO2==Na2CO3+H2O34、石灰石(或大理石)与稀盐酸反响(二氧化碳的实验室制法):CaCO3+2HCl==CaCl2+H2O+CO2↑35、碳酸钠与浓盐酸反响(泡沫灭火器的原理): Na2CO3+2HCl==2NaCl+H2O+CO2↑一.物质与氧气的反响:⑴单质与氧气的反响:1.镁在空气中焚烧: 2Mg+O22MgO2.铁在氧气中焚烧: 3Fe+2O2Fe3O43.铜在空气中受热: 2Cu+O22CuO4.铝在空气中焚烧: 4Al+3O22Al2O35.氢气中空气中焚烧:2H2+O22H2O6.红磷在空气中焚烧:4P+5O22P2O57.硫粉在空气中焚烧:S+O2SO28.碳在氧气中充足焚烧:C+O2CO29.碳在氧气中不充足焚烧: 2C+O22CO⑵化合物与氧气的反响:10. 一氧化碳在氧气中焚烧:2CO+O22CO211.甲烷在空气中焚烧:CH4+2O2CO2+2H2O12.酒精在空气中焚烧:C2H5OH+3O22CO2+3H2O二.几个分解反响:13.水在直流电的作用下分解:2H2O2H2↑ +O2↑14.加热碱式碳酸铜: Cu2(OH)2CO32CuO+H2O+CO2↑15.加热氯酸钾(有少许的二氧化锰): 2KClO32KCl+3O2 ↑16.加热高锰酸钾: 2KMnO4K2MnO4+MnO2+O2↑17.碳酸不稳固而分解:H2CO3==H2O+CO2↑18.高温煅烧石灰石: CaCO3CaO+CO2↑三.几个氧化复原反响:19.氢气复原氧化铜: H2+CuO Cu+H2O20.木炭复原氧化铜: C+2CuO2Cu+CO2↑21.焦炭复原氧化铁: 3C+2Fe2O34Fe+3CO2↑22.焦炭复原四氧化三铁:2C+Fe3O43Fe+2CO2↑23.一氧化碳复原氧化铜:CO+CuO Cu+CO224.一氧化碳复原氧化铁:3CO+Fe2O32Fe+3CO225.一氧化碳复原四氧化三铁:4CO+Fe3O43Fe+4CO2四.单质、氧化物、酸、碱、盐的互相关系⑴金属单质 + 酸 --------盐 + 氢气(置换反响)26.锌和稀硫酸 Zn+H2SO4==ZnSO4+H2↑27.铁和稀硫酸 Fe+H2SO4==FeSO4+H2↑28.镁和稀硫酸 Mg+H2SO4==MgSO4+H2↑29.铝和稀硫酸 2Al+3H2SO4==Al2(SO4)3+3H2↑30.锌和稀盐酸 Zn+2HCl==ZnCl2+H2↑31.铁和稀盐酸 Fe+2HCl==FeCl2+H2↑32.镁和稀盐酸 Mg+2HCl==MgCl2+H2 ↑33.铝和稀盐酸 2Al+6HCl==2AlCl3+3H2 ↑⑵金属单质 + 盐(溶液) ------- 另一种金属+ 另一种盐34.铁和硫酸铜溶液反响: Fe+CuSO4==FeSO4+Cu35.锌和硫酸铜溶液反响: Zn+CuSO4==ZnSO4+Cu36. 铜和硝酸汞溶液反响:Cu+Hg(NO3)2==Cu(NO3)2+Hg⑶碱性氧化物+酸 --------盐+水37.氧化铁和稀盐酸反响: Fe2O3+6HCl==2FeCl3+3H2O38.氧化铁和稀硫酸反响: Fe2O3+3H2SO4==Fe2(SO4)3+3H2O39.氧化铜和稀盐酸反响: CuO+2HCl==CuCl2+H2O40.氧化铜和稀硫酸反响: CuO+H2SO4==CuSO4+H2O41.氧化镁和稀硫酸反响: MgO+H2SO4==MgSO4+H2O42.氧化钙和稀盐酸反响: CaO+2HCl==CaCl2+H2O⑷酸性氧化物+碱 --------盐+水43.苛性钠裸露在空气中变质:2NaOH+CO2==Na2CO3+H2O 44.苛性钠汲取二氧化硫气体:2NaOH+SO2==Na2SO3+H2O 45.苛性钠汲取三氧化硫气体:2NaOH+SO3==Na2SO4+H2O 46.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓ +H2O47.消石灰汲取二氧化硫: Ca(OH)2+SO2==CaSO3↓ +H2O⑸酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反响:HCl+NaOH==NaCl+H2O49. 盐酸和氢氧化钾反响:HCl+KOH==KCl+H2O50.盐酸和氢氧化铜反响:2HCl+Cu(OH)2==CuCl2+2H2O51.盐酸和氢氧化钙反响: 2HCl+Ca(OH)2==CaCl2+2H2O52.盐酸和氢氧化铁反响: 3HCl+Fe(OH)3==FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl3+3H2O54.硫酸和烧碱反响:H2SO4+2NaOH==Na2SO4+2H2O55.硫酸和氢氧化钾反响:H2SO4+2KOH==K2SO4+2H2O56.硫酸和氢氧化铜反响:H2SO4+Cu(OH)2==CuSO4+2H2O57.硫酸和氢氧化铁反响:3H2SO4+2Fe(OH)3==Fe2(SO4)3+ 6H2O58.硝酸和烧碱反响:HNO3+NaOH==NaNO3+H2O⑹酸 + 盐 -------- 另一种酸+ 另一种盐59.大理石与稀盐酸反响:CaCO3+2HCl==CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸反响: Na2CO3+2HCl==2NaCl+H2O+CO2 ↑61.碳酸镁与稀盐酸反响: MgCO3+2HCl==MgCl2+H2O+CO2 ↑62.盐酸和硝酸银溶液反响:HCl+AgNO3==AgCl ↓ +HNO363.硫酸和碳酸钠反响:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液反响:H2SO4+BaCl2==BaSO4↓ +2HCl⑺碱 + 盐 -------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH+CuSO4==Cu(OH)2↓ +Na2SO4 66.氢氧化钠与氯化铁:3NaOH+FeCl3==Fe(OH)3 ↓ +3NaCl 67.氢氧化钠与氯化镁:2NaOH+MgCl2==Mg(OH)2↓ +2NaCl68.氢氧化钠与氯化铜: 2NaOH+CuCl2==Cu(OH)2 ↓ +2NaCl69.氢氧化钙与碳酸钠: Ca(OH)2+Na2CO3==CaCO3↓ +2NaOH⑻盐+ 盐 -----两种新盐70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl ↓ +NaNO3 71.硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓ +2NaCl五.其余反响:72.二氧化碳溶解于水:CO2+H2O==H2CO373.生石灰溶于水:CaO+H2O==Ca(OH)274.氧化钠溶于水:Na2O+H2O==2NaOH75.三氧化硫溶于水:SO3+H2O==H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O CuSO4+5H2O77.无水硫酸铜作干燥剂: CuSO4+5H2O==CuSO4· 5H2O化学方程式反响现象应用2Mg+O22MgO 强烈焚烧 .刺眼白光 .生成白色固体.放热 .产生大批白烟白色信号弹2Hg+O22HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O22CuO 红色金属变成黑色固体4Al+3O22Al2O3 银白金属变成白色固体3Fe+2O2Fe3O4 强烈焚烧、火星四射、生成黑色固体、放热C+O2CO2 强烈焚烧、白光、放热、使石灰水变污浊S+O2SO2 强烈焚烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O22H2O 淡蓝火焰、放热、生成使无水CuSO4 变蓝的液体(水)高能燃料4P+5O22P2O5 强烈焚烧、大批白烟、放热、生成白色固体证明空气中氧气含量CH4+2O22H2O+CO2蓝色火焰、放热、生成使石灰水变污浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的焚烧2C2H2+5O22H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变污浊气体和使无水 CuSO4 变蓝的液体(水)氧炔焰、焊接切割金属2KClO32KCl+3O2 ↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4K2MnO4+MnO2+O2↑紫色变成黑色、生成使带火星木条复燃的气体实验室制备氧气2HgO2Hg+O2↑红色变成银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O2H2↑ +O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO32CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变污浊气体铜绿加热NH4HCO3NH3↑ +H2O+CO2↑白色固体消逝、管壁有液体、使石灰水变污浊气体碳酸氢铵长久裸露空气中会消逝Zn+H2SO4==ZnSO4+H2↑有大批气泡产生、锌粒渐渐溶解实验室制备氢气Fe+H2SO4==FeSO4+H2↑有大批气泡产生、金属颗粒渐渐溶解Mg+H2SO4==MgSO4+H2↑有大批气泡产生、金属颗粒渐渐溶解2Al+3H2SO4==Al2(SO4)3+3H2 ↑有大批气泡产生、金属颗粒渐渐溶解Fe2O3+3H22Fe+3H2O 红色渐渐变成银白色、试管壁有液体冶炼金属、利用氢气的复原性Fe3O4+4H23Fe+4H2O 黑色渐渐变成银白色、试管壁有液体冶炼金属、利用氢气的复原性WO3+3H2W+3H2O冶炼金属钨、利用氢气的复原性MoO3+3H2Mo+3H2O 冶炼金属钼、利用氢气的复原性2Na+Cl22NaCl 强烈焚烧、黄色火焰离子化合物的形成、H2+Cl22HCl 苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓ +Na2SO4 蓝色积淀生成、上部为澄清溶液质量守恒定律实验2C+O22CO 煤炉中常有反响、空气污染物之一、煤气中毒原由2CO+O22CO2 蓝色火焰煤气焚烧C+CuO2Cu+CO2↑黑色渐渐变成红色、产生使澄清石灰水变污浊的气体冶炼金属2Fe2O3+3C4Fe+3CO2↑冶炼金属Fe3O4+2C3Fe+2CO2↑冶炼金属C+CO22COCO2+H2O==H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3CO2↑ +H2O 石蕊红色褪去Ca(OH)2+CO2==CaCO3↓ +H2O 澄清石灰水变污浊应用 CO2 查验和石灰浆粉刷墙壁CaCO3+H2O+CO2==Ca(HCO3)2 白色积淀渐渐溶解溶洞的形成,石头的风化Ca(HCO3)2CaCO3↓ +H2O+CO2↑白色积淀、产生使澄清石灰水变污浊的气体水垢形成.钟乳石的形成2NaHCO3Na2CO3+H2O+CO2↑产生使澄清石灰水变污浊的气体小苏打蒸馒头CaCO3CaO+CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl==CaCl2+H2O+CO2↑固体渐渐溶解、有使澄清石灰水变污浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4==Na2SO4+H2O+CO2↑固体渐渐溶解、有使澄清石灰水变污浊的气体泡沫灭火器原理Na2CO3+2HCl==2NaCl+H2O+CO2↑固体渐渐溶解、有使澄清石灰水变污浊的气体泡沫灭火器原理MgCO3+2HCl==MgCl2+H2O+CO2↑固体渐渐溶解、有使澄清石灰水变污浊的气体CuO+CO Cu+CO2 黑色渐渐变红色,产生使澄清石灰水变污浊的气体冶炼金属Fe2O3+3CO2Fe+3CO2 冶炼金属原理Fe3O4+4CO3Fe+4CO2 冶炼金属原理WO3+3CO W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O22CO2+4H2OC2H5OH+3O22CO2+3H2O蓝色火焰、产生使石灰水变污浊的气体、放热酒精的焚烧Fe+CuSO4==Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4==Fe+MgSO4溶液由浅绿色变成无色Cu+Hg(NO3)2==Hg+Cu(NO3)2Cu+2AgNO3==2Ag+Cu(NO3)2红色金属表面覆盖一层银白色物质镀银Zn+CuSO4==Cu+ZnSO4青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl==2FeCl3+3H2O铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl==2AlCl3+3H2O白色固体溶解Na2O+2HCl==2NaCl+H2O白色固体溶解CuO+2HCl==CuCl2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HCl==ZnCl2+H2O白色固体溶解MgO+2HCl==MgCl2+H2O白色固体溶解CaO+2HCl==CaCl2+H2O白色固体溶解NaOH+HCl==NaCl+H2O白色固体溶解Cu(OH)2+2HCl==CuCl2+2H2O蓝色固体溶解Mg(OH)2+2HCl==MgCl2+2H2O白色固体溶解Al(OH)3+3HCl==AlCl3+3H2O白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl==FeCl3+3H2O红褐色积淀溶解、溶液呈黄色Ca(OH)2+2HCl==CaCl2+2H2OHCl+AgNO3==AgCl ↓ +HNO3生成白色积淀、不溶解于稀硝酸查验 Cl —的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4==Al2(SO4)3+3H2O白色固体溶解CuO+H2SO4==CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4==ZnSO4+H2O白色固体溶解MgO+H2SO4==MgSO4+H2O白色固体溶解2NaOH+H2SO4==Na2SO4+2H2OCu(OH)2+H2SO4==CuSO4+2H2O蓝色固体溶解Ca(OH)2+H2SO4==CaSO4+2H2OMg(OH)2+H2SO4==MgSO4+2H2O白色固体溶解2Al(OH)3+3H2SO4==Al2(SO4)3+3H2O白色固体溶解2Fe(OH)3+3H2SO4==Fe2(SO4)3+3H2O 红褐色积淀溶解、溶液呈黄色Ba(OH)2+H2SO4==BaSO4↓ +2H2O生成白色积淀、不溶解于稀硝酸查验 SO42—的原理BaCl2+H2SO4 ==BaSO4↓ +2HCl 生成白色积淀、不溶解于稀硝酸查验 SO42—的原理Ba(NO3)2+H2SO4==BaSO4↓ +2HNO3 生成白色积淀、不溶解于稀硝酸查验 SO42—的原理Na2O+2HNO3==2NaNO3+H2O白色固体溶解CuO+2HNO3==Cu(NO3)2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HNO3==Zn(NO3)2+H2O白色固体溶解MgO+2HNO3==Mg(NO3)2+H2O白色固体溶解CaO+2HNO3==Ca(NO3)2+H2O白色固体溶解NaOH+HNO3==NaNO3+H2OCu(OH)2+2HNO3==Cu(NO3)2+2H2O蓝色固体溶解Mg(OH)2+2HNO3==Mg(NO3)2+2H2O白色固体溶解Al(OH)3+3HNO3==Al(NO3)3+3H2O白色固体溶解Ca(OH)2+2HNO3==Ca(NO3)2+2H2OFe(OH)3+3HNO3==Fe(NO3)3+3H2O红褐色积淀溶解、溶液呈黄色3NaOH+H3PO4==3H2O+Na3PO43NH3+H3PO4==(NH4)3PO42NaOH+CO2==Na2CO3+H2O汲取 CO、O2 、H2 中的 CO22NaOH+SO2==Na2SO3+H2O2NaOH+SO3==Na2SO4+H2O办理硫酸工厂的尾气( SO2)FeCl3+3NaOH==Fe(OH)3 ↓ +3NaCl溶液黄色褪去、有红褐色积淀生成AlCl3+3NaOH==Al(OH)3 ↓ +3NaCl有白色积淀生成MgCl2+2NaOH==Mg(OH)2↓ +2NaClCuCl2+2NaOH==Cu(OH)2 ↓ +2NaCl 溶液蓝色褪去、有蓝色积淀生成CaO+ H2O==Ca(OH)2 白色块状固体变成粉末、生石灰制备石灰浆Ca(OH)2+SO2==CaSO3↓ +H2O 有白色积淀生成初中一般不用Ca(OH)2+Na2CO3==CaCO3↓ +2NaOH 有白色积淀生成工业制烧碱、实验室制少许烧碱Ba(OH)2+Na2CO3==BaCO3↓ +2NaOH 有白色积淀生成Ca(OH)2+K2CO3==CaCO3↓ +2KOH有白色积淀生成CuSO4+5H2O==CuSO4· H2O 蓝色晶体变成白色粉末CuSO4+H2O CuSO4+5H2O白色粉末变成蓝色查验物质中能否含有水AgNO3+NaCl==AgCl ↓ +NaNO3 白色不溶解于稀硝酸的积淀(其余氯化物近似反响)应用于查验溶液中的氯离子BaCl2+Na2SO4==BaSO4↓ +2NaCl 白色不溶解于稀硝酸的积淀(其余硫酸盐近似反响)应用于查验硫酸根离子CaCl2+Na2CO3==CaCO3↓ +2NaCl 有白色积淀生成MgCl2+Ba(OH)2==BaCl2+Mg(OH)2↓有白色积淀生成CaCO3+2HCl==CaCl2+H2O+CO2↑MgCO3+2HCl==MgCl2+H 2O+ CO2↑NH4NO3+NaOH==NaNO3+NH3↑+H2O生成使润湿石蕊试纸变蓝色的气体应用于查验溶液中的铵根离子NH4Cl+KOH==KCl+NH3↑ +H2O生成使润湿石蕊试纸变蓝色的气体。
(完整版)北京初中化学方程式大全

北京初中化学方程式大全化合反应1、镁在空气中燃烧:2Mg+O22MgO2、铁在氧气中燃烧:3Fe+2O2 Fe3O43、铝在空气中燃烧:4Al+3O2 2Al2O34、氢气在空气中燃烧:2H2+O2 2H2O5、红磷在空气中燃烧:4P+5O2 2P2O56、硫粉在空气中燃烧:S+O2SO27、碳在氧气中充分燃烧:C+O2 CO28、碳在氧气中不充分燃烧:2C+O22CO9、二氧化碳通过灼热碳层:C+CO2 2CO10、一氧化碳在氧气中燃烧:2CO+O2 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O==H2CO312、生石灰溶于水:CaO+H2O==Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl22NaCl分解反应15、实验室用双氧水制氧气:2H2O22H2O+O2↑16、加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O2H2↑+O2↑18、碳酸不稳定而分解:H2CO3==H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3CaO+CO2↑置换反应20、铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4==ZnSO4+H2↑22、镁和稀盐酸反应:Mg+2HCl==MgCl2+H2↑23、氢气还原氧化铜:H2+CuO Cu+H2O24、木炭还原氧化铜:C+2CuO 2Cu+CO2↑25、水蒸气通过灼热碳层:H2O+C H2+CO26、焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑其他27.氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO428、甲烷在空气中燃烧:CH4+2O2CO2+2H2O29、酒精在空气中燃烧:C2H5OH+3O22CO2+3H2O30、一氧化碳还原氧化铜:CO+CuO Cu+CO231、一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO232、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O33、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO2==Na2CO3+H2O34、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl==CaCl2+H2O+CO2↑35、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+2HCl==2NaCl+H2O+CO2↑一.物质与氧气的反应:⑴单质与氧气的反应:1. 镁在空气中燃烧:2Mg+O22MgO2. 铁在氧气中燃烧:3Fe+2O2 Fe3O43. 铜在空气中受热:2Cu+O22CuO4. 铝在空气中燃烧:4Al+3O2 2Al2O35. 氢气中空气中燃烧:2H2+O2 2H2O6. 红磷在空气中燃烧:4P+5O22P2O57. 硫粉在空气中燃烧:S+O2 SO28. 碳在氧气中充分燃烧:C+O2 CO29. 碳在氧气中不充分燃烧:2C+O2 2CO⑵化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2 2CO211. 甲烷在空气中燃烧:CH4+2O2 CO2+2H2O12. 酒精在空气中燃烧:C2H5OH+3O2 2CO2+3H2O 二.几个分解反应:13. 水在直流电的作用下分解:2H2O2H2↑+O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 2CuO+H2O+CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO32KCl+3O2↑16. 加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑17. 碳酸不稳定而分解:H2CO3==H2O+CO2↑18. 高温煅烧石灰石:CaCO3CaO+CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+CuO Cu+H2O20. 木炭还原氧化铜:C+2CuO2Cu+CO2↑21. 焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑22. 焦炭还原四氧化三铁:2C+Fe3O43Fe+2CO2↑23. 一氧化碳还原氧化铜:CO+CuO Cu+CO224. 一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO225. 一氧化碳还原四氧化三铁:4CO+Fe3O4 3Fe+4CO2 四.单质、氧化物、酸、碱、盐的相互关系⑴金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸Zn+H2SO4==ZnSO4+H2↑27. 铁和稀硫酸Fe+H2SO4==FeSO4+H2↑28. 镁和稀硫酸Mg+H2SO4==MgSO4+H2↑29. 铝和稀硫酸2Al+3H2SO4==Al2(SO4)3+3H2↑30. 锌和稀盐酸Zn+2HCl==ZnCl2+H2↑31. 铁和稀盐酸Fe+2HCl==FeCl2+H2↑32. 镁和稀盐酸Mg+2HCl==MgCl2+H2↑33. 铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑⑵金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu35. 锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu36. 铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg⑶碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O38. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O39. 氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O40. 氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O41. 氧化镁和稀硫酸反应:MgO+H2SO4==MgSO4+H2O42. 氧化钙和稀盐酸反应:CaO+2HCl==CaCl2+H2O⑷酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O 45.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O 46.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O47. 消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O⑸酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O49. 盐酸和氢氧化钾反应:HCl+KOH==KCl+H2O50.盐酸和氢氧化铜反应:2HCl+Cu(OH)2==CuCl2+2H2O51. 盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl2+2H2O52. 盐酸和氢氧化铁反应:3HCl+Fe(OH)3==FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl3+3H2O54.硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4+2KOH==K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2==CuSO4+2H2O57.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==Fe2(SO4)3+ 6H2O58.硝酸和烧碱反应:HNO3+NaOH==NaNO3+H2O⑹酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸反应: Na2CO3+2HCl==2NaCl+H2O+CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3+2HCl==MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+AgNO3==AgCl↓+HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl⑺碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 66.氢氧化钠与氯化铁:3NaOH+FeCl3==Fe(OH)3↓+3NaCl 67.氢氧化钠与氯化镁:2NaOH+MgCl2==Mg(OH)2↓+2NaCl68. 氢氧化钠与氯化铜:2NaOH+CuCl2==Cu(OH)2↓+2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH⑻盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO3 71.硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓+2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+H2O==H2CO373.生石灰溶于水:CaO+H2O==Ca(OH)274.氧化钠溶于水:Na2O+H2O==2NaOH75.三氧化硫溶于水:SO3+H2O==H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O CuSO4+5H2O77.无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O化学方程式反应现象应用2Mg+O2 2MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O22HgO银白液体、生成红色固体拉瓦锡实验2Cu+O22CuO红色金属变为黑色固体4Al+3O22Al2O3银白金属变为白色固体3Fe+2O2 Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热C+O2 CO2剧烈燃烧、白光、放热、使石灰水变浑浊S+O2SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 2H2O淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2 2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2 2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3 2KCl+3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgO2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO32CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3 NH3↑+H2O+CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4==ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4==FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4==MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4==Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H22Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H23Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2W+3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2Mo+3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2 2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl22HCl 苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C+O2 2CO煤炉中常见反应、空气污染物之一、煤气中毒原因2CO+O2 2CO2蓝色火焰煤气燃烧C+CuO 2Cu+CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C4Fe+3CO2↑冶炼金属Fe3O4+2C 3Fe+2CO2↑冶炼金属C+CO22COCO2+H2O==H2CO3碳酸使石蕊变红证明碳酸的酸性H2CO3 CO2↑+H2O石蕊红色褪去Ca(OH)2+CO2==CaCO3↓+H2O澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2==Ca(HCO3)2白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2CaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3Na2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 CaO+CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl==CaCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4==Na2SO4+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl==2NaCl+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl==MgCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO+CO Cu+CO2黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO2Fe+3CO2冶炼金属原理Fe3O4+4CO3Fe+4CO2冶炼金属原理WO3+3CO W+3CO2冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2 2CO2+4H2OC2H5OH+3O2 2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4==Cu+FeSO4银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4==Fe+MgSO4溶液由浅绿色变为无色Cu+Hg(NO3)2==Hg+Cu(NO3)2Cu+2AgNO3==2Ag+Cu(NO3)2红色金属表面覆盖一层银白色物质镀银Zn+CuSO4==Cu+ZnSO4青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl==2FeCl3+3H2O铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl==2AlCl3+3H2O白色固体溶解Na2O+2HCl==2NaCl+H2O白色固体溶解CuO+2HCl==CuCl2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HCl==ZnCl2+H2O白色固体溶解MgO+2HCl==MgCl2+H2O白色固体溶解CaO+2HCl==CaCl2+H2O白色固体溶解NaOH+HCl==NaCl+H2O白色固体溶解Cu(OH)2+2HCl==CuCl2+2H2O蓝色固体溶解Mg(OH)2+2HCl==MgCl2+2H2O白色固体溶解Al(OH)3+3HCl==AlCl3+3H2O白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl==FeCl3+3H2O红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl==CaCl2+2H2OHCl+AgNO3==AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4==Al2(SO4)3+3H2O白色固体溶解CuO+H2SO4==CuSO4+H2O黑色固体溶解、溶液呈蓝色ZnO+H2SO4==ZnSO4+H2O白色固体溶解MgO+H2SO4==MgSO4+H2O白色固体溶解2NaOH+H2SO4==Na2SO4+2H2OCu(OH)2+H2SO4==CuSO4+2H2O蓝色固体溶解Ca(OH)2+H2SO4==CaSO4+2H2OMg(OH)2+H2SO4==MgSO4+2H2O白色固体溶解2Al(OH)3+3H2SO4==Al2(SO4)3+3H2O白色固体溶解2Fe(OH)3+3H2SO4==Fe2(SO4)3+3H2O红褐色沉淀溶解、溶液呈黄色Ba(OH)2+H2SO4==BaSO4↓+2H2O生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+H2SO4==BaSO4↓+2HCl生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4==BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3==2NaNO3+H2O白色固体溶解CuO+2HNO3==Cu(NO3)2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HNO3==Zn(NO3)2+H2O白色固体溶解MgO+2HNO3==Mg(NO3)2+H2O白色固体溶解CaO+2HNO3==Ca(NO3)2+H2O白色固体溶解NaOH+HNO3==NaNO3+H2OCu(OH)2+2HNO3==Cu(NO3)2+2H2O蓝色固体溶解Mg(OH)2+2HNO3==Mg(NO3)2+2H2O白色固体溶解Al(OH)3+3HNO3==Al(NO3)3+3H2O白色固体溶解Ca(OH)2+2HNO3==Ca(NO3)2+2H2OFe(OH)3+3HNO3==Fe(NO3)3+3H2O红褐色沉淀溶解、溶液呈黄色3NaOH+H3PO4==3H2O+Na3PO43NH3+H3PO4==(NH4)3PO42NaOH+CO2==Na2CO3+H2O 吸收CO、O2、H2中的CO22NaOH+SO2==Na2SO3+H2O 2NaOH+SO3==Na2SO4+H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH==Fe(OH)3↓+3NaCl溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH==Al(OH)3↓+3NaCl有白色沉淀生成MgCl2+2NaOH==Mg(OH)2↓+2NaClCuCl2+2NaOH==Cu(OH)2↓+2NaCl溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O==Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2==CaSO3↓+H2O有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3==CaCO3↓+2NaOH有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3==BaCO3↓+2NaOH有白色沉淀生成Ca(OH)2+K2CO3==CaCO3↓+2KOH有白色沉淀生成CuSO4+5H2O==CuSO4·H2O蓝色晶体变为白色粉末CuSO4+H2O CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl==AgCl↓+NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2+Na2SO4==BaSO4↓+2NaCl白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3==CaCO3↓+2NaCl有白色沉淀生成MgCl2+Ba(OH)2==BaCl2+Mg(OH)2↓有白色沉淀生成CaCO3+2HCl==CaCl2+H2O+CO2↑MgCO3+2HCl==MgCl2+H2O+ CO2↑NH4NO3+NaOH==NaNO3+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+KOH==KCl+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体。
北京初中必背化学方程式

人教版九年级化学全书化学方程式一.化合反应:1. 镁在空气中燃烧:2Mg + O2 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 Fe3O43. 铜在空气中受热:2Cu + O22CuO4. 氢气中氧气中燃烧(氢气爆炸):2H2 + O2 2H2 O5. 红磷在空气中燃烧:4P + 5O2 2P2 O56. 硫粉在空气(氧气)中燃烧:S + O2 SO27. 碳在氧气中充分燃烧:C + O2 CO28. 碳在氧气中不充分燃烧:2C + O2 2CO9. 一氧化碳在氧气中燃烧:2CO + O2 2CO210. 甲烷在空气中燃烧(瓦斯爆炸):CH4 + 2O2 CO2 + 2H2 O11. 酒精在空气中燃烧:C2 H5OH + 3O2 2CO2 + 3H2 O12.二氧化碳与水反应:CO2 + H2O === H2 CO313.生石灰与水反应:CaO + H2 O === Ca(OH) 2二.几个分解反应:14. 水在直流电的作用下分解:2H2 O 2H2 ↑+ O2 ↑15. 过氧化氢的分解:2H 2O 22H 2O+O 2↑16. 加热氯酸钾(有少量的二氧化锰):2KClO32KCl + 3O2 ↑实验室制备O217. 加热高锰酸钾:2KMnO4 K2 MnO4 + MnO2 + O2 ↑18. 碳酸不稳定而分解:H2 CO3 = H2 O + CO2↑19. 高温煅烧石灰石:CaCO3CaO + CO2 ↑三.几个还原反应:20. 木炭还原氧化铜:C+ 2CuO 2Cu + CO2 ↑21 焦炭还原氧化铁:3C+ 2Fe2O34Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O43Fe + 2CO2↑23. 木炭还原二氧化碳:CO2 + C CO24. 一氧化碳还原氧化铜:CO+ CuO Cu + CO225. 一氧化碳还原氧化铁:3CO+ Fe2 O32Fe + 3CO226. 一氧化碳还原四氧化三铁:4CO+ Fe3O43Fe + 4CO2 四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)27. 锌和稀硫酸Zn + H2 SO4 = ZnSO 4+ H2 ↑28. 铁和稀硫酸Fe + H2 SO4 = FeSO4 + H2 ↑29. 镁和稀硫酸Mg + H2 SO4 = MgSO4 + H2 ↑30. 铝和稀硫酸2Al +3H2 SO4 = Al2 (SO4) 3 +3H2 ↑31. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2 ↑32. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2 ↑33. 镁和稀盐酸Mg+ 2HCl === MgCl 2 + H2↑34. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + H2↑(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐35. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu36. 铜和硝酸银溶液反应:Cu + 2AgNO3 === Cu(NO3) 2 +2 Ag (3)碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ===2 FeCl 3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2 (SO4) 3+ 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2 O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2 O(4)酸性氧化物+碱-------- 盐+ 水41.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 42.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 43.苛性钠吸收三氧化硫气体:2NaOH + SO3==== Na2SO4 + H2O 44.消石灰放在空气中变质:Ca(OH) 2 + CO2 ==== CaCO 3↓+ H2 O (5)酸+ 碱-------- 盐+ 水45.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2 O46. 盐酸和氢氧化钙反应:2HCl + Ca(OH) 2 ==== CaCl2 + 2H2 O47.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH) 3==== AlCl3 + 3H2O (6)酸+ 盐-------- 另一种酸+ 另一种盐48.大理石与稀盐酸反应:(实验室制二氧化碳)CaCO 3+ 2HCl === CaCl2 + H2 O + CO2↑49.碳酸钠与稀盐酸反应:Na2CO 3+ 2HCl === 2NaCl + H2 O + CO2 ↑50.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl === NaCl + H2 O + CO2 ↑(7)碱+ 盐-------- 另一种碱+ 另一种盐51.氢氧化钠与硫酸铜:2NaOH + CuSO4==== Cu(OH) 2↓ + Na2 SO452. 氢氧化钙与碳酸钠:Ca(OH) 2 + Na2CO3=== CaCO3↓+ 2NaOH(8)盐+ 盐----- 两种新盐53.碳酸钠溶液和氯化钙溶液:Na2CO 3+CaCl2=== CaCO3↓+ 2Na Cl。
九年级中考总复习:化学方程式汇总

化学方程式汇总一.物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2Mg+O点燃2MgO2.铁在氧气中燃烧:3Fe+点燃Fe3O 43.铜在空气中受热:2Cu+O2加热2CuO4.铝在空气中燃烧:4Al+3O点燃2Al2O 35.氢气中空气中燃烧:2H2+点燃2H2O6.红磷在空气中燃烧:4P+点燃2P2O 57.硫粉在空气中燃烧:S+O点燃SO28.碳在氧气中充分燃烧:C点燃CO29.碳在氧气中不充分燃烧:2C点燃2CO (2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O点燃2CO211.甲烷在空气中燃烧:CH4+2O点燃CO22H2O12.酒精在空气中燃烧:C2H5OH点燃2CO2+3H2O二.几个分解反应:13.水在直流电的作用下分解:2H2O通电2H2↑+O2↑14.加热碱式碳酸铜:Cu2(OH)2CO加热2CuO+H2O+CO2↑15.2KClO3==加热==2KCl+3O2↑16.加热高锰酸钾:2KMnO加热K2MnO4+MnO2+O2↑17.碳酸不稳定而分解:H232O+CO2↑18.高温煅烧石灰石:CaCO3高温CaO+CO2↑三.几个氧化还原反应:19.氢气还原氧化铜:H2+CuO加热Cu+H2O20.木炭还原氧化铜:C+高温2Cu+CO2↑21.焦炭还原氧化铁:3C+2Fe2O高温4Fe+3CO2↑22.焦炭还原四氧化三铁:2C+3高温3Fe+2CO2↑23.一氧化碳还原氧化铜:CO+CuO加热Cu+CO224.一氧化碳还原氧化铁:3CO+Fe2高温2Fe+3CO225.一氧化碳还原四氧化三铁:4CO3高温3Fe+4CO2(1)金属单质+酸--------盐+氢气(置换反应)26.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑27.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑28.镁和稀硫酸Mg+H2SO4=MgSO4+H2↑29.铝和稀硫酸2Al+3H2SO4=Al2(SO4)3+3H2↑30.锌和稀盐酸Zn+2HCl===ZnCl2+H2↑31.铁和稀盐酸Fe+2HCl===FeCl2+H2↑32.镁和稀盐酸Mg+2HCl===MgCl2+H2↑33.铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑(2)金属单质+盐(溶液)-------另一种金属+另一种盐34.铁和硫酸铜溶液反应:Fe+CuSO4===FeSO4+Cu35.锌和硫酸铜溶液反应:Zn+CuSO4===ZnSO4+Cu36.铜和硝酸汞溶液反应:Cu+Hg(NO3)2===Cu(NO3)2+Hg(3)金属氧化物+酸--------盐+水37.氧化铁和稀盐酸反应:Fe2O3+6HCl===2FeCl3+3H2O氧化亚铁和稀盐酸反应:FeO+2HCl===FeCl2+H2O38.氧化铁和稀硫酸反应:Fe2O3+3H2SO4===Fe2(SO4)3+3H2O氧化亚铁和稀硫酸反应:FeO+H2SO4===FeSO4+H2O39.氧化铜和稀盐酸反应:CuO+2HCl====CuCl2+H2O40.氧化铜和稀硫酸反应:CuO+H2SO4====CuSO4+H2O41.氧化镁和稀硫酸反应:MgO+H2SO4====MgSO4+H2O42.氧化钙和稀盐酸反应:CaO+2HCl====CaCl2+H2O(4)非金属氧化物+碱--------盐+水43.苛性钠暴露在空气中变质:2NaOH+CO2====Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH+SO2====Na2SO3+H2O45.苛性钠吸收三氧化硫气体:2NaOH+SO3====Na2SO4+H2O46.销石灰放在空气中变质:Ca(OH)2+CO2====CaCO3↓+H2O47.销石灰吸收二氧化硫:Ca(OH)2+SO2====CaSO3↓+H2O(5)酸+碱--------盐+水48.盐酸和烧碱起反应:HCl+NaOH====NaCl+H2O49. 盐酸和氢氧化钾反应:HCl+KOH====KCl+H2O50.盐酸和氢氧化铜反应:2HCl+Cu(OH)2====CuCl2+2H2O51. 盐酸和氢氧化钙反应:2HCl+Ca(OH)2====CaCl2+2H2O52. 盐酸和氢氧化铁反应:3HCl+Fe(OH)3====FeCl3+3H2O53. 氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3====AlCl3+3H2O54. 硫酸和烧碱反应:H2SO4+2NaOH====Na2SO4+2H2O55. 硫酸和氢氧化钾反应:H2SO4+2KOH====K2SO4+2H2O56. 硫酸和氢氧化铜反应:H2SO4+Cu(OH)2====CuSO4+2H2O57. 硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3====Fe2(SO4)3+6H2O58. 硝酸和烧碱反应:HNO3+NaOH====NaNO3+H2O(6)酸+盐--------另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3+2HCl===CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸反应:Na2CO3+2HCl===2NaCl+H2O+CO2↑61.碳酸镁与稀盐酸反应:MgCO3+2HCl===MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+AgNO3===AgCl↓+HNO363. 硫酸和碳酸钠反应:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑64. 硫酸和氯化钡溶液反应:H2SO4+BaCl2====BaSO4↓+2HCl(7)碱+盐--------另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH+CuSO4====Cu(OH)2↓+Na2SO466.氢氧化钠与氯化铁:3NaOH+FeCl3====Fe(OH)3↓+3NaCl67.氢氧化钠与氯化镁:2NaOH+MgCl2====Mg(OH)2↓+2NaCl68. 氢氧化钠与氯化铜:2NaOH+CuCl2====Cu(OH)2↓+2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3===CaCO3↓+2NaOH(8)盐+盐-----两种新盐70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3====AgCl↓+NaNO371.硫酸钠和氯化钡:Na2SO4+BaCl2====BaSO4↓+2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+H2O===H2CO373.生石灰溶于水:CaO+H2O===Ca(OH)274.氧化钠溶于水:Na2O+H2O====2NaOH75.三氧化硫溶于水:SO3+H2O====H2SO476. 二氧化硫溶于水:SO2+H2O====H2SO3。
中考必考初中化学方程式

中考必考初中化学方程式中考必考的初中化学方程式包括:1. 镁与氧气反应:2Mg + O2 点燃2MgO。
2. 铁与氧气反应:3Fe + 2O2 点燃Fe3O4。
3. 铜与氧气反应:2Cu + O2 加热2CuO。
4. 铝与氧气反应:4Al + 3O2 点燃2Al2O3。
5. 氢气与氧气反应:2H2 + O2 点燃2H2O。
6. 红磷与氧气反应:4P + 5O2 点燃2P2O5。
7. 硫粉与氧气反应:S + O2 点燃SO2。
8. 碳与氧气反应:C + O2 点燃CO2。
9. 一氧化碳与氧气反应:2CO + O2 点燃2CO2。
10. 一氧化碳与甲烷反应:CH4 + 2O2 点燃CO2 + 2H2O。
11. 一氧化碳与水反应:CO + H2O = H2 + CO2。
12. 一氧化碳还原氧化铁反应:3CO + Fe2O3 高温2Fe +3CO2。
13. 一氧化碳还原氧化铜反应:CuO + CO(高温)= Cu + CO2。
14. 一氧化碳还原四氧化三铁反应:Fe3O4 + 4CO(高温)= 3Fe + 4CO2。
15. 一氧化碳还原氧化亚铁反应:FeO + CO(高温)= Fe + CO2。
16. 一氧化碳还原二氧化锰反应:MnO2+4CO(高温)\textsuperscript{催化剂} Mn+4CO2。
17. 水在直流电的作用下分解:2H2O通电2H2↑+ O2 ↑。
18. 高锰酸钾制氧气:2KMnO4加热K2MnO4+ MnO2+ O2↑。
19. 过氧化氢制氧气:2H2O2(MnO2) = 2H2O+ O2↑。
这些方程式都是初中化学的重要知识点,也是中考必考的考点,需要同学们熟练掌握。
2023年北京市中考化学总复习:化学反应方程式(附答案解析)

2023年北京市中考化学总复习:化学反应方程式一.选择题(共20小题)1.抗击新冠病毒期间使用84消毒液进行环境消毒。
84消毒液的主要成分是次氯酸钠(NaClO),洁厕灵的主要成分是浓度较高的盐酸(HCl),二者混合使用会发生危险。
反应化学方程式为:2HCl+NaClO═NaCl+X↑+H2O,请推测X的化学式()A.HClO B.O2C.ClO D.Cl22.下列化学方程式书写正确的是()A.3CO+2Fe2O3=2Fe+3CO2B.Ca(OH)2+H2SO4=CaSO4+2H2OC.Fe2O3+2HCl=FeCl2+2H2OD.2H2O=2H2+O23.下列指定反应的化学方程式正确的是()A.实验室用双氧水制氧气:H2O2 H2↑+O2↑B.铜在潮湿的空气中生锈:2Cu+2H2O+O2═2Cu(OH)2C.用小苏打治疗胃酸过多:Na2CO3+2HCl═2NaCl+H2O+CO2↑D.用石灰石浆吸收烟气中的二氧化硫:2CaCO3+2SO2+O2═2CaSO4+2CO24.把一定质量的甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如表,下列说法中正确的是()物质甲乙丙丁反应前的物质(g)100.3 4.8 2.8反应后的物质(g) 3.2待测8 6.4A.待测值为0.6B.此反应可表示为:丙+丁→甲C.反应中甲和丁变化的质量比为1:2D.甲一定是化合物5.在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少量,0表示物质质量不变),下列说法正确的是()第1页共45页。
北京市东城区2018届初三化学中考复习化学方程式专题训练题教师版含答案
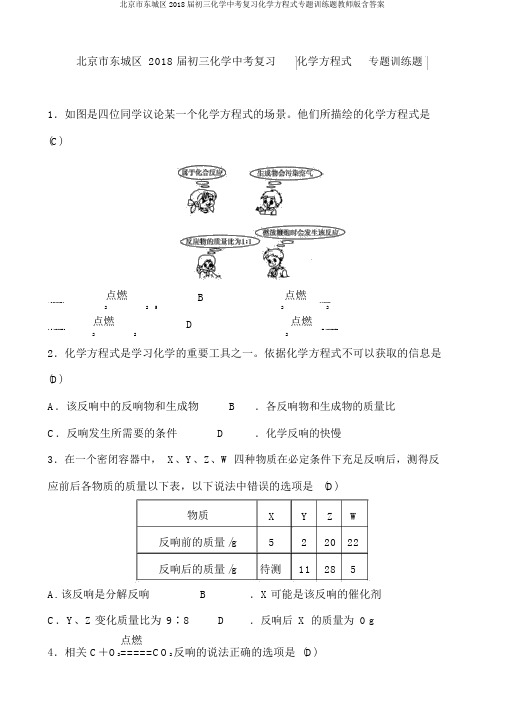
北京市东城区 2018 届初三化学中考复习化学方程式专题训练题1.如图是四位同学议论某一个化学方程式的场景。
他们所描绘的化学方程式是(C)点燃 B 点燃A.4P+5O=====2P O .C+O=====CO2 2 5 2 2点燃 D 点燃C.S+O=====SO .2H+O=====2HO2 2 22.化学方程式是学习化学的重要工具之一。
依据化学方程式不可以获取的信息是(D)A.该反响中的反响物和生成物B.各反响物和生成物的质量比C.反响发生所需要的条件D.化学反响的快慢3.在一个密闭容器中, X、Y、Z、W四种物质在必定条件下充足反响后,测得反应前后各物质的质量以下表,以下说法中错误的选项是(D)物质X Y Z W反响前的质量 /g 5 2 20 22反响后的质量 /g 待测11 28 5A. 该反响是分解反响B.X可能是该反响的催化剂C.Y、Z 变化质量比为9∶8D.反响后X的质量为0 g点燃4.相关 C+O2=====CO2反响的说法正确的选项是 (D)A.碳加氧气点燃等于二氧化碳B.一个碳原子和一个氧气分子在点燃条件下反响生成二氧化碳C.一份质量的碳和一份质量的氧气在点燃条件下反响生成一份质量的二氧化碳D.碳和氧气在点燃条件下反响生成二氧化碳5.以下化学方程式书写正确的选项是(D)A.C+O===CO B .Zn+HCl===ZnCl+HO2 2 2 2C.H2SO4+NaOH===NaSO4+H2OD△.2KMnO4=====K2MnO4+MnO2+O2↑6.铜与稀硝酸发生以下反响:3Cu+8HNO3===3Cu(NO) 2+2X↑+ 4H2 O,此中 X 的化学式为 (A)A.NO B .N2 C .NO2 D.N2O7.依据化学方程式的书写原则,剖析以下化学方程式违反了什么原则。
点燃C+O2=====CO违反了质量守恒定律。
点燃Mg+O2=====MgO2违反了客观事实。
点燃H2+O2=====H2O违反了质量守恒定律。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 1 页 共 31 页
2021年北京市中考化学总复习:化学反应方程式
一.选择题(共20小题)
1.抗击新冠病毒期间使用84消毒液进行环境消毒。
84消毒液的主要成分是次氯酸钠
(NaClO ),洁厕灵的主要成分是浓度较高的盐酸(HCl ),二者混合使用会发生危险。
反应化学方程式为:2HCl+NaClO ═NaCl+X ↑+H 2O ,请推测X 的化学式( )
A .HClO
B .O 2
C .ClO
D .Cl 2
解:由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前氢、氯、钠、氧原子个数分别为2、3、1、1,反应后的生成物中氢、氯、钠、氧原子个数分别为2、1、1、1,根据反应前后原子种类、数目不变,则每个X 分子由2个氯原子构成,则物质X 的化学式为Cl 2。
故选:D 。
2.下列化学方程式书写正确的是( )
A .3CO+2Fe 2O 3=2Fe+3CO 2
B .Ca (OH )2+H 2SO 4=CaSO 4+2H 2O
C .Fe 2O 3+2HCl =FeCl 2+2H 2O
D .2H 2O =2H 2+O 2
解:A .该反应是在高温的条件下进行的,且未配平,正确的化学方程式为
3CO+Fe 2O 3高温¯2Fe+3CO 2;
B .氢氧化钙与硫酸反应生成硫酸钙和水,化学方程式书写正确;
C .氧化铁与盐酸反应生成氯化铁和水,正确的化学方程式为Fe 2O 3+6HCl =2FeCl 3+3H 2O ;
D .水在通电的条件下分解生成氢气和氧气,正确的化学方程式为2H 2O
通电¯2H 2↑+O 2
↑。
故选:B 。
3.下列指定反应的化学方程式正确的是( )
A .实验室用双氧水制氧气:H 2O 2MnO 2¯H 2↑+O 2↑
B .铜在潮湿的空气中生锈:2Cu+2H 2O+O 2═2Cu (OH )2
C .用小苏打治疗胃酸过多:Na 2CO 3+2HCl ═2NaCl+H 2O+CO 2↑。
