2020人教版高三化学选修3电子课本课件【全册】
高中化学选修三全套共201张精品PPT课件
牢固程度 强度大,不易断 强度较小,易断
成键判断规 律
单键是σ键,双键中一个 σ键,另 一个是π键,共价三键中一个是σ键 ,另两个为π键。
共价键特征
饱和性 方向性
共价键类型
σ键
s-s s-p
头碰头
p-p 轴对称
(按电子云 重叠方式分) π键 p-p 肩并肩
d-p 镜面对称
第二课时
• 教学目标: • 1、了解键的参数,能用键能、键长、键角
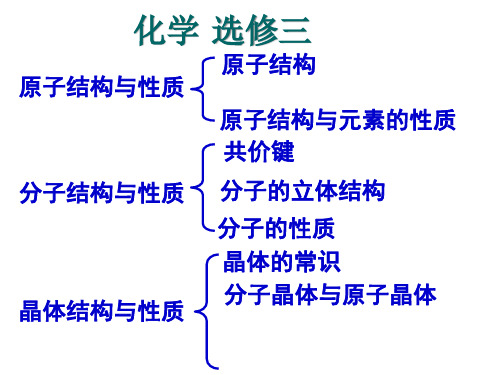
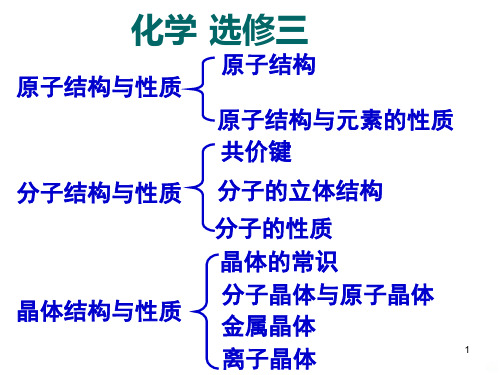
化学 选修三
原子结构 原子结构与性质
原子结构与元素的性质 共价键
分子结构与性质 分子的立体结构
晶体结构与性质
分子的性质 晶体的常识 分子晶体与原子晶体
第一章 原子的结构与性质
第一节 原子结构(第一课时) 高二化学组
1.进一步认识原子核外电子的分层排布 2.知道原子核外电子的能层分布及其能
量关系 3.知道原子核外电子的能级分布及其能
同周期的主族元素从左至右 金属性减弱,非金属性增强
金属性强弱的判断依据 跟水(酸)反应置换出氢的难易程度
越容易发生,金属性越强
最高价氧化物对应水化物——最高价氢氧化物 碱性强弱
最高价氢氧化物碱性越强,金属性越强
金属活动性顺序 单质与盐溶液的置换反应 普通原电池正负极
非金属性强弱的判断依据 跟氢气化合生成气态氢化物的难易程度
核素:含有一定数目质子和中子的一种原子 同位素:质子数相同中子数不同的 同一种元素的不同原子
核电荷数=核内质子数=核外电子数=原子序数
质量数A= 质子数Z+ 中子数N
一、原子结构与元素周期表 (一课时)
1、周期 元素周期表的横行
①特点 同周期元素电子层数相同 同周期元素从左至右原子依次序数递增
人教版高中化学选修三课件第1章-第1节-第1课时

●教学地位
本课时从介绍原子的诞生入手。在介绍能层、能级的概 念后,直接给出构造原理并根据构造原理进行书写简单原子 的电子排布式。因此本讲内容虽然基础,但是它是学习好选 修3内容的基础。
●新课导入建议 在初中我们已经学过初步的原子结构知识,又知道结构 决定性质,更知道化学反应中最小粒子是原子。但是你知道 原子是如何诞生的吗?
2.各能层、能级所容纳的最多电子数
根据上表可归纳出如下结论:每一个能层所容纳的电子 数最多为2n2。
下列能级表示正确(实际存在的)且最多容纳的 电子数按照从少到多的顺序排列的是( )
A.1s、2p、3d C.2s、2p、2d
B.1s、2s、3s D.3p、3d、3f
【解析】 从M层开始有d能级,即3d,不存在2d,故
【答案】 (1)H O Al S K(写元素名称也可)
(2)KAl(SO4)2·12H2O (3)1s22s22p63s23p1 (4)[Ar]4s1
净水剂
3.(高考组合题)(1)(2012·新课标全国卷)Se原子序数为 ________,其核外M层电子的排布式为________。
(2)(2011·福建高考)基态氮原子的价电子排布式是 ________。
●教学流程设计
演示结束
课标解读
重点难点
1.了解原子核外电子的运动状
态。
1.能准确把握能级分布与能
2.了解原子结构的构造原理。 量的关系。(重点)
3.知道原子核外电子的能级分 2.能用符号表示原子核外的
布,掌握基态原子核外电子 不同能级。(难点)
排布规律,能用电子排布式 3.将构造原理迁移应用到核
(3)汤姆生原子模型和卢瑟福原子模型 1897年汤姆生发现原子中存在电子以后,又于1904年提 出了一种原子模型,认为原子是一个平均分布着正电荷的粒 子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性 原子。 1911年卢瑟福在α粒子散射实验的基础上提出了“行星 系式”原子模型:“在原子的中心有一个带正电荷的核,它 的质量几乎等于原子的全部质量,电子在它的周围沿着不同 的轨道运动,就像行星环绕太阳运转一样。电子在运转时产 生的离心力和原子核对电子的吸引力达到平衡,因此电子能 够与原子核保持一定的距离,正像行星和太阳保持一定的距 离一样。原子越重,正电荷也就越大,电子数也越多。”
高中人教版化学选修3课件:第1章第1节 原子结构(53张ppt)_最新修正版

能层 一 二 三 四 五 六 七 ……
符号 _K__ _L__ M _N__ _O__ P Q ……
最多 电子
数
各能层最多容纳的电子数为 _2_n_2 ___
最新修正版
7
2.能级 (1)分类依据 根据多电子原子中同一能层电子___能__量____的不 同,将它们分成不同的能级。 (2)能级的表示方法及各能级最多容纳的电子数如 下:
最新修正版
10
三、构造原理与电子排布式 1.构造原理 (1)含义 在多电子原子中,电子在能级上的排布顺序是: 电子先排在能量_低___的能级上,然后依次排在能 量__较__高____的能级上。
最新修正版11Fra bibliotek(2)构造原理示意图
最新修正版
12
思考感悟 2.(1)“能层越大,能级的能量越高。”对吗? (2)为什么K原子的原子结构示意图不是
子
结
构
知能优化训练
最新修正版
3
课前自主学案
一、开天辟地——原子的诞生 1.原子的诞生
氢
氦
锂
最新修正版
4
2.宇宙的组成与各元素的含量
宇宙
氢H:占原子总数的88.6%两者占宇宙原子总 氦He:约为氢原子数的18 数的99.7%以上
其他90多种天然元素的原子
总数加起来不足_1_%___
最新修正版
5
3.地球的组成元素 地球上的元素绝大多数是__金__属___,__非__金__属____ (包括稀有气体)仅22种。 二、能层与能级
1.能层 (1)分类依据 根据多电子原子的核外电子的_能__量__差__异___,将核 外电子分成不同的能层。
最新修正版
6
高中化学选修三--全套课件

能层 K L
M
N
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
能级 电子 2 2 6 2 6 10 2 6 10 14
数
能层 2 8 电子
18
32
数 2n2 2n2
2n2
2n2
三、构造原理与电子排布式
1、构造原理
多电子基态原子的电子按能级交错的形式排布
电子排布顺序 1s
→ 2s → 2p → 3s → 3p → 4s → 3d → 4p → → 5s → 4d → 5p → → 6s → 4f → 5d → 6p……
第二章
分子的结构与性质
第一节 共价键 高二化学组
第一课时
• 教学目标: • 1、复习化学键的概念,能用电子式表示常
见物质的离子键或共价键的形成过程。 • 2、知道共价键的主要类型δ键和π键。 • 3、说出δ键和π键的明显差别和一般规律。
一、共价键
1、化学键及其分类
相邻原子或离子之间强烈的相互作用
σ键 按成键方式 按电子云 π键 重叠方式
极性共价键 不同原子 成键
非极性共 同种原子
价键
成键
4、σ键
定义: 两个原子轨道沿键轴方向 以“头碰头”的方式重叠
H
H
HH
HH
Cl
Cl
H
H
①类型 s-s σ键 例:H2 s-p σ键 例:HCl p-p σ键 例:Cl2
HH
Cl H
HH
②特点 头碰头 重叠程度大,稳定性高
周期序数 起始原子序数 终止原子序数 元素种类
短
一
1
2
2
周
二
3
10
人教版高中化学选修三课件第1章-第2节-第2课时

已知:一般两成键元素间电负性差值大于1.7时,形成离子 键,两成键元素间电负性差值小于1.7时,形成共价键。
试结合元素周期律知识完成下列问题: (1)根据上表给出的数据,可推知元素的电负性具有的变化规 律是________________。 (2)由上述变化规律可推知,短周期主族元素中,电负性最大 的元素是______________,电负性最小的元素是__________,由 这两种元素构成的化合物属于____________(填“离子”或“共 价”)化合物,并用电子式表示该化合物的形成过程: _______________。
④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的
范围:________<E<________。
(4)10号元素E值较大的原因是___________。
【解析】 (1)从H、Li、Na、K等可以看出,同主族元 素随元素原子序数的增大,E值变小;从H到He、Li到Ne; 从Na到Ar,均呈现明显的周期性变化。
2.电离能 (1)概念 气态电中性基态原子失去一个电子转化为 气 态基态正 离子所需要的 最低能量 叫做第一电离能。 (2)变化规律 ①同一周期从左到右:第一电离能有逐渐增大的趋势; ②同族元素从上到下第一电离能逐渐 减小 。
1.M(g) ―-―2e→- M2+(g)所需的能量是否是其第一电离能 的2倍?
空白演示
单击输入您的封面副标题
第2课时 元素周期律
教师用书独具演示
●课标要求 能说出元素电离能、电负性的涵义,能应用元素的电离 能说明元素的某些性质。
●课标解读 1.掌握元素电离能的涵义,并能应用元素的电离能说 明元素的某些性质。 2.理解电负性的涵义,并能依据电负性判断某些元素 的金属性和非金属性的强弱。
【课件】人教版高中化学选修三第一章原子结构与性质之一原子结构

选修三物质结构与性质引言世界万物本源冷热干湿水土气火古希腊吞食金石矿物,可以将金石的抗腐蚀性直接移植给人体。
——吞金可长生古中国物质的性质与变化决定了物质的组成与结构。
杜玛克(G. Domagk,1895.10.30~1964.4.24)德国病理学家,1933年将磺胺药应用于临床。
Chapter One本章内容结构洪特规则泡利原理原子光谱激发态基态能级泡利原理原子半径电离能电负性电子云和原子轨道能量最低原理构造原理原子核外电子排布元素周期律元素周期表元素周期系元素的性质原子结构原子结构与性质第一节原子结构(Section I Atomic Structure)一.开天辟地——原子的诞生1.大爆炸理论(The Big Bang Theory)比利时天文学家和宇宙学家勒梅特(Lemaitre Georges,1894.7.17~1966.6.20)1932年——宇宙大爆炸理论2.氢元素是宇宙中最丰富的元素——88.6%,氦约为氢原子数的1/8,两者约占宇宙原子总数的99.7%以上。
另外90多种天然元素——不足总数的1%。
【阅读教材】P4“科学史话”,你认为普鲁特的推理是符合逻辑的吗?【阅读教材】第一章彩图,了解人们认识原子模型的发展史。
一.开天辟地——原子的诞生3.不同时期的原子结构模型(1)古希腊原子论古希腊哲学家德谟克利特(Democritus,约公元前460 年~前370 年)原子是最小的、不可分割的物质粒子。
原子之间存在着虚空,无数原子从古以来就存在于虚空之中,既不能创生,也不能毁灭,它们在无限的虚空中运动着构成万物。
一.开天辟地——原子的诞生3.不同时期的原子结构模型(2)道尔顿原子模型(1803年)(实心球模型)道尔顿(John Dalton ,1766~1844)原子学说:①原子在一切化学变化中不可再分,并保持自己的独特性质。
②同一元素所有原子的质量、性质都完全相同。
③不同元素的原子质量和性质各不相同。
高中化学选修三全套共张PPT课件
处于一定空间运动状态的电子在原子核外空间
的概率密度分布的形象化描述
小黑点:概率密度
单位体积内出现的概率
小黑点越密概率密度越大
小黑点不是电子!
23
②电子云轮廓图
电子出现的概率约为90%的空间
即精简版电子云
③电子云轮廓图特点
a.形状
ns能级的电子云轮廓图:球形
np能级的电子云轮廓图:双纺锤形
nd能级的电子云轮廓图:多纺锤形
能级符号:ns、np、nd、nf…… n代表能层
最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一
K
二
L
三
M
四……
N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
14
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f……
能层中能级的数量不超过能层的序数
2、电离能
①第一电离能
气态电中性基态原子失去一个电子转
化为气态基态正离子所需最低能量
同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
②逐级电离能
利用逐级电离能判断化合价
43
3、电负性(第三课时)
键合电子:参与化学键形成
原子的价电子
孤对电子:未参与化学键形成
①电负性
不同元素的原子对键合电子吸引能力
②特点
头碰头
重叠程度大,稳定性高
轴对称
可绕键轴旋转
H
Cl
s-p σ键
H
H
56
5、π键
定义:两个原子轨道以平行
即“肩并肩”方式重叠
人教版高中化学选修3 物质结构与性质 第一章 第一节 原子结构(第1课时)精品PPT课件

开天辟地—原子的诞生
质子(正电) 原子核 原子 (正电) 中子(不带电) 不显 电性 核外电子 分层排布 (负电) 与物质化学性质密切相关
2020/10/26
18
能层与能级
二、能层与能级
(1)能层
在多电子的原子核外电子的能量是不同的, 按电子的能量差异,可以将核外电子分成不 同的能层。
2020/10/26
开天辟地—原子的诞生
问题:宇宙大爆炸是怎么回事?物质是由原子构成的,那 么原子是怎样诞生的呢? P4
1932年勒梅特首次提出了现代大爆炸宇宙理论
宇宙大爆炸
2h后 诞生
大量的氢 大量的氦 极少量的锂
原子核的 熔合反应
合成
其他元素
2020/10/26
4
开天辟地—原子的诞生
一、开天辟地—原子的诞生
思考与交流 阅读课本P4
2020/10/26
5
开天辟地—原子的诞生
人类认识原子的过程
人类在认识自然的过 程中,经历了无数的艰 辛,正是因为有了无数 的探索者,才使人类对 事物的认识一步步地走 向深入,也越来越接近 事物的本质。随着现代 科学技术的发展,我们 现在所学习的科学理论, 还会随着人类对客观事 物的认识而不断地深入 和发展。
19
能层与能级
核外电子分层排布
依据核外电子的能量不同:
离核远近:近
远
能量高低:低
高
1
2
3
4
5
6
7
K
L
M
N
O
P
Q
2020/10/26
20
能层与能级
原子核外电子分层排布规律:
(1)各能层最多能容纳2n2个电子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
பைடு நூலகம்
归纳与整理 复习题
2020人教版高三化学选修3电子课 本课件【全册】
2020人教版高三化学选修3电子 课本课件【全册】目录
0002页 0236页 0238页 0347页 0428页 0564页 0652页
第一章 原子结构与性质 第一节 原子结构 归纳与整理 复习题 第二节 分子的立体结构 归纳与整理 复习题 第二节 分子晶体与原子晶体 第四节 离子晶体 开放性作业——元素周期表
第一章 原子结构与性质 第一 节 原子结构
2020人教版高三化学选修3电子课 本课件【全册】
第二节 原子结构与元素的性质
