常见氧化剂
常见氧化剂还原剂和催化剂的应用
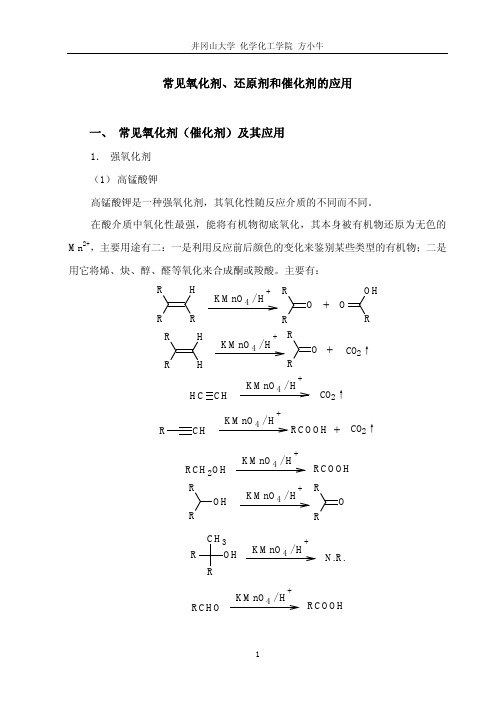
常见氧化剂、还原剂和催化剂的应用一、 常见氧化剂(催化剂)及其应用1. 强氧化剂 (1) 高锰酸钾高锰酸钾是一种强氧化剂,其氧化性随反应介质的不同而不同。
在酸介质中氧化性最强,能将有机物彻底氧化,其本身被有机物还原为无色的Mn 2+,主要用途有二:一是利用反应前后颜色的变化来鉴别某些类型的有机物;二是用它将烯、炔、醇、醛等氧化来合成酮或羧酸。
主要有:R H KMnO 4 / H+OROR OH+ R RHH KMnO 4 / H++O RRCO 2↑KMnO 4 / H+C H CH CO 2↑KMnO 4 / H++CHRCO 2↑RCOOHKMnO 4 / H+RCOOHRCH 2OHOH RRKMnO 4 / H+O RROHRR CH 3KMnO 4 / H+N.R.KMnO 4 / H+RCOOH RCHOKMnO 4 / H +N.R.RCOR' KMnO 4 / H+CO 2↑COOH COOH高锰酸钾在中性或碱性介质中的氧化性稍弱,在控制条件下可以将 π 键氧化而不断裂 σ 键,主要用于从烯烃制备邻二醇(反应的立体化学特征是顺式加成)。
四氧化锇的作用与此类似。
OO MnO(2) 重铬酸钾K 2Cr 2O 7 / H 2SO 4溶液的氧化性能与KMnO 4 / H +相似,用途也相似。
除用以氧化醇、醛等含氧衍生物外,主要用于将芳环氧化成醌。
如:O OCrO 3-H 2SO 4CrO 3-H 2SO 4OOK 2Cr 2O 7 / H 2SO 4RCH 2OHRCHO 边氧化边蒸馏(3) 稀硝酸稀硝酸具有强氧化性,它可以将芳环的侧链氧化和将醇氧化,如:Ar-CH 3Ar-COOH 稀HNO 3稀HNO 3OHO△HO 2C-(CH 2)4-CO 2H2. 温和氧化剂 (1) 二氧化锰MnO 2-H 2SO 4是一种中强氧化剂,可将甲苯氧化成苯甲醛:C 6H 5-CH 3C 6H 5-CHOMnO 2-H 2SO 4活性MnO 2则是一种温和的氧化剂,能将烯丙式醇氧化成醛而不影响C=C 双键:CH 3CH 3CH 3CHOMnO 2石油醚(2) 三氧化铬-吡啶络合物三氧化铬-吡啶络合物(CrO 3-C 5H 5N )又称为Sarett 试剂,是一种温和的氧化剂,能将醇(尤其是烯丙式的)氧化成为醛,而不影响其它基团。
常见的氧化剂和还原剂

常见的氧化剂和还原剂在化学反应中,氧化剂和还原剂是两种常见的重要概念。
氧化剂可以接受电子,使得其他物质失去电子而被氧化,还原剂则相反,它们可以提供电子,使得其他物质接受电子而被还原。
在本文中,我们将介绍一些常见的氧化剂和还原剂。
氧化剂氧气氧气是最常见的氧化剂之一,它可以参与许多氧化反应。
例如,在可燃物燃烧时,氧气就是典型的氧化剂。
氧气也可以氧化一些金属和非金属物质,使它们失去电子。
由于氧气极易与其它物质反应,加热或提高压力可以促进其反应活性。
高锰酸钾高锰酸钾(KMnO4)是一种强氧化剂,可以参与许多氧化反应,常用于工业和化学实验室中。
它可以氧化有机物和无机物,包括金属离子和离子化合物。
在有机化学中,高锰酸钾也被用于氧化剂。
双氧水双氧水(H2O2)是一种弱氧化剂,在化学反应中被广泛使用。
它可以将一些有机物转化为更易于处理的化合物,并且常用于消毒和漂白。
双氧水也可以用作氧化铁和氧化锰的原料,以及化学合成过程中的还原剂。
还原剂金属在化学反应中,金属是最常见的还原剂之一,由于其外层电子结构的特殊性质,金属具有提供电子的能力。
铁和钢铁是在建筑和机械工程中常用的金属还原剂。
氢气氢气(H2)是一种常用的还原剂,主要是因为它极易与氧气反应,从而释放出大量的能量。
在一些化学反应中,两种反应要素之一是氧化剂和还原剂。
在某些情况下,氢气可以被用作还原剂,提供电子给其他物质。
亚硫酸盐亚硫酸盐是一类含有亚硫酸根离子(SO32-)的离子化合物。
它们可以提供电子给其他物质,从而发挥还原剂的作用。
关于亚硫酸盐作为还原剂的应用,最常见的例子是在染料、药物和食品加工工业中,其中亚硫酸盐可以被用作脱色剂和防腐剂。
氧化剂和还原剂在化学反应中起着重要作用。
常见的氧化剂包括氧气、高锰酸钾和双氧水。
而在还原剂方面,金属、氢气和亚硫酸盐是其中最常见的几种。
这些物质的化学特性使得它们可以用于许多不同类型的反应,并为化学工业和实验室提供了广泛的应用。
常见氧化物还原物

常见氧化物还原物
1、常见的氧化剂
(1)典型的非金属单质如F2、Cl2、O2、Br2、I2、S、Si等(其氧化性强弱与非金属活动性基本一致);
(2)含有变价元素的高价化合物,如KMnO4、KClO3、浓H2SO4、HNO3、MnO2、FeCl3等;
(3)金属阳离子如:Fe3+、Cu2+等。
2、常见的还原剂
(1)活泼的金属单质:如Na,Al,Zn,Fe等;
(2)活泼的金属氢化物:如氢化铝锂LiAlH4;
(3)某些非金属单质:如H2,C,Si等;
(4)碱金属单质:如Li,Na,K等;
(5)处于低化合价时的氧化物:如CO,SO2等。
(6)非金属氢化物:如H2S,NH3,HCl,CH4等。
(7)处于低化合价时的盐:如Na2SO3,FeSO4等。
3、氧化性、还原性强弱的比较
(1)通过化学反应比较:氧化性——氧化剂>氧化产物;还原性——还原剂>还原产物。
(2)依据反应条件:是否加热、有无催化剂、反应温度、反应物的浓度。
(3)同一种元素,一般价态越高其氧化性越强,但要注意特例。
常见的氧化剂和还原剂

常见的氧化剂和还原剂1、常见的氧化剂:(1)活泼的非金属单质(F2、CI2、B「2、丨2、Q、Q等);①(金属活动性顺序为基准)氧气与除铂、金外的其它金属均可反应。
钾、钙、钠在空气中极易和氧气反应(Na燃烧时形成过氧化物、K燃烧生成超氧化物);钾~~锡在空气中燃烧;铅~~汞在空气中不能燃烧,但加热可以反应,如铜在空气中加热生成氧化铜。
O2 可以氧化NO SO、CO Na z SQ、KI、fS、fSQ、Nf Fg+等还原性强的物质或微粒。
H t S点燃生成SO,缓慢氧化生成S单质。
亚铁盐和亚硫酸盐溶液易被氧化,所以实验中要现配现用。
②氟、氯可以氧化所有金属。
溴、碘可以氧化除铂、金金属以外的所有金属,碘与铁生成的二价的碘化亚铁Fe"。
③Cl2可以氧化N Q S、SQ、N Q SO、H2S、I —、S2—、Br —、Fe2*、NH等物质或微粒。
产物Cl2-Cl—,氧化产物化合价升至相邻价态,I T I 2(。
3 。
④B「2可以氧化Na^S、SQ、Na^SQ、H2S、I—、S2-、Fe2+、等还原性物质或微粒。
产物Br? T Br—⑤I 2可以氧化N^S、SQ、N Q SQ、H2S、S2—、等还原性强的物质或微粒。
产物I 2T I —CI2, Br2 , I 2 , Fe 3+在水溶液中都能把SQ2-氧化成SQ2-(2)元素处于高价时的含氧酸(硝酸、浓硫酸)①HNO可以氧化:S2―、Hi、H2S、SQ2-、HSQ-、SQ、I ―Fe2+> 一些金属单质、非金属单质等。
②浓硫酸可以氧化:H2S、HI、HBr、一些金属单质、非金属单质等。
⑶元素处于高价时盐:(KCIO3、KMnO、FeCl3)①KMn(4(H+)可以氧化:S2—、HS-、fS、SQ2 -、HSQ-、SQ、I —、Br-、Cl -、Fe2+、fQ 等。
产物KMn QH+) _ Mrf+②Fe3+可以氧化:S2-、HS-、H2S、SQ2-、HSQ—、SQ、I-、Fe、Cu Zn 等。
什么是氧化剂和还原剂?

什么是氧化剂和还原剂?一、氧化剂的定义和特点氧化剂是指能够接受电子或氧化其他物质的化学物质。
其本质是具有很强的氧化能力,能够使其他物质失去电子或与氧原子结合,从而引发化学反应。
氧化剂通常具有以下特点:1. 强氧化性:氧化剂能够提供氧原子或接受电子,使其他物质发生氧化反应。
常见的氧化剂包括高锰酸钾、过氧化氢等。
2. 毒性较大:由于其强氧化性,氧化剂对人体和环境具有较大的毒性。
因此,在使用氧化剂时需要十分小心,防止接触或吸入。
3. 易燃易爆:一些氧化剂具有易燃易爆的性质,如过氧化氢、高锰酸钾等。
在储存和使用时需要特别注意防止火灾和爆炸事故的发生。
二、还原剂的定义和特点还原剂是指能够给予电子或使其他物质发生还原反应的化学物质。
其本质是具有较强还原能力,能够使其他物质接受电子或与氢原子结合,从而引发化学反应。
还原剂通常具有以下特点:1. 易氧化:还原剂能够将电子转移给其他物质,自身被氧化。
常见的还原剂包括亚硫酸氢钠、铁粉等。
2. 燃烧性强:由于其易氧化的特性,很多还原剂具有较强的燃烧性。
因此,在使用还原剂时需要注意防止火灾和爆炸事故的发生。
3. 具有还原性:还原剂能够还原其他物质,使其失去氧原子或电子。
在很多化学反应中,还原剂被广泛应用于还原金属氧化物、还原有机化合物等。
三、氧化剂与还原剂的关系氧化剂和还原剂是化学反应中重要的概念,它们之间存在着密切的关系。
在氧化还原反应中,氧化剂接受了被氧化物质的电子,而还原剂提供了给予氧化剂的电子。
可以用下面的方程式来表示:氧化剂 + 还原剂→ 还原剂的氧化物 + 氧化剂的还原物在这个方程式中,氧化剂接受了还原剂的电子和氧原子,而还原剂给予了氧化剂一部分的电子。
四、常见的氧化剂和还原剂1. 常见的氧化剂有:高锰酸钾、过氧化氢、氯气、臭氧等。
这些物质能够与其他物质反应,使其发生氧化反应。
2. 常见的还原剂有:亚硫酸氢钠、铁粉、氢气等。
这些物质能够给予其他物质电子,使其发生还原反应。
常用氧化剂

常用氧化剂
1、硫酸:水溶液可形成硫酸H2SO4,是一种强有力的强氧化剂,热
条件下可解出大量氧气,是有效的氧化剂;
2、过氧化氢:过氧化氢水溶液是一种高效的氧化剂,弱酸性,溶解
性好,对许多金属有腐蚀作用;
3、过氧化脲:多用于热水洗碱涤毛,生物化学实验中氧化葡萄糖等;
4、过氧化钾:含有硝酸根,可以氧化有机物,强酸性,可用于脱脂、脱色;
5、氢氧化钠:含有氢氧根,熔点高,在热条件下可以转化为氢氧根,氧化能力强,常用于氧化和除色;
6、高氯酸:可以形成氯酸HClO4,有很强的氧化性,可以氧化金属
和非金属,可用于溶解碳酸钙等;
7、硝酸:可以用来溶解金属金属离子,可以用来氧化非金属,如有
机物;
8、溴水:可以溶解氢键,对有机物具有一定的氧化作用;
9、硝酸钙:含有硝酸根,具有较强的氧化作用,常用于氧化处理;
10、过氯酸钠:可以溶解非金属,如有机物,可以溶解卤素和氟素,
在热条件下,其结晶水可形成过氯酸钠,是一种有效的氧化剂。
中国药典氧化剂

中国药典氧化剂
中国药典中列举了一些常见的氧化剂,用于医药和化妆品等领域。
以下是一些常见的中国药典中列明的氧化剂:
1.双氧水(H2O2):双氧水是一种常见的氧化剂,在医疗、卫生和消毒领域被广泛使用。
它可以杀灭细菌、真菌和病毒,并用于伤口清洁、漂白等方面。
2.高锰酸钾(KMnO4):高锰酸钾是一种强氧化剂,具有消毒、氧化和漂白的功能。
它常用于皮肤感染的治疗、水质净化和工业领域的氧化反应等。
3.过氧化氢(H2O2):过氧化氢也是一种常见的氧化剂,具有强氧化性和杀菌作用。
在医疗和口腔护理中,过氧化氢常用于漂白牙齿、口腔消毒和伤口处理等。
这些氧化剂在适当的条件下可以发挥其氧化性能,但也需要谨慎使用,以避免不良反应或安全问题。
氧化剂、还原剂

典型氧化剂(可燃、助燃、爆炸、腐蚀)
(1)酸性介质氧化剂(过氧化氢、过氧乙酸、重铬酸钠、铬酸、硝酸、高锰酸钾、过硫酸铵、浓硫酸、浓硝酸)。
(2)碱性介质氧化剂(次氯酸钠、过碳酸钠、过硼酸钠、过硼酸钾)。
(3)中性氧化剂(溴、碘)。
常见的氧化剂中,氟气的氧化性最强,相应的,氟离子的还原性最弱。
凡品名中有"高"、"重"、“过”字的,如高氯酸盐、高锰酸盐、重铬酸盐,过氧化钠等,都属于此类物质。
常见的氧化剂有氧气(或空气)、氯气、重铬酸钠、重铬酸钾、高锰酸钾、硝酸等。
常见的这类物质有:氯酸盐:ClO3-;高氯酸盐:ClO4-;无机过氧化物:Na2O2、K2O2、MgO2、CaO2、BaO2、H2O2;硝酸盐:NO3-;高锰酸盐:MnO4-。
典型还原剂
活泼的金属单质:如Na,Al,Zn,Fe等.
活泼的金属氢化物:如氢化铝锂LiAlH4
某些非金属单质:如H2,C,Si等.元素(如C,S等)
碱金属单质:如Li,Na,K等
处于低化合价时的氧化物:如CO,SO2,H2O2等。
非金属氢化物:如H2S,NH3,HCl,CH4等。
处于低化合价时的盐:如Na2SO3,FeSO4等。
氯化亚锡SnCl2,草酸H2C2O4,硼氢化钾KBH4,硼氢化钠NaBH4,乙醇C2H5OH。
氧化剂与还原剂的定义和常见例子

氧化剂与还原剂的定义和常见例子氧化剂和还原剂是化学反应中常见的两类物质,它们在氧化还原反应中起着重要的作用。
本文将介绍氧化剂和还原剂的定义,并结合常见的例子进行说明。
一、氧化剂的定义和例子氧化剂是指在氧化还原反应中能够接受电子或者氢离子的物质。
它通过氧化其他物质而自身被还原。
氧化剂常以正离子形式出现,具有较强的亲电性,能够从其他物质中夺取电子。
1. 氧气(O2):氧气是最常见的氧化剂,能够参与众多氧化反应。
例如,金属在空气中氧化形成金属氧化物,如铁生锈;火焰燃烧也是氧化剂与燃料反应的结果。
2. 过氧化氢(H2O2):过氧化氢是一种强氧化剂,能够释放出氧气。
它广泛应用于消毒、漂白、医疗等领域。
例如,在伤口发生感染时,医生会使用过氧化氢溶液进行消毒。
3. 高锰酸钾(KMnO4):高锰酸钾是一种强氧化剂,呈紫红色晶体,容易分解放出氧气。
常用于化学实验中的氧化反应。
例如,它可以氧化二氧化硫(SO2)生成硫酸。
二、还原剂的定义和例子还原剂是指在氧化还原反应中能够提供电子或者氢离子的物质。
它通过失去电子而自身被氧化。
还原剂常以负离子形式出现,具有较强的亲电子性,能够向其他物质提供电子。
1. 氢气(H2):氢气是最常见的还原剂,能够与氧气反应生成水。
许多金属的提取与还原过程中也会使用氢气。
2. 硫化氢(H2S):硫化氢是一种常见的还原剂,有剧毒的气味。
例如,在贵金属的提取中,硫化氢可以与贵金属形成沉淀,从而实现分离。
3. 亚磷酸(H3PO2):亚磷酸是一种常见的还原剂,具有还原性较强。
它常用于化学合成中的还原反应,例如还原银盐制备银粉。
三、氧化还原反应中的应用氧化剂和还原剂在氧化还原反应中起着重要的作用,广泛应用于各个领域。
1. 工业领域:氧化剂和还原剂在许多工业生产过程中被广泛使用。
例如,有机合成中常使用氧化剂氧化有机物,制备目标产物。
2. 燃烧反应:燃烧是氧化剂与燃料反应的结果。
氧化剂接受燃料中的电子,使燃料发生氧化反应,产生能量和新的产物。
常见氧化剂

常见氧化剂
常见的氧化剂有氟气、氧气、氯气、重铬酸钠、重铬酸钾、高锰酸钾、硝酸等。
常见的还原剂有氯化亚锡,草酸,硼氢化钾,硼氢化钠,乙醇等。
常见的氧化剂:
(1)典型的非金属单质如F2、Cl2、O2、Br2、I2、S、Si等(其氧化性强弱与非金属活动性基本一致);
(2)含有变价元素的高价化合物,如KMnO4、KClO3、浓H2SO4、HNO3、MnO2、FeCl3等;
(3)金属阳离子如:Fe3+、Cu2+等。
常见的还原剂:
(1)、活泼的金属单质:如Na,Al,Zn,Fe等;
(2)、活泼的金属氢化物:如氢化铝锂LiAlH4;
(3)、某些非金属单质:如H2,C,Si等;
(4)、碱金属单质:如Li,Na,K等;
(5)、处于低化合价时的氧化物:如CO,SO2等。
(6)、非金属氢化物:如H2S,NH3,HCl,CH4等。
(7)、处于低化合价时的盐:如Na2SO3,FeSO4等。
高中常见氧化剂及其还原产物

高中常见氧化剂及其还原产物一、氧气(O₂)1. 还原产物。
- 在大多数反应中,氧气作为氧化剂,其还原产物为氧化物中的氧元素呈现 -2价的物质。
例如,在与金属单质反应时,与铜反应:2Cu + O_2{}{===}2CuO,还原产物为CuO。
- 当氧气与氢气反应时:2H_2+O_2{点燃}{===}2H_2O,还原产物是H_2O。
2. 原因。
- 氧气具有较强的氧化性,它在反应中容易得到电子。
氧原子最外层电子数为6,得到2个电子后达到8电子稳定结构,所以在反应中常使其他元素氧化,自身被还原为 -2价的氧化物。
二、氯气(Cl₂)1. 还原产物。
- 当氯气与金属反应时,如与铁反应:2Fe + 3Cl_2{点燃}{===}2FeCl_3,还原产物为Cl^-(在FeCl_3中以Cl^-形式存在)。
- 氯气与氢氧化钠溶液反应:Cl_2+2NaOH = NaCl + NaClO + H_2O,这里氯气既作氧化剂又作还原剂,作氧化剂时的还原产物为Cl^-(在NaCl中)。
2. 原因。
- 氯原子最外层电子数为7,它容易得到1个电子形成Cl^-,达到8电子稳定结构。
所以在反应中氯气作为氧化剂时,往往被还原为Cl^-。
三、硝酸(HNO₃)1. 还原产物。
- 浓硝酸与铜反应:Cu + 4HNO_3(浓)===Cu(NO_3)_2+2NO_2↑+2H_2O,还原产物为NO_2。
- 稀硝酸与铜反应:3Cu + 8HNO_3(稀)===3Cu(NO_3)_2+2NO↑+4H_2O,还原产物为NO。
- 当硝酸与一些活泼金属(如镁)反应时,如果硝酸很稀,还可能生成N_2O、N_2甚至NH_4^+等还原产物。
例如:4Mg +10HNO_3(极稀)===4Mg(NO_3)_2+N_2O↑+5H_2O。
2. 原因。
- 硝酸中氮元素为 + 5价,具有很强的氧化性。
在反应中,硝酸得到电子被还原,其还原产物的化合价取决于硝酸的浓度和反应条件等因素。
常见氧化剂及还原剂

常见的氧化剂和复原剂1、常见的氧化剂:活泼的非金属单质(F2、Cl2、Br2、I2、O2、O3等);①〔金属活动性顺序为基准〕氧气与除铂、金外的其它金属均可反响。
钾、钙、钠在空气中极易和氧气反响(Na燃烧时形成过氧化物、K燃烧生成超氧化物);钾~~锡在空气中燃烧;铅~~汞在空气中不能燃烧,但加热可以反响,如铜在空气中加热生成氧化铜。
O可以氧化NO、SO、CO、NaSO、KI、HS、HSO、NH、Fe2+等22232233复原性强的物质或微粒。
H2S点燃生成SO2,缓慢氧化生成S单质。
亚铁盐和亚硫酸盐溶液易被氧化,所以实验中要现配现用。
②氟、氯可以氧化所有金属。
溴、碘可以氧化除铂、金金属以外的所有金属,碘与铁生成的二价的碘化亚铁FeI2。
③Cl可以氧化NaS、SO、NaSO、HS、I―、S2―、Br―、222232Fe2+、NH等物质或微粒。
产物Cl2→Cl—,氧化产物化合价升至相3邻价态,I―→I2→IO3―。
④Br可以氧化NaS、SO、NaSO、HS、I―、S2-、Fe2+、等复原222232性物质或微粒。
产物Br2→Br—⑤I可以氧化NaS、SO、NaSO、HS、S2―、等复原性强的物22232质或微粒。
产物I2→I—Cl2,Br2,I2,Fe3+在水溶液中都能把SO32-氧化成SO42-元素处于高价时的含氧酸(硝酸、浓硫酸)①HNO可以氧化:S、HS、HS、SO、HSO、SO、I、Fe、32―2322+3一些金属单质、非金属单质等。
②浓硫酸可以氧化:H2S、HI、HBr、一些金属单质、非金属单质等。
(3)元素处于高价时盐:(KClO3、KMnO4、FeCl3)①KMnO(H+)可以氧化:S2―、HS―、HS、SO2-、HSO-、SO、I―、42332 Br-、Cl-、Fe2+、H2O2等。
产物KMnO(H4+)→Mn2+3+2―、HS、SO2-、SO、I―、Fe、②Fe可以氧化:S、HS、HSO2332Cu、Zn等。
常见的氧化剂和还原剂

常见的氧化剂和还原剂 Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998常见的氧化剂和还原剂1、常见的氧化剂:(1)活动的非金属单质(F2、Cl2、Br2、I2、O2、O3等);①氧气与除铂、金外的其它金属均可反应。
钾、钙、钠在空气中极易和氧气反应(Na燃烧时形成过氧化物、K燃烧生成超氧化物);钾―锡在空气中燃烧;铅―汞在空气中不能燃烧,但加热可以反应,如铜在空气中加热生成氧化铜。
O2可以氧化NO、SO2、CO、Na2SO3、KI、H2S、H2SO3、NH3、Fe2+ 等还原性强的物质或微粒。
H2S点燃生成SO2,缓慢氧化生成S单质。
亚铁盐和亚硫酸盐溶液易被氧化,所以实验中要现配现用。
②氟、氯可以氧化所有金属。
溴、碘可以氧化除贵金属以外的所有金属,碘与铁生成的二价的碘化亚铁。
③Cl2可以氧化Na2S、SO2、Na2SO3、 H2S 、 I―、S2―、 Br―、Fe2+、NH3等物质或微粒④Br2可以氧化Na2S、SO2、Na2SO3、H2S、I―、S2-、Fe2+、等还原性物质或微粒⑤I2可以氧化Na2S、SO2、Na2SO3、H2S 、S2―、等还原性强的物质或微粒Cl2, Br2 ,I2 ,Fe3+在水溶液中都能把SO32-氧化成SO42-(2)元素处于高价时的含氧酸(硝酸、浓硫酸)①HNO3:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Fe2+、一些金属单质、非金属单质等。
②浓硫酸: H2S、 HI、HBr、一些金属单质、非金属单质等。
(3)元素处于高价时盐:(KClO3、KMnO4、FeCl3)①KMnO4(H+):S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Br-、Cl-、Fe2+、H2O2等。
②Fe3+:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Fe、Cu、Zn等。
(4)过氧化物(H2O2、Na2O2)①H2O2:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Fe2+(5)其它(HClO)2、常见还原剂金属单质:K、Na、Mg等;非金属单质:H2、C、Si等;低价态的化合物:CO、H2S、HI、Fe2+、NH3等。
常见氧化剂和还原剂

• 元素在最低价时只具有还原性(即只能作 还原剂);
• 元素在中间价态时既可作还原剂又可作氧 化剂。
Hale Waihona Puke • 化合价:最高价=最外层电子数 最低价=最外层电子数-8 介于最低价和最高价之间为中间价 态
旧知回顾
• 氧、得、还 • (氧化剂,得电子即化合价降低,被
还原即发生还原反应。) • 还、失、氧 • (还原剂,失电子即化合价升高,被
氧化即发生氧化反应。)
• 1.常见氧化剂:O2 Cl2 浓硫酸、硝酸、高锰 酸钾、FeCl3等;
• 2.常见还原剂:活泼的金属单质,以及C、H2、 CO等。
• 3.从化合价上讲:
氧化剂

氧化剂:(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:①活泼非金属单质:如Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如浓H2SO4、HNO3、HClO等④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等还原剂:(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:①活泼金属单质:如Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;③某些非金属单质:如H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如H2S、HCl、HI、NH3等。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
∙常见的氧化剂及对应的还原产物:∙常见的还原剂及对应的氧化产物:∙∙易错易混点:(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等(3)元素化合价的变化:①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如:遇到氧化剂,碘化钾被氧化为碘单质,溶液变蓝.(1)①在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,这是因为NaClO将KI氧化生成了I2,离子方程式为ClO-+2I-+H2O═I2+Cl-+2OH-.②在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,这是因为I2被Na2SO3还原生成了I-,离子方程式是SO32-+I2+2OH-═SO42-+2I-+H2O.③对比①和②实验所得的结果,将I2、ClO-、SO2-4按氧化性由强到弱的顺序排列为ClO->I2>SO42-.(2)今有铁片、铜片,设计实验证明以下事实并写出化学反应方程式.①浓硫酸的氧化性比稀硫酸强Cu与浓H2SO4在加热时反应而与稀H2SO4在加热时不反应;Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O.②氯化铁溶液中Fe3+的氧化性比硫酸铜溶液中的Cu2+强Cu与FeCl3溶液能反应;2FeCl3+Cu═2FeCl2+CuCl2.③铁的还原性比铜强Fe能与CuSO4溶液反应置换出Cu;Fe+CuSO4═FeSO4+Cu 常见的氧化剂和还原剂别是气体)的气味,不得尝任何药品的味道。
氧化剂和还原剂的定义与举例

氧化剂和还原剂的定义与举例氧化剂和还原剂是化学反应中常见的两类物质,它们在氧化还原反应中起着重要的作用。
本文将就氧化剂和还原剂的定义进行介绍,并给出一些典型的举例。
一、氧化剂的定义与举例氧化剂是指在氧化还原反应中能够接受电子,同时使其他物质失去电子的物质。
它本身能够被还原,电荷数增加。
下面是几个典型的氧化剂的例子:1. 氧气(O2):氧气是最常见的氧化剂之一,它能够与其他物质反应,使其失去电子。
例如,氧气与铁发生反应生成氧化铁。
2. 高锰酸钾(KMnO4):高锰酸钾是一种强氧化剂,它能够接受其他物质的电子,同时自身还原成低价锰离子。
例如,高锰酸钾与二氧化硫反应生成硫酸和锰酸盐。
3. 过氧化氢(H2O2):过氧化氢是一种常见的氧化剂,它能够与其他物质发生氧化反应,自身还原成水。
例如,过氧化氢与二氧化锰反应生成水和氧气。
二、还原剂的定义与举例还原剂是指在氧化还原反应中能够提供电子,同时使其他物质得到电子的物质。
它本身能够被氧化,电荷数减少。
下面是几个典型的还原剂的例子:1. 硫化氢(H2S):硫化氢是一种常见的还原剂,它能够失去电子,同时使其他物质得到电子。
例如,硫化氢与氯气反应生成氯化氢和硫。
2. 氢气(H2):氢气是一种常见的还原剂,它能够提供电子,同时被氧化成氢离子。
例如,氢气与氯气反应生成氯化氢。
3. 亚硝酸钠(NaNO2):亚硝酸钠是一种常用的还原剂,它能够给予其他物质电子,同时自身被氧化成亚硝酸根离子。
例如,亚硝酸钠与硫酸铜反应生成亚硝酸根离子和硫酸铜。
总结:本文介绍了氧化剂和还原剂的定义与举例。
氧化剂是在氧化还原反应中接受电子的物质,能使其他物质失去电子;还原剂则是提供电子,使其他物质得到电子的物质。
它们在化学反应中发挥着重要的作用,常见的例子有氧气、高锰酸钾、过氧化氢等氧化剂,以及硫化氢、氢气、亚硝酸钠等还原剂。
通过了解氧化剂和还原剂的定义与示例,我们可以更好地理解和应用氧化还原反应。
化学反应中的氧化剂

化学反应中的氧化剂在化学反应中,氧化剂(也称作氧化剂)是指能够接受电子或者氧化其他物质的化合物或离子。
它们在化学反应中起到提供氧气或者拿走电子的作用。
在本文中,我们将探讨氧化剂在化学反应中的重要性以及一些常见的氧化剂的例子。
一、氧化剂的概念和作用氧化剂是化学反应中不可或缺的一部分。
它们通过接受或拿走电子来促进化学反应的进行。
在氧化反应中,氧化剂接受电子,从而被还原,而在还原反应中,氧化剂会拿走电子,从而被氧化。
因此,氧化剂在不同类型的反应中起到不同的作用,如促进燃烧、氧化金属或氧化有机物等。
二、常见的氧化剂及其应用1. 氧气(O2):氧气是最常见的氧化剂。
它可以与其他物质反应,产生火焰并释放能量。
也可以促进金属的氧化,例如生锈。
在许多生物过程中,氧气还作为氧化剂来支持细胞呼吸。
2. 高锰酸钾(KMnO4):高锰酸钾是一种强氧化剂,常用于化学实验室和工业生产中。
它可以与有机物发生反应,将其氧化为较高价态的产物。
同时,高锰酸钾也可用于水处理、染料制备和金属清洗等领域。
3. 双氧水(H2O2):双氧水是一种常见的氧化剂和还原剂。
它可以通过释放氧气来促进许多反应。
双氧水广泛应用于医疗、美容、清洁和环境领域。
4. 氯气(Cl2):氯气是一种强氧化剂,具有广泛的应用。
它常用于消毒、漂白和制备化学品等领域。
氯气能够与有机物发生剧烈反应,引发火灾和爆炸。
5. 过氧化氢(H2O2):过氧化氢是一种有氧化和还原性质的氧化剂。
它可以用于漂白纸浆、水处理、清洁剂制备以及医疗和卫生等领域。
三、氧化剂的安全性和环境影响氧化剂在处理过程中需要小心使用,因为它们可能对健康和环境带来危害。
例如,某些氧化剂可能产生有害的气体或腐蚀性物质。
因此,在使用氧化剂时,必须遵循正确的安全操作规程并戴上适当的防护设备。
此外,一些氧化剂可能对环境造成负面影响。
例如,排放到空气中的氧化剂可能与其他化学物质反应,生成臭氧等有害物质。
因此,在处理和运输氧化剂时,需要采取适当的措施以减少对环境的潜在风险。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化剂:O2、Cl2、Br2、I2、03
Fe3+、Cu2+、Ag+
KMn04、K2Cr2O7、KCIO3
浓H2SO4、HNO3、MnO2、H2O2
O2、Cl2、Br2、I2、O3:活泼非金属单质,常见的氧化剂。
Fe3+、Cu2+、Ag+:三个金属阳离子,它们的化合价顺序也是3、2、1。
其中,Fe3+氧化性是比较强的。
KMn04、K2Cr2O7、KCIO3:中心原子化合价比较高的盐。
浓H2SO4、HNO3:典型的强氧化性酸。
浓H2SO4具有氧化性,HNO3不论浓、稀都有氧化性。
硝酸的浓度越大,氧化性就越强。
MnO2、H2O2:氧化剂,MnO2具有很强的氧化性,H2O2也有比较强的氧化性,H2O2在通常情况下可以分解出原子态的氧。
还原剂:K、Na、Ca、Mg、Al、C、H2
Fe2+、Cu+、S2-+、I-、Br-
CO、S02、H2S、NH3、N0
K、Na、Ca、Mg、Al、C、H2:单质。
K、Na、Ca、Mg、Al:活泼金属,活泼金属容易失去电子,是典型的还原剂。
C、H2:典型的非金属,还原性很强。
(非金属可以是常见的氧化剂,也可以是常见的还原剂;金属单质都是常见的还原剂。
)
Fe2+、Cu+:金属阳离子,具有还原性。
s2-、I-、Br-:非金属的阴离子。
CO、S02、N0:氧化物,是还原剂。
H2S、NH3:非金属氢化物,是还原剂。
请同学们思考、总结一下,常见的氧化剂和还原剂分成哪些类型?
氧化剂包括五类物质:
①非金属单质;
②部分金属阳离子;
③部分高价态的盐;
④浓H2SO4、浓HN03;
⑤氧化物、MnO2和H2O2。
还原剂分为三大类六小类:
①活泼金属都是还原剂;
②部分非金属单质C、H2;
③部分金属阳离子;
④部分非金属阴离子:
⑤部分非金属氧化物;
⑥非金属氢化物,比如H2S和NH3。
5.氧化还原反应的规律
例3 亚硝酸钠(NANO2)中氮元素的化合价为+3价,为研究,亚硝酸钠的化学性质,现有以下几种试剂可供选择:
a.KMnO4溶液
b.稀H2SO4
c.稀HNO3
d.稀NaOH溶液
e.淀粉碘化钾溶液
f.品红溶液
①证明NaNO2具有氧化性应选择的试剂是__,实验现象是__,反应的离子方程式为__。
②证明NaNO2具有还原性应选择的试剂是__,实验现象是__,反应的离子方程式为__。
答案:(详见讲解视频)
①b、e,溶液呈蓝色,
②a、b,紫色褪去,
1.非金属氢化物的结构
(1) 甲烷(CH4)、硅化氢(SiH4)为正四面体非极性分子。
(2)氨气(NH3)、磷化氢(PH3)三角锥形极性分子。
(3)H2O、硫化氢(H2S)为折线形极性分子。
(4)HCl、HBr直线形极性分子。
2.化学性质
(1)酸性、碱性
①酸性:HCl、HBr、HI、HF、H2S
非金属氢化物显酸性。
比如说氯化氢(HCI)、溴化氢(HBr)、碘化氢(HI)是强酸性,硫化氢(H2S)、氟化氢(HF)是弱酸性。
②碱性:NH3、PH3
最典型的是氨(NH3),氨溶于水所形成溶液的pH值大于7,是碱性的。
磷化氢(PH3)显碱性。
二、金属的分类
1.按常见价态分类
(1)无变价金属(IA、ⅡA等)
一种情况是多数金属没有变价,化合价不发生改变。
比如碱金属:锂(L)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr),这些金属都是+1价。
碱金属是第1竖行的第1A族元素。
再比如碱土金属,元素周期表中第ⅡA族元素:铍(Be)、镁(Mg)、钙(Ca)、锶(S)、钡(Ba)、镭(Ra),化合价是+2价,没有变价的情况。
(2)变价金属(ⅣA、VA、副族、Ⅷ族)
另一种情况,相当一部分金属有变价的情况。
在主族元素当中,主要是第ⅣA族、第VA族元素有变价的情况;副族元素和第Ⅷ族元素有变价的情况。
2.按冶金工业分类
在冶金工业上,金属被分为两类,一类叫做黑色金属,一类叫做有色金属。
(1)黑色金属
铁(Fe)、铬(Cr)、锰(Mn)是黑色金属。
(2)有色金属
除了铁、铬、锰这三个元素以外的其它金属是有色金属。
3.按密度分类
金属的密度(ρ)小于4.5g/cm3,叫做轻金属;金属的密度(ρ)大于4.5g/cm3,就叫做重金属。
(1)轻金属ρ<4.5g/cm3
Na、Mg、Al是轻金属。
(2)重金属ρ>4.5g/cm3
常见的重金属有Fe、Cu。
4.按存在丰度分类
存在丰度的意思是,有一部分金属在自然界当中存在比较多,开发、应用比较广泛,特别是在我们的生活当中、在工业生产和科学中用的比较多,我们把这一类叫做常见金属。
还有一部分金属分布比较稀少,在自然界当中存在很少,我们把这一类叫做稀有金属。
(1)常见金属
Fe、Al、Cu等
(2)稀有金属
锆Z、铪Hf、铌Nb等。
