第五章 二元相图
第5章 相图

2.可逆与不可逆多晶转变
z 多晶转变相图 4个单相区
晶型II熔融曲线
晶型转变线 晶型I的升华曲线
熔体的蒸气压曲线
3相平衡点: 晶型II的升华曲线 晶型II、熔体和气相
3相平衡点: 晶型I、II和气相
z 多晶转变相图(介稳平衡态)
过热晶型I熔融曲线 过热晶型I的介稳单相区
过冷熔体的介稳单相区
硅钙石:不一致熔 各种高炉矿渣中
水泥熟料生产重要
9%体积效应
C2S:一致熔融化合物 具有复杂的多晶转变 C3S:不一致熔融化合物
2150℃ ~ 1250℃
IV. 三元系统相图
对于三元凝聚态系统, C=3,n=1(T)
相律:F = C-P + n = 4-P
Fmin = 0,Pmax = 4 Pmin = 1,Fmax = 3
z 自由度(F)
在温度、压力、组分浓度等可能影响系统平衡状态的变量中, 可以在一定范围内任意改变而不会引起旧相消失或新相产生的 独立变量数目.
z 组分及独立组分(C)
组分 系统中每个能独立分离出来,并能独立存在的化学纯物质. 独立组分 足以表示系统中各个相的组成所需的组分的最小数目.
C = 组分数-独立的化学反应数-独立的限制条件数
M’熔体的结晶路程
液相点
L M’
1
F=2
L→S F=1
3
L→S F=1
5
固相点
L→S 2
4 L→S
6S
M
⑦ 形成有限固溶体的二元相图
B在A中 形成的 固溶体
SA(B)的 溶解度 曲线
B在A中 的最大 固溶度
A在B中 的最大 固溶度
A在B中 形成的 固溶体
大学材料科学基础 第五章材料的相结构和相图(1)

弗兰克尔空位
肖脱基空位
2) 为了保持电中性,离子间数量不等的置换会 在晶体内部形成点缺陷。 如:2Ca2+→Zr4+ ,形成氧离子空缺。 3) 陶瓷化合物中存在变价离子,当其电价改变 时,也会在晶体中产生空位。 如:方铁矿中,部分Fe2+被氧化为Fe3+时, 2FeO+O → Fe2O3中,产生阳离子空缺。 同理,TiO2中,部分Ti4+被还原为Ti3+时,产 生阴离子空缺。 这种由于维持电中性而出现的空位,可以 当作电子空穴。欠缺或多出的电子具有一定的 自由活动性,因而降低了化合物的电阻。这种 现象在材料的电性能方面有重要意义。
3.陶瓷材料中的固溶方式
陶瓷材料——一般不具备金属特性,属无机非金属。 无机非金属化合物可以置换或间隙固溶的方式溶入其 它元素而形成固溶体,甚至无限固溶体,但是一般形 成有限固溶体。 如:Mg[CO3] → (Mg,Fe)[CO3] →(Fe,Mg)[CO3] →Fe[CO3] 菱镁矿 含铁菱镁矿 含镁菱铁矿 菱铁矿 不改变原来的晶格类型,晶格常数略有改变。
(3) 多为金属间或金属与类金属间的化合物, 以金属键为主,具有金属性,所以也称金属 间化合物。 (4) 晶体结构复杂。 (5) 在材料中是少数相,分布在固溶体基体 上,起到改善材料性能、强化基体的作用。 中间相可分为以下几类: 正常价化合物;电子化合物;间隙相;间隙 化合物;拓扑密堆相。
1. 正常价化合物 • 通常是由金属元素与周期表中第Ⅳ、Ⅴ、 Ⅵ族元素形成,它们具有严格的化合比, 成分固定不变,符合化合价规律,常具有 AB、AB2、A2B3分子式。 • 它的结构与相应分子式的离子化合物晶体 结构相同,如分子式具有AB型的正常价化 合物其晶体结构为NaCl型。正常价化合物 常见于陶瓷材料,多为离子化合物。如 Mg2Si、Mg2Pb、MgS、AuAl2等。 • 在合金材料中,起弥散强化的作用。
金属二元二元相图

100%
5.1.3. 相图的建立
5.1. 基本概念
5.1.3 相图的建立 可以从理论和实验两条途径获得相图 实验:测临界点 理论:热力学函数计算
测定临界点的方法:热分析、X射线、电阻法、 金相分析法、热膨胀、磁性方法等 原理:材料在到达临界点时,相关的性能或参数 有一个突变,通过测突变点来确定临界点。
5.3 共晶相图
2. 共晶成分( 61.9wt.% Sn) 在T=183oC时发生共晶转变 LE M + b N
合金中各相的相对百 分数:
% =
EN = 45.4% MN
b% =
ME = 54.6% MN
5.3.4 平衡凝固过程及组织
5.3 共晶相图
L
L
b
b
共晶组织中的II、bII,不容易在金相中被辨认
5.2
匀晶相图
5.2.3 非平衡匀晶转变
总的特点:成分不均匀 固相线偏离 易形成枝晶偏析
5.2 .3 非平衡转变
5.2
匀晶相图
1260
1240 1220 1205
固相线偏离
5.2 .3 非平衡转变
5.2
匀晶相图
先凝固的部分富Ni,不易侵蚀,呈现亮白色,成为枝干. 后凝固的部分富Cu,易被侵蚀,呈现暗黑色,分布于枝间.
第五章-I
二元相图
Binary Phase Diagram
T
米
水
基本概念- 相律、成分表示方法、相图测定、杠杆定理
匀晶
形成化合物的相图 共晶型
二 元 相 图
典型的 二元相图
共晶 包晶
包晶型
具有固态相变 两相平衡转变
材料科学基础 第5章 相 图剖析

由于 所以
dni dni
dG (i i )dni
在 相和 相处于平衡时,dG=0 ,故:
i i
即两相平衡的条件是两相中同一组元的化学 位相等。此时,在两相之间转移趋于平衡。 若多元系中有C个组元,P个相,则它们的相 平衡条件可以写成:
由热力学原理可知,当组元在不同相间转 移时,将引起体系自由能的变化。对于一个多 元系,这种自由能变化可用下式表示:
dG Vdp SdT
dn
i
i
在等温等压条件下,可简化为:
dG
dn
i
i
如果体系中只有 和 两相,当极少量(d n i)的 i 组元从 相转移到 相中,则B
Pb
10
20
30
40
50
60
70
80
90
500 400 tA 300 327.5℃ 231.9℃ M α +L 183℃ 19 α +β F Pb 10 20 30 40 50 60 70 80 90 G Sn E 61.9 L+β N β 97.5 L
200 α 100
tB
W W1 W2
2的质量 Wx W1 x1 体系中相 W21 x 体系中相 的质量 体系中物质的总质量 2
t1 t2 M R P Q
L1
L2 L E x x2 20 40 K S N B 100
由上两式可得:
体系中 相1 相 中 B2 组元的含量 B 中 组元的含量 B组元的含量
W1 (x x1 ) W2 (x 2 x)
1083
时间
Cu 0
30
实验五.二元液系相图
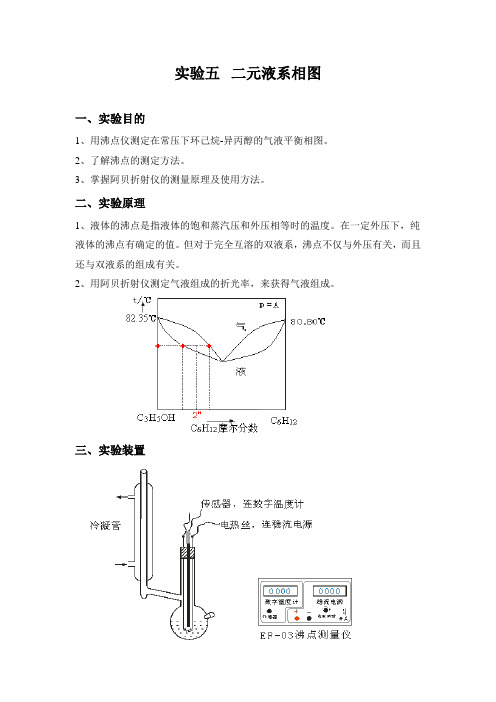
实验五二元液系相图一、实验目的1、用沸点仪测定在常压下环己烷-异丙醇的气液平衡相图。
2、了解沸点的测定方法。
3、掌握阿贝折射仪的测量原理及使用方法。
二、实验原理1、液体的沸点是指液体的饱和蒸汽压和外压相等时的温度。
在一定外压下,纯液体的沸点有确定的值。
但对于完全互溶的双液系,沸点不仅与外压有关,而且还与双液系的组成有关。
2、用阿贝折射仪测定气液组成的折光率,来获得气液组成。
三、实验装置四、仪器及试剂仪器:EF-03沸点测量仪、阿贝折射仪、沸点仪、取样管试剂:异丙醇、环己烷五、实验步骤1、配制含异丙醇约5%、10%、25%、35%、50%、75%、85%、90%、95%质量分数的环已烷溶液。
2、安装好干燥的沸点仪。
3、加入异丙醇30ml左右,盖好瓶塞,使电热丝浸入液体中,温度传感器与液面接触。
4、开冷凝水,将稳流电源调至(1.8-2.0A),接通电热丝,加热至沸腾,待数字温度计上读数恒定后,读下该温度值。
5、关闭电源,停止加热,将干燥的取样管自冷凝管上端插入冷凝液收集小槽中,取气相冷凝液样,迅速用阿贝折射仪测其折光率。
6、用干燥的小滴管取液相液样,迅速用阿贝折射仪测其折光率。
7、每份样品需读数三次,取其平均值。
实验完毕,将蒸馏器中溶液倒回原瓶。
8、同法用含有异丙醇约为5%、10%、25%、35%、50%、75%、85%、90%、95%的环已烷溶液进行实验,各次实验后的溶液均倒回原瓶中。
实验过程应注意室内气压的读数。
9、根据环己烷-异丙醇标准溶液的折射率,将上述数据转换成环己烷的摩尔分数,绘制相图。
10、实验完毕后,关闭冷凝水,关闭电源,整理实验台。
六、阿贝折光仪的使用1、用擦镜纸将镜面擦干,取样管垂直向下将样品滴加在镜面上,注意不要有气泡,然后将上棱镜合上,关上旋钮。
2、打开遮光板,合上反射镜。
3、轻轻旋转目镜,使视野最清晰。
4、旋转刻度调节手轮(下手轮),使目镜中出现明暗面(中间有色散面),图a。
材料科学基础-第五章 材料的相结构及相图

相律在相图中的应用
C
2 二元系
P 1 2
3 1
f 2 1 0
3 2 1 0
含义
单相合金,成分和温度都可变 两相平衡,成分、相对量和温度 等因素中只有一个独立变量 三相平衡,三相的成分、相对 量及温度都确定 单相合金其中两个组元的含量 及温度三个因素均可变 两相平衡,两相的成分、数量 及温度中有两个独立变量 三相平衡,所有变量中只有 一个是独立变量 四相平衡所有因素都确定不变
结构简单的具有极高的硬度及熔点,是合金工具钢和硬 质合金的重要组成相。
I. 间隙化合物
间隙化合物和间隙固溶体的异同点
相同点: 非金属原子以间隙的方式进入晶格。
不同点: 间隙化合物:间隙化合物中的金属组元大多与自 身原来的结构类型不同 间隙固溶体:间隙固溶体中的金属组元仍保持自 身的晶格结构
I. 尺寸因素
II. 晶体结构因素 组元间晶体结构相同时,固溶度一般都较大,而且有可 能形成无限固溶体。若不同只能形成有限固溶体。
III. 电负性差因素
两元素间电负性差越小,越易形成固溶体,且形成的 固溶体的溶解度越大;随两元素间电负性差增大,固 溶度减小。
1)电负性差值ΔX<0.4~0.5时,有利于形成固溶体 2)ΔX>0.4~0.5,倾向于形成稳定的化合物
Mg2Si
Mg—Si相图
(2)电子化合物
由ⅠB族或过渡金属元素与ⅡB,ⅢB,ⅣB族元素 形成的金属化合物。 不遵守化合价规律,晶格类型随化合物电子浓度 而变化。 电子浓度为3/2时: 呈体心立方结构(b相); 电子浓度为21/13时:呈复杂立方结构(g相); 电子浓度为21/12时。呈密排六方结构(e相);
NaCl型 CaF2型 闪锌矿型 硫锌矿型 (面心立方) (面心立方) (立方ZnS) (六方ZnS)
材料科学基础 第五章 5.1-5.4相图

5.2.3 杠杆定律
设成份为 X的合金的总重量为1,液相的相对重量为 QL,其 成份为 X1,固相相对重量为Qα,其成份为X2,则 :
5.2.4 相图的类型和结构 根据组元的多少,可分为单元系、二元系、三元 系 …. 相图。
二元系相图的类型有:
① 液态无限溶解,固态无限溶解 -匀晶相图; ②液态无限溶解,固态有限溶解 -共晶相图和包晶
共晶组织:共晶转变产物。(是两相混合物)
共晶合金的特殊性质: ①比纯组元熔点低,简化了熔化和铸造的操作; ②共晶合金比纯金属有更好的流动性,其在凝固之 中防止了阻碍液体流动的枝晶形成,从而改善铸造 性能; ③恒温转变(无凝固温度范围)减少了铸造缺陷, 例如偏聚和缩孔; ④共晶凝固可获得多种形态的显微组织,尤其是规 则排列的层状或杆状共晶组织可能成为优异性能的 原位复合材料(in-situ composite )。
5.2.2 相律
相律(phase rule)是表示在平衡条件下,系统的自 由度数、组元数和相数之间的关系,是系统的平 衡条件的数学表达式。 相律数学表达式:f = C – P + 2 式中 P—平衡相数 C—体系的组元数 f—体系自由度(degrees of freedom) 数 2-温度和压力 自由度数 f:是指不影响体系平衡状态的独立可 变参数(温度、压力、浓度等)的数目。 在恒压下,相律表达式: f = C – P + 1
相律的应用
① 利用它可以确定系统中可能存在的最多平衡相数 单元系,因f ≥0,故 P≤1-0+1=2,平衡相最大为二个。 注意:这并不是说,单元系中能够出现的相数不能超过二 个,而是说,某一固定 T下,单元系中不同的相只能有两 个同时存在,而其它相则在别的条件下存在。
ch5-2 二元相图

24
共晶反应要点
• 共晶转变在恒温下进行。 • 转变结果是从一种液相中结晶出两个不同的固相。 • 存在一个确定的共晶点。在该点凝固温度最低。 • 成分在共晶线范围的合金都要经历共晶转变。
材料科学基础
第5章 相 图 5.3 二元相图
主讲:徐敏虹
1
二元相图的几何规律
1.两个单相区之间必定有一个由这两个相组成的两相区,而 不能以一条线接界。两个两相区必须以单相区或三相水平线 隔开。由此可以看出二元相图中相邻相区的相数差一个(点 接触除外)。这个规律被称为相区接触法则。
2
2.在二元相图中,若是三相平衡,则三相区必为一水平线,这条
T,C
183
L
L+
L+
c
d
e
+
Pb
Sn
25
将用适当方法(如侵蚀)处理后的金 属试样的磨面或其复型或用适当方法 制成的薄膜置于光学显微镜或电子显 微镜下观察到的组织
➢ 相组成物:组成合金显微组织的基本相。
由于形成条件不同,合金中各相构成的晶粒 将以不同的数量、形状、大小和分布等相组 合,并在显微镜下可区分的部分,称为组织
1.没有共晶反应过程,
T,C
而是经过匀晶反应形成 单相固相。
L
L+
L
+ Ⅱ
2.要经过脱溶转变, 固溶体中析出另一 种固相的过程,产 物称为次生相和二 次相, Ⅱ
冷却曲线 t Ⅱ
28
29
X2合金结晶过程分析
L
二元相图【材料科学基础】

13
¾ α相: Cu-Ni合金形成的置换固溶体。 ¾ 在两相区中: 9 f =C-P+1=2-2+1= 1,两个相的成分和温度
变量中只有一个可以独立变化,其中一个固定后, 另一个也随之固定。 9 例如,温度一定,在此温度下两个平衡相成分固 定,由该温度水平线与该两相区边界线相交的两点 决定(杠杆定律)。
33
• 共晶反应:在一定的温度下,由一定成分的液相同 时结晶出成分一定且不相同的两个固相的转变过 程,也称共晶转变。其反应式为:
共晶温度
• 发生共晶反应时,根据相律 f = C – P + 1 = 2-3+1=0,所以三个相的成分不能变化,温度也 不能变化,因此共晶线为水平线,三个相在此线上 有确定的成分点。
以Cu-40%Ni合金为例
16
t0
●
t1
●
t2
●
t3
●
● ●
●
●
17
平衡结晶过程
形核和核长大
¾ 形核:过冷、结构起伏、能量起伏、成分起伏(微 小区域内成分偏离平均成分的现象)。
¾ 长大:建立平衡 界面前沿液相中溶质原子扩散 破坏平衡 晶体长大 恢复平衡 重
新建立平衡。
18
19
20
结晶特点: ¾ 结晶在一个温度范围内进行,f =1,平衡结晶过
共晶区如此。 • 组成共晶体的两相均为金属
型液固界面,两个相的长大 速度与过冷度关系的差别不 大,伪共晶区对称地扩大。
53
9 (2)伪共晶区偏向一边扩大
• 两个组元熔点差别大,共晶点偏向低熔点组元,伪共晶 区偏向高熔点组元。
第5章 二元相图与合金凝固(1-4)-二元相图分析

四、二元相图的建立
建立相图的关键是要准确地测出各成 分合金的相变临界点(临界温度)。 临界点的测试方法: 热分析法,硬度法,电阻法, 膨胀法,金相分析, X射线结构分析等。 常用热分析法:由于合金凝固时的结 晶潜热较大,结晶时冷却曲线上的转折比 较明显。
与纯金属相比,固溶 体合金凝固过程有两个特 点: (1)成份起伏。 (2)异类原子互相扩散。
(1)固溶体合金凝固时析出的固相成分与原液相成份不 同,需要成份起伏。(晶粒的形核位置是那些结构起伏、 能量起伏和成分起伏都满足要求的地方) (2)固溶体合金凝固时依赖于异类原子的互相扩散。
L 温度 成分 质量分数
α
变化趋势 成分 质量分数 变化趋势
t1 t2 t3 t4
l1 l2 l3 l4
100%
2 X0 2 l2 3 X 0 3 l3
α1 α2 α X 0 l3 3 l3
0%
100%
液固两相共存区,随着温度的降低,液相的量不断减少, 固相的量不断增多; 同时液相的成分沿液相线变化,固相成分沿固相线变化。
图 可能产生离异共晶示意图
三、包晶相图
1.相图分析
由一个液相与一个固相在恒温下生成另一个 固相的转变称为包晶转变。 两组元在液态无限溶解,在固态有限固溶, 并且发生包晶反应的相图,称为包晶相图。
L
包晶转变
• • • • • •
• • • •
点 A点 B点 C点 D点 P点 E点 线 ACB线为液相线 APDB线为固相线 CDP线是包晶转变线 ,PE线为Ag在Pt中的 固溶度曲线,DF线为 Pt在Ag中的固溶度曲 线 相区 单相区 两相区 三相线
第五章二元相图资料

[P(C 1) 2] C(P 1) C P 2
5-1 相图的基本知识
对于不含气相的凝聚态体系,压力在通常范围的变化 对平衡状态的影响极小。因此,相律可写成如下形式:
f C P 1
相律给出了平衡状态下多元多相体系中中存在的相数 与组元数及温度、压力之间的关系,对分析和研究相图具 有重要的意义。
合金如CuNi、AuAg、AuP等只发生匀晶转变,其相图
均为匀晶相图。
5-2 二元匀晶相图
临界点:a点—纯Cu的熔点 b点—纯Ni的熔点
临界线:acb线—液相线(凝固 开始线)
adb线—固相线(凝固 终了线)
相区:液相线以上为液相区, 固相线以下为固相区,而液 相线与固相线所包围的区域 为液、固两相平衡共存区。
整理可得:Q QL
wBo wB
wBL wBo
ao ob
L
o
L+
wBL wBo wB
A
wB
B
o
QL
Q
杠杆定律的力学比喻
5-2 二元匀晶相图
杠杆定律:
%
Q Qo
ao ab
wBo wBL wB wBL
100%
L%
QL Qo
ob ab
wB wB
wBO wBL
100%
L
o
L+
wBL wBo wB
wSn /%
PbSn二元共晶相图
成分为e的液相中同时凝固出成分为m的 相和成分为n的 相
Le Te (m n )
5-3 二元共晶相图
单相区:液相L相区
固相 相区
固相 相区
两相区:L + 相区
材料科学基础第五章 材料的相结构及相图

SCHOOL OF CHEMISTRY AND MATERIAL SCIENCE OF GUIZHOU NORMAL UNIVERSITY
贵州师范大学 2)尺寸因素
化学与材料科学学院
溶质原子溶入溶剂晶格会引起晶格点阵畸变,使晶体能量升高。 晶格畸变能
能量越高,晶格越不稳定。
单位体积畸变能的大小与溶质原子溶入的数量及溶质原子的相对尺寸有关:
SCHOOL OF CHEMISTRY AND MATERIAL SCIENCE OF GUIZHOU NORMAL UNIVERSITY
贵州师范大学
化学与材料科学学院
1)晶体结构因素
溶质与溶剂的晶格结构相同→固溶度大。 例如:具有面心立方结构的Mn、Co、Ni、Cu,在γ-Fe中 固溶度较大,而在α-Fe中固溶度较小。 溶质与溶剂的晶格结构相同是形成无限固溶体的必要条件。
贵州师范大学
化学与材料科学学院
1)无限固溶体
无限固溶体都是置换固溶体? 2)有限固溶体 间隙固溶体只能是有限固溶体?
SCHOOL OF CHEMISTRY AND MATERIAL SCIENCE OF GUIZHOU NORMAL UNIVERSITY
贵州师范大学
化学与材料科学学院
按溶质原子分布分类 1)有序固溶体 2)无序固溶体
贵州师范大学
化学与材料科学学院
基本概念
组元:组成材料的最基本的、独立的物质,简称元。
金属元素:Cu、Al、Fe 非金属元素:C、N、O 化合物: Al2O3, MgO, Na2O, SiO2 单一组元组成:纯金属、 Al2O3晶体等 材料: 二元合金 多组元组成,含合金 三元合金
组元:
纯元素
合金:指由两种或两种以上的金属或金属与非金属 经熔炼或其它方法制成的具有金属特性的物质。
材料科学基础第五章二元合金相图

第五章二元合金相图第一节相图的基本知识一. 相律相图:研究合金在平衡的条件下,(无限缓慢冷却)合金的状态与温度、成分间的关系的图解称为相图或平衡图。
组元:组成合金的基本物质。
包括:单个元素或金属化合物如: Fe-C合金组元Fe、Fe3CCu-Ni合金组元Cu、Ni合金系:指研究的对象。
如:Fe-C系,Pb-Sn系等。
状态:指合金在一定条件下有那几项组成,称为合金在该条件下的状态。
如:水在零度时的状态是水和冰两项共存,在零度以上为水,在零度以下为固相冰。
组织:合金中的相以不同的大小、形状、分布组成为组织。
如:珠光体是由F和Fe3C组成的组织。
(二)相律(恒压状态下)系统平衡:如果某组元在各相中的化学位相同,那么就没有物质的迁移现象,系统处于平衡状态。
相律:处于平衡状态的合金,保持相数不变的条件下,独立可变的,且影响和金状态的内、外部因素的数目。
数学表达式:f=C-P+1(恒压)f 为系统的自由度数(系统中独立可变因素);C系统的组元;P相数实例:1.纯金属—正在结晶时相数不变(P=2)f=02.二元合金--正在结晶时两相平衡,(P=2)若温度独立可变(T1 T2)则两相的成分随之变化(T1:L I αH)⑩(T2:L M αN)反之相成分独立可变,温度随之而变f=1正在结晶时三相平衡(P=3)T=T C相成分温度、均不可变f=0图5-2错误二元相图图5-1二元相图应用:(1)确定平衡系中的最大平衡相数(2)判断相图正确与否(3)分析合金的平衡结晶二、二元合金相图的表示方法横坐标表示成分A%+B%=100%纵坐标表示温度C点(表象点)成分:30%Sb,70%Bi温度:450三、二元相图的建立(Cu-Ni系以匀晶相图为例)图5-3 二元相图的表示方法(一)用热分析方法建立相图。
1)配制不同成分的合金( T mA > T Mb)(1)100%Cu,0%Ni (2)70%Cu,30%Ni (3)50%Cu,50%Ni(4)30%Cu,70%Ni (5)0%Cu,100%Ni2)熔化后作各合金的冷却曲线(T-t)3)将各T-t曲线上、下各临界点投影到温度-成分坐标系中4)连接同类型的临界点即得到Cu-Ni二元相图。
材料科学基础_第5章_二元相图

Cu
18 20
30 40
66 60 80
Ni 相对质量为1/4。溶体合金的平衡凝固及组织
➢ 平衡凝固是指凝固过程中每个阶段都能达到平衡,因此 平衡凝固是在极其缓慢的冷速下实现的。现以30%Ni和 70%Cu的铜镍合金为例来说明固溶体的平衡冷却过程及其 组织的。
11
冷却曲线 t Ⅱ
23
X2合金结晶过程分析
L
(共晶合金)
T,C
183
L
L+
L+
c
d
e
+
T,C
(+ )
围内凝固,具有变温凝固的特征 ②还需要成分起伏
15
5.3.2 二元共晶相图 两组元在液态无限互溶,固态有限溶解,通过共晶反
应形成两相机械混合物的二元合金称为二元共晶相图。共 晶反应是液相在冷却过程中同时结晶出两个结构不同的固
相的过程。 L
16
Ta,tb分别是Pb,Sn的熔点 M:锡在铅中的最大溶解度。N:铅在锡中的最大溶解度 E:为共晶点,具有该点成分的合金在恒温183℃发生共 晶转变LE→aM+ΒN,共晶转变是具有一定成分的液相在恒 温下同时转变为两个具有一定成分和结构的固相的过程。 F:室温时锡在铅中的溶解度;G:室温时铅在锡中的溶 解度
之间一定是由这两个相组成的两相区。如铁区(线)区(
第5章 二元相图与合金凝固(5-6)-复杂相图分析

0.53 0.17
1148
2.11 0.0218 0.77
727
4.3
0.0008
6.69
(3)过共析钢
过共析钢凝固过程示意图
过共析钢光学显微组织照片
0.09
1538 1495 1394
0.53 0.17
1148
2.11 0.0218 0.77
727
4.3
0.0008
6.69
(4)共晶白口铸铁
α与γ同素异构转变点(A3)
碳在δ-Fe中的最大溶解度 包晶点 Fe3C的成分
γ与δ同素异构转变点(A4) 碳在α-Fe中的最大溶解度
共析点 室温下碳在α-Fe中的溶解度
表 铁碳相图中的特征线
特性线 ABCD AHJECF HJB ECF GS ES PSK PQ 含 义
铁碳合金的液相线 铁碳合金的固相线 LB+ δ →AJ LC→AE+Fe3C共晶转变线 奥氏体转变为铁素体的开始线 碳在奥氏体中的溶解度线 As→ Fp+Fe3C 共析转变线 碳在铁素体中的溶解度线
0.53 0.17
1148
2.11 0.0218 0.77
727
4.3
0.0008
6.69
(6)过共晶白口铸铁
过共晶白口铸铁的光学显微组织照片 过共晶白口铸铁的凝固过程示意图
0.09
1538 1495 1394
0.53 0.17
1148
2.11 0.0218 0.77
727
4.3
0.0008
6.69
14950 C
恒温转变线ECF--共晶转变
LC E Fe3C
莱氏体(又称高温莱氏体)共晶反应的产物,用符号 “Ld”表示。变态莱氏体(又称低温莱氏体)是由珠光体、 二次渗碳体和共晶渗碳体组成,用符号“Ld΄”表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5-2 二元匀晶相图
固溶体的凝固过程与纯金属一样,也包括形核与长大两个阶
段。但由于存在第二组元,使其凝固过程与纯金属的凝固过程有 所不同,主要表现在:
(1) 固溶体的凝固是在一个温度范围内完成的,而纯金属的
凝固是在恒温下完成的。 (2) 固溶体凝固时所形成的固相成分与液相不同,所以形核
时除需要结构起伏和能量起伏外,还需要一定的成分起伏(液相
ae线、be线—液相线 am线、bn线—固相线 mf线—Sn在Pb中的固溶度曲线 ng线—Pb在Sn中的固溶度曲线 men水平线—共晶转变线
wSn /%
在e点对应的温度下,会由
PbSn二元共晶相图
成分为e的液相中同时凝固出成分为m的 相和成分为n的 相
Te Le ( m n )
5-3 二元共晶相图
一、相图分析
两组元在液态无限互溶、在固态有限互溶或完全不互溶, 且在冷却过程中发生共晶转变的相图,称为共晶相图。 具有共晶相图的合金系 主要有Pb-Sn、Pb-Sb、Al-Si、
AgAu、PbBi等,一些硅酸
盐也具有共晶相图。
wSn /%
PbSn二元共晶相图
5-3 二元共晶相图
dG Vdp SdT i dni
式中S和V分别为体系的熵和体积,p为压力,T为温度,
i是 i 组元的化学位,它代表体系内组元在相间转移的驱
动力,dni为 i 组元在不同相之间的转移量。 在等温等压条件下,上式可简化为:
dG i dni
5-1 相图的基本知识
假设体系中只有 和 两相,当极少量(dni)的 i 组元从 相转移到 相中,则引起的体系自由能变 化为: 实际上 故
70Ni 50Ni 30Cu Ni 30Ni 50Cu 70Cu 1452 T / C L 1452 L+ 1083 1083
Cu 温度 / C
时间
Cu
wNi / %
Ni
5-1 相图的基本知识
思考题: 1. 何谓相律?
2. 请写出不含气相的凝聚态体系中相律的
具体表达式。
5-2 二元匀晶相图
第五章 二元相图
概述
相图:描述在热力学平衡状态下,材料的相和组 织与其成分和温度之间关系的图形。
从相图中可以确定不同成分的材料在不同温度下
所含相的种类和相对数量,通过相图可以预测材料的 性能,故相图是研究新材料和制定材料的生产工艺如 熔炼、铸造、塑性加工以及热处理规范的重要工具。
5-1 相图的基本知识
L Qo,在T 温度时液相的成分为 wB 、
L wB o wB
L L+
o
w B
B
A
wB
杠杆定律的推导
质量为QL,固相 的成分为 wB、质量为Q。 显然,T 温度时液、固两相的质量和应等于合金的总质 量,即:
Qo QL Q
5-2 二元匀晶相图
L L+
o
液相中B 组元的质量应为 QL wB,
L
L wB o wB
固相中B 组元的质量应为 Q wB,合金 中B 组元的质量应为 Qo wB 。
o
w B
B
A
wB
o
o L Q w Q w Q w 故有: o B L B B
o L (QL Q ) wB QL wB Q w B
后结晶的枝间的成分不同, 称为枝晶偏析。
CuNi 合金的铸态组织 枝干富Ni(白色),枝间富Cu(黑色)
5-2 二元匀晶相图
思考题: 1. 何谓匀晶转变?何谓成分过冷?何谓晶内偏析?
何谓枝晶偏析?
2. 指出单相固溶体合金的凝固过程与纯金属(或纯 组元)的凝固过程之间的主要区别。 3. 指出单相固溶体合金的平衡凝固过程与非平衡凝 固过程之间的主要区别。
中成分不均匀的现象即称为成分起伏)。 (3) 为了满足不同温度下两相平衡共存的成分要求,液、固
两相的成分必须随温度下降而不断地发生变化,这种成分的变化
必然依赖于两组元原子的扩散来完成。
5-2 二元匀晶相图
随着固溶体凝固过程的进行,液 相的量不断减少,而固相的量则不断 增加。在液、固两相平衡共存区,两 相的相对量与它们各自的成分有关。 o w 设合金的成分为 B、总质量为
称为非平衡凝固。
5-2 二元匀晶相图
固溶体在非平衡凝固时液、固两相成分变化及组织变化示意图
5-2 二元匀晶相图
对于固溶体合金的非平衡凝固过程: (1) 固相和液相的平均成分线分别偏离平衡相图中的固 相线和液相线。冷却速度越快,偏离固、液相线越严重; 反之,冷却速度越慢,越接近固、液相线。 (2) 先凝固部分总是富含高熔点组元,后凝固部分总是
这些变量并不都是彼此独立可变的。
5-1 相图的基本知识
由相平衡条件可知,有 C ( P 1) 个方程式表明各个
组元在不同相中的化学位之间的关系,而化学位是组元 浓度的函数,因此,用来确定体系状态的总变量中应有
C ( P 1) 个成分或浓度变量不能独立变化。
显然, P (C 1) 2 个总变量中应包括独立变量和 非独立变量两部分,其中的独立变量数即称为自由度, 用 f 表示。 f = 总变量数 非独立变量数
1 1 1
P 1
2 2 2 2P
P C C C C
5-1 相图的基本知识
(二)相律 相律:平衡条件下,多元多相体系中的组元数与相数之
间存在着一定的关系,这种关系称为相律。
[ P (C 1) 2] C ( P 1) C P 2
5-1 相图的基本知识
对于不含气相的凝聚态体系,压力在通常范围的变化
对平衡状态的影响极小。因此,相律可写成如下形式:
f C P 1
相律给出了平衡状态下多元多相体系中中存在的相数
与组元数及温度、压力之间的关系,对分析和研究相图具
k0 > 1
随溶质含量增大,k01时,合金凝固开始和终了温度降低,k01时,则相反
5-2 二元匀晶相图
液-固界面前沿液相中的溶质成分分布与其决定的凝固温度
1 k0 Rx w L wo (1 e D) k0
wo
1 k0 Rx TL TA mw e D) o (1 k0
o L Q wB wB ao 整理可得: o QL wB wB ob
QL
Q
杠杆定律的力学比喻
5-2 二元匀晶相图
杠杆定律:
Q ao w w % 100% Qo ab wB w
o B L B L B O QL ob w w B L% B 100% L Qo ab wB wB
相图)和具有极大点的相图(如PbTl相图)。 成分对应于极大点和极小点的合金,其液、固两相的成分相同,此时 确定合金状态的变量数应少一个,故自由度 f = 0,即发生恒温转变。
wB / %
a 具有极小点
wB / %
b 具有极大点
其他形式的二元匀晶相图
5-2 二元匀晶相图
二、固溶体的平衡凝固
平衡凝固:凝固过程中以极缓慢的速度冷却,使每个
临界线:acb线—液相线(凝固
温度 / C
b点—纯Ni的熔点
L c d 1083
1452
b
开始线)
adb线—固相线(凝固 终了线) 相区:液相线以上为液相区, 固相线以下为固相区,而液 相线与固相线所包围的区域 为液、固两相平衡共存区。
L+
a
Cu
wNi / %
Ni
5-2 二元匀晶相图
其它形式的二元匀晶相图包括具有极小点的相图(如AuCu、FeCo
L L+
o
L wB o wB
w B
B
A
wB
% — 相的相对量;L% — L相的相对量
杠杆定律只适用于处于平衡状态的两相区,且对相的类
型不作限制。
5-2 二元匀晶相图
平衡分配系数:平衡凝固时固相溶质含量与液相溶质含量之比 w k0 s wL
L T0 L T0
S
k0 < 1 wS wo wL S wL wo wS
有重要的意义。
5-1 相图的基本知识
二、相图的表示方法
材料的状态是由成分、温度和压力决定的,但是压力
对液固相之间或固相之间的变化影响不大,而且材料的状
态变化多数是在常压下进行的,因此,研究材料的相变时 往往不考虑压力的作用。这样,影响材料状态的因素就只 有成分和温度两个参数了,所以,相图就是以材料的成分 和温度为坐标所构成的图形。
5-3 二元共晶相图
单相区:液相L相区 固相 相区 固相 相区 两相区:L + 相区 L + 相区
5-2 二元匀晶相图
m wo T TA Gx k0
成分过冷
成分过冷:液固界面前沿液相的实际温度低于由溶质分布所 决定的凝固温度时所产生的过冷。
5-2 二元匀晶相图
三、固溶体的非平衡凝固
固溶体的凝固依赖于组元原子的扩散,要达到平衡凝 固,必须有足够的时间使扩散进行充分,但在实际生产条 件下,液态材料浇铸后的冷却速度较快,在每一温度下不 能保证足够的扩散时间,从而使凝固过程偏离平衡条件,
富含低熔点组元。
(3) 非平衡凝固总是导致凝固的终了温度低于平衡凝固
时的终了温度。
5-2 二元匀晶相图
非平衡凝固的固溶体内部富含高熔点组元,而后结晶的 外部则富含低熔点组元。这种在晶粒内部出现的成分不均匀 现象,称为晶内偏析。 由于固溶体通常以树枝 状生长方式生长,故非平衡
