外源性蛋白在大肠杆菌中的高效表达
大肠杆菌中高效表达外源蛋白的策略
在大肠杆菌中高效表达外源蛋白的策略赵军侯云德(病毒基因工程国家重点实验室 100052 北京)本世纪60至70年代对大肠杆菌的研究使之成为自然界中最普遍为人们所认识的生物体。
大肠杆菌具有两个显着特征:操作简单和能在廉价的培养基中高密度培养,它的这些特征加上十多年外源基因表达的经验使其在大多数科研应用中成为高效表达异源蛋白最常用的原核表达系统。
尽管大肠杆菌有众多的优点,但并非每一种基因都能在其中有效表达。
这归因于每种基因都有其独特的结构、mRNA的稳定性和翻译效率、蛋白质折叠的难易程度、宿主细胞蛋白酶对蛋白质的降解、外源基因和E.coli在密码子利用上的主要差别以及蛋白质对宿主的潜在毒性等等。
但知识的大量积累还是有助于为表达方面某些特定的困难提供一般的解决方法。
大肠杆菌作为表达系统的主要障碍包括:不能象真核蛋白那样进行翻译后修饰、缺乏将蛋白质有效释放到培养基中的分泌机制和充分形成二硫键的能力。
另一方面,许多真核蛋白在非糖基化的形式下能保留其生物学活性,因而也就可以用大肠杆菌来表达。
如何实现外源基因在原核细胞中的有效表达,自60年代以来,对影响外源基因在其表达体系中表达效率的各个因素作了大量实验研究,并有多篇归纳性综述发表[1,2,3]。
国内针对外源基因在原核细胞中高效表达的关键因素,构建了高效表达载体[4],并在此基础上成功表达了一系列细胞因子的基因[5,6,7]。
我们在分析了国内外有关在原核系统中表达蛋白的实验资料的基础上,对在大肠杆菌中高效表达外源蛋白的策略所涉及的内容进行全面的总结,以期有助于我国在这方面的研究。
有效表达载体的构型构建表达质粒需要多种元件,需要仔细考虑它们的组合,以保证最高水平的蛋白质合成。
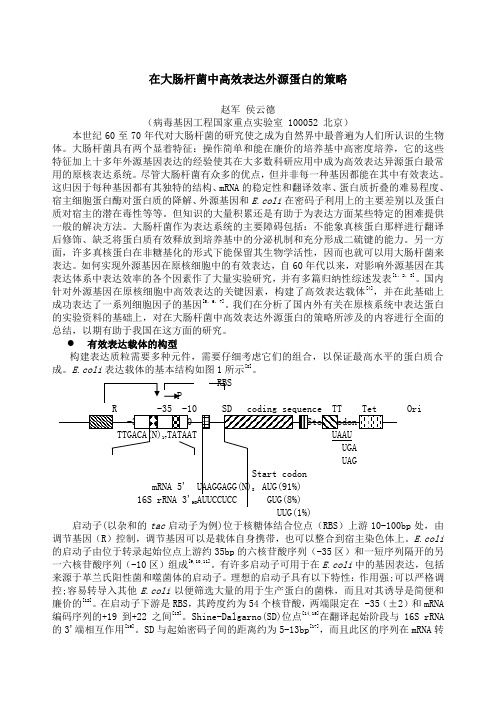
E.coli表达载体的基本结构如图1所示[8]。
RBSP启动子(以杂和的tac启动子为例)位于核糖体结合位点(RBS)上游10-100bp处,由调节基因(R)控制,调节基因可以是载体自身携带,也可以整合到宿主染色体上。
包涵体及其应对策略

包涵体及其应对策略班级:生物化工10级姓名:张义凯学号:10721718摘要:在介绍包涵体形成原因、特性及利弊的基础上,重点阐述了包涵体的避免方法及复性前准备、主要复性方法。
关键词:包涵体;形成;避免;去折叠;蛋白质复性包涵体是外源基因在原核细胞中表达时,尤其在大肠杆菌中高效表达时,形成的由膜包裹的高密度、不溶性蛋白质颗粒,在显微镜下观察时为高折射区,与胞质中其他成分有明显区别[1]。
1包涵体的发现:在基因重组技术得到迅速发展之前,研究者就已经发现,细胞内人工引入反常的蛋白质(这些蛋白质可以看作是细胞的外源蛋白质),这些蛋白质会堆积起来形成不溶的形式。
这些蛋白质聚集的形态是明显的球形,这些球形的物质全部是蛋白质,并且通过非共价键的作用力形成,必须使用变性剂如十二烷基硫酸钠(SDS)或者盐酸胍才能溶解。
自从基因工程的蛋白质在大肠杆菌表达以后,人们逐渐发现这些外源蛋白质基因在细胞中的过量表达同样形成不溶性的状态[2]。
2包涵体的形成及其性质:2.1包涵体的形成重组异源蛋白在细菌(大肠杆菌)中高效表达易形成包涵体。
此外,由高效表达质粒构建的大肠杆菌工程菌大量合成非天然的同源蛋白质,有时也可形成包涵体。
包涵体的形成有两种模式,其前体物分别为非天然态单体蛋白和寡聚蛋白质。
大量的单体蛋白经扩散后聚集在一起形成包涵体,而寡聚蛋白质则既可通过扩散也可被直接转运(依赖于微管)而形成包涵体[3,4]。
2.2包涵体形成的原因在原核表达过程中,包涵体的形成原因多且复杂,主要原因如下:外源性重组蛋白在高表达时,由于蛋白折叠辅助因子不足,在蛋白折叠之前分子间连接的疏水表面暴露在外面,导致折叠中间体大量堆积,并且这些中间体对蛋白酶的降解有抑制作用;对于大量折叠错误蛋白的出现,重组细菌体内缺乏相应的反应机制来恢复蛋白的正确折叠;促进细胞表达的蛋白多肽的溶解和正确折叠功能的丧失;蛋白或多肽自身结构在热力学和动力学上失衡;一些环境因素(如高温、酸性介质)能明显刺激包涵体的形成,因此控制介质组成成分、培养基和基因表达条件也可以减少包涵体的形成;一般,含硫氨基酸越多越易形成包涵体,脯氨酸含量明显与包涵体的形成呈正相关,因此,通过改变重组蛋白连接区的氨基酸序列可以减少包涵体的形成。
重组菌株外源蛋白生物学信息-概述说明以及解释

重组菌株外源蛋白生物学信息-概述说明以及解释1.引言1.1 概述概述部分的内容如下:随着生物技术的迅速发展,重组蛋白已经成为了现代生物学研究和应用的重要组成部分。
重组蛋白是通过在不同来源(通常为非人源)的宿主细胞中表达外源基因而产生的蛋白质。
这种技术使得科学家们能够在大规模生产外源蛋白的同时,也能够通过生物学方法对蛋白质进行定点修改。
重组蛋白的应用广泛涉及到各个领域,包括药物研发、生物治疗、农业改良以及基础生物学研究等。
这些外源蛋白的生物学信息包括其序列、结构、功能以及相互作用等方面。
了解和分析这些生物学信息对于研究人员设计和优化外源蛋白的表达、纯化以及功能研究具有重要意义。
本文将重点介绍重组菌株在外源蛋白生物学信息中的应用。
首先,我们将详细探讨外源蛋白的重组技术,包括常用的表达系统和载体选择以及基因工程的策略与方法。
接下来,我们将介绍重组菌株的选择与构建,包括宿主菌株的选择、遗传转化技术以及菌株构建的方法。
最后,我们将讨论外源蛋白的表达与纯化技术,介绍不同的表达策略和纯化方法,并探讨其在重组菌株外源蛋白生物学信息的研究中的应用。
通过对重组菌株外源蛋白的生物学信息的深入研究,我们可以更好地了解外源蛋白的结构与功能,为药物研发和生物应用提供更多的可能性。
然而,重组菌株外源蛋白的研究仍然面临一些挑战,例如蛋白质的折叠和纠正、产生的蛋白质的规模化表达与纯化等。
因此,对于重组菌株外源蛋白的未来研究和应用展望,我们也将进行探讨。
通过对重组菌株外源蛋白的生物学信息的深入研究以及对其应用前景和挑战的探讨,本文旨在推动该领域的发展,并为研究人员在选择和构建重组菌株时提供参考依据,为相关领域的进一步研究和应用提供有益的借鉴。
1.2文章结构文章结构的主要目的是提供读者一个清晰的逻辑框架,使其能够更好地理解和阅读文章的内容。
本文的结构主要分为引言、正文和结论三个部分。
引言部分将对本文的主题进行概述,介绍外源蛋白的重要性和应用背景,并提出本文的目的。
实验九 外源基因在大肠杆菌中的诱导表达和降解物阻遏作用

实验九外源基因在大肠杆菌中的诱导表达和降解物阻遏作用【实验目的】1.了解外源基因在原核细胞中表达的基础理论。
2.掌握乳糖操纵子的调节机制和操作方法。
【实验原理】1.外源基因在原核细胞中的表达蛋白质通常是研究的最终目标,因此蛋白质的表达在基因工程中占有非常重要的地位。
常用的表达系统有原核细胞和真核细胞。
原核细胞表达系统主要使用大肠杆菌,真核细胞表达系统主要有酵母细胞、哺乳动物细胞和昆虫细胞。
这些表达系统各有优缺点,应根据实验目的和实验室条件加以选择。
本实验主要介绍以大肠杆菌为代表的原核细胞表达系统。
(1)大肠杆菌表达系统的特点:生物学特性和遗传背景清楚,易于操作;已开发较多的克隆载体可供选择;容易获得大量的外源蛋白(外源蛋白可占细菌总蛋白50%左右)。
(2)蛋白质在原核细胞中的表达特点:原核细胞有其固有的RNA聚合酶,识别原核基因的启动子。
因此,在用原核细胞表达目的基因(无论是真核基因还是原核基因)时,一般应使用原核启动子。
原核基因的mRNA含有SD序列,启动蛋白质的合成。
而在真核基因上则缺乏该序列。
因此,一些商品化原核表达载体上设计有SD序列,以方便真核基因的表达。
原核细胞没有mRNA转录后加工的能力。
因此,在原核细胞中表达真核基因时,应使用cDNA 为目的基因。
原核细胞缺乏真核细胞对蛋白质进行翻译后加工的能力。
如表达产物的功能和蛋白质的糖基化、高级结构的正确折叠有关,必须慎重使用原核表达系统。
外源基因在大肠杆菌中高效表达时,表达产物往往在胞浆聚集,形成均一密度的包涵体。
包涵体的形成有利于保护表达产物不被胞内的蛋白酶降解,而且可以通过包涵体和胞内其他蛋白质密度不同来纯化包涵体蛋白。
但包涵体蛋白不具有该蛋白的所有生物学活性,往往需要通过变性复性的方法恢复活性,有时只能回复部分活性。
(3)蛋白质在原核细胞表达的调控启动子是转录水平调控的主要因素。
根据启动子起始mRNA合成效率的不同,可分为强、弱启动子,但是启动子的强弱是相对于不同基因而言的。
提高大肠杆菌重组蛋白可溶性表达方法研究进展

Vol.53,No.07. 2019DOI:10.3969/j.issn.2095-1205.2019.07.23提高大肠杆菌重组蛋白可溶性表达方法研究进展张真汪燕马振刚(重庆市动物生物学重点实验室,重庆市媒介昆虫重点实验室,重庆师范大学重庆401331)摘要大肠杆菌表达系统与其他外源表达系统相比具有重组蛋白产量高、易操作、生长速度快和成本低等特点。
通过大肠杆菌表达重组蛋白是一种既高效又经济的途径。
然而,外源蛋白在大肠杆菌中表达时往往处于还原性环境的胞质中,而在胞质中外源蛋白不易形成二硫键,出现外源蛋白无法正确折叠的现象,从而形成不可溶的包涵体。
文章在近年提高大肠杆菌重组蛋白可溶性表达研究的基础上,从选择适当的载体和宿主、外源蛋白与其他辅助蛋白共表达、降低蛋白合成速率、提高周质蛋白表达、融合标签表达、肽标签表达、替换蛋白质中的氨基酸、改变培养基的条件等方面进行了综述,为研究者根据外源蛋白自身特点,优化外源蛋白可溶性表达方法提供了参考。
关键词外源蛋白;可溶性表达;大肠杆菌;包涵体中图分类号:Q78文献标识码:A文章编号:2095-1205(2019)07-37-04 Advances in Improving the Soluble Expression of EscherichiaColi Recombinant ProteinZhang Zhen Wang Yan Ma Zhengang(Chongqing Key Laboratory of Animal Biology, Chongqing Key Laboratory of Vector Insects, Chongqing Normal University,Chongqing 401331)Abstract:Compared with other exogenous expression systems, escherichia coli expression system has the characteristics of high yield, easy operation, fast growth rate and low cost of recombinant protein. It is an efficient and economical way to express recombinant protein through escherichia coli. However, when expressed in escherichia coli, exogenous proteins tend to be in the cytoplasm of the reductive environment, whereas in cytoplasm, exogenous proteins are not easy to form disulfide bonds, and foreign proteins cannot fold properly, thus forming insoluble inclusion bodies. On the basis of improving the soluble expression of escherichia coli recombinant protein, the article summarized from selecting the appropriate carrier and the host, exogenous proteins are co-expressed with other helper proteins, reducing the rate of protein synthesis, improving the periplasmic protein expression, expression of fusion tag expression, peptide tag expression, replacing amino acids in a protein, changing the condition of culture medium and other aspects, providing a reference for researchers to optimize the soluble expression of exogenous proteins according to their own characteristics.Key words:exogenous proteins; soluble expression; escherichia coli; inclusion body目前大部分蛋白质功能研究需要的是可以大量纯化并且可溶的蛋白质,但不管是天然提取还是使用化学合成纯的蛋白质都是非常困难的[1],而DNA重组技术提供了一种经济的外源蛋白获取方式。
外源基因在大肠杆菌中的高效表达

实验十八外源基因在大肠杆菌中的高效表达一、实验目的1. 掌握外源基因在大肠杆菌中表达的特点和方法。
2. 复习SDS-PAGE的制备及其分离原理。
二、实验原理一种高效的原核表达载体需要包括一个强大并且可以严紧调节的启动子;一位于翻译起始密码子5’端大约9bp的SD序列;位于目的基因3’末端的一个高效转录终止子。
此外,载体还需要一个复制起点,筛选标记和利于对启动子活性进行严紧调节的基因。
这些元件的作用往往具有基因特异性,因此要根据不同的情况加以取舍。
E.coli表达载体的基本结构见下图:1.有效的转录起始与基因的高效表达有效的转录起始是外源基因能否在宿主细胞中高效表达的关键性步骤之一。
最理想的强的可调控的启动子应该是:在发酵的早期阶段表达载体的启动子被紧紧地阻遏,这样可以避免出现表达载体不稳定,细胞生长缓慢或由于产物表达而引起的细胞死亡等问题。
对于原核细胞而言,可分为可诱导型启动子,比如lac,trp,tac,phoA等,和组成型启动子如T7噬菌体启动子。
2.mRNA 的有效延伸和转录终止与基因的高效表达转录开始后,mRNA 开始进行有效延伸,终止以及稳定的积累,在这个过程中,转录物内的衰减和非特异性终止能诱发转录中的mRNA分子提前终止。
衰减子位点具有简单终止子的特性,在原核细胞中其处于操纵子的启动子和第一个结构基因之间,为保证mRNA转录安全,在表达载体的组建中要尽量避免其存在。
正常的转录终止子序列的存在也是外源基因高效表达的一个因素,其作用是防止不必要的转录,使mRNA的长度限制到最小,增加表达质粒的稳定性。
对于真核细胞而言,表达载体上含有转录终止序列和poly A加入位点,使外源基因高效表达的重要因素。
3.有效的翻译起始与基因的高效表达在原核细胞中使翻译起始达到最大效率的一般原则:1) AUG(ATG)是最首选的起始密码子。
GUG、UUG、AUU和AUA有时也用作起始密码子,但非最佳选择。
2) SD序列中至少含有AGGAGG序列中的四个碱基。
外源基因在大肠杆菌中的表达

PL 和 PR 表达系统
转录调控的机理
由 l 噬菌体 PE 启动子控制的 cI 基因的产物是 PL 、 PR 启动子转录的
阻遏物。cI 基因的产物在大肠杆菌宿主中的浓度取决于一系列宿主与 噬菌体因子之间的错综复杂的平衡关系。由于通过细胞因子来控制cI 基因产物的产生和消失是相当困难的。
由于 PL 和 PR 表达系统诱导时不加化学诱导剂,成本又低廉,最初几 个在大肠杆菌中制备的药用重组蛋白质都采用 PL 或 PR 表达系统。
缺陷 在热脉冲诱导过程中,大肠杆菌热休克蛋白的表达也会被激活,其 中一些是蛋白水解酶,有可能降解所表达的重组蛋白。 在大体积发酵培养菌体时,通过热平衡交换方式把培养温度从30℃ 提高到 42℃ 需要较长的时间,这种缓慢的升温方式影响诱导效 果,对重组蛋白表达量有一定的影响。
T7 表达系统
大肠杆菌 T7 噬菌体具有一套专一性非常强的转录体系,利用这一 体系中的元件为基础构建的表达系统称为 T7 表达系统。
T7 表达系统
T7 噬菌体基因 1 编码的 T7 RNA 聚合酶选择性的激活 T7 噬菌体启 动子的转录。
T7 RNA 聚合酶活性高,其合成 RNA 的速度比大肠杆菌 RNA 聚合 酶快 5倍左右。并可以转录某些不能被大肠杆菌 RNA聚合酶有效转 录的序列。
对宿主菌的要求
用溶源化 l 噬菌体的大肠杆菌作 PL、PR 启动子表达载体的宿主菌
N4830-1,POP2136 等菌株已经溶源化 cI 857(ts) l 噬菌体, 可用作表达外源基因时的宿主菌。 把 cI 857(ts) 基因组装在表达载体上 宿主菌选择范围更大
PL 和 PR 表达系统存在的问题
这两个启动子受在培养基中的无机磷(Pi)浓度调控(Pi﹥5mmol/L 时抑制,Pi﹤1mmol/L 时激活),具有较高的转录水平。
实验 7 外源基因在大肠杆菌中的表达(或诱导表达)和检测 (1)

原核(大肠杆菌)表达系统
特点: 表达质粒独立运转表达 基因重组速度快,生产工艺简单, 成本低,表达量较高, 重组蛋白翻译后修饰较差。
1978年,人胰岛素insulin 基因首次表达 目前仍是一个重要的表达系统
应用:活性要求不高的蛋白质 如抗原制备
原核表达系统-E.coli:
transformation
The metal binding domain of the fusion peptide allows simple purification of recombinant proteins by Immobilized Metal Affinity Chromatography with Invitrogen’s ProBond. resin (available in bulk, see page v). The enterokinase cleavage recognition site in the fusion peptide located between the metal binding domain and the recombinant protein allows for subsequent removal of this N-terminal fusion peptide from thepurified recombinant protein.
OD600 = 0.4-0.6
37℃ overnight
IPTG
诱导表达4-6小时,time-course expression
SDS-PAGE分析
Invitrogen
T7 promoter: bases 20-39 Ribosome binding site: bases 84-90 6xHis tag: bases 112-129 T7 gene 10 leader: bases 133-162 Anti-XpressTM epitope: bases 169-192 Multiple cloning site: bases 202-248 pRSET reverse priming site: bases 295-314 T7 transcription terminator: bases 256-385 f1 origin: bases 456-911 bla promoter: bases 943-1047 Ampicillin (bla) resistance gene (ORF): bases 1042-1902 pUC origin: bases 916-2852 (C)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
提高外源性蛋白在大肠杆菌中的高效表达策略本世纪60至70年代对大肠杆菌的研究使之成为自然界中最普遍为人们所认识的生物体。
大肠杆菌具有操作简单和能在廉价的培养基中高密度培养的特点,它的这些特征加上十多年外源基因表达的经验使其在大多数科研应用中成为高效表达异源蛋白最常用的原核表达系统。
尽管大肠杆菌有众多的优点,但并非每一种基因都能在其中有效表达。
这归因于每种基因都有其独特的结构、mRNA的稳定性和翻译效率、蛋白质折叠的难易程度、宿主细胞蛋白酶对蛋白质的降解、外源基因和E.coli在密码子利用上的主要差别以及蛋白质对宿主的潜在毒性等等。
影响大肠杆菌中蛋白表达量的因素有载体启动子结构、质粒拷贝数、质粒稳定性、mRNA结构、密码子的偏爱性和宿主菌的生长状态等因素。
在分析了国内外有关在原核系统中表达蛋白的实验资料的基础上,对在大肠杆菌中高效表达外源蛋白的策略所涉及的内容进行总结,以期有助于研究。
1.有效表达载体的构型构建表达质粒需要多种元件,需要仔细考虑它们的组合,以保证最高水平的蛋白质合成。
其主要构件包括启动子、终止子、抗终止子、弱化子、绝缘子和增强子等。
1.1启动子理想的启动子具有以下特性:作用强;可以严格调控;容易转导入其他E.coli以便筛选大量的用于生产蛋白的菌株,而且对其诱导是简便和廉价的[1]。
在启动子下游是RBS,其跨度约为54个核苷酸,两端限定在 -35(±2)和mRNA编码序列的+19到+22之间[2]。
Shine-Dalgarno(SD)位点在翻译起始阶段与16S rRNA的3’端相互作用[3]。
SD与起始密码子间的距离约为5-13bp,而且此区的序列在mRNA转录物中应避免出现二级结构,否则将会降低翻译起始的效率[4]。
在RBS的5’和3’端均为A丰富区。
转录终止子位于编码序列的下游,作为转录终止的信号和组成发卡结构的保护性元件,阻止核酸外切酶对mRNA的降解,从而延长mRNA的半衰期。
但目前发现在转录过程中部分启动子在转录为RNA后可引起导致转录后基因沉默,从而减少目的蛋白量(a)。
某些启动子还识别特异性的RNA聚合酶( rnap ),特异性的RNA聚合酶( rnap )可以分辨出不同的启动子结构,优先启动推动者与目的序列。
(c)还有研究表明有关基因表达的假设增强子与启动子之间相互作用发生分子间的结构独立功能联合的复合体增强启动子功能,该结构具有特异性。
并不是所有增强子与启动子都能发生功能联合的复合体(b)。
目前在E.coli中发挥作用的启动子很多。
通常常被使用的可调控的启动子有Lac(乳糖启动子)、Trp(色氨酸启动子)、Tac(乳糖和色氨酸的杂合启动子) 、lP L(l噬菌体的左向启动子)、T7噬菌体启动子等。
1.2 终止子在一个基因的3末端或是一个操纵子的3末端往往有特定的核苷酸序列,且具有终止转录功能,这一序列称之为转录终止子,简称终止子(terminator)。
在原核生物中,转录终止有两种不同的机制。
一种是依赖六聚体蛋白rho的rho依赖性转录终止,rho蛋白能使新生RNA转录本从模板解离,它是一种环状hexameric蛋白质和ATP解旋酶的活动。
nusg ,nusa和nusb是以附加因素的形式参与终止进程。
rho依赖性终止作用是当rho与游离核糖体中富含C 的位点相结合后产生的, rho的ATP酶激活rho - mRNA的终止子作用,并为其提供能量,使rho能够在mRNA上向前移行;移行过程中是mRNA上的讯息进入六聚体的中心孔,当移行到转录底物释放rho的解旋酶时聚合酶停止工作转录终止(d,e)。
另一种是rho非依赖性转录终止,它特异性依赖于模板上编码的信号,即在新生RNA中形成发卡结构的一回文序列区,和位于该回文序列下游4-9bp处的dA、dT富含区[5]。
贯穿启动子的转录将抑制启动子的功能,造成所谓的启动子封堵[6]。
这种效应可以通过在编码序列下游的适当位置放置一转录终止子,阻止转录贯穿别的启动子来避免。
同样地,在启动目的基因的启动子上游放置一转录终止子,将最大限度地减小背景转录[7]。
同时对于大肠杆菌来说,翻译终止效率可因终止密码子及临近的下游碱基的不同而显著不同,对于UAAN 和UAGN系列终止密码子下游碱基对翻译的有效终止的影响力大小依序为U>G>A、C。
UAG 极少被大肠杆菌利用,相比UAAN和UGAN,UAG表现了有效终止,但其后的碱基对有效终止的影响力为U>G>A>C。
1.3抗终止子细菌中许多参与氨基酸生物合成的操纵子在其第一个结构基因的5’端含有转录衰减子。
衰减子由特定操纵子的氨基酸产物调节。
这样关联的带电荷tRNA的存在就会在核糖体剪切之后引导初始转录本中二级结构的形成。
如果没有关联的带电荷tRNA,则会形成抗终止子结构,从而抑制终止子中发卡结构的形成和转录的终止[8]。
其中hutp是一种RNA结合蛋白表达的调节有关氨基酸利用率的操纵子,具有约束力的顺式调控序列。
(g)它要求组氨酸和镁离子结合才能进行mRNA的表达。
在研究中,已证明了几个二价阳离子可调解hutp RNA的相互作用。
最好的二价阳离子被锰,锌和镉,其次是镁,钴和镍离子,而铜离子, yb2 +和Hg2 +无效。
在hutp RNA的互动中表明金属离子能调解蛋白质核酸相互作用,增强mRNA的转录(f)。
在rho依赖性终止中抗终止元件能使RNA 多聚酶越过核糖体RNA操纵子中的rho依赖性终止子即boxA[9],从而达到抗终止子的作用。
1.4弱化子弱化子(attenuator)是在研究大肠杆菌的色氨酸操纵子表达弱化现象中发现的。
在trp mRNA 5’端trp正基因的起始密码前有一个长162 bp的DNA序列称为前导区,其中第123~150位核苷酸能影响色氨酸的表达,如果缺失,trp基因的表达水平可提高6倍。
这个区域被称为弱化子。
弱化作用在原核生物中是相当普遍的,大肠杆菌和鼠伤寒沙门氏菌中已陆续发现不少操纵子都有弱化现象。
例如在AmpC酶的表达过程中,其基因上的弱化子为一段不稳定的发卡结构(h),但这段发卡结构较易突变,若其上16~43基因缺失将改变这一结构使其弱化作用消失(i)。
1.5绝缘子绝缘子(insultor)长约几百个核苷酸对,是通常位于启动子同正调控元件(增强子)或负调控因子(为异染色质)之间的一种调控序列。
绝缘子本身对基因的表达既没有正效应,也没有负效应,其作用只是不让其他调控元件对基因的活化效应或失活效应发生作用,其作用机制可能是取消核酸的碱基的配对作用,和阻断增强子机制(j).1.6增强子增强子(enhancer)指增加同它连锁的基因转录频率的DNA序列。
增强子是通过启动子来增加转录的。
增强子的特点是:①在转录起始点5’或3’侧均能起作用;②相对于启动子的任一指向均能起作用;③大部分增强子发挥作用与受控基因的远近距离相对无关,但也有小部分增强子其作用与受控基因的远近有关(K);④对异源性启动子也能发挥作用;⑤通常具有一些短的重复顺序。
如今已经在细菌和噬菌体中鉴定了一些在E.coli中显著增强异源基因表达的序列。
Olins等从T7噬菌体基因10前导序列( g10-L)中鉴定了一9bp的序列,该序列似乎能替代有效的RBS。
同SD共有序列相比,g10-L能使多种基因的表达水平提高40-340倍[10]。
另外的研究小组在mRNA的5’非翻译区(UTR)鉴定了一U富含序列,该序列同样具有翻译增强子活性。
McCarthy等[11]在 E.coli atpE基因中紧接于SD位点下游鉴定一类似区域。
同时增强子的作用强弱与细胞培养的理化条件有一定的关系,例如,当在缺氧的条件下(EPO)3‘增强子野生片段或其突变片段其作用将不是增强目的基因的表达,而是相反起到抑制作用(L)。
而且部分增强子的作用强弱与其所转入细胞也有关系。
(m)2.培养条件E.coli中的蛋白质产量可以通过高细胞密度培养系统而获得显著提高。
高细胞密度培养系统可以分成三类:分批培养、补料分批培养和连续培养。
这些方法能获得超过100g/升的细胞浓度,从而获得廉价的重组蛋白。
培养基的组成需要仔细地计算和监控,因为这对细胞和蛋白质的产生具有重要的代谢效应。
营养成分和培养参数如pH、温度和其他参数都会影响蛋白酶的活性、分泌和产量[12]。
已经证明对培养基的特殊操作能明显提高蛋白质释放到培养基中。
例如,在培养基中添加甘氨酸能增强外周质蛋白释放到培养基中,且不引起明显的细菌裂解[13]。
同样,在山梨糖醇和甘氨酰甜菜碱存在的渗透压力下培养细菌,可以使可溶性的活性蛋白产量提高多达400倍[14]。
同时,在表达外源蛋白时,要尽量避免由于营养物质缺乏导致的菌体生长抑制的情况发生.外源蛋白的表达显著地受葡萄糖浓度的影响,虽然葡萄糖比较适合作为菌体生长的碳源,但在诱导表达时期,需尽量保持低水平的葡萄糖.以甘油代替葡萄糖作为表达外源蛋白的碳源是解除葡萄糖效应的有效途径之一。
外源蛋白的构象也是影响可溶性表达量的重要条件,可通过影响外源蛋白的化学键的形成来影响结构的改变。
例如,外源蛋白二硫键的形成是一个酶依赖性反应过程,向培养基中添加适量的金属离子,可能提高这些酶类的活性,因此也有可能增加可溶蛋白的表达量.某些外源蛋白的活性和稳定性与某些金属离子密切相关,因此向培养基中添加外源蛋白所需金属离子也可能提高蛋白的可溶性和稳定性[15].另外,良好的通气能有效降低培养基中对菌体表达蛋白有重要影响的CO2和乙酸的浓度,也有助于获得高产量的活性蛋白。
同时,高细胞密度培养系统也有其自身的缺陷。
这些缺陷包括在高细胞密度情况下,溶解氧的量有限;二氧化碳水平能够降低生长速度、刺激乙酸形成降低发酵罐的混合效率和产热等。
利用高细胞密度培养系统生产重组蛋白质的一个主要问题是乙酸的积累,近来这一问题通过将来自B. subtilis编码醋酸盐合成酶的alsS基因导入E.coli细胞中得以解决[16]。
3.诱导条件目前对于蛋白质在大肠杆菌中表达的诱导剂主要有β–半乳糖苷酶(IPTG)、乳糖和胞外超氧化物歧化酶等。
在大肠杆菌中表达可溶性外源蛋白时,诱导时机和诱导剂的用量必须严格控制.普遍认为在低菌体浓度下诱导比较合适,因为在低菌浓度下菌体处于对数生长期,生长活跃,有利于表达可溶性蛋白.然而,如果能保证合理的补料与充分的通气,在较高菌浓度下诱导也同样可能获得可溶蛋白的高效表达.目前一般认为在菌体浓度在OD600在0.4~0.6之间效果较好,但Margret B等认为在OD600为0.5~2.0同样可获得较好的效果[17]。
.诱导剂种类及其浓度都会对外源蛋白表达产生重要影响,应根据所采用的表达系统(比如启动子的强弱)和外源蛋白的特点优化选择[18]。
