PBS缓冲液配制标准操作规程
(完整版)磷酸盐缓冲液(PBS)配制方法

磷酸盐缓冲液(PBS)配制方法科研实验 2010-04-20 22:25:48 阅读935 评论0 字号:大中小订阅0.01M PBSPBS (135 mM NaCl, 2.7 mM KCl, 1.5 mM KH2PO4, and 8 mM K2HPO4,pH 7.2)PBS缓冲液(pH7.2~7.4):NaCl 137mmol/L,KCl 2.7mmol/L,Na2HPO4 4.3mmol/L,KH2PO4 1.4mmol/L称7.9g NaCl,0.2g KCl,0.24g KH2PO4(or 1.44g Na2HPO4)和1.8g K2HPO4,溶于800 ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1 L。
保存于4℃冰箱中即可。
需要注意的是,通常所说的浓度0.01 M 指的是缓冲溶液中所有的磷酸根浓度,而非Na 离子或K 离子的浓度,Na 离子和K 离子只是用来调节渗透压的。
母液的配制:0.2M Na2HPO4:称取71.6g Na2HPO4-12H2O,溶于1000ml 水0.2M NaH2PO4:称取31.2g NaH2PO4-2H2O,溶于1000ml 水各种浓度PB(pH=7.4)的配制:先配0.2M PB (pH=7.4,100ml):取19ml 0.2mol/L的NaH2PO4, 81ml 0.2mol/L 的Na2HPO4, 即可。
然后只需将0.2M PB (pH=7.4)按相应比例适当稀释即可,如:0.1M PB(PH=7.4):取500ml 0.2M PB,加水稀释至1000ml 即可。
0.01M PB (PH=7.4):取50ml 0.2M PB,加水稀释至1000ml 即可。
0.02M PB (PH=7.4):取100ml 0.2 M PB,加水稀释至1000ml 即可。
若需要NaCl的话,加入NaCl 至0.9%(g/100ml)即可。
另:其它各种另PH值的0.2M PB(100ml)配方:pH 0.2M NaH2PO4(ml)0.2M Na2HPO4(ml)5.7 93.56.55.8 92 85.9 90 106.0 87.7 12.36.1 85 156.2 81.5 18.56.3 77.5 22.56.4 73.5 26.56.5 68.5 31.56.6 62.5 37.56.7 56.5 43.56.8 51 496.9 45 557.0 38 627.1 33 677.2 28 727.3 23 777.4 19ml 81ml7.5 16 847.6 13 877.7 10.5 90.57.8 8.5 91.57.9 7 938.0 5.3 94.70.01M 磷酸盐缓冲液(PBS)配制方法称取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L即可。
(完整版)磷酸盐缓冲液(PBS)配制方法

磷酸盐缓冲液(PBS)配制方法科研实验 2010-04-20 22:25:48 阅读935 评论0 字号:大中小订阅0.01M PBSPBS (135 mM NaCl, 2.7 mM KCl, 1.5 mM KH2PO4, and 8 mM K2HPO4,pH 7.2)PBS缓冲液(pH7.2~7.4):NaCl 137mmol/L,KCl 2.7mmol/L,Na2HPO4 4.3mmol/L,KH2PO4 1.4mmol/L称7.9g NaCl,0.2g KCl,0.24g KH2PO4(or 1.44g Na2HPO4)和1.8g K2HPO4,溶于800 ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1 L。
保存于4℃冰箱中即可。
需要注意的是,通常所说的浓度0.01 M 指的是缓冲溶液中所有的磷酸根浓度,而非Na 离子或K 离子的浓度,Na 离子和K 离子只是用来调节渗透压的。
母液的配制:0.2M Na2HPO4:称取71.6g Na2HPO4-12H2O,溶于1000ml 水0.2M NaH2PO4:称取31.2g NaH2PO4-2H2O,溶于1000ml 水各种浓度PB(pH=7.4)的配制:先配0.2M PB (pH=7.4,100ml):取19ml 0.2mol/L的NaH2PO4, 81ml 0.2mol/L 的Na2HPO4, 即可。
然后只需将0.2M PB (pH=7.4)按相应比例适当稀释即可,如:0.1M PB(PH=7.4):取500ml 0.2M PB,加水稀释至1000ml 即可。
0.01M PB (PH=7.4):取50ml 0.2M PB,加水稀释至1000ml 即可。
0.02M PB (PH=7.4):取100ml 0.2 M PB,加水稀释至1000ml 即可。
若需要NaCl的话,加入NaCl 至0.9%(g/100ml)即可。
另:其它各种另PH值的0.2M PB(100ml)配方:pH 0.2M NaH2PO4(ml)0.2M Na2HPO4(ml)5.7 93.56.55.8 92 85.9 90 106.0 87.7 12.36.1 85 156.2 81.5 18.56.3 77.5 22.56.4 73.5 26.56.5 68.5 31.56.6 62.5 37.56.7 56.5 43.56.8 51 496.9 45 557.0 38 627.1 33 677.2 28 727.3 23 777.4 19ml 81ml7.5 16 847.6 13 877.7 10.5 90.57.8 8.5 91.57.9 7 938.0 5.3 94.70.01M 磷酸盐缓冲液(PBS)配制方法称取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L即可。
磷酸盐缓冲液(PBS)配制方法

磷酸盐缓冲液(PBS)配制方法科研实验 2010-04-20 22:25:48 阅读935 评论0 字号:大中小订阅0.01M PBSPBS (135 mM NaCl, 2.7 mM KCl, 1.5 mM KH2PO4, and 8 mM K2HPO4,pH 7.2)PBS缓冲液(pH7.2~7.4):NaCl 137mmol/L,KCl 2.7mmol/L,Na2HPO4 4.3mmol/L,KH2PO4 1.4mmol/L称7.9g NaCl,0.2g KCl,0.24g KH2PO4(or 1.44g Na2HPO4)和1.8g K2HPO4,溶于800 ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1 L。
保存于4℃冰箱中即可。
需要注意的是,通常所说的浓度0.01 M 指的是缓冲溶液中所有的磷酸根浓度,而非Na 离子或K 离子的浓度,Na 离子和K 离子只是用来调节渗透压的。
母液的配制:0.2M Na2HPO4:称取71.6g Na2HPO4-12H2O,溶于1000ml 水0.2M NaH2PO4:称取31.2g NaH2PO4-2H2O,溶于1000ml 水各种浓度PB(pH=7.4)的配制:先配0.2M PB (pH=7.4,100ml):取19ml 0.2mol/L的NaH2PO4, 81ml 0.2mol/L 的Na2HPO4, 即可。
然后只需将0.2M PB (pH=7.4)按相应比例适当稀释即可,如:0.1M PB(PH=7.4):取500ml 0.2M PB,加水稀释至1000ml 即可。
0.01M PB (PH=7.4):取50ml 0.2M PB,加水稀释至1000ml 即可。
0.02M PB (PH=7.4):取100ml 0.2 M PB,加水稀释至1000ml 即可。
若需要NaCl的话,加入NaCl 至0.9%(g/100ml)即可。
另:其它各种另PH值的0.2M PB(100ml)配方:pH 0.2M NaH2PO4(ml)0.2M Na2HPO4(ml)5.7 93.56.55.8 92 85.9 90 106.0 87.7 12.36.1 85 156.2 81.5 18.56.3 77.5 22.56.4 73.5 26.56.5 68.5 31.56.6 62.5 37.56.7 56.5 43.56.8 51 496.9 45 557.0 38 627.1 33 677.2 28 727.3 23 777.4 19ml 81ml7.5 16 847.6 13 877.7 10.5 90.57.8 8.5 91.57.9 7 938.0 5.3 94.70.01M 磷酸盐缓冲液(PBS)配制方法称取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L即可。
PBS缓冲液的配制方法

PBS缓冲液的配制方法在免疫组化和细胞培养中,常用到PBS缓冲液。
以下是我们实验室的配方,供大家参考:A液:0.1mol/L磷酸二氢钾将1.361g磷酸二氢钾(KH2PO4,分子量136.09)加入100ml双蒸水中。
B液:0.1mol/L磷酸氢二钠将1.78g酸酸氢二钠(Na2HPO4.2H2O,分子量177.99)加入100ml双蒸水中。
或者将3.58g酸酸氢二钠(Na2HPO4.12H2O,分子量358.14)加入100ml双蒸水中。
pH值。
A液(ml)。
B液(ml)5.60.9.50.0.255.91.9.00.1.006.24.8.00.2.006.47.7.00.3.006.64.6.00.4.006.81.5.00.5.006.98.4.00.6.007.17.3.00.7.007.38.2.00.8.007.73.1.00.9.008.04.0.50.9.50免疫组化常用的PBS只包含Na2HPO4•12H2O(磷酸氢二钠)、NaH2PO4•2H2O(磷酸二氢钠)和NaCl。
用于细胞培养的PBS需要含有氯化钾。
配方如下:取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L,浓度为0.01M。
PBS缓冲液的配方如下:取8g NaCl、0.2g KCl、3.63g Na2HPO4•12H2O和0.24gKH2PO4,溶于900ml双蒸水中,用盐酸调节pH值至7.4,加水定容至1L,常温保存备用。
PBS缓冲液是实验室中最常用的缓冲液之一,但不同实验室的配方可能不同。
以下是我的总结:母液的配制:0.2M Na2HPO4:取71.6g Na2HPO4-12H2O,溶于1000ml水。
0.2M NaH2PO4:取31.2g NaH2PO4-2H2O,溶于1000ml 水。
不同浓度的PBS(pH=7.4)的配制:先配制0.2M PBS(pH=7.4,100ml):取19ml 0.2mol/L的NaH2PO4和81ml 0.2mol/L的Na2HPO4即可。
pbs缓冲液各种PH值得配制方法

配置方法编辑采用去离子水、KH2PO4和Na2HPO4·2H2O配制PBS溶液,按以下步骤进行:(1) 配制1/15mol/L KH2PO4,即每升水中溶解9.078克KH2PO4;(2) 配制1/15mol/LNa2HPO4·2H2O,即每升水中溶解11.876克Na2HPO4·2H2O;(3) 将18.2%(体积分数)KH2PO4溶液和81.8%Na2HPO4·2H2O混合;最终测定PBS液的PH值约为7.4。
磷酸盐缓冲液取磷酸二氢钠38.0g,与磷酸氢二钠5.04g,加水使成1000ml,即得。
磷酸盐缓冲液(pH2.0) 甲液:取磷酸16.6ml,加水至1000ml,摇匀。
乙液:取磷酸氢二钠71.63g,加水使溶解成1000ml。
取上述甲液72.5ml与乙液27.5ml混合,摇匀,即得。
磷酸盐缓冲液(pH2.5) 取磷酸二氢钾100g,加水800ml,用盐酸调节pH至2.5,用水稀释至1000ml。
磷酸盐缓冲液(pH5.0) 取0.2mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液调节pH值至5.0,即得。
磷酸盐缓冲液(pH5.8) 取磷酸二氢钾8.34g与磷酸氢二钾0.87g,加水使溶解成1000ml,即得。
磷酸盐缓冲液(pH6.5) 取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液15.2ml,用水稀释至100ml,即得。
磷酸盐缓冲液(pH6.6) 取磷酸二氢钠1.74g、磷酸氢二钠2.7g与氯化钠1.7g,加水使溶解成400ml,即得。
磷酸盐缓冲液(含胰酶)(pH6.8) 取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释至1000ml,即得。
磷酸盐缓冲液(pH6.8) 取0.2mol/L磷酸二氢钾溶液250ml,加0.2mol/L氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得。
pbs缓冲液各种PH值得配制方法

pbs缓冲液各种PH值得配制方法配置方法编辑用去离子水、KH2PO4和na2hpo42h2o按以下步骤制备PBS溶液:(1)制备1/15mol/lkh2po4,即每升水溶解9.078g KH2PO4;(2)配制1/15mol/lna2hpo42h2o,即每升水中溶解11.876克na2hpo42h2o;(3)将18.2%(体积分数)kh2po4溶液和81.8%na2hpo42h2o混合;最终测定pbs液的ph值约为7.4。
磷酸盐缓冲液:取38.0g磷酸二氢钠和5.04g磷酸二氢钠,加水至1000ml。
磷酸盐缓冲液(ph2.0)溶液A:取16.6ml磷酸,加水至1000ml,摇匀。
B液:取71.63g磷酸氢二钠,加水溶解成1000ml。
取72.5毫升液体a和27.5毫升液体B,混合并摇匀。
磷酸盐缓冲液(ph2.5)取磷酸二氢钾100g,加水800ml,用盐酸调节ph至2.5,用水稀释至1000ml。
磷酸盐缓冲液(pH5.0):取一定量的0.2mol/l磷酸二氢钠溶液,用氢氧化钠试液调节pH值至5.0。
磷酸盐缓冲液(ph5.8)取磷酸二氢钾8.34g与磷酸氢二钾0.87g,加水使溶解成1000ml,即得。
磷酸盐缓冲液(pH6.5):取0.68g磷酸二氢钾,加入15.2ml 0.1mol/l氢氧化钠溶液,用水稀释至100ml。
磷酸盐缓冲液(ph6.6)取磷酸二氢钠1.74g、磷酸氢二钠2.7g与氯化钠1.7g,加水使溶解成400ml,即得。
磷酸盐缓冲液(包括胰蛋白酶)(pH 6.8)取6.8g磷酸二氢钾,加水500ml溶解,用0.1mol/l氢氧化钠溶液调节pH至6.8;此外,取胰蛋白酶10g,加入适量水溶解,将两种溶液混合,用水稀释至1000ml。
磷酸盐缓冲液(ph6.8)取0.2mol/l磷酸二氢钾溶液250ml,加0.2mol/l氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得。
磷酸盐缓冲液(pH7.0):取0.68g磷酸二氢钾,加入29.1ml 0.1mol/l氢氧化钠溶液,用水稀释至100ml。
PBS缓冲液的配制方法

PBS缓冲液配方不管是免疫组化,还是细胞培养中,常用到PBS缓冲液,下面是我们实验室的配方,供大家参考。
我们实验室的配方:A液:0.1mol/L磷酸二氢钾:磷酸二氢钾(KH2PO4,MW136.09)1.361g,加双蒸水至100ml。
B液:0.1mol/L磷酸氢二钠:酸酸氢二钠(Na2HPO4.2H2O,MW177.99)1.78g,加双蒸水至100ml。
或者酸酸氢二钠(Na2HPO4.12H2O,MW358.14)3.58g,加双蒸水至100ml。
pH -- A液(ml)-- B液(ml)5.60 -- 9.50 -- 0.255.91 -- 9.00 -- 1.006.24 -- 8.00 -- 2.006.47 --7.00 -- 3.006.64 -- 6.00 -- 4.006.81 -- 5.00 -- 5.006.98 -- 4.00 -- 6.007.17 -- 3.00 -- 7.007.38 -- 2.00 -- 8.007.73 -- 1.00 -- 9.008.04 -- 0.50 -- 9.50一般免疫组化用PBS都只包含Na2HPO4•12H2O(磷酸氢二钠)NaH2PO4•2H2O(磷酸二氢钠)Nacl用于细胞培养的PBS需含有氯化钾称取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml 蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L 即可0.01MPBS缓冲液称取NaCl 8g,KCl 0.2g,Na2HPO4•12H2O 3.63g, KH2PO4 0.24g,溶于900ml双蒸水中,用盐酸调pH值至7.4,加水定容至1L,常温保存备用。
PBS是最普遍不过的实验室缓冲液,但其配方各异。
以下是我的总结:母液的配制:0.2M Na2HPO4:称取 71.6g Na2HPO4-12H2O,溶于 1000ml 水0.2M NaH2PO4:称取 31.2g NaH2PO4-2H2O,溶于1000ml 水各种浓度PB(pH=7.4)的配制:先配 0.2M PB (pH=7.4,100ml):取19ml 0.2mol/L 的 NaH2PO4, 81ml 0.2mol/L 的 Na2HPO4, 即可。
PBS缓冲液的配制方法

PBS缓冲液配方不管是免疫组化,还是细胞培养中,常用到PBS缓冲液,下面是我们实验室的配方,供大家参考。
我们实验室的配方:A液:0.1mol/L磷酸二氢钾:磷酸二氢钾〔KH2PO4,MW136.09〕1.361g,加双蒸水至100ml。
B液:0.1mol/L磷酸氢二钠:酸酸氢二钠〔Na2HPO4.2H2O,MW177.99〕1.78g,加双蒸水至100ml。
或者酸酸氢二钠〔Na2HPO4.12H2O,MW358.14〕3.58g,加双蒸水至100ml。
pH --A液〔ml〕--B液〔ml〕5.60 --9.50 --0.255.91 --9.00 --1.006.24 --8.00 --2.006.47 --7.00 --3.006.64 --6.00 --4.006.81 --5.00 --5.006.98 --4.00 --6.007.17 --3.00 --7.007.38 --2.00 --8.007.73 --1.00 --9.008.04 --0.50 --9.50一般免疫组化用PBS都只包含Na2HPO4•12H2O〔磷酸氢二钠〕NaH2PO4•2H2O〔磷酸二氢钠〕Nacl用于细胞培养的PBS需含有氯化钾称取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml 蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L 即可0.01MPBS缓冲液称取NaCl 8g,KCl 0.2g,Na2HPO4•12H2O 3.63g, KH2PO4 0.24g,溶于900ml双蒸水中,用盐酸调pH值至7.4,加水定容至1L,常温保存备用。
PBS是最普遍不过的实验室缓冲液,但其配方各异。
以下是我的总结:母液的配制:0.2M Na2HPO4:称取 71.6g Na2HPO4-12H2O,溶于 1000ml 水0.2M NaH2PO4:称取 31.2g NaH2PO4-2H2O,溶于1000ml 水各种浓度PB(pH=7.4)的配制:先配 0.2M PB (pH=7.4,100ml):取19ml 0.2mol/L 的 NaH2PO4, 81ml 0.2mol/L 的 Na2HPO4, 即可。
pbs 缓冲液的配置0.01M

0.1M “PBS”缓冲液配制(10倍浓缩)一般所说PBS缓冲液为0.01M,故使用时需稀释溶液10倍1、首先配制0.2mol/L磷酸盐缓冲液(PB)试剂:NaH2PO4·2H2ONa2HPO4·12H2O配制方法:先配制0.2mol/L的NaH2PO4(A液)和0.2mol/L的Na2HPO4(B液),两者按一定比例混和即成0.2mol/L磷酸盐缓冲液。
A液:称取NaH2PO4·2H2O 3.12g,加双蒸水充分溶解定容至100ml;B液:称取Na2HPO4·12H2O 7.16g,加双蒸水充分溶解定容至100ml;2、0.2mol/L磷酸盐缓冲液(PB)的配制:A液为碱性,B液为酸性;取A液和B液在pH计的监测下按一定比例进行混和,可得到所需的不同pH的0.2mol/L的PB。
pH7.4所需A液和B液为1.9ml和8.1ml0.2mol/L磷酸盐缓冲液(pH5.7~8.0)(PB)pH 0.2mol/L NaH2PO4(ml) 0.2mol/L Na2HPO4(ml)7.3 2.3 6.77.4 1.9 8.17.5 1.6 8.43、0.1mol/L磷酸盐缓冲生理盐水(PBS):(1)、100ml试剂:0.2mol/L PB 50ml 【(5×1.9)+(5×8.1)= 9.5 + 40.5】NaCl 0.85-0.9g(约0.15mol/L)双蒸水加至100ml配制方法:取0.2mol/L PB 50ml,加入30ml双蒸水及NaCl 0.85-0.9g,充分搅拌溶解后加入双蒸水定容至100ml。
一般情况下,0.2mol/L PB的pH值稍微高些,稀释成0.1mol/L PBS时,常可达到要求的pH;若需调整pH,通常是调PB的pH。
(2)、20ml试剂:0.2mol/L PB 10ml 【1.9(A)+8.1(B)= 10ml】NaCl 0.17-0.18g (约0.15mol/L)双蒸水加至20ml配制方法:取0.2mol/L PB 10ml,加入6ml双蒸水及NaCl 0.17-0.18g,充分搅拌溶解后加入双蒸水定容至20ml。
PBS缓冲液配制

NaCl 8.0g;KCl 0.2g;Na2HPO4 1.44g;KH2PO4 0.24g;加蒸馏水至1000ml,调节pH到7.4(用Na2HPO4或KH2PO4调节)。用于免疫反应时可加入0.1%叠氮钠(0.1g/100ml PBS);当试剂中含有辣根过氧化物酶时,严禁使用叠氮钠,可改用0.01%柳硫汞。
PBS缓冲液称取NaCl 8g,KCl 0.2g,Na2HPO4•12H2O 3.63g, KH2PO4 0.24g,溶于900ml双蒸水中,用盐酸调pH值至7.4,加水定容至1L,常温保存备用。
PBST缓冲液取300μl Tween-20加入PBS 100ml中,混匀后即刻使用。现用现配。如果是把所有固体加大十倍,配置为浓缩液,工作时候十倍稀释,那么,在刚配好浓缩液时,PH在6.5左右,明显偏酸。不能用盐酸调。虽然可以用氢氧化钠颗粒调,但是有更方便的方法。十倍稀释以后,PH自动升高到所需要的值。不需要其它任何处理。这个可以先取少量试一试,配好之后再测一次~
PBS缓冲液配方
PH 7.6 7.4 7.2 7.0 H2O 1000 1000 1000 1000 NaCl 8.5 8.5 8.5 8.5 Na2HPO4 2.2 2.2 2.2 2.2 NaH2PO4 0.1 0.2 0.3 0.4
根据经验来看,新鲜配置的PBS搅匀后其PH值约在7.2-7.4之间,可是在温度的影响下,尤其在夏天,其电离常数发生了改变,在经过昼夜的时间后,PH值会明显改变(我亲自测过偏酸)。所以做实验的同学可要注意了,PH值可能会影响实验结果,甚至可能导致阴性。所以务必记得这个时候和天气,要加强实验条件控制问题。每次使用前最好用试纸测一下过夜了的PBS,如果发生偏酸或偏碱,注意重新换新液。
pbs 缓冲液的配置
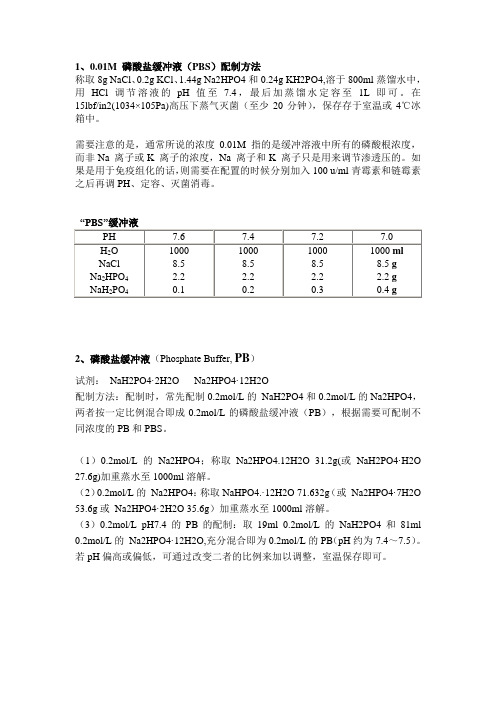
1、0.01M 磷酸盐缓冲液(PBS)配制方法称取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L即可。
在15lbf/in2(1034×105Pa)高压下蒸气灭菌(至少20分钟),保存存于室温或4℃冰箱中。
需要注意的是,通常所说的浓度0.01M 指的是缓冲溶液中所有的磷酸根浓度,而非Na 离子或K 离子的浓度,Na 离子和K 离子只是用来调节渗透压的。
如果是用于免疫组化的话,则需要在配置的时候分别加入100 u/ml青霉素和链霉素之后再调PH、定容、灭菌消毒。
2、磷酸盐缓冲液(Phosphate Buffer, PB)试剂:NaH2PO4·2H2O Na2HPO4·12H2O配制方法:配制时,常先配制0.2mol/L的NaH2PO4和0.2mol/L的Na2HPO4,两者按一定比例混合即成0.2mol/L的磷酸盐缓冲液(PB),根据需要可配制不同浓度的PB和PBS。
(1)0.2mol/L的Na2HPO4;称取Na2HPO4.12H2O 31.2g(或NaH2PO4·H2O 27.6g)加重蒸水至1000ml溶解。
(2)0.2mol/L的Na2HPO4:称取NaHPO4.·12H2O 71.632g(或Na2HPO4·7H2O 53.6g或Na2HPO4·2H2O 35.6g)加重蒸水至1000ml溶解。
(3)0.2mol/L pH7.4的PB的配制:取19ml 0.2mol/L的NaH2PO4和81ml 0.2mol/L的Na2HPO4·12H2O,充分混合即为0.2mol/L的PB(pH约为7.4~7.5)。
若pH偏高或偏低,可通过改变二者的比例来加以调整,室温保存即可。
0.2mol/L磷酸盐缓冲液(pH5.7~8.0)pH 0.2mol/L NaH2PO4(ml) 0.2mol/L Na2HPO4(ml) 5.7 93.5 6.55.8 92.0 8.05.9 90.0 10.06.0 87.7 12.36.1 85.0 15.06.2 81.5 18.56.3 77.5 22.56.4 73.5 26.56.5 68.5 31.56.6 62.5 37.56.7 56.5 43.56.8 51.0 49.06.9 45.0 55.07.0 39.0 61.07.1 33.0 67.07.2 28.0 72.07.3 23.0 67.07.4 19.0 81.07.5 16.0 84.07.6 13.0 87.07.7 10.5 89.57.8 8.5 91.57.9 7.0 93.08.0 5.3 94.73、0.1mol/L磷酸盐缓冲生理盐水(PBS)的配制方法一1、首先配制0.2mol/L磷酸盐缓冲液(PB)试剂:NaH2PO4·2H2ONa2HPO4·12H2O配制方法:先配制0.2mol/L的NaH2PO4(A液)和0.2mol/L的Na2HPO4(B液),两者按一定比例混和即成0.2mol/L磷酸盐缓冲液。
0.01M PBS (pH 7.4)配制标准操作规程
编号:YF-001 实验室PBS缓冲液配制标准操作规程
版次:第一版/0 第1页/共1页
0.01M PBS (pH 7.4)配制标准操作规程
1.目的
建立实验室PBS缓冲液配制标准操作规程,确保溶液的配制准确
2.适用范围
0.01M PBS pH7.4缓冲液配制。
3.溶液配制前
3.1 配制前确认药品是否足够,不足的按名称、编号、规格、数量等填写限额领料单给领料员到仓库领料。
3.2 领取的药品需具有合格标签,并在有效期内。
3.3 准备配制所用的试剂瓶、烧杯和烧瓶等,检查是否已清洁并且干燥。
4. 溶液配制(以1000mL为例)
4.1 称量:用电子分析天平按下表称取药品并做好记录,倒入1000ml烧杯中。
4.2 溶解:用量筒量取800mL纯化水倒入烧杯中,放入搅拌转子,并放到磁力搅拌器上搅拌至完全溶解。
4.3 pH调节:用校准后的pH计测量上述溶液的pH,用0.1M的HCl或NaOH调整pH=7.40±0.05。
4.4 定容:将上述完全溶解的溶液到入1000ml容量瓶,并用少量纯化水冲洗烧杯后,倒入容量瓶,重复3次,将容量瓶中的液体用纯化水补充至刻度线,塞上盖子后上下颠倒10次,确保溶液充分混匀。
4.6 过滤:
4.7 移瓶:将定容后的溶液倒入洁净蓝色盖子的玻璃瓶,在瓶身上标明品名、体积、日期、有效期、操作者等信息。
4.8 存储:该溶液于(4~30)℃,可保存6个月。
5.溶液配制完成后
5.1 按要求填写溶液配制记录。
5.2 关闭仪器,填写仪器使用记录。
5.3 清理实验场地,清洗烧杯、容量瓶、转子等。
PBS缓冲液的配制方法

PBS缓冲液配方不管是免疫组化,还是细胞培养中,常用到PBS缓冲液,下面是常用配方,供大家参考。
用于细胞培养的PBS需含有氯化钾称取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L,灭菌即可。
0.01M PBS缓冲液称取NaCl 8g,KCl 0.2g,Na2HPO4•12H2O 3.63g, KH2PO4 0.24g,溶于900ml 双蒸水中,用盐酸调pH值至7.4,加水定容至1L,常温保存备用。
一般免疫组化用PBS,主要用来清洗,都只包含Na2HPO4•12H2O(磷酸氢二钠)和NaH2PO4•2H2O(磷酸二氢钠)两种组分,母液的配制:0.2M Na2HPO4:称取 71.6g Na2HPO4-12H2O,溶于 1000ml 水0.2M NaH2PO4:称取 31.2g NaH2PO4-2H2O,溶于1000ml 水各种浓度PB(pH=7.4)的配制:先配 0.2M PB (pH=7.4,100ml):取19ml 0.2mol/L 的 NaH2PO4, 81ml 0.2mol/L 的 Na2HPO4, 即可。
然后只需将0.2M PB (pH=7.4)按相应比例适当稀释即可,如:0.1M PB(PH=7.4):取 500ml 0.2M PB,加水稀释至 1000ml 即可。
0.01M PB (PH=7.4):取50ml 0.2M PB,加水稀释至 1000ml 即可。
0.02M PB (PH=7.4):取100ml 0.2 M PB,加水稀释至 1000ml 即可。
若需要 NaCL 的话,加入 NaCL 至0.9%(g/100ml)即可。
另:其它各种另 PH值的 0.2M PB(100ml)配方:pH 0.2M NaH2PO4(ml) 0.2M Na2HPO4(ml)5.7 93.5 6.55.8 92 85.9 90 106.0 87.7 12.36.1 85 156.2 81.5 18.56.3 77.5 22.56.4 73.5 26.56.5 68.5 31.56.6 62.5 37.56.7 56.5 43.56.8 51 496.9 45 557.0 38 627.1 33 677.2 28 727.3 23 777.4 19ml 81ml7.5 16 847.6 13 877.7 10.5 0.57.8 8.5 91.57.9 7 938.0 5.3 94.7关于磷酸缓冲溶液的一些问答PBS可以为三种溶液的英文缩写,分别是1.磷酸盐缓冲溶液(phosphate buffered solution)、2.磷酸盐缓冲盐水(phosphate buffered saline)及3.磷酸盐缓冲钠(phosphate buffered sodium),其配制方法不同,pH值不同,发挥的生物学作用亦不完全相同。
pbs缓冲液各种PH值得配制方法

配置方法编辑采用去离子水、KH2PO4和Na2HPO4·2H2O配制PBS溶液,按以下步骤进行:(1) 配制1/15mol/L KH2PO4,即每升水中溶解9.078克KH2PO4;(2) 配制1/15mol/LNa2HPO4·2H2O,即每升水中溶解11.876克Na2HPO4·2H2O;(3) 将18.2%(体积分数)KH2PO4溶液和81.8%Na2HPO4·2H2O混合;最终测定PBS液的PH值约为7.4。
磷酸盐缓冲液取磷酸二氢钠38.0g,与磷酸氢二钠5.04g,加水使成1000ml,即得。
磷酸盐缓冲液(pH2.0) 甲液:取磷酸16.6ml,加水至1000ml,摇匀。
乙液:取磷酸氢二钠71.63g,加水使溶解成1000ml。
取上述甲液72.5ml与乙液27.5ml混合,摇匀,即得。
磷酸盐缓冲液(pH2.5) 取磷酸二氢钾100g,加水800ml,用盐酸调节pH至2.5,用水稀释至1000ml。
磷酸盐缓冲液(pH5.0) 取0.2mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液调节pH值至5.0,即得。
磷酸盐缓冲液(pH5.8) 取磷酸二氢钾8.34g与磷酸氢二钾0.87g,加水使溶解成1000ml,即得。
磷酸盐缓冲液(pH6.5) 取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液15.2ml,用水稀释至100ml,即得。
磷酸盐缓冲液(pH6.6) 取磷酸二氢钠1.74g、磷酸氢二钠2.7g与氯化钠1.7g,加水使溶解成400ml,即得。
磷酸盐缓冲液(含胰酶)(pH6.8) 取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释至1000ml,即得。
磷酸盐缓冲液(pH6.8) 取0.2mol/L磷酸二氢钾溶液250ml,加0.2mol/L氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得。
0.01M PBS (pH 7.4)配制标准操作规程

编号:YF-001 实验室PBS缓冲液配制标准操作规程
版次:第一版/0 第1页/共1页
0.01M PBS (pH 7.4)配制标准操作规程
1.目的
建立实验室PBS缓冲液配制标准操作规程,确保溶液的配制准确
2.适用范围
0.01M PBS pH7.4缓冲液配制。
3.溶液配制前
3.1 配制前确认药品是否足够,不足的按名称、编号、规格、数量等填写限额领料单给领料员到仓库领料。
3.2 领取的药品需具有合格标签,并在有效期内。
3.3 准备配制所用的试剂瓶、烧杯和烧瓶等,检查是否已清洁并且干燥。
4. 溶液配制(以1000mL为例)
4.1 称量:用电子分析天平按下表称取药品并做好记录,倒入1000ml烧杯中。
4.2 溶解:用量筒量取800mL纯化水倒入烧杯中,放入搅拌转子,并放到磁力搅拌器上搅拌至完全溶解。
4.3 pH调节:用校准后的pH计测量上述溶液的pH,用0.1M的HCl或NaOH调整pH=7.40±0.05。
4.4 定容:将上述完全溶解的溶液到入1000ml容量瓶,并用少量纯化水冲洗烧杯后,倒入容量瓶,重复3次,将容量瓶中的液体用纯化水补充至刻度线,塞上盖子后上下颠倒10次,确保溶液充分混匀。
4.6 过滤:
4.7 移瓶:将定容后的溶液倒入洁净蓝色盖子的玻璃瓶,在瓶身上标明品名、体积、日期、有效期、操作者等信息。
4.8 存储:该溶液于(4~30)℃,可保存6个月。
5.溶液配制完成后
5.1 按要求填写溶液配制记录。
5.2 关闭仪器,填写仪器使用记录。
5.3 清理实验场地,清洗烧杯、容量瓶、转子等。
磷酸盐缓冲液配制方法

磷酸盐缓冲液(PBS)配制方法0.01M PBSPBS (135 mM NaCl, 2.7 mM KCl, 1.5 mM KH2PO4, and 8 mM K2HPO4,pH 7.2)PBS缓冲液(pH7.2~7.4):NaCl 137mmol/L,KCl 2.7mmol/L,Na2HPO4 4.3mmol/L,KH2PO4 1.4mmol/L称7.9g NaCl,0.2g KCl,0.24g KH2PO4(or 1.44g Na2HPO4)和1.8g K2HPO4,溶于800 ml 蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1 L。
保存于4℃冰箱中即可。
需要注意的是,通常所说的浓度0.01 M 指的是缓冲溶液中所有的磷酸根浓度,而非Na 离子或K 离子的浓度,Na 离子和K 离子只是用来调节渗透压的。
母液的配制:0.2M Na2HPO4:称取71.6g Na2HPO4-12H2O,溶于1000ml 水0.2M NaH2PO4:称取31.2g NaH2PO4-2H2O,溶于1000ml 水各种浓度PB(pH=7.4)的配制:先配0.2M PB (pH=7.4,100ml):取19ml 0.2mol/L的NaH2PO4,81ml 0.2mol/L 的Na2HPO4, 即可。
然后只需将0.2M PB (pH=7.4)按相应比例适当稀释即可,如:0.1M PB(PH=7.4):取500ml 0.2M PB,加水稀释至1000ml 即可。
0.01M PB (PH=7.4):取50ml 0.2M PB,加水稀释至1000ml 即可。
0.02M PB (PH=7.4):取100ml 0.2 M PB,加水稀释至1000ml 即可。
若需要NaCl的话,加入NaCl 至0.9%(g/100ml)即可。
另:其它各种另PH值的0.2M PB(100ml)配方:pH 0.2M NaH2PO4(ml)0.2M Na2HPO4(ml)5.7 93.56.55.8 92 85.9 90 106.0 87.7 12.36.1 85 156.2 81.5 18.56.3 77.5 22.56.4 73.5 26.56.5 68.5 31.56.6 62.5 37.56.7 56.5 43.56.8 51 496.9 45 557.0 38 627.1 33 677.2 28 727.3 23 777.4 19ml 81ml7.5 16 847.6 13 877.7 10.5 90.57.8 8.5 91.57.9 7 938.0 5.3 94.70.01M 磷酸盐缓冲液(PBS)配制方法称取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml蒸馏水中,用HCl 调节溶液的pH值至7.4,最后加蒸馏水定容至1L即可。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PBS缓冲液配制标准操作规程
1 范围
本标准适用于PBS缓冲液的配制。
2 职责
操作人员:严格按照该标准操作规程进行。
QA:对该标准操作规程的执行情况进行监督检查。
3 内容
3.1 操作前检查
3.1.1 计量器具是否完好,性能与称量要求相符,并在检定有效期内。
3.1.2 操作人员检查水、电、气供应是否良好,纯化水及注射用水是否检验合格。
3.1.3 操作人员检查洁净室温度、湿度、压差是否符合要求。
3.1.4 操作人员检查质量部门出示的尘埃粒子、沉降菌的检测报告是否符合相关规定,并在有效期内。
3.1.5 操作人员应对上一个班次的生产清场进行检查,有QA下发的清场合格证,方可进行操作。
3.1.6 检查电子天平等设备状态标志,设备是否“完好”、“已清洁”。
3.1.7 检查所需文件记录齐备,无与本批生产无关的指令及记录,无与本批生产无关的物料。
3.1.8 及时填写并悬挂生产状态卡。
3.2 操作前准备
3.2.1 药品
氯化钠
磷酸氢二钠
磷酸二氢钠(NaH
2PO
4
·H
2
O)
3.2.2 器具配液罐
搅拌器
电子天平
蠕动泵
套筒式滤器
滤芯
印度瓶
pH计
吸管
吸头
硅胶塞
绢布
丝光绳
3.3 配制过程
3.3.1 配方:配制0.001mol/L PBS缓冲液(按10L配制量计算)配制10L0.01mol/L
PBS 缓冲液需用药品氯化钠80.8g、磷酸氢二钠12.4g、磷酸二氢钠(NaH
2PO
4
·H
2
O)1.8g,
如药品结晶水有变化应按其配方相应换算。
3.3.2 用电子天平分别称取 3.3.1中药品倒入同一印度瓶中,加注射用水至8000ml,摇动印度瓶使其充分溶解,补加注射用水至10L,混匀(二人复核)。
3.3.3 用pH计测pH值,为7.6±0.1时合格。
3.3.4 按生产所需进行分装,经过滤后,每10000ml印度瓶装量7000ml包扎瓶口,然后贴上标签注明名称、批号、灭菌日期及有效期。
3.3.5 于121℃、0.105Mpa、60分钟(压力蒸汽灭菌器)或 121℃、0.105Mpa、40
分钟(脉动真空灭菌柜)高压灭菌,灭菌后存放于已高压灭菌室备用,有效期72小时,或按3.3.6项进行操作。
3.3.6 启动蠕动泵,将PBS缓冲液通过套筒式过滤器过滤到印度瓶中,盖上灭菌胶塞。
(如使用配液罐,参照3.3.2按相应的配制体积加入药品,使其充分溶解后校准液量,再除菌过滤)。
参照《除菌过滤标准操作规程》。
3.3.7 取样做无菌试验,参照《无菌检查标准操作规程》。
3.3.8 对套筒式过滤系统清洗参照《套筒式过滤系统清洁标准操作规程》。
3.3.9 对套筒式过滤系统进行完整性检测,参照《完整性检测仪使用、维护
保养标准操作规程》,如完整性检测不合格,应对制品重新滤制。
3.3.10 在瓶壁上贴上标签,注明名称、批号、浓度、配制日期、有效期,放入2~8℃冷库中保存备用,并在6个月内使用完。
3.3.11 填写PBS缓冲液配制记录。
3.4 清洁清场
3.4.1 生产结束后,对物料、设备、文件、环境按《清场管理规程》进行清洁及时悬挂卫生状态标志。
3.4.2 清场合格后,经QA验收合格后发放清场合格证并作好清场记录。
3.5 异常情况处理和报告
3.5.1 在配液过程中如遇停电、无注射用水,应立即盖好所有盖子保持环境的清洁卫生要求。
3.5.2 如遇异常情况按上述方法处理后,应立即报告相关人员和车间主任。
4 相关文件
《除菌过滤标准操作规程》
《无菌检查标准操作规程》
《套筒式过滤系统清洁标准操作规程》
《完整性检测仪使用、维护保养标准操作规程》
《物品进出一般生产区和洁净区标准操作规程》
《人员进出一般生产区和洁净区标准操作规程》
《清场管理规程》
《压力蒸汽灭菌器使用、维护保养标准操作规程》。
