必修二1-2碱金属和卤族元素
(完整word版)化学:第一章第一节碱金属元素和卤素学案(人教版新课标必修2)
第一章物质结构元素周期律第一节元素周期表(第2课时)碱金属元素和卤素【学习目标】1.了解碱金属元素的原子结构及特点。
2.了解碱金属元素化学性质的相似性和递变性。
3.了解卤族元素在周期表中的位置及原子的结构特点。
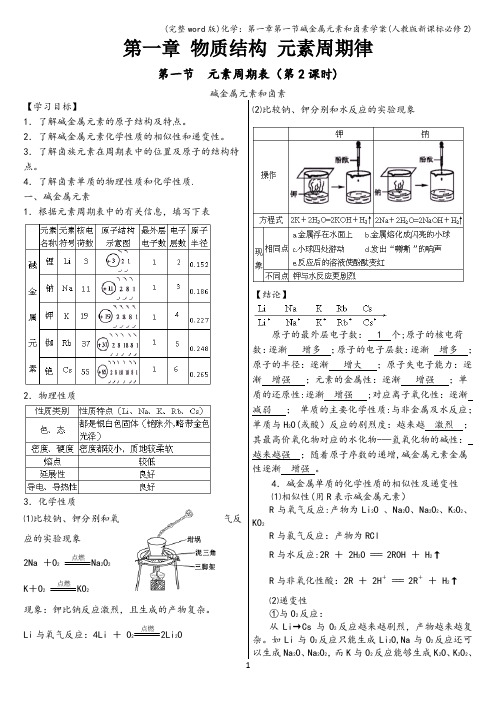
4.了解卤素单质的物理性质和化学性质.一、碱金属元素1.根据元素周期表中的有关信息,填写下表2.物理性质3.化学性质⑴比较钠、钾分别和氧气反应的实验现象2Na +O2点燃Na2O2K+O2点燃KO2现象:钾比钠反应激烈,且生成的产物复杂。
Li与氧气反应:4Li + O2点燃2Li2O ⑵比较钠、钾分别和水反应的实验现象【结论】原子的最外层电子数: 1 个;原子的核电荷数:逐渐增多;原子的电子层数:逐渐增多;原子的半径:逐渐增大;原子失电子能力:逐渐增强;元素的金属性:逐渐增强;单质的还原性:逐渐增强 ;对应离子氧化性:逐渐减弱;单质的主要化学性质:与非金属及水反应;单质与H2O(或酸)反应的剧烈度:越来越激烈;其最高价氧化物对应的水化物-—氢氧化物的碱性:越来越强;随着原子序数的递增,碱金属元素金属性逐渐增强。
4.碱金属单质的化学性质的相似性及递变性⑴相似性(用R表示碱金属元素)R与氧气反应:产物为Li2O 、Na2O、Na2O2、K2O2、KO2R与氯气反应:产物为RClR与水反应:2R + 2H2O === 2ROH + H2↑R与非氧化性酸:2R + 2H+=== 2R++ H2↑⑵递变性①与O2反应:从Li→Cs与O2反应越来越剧烈,产物越来越复杂。
如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O、Na2O2,而K与O2反应能够生成K2O、K2O2、KO2等。
②与H2O(或酸)的反应:从Li→Cs,与H2O(或酸)反应越来越剧烈,如K 与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
③最高价氧化物对应水化物的碱性:碱性:LiOH〈NaOH〈KOH<RbOH<CsOH。
(完整word版)化学第一章第一节碱金属元素和卤素学案(人教版新课标必修2)
第一章物质构造元素周期律第一节元素周期表(第 2 课时)碱金属元素和卤素【学习目标】1.认识碱金属元素的原子构造及特色。
2.认识碱金属元素化学性质的相像性和递变性。
3.认识卤族元素在周期表中的地点及原子的构造特色。
4.认识卤素单质的物理性质和化学性质。
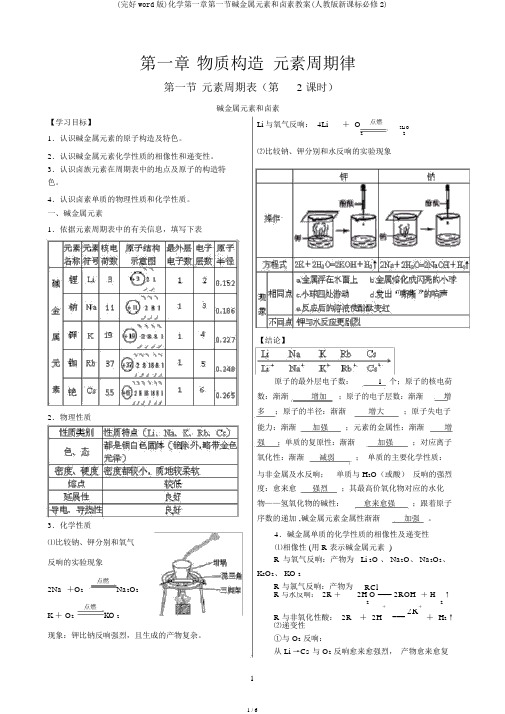
一、碱金属元素1.依据元素周期表中的有关信息,填写下表2.物理性质3.化学性质⑴比较钠、钾分别和氧气反响的实验现象点燃2Na +O2Na2O2点燃K + O2KO 2现象:钾比钠反响强烈,且生成的产物复杂。
Li 与氧气反响: 4Li+ O点燃2Li O22⑵比较钠、钾分别和水反响的实验现象【结论】原子的最外层电子数: 1 个;原子的核电荷数:渐渐增加;原子的电子层数:渐渐增多;原子的半径:渐渐增大;原子失电子能力:渐渐加强;元素的金属性:渐渐增强;单质的复原性:渐渐加强;对应离子氧化性:渐渐减弱;单质的主要化学性质:与非金属及水反响;单质与 H2O(或酸)反响的强烈度:愈来愈强烈;其最高价氧化物对应的水化物——氢氧化物的碱性:愈来愈强;跟着原子序数的递加 ,碱金属元素金属性渐渐加强。
4.碱金属单质的化学性质的相像性及递变性⑴相像性 (用 R 表示碱金属元素 )R与氧气反响:产物为 Li 2O 、 Na2O、 Na2O2、K2O2、 KO 2R 与氯气反响:产物为RClR 与水反响: 2R +2H O === 2ROH+ H↑22 R 与非氧化性酸: 2R+++ 2H===2R+ H2↑⑵递变性①与 O2反响:从 Li →Cs 与 O2反响愈来愈强烈,产物愈来愈复杂。
如 Li 与 O 2 反响只好生成 Li 2O ,Na 与 O 2 反响还 从 Li →Cs,与 H 2O(或酸 ) 反响愈来愈强烈,如 K能够生成 Na 2O 、 Na 2O 2,而 K 与 O 2 反响能够生成与 H 2O 反响可能会发生稍微爆炸, Rb 与 Cs 遇水发K 2O 、 K 2O 2、 KO 2 等。
高中化学必修二课件-1.2元素周期律1-人教版

原子 11
12
13
14
15 16 17 18
序数
元素 钠 镁
铝
硅
磷
硫氯氩
名称
元素 Na Mg
Al
Si
P
S Cl Ar
符号
电子 排布
2,8,1 2,8,2
2,8,3
2,8,4 2,8,5 2,8,6 2,8,7 2,8,8
原子半径 (10-10m)
1.86
1.60
1.43
1.17 1.10
1.02 0.99 1.91
化合价 +1
+2
+3
+4 -4
+5 +6 +7 -3 -2 -1
0
随着原子序数的递增,元素原子的核外电子排布、元 素的原子半径和元素化合价各有什么变化规律?
原子序数 1--2
电子层数 最外层电子数
1
1→2
原子半径的变化 最高或最低化合价的 变化
-------
+1-------→0
3--10
2
2数的递增,电子层数的增大, 原子半径、元素的金属性、单质的还原性等有什么递变规 律?
2.卤族元素中,随着核电荷数的递增,电子层数的增大, 原子半径、元素的非金属性、单质的氧化性等有什么递变 规律?
同主族元素性质递变规律:
同一主族中,随着核电荷数的递增,原子核外电子层数增 加,原子半径增大,得电子能力逐渐减弱,失电子能力逐 渐增强,非金属性逐渐减弱,金属性逐渐增强。
探究1:
随着原子序数的递增,同周期主族元素的性质又 有哪些递变规律呢?
二、元素周期律
核电荷数为1-18的元素原子核外电子层排布
高中化学人教版必修2课件:1.1.2元素的性质与原子结构课件

b.得出结论:从 F2 到 I2,与 H2 反应所需要的条件逐渐升高, 反应剧烈程度依次减弱,生成气态氢化物的稳定性依次减弱。
②卤素单质间的置换反应。 a.填写下表:
实验操作 实验现象 化学方程式 静置后,液体分层,上层 2NaBr+Cl2===2NaCl+ Br2 无色,下层橙红色 静置后,液体分层,上层 2KI+Br2===2KBr+I2 无色,下层紫红色 静置后,液体分层,上层 2KI+Cl2===2KCl+I2 无色,下层紫红色
3.氟、氯、溴、碘四种元素,它们的下列性质的递变规律 不正确的是( ) A.单质的密度依次增大 B.单质的熔、沸点依次升高 C.Cl2 可以从 KI 溶液中置换出 I2 D.Br2 可以从 NaCl 溶液中置换出 Cl2
【答案】 D
4.卤素是最活泼的一族非金属元素,下列关于卤族元素的 说法正确的是( ) A.卤素单质的最外层电子数都是 7 B.卤族元素的单质只有氧化性 C.从 F 到 I,原子核对最外层电子的吸引能力依次减弱, 原子的得电子能力依次减弱 D.卤素单质与 H2 化合的难易程度为 F2<Cl2<Br2<I2
ห้องสมุดไป่ตู้
Cs
0.265
结 相同 最外层电子数都是 1 构 点 特 递变 从 Li 到 Cs,核电荷数逐渐增加,电子层数 点 性 逐渐 增多,原子半径逐渐 增大
2.碱金属单质的性质 (1)碱金属单质的物理性质
(2)实验探究碱金属单质的化学性质 a.锂、钠、钾与 O2 反应的比较
b.钾、钠与 H2O 反应的比较
物 理 性 质
2.碱金属单质的化学性质的相似性、递变性和特殊性 相似性 递变性 特殊性 还原性逐渐 均为活泼金 增强,与 O2、 属,还原性 化学 水反应剧烈 Li 与 O2 反应 强,易与 O2、 性质 程度增强, 只生成 Li2O H2O 等反应, ROH 碱性逐 ROH 为强碱 渐增强 Li Na K Rb Cs ―――――→ 结论 金属性逐渐增强,单质还原性增强
化学必修Ⅱ人教新课标1-1-2碱金属元素的结构与性质课件(41张)

卤族元素
[基础·初探] 教材整理 1 卤族元素的结构与性质 1.卤族元素的原子结构 卤族元素包括: F、Cl、Br、I、At (写元素符号)。 原子结构特点如下: (1)相似性:最外层电子数都是____7____; (2)递变性:F→I,核电荷数 增多 ,电子层数 增多 ,原子半径 增大 。
上一页
返回首页
下一页
2.卤素单质的物理性质 F2
颜色、 淡黄绿 状态 色气体 密度
熔、沸点
Cl2
Br2
I2
黄绿色 深红棕 色 紫黑 色
气体 液体
固体
逐渐 增大
逐渐 升高
3.卤素单质的化学(用“>”或“<”填写): 反应的剧烈程度:F2> Cl2 > Br2 > I2; 氢化物的稳定性:HF > HCl > HBr > HI。
1.钠、钾与氧气的反应
[合作·探究]
2.钠、钾与水的反应
[核心·突破] 1.碱金属元素原子结构与性质的关系
2.碱金属单质化学性质的相似性和递变性 (1)相似性(用 R 表示碱金属元素)
(2)递变性
①与 O2 反应 从 Li→Cs,与 O2 反应越来越剧烈,产物越来越复杂;如 Li 与 O2 反应只能生 成 Li2O,Na 与 O2 反应还可以生成 Na2O2,而 K 与 O2 反应能够生成 KO2 等。
2.碱金属的化学性质(写出化学方程式)
(1)与 O2 反应
①锂与氧气反应:4Li+O2==△===2Li2O。
②钠与氧气反应: 4Na+O2===2Na2O ;2Na+O2==△===Na2O2
。
(2)与 H2O 反应 ①钠与水反应:2Na+2H2O===2NaOH+H2↑。
②钾与水反应:2K+2H2O===2KOH+H2↑
【推荐下载】高一必修2化学元素周期律知识点梳理

[键入文字]
高一必修2 化学元素周期律知识点梳理
世界由物质组成,化学则是人类用以认识和改造物质世界的主要方法和手段之一。
精品小编准备了高一必修2 化学元素周期律知识点,希望你喜欢。
一.元素周期表的结构
周期序数=核外电子层数主族序数=最外层电子数
原子序数=核电荷数=质子数=核外电子数
二.元素的性质和原子结构
(一)碱金属元素:
2.碱金属化学性质的递变性:
递变性:从上到下(从Li 到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。
所以从Li 到Cs 的金属性逐渐增强。
结论:
1)原子结构的递变性导致化学性质的递变性。
1。
【人教版】高中化学必修二:1.1.2《元素性质》ppt课件

3.碱金属单质的化学性质 (1)K 与 O2 反应
钾迅速燃烧且比钠 →现象 的燃烧更
(2)K 与 H2O 反应 a. b. c.小球四处游动 d.发出 →现象 e.反应后的溶液 使酚酞 f.剧烈程度比钠与 水的反应
7.下列各组比较不正确的是(
)
A.锂与水反应不如钠与水反应剧烈 B.还原性:K>Na>Li,故 K 可以从 NaCl 溶液中置换出 金属钠 C.熔、沸点:Li>Na>K D.碱性:LiOH<NaOH<KOH
2.碱金属单质的物理性质 (1) 相 似 性 : 都 是 ________ 色 金 属 ( 除 铯 外 ) , 质 地 ________( 填 “ 柔 软 ” 或 “ 坚 硬 ”) , 密 度 ________ , 熔 点 ________,导热性和导电性________,有延展性。 (2)差异性和递变性:随着 Li、Na、K、Rb、Cs________ 的递增,碱金属熔、沸点__________,密度________(Li、Na、 K 的密度小于 1 g· cm 3,Rb、Cs 的密度大于 1 g· cm 3),特殊
二、卤族元素 1.卤族元素的原子结构及特点 (1)原子结构示意图 氟__________,氯__________,溴__________,碘 (2)结构特点 ①卤族元素位于周期表第________族。 ②相同点:最外层上都有________个电子。 ③递变性:从 F→I,核电荷数逐渐________,电子层数逐 渐________,原子半径逐渐________。 。
2KI+Br2===2KBr+ I2
课前预习 一、 1.(1)Li 37 1 5 Cs 3 55 1 1 2 Na 6 小 11 1 3 K 19 1 4 Rb
碱金属和卤族元素

不同现 后熔化并燃烧,火焰呈黄色 先熔化并燃烧,火焰呈紫色 象
产物 结论 Na2O2 更复杂的氧化物(KO2) ①K与Na都能与氧气发生反应; ②K比Na反应更加剧烈,金属性:K>Na
从实验中可获得的其他信息: ①K的保存(密度)②K的熔点(比Na更低) ③碱金属与氧气反应的产物越来越复杂 (写出Li在氧气中点燃的方程式)
0.534 0.97 0.86 1.532 1.879
180.5 97.81 63.65 38.89 28.40
1347 882.9 774 688 678.4
铯
Cs
55
提取信息:碱金属在物性哪些相似点,不同之处有什么规律?
相似性:色(铯略带金色)、软、轻、 低、导 递变性(从上到下):ρ增大 (K与Na反常); 熔、沸点降低。
二、卤族元素 Ⅶ A族 1、原子结构: 结构
最外层7个电子 核电荷数递增
F
+9 2 7
Cl
+17 2 8 7
Br
+35 2 8 18 7
+53
I
2 8 18 18 7
决定
性质
易得一个电子,具氧化性 原子核对外来电子的引力减弱
得电子能力(非金属性)减弱 单质氧化性逐渐减弱 氧化性:F2 > Cl2 > Br2 > I2
化学方程 2Na+2H2O=2NaOH+H2↑ 2K+2H2O=2KOH+H2↑ 式
思考:为了保证结论的准确性,还需补充哪些实验? 如果是Li、Rb、Cs与水反应,现象又会如何? 试写出反应的化学方程式。
3、碱金属元素性质小结
人教版化学必修二第一章第一节元素周期表(第二课时)

2.试管内液体分为 上下层,上层为无 色,下层为紫红色。 化学方程式:
KI溶液
Cl2 + 2KI =2KCl + I2
②卤素单质间的置换反应
溴水
四氯化碳
现象: 1.试管内溶液由无 色变褐色;
振荡
振荡
2.试管内液体分为 上下层,上层为无 色,下层为深紫色。 化学方程式:
KI溶液
Br2 + 2KI = 2KBr +I2
与O2 反应
与H2O 反应 结论
较剧烈,剧烈,生 轻微的爆 遇水立即 炸,生成 燃烧,爆 生成H2 成H2 炸 H2
金 属 性
逐 渐 增 强
碱金属总结(同主族从上到下)
1.相似性:
最外层上都只 有一个电子 化学性 质相似
1) 都易失电子表现强还原性 2) 化合物中均为+1价 核电荷数 2.递变性: 电子层数 原子 半径 核对最外 层电子的 引力
(2)碱金属单质的化学性质:
①与非金属单质(O2)的反应: 4Li+O2===2Li2O(氧化锂) 2Na+O2===Na2O2 (过氧化钠)
点燃 点燃 点燃
K+O2===KO2 (超氧化钾) ②与水反应 2Li+2H2O==2LiOH+H2 (比钠缓慢,且Li不熔化) 2Na+2H2O==2NaOH+H2
同一主族元素金属性和非金属变化 最
Li
失 电 子 能 力 逐 渐 增 强
金 属 性 逐 渐 增 强
F 9氟 Cl 17氯 Br 35溴 I 53碘 At 85砹
3锂 Na
11钠 K 19钾 Rb 37铷 Cs 55铯
非 金 属 性 逐 渐 增 强
人教版高中化学精品系列 必修二 碱金属元素和卤素 课件

难 反应,生成氢化物越来越不稳定 。
【应用:元素非金属性强弱判断依据】
比较元素非金属性强弱,其实质是看元素 原子得电子的难易,越容易得电子,非金属性 越强,反之非金属性越弱(方法3种) (1)非金属单质与氢气化合的难易程度;形成 气态氢化物的稳定性;氢化物稳定性越强,非 金属性越强; (2)最高价氧化物对应水化物酸性强弱; (3)单质间的置换反应。
【简单记忆】
同主族金属,最外层电子数相同,从上到 下,电子层数增多,半径增大。 从上到下
失电子能力增强,还原性增强,越活泼。
(金属性强,还原性强,失电子能力强)
VIIA族——卤族元素
(简称卤素)
【学与问】
卤素原子结构示意图:
交流· 探究:卤素在化学性质上的相似性和递变性?
【卤素原子结构特点】 (1)相似性:
【碱金属单质物理性质】
元 素 名 称 锂 钠 钾 铷 铯 元 素 符 号 Li Na K Rb Cs 颜色 核 电 和 荷 状态 数 3 银白色,柔软 11 银白色,柔软 19 银白色,柔软 37 银白色,柔软 55 略带金色光泽, 柔软
密度 熔点 g· cm-3 ℃ 0.534 0.97 0.86 1.532 1.879
最外层电子数均为 7 ,均易 得到 电子, 化合价 降低 ,被 还电荷数的递增,电子层数渐 增多 , 原子半径逐渐 增大 。
【卤素单质化学性质】
金属越容易失去电子,越活泼,还原性 越强,反应越剧烈。那么非金属呢?
由F到I,非金属性逐渐
减弱
。
化学反应越来越 剧烈
随着核电荷数的递增,电子层数逐渐 增多, 原子半径逐渐 增大 ,越来越容易失去电子。
【碱金属元素原子结构特点】
高一化学人教版必修2课件:1.1.2元素的性质与原子结构

自主预习
知识梳理 典例透析
合作探究
一、碱金属单质化学性质的相似性及递变性 1.相似性(用R表示碱金属元素)
自主预习
知识梳理 典例透析
合作探究
2.递变性 (1)与O2反应。 从Li→Cs,与O2反应越来越剧烈,产物越来越复杂,如Li与O2反应 只能生成Li2O,Na与O2反应还可以生成Na2O2,而K与O2反应能够生 成KO2等。 (2)与H2O(或酸)的反应。 从Li→Cs,与H2O(或酸)反应越来越剧烈,如K与H2O反应可能会发 生轻微爆炸,Rb和Cs遇水发生剧烈爆炸。 (3)最高价氧化物对应水化物的碱性。 碱性:LiOH<NaOH<KOH<RbOH<CsOH。
自主预习
知识梳理 典例透析
合作探究
(2)从元素单质及其化合物的相关性质判断。 ①金属单质与水或酸反应越剧烈,元素金属性越强。 ②最高价氧化物对应水化物的碱性越强,元素金属性越强。 (3)根据金属活动性顺序判断。 一般来说排在前面的金属元素其金属性比排在后面的强。 (4)根据离子的氧化性强弱判断。 一般来说离子的氧化性越强,则对应金属元素的金属性越弱。
自主预习
知识梳理 典例透析
合作探究
二、卤素单质性质的相似性、递变性和特性 1.相似性
(1)与 H2 反应:X2+H2
(3)与H2O反应:
2HX。 2NaX。
(2)与活泼金属(如 Na)反应:2Na+X2
自主预习
知识梳理 典例透析
合作探究
2.递变性 (1)氧化性与还原性。
(2)与H2反应的难易及氢化物稳定性(由F2→I2)。 ①与H2反应越来越难,生成氢化物的稳定性逐渐减弱,还原性逐 渐增强。 ②氢化物中HCl、HBr、HI的熔、沸点依次升高。 (3)卤素单质与变价金属(如Fe)反应。
高中化学人教版必修2课件第一章第一节第2课时元素的性质与原子结构

解题归纳 卤素单质的特殊性
1.氟无正价,无含氧酸,而 Cl、Br、I 都有正化合 价和含氧酸。
2.Cl2 易液化,Br2 易挥发,I2 易升华。
3.常温下呈液态的非金属单质是 Br2,I2 遇淀粉变蓝 色。
4.活泼的卤素单质能置换较不活泼的卤素单质,但 F2 不 能 从 NaCl 溶 液 中 置 换 出 Cl2 , 原 因 是 2F2 + 2H2O===4HF+O2↑。
2.钠与水反应的离子方程式为 2Na+2H2O===2Na+ +2OH-+H2↑。钠与氧气在常温和加热条件下反应得到 的产物分别为:Na2O、Na2O2。
3.氯气与氢气反应的条件是:点燃或光照,与溴化 钠溶液反应的离子方程式为:Cl2+2Br-=== 2Cl-+Br2。
4.实验室制取氯气,验证集气瓶是否收集满的方法 之一:用湿润的淀粉碘化钾试纸,具体操作是:用镊子 夹住湿润的淀粉碘化钾试纸放在瓶口处;反应原理(用离 子方程式表示)Cl2+2I-===I2+2Cl-。
2.砹是原子序数最大的卤族元素,根据卤素性质的 递变规律,对砹及其化合物的叙述正确的是( )
A.与 H2 化合能力:At2>I2 B.砹在常温下为白色固体 C.砹原子的最外电子层上有 7 个电子 D.砹能从 NaCl 溶液中置换出氯单质
解析:从 F2 到 At2,元素的非金属性逐渐减弱,与 H2 化合能力逐渐减弱,A 项不正确;由 F2 到 I2,单质的 颜色依次加深,I2 是紫黑色固体,则砹为黑色固体,B 项 不正确;卤族元素的原子,最外电子层上都有 7 个电子, C 项正确;因氧化性 Cl2>At2,所以 At2 不能从 NaCl 溶液 中置换出 Cl2,D 项不正确。
第一章 物质结构 元素周期律
人教版化学必修二112碱金属and卤族元素课件共26张

☆☆☆元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的
难易程度。置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱
性强弱 。碱性越强,则原金属元素的金属性
越强。
已知NaOH为强碱、 Mg(OH) 2 为中强碱、 Al(OH) 3为两性氢氧
Br 2
高温
H 2+Br 2======2HBr
HCl 稳定 较不稳定
I2
高温、持
H2+I 2======2HI
HI 很不稳定
续加热
卤素与水的反应
反
应
2F2+2H2O=====4HF +O2 (特例) 越
来
Cl2 +H2O=====HCl +HClO
越
Br2+ H2O=====HBr +HBrO
难 以
②与水的反应
2Na + 2H 2O = 2NaOH + H 2↑ 2K + 2H2O = 2KOH + H 2↑
通式: 2R +2H 2O = 2ROH + H2↑
(2)碱金属元素从上到下( Li 、Na、K、
Rb 、Cs),随着核电荷数的增加,碱金
属元素原子的电子层数逐渐增多 ,原子
核对最外层电子 的引力逐渐减弱,原子
元素的性质主要取决于原子的 最外 层电子数 ,从碱金属原子的结构可推知
其化学性质如何?是否完全相同?
最外层上都只有一个电子,化学反应 中易失去一个电子,表现还原性,形成 +1 价的阳离子,并 能与氧气等非金属元 素及水发生化学反应。
钠、钾化学性质比较 →P6
钠
与氧气 剧烈燃烧,火焰呈
化学必修二第二节 元素金属性、非金属性周期性变化规律

二.元素金属性、非金属性周期性变化规律元素的金属性是指元素的原子 电子的能力;元素的非金属性是指元素的原子 电子的能力。
1.碱金属元素 (1)原子结构特点相同点:碱金属元素原子的 相同,都为 。
递变性:从Li 到Cs ,碱金属元素的原子结构中, 依次增多,原子半径依次 。
根据教材实验,完成下表相似性:都能与O 2和H 2O 发生 反应,都有强 。
递变性: 比 的还原性更强,更易与O 2和H 2O 反应。
有关反应方程式:①与O 2反应:锂与氧气反应: 钠在不同条件下与O 2反应:常温下: 加热(或点燃):小结:从Li 到Cs 在空气中燃烧其产物越来越复杂。
②与水反应:钠与水反应: 钾与水反应: (3)碱金属的物理性质根据教材表1-1碱金属的主要物理性质,归纳碱金属的物理性质的相似性和递变性:相似性:除 略带金色光泽外,其余的都呈 色;它们的质地都比较 ,有 性;密度都比较 ,熔点都比较 ,导电性和导热性 。
递变性:随着核电荷数的增多,碱金属的密度逐渐 (钠除外),熔、沸点逐 。
2.卤族元素卤族元素包括 、 、 、 、5种元素,它们位于元素周期表的第 纵行,属于第 族。
(1)原子结构特点相同点:卤族元素原子的 相同,都为 。
递变性:从F 到I ,卤族元素原子的 增多,原子半径 。
阅读教材的资料卡片,归纳卤素单质物理性质的变化规律:单质的颜色逐渐 ,密度逐渐 ,熔、沸点逐渐 。
(3).卤族元素的化学性质 ①卤族单质与氢气的反应②卤素单质间的置换反应思考:1.以上卤素单质的置换反应中用三组实验来说明(1)元素性质的影响因素元素的性质主要与原子核外电子的排布,特别是与 有关。
(2)同主族元素性质的递变规律同主族元素从上到下原子核外电子层数 ,原子半径 ,失电子能力 ,得电子能力 ,金属性 ,非金属性 。
4.元素金属性和非金属性的周期性变化 (1)钠、镁、铝金属性强弱的比较[实验探究]钠、镁、铝与水(或酸)反应的剧烈程度逐渐 ,置换出氢越来越 ;最高价氧化物对应水化物的碱性逐渐 ,因此元素的金属性逐渐 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4、与碱反应
5、卤素之间的反应
Cl2 + 2NaBr = 2NaCl +Br2 Cl2 + 2 KI = 2KCl + I2
Br2 + 2KI = 2KBr +I2
氧化性: Cl2 > Br2 > I2 还原性: I -> Br- >Cl实验证明,氟的性质比氯、溴、碘更活泼, 能把氯等从它们的无水化合物中置换出来。
正价和含氧酸。
溴、碘在几种溶剂中的颜色、溶解性
溶剂 溶质
Br2 I2
水中
黄 深黄 橙 褐
汽油、苯、四氯 化碳中
橙 浅紫 橙红 紫红
溶解的量多少不一,颜色呈现深浅不一 汽油、苯比水轻,四氯化碳比水重
可用萃取来分离溴水或碘水
卤素离子的检验方法
1、沉淀法
2、萃取法
【典例】某学生向一支试管中按一定次序分别加入下列
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的 难易程度。置换出氢越容易,则金属性越强。
已知金属A可与冷水反应,金属B和热水 才能反应,金属C和水不能反应,判断金属A、 B、C金属性强弱如何?
金属性
A〉B〉C
元素金属性强弱判断依据:
2、根据金属元素最高价氧化物对应水化物碱性强弱。
At 氟 氯
砹
溴
碘
单 质
颜色
状 态
密度
熔、沸 点
溶解性 (水 )
反应 大
毒性
F2 浅黄绿 气 Cl2 黄绿 Br2 红棕
浅 深
气
液 固
小 — 大
低 — 高
大 ——
I2
紫黑
—
— 小
小
氟
卤素原子结构有何异同?
相同点:卤族元素原子结构的
氯
最外层电子数
相同, 都为
7
。
递变性:从F到I 溴
①
② ③
核电荷数
钾在空气中 的燃烧
(1)与非金属的反应(以O2为例)
元素
条件 加热 加热
现象 燃烧, 较不剧烈 燃烧,剧烈
产物 Li2O Na2O2
结论(记!)
Li
Na
K
稍加热
接触空气 不加热 接触空气 不加热
燃烧, 更剧烈
Rb Cs
剧烈
剧烈
更复杂的 氧化物 KO 2 更复杂的 氧化物
更复杂的 氧化物
从Li—Cs, 随电子层数 的递增,
思考与交流:
主族元素随原子核外电子层数增加,它们得失 电子能力、金属性、非金属性、递变的趋势。 规律:
同一主族中,随原子核外电子层数增 加,得电子能力逐渐减弱失电子能力逐 渐增强,非金属性逐渐减弱,金属性逐 渐增强。
1.氟的特性
特 殊 (1)F元素无正化合价,无含氧酸。 性 (2)F2是最强的氧化剂,没有一种氧 化剂可以将F-变为F2。 (3)F2与H2O剧烈反应:
课堂练习:
1:碱金属钫(Fr)具有放射性,它是碱金属元素中 最重的元素,下列预言错误的是:( ) C
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱 C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物 D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而 发生爆炸.
3、与水反应
Cl2+H2O 相同: Br2+H2O I2+H2O 不同: 2F2+2H2O Cl2+2NaOH Br2+2NaOH I2+2NaOH HCl+HClO HBr+HBrO HI+HIO 4HF+O2 NaCl+NaClO+H2O NaBr+NaBrO+H2O NaI+NaIO+H2O
(2)I2遇淀粉呈蓝色(用于碘的检验)。
(3)AgI作人工降雨材料。 (4)I2与铁的反应:Fe+I2
====
△
FeI2。
(5)碘盐可预防地方性甲状腺肿大。
F与Cl、Br、I的性质在某些方面
差别较大:(1)卤素单质与水的反应;
(2)F-的还原性极弱;(3)氢氟酸为弱酸,
而盐酸、氢溴酸、氢碘酸为强酸;(4)F 无正价、无含氧酸,而Cl、Br、I有最高
2. 下列关于钾、钠、铷、铯的说法中,不正确的 是:( BD ) A.原子半径随核电荷数的增大而增大 B.单质的密度均小于1 C.其氢氧化物中,碱性最强的CsOH
D.氧化能力最强的是钠原子
3. 钠、钾保存在煤油里,锂是否也可保存在煤 油里?(煤油的密度为0.78g/cm3)
少量的锂可保存在密度更小的石蜡油里。
氧化性 Al3+﹥Mg2+﹥Na+ ,则元素金属性顺序为
Na﹥Mg﹥Al
碱金属元素的用途:
1.锂电池是一种高能电池。 锂有机化学中重要的催化剂。 锂制造氢弹不可缺少的材料。 锂是优质的高能燃料(已经 用于宇宙飞船、人造卫星和 超声速飞机)。 2.钾的化合物最大用途是做钾肥。 硝酸钾还用于做火药。 3.铷铯主要用于制备光电管、真 空管。铯原子钟是目前最准确的计 时仪器。
下列关于碱金属元素的叙述中正确的是:
A
1 原子半径:Li<Na<K<Rb<Cs 2 还原性:Li<Na<K<Rb<Cs 3 氧化性:Li+<Na+<K+<Rb+<Cs+
4 熔沸点:Li<Na<K<Rb<Cs
A. 1 2
B. 3 4
C. 1 3
D. 2 4
卤族元素
画出 F 、 Cl 、 Br 、 I 元素的原子结构示 意图 课本P8
2Li+2H+= 2Li++H2↑
2.钾与水反应的离子方程式
2K+2H2O= 2K++2OHˉ+H2↑
3.过氧化钾与CO2
2K2O2+2CO2= 2K2CO3+O2
4.超氧化钾与水,CO2
4KO2+2CO2= 2K2CO3+3O2
5.氧化锂与水,CO2
4KO2+2H2O= 4KOH+3O2↑ Li2O+H2O= 2LiOH Li2O+CO2= Li2CO3
几种物质:A.碘化钾溶液,B.淀粉溶液,C.NaOH溶液,D.
氯水。发现溶液颜色变化依次为:①无色→②棕黄色→ ③蓝色→④无色。请根据颜色变化回答: (1)加入以上试剂的顺序为_____________________。 (2)写出发生下列变化的离子方程式: ①→②:______________________________________。 ③→④:______________________________________。
2Na+2H2O==2NaOH+H2
(比钠更剧烈) (反应特点:浮,熔,游,响、红)
碱金属元素的主要物理性质
元素 名称 锂
钠 钾
元素 符号 Li
Na K
核电 荷数 3
11 19
颜色和状态
密度 g/cm3
0.534
0.97 0.86
熔点 O C
180.5
97.81 63.65
沸点 O C
1347
882.9 774
光照
F2 阴暗处爆炸
Cl2 光照或点燃 Br2 加热条件下 高温条件下
2HF
生成氢化物 的稳定性 很稳定 稳定 较不稳定 很不稳定
H2+Cl2 或点燃 2HCl H2+Br2
加热 高温
2HBr
I2
H2+I2
2HI
卤素单质与氢气反应 剧烈程度:F2>Cl2>Br2>I2 生成氢化物稳定性:HF>HCl>HBr>HI
总结:
Li
碱金属的原子结构 Na K Rb Cs
1) 都易失电子, 表现强还原性 2) 化合物中均为+1价
失电 子能 力
1.相似性: 最外层上都 化学性质相似 只有一个电 子
核对最 外层电 子的引 力
2.递变性:
核电荷数 电子层数 原子半径
还原 性
金 属 性
(电子层数的影响大于核电荷数的影响)
碱金属单质的化学性质: 1、与非金属单质的反应: 4Li+O2===2Li2O(氧化锂) 点燃 2Na+O2===Na2O2 (过氧化钠)
微弱爆炸
元素
Li
现象
产物
结论
会反应,比Na缓慢 剧烈反应,有“浮、 熔、游、响、红” 更剧烈,气体会燃烧, 轻微爆炸 遇水燃烧, 甚至爆炸
对 应 的 碱 和 氢 气
从Li—Cs,随 电子层数的递 增,还原性 (金属性)逐 渐增强。
Na
K
Rb
Cs
练习:完成下列方程式:
1写出锂与稀盐酸反应的离子方程式
3) 密度小(ρ石蜡< ρLi < ρ煤油< ρK < ρNa < ρ水 < ρRb < ρCs) 4) 熔点低(均小于200℃) 5) 导电、导热
如何保 存?
2.递变性:
1) 密度呈增大趋势(但K 反常) 2) 熔、沸点逐渐降低
碱金属元素(从上到下)(课本6-7页)
随着核电荷数的增加,碱金属元素原子 的电子层数逐渐 增多 ,原子半径逐 渐 增大 ,原子核对 最外层电子 的引力逐渐 减弱,原子失电子的能力逐渐 。 增强 元素的金属性逐渐 增强 ,金属单质 的还原性逐渐 增强 ,与水和氧气的反应越 来越 剧烈 ,生成的氧化物越来越 复杂 。 最高价氧化物对应水化物的碱性越来越 强。
