配位化学试题
配位化学试题

1. 命名(20分)
[Cu(NH3)4]SO4;[CoCl2(en)2]Cl;[Co(NH3)5H2O]Cl3;
K[PtCl3(C2H4)];[Fe(C5H5)2]
2. 判断下列各组中,哪种配体与同一中心离子形成的配合物稳定性较高,为什么?(10分)
(1) Cl-, F-和Al3+(2) Br-, I-和Hg2+
3. 实验测得一些配合物的磁矩如下,由该实验事实预言这些配合物中心原子的未成对电子数,杂化轨道类型,配合物的空间结构类型,属价键理论的内轨型还是外轨型,属晶体场理论的高自旋还是低自旋?(20分)
(1) [Co(SCN)4] 2- 4.3 B M (2) [Mn(CN)4] 2- 1.8 B M
(3) [FeF6] 3- 5.9 B M (4) [Ni(NH3)6] 2+ 3.2 B M
4.判断下列配离子能否产生Jahn-Teller效应,几何构型发生畸变。
(20分)
(1) [Ti(H2O)6]3+ (2) [Fe(CN)6]4− (3) [CoCl4]2− (4) [Cu(en)3]2+
5. 通过计算说明下列配合物是否满足ENA规则。
(20分)
(1) Ni(CO)4 (2) Fe(CO)4H2(3) V(CO)6
(4) Mn2(CO)10(5) [PtCl3( 2-C2H4)]−
6.试简述配位场光谱的特点和荷移跃迁光谱的特点。
(10分)。
配位化学复习题及答案

配位化学复习题及答案配位化学是无机化学的一个重要分支,它研究金属离子与配体形成配位化合物的过程和性质。
以下是一些配位化学的复习题及答案,供参考:一、选择题1. 什么是配位化合物?A. 含有金属离子的化合物B. 含有配体的化合物C. 金属离子与配体通过配位键结合形成的化合物D. 只含有金属元素的化合物答案:C2. 配位化合物中的配位键是由什么构成的?A. 金属离子和非金属离子之间的离子键B. 金属离子和配体之间的共价键C. 金属离子提供的空轨道和配体提供的孤对电子D. 配体之间的共价键答案:C3. 下列哪个不是常见的配体?A. 水分子B. 氨分子C. 二氧化碳分子D. 硫氰酸根离子答案:C4. 配位数是指什么?A. 配体的数量B. 配位化合物中的金属离子数量C. 与中心金属离子直接相连的配体数量D. 配位化合物中的总原子数量答案:C5. 什么是内界和外界?A. 内界是配体,外界是金属离子B. 内界是金属离子,外界是配体C. 内界是配位化合物的中心,外界是配位化合物的外围D. 内界和外界都是配体答案:B二、填空题6. 配位化合物的化学式通常表示为[M(L)_n]^z+,其中M代表______,L代表______,n代表______,z代表______。
答案:中心金属离子;配体;配位数;电荷数7. 配位化合物的几何构型取决于配位数,例如,四面体、平面正方形、八面体等。
当配位数为4时,常见的几何构型是______。
答案:四面体8. 配位化合物的稳定性可以通过______来衡量,它与配体的电子供体能力有关。
答案:配位常数9. 配位化合物的光学活性是由于分子的______性造成的。
答案:手性10. 在配位化学中,硬酸和硬碱倾向于形成______,而软酸和软碱倾向于形成______。
答案:硬配位键;软配位键三、简答题11. 简述什么是配位化学中的“软硬酸碱理论”?答案:软硬酸碱理论是由R. P. Pearson提出的,它根据中心金属离子和配体的相对电负性差异,将它们分为硬酸、软酸、硬碱和软碱。
配位化学习题

二、简答题 1.八面体型配合物[Cr(en)3]3+ 和[Ni(en)3]2+ 的中心原子分别为d3和d8电子构型,它们CFSE 都是–1.2∆O,能否说二者稳定性相同?为什么? 2.请画出[CoCl3(NH3)3]+ 的所有几何异构体。 3.[Fe(H2O)6]2+为顺磁性, 而[Fe(CN)6]4–为反 磁性, 请分别用价键理论和晶体场理论解释该 现象。
将化学组成为cocl34nh3的紫色固体配制成溶液向其中加入足量的agno3溶液后只有13的氯从沉淀析出
习题
一.选择题 1.在配合物 .在配合物[(RuCl5)2O]4– 和[PtCl3(C2H4)]– 中, 中心原子的配位数分别是 A、5.5,5; B、 5.5,4; C、6,5; D、6, 、 , ; 、 , ; 、 , ; 、 , 4。 。 2.将化学组成为 .将化学组成为CoCl3·4NH3的紫色固体配制成 的紫色固体配制成 溶液,向其中加入足量的AgNO3溶液后,只有 溶液后, 溶液,向其中加入足量的 溶液后 1/3的氯从沉淀析出。该配合物的内界含有 的氯从沉淀析出。 的氯从沉淀析出 A、2个Cl–和1个NH3; B、2个Cl–和2个NH3; 、 个 和 个 ; 、 个 和 个 ; C、2个Cl–和3个NH3; D、2个Cl–和4个NH3。 、 个 和 个 ; 、 个 和 个 。
4.(1)欲使0.10molAgCl溶解在1升氨水中,的浓 度至少应多大? (2)欲使0.10molAgI溶解在1升氨水中,的浓度 至少应多大? Ksp(AgCl)=1.56x10-10; Ksp(AgI)=1.5x10-16;K不稳=6.2x10-8
5.已知: Co3++e→ Co2+ Eθ=1.82V 已知: 已知 → O2+4H++4e→ 2H2O Eθ =1.23V → NH3·H2O→ NH4++OHKb=1.8×10-5 → × Co3++6NH3→ [Co(NH3)6]3+ K稳 稳 =1.6×1035 × Co2+ +6NH3→ [Co(NH3)6]2+ K稳=1.6×105 稳 × 判断: 判断: (1)溶液中 溶液中[H+]=1.0mol·l-1,空气 2=20.26kPa, 空气Po 溶液中 空气 能够将氧化Co 能够将氧化 2+ → Co3+. (2)设NH3·H2O浓度为 浓度为1.0mol·l-1,空气能否将 设 浓度为 [Co(NH3)6]2+ → [Co(NH3)6]3+
配位化合物练习题配位键配位数与配位化合物的命名

配位化合物练习题配位键配位数与配位化合物的命名配位键是指形成配位化合物的中心金属离子与配体之间的化学键。
配位数是指配位化合物中金属离子与配体之间的键的数量。
命名配位化合物的规则根据配体中的原子数、电荷和官能团等因素来确定。
以下是一些配位化合物练习题,以及配位键、配位数和命名的相关内容。
练习题一:以下配位化合物中,指出配位键的类型和配位数:1. [Co(NH3)6]Cl32. [Fe(CN)6]4-3. [Cu(NH3)4(H2O)2]2+练习题二:请根据以下配位化合物的配位数,给出它们的命名:1. [PtCl4]2-2. [Cu(NH3)2(H2O)2]2+3. [Fe(CO)5]练习题三:请给出以下配位化合物的化学式和它们的命名:1. Tetrachloridocobaltate(II)2. Hexaamminecobalt(III) chloride3. Potassium hexacyanidoferrate(III)解析:练习题一:1. [Co(NH3)6]Cl3配位键类型:配位键类型是金属离子和配体之间的键,此处是配体是氨(NH3),氨和钴(Co)之间形成了配位键。
配位数:配位数是指金属离子与配体之间键的数量,这里配位数为六,因此配位复合物的名称是六配位配合物。
2. [Fe(CN)6]4-配位键类型:配体是氰化物(CN),氰化物和铁(Fe)之间形成了配位键。
配位数:配位数为六,因此配位复合物的名称是六配位配合物。
3. [Cu(NH3)4(H2O)2]2+配位键类型:配体是氨和水,氨和铜(Cu)以及水和铜之间形成了配位键。
配位数:配位数为六,因此配位复合物的名称是六配位配合物。
练习题二:1. [PtCl4]2-配位数为四的配位化合物命名为四氯金(II)。
2. [Cu(NH3)2(H2O)2]2+配位数为六的配位化合物命名为二氨二水铜(II)。
3. [Fe(CO)5]配位数为五的配位化合物命名为五羰基铁。
研究生《配位化学》试题

化学系09级研究生《配位化学》试题姓名学号成绩一、填空题(每空1分共15分)1.命名上面左图的配合物:右图的中心原子的电荷数 ,配位数。
2.Mn(acac)3的磁矩为4.90 B.M.,试指出:(1) 中心原子氧化态, (2) 中心原子的配位数,(3) 中心原子未成对电子数, (4) 配合物的空间构型,注: acac-为乙酰丙酮根CH3C CH C CH3 O O-3.配位共价键形成的时候,中心原子提供 ,配位原子提供4.磁矩的测量证明,〔Co(NH3)6〕2+有3个未成对电子,而[Co(CN)6〕3-离子已没有未成对电子,由此说明,其中属内轨型配合物,其空间构型为;这也说明,两者比较其中更稳定。
12.实验测得Fe(H2O)63+和Fe(CN)63-的磁矩差别极大,其中CN-为强场配体,它们的空间构型为,其杂化轨道类型为,。
二.解释、区别下列名词(5*7=35分)1.单齿配体与多齿配体2.d2sp3杂化和sp3d2杂化3.简单配合物与螯合物4.低自旋配合物和高自旋配合物5.金属酶与金属蛋白6.强场配体和弱场配体7.晶体场理论与分子轨道理论三、选择题(每题3分共15分)1下列配位化合物高自旋的是 ------------------------------------ ()A、[]+363)(NHCo B、[]+263)(NHCoC、[]-362)(NOCo D、[]-46)(CNCo2、下列配合物磁矩最大的是 ------------------------------------ ()A、[]-36FeF B、[]-36)(CNMnC、[]+262)(OHNi D、[]+363)(NHCo3、Ni与CO可形成羰基配合物Ni(Co)n,其中n是 -------------------()A、6B、3C、4D、54、Cr与CO形成羰基配合物所属的点群是 ---------------------------()A、D3h B、TdC、 OhD、D6h5、下列配合物中几何构型偏离正八面体最大的是 --------------------()A、[]+262)(OHCu B、[]+262)(OHCoC、[]-36)(CNFe D、[]-46)(CNNi四.分子的点群填空题(3*5=15分)1.H3BO3分子是群,由于B与O原子都以Sp2杂化与其它原子成键,所以整个分子在一个平面上。
配位化学试题及答案

配位化学试题及答案一、选择题(每题2分,共10分)1. 配位化学中,配体与中心原子通过什么键结合?A. 离子键B. 共价键C. 配位键D. 氢键答案:C2. 以下哪个不是配位化合物的特点?A. 含有配位键B. 含有金属离子C. 含有非金属离子D. 含有配体答案:C3. 配位化学中,配位数指的是什么?A. 配体的数量B. 中心原子的电荷数C. 配体的电荷数D. 配体的价电子数答案:A4. 以下哪种配位化合物的几何构型是八面体?A. [Co(NH3)6]3+B. [Fe(CN)6]4-C. [Ni(CO)4]D. [PtCl6]2-答案:B5. 配位化学中,内球络合物与外球络合物的区别是什么?A. 配体的种类不同B. 配位键的数目不同C. 配位键的强度不同D. 配位键的类型不同答案:C二、填空题(每题2分,共10分)1. 在配位化学中,中心原子与配体之间的键被称为________。
答案:配位键2. 配位化合物的化学式中,通常用方括号表示________。
答案:配位离子3. 配位化学中,配体与中心原子之间的键角通常小于________。
答案:180度4. 配位化合物的命名中,配体的名称通常放在中心原子的名称________。
答案:之前5. 配位化学中,配体的配位能力与其________有关。
答案:电子密度三、简答题(每题5分,共10分)1. 简述配位化学中的配位键形成机制。
答案:配位键的形成机制是指配体向中心原子提供孤对电子,而中心原子提供空轨道,两者通过共享电子对形成配位键。
2. 描述一下配位化学中的几何异构现象。
答案:在配位化学中,几何异构是指具有相同化学式但不同空间排列的配位化合物。
例如,[Co(NH3)4Cl2]Cl·H2O可以存在两种不同的几何异构体:顺式和反式。
四、计算题(每题10分,共20分)1. 已知一个配位化合物的化学式为[Cu(NH3)4]SO4,计算其中心原子Cu的氧化态。
(完整版)配位化学练习题

(完整版)配位化学练习题配位化学练习题一.是非题1.配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。
2.[Cu(NH 3)3]2+ 的积累稳定常数β3是反应[Cu(NH 3)2]2+ +NH 3?[Cu(NH 3)3]2+的平衡常数。
3.配位数是中心离子(或原子)接受配位体的数目。
4.配离子的电荷数等于中心离子的电荷数。
5.配合物中由于存在配位键,所以配合物都是弱电解质。
6.根据稳定常数的大小,即可比较不同配合物的稳定性,即K f 愈大,该配合物愈稳定。
7.外轨型配离子磁矩大,内轨型配合物磁矩小。
8.Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe 3+离子接受孤对电子的空轨道是sp 3d 2。
9.中心离子的未成对电子数越多,配合物的磁矩越大。
10.配离子的配位键越稳定,其稳定常数越大。
二.选择题1.下列叙述正确的是 A.配合物由正负离子组成B.配合物由中心离子(或原子)与配位体以配位键结合而成C.配合物由内界与外界组成D.配合物中的配位体是含有未成键的离子2.下面关于螯合物的叙述正确的是( )。
A 、有两个以上配位原子的配体均生成螯合物B 、螯合物和具有相同配位原子的非螯合物稳定性相差不大C 、螯合物的稳定性与环的大小有关,与环的多少无关D 、起螯合作用的配体为多齿配体,称为螯合剂3.已知()lg 232Ag NH θβ+=7.05,()lg 22Ag CN θβ-=21.7,()lg 22Ag SCN θβ-=7.57,()3lg 2232Ag S O θβ-=13.46;当配位剂的浓度相同时,AgCl 在哪种溶液中的溶解度最大A. NH3·H2OB. KCNC. Na2S2O3D. NaSCN4.为了保护环境,生产中的含氰废液的处理通常采用FeSO4法产生毒性很小的配合物是()A、Fe(SCN)-3B、Fe(OH) 36D、Fe2 [(Fe(CN) 6]C、Fe(CN)-365.下列说法中错误的是A.在某些金属难溶化合物中,加入配位剂,可使其溶解度增大B.在Fe3+溶液中加入NaF后,Fe3+的氧化性降低C.在[FeF]3-溶液中加入强酸,也不影响其稳定性6]3+溶液中加入强碱,会使其稳定性下降D.在[FeF66.对于一些难溶于水的金属化合物,加入配位剂后,使其溶解度增加,其原因是A.产生盐效应B.配位剂与阳离子生成配合物,溶液中金属离子浓度增加C.使其分解D.阳离子被配位生成配离子,其盐溶解度增加7.下列分子或离子能做螯合剂的是A. H2N-NH2B. CH3COO-C. HO-OHD.H2NCH2CH2NH28. 配位数是A.中心离子(或原子)接受配位体的数目B.中心离子(或原子)与配位离子所带电荷的代数和C.中心离子(或原子)接受配位原子的数目D.中心离子(或原子)与配位体所形成的配位键数目9.关于配合物,下列说法错误的是A.配体是一种可以给出孤对电子或π健电子的离子或分子B.配位数是指直接同中心离子相连的配体总数C.广义地讲,所有金属离子都可能生成配合物D.配离子既可以存在于晶体中,也可以存在于溶液中10.分子中既存在离子键,共价键还存在配位键的有()A.42SO NaB.3AlClC.[Co(NH 3)6]3+Cl 3 D.KCN 11.下列离子中,能较好地掩蔽水溶液中Fe 3+离子的是 A.F - B.Cl - C. Br - D. I - 12.下列说法中错误的是A.配合物的形成体通常是过渡金属元素B.配位键是稳定的化学键C.配位体的配位原子必须具有孤电子对D.配位键的强度可以与氢键相比较 13.下列命名正确的是A. [Co(ONO)(NH 3)5Cl]Cl 2 亚硝酸根二氯·五氨合钴(III )B. [Co(NO 2)3(NH 3)3] 三亚硝基·三氨合钴(III )C. [CoCl 2(NH 3)3]Cl 氯化二氯·三氨合钴(III )D. [CoCl 2(NH 3)4]Cl 氯化四氨·氯气合钴(III ) 14.影响中心离子(或原子)配位数的主要因素有A.中心离子(或原子)能提供的价层空轨道数B.空间效应,即中心离子(或原子)的半径与配位体半径之比越大,配位数越大C.配位数随中心离子(或原子)电荷数增加而增大D.以上三条都是 15.下列说法中正确的是A.配位原子的孤电子对越多,其配位能力就越强B.电负性大的元素充当配位原子,其配位能力就强C.能够供两个或两个以上配位原子的多齿配体只能是有机物分子D.内界中有配位键,也可能存在共价键16.已知某化合物的组成为CoCl 3·5NH 3·H 2O ,其水溶液显弱酸性,加入强碱并加热至沸,有氨放出,同时产生三氧化二钴的沉淀;加AgNO 3于另一份该化合物的溶液中,有AgCl 沉淀生成,过滤后,再加入AgNO 3而无变化,但加热至沸又产生AgCl 沉淀,其重量为第一次沉淀量的二分之一,故该化合物的化学式为A.[CoCl 2(NH 3)5]Cl ·H 2OB.[Co(NH 3)5H 2O]Cl 3C.[CoCl(NH 3)5]Cl 2·H 2OD.[CoCl 2(NH 3)4]Cl ·NH 3·H 2O17.Fe 3+离子能与下列哪种配位体形成具有五元环的螯合离子A. CO 32-B.CH 3COCH 2COCH 3C.-OOCCH 2CH 2COO -D.-OOCCH 2COO - 18.Fe 3+离子能与下列哪种配位体形成具有五元环的螯合离子A. CO 32-B.CH 3COCH 2COCH 3C.-OOCCH 2CH 2COO -D.-OOCCH 2COO - 19.下列各配合物具有平面正方形或八面体的几何构型,其中CO 32-离子作为螯合剂的是( )A.[Co(NH 3)5CO 3]+B.[Co(NH 3)3CO 3]+C.[Pt(en)CO 3]D.[Pt(en)( NH 3)CO 3]20.下列配离子能在强酸性介质中稳定存在的是A.()-3232O S Ag B.()+243NH Ni C.()-3342O C Fe ; D.-24HgCl 。
第3章配位化学-习题

第3章配位化学-习题第三章配位化学【习题】3.1 试判断下列配离子的几何构型和电子结构:[Co(CN)6]3-(抗磁性);[NiF6]4-(两个成单电子);[CrF6]4-(4个成单电子);[AuCl4]-(抗磁性);[FeCl4]-(5个成单电子);[NiF6]2-(抗磁性)3.2 画出下列各配合物(配离子)所有可能的异构体:[CoCl2(NH3)4]+,[Be(gly)2],[RhBr2(en)2]+,[PtBr2Cl2(en)],[Ir(C2O4)2Cl2]3-,[Cr(gly)3],[Pt(gly)2](gly=glycine,甘氨酸)3.3 已知配合物[M(A-B)2]和[M(A-B)2X2]型的配合物都是旋光活性的,请分别画出它们的几何结构。
3.4 紫红色的[Ti(H2O)6]3+在可见区的吸收光谱如教材中例题3-1的图所示,其最大吸收峰位置对应于20.3×103 cm-1,并在该最大吸收峰位置的右边(低频方向)出现一个肩峰,试用晶体场理论解释上述肩峰的由来。
3.5 下列配离子中哪些属于高自旋构型?(a)Mn(H2O)62+;(b)Fe(H2O)63+;(c)Co (NH3)63+;(d)Co(H2O)62+;(e)CoCl42-;(f)Fe(CN)64-3.6 下列配合物或配离子中属于低自旋构型的是(a)Fe(H2O)63+;(b)Co(H2O)62+;(c)Co (H2O)63+;(d)CoF63-3.7 对于CoF63-配离子,下面的哪项论述是正确的?(a)CoF63-的晶体场分裂能大;(b)F-为强场配体;(c)CoF63-是顺磁性的;(d)所有论述都不正确。
3.8 下列配离子中,哪一种可能产生Jahn-Teller效应?(a)Fe(CN)64-;(b)Fe(H2O)62+;(c)Cr(H2O)63+;(d)Co(NH3)63+;3.9 试画出配合物[Co(NO2)3(NH3)3]可能存在的几何异构体。
配位化学考研试题及答案

配位化学考研试题及答案一、选择题(每题2分,共20分)1. 下列哪项是配位化学中配体的特征?A. 能够提供孤对电子B. 能够接受孤对电子C. 能够提供空轨道D. 能够接受空轨道答案:A2. 在配位化合物中,中心离子或原子的电荷数与配位数的乘积称为?A. 配位数B. 配位数C. 配位能力D. 配位价答案:D3. 配位化合物的几何构型通常由什么决定?A. 中心离子的大小B. 配体的类型C. 配位数D. 以上都是答案:D4. 配位化合物的稳定性主要取决于什么?A. 配体的类型B. 中心离子的电荷C. 配位数D. 配位化合物的几何构型答案:A5. 配位化合物中,配体与中心离子之间的键被称为?A. 离子键B. 共价键C. 配位键D. 金属键答案:C6. 下列哪种类型的配体是硬酸?A. 氨B. 硫氰酸根C. 碘离子D. 溴离子答案:A7. 硬碱和硬酸之间的相互作用被称为?A. 软相互作用B. 硬相互作用C. 软硬相互作用D. 非相互作用答案:B8. 配位化学中,哪种类型的配体可以提供多个孤对电子?A. 单齿配体B. 双齿配体C. 多齿配体D. 桥联配体答案:C9. 配位化合物中,中心离子的氧化态通常由什么决定?A. 配体的类型B. 中心离子的电子构型C. 配位数D. 配位化合物的几何构型答案:B10. 配位化学中,哪种类型的配体可以作为桥联配体?A. 单齿配体B. 双齿配体C. 多齿配体D. 所有类型的配体答案:C二、填空题(每题2分,共20分)1. 配位化合物中,中心离子或原子的电荷数与配位数的乘积称为配位价。
2. 配位化合物的稳定性主要取决于配体的类型。
3. 硬碱和硬酸之间的相互作用被称为硬相互作用。
4. 配位化合物中,中心离子的氧化态通常由中心离子的电子构型决定。
5. 配位化合物的几何构型通常由配位数决定。
6. 配位化学中,多齿配体可以作为桥联配体。
7. 配位化合物中,配体与中心离子之间的键被称为配位键。
配位化学课程考试题
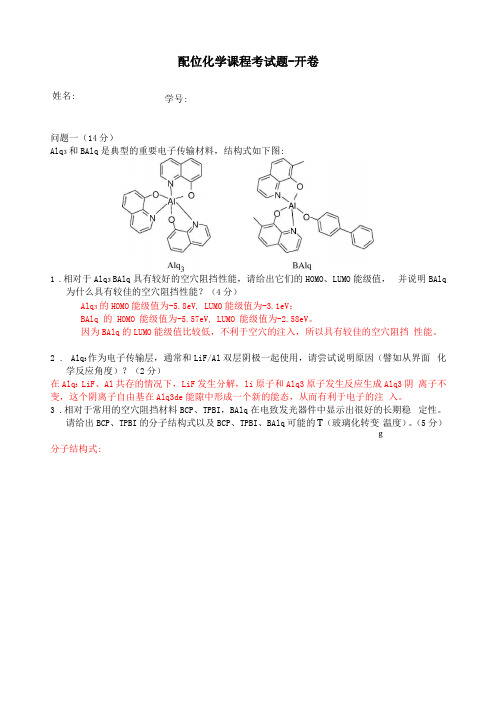
配位化学课程考试题-开卷姓名:学号:问题一(14分)Alq3和BAlq是典型的重要电子传输材料,结构式如下图:1.相对于Alq3 BAlq具有较好的空穴阻挡性能,请给出它们的HOMO、LUMO能级值,并说明BAlq为什么具有较佳的空穴阻挡性能?(4分)Alq3的HOMO能级值为-5.8eV, LUMO能级值为-3.1eV;BAlq 的HOMO 能级值为-5.57eV, LUMO 能级值为-2.58eV。
因为BAlq的LUMO能级值比较低,不利于空穴的注入,所以具有较佳的空穴阻挡性能。
2. Alq3作为电子传输层,通常和LiF/Al双层阴极一起使用,请尝试说明原因(譬如从界面化学反应角度)?(2分)在Alq3 LiF、Al共存的情况下,LiF发生分解,li原子和Alq3原子发生反应生成Alq3阴离子不变,这个阴离子自由基在Alq3de能隙中形成一个新的能态,从而有利于电子的注入。
3.相对于常用的空穴阻挡材料BCP、TPBI,BAlq在电致发光器件中显示出很好的长期稳定性。
请给出BCP、TPBI的分子结构式以及BCP、TPBI、BAlq可能的T (玻璃化转变温度)。
(5分)g分子结构式:BCP 、TPBI 、BAlq 可能的 T g 分别为:80℃、100℃、200℃ 4 .给出BCP 、TPBI 、Alq 3电子迁移率大小顺序。
(3分)问题二(34分)有机磷光金属配合物及电致磷光器件是当前有机电致发光研究领域的热点之一:1 说明基于磷光材料的电致发光器件的内量子效率,理论上,能够达到100%。
(4分) 再临光器件的发光层,主发光体的单重激发态与三重激发态的能量都可以分别由Foster 能 量转移和Dexter 能量转移到磷光发光体的单重激发态和三重激发态中,再经由磷光发 光体内部快速的系间窜越将单重激发态的能量转换到三重激发态,进而放出磷光,因 而内部量子效率可接近100%。
2 假定电致磷光器件的外量子为100%,通常情况下,外量子效率为多少?为什么? (4分)?试分析提高外量子效率的途径?(4分)p3151发光层具有较高的光致发光的效率2磷光材料(磷光材料可以通过采用重原子效应、降低体系温度和向体系内引入顺磁分子的 方法提高量子产率)3在发光层内,实现电荷以及激子限制4提高发射光耦合出射效率3 以非离子、分子型电致磷光铱配合物为例,当前,蓝、天蓝、绿、黄、红、近红外发光材料都已报道。
配位化学试题
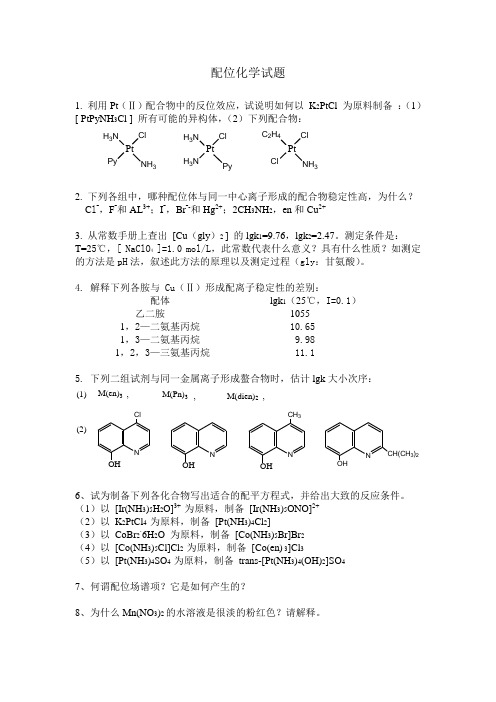
配位化学试题1. 利用Pt (Ⅱ)配合物中的反位效应,试说明如何以 K 2PtCl 为原料制备 :(1)[ PtPyNH 3Cl ] 所有可能的异构体,(2)下列配合物: PtCl NH 3H 3N Py Pt Cl Py H 3N H 3N Pt ClNH 3C 2H 4Cl2. 下列各组中,哪种配位体与同一中心离子形成的配合物稳定性高,为什么? C l -,F -和AL 3+;I -,Br --和Hg 2+;2CH 3NH 2,en 和Cu 2+3. 从常数手册上查出 [Cu (gly )2 ] 的lgk 1=9.76,lgk 2=2.47。
测定条件是: T=25℃,[ NaClO 4 ]=1.0 mol/L ,此常数代表什么意义?具有什么性质?如测定的方法是pH 法,叙述此方法的原理以及测定过程(gly :甘氨酸)。
4. 解释下列各胺与 Cu (Ⅱ)形成配离子稳定性的差别:配体 lgk 1(25℃,I=0.1) 乙二胺 10551,2—二氨基丙烷 10.651,3—二氨基丙烷 9.981,2,3—三氨基丙烷 11.15. 下列二组试剂与同一金属离子形成螯合物时,估计lgk 大小次序:M(en)3M(Pn)3M(dien)2(1),,,(2)N OH Cl N OH N OH CH 3NOH CH(CH 3)26、试为制备下列各化合物写出适合的配平方程式,并给出大致的反应条件。
(1)以 [Ir(NH 3)5H 2O]3+ 为原料,制备 [Ir(NH 3)5ONO]2+(2)以 K 2PtCl 4 为原料,制备 [Pt(NH 3)4Cl 2](3)以 CoBr 2·6H 2O 为原料,制备 [Co(NH 3)5Br]Br 2(4)以 [Co(NH 3)5Cl]Cl 2 为原料,制备 [Co(en) 3]Cl 3(5)以 [Pt(NH 3)4SO 4 为原料,制备 trans-[Pt(NH 3)4(OH)2]SO 47、何谓配位场谱项?它是如何产生的?8、为什么Mn(NO 3)2的水溶液是很淡的粉红色?请解释。
配位化学习题(答案参考)

配位化合物(01)1.历史上记录的第一种人工合成的配位化合物是( D )A.硫酸六氨合钴(II)B.普鲁士蓝C.硫酸四氨合铜(II)D.氯化二氨合银(I)2.配位化学的奠基人是( D)A.阿仑尼乌斯B.路易斯C.鲍林D.维尔纳3.下列说法中错误的是( C)A 配合物的形成体通常是过渡金属元素B 配键是稳定的化学键C 配键的强度可以和氢键相比较D 四面体配合物中,不存在顺反几何异构现象4.下列说法中正确的是(D )A 配位原子的孤电子对越多,其配位能力就越强B 电负性大的元素充当配位原子,其配位能力也强C CH3-C-OH配体是双齿配体D 在[Cu(en)2]2+中,Cu2+的配位数是412.下列说法中错误的是(D )A.对于Ni2+来说,当配位数为6时,无论是强场或弱场配体本位,只能采用SP3d2杂化B.对Ni2+来说,当本位数为4时,随配体的不同可采取dsp2或SP3杂化C.无论中心离子杂化轨道是d2sp2或SP3d2,其构型均为八面体形D.配合物中,由于存在配键,所以配合物都是弱电解质13.下列配体的本位能力的强弱次序为(B )->NH3>NCS->H2O>X-->NH3>NCS->H2O>X-C.X->H2O>CH->NH3>NCS-D.X->CN->H2O>NH3>NCS-14.在配位分子3KNO2.Co(NO3)2中,配位数为(D )A 3B 4C 5D 627.1 共价键和配位共价键的区别是什么?在NH4+离子中分别有多少个共价键和配位共价键?如何对其进行区分?解配位共价键是指一对电子由两个原子共享,且此电子是由其中的一个原子提供的;共价键是指一对共用电子对,一旦形成这两种键就没有区别。
在NH4+离子中有四个共价键,其中有一个是配位共价键。
27.4 求下列配位化合物的中心原子的配位数分别是多少?(a) [Mo(CN)8]4-中的钼(b)Cu(en)22+中的铜(en为乙二胺)解(a) 8 (b) 427.7 指出下列各金属中心离子的特征配为数:(a) CuⅠ(b) CuⅡ(c)AlⅢ(d) CoⅢ(e) ZnⅡ(f) FeⅡ(g) FeⅢ(h) AgⅠ。
配位化学练习题

配位化学练习题配位化学是无机化学的重要分支,研究的对象是配位化合物和配位反应。
配位化学主要研究金属离子与配体之间的相互作用,以及在配位化合物中金属离子的周围有哪些配体。
以下是一些配位化学的练习题,用以帮助读者巩固相关知识。
题目一:给定以下化学方程式,请推导出反应类型,并写出反应物和生成物的化学式。
1. AgNO3 + NaCl →2. CuSO4 + NH3 →3. FeCl3 + KOH →题目二:根据以下配位化合物的谱系图,请回答以下问题。
1. 对于配位数为4的配合物,属于以下哪种晶体场理论?2. 高自旋和低自旋的配合物分别具有什么样的差异?3. 配体场强度增加,配体键长和配位键数会发生什么变化?4. 对于给定的配合物,如果配位键数为6,那么该配合物的中心离子是什么?题目三:结合以下反应机理,请写出反应的平衡常数表达式。
1. Co(H2O)6 2+ + 6NH3 ⇌ Co(NH3)6 2+ + 6H2O2. NH3 + H2O ⇌ NH4+ + OH-3. Cu(H2O)6 2+ + 4Cl- ⇌ [CuCl4]2- + 6H2O题目四:以下是一些配位化合物的常见名称,请根据化学式给出其对应的名称。
1. Fe2(SO4)32. K3[Fe(CN)6]3. [Co(NH3)4Cl2]Cl题目五:给定以下化学方程式,请写出反应的电子方程式和平衡常数表达式。
1. Co(H2O)6 2+ + [Cr(CN)6]4- → Co(CN)6 4- + [Cr(H2O)6]2+2. [Cu(NH3)4]2+ + 4Br- → [CuBr4]2- + 4NH3题目六:结合以下反应,回答以下问题。
1. 配位化合物的颜色与什么因素有关?2. 过渡金属配合物为什么可以具有催化性质?3. 配合物中的中心离子的电荷数会如何影响配合物的稳定性?4. 配体的选择如何影响配位化合物的形状?这些练习题覆盖了配位化学的不同方面,包括反应类型、配位反应机理、命名和电子结构等。
配位化学试题及答案

配位化学试题及答案一、选择题(每题2分,共10分)1. 下列哪项不是配位化合物的特点?A. 含有中心原子或离子B. 含有配位键C. 含有离子键D. 含有配体答案:C2. 配位化合物的几何构型通常由什么决定?A. 配体的电荷B. 配体的数目C. 配体的电子排布D. 中心原子的氧化态答案:B3. 配位化学中,路易斯碱是指什么?A. 能够提供电子的分子或离子B. 能够接受电子的分子或离子C. 能够提供空轨道的分子或离子D. 能够接受空轨道的分子或离子答案:B4. 下列哪种配体是单齿配体?A. 乙二胺(en)B. 1,3-丙二胺(pn)C. 环己二胺(cn)D. 四齿配体答案:A5. 配位化合物的命名中,配体的名称通常放在什么位置?A. 中心原子的前面B. 中心原子的后面C. 配位化合物的前面D. 配位化合物的后面答案:A二、填空题(每题2分,共10分)1. 配位化学中,中心原子或离子与配体之间形成的化学键称为______。
答案:配位键2. 一个中心原子或离子最多可以与______个配体形成配位键。
答案:63. 配位化合物的配位数是指______。
答案:中心原子或离子周围配体的数量4. 配位化合物的命名中,配体的数目通常用希腊数字表示,其中“二”表示______。
答案:二5. 配位化合物的命名中,配体的电荷通常用罗马数字表示,其中“Ⅱ”表示______。
答案:+2三、简答题(每题5分,共20分)1. 简述什么是内界和外界,并举例说明。
答案:内界是指配位化合物中中心原子或离子与配体形成的配位单元,外界是指配位单元以外的部分。
例如,在[Co(NH3)6]Cl3中,[Co(NH3)6]是内界,Cl3是外界。
2. 什么是螯合配体?请举例说明。
答案:螯合配体是指能够通过多个配位点与中心原子或离子形成配位键的配体。
例如,乙二胺(en)可以与金属离子形成螯合配位化合物。
3. 配位化合物的稳定性与哪些因素有关?答案:配位化合物的稳定性与中心原子或离子的电荷、配体的类型、配位数以及配体与中心原子或离子之间的配位键强度等因素有关。
配位化学练习

。
16. 2 分 (2026)
四配位平面四方形 Fe(II) 卟啉配合物的轴向位置还可结合两个配位体。配位数最大的
配合物[FePL2]( P 代表卟啉,L 代表另外的配体)为低自旋,而[FePL]则为高自旋。第二步 (生成[FePL2])形成常数大于第一步(生成[FePL])的原因是
。
17. 2 分 (2030)
- -4
配位化学习题
成
键对称性是不匹配的,但可参与形成
35. 2 分 (2081)
下列反应的产物(注明顺式−、反式−:
(1) [Pt(PR3)4]2+ + 2Cl-
键。
(2) [PtCl4]2- + 2PR3
(1) 为
,(2) 为
。
36. 5 分 (2082)
指出下列配离子属高自旋的是
,属低自旋的是
下列穴醚的表示式分别为
、
和
。
O NO
O
Om ON
m O
n
当 m = 0,n = 0; m = 1,n = 0; m = 0,n = 1;
33. 5 分 (2078) 下面是对配合物高低自旋的预言的几条规律,请填空并
勾出括号中合适的字、句。
(1) 在(强、弱)场时,由于分裂能△较小,所以配合物通常取
自旋构型;
0
10Dq
3T 2g
3A2g
- -3
配位离子
Co
(NH
3
)Leabharlann 3+ 6Fe(H2
O)
3+ 6
配位化学习题
成对能 P / cm-1 22000
分裂能△o / cm-1 23000
30000
配位化学习题

配位化合物(01)1.历史上记录的第一种人工合成的配位化合物是( D )A.硫酸六氨合钴(II)B.普鲁士蓝C.硫酸四氨合铜(II)D.氯化二氨合银(I)2.配位化学的奠基人是( D)A.阿仑尼乌斯B.路易斯C.鲍林D.维尔纳3.下列说法中错误的是( C)A 配合物的形成体通常是过渡金属元素B 配键是稳定的化学键C 配键的强度可以和氢键相比较D 四面体配合物中,不存在顺反几何异构现象4.下列说法中正确的是(D )A 配位原子的孤电子对越多,其配位能力就越强B 电负性大的元素充当配位原子,其配位能力也强C CH3-C-OH配体是双齿配体D 在[Cu(en)2]2+中,Cu2+的配位数是412.下列说法中错误的是(D )A.对于Ni2+来说,当配位数为6时,无论是强场或弱场配体本位,只能采用SP3d2杂化B.对Ni2+来说,当本位数为4时,随配体的不同可采取dsp2或SP3杂化C.无论中心离子杂化轨道是d2sp2或SP3d2,其构型均为八面体形D.配合物中,由于存在配键,所以配合物都是弱电解质13.下列配体的本位能力的强弱次序为(B )>NH3>NCS->H2O>X- >NH3>NCS->H2O>X- >H2O>CH->NH3>NCS- >CN->H2O>NH -3>NCS14.在配位分子(NO3)2中,配位数为( D )A 3B 4C 5D 6共价键和配位共价键的区别是什么在NH4+离子中分别有多少个共价键和配位共价键如何对其进行区分解配位共价键是指一对电子由两个原子共享,且此电子是由其中的一个原子提供的;共价键是指一对共用电子对,一旦形成这两种键就没有区别。
在NH4+离子中有四个共价键,其中有一个是配位共价键。
求下列配位化合物的中心原子的配位数分别是多少(a) [Mo(CN)8]4-中的钼 (b)Cu(en)22+中的铜(en为乙二胺)解 (a) 8 (b) 4指出下列各金属中心离子的特征配为数:(a) CuⅠ (b) CuⅡ(c)AlⅢ (d) CoⅢ (e) ZnⅡ (f) FeⅡ (g) FeⅢ (h) AgⅠ。
(完整版)配位化学复习题

配位化学复习题1.试用图形表示下列配合物所有可能的异构体并指明它们各属哪一类异构体。
(1)[Co(en)2(H 2O)Cl]2+ (2)[Co(NH 3)3(H 2O)ClBr]+(3)Rh(en)2Br 2](4)Pt(en)2Cl 2Br 2 (5)Pt(Gly)3 (6)[Cr(en)3][Cr(CN)6] 2.配合物[Pt(py)(NH 3)(NO 2)ClBrI]共有多少个几何异构体?3.试举出一种非直接测定结构的实验方法区别以下各对同分异构体: (1)[Cr(H 2O)6]Cl 3 和[Cr(H 2O)5Cl]Cl 2·H 2O (2)[Co(NH 3)5Br](C 2O 4)和[Co(NH 3)5(C 2O 4)]Br (3)[Co(NH 3)5(ONO)]Cl 2 和[Co(NH 3)5(NO 2)]Cl 2 4.解释下列事实:(1)[ZnCl 4]2-为四面体构型而[PdCl 4]2-却为平面正方形?(2)Ni(II)的四配位化合物既可以有四面体构型也可以有平面正方形构型,但Pd(II)和Pt(II)却没有已知的四面体配合物?(3)根据[Fe(CN)6]4水溶液的13C -NMR 只显示一个峰的事实,讨论它的结构。
(4)主族元素和过渡元素四配位化合物的几何构型有何异同?为什么? (5)形成高配位化合物一般需要具备什么条件?哪些金属离子和配体可以满足这些条件?试举出配位数为八、九、十的配合物各一例,并说明其几何构型和所属点群。
5.阐述晶体场?分裂能的大小有何规律?分裂能与周期数有什么关系? 6. 为什么T d 场的分裂能比O h 场小? 如何理解四面体配合物大多数是高自旋的? 7.d n 离子哪些无高低自旋的可能?哪些有高低自旋之分?确定高低自旋的实验方法是什么?用什么参数可以判断高低自旋?8.根据LFT 绘出d 轨道在O h 场和T d 场中的能级分裂图。
标出分裂后d 轨道的符号 9.什么叫光化学顺序?如何理解电子云伸展效应?10.指出下列配离子哪些是高自旋的?哪些是低自旋的?并说明理由。
配位化学题库

一、 单选题1、近代配位化学的奠基人是( )。
(A) 阿仑尼乌斯 (B) 路易斯 (C) 鲍林 (D) 维尔纳2、下列配合物中,具有平面四边形构型的是( )。
(A) [Zn(CN)4]2- (B) Ni(CO)4 (C) [Ni(CN)4]2- (D) [ZnCl 4]2-3、已知M 为配合物的中心原子,A 、B 和C 为不同的单齿配体,在具有下列化学式的配合物中,不存在几何异构体的是( )。
(A) MA 4B 2 (B) MA 2BC (平面四边形)(C) MA 2BC (四面体) (D) MA 2B 2C 24、下列配离子中可能产生Jahn-Teller 效应的有( )。
(A) [Fe(CN)6]4- (B) [CoF 6]3- (C) [CrCl 6]3- (D) [FeF 6]3-5、在下列配合物或配离子中,没有形成反馈π键的是( )。
(A) [Co(CN)6]4- (B) [Ru(NH 3)5(N 2)]2+(C) FeF 63 (D) K[PtCl 3(C 2H 4)]6、对于[Co(CN)6]3-配离子,下列论述正确的是( )。
(A) [Co(CN)6]3-是高自旋 (B) CN -为弱场配体(C) [Co(CN)6]3-是反磁性的 (D) 以上说法均不正确7、根据晶体场理论判断下列配离子中具有取代活性的是( )。
(A) [Fe(CN)6]4- (B) [FeF 6]3- (C) [Cr(CN)6]3+ (D) [Ni(H 2O)6]2+8、反位效应最大的卤素离子为( )。
(A) F - (B) Cl - (C) Br - (D) I -9、关于CO 和N 2的表述正确的是( )。
① N 2和CO 为等电子体② N 2和CO 均可以作为配体③ N 2的σ给予能力比CO 弱④ N 2的π接受能力比CO 强(A) ①③④ (B) ①④ (C) ①②③ (D) ①②③④10、关于CO 中毒机制,正确的表述是( )。
(完整版)配位化学习题

配位化合物(01)1.历史上记录的第一种人工合成的配位化合物是( D )A.硫酸六氨合钴(II)B.普鲁士蓝C.硫酸四氨合铜(II)D.氯化二氨合银(I)2.配位化学的奠基人是( D)A.阿仑尼乌斯B.路易斯C.鲍林D.维尔纳3.下列说法中错误的是( C)A 配合物的形成体通常是过渡金属元素B 配键是稳定的化学键C 配键的强度可以和氢键相比较D 四面体配合物中,不存在顺反几何异构现象4.下列说法中正确的是(D )A 配位原子的孤电子对越多,其配位能力就越强B 电负性大的元素充当配位原子,其配位能力也强C CH3-C-OH配体是双齿配体D 在[Cu(en)2]2+中,Cu2+的配位数是412.下列说法中错误的是(D )A.对于Ni2+来说,当配位数为6时,无论是强场或弱场配体本位,只能采用SP3d2杂化B.对Ni2+来说,当本位数为4时,随配体的不同可采取dsp2或SP3杂化C.无论中心离子杂化轨道是d2sp2或SP3d2,其构型均为八面体形D.配合物中,由于存在配键,所以配合物都是弱电解质13.下列配体的本位能力的强弱次序为(B )->NH3>NCS->H2O>X-->NH3>NCS->H2O>X-C.X->H2O>CH->NH3>NCS-D.X->CN->H2O>NH3>NCS-14.在配位分子3KNO2.Co(NO3)2中,配位数为(D )A 3B 4C 5D 627.1 共价键和配位共价键的区别是什么?在NH4+离子中分别有多少个共价键和配位共价键?如何对其进行区分?解配位共价键是指一对电子由两个原子共享,且此电子是由其中的一个原子提供的;共价键是指一对共用电子对,一旦形成这两种键就没有区别。
在NH4+离子中有四个共价键,其中有一个是配位共价键。
27.4 求下列配位化合物的中心原子的配位数分别是多少?(a) [Mo(CN)8]4-中的钼(b)Cu(en)22+中的铜(en为乙二胺)解(a) 8 (b) 427.7 指出下列各金属中心离子的特征配为数:(a) CuⅠ(b) CuⅡ(c)AlⅢ(d) CoⅢ(e) ZnⅡ(f) FeⅡ(g) FeⅢ(h) AgⅠ。
配位化学习题 一
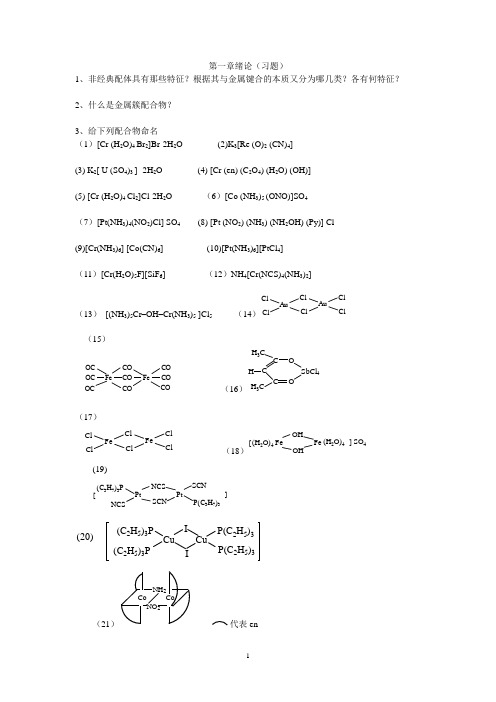
第一章绪论(习题)1、非经典配体具有那些特征?根据其与金属键合的本质又分为哪几类?各有何特征?2、什么是金属簇配合物?3、给下列配合物命名 (1)[Cr (H 2O)4 Br 2]Br·2H 2O (2)K 3[Re (O)2 (CN)4](3) K 2[ U (SO 4)3 ] ·2H 2O (4) [Cr (en) (C 2O 4) (H 2O) (OH)](5) [Cr (H 2O)4 Cl 2]Cl·2H 2O (6)[Co (NH 3)5 (ONO)]SO 4(7)[Pt(NH 3)4(NO 2)Cl] SO 4 (8) [Pt (NO 2) (NH 3) (NH 2OH) (Py)] Cl(9)[Cr(NH 3)6] [Co(CN)6] (10)[Pt(NH 3)6][PtCl 4](11)[Cr(H 2O)5F][SiF 6] (12)NH 4[Cr(NCS)4(NH 3)2](13) [(NH 3)5Cr –OH –Cr(NH 3)5 ]Cl 5 (14)AuCl ClAuClCl ClCl(15)Fe CO FeCO OC CO CO COOC OCCO (16)COH 3CH 4C C OH 3C(17)FeCl ClFeClCl Cl Cl(18)FeFe OH OH(H 2O)4(H 2O)4[]SO 4(19)PtPtNCS SCN[]NCSSCN P(C 3H 7)3(C 3H 7)3PCuCu I (C 2H 5)3P P(C 2H 5)3P(C 2H 5)3(C 2H 5)3P(20)(21) 代表en(22)[Co(NH3)4(en)]Cl3(23)[RuN2(NH3)5](NO3)2(24)K3[Cl3WCl3 WCl3] (25)[ReI(CO) 3(py)2](26)K3[Ni(NO)(S2O3)2]4、写出下列配合物的结构式(1)三氯·(η-乙烯)合铂(Ⅱ)酸钾(2)二羰基·(η-茂)·(σ-茂)合铁(Ⅱ)(3)三氯·氨合铂(Ⅱ)酸钾(4)硫酸叠氮·五氨合钴(Ⅲ)(5)η-二苯合铬(0)(6)三(μ-羟基)·六氨合二钴(Ⅲ)离子5、有两种配合物,其组成皆为CoBr (SO4) (NH3)4 H2O,若将它们分别溶于水中,各以AgNO3和BaCl2溶液检验,一种只与AgNO3生成沉淀,另一种也只与BaCl2生成沉淀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配位化学试题
1. 利用Pt (Ⅱ)配合物中的反位效应,试说明如何以 K 2PtCl 为原料制备 :(1)
[ PtPyNH 3Cl ] 所有可能的异构体,(2)下列配合物: Pt
Cl NH 3H 3N Py Pt Cl Py H 3N H 3N Pt Cl
NH 3C 2H 4Cl
2. 下列各组中,哪种配位体与同一中心离子形成的配合物稳定性高,为什么? C l -,F -和AL 3+;I -,Br --和Hg 2+;2CH 3NH 2,en 和Cu 2+
3. 从常数手册上查出 [Cu (gly )2 ] 的lgk 1=9.76,lgk 2=2.47。
测定条件是: T=25℃,[ NaClO 4 ]=1.0 mol/L ,此常数代表什么意义?具有什么性质?如测定
的方法是pH 法,叙述此方法的原理以及测定过程(gly :甘氨酸)。
4. 解释下列各胺与 Cu (Ⅱ)形成配离子稳定性的差别:
配体 lgk 1(25℃,I=0.1) 乙二胺 1055
1,2—二氨基丙烷 10.65
1,3—二氨基丙烷 9.98
1,2,3—三氨基丙烷 11.1
5. 下列二组试剂与同一金属离子形成螯合物时,估计lgk 大小次序:
M(en)3M(Pn)3M(dien)2(1),
,,(2)N OH Cl N OH N OH CH 3N
OH CH(CH 3)2
6、试为制备下列各化合物写出适合的配平方程式,并给出大致的反应条件。
(1)以 [Ir(NH 3)5H 2O]3+ 为原料,制备 [Ir(NH 3)5ONO]2+
(2)以 K 2PtCl 4 为原料,制备 [Pt(NH 3)4Cl 2]
(3)以 CoBr 2·6H 2O 为原料,制备 [Co(NH 3)5Br]Br 2
(4)以 [Co(NH 3)5Cl]Cl 2 为原料,制备 [Co(en) 3]Cl 3
(5)以 [Pt(NH 3)4SO 4 为原料,制备 trans-[Pt(NH 3)4(OH)2]SO 4
7、何谓配位场谱项?它是如何产生的?
8、为什么Mn(NO 3)2的水溶液是很淡的粉红色?请解释。
9、已知四羰基镍[Ni(CO4)]是抗磁性的,试用价键理论指出这个化合物的结构。
10、试判断下列配离子的几何结构:
[Co(CN)6]3- [FeCl4]- (五个成单电子) [AuCl4]-(反磁性的) [Ni(CO)4][Ni(CN)4]2- [Fe(CO)5]
[SbCl5]2- [CrF6]3-。
