舒马曲坦相关杂质
琥珀酸舒马曲坦的合成工艺改进

琥珀酸舒马曲坦的合成工艺改进
丁磊;富强;沈晗;唐锋
【期刊名称】《药学进展》
【年(卷),期】2007(31)4
【摘要】目的:改进琥珀酸舒马曲坦的合成工艺. 方法:以4-肼基-N-甲基-苄基磺酰胺盐酸盐与4,4-二甲氧基-N,N-二甲基-丁胺为起始原料,改用多聚磷酸和磷酸二氢钠作为催化剂,后处理采用异丙醚和丙酮作为重结晶溶剂,经缩合、重排、环合、成盐的4步反应合成琥珀酸舒马曲坦. 结果:获得纯度和收率均较满意的目标产物,总收率由文献报道的8.5%提高到12.7%. 结论:此改进后的合成工艺成本低,操作简便易行,适于工业化生产.
【总页数】3页(P171-173)
【作者】丁磊;富强;沈晗;唐锋
【作者单位】江苏先声药物研究有限公司药物合成研究室,江苏,南京,210042;江苏先声药物研究有限公司药物合成研究室,江苏,南京,210042;江苏先声药物研究有限公司药物合成研究室,江苏,南京,210042;江苏先声药物研究有限公司药物合成研究室,江苏,南京,210042
【正文语种】中文
【中图分类】R971;TQ460.31
【相关文献】
1.琥珀酸舒马曲坦固体分散体颗粒溶出度的测定 [J], 徐俊;闫启东;石雷
2.微渗析技术研究琥珀酸舒马曲坦在大鼠脑和血中的药代动力学 [J], 张雄;唐星;
3.琥珀酸舒马曲坦的工艺研究 [J], 管宜河; 于小红; 谢帆; 张少林; 王俊华
4.琥珀酸舒马曲坦的工艺研究 [J], 管宜河; 于小红; 谢帆; 张少林; 王俊华
5.琥珀酸舒马曲坦的剂型研究 [J], 郑文秀; 管宜河
因版权原因,仅展示原文概要,查看原文内容请购买。
舒马曲坦杂质汇总
项目报批 纯度高于98%
Sumatriptan Impurity 4
舒马曲坦杂质4
(Sumatriptan EP 212069-94-8
Impurity D)
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
Sumatriptan Impurity 5
舒马曲坦杂质5
(Sumatriptan EP
杂质等;并提供COA、NMR、HPLC、MS等结构确证图谱;详情请点 用户名 ,谢谢!
专业<杂质对照品>解决方案,代理中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/STD等品牌。
88919-22-6
Impurity E)
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
扬信医药代理各品种杂质对照品:舒更葡糖钠杂质,达托霉素杂质,依维莫司杂质,他克莫司杂质,阿奇霉素杂质,克拉维酸钾杂质, 红霉素杂质,克拉霉素杂质,林可霉素杂质,罗红霉素杂质,克林霉素杂质,恩曲他滨杂质,艾地那非杂质,瑞卢戈利杂质,艾氟康唑
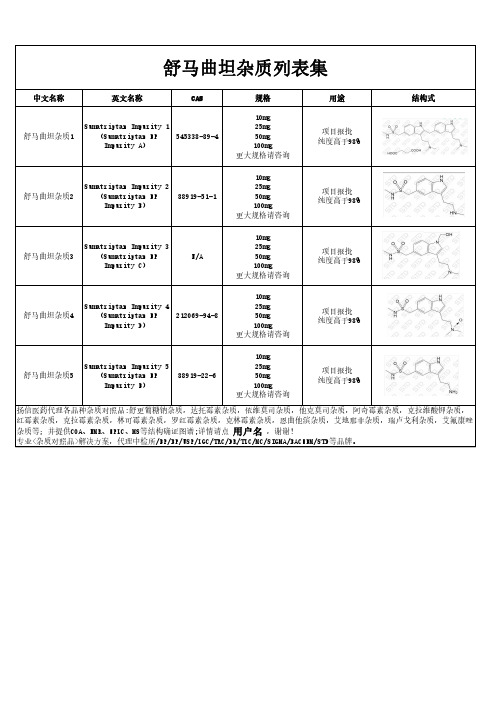
舒马曲坦杂质列表集
中文名称
英文名称
CAS
Sumatriptan Impurity 1
舒马曲坦杂质1
(Sumatriptan EP 545338-89-4
Impurity A)
规格
10mg 25mg 50mg 100mg 更大规格请咨询
用途
项目报批 纯度高于98%
结构式
Sumatriptan Impurity 2
舒马曲坦杂质2
(Sumatriptan EP
88919-51-1
琥珀酸舒马普坦残留溶剂方法确认报告

琥珀酸舒马普坦残留溶剂方法确认报告文件编号:RSH6019-1起草人:日期:审核人:日期:日期:批准人:日期:目录一、概述二、验证目的三、验证范围四、验证人员五、验证依据六、验证内容七、验证结论八、附色谱图九、批准一、概述药物中的残留溶剂系指在原料药或辅料的生产中以及制剂的制备过程中使用的,但在工艺过程中未能完全除去的有机溶剂,我司在琥珀酸舒马普坦生产过程中使用了有机溶剂甲醇、乙醇、乙酸乙酯,因残留溶剂会影响产品的安全性,故需对琥珀酸舒马普坦的残留溶剂方法进行确认。
二、验证目的通过对琥珀酸舒马普坦残留溶剂的分析方法的专属性、精密度进行确认,确保方法的可行性,以便为有效控制琥珀酸舒马普坦的质量提供依据。
三、验证范围针对琥珀酸舒马普坦残留溶剂测定方法的可靠性及可行性。
四、验证人员张玲、黄翠、张茜、向波五、验证依据5.1 ICH Q2A、ICH Q2B、 ICH Q3C5.2 中国药典2010版二部附录VIII P 残留溶剂测定法5.3中国药典2010版二部附录XIX A药品质量标准分析方法验证指导原则六、验证内容6.1、验证用仪器、试剂、对照品6.2、验证方法6.2.1色谱条件:仪器:Agilent 7890A 检测器:FID色谱柱:DB-624 30m*0.53mm*3.0um 进样口温度:200℃检测器温度:200℃柱温:起温度始60℃,维持5分钟,以每分钟30℃的速度升温到150℃,维持6分钟。
流速:3.0ml/min 分流比:10:1 进样量:1ul载气:氮气空气:400ml/min 氢气:30ml/min6.2.1.1溶液的配制6.2.1.1.1供试品溶液:精密称取琥珀酸舒马普坦0.2g至10ml量瓶中,加N,N-二甲基甲酰胺溶解并稀释至刻度,摇匀,作为供试品溶液。
6.2.1.1.2储备溶液:精密称取甲醇150mg于100mL量瓶中,加N,N-二甲基甲酰胺溶解并稀释至刻度,摇匀,作为甲醇储备溶液;精密称取乙醇250mg于100mL量瓶中,加N,N-二甲基甲酰胺溶解并稀释至刻度,摇匀,作为乙醇贮备溶液;精密称取乙酸乙酯250mg于100mL量瓶中,加N,N-二甲基甲酰胺溶解并稀释至刻度,摇匀,作为乙酸乙酯贮备溶液;。
FDA批准新的琥珀酸舒马普坦注射剂

FDA批准新的琥珀酸舒马普坦注射剂
佚名
【期刊名称】《世界临床药物》
【年(卷),期】2006(27)5
【摘要】美国FDA批准新的琥珀酸舒马普坦4mg注射剂(Imitrex Injection),用于紧急治疗有或无先兆的偏头痛。
本品采用Imitrex STATdose系统。
患者仅启动按钮就可方便地获得4mg剂量的药物。
【总页数】1页(P257-257)
【关键词】琥珀酸舒马普坦;FDA批准;注射剂;紧急治疗;偏头痛;e系统
【正文语种】中文
【中图分类】R944;R97
【相关文献】
1.舒马曲坦鼻吸粉获FDA批准用于治疗偏头痛 [J], 黄世杰
2.顶空毛细管气相色谱法测定琥珀酸舒马普坦中7种有机溶剂的残留量 [J], 李娟;蔡蓝洁;艾朝辉;孔杜林
3.琥珀酸舒马普坦固体脂质纳米粒的制备及处方优化 [J], 屈晓梅;张芳
4.对舒马普坦治疗反应的预测:舒马普坦和那拉曲坦集合患者数据库 [J], Christoph-Diener H.;Ferrari M.;Mansbach H.;高方
5.国家食品药品监督管理局修订琥珀酸舒马普坦口服制剂说明书 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
舒马曲坦胶囊的制备与质量控制

舒马曲坦胶囊的制备与质量控制张敬如;赵凯;黄复生;王昆【摘要】Objective To prepare sumatriptan capsules and establish the quality standard for them. Methods HPLC was used to determine the content of sumatriptan. Results Sumatriptan showed a good linear relationship in the range of 50-1 600 ng/mL( r = 0. 999 9) and the average recovery was up to (105. 73 ±4. 58)% , RSD was 4. 33%. The mean intra-day RSD and inter - day RSD were 2.20% and 2. 59%. Conclusion This standard is precise and can be used for the quality control of sumatriptan capsules.%目的制备舒马曲坦胶囊并建立其质量控制方法.方法采用高效液相色谱(HPLC)法测定制剂中舒马曲坦.结果舒马曲坦质量浓度在50~1600 ng/mL范围内与峰面积线性关系良好(r=0.9999),平均回收率为(105.73±4.58)%,RSD为4.33%(n=6),日内、日间精密度平均RSD为2.20%和2.59%.结论质量控制方法稳定可靠,可用于舒马曲坦胶囊的质量控制.【期刊名称】《中国药业》【年(卷),期】2012(021)021【总页数】3页(P32-34)【关键词】舒马曲坦胶囊;质量控制;高效液相色谱法【作者】张敬如;赵凯;黄复生;王昆【作者单位】中国人民解放军第三军医大学基础部病原生物学教研室,重庆400038;中国人民解放军第三军医大学基础部病原生物学教研室,重庆 400038;中国人民解放军第三军医大学基础部病原生物学教研室,重庆 400038;中国人民解放军第三军医大学基础部病原生物学教研室,重庆 400038【正文语种】中文【中图分类】R927.2;R971偏头痛是一种慢性神经血管紊乱性疾病,全球发病率约为10%~15%,随着生活节奏的加快和工作压力的加大,发病率呈上升趋势。
琥珀酸舒马普坦胶囊

琥珀酸舒马普坦胶囊药品名称:【通用名称】琥珀酸舒马普坦胶囊【商品名称】纳川【英文名称】 Sumatriptan Succinate Capsules【汉语拼音】 Hu Po Suan Shu Ma Pu Tan Jiao Nang成份:本品主要成分为琥珀酸舒马普坦,其化学名为:3-[2-(二甲胺基)乙基]-N-甲基吲哚-5-甲烷磺酰胺琥珀酸盐。
其结构式为:所属类别:化药及生物制品>> 麻醉药及麻醉辅助用药>> 麻醉辅助用药>> 镇痛药化药及生物制品>> 循环系统药物>> 血管活性药>> 血管收缩药化药及生物制品>> 神经系统药物>> 抗偏头痛药性状:本品为胶囊剂,内容物为白色或类白色颗粒。
适应症:用于成人有先兆或无先兆偏头痛的急性发作。
规格:50mg(以舒马普坦计)用法用量:单次口服的推荐剂量为50mg(1粒),用水送服,若服用1次后无效,不必再加服。
如果在首次服药后有效,但症状仍持续发作者可于2小时后再加服1次。
若服用后症状消失,但之后又复发者,应待前次给药24小时后方可再次用药。
单次口服的最大推荐剂量为100mg (2粒)。
24小时内的总剂量不得超过200mg(4粒)。
不良反应:据国外文献报道:一、主要不良反应1、心脏的不良反应:急性心肌梗塞,致命性心律失常(如:心动过速,室颤,心跳骤停),甚至于有报道病人使用舒马普坦后数小时内死亡,但上述事件的发生率微乎其微。
舒马普坦还可导致冠脉痉挛,6348例临床试验中,有两例病人在服用舒马普坦后即刻出现冠脉痉挛的不良反应,但这些不良反应并未出现严重的临床后果。
2、脑血管的不良反应:脑出血,蛛网膜下腔出血,脑梗塞和其它事件,有些还出现致命的结果,但舒马普坦与这些事件的关联并不确定,相当一部分病例中,看起来更象是本来就存在脑血管病变,而将相关症状误认为系偏头痛(其实不是)所致,进而采用舒马普坦治疗。
超细琥珀酸舒马普坦的制备及其性能评价

温度 4℃ ,搅拌 速率 20 0rmi。利用体外模拟肺部沉积实验考察了不 同干燥方式 ( 0 / n 真空干燥 和喷雾干
燥 ) 对产 品性 能 的影 响 。实 验 结 果 表 明 ,真 空 干 燥 可 以得 到 平 均 粒 径 约 为 1b 的 琥 珀 酸 舒 马 普 坦超 微 粉 , L m 喷 雾 干燥 得 到流 动 性 好 的 薄 片 状 产 品 ,且 喷雾 干 燥 的 产 品体 外 肺 部 沉 积效 果 明显 优 于 经 真 空 干 燥 制 备 的 产
基金 项 目 :国家 自然科 学基 金 (0 0 0 4 ;北 京 市科 技 新 星 计 划 (0 7 0 2 2860) 20B 2)
46 0
化 学 反 应 工程 与 工 艺
9 . ,北 京联本 医 药 化 学 技 术 有 限公 司。琥 珀 酸 舒 马 普 坦 结 构 见 图 1 ( ) 9 5/ 9 6 a ,原 料 药 扫 描 电 镜
收 稿 日期 :2 0—61 ;修 订 日期 :2 0 —80 0 80 —7 0 80 —7
作 者 简 介 :刘
淼 (94 ) 18一 ,女 ,硕士研 究 生 ;陈建 峰 (95 ,男 ,教授 ,博 士生 导 师 ,通 讯 联系 人 。Ema ;ce] ̄nibe.d.n 16一) - i hnf ra.uteuc l ( l
体性质 和制剂 的有效 性产 生很 大影 响[ 。其 中药 物 的粒 径大 小 和 分 布是 影 响 D I 沉 积率 的重 要 因 2 ] P肺
素 。一般认为 理想 的药物 粒径 为 1 m,大于此范 围 的粒 子不 能进人 细支 气管 内 ,而更小 的粒子 又 ~5 易随 呼吸呼 出。药物 微粉化 是 干粉 吸入剂取 得成 功的一 大关键 。 目前 多采 用 的药物 微粉化 技术为机 械
琥珀酸舒马曲坦的工艺研究

未 经校正 ;
(, H,H00CC CH2 00H) .2 s H, s4 H2 C ,27 (,3 一NHC ) H3 ,
28 [ H,一 C 3] .0 ~ 31 [ . 7 s ,6 N(H ),31 2 . 4 m,2 一 H, C 2H N C ]3 4 3 [ 2 , C 2H NC ] H C 2 (H 2 - ~ 36 m, H 一 H C 2 (H 2 ,3 ,
b n y 一s l h n mi e h d 0 h 0 ie a d4 4 d me to y N, e z1 up o a d y rc lr n ,一 i —h x — d
析 出固体 , 搅拌 l 。 放人 4℃冰箱 中静置过夜, h 中
性 滤 纸 过滤 , 白色 粉 末 状 休 。 甲醇 重 结 晶得 得 用
1 仪 器 及 试 剂
33 K 0型低 温趟 速 离心 机(唔 , S ) S ma u A ;
S zD型循 环 水式 多 用 真空 泵 ( 州市 英 峪 电子仪 H 郑
器厂1 :
u 一 80 V 2 0 型紫外 口见分光光度计 ( 』 尤尼柯 ( 上海 ) 仪
器有 限公 司 ) ;
的用量 比例进行 丫平 行考 察 . 当肼盐 酸盐/ 缩醛( o r1 n/
将 4 (.5mo 4 肼 基一 一 0g 1 1 一 0 ) N 甲基一 基磺 酰胺 苄
盐 酸盐 ( 溶 于 水 , 性 滤 纸 快 速 过 滤 , 液 加 入 到 1 ) 巾 滤 10 o 0mL反应 瓶 中, 拌 下 , 加 4 (.5mo 4 一 搅 滴 Og 2 1 , 0 ) 4
头孢克洛杂质研究总结

项目研发 注册申报
53994-83-5
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
10mg
25mg
项目研发
N/A
50mg
注册申报
100mg
其他
10mg
25mg
项目研发
N/A
50mg
注册申报
100mg
其他
10mg
25mg
项目研发
N/A
50mg
注册申报
100mg
其他
10mg
25mg
项目研发
N/A
50mg
注册申报
100mg
其他
Cefaclor
15 头孢克洛杂质 8
N/A
Impurity 8
Cefaclor
16 头孢克洛杂质 9
N/A
Impurity 9
Cefaclor
17 头孢克洛杂质 10
N/A
Impurity 10
Cefaclor
18 头孢克洛杂质 11
N/A
Impurity 11
Cefaclor
19 头孢克洛杂质 12
N/A
Impurity 12
Cefaclor
20 头孢克洛杂质 13
N/A
Impurity 13
Cefaclor
Cefaclor
22 头孢克洛杂质 15
N/A
Impurity 15
......未完待续,更多相关杂质欢迎咨询!
项目研发 注册申报
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
10mg 25mg 50mg 100mg 其他
项目研发 注册申报
抗偏头痛药 丁二酸舒马坦(Sumatriptan Succinate)

抗偏头痛药丁二酸舒马坦(Sumatriptan Succinate)
周斌
【期刊名称】《国外医药:合成药.生化药.制剂分册》
【年(卷),期】1993(14)4
【摘要】异名 ImIGran,GR43175C 化学名 3-[2-(二甲胺基)乙基]-N-甲基-1 H-吲哚-5-甲胺基磺酰基丁二酸药效分类抗偏头痛药开发单位 (英国)Glaxo LaboratoriesLtd 上市厂商 1991年在荷兰首次上市偏头痛是一种单侧型头痛,常伴有恶心和呕吐。
在西方国家有10%以上的人患有此病,且大多数患者为女性。
其病因学机制尚待阐明,但已知偏头痛与颅血管显著而持续的扩张有关。
偏头痛一直是用麦角胺来治疗的,该药对颈动脉吻合具有血管收缩作用,
【总页数】3页(P241-243)
【关键词】抗偏头痛药;丁二酸舒马坦;新药
【作者】周斌
【作者单位】
【正文语种】中文
【中图分类】R971.1
【相关文献】
1.抗偏头痛药——Sumatriptan(舒马坦) [J], 郭丽仪
2.抗偏头痛药舒马曲坦的合成进展 [J], 张雪峰;王兴涌;杨志林;侯永春;沈春红
3.抗偏头痛药——舒马普坦 [J], 王佑宏;孙铁民
4.国外上市新药:抗偏头痛药丁二酸舒马坦 [J], 周斌
5.治抗偏头痛药舒马坦(Sumatriptan) [J], Bate.,DN;李春元
因版权原因,仅展示原文概要,查看原文内容请购买。
各种杂质及价格-

专业承接美国、日本、法国、德国、瑞士、意大利、英国等国家参比制剂一次性进口和代购业务,提供进口〔EP、USP、LGC、BP、TLC、TRC、QCC、MC〕和国产对照品,有需要的欢迎联系我咨询哈.市振强生物技术劳先生135******** QQ3004867396各种杂质名称及英文名:依鲁替尼〔Ibrutinib〕杂质6个,palbociclib杂质6个,泰地唑胺杂质tedizolid phosphate 12个达格列净杂质Dapagliflozin 7个,索非布韦杂质sofosbuvir 20个,替卡格雷杂质Ticagrelor 14个,米拉贝隆杂质Mirabegron 10个,TAK 438杂质10个,沃替西汀杂质Vortioxetine 15个,LCZ696杂质6个非布司他杂质Febuxostat 14个泊沙康唑异构体Posaconazole 14个阿普斯特杂质Apremilast 6个阿奇霉素杂质Azithromycin 14个阿考替胺杂质Acotiamide 14个依托考昔杂质Etoricoxib 14个尼达尼布杂质Nintedanib 8个罗库溴铵杂质Rocuronium Bromide 8个恩杂鲁胺杂质Enzalutamide 4个卢帕他定杂质Rupatadine 6个瑞格非尼杂质Regorafenib 20个色瑞替尼杂质Ceritinib 11个依美斯汀杂质Emedastine8个依匹唑派杂质Brexpiprazole6个依帕司他杂质epalrestat6个乌苯美司杂质Ubenimex 19个福多司坦杂质Fudosteine 6个马来酸匹杉琼杂质Maleic acid Chinese fir, Joan 6个扎鲁司特杂质Zafirlukast 6个贝利司他杂质belinostat 6个奥扎格雷的杂质ozagrel 6个酒石酸伐尼克兰片杂质Varenicline Tartrate Tablets 6个莫扎伐普坦杂质Mozavaptan 5个沙芬酰胺杂质Safinamide 4个沃雷生杂质suvorexant 5个依替巴肽杂质Eptifibatide 5个乐伐替尼杂质lenvatinib 8个1.埃索美拉唑杂质esomeprazole impurity2.奥拉西坦杂质oxiracetam3.罗氟司特杂质roflumilast4.阿戈美拉汀杂质Agomelatine5.鲁拉西酮杂质Lurasidone6.莫西沙星杂质moxifloxacin7.阿齐沙坦杂质Azilsartan8.达比加群酯杂质Pradaxa9.利拉利汀杂质Linagliptin10.托法替尼杂质Tofacitinib11.依托考昔杂质12.阿西替尼杂质Axitinib13.维格列汀杂质Vildagliptin14.帕瑞昔布杂质parecoxib15.伊马替尼杂质imatinib16.阿哌沙班杂质Apixaban17.替诺福韦酯杂质Tenofovir Disoproxil Fumarate18.普拉格雷杂质Prasugrel19.伊拉地平杂质isradipine20.利托那韦杂质ritonavir21.培美曲塞二钠杂质pemetrexed disodium22.依达拉奉杂质Edaravone23.吉非替尼杂质gefitinib24.替吉奥杂质BCB25.苯达莫司汀杂质Cephalon26.替加环素杂质Tigecycline27.布南色林杂质Blonanserin28.文拉法辛杂质venlafaxine29.替卡格雷杂质30.利伐沙班杂质Rivaroxaban31.伊曲茶碱杂质Istradefylline32.依度沙班杂质Edoxaban33.三氟胸苷杂质Trifluorothymidine34.盐酸阿考替胺杂质acotiamide hydrochloride35.度洛西汀杂质Duloxetine36.泊沙康唑杂质37.泰地唑胺杂质38.沃替西汀杂质39.乐伐替尼杂志40.卡博替尼杂质Cabozantinib41.依鲁替尼杂质42.恩格列净杂质EMpagliflozin43.辛伐他汀杂质simvastatin44.恩杂鲁胺杂质45. 阿苯达唑Albendazole46. 阿达帕林adapalene47. 阿夫唑嗪alfuzosin48. 阿卡地新acadesine49. 阿立哌唑aripiprazole50. 阿莫曲普坦almotriptan51. 阿莫西林amoxicillin52. 阿瑞吡坦Aprepitant53. 阿昔洛韦acyclovir54. 埃罗替尼erlotinib55. 安非他酮bupropion56. 氨苄青霉素ampicillin57. 氨基葡萄糖Glucosamine58. 氨甲环酸tranexamic59. 氨溴索Ambroxol60. 胺碘酮Amiodarone61. 奥氮平olanzapine62. 奥沙利铂Oxaliplatin63. 奥司他韦oseltamivir64. 保胆键素dihydroxydibutylether65. 保特佐米Bortezomib66. 苯达莫司汀Bendamustin67. 比卡鲁胺bicalutamide68. 吡罗昔康piroxicam69. 吡嗪酰胺Pyrazinamide70. 别嘌醇allopurinol71. 波生坦bosentan72. 布洛芬Ibuprofen73. 布美他尼Bumetanide74. 雌甾四烯estratetraenol75. 醋氯芬酸aceclofenac76. 达非那新Darifenacin77. 大黄酸Diacerein78. 地尔硫卓diltiazem79. 地拉罗司deferasirox80. 氨氯地平Amlodipine81. 硝苯地平nifedipine82. 甲氨蝶呤Methotrexate83. 氨基蝶呤Aminopterin84. 丁螺环酮buspirone85. 多奈哌齐Donepezi86. 多立酮Domperidone87. 恩丹西酮ondansetron88. 恩他卡朋entacapone89. 伐昔洛韦valacyclovir90. 泛昔洛韦famciclovir91. 非布索坦Febuxostat92. 非那雄胺inasteride-ep93. 非诺贝特fenofibrate94. 弗斯特罗定fesoterodine95. 伏立康唑Voriconazole96. 氟替卡松丙酸酯fluticasone-propionate97. 氟维司群Fulvestrant98. 格列吡嗪glipizide99. 桂利嗪cinnarizine100. 环苯扎林cyclobenzaprine101. 加巴喷丁gabapentin102. 甲状旁腺激素西那卡塞Cinacalcet 103. 甲状腺素Levothyroxine104. 卡巴拉汀利凡斯的明Rivastigmine RC's 105. 喹硫平Quetiapine106. 奥美拉唑Omeprazole107. 兰索拉唑Lansoprazol108. 雷贝拉唑Rabeprazole109. 泮托拉唑pantoprazol110. 来氟米特leflunomide111. 雷洛昔芬raloxifene112. 雷莫拉宁Ramoplanin113. 雷奈佐利Linezolid114. 利伐沙班Rivaroxaban115. 利培酮Risperidal116. 罗匹尼罗ropinirole117. 阿替洛尔Atenolol118. 比索洛尔Bisoprolol119. 醋丁洛尔Acebutolol120. 美托洛尔metoprolol121. 奈必洛尔nebivolol122. 氯吡格雷Clopidogrel123. 氯雷他定Loratadine124. 霉酚酸mycophenolate125. 美洛昔康meloxicam126. 孟鲁司特montelukast127. 米氮平mirtazapine128. 尼美舒利nimesulide129. 帕罗西汀Paroxetine130. 帕立酮Paliperidone131. 生丁Dipyridamole Dipyridamole 132. 培美曲塞二钠Pemetrexed-disodium 133. 普拉克索Pramipexole134. 喹那普利Quinapril135. 卡托普利captopril136. 赖诺普利Lisinopril137. 雷米普利Ramipril138. 培哚普利Perindopril Imp139. 群多普利Trandolapril140. 伊拉普利Enalapril141. 普瑞巴林pregabalin142. 瑞格列奈Repaglinide143. 塞来西布Celecoxib144. 噻托溴铵Tiotropium bromide 145. 沙丁胺醇salbutamol146. 沙美特罗salmeterol147. 奥美沙坦Olmesartan 148. 坎地沙坦Candesartan 149. 罗沙坦Losartan150. 替米沙坦Telmisartan151. 缬沙坦Valsartan152. 加替沙星gatifloxacin153. 氟哌酸norfloxacin154. 菲宁达、氧氟沙星Ofloxacin 155. 恩诺沙星enrofloxacin 156. 环丙沙星Ciprofloxacin 157. 莫西沙星moxifloxacin158. 左氧氟沙星Levofloxacin 159. 舍曲林Sertraline160. 舒马曲坦sumatriptan 161. 双醋瑞因diacerein162. 双氯芬酸Diclofenac 163. 他达那非Tadalafil164. 阿托伐他汀atorvastatin 165. 洛伐他汀Lovastatin166. 匹伐他汀pitavastatin 167. 普伐他汀pravastatin 168. 瑞舒伐他汀Rosuvastatin 169. 辛伐他汀Simvastatin 170. 坦索罗辛Tamsulosin 171. 格列美脲glimepiride 172. 吡格列酮pioglitazone 173. 尼扎替丁nizatidine 174. 替卡西林Ticarcillin 175. 酮咯酸氨丁三醇Ketorolac 176. 酮基布洛芬Ketoprofen 177. 头孢氨苄cefalexin178. 头孢克洛cefaclor179. 头孢磺啶cefsulodin180. 托特罗定tolterodine 181. 拓扑替康topotecan182. 万古霉素vanycin183. 文拉伐辛Venlafaxine 184. 那非Sildenafil185. 西他列汀Sitagliptin186. 西酞普兰Citalopram 187. 西替利嗪cetirizine188. 伊立替康Irinotecan189. 伊马替尼imatinib190. 伊曲康唑Itraconazole191. 依泽替米贝ezetimibe192. 左乙拉西坦Levetiracetam193. 佐米曲普坦zolmitriptan194. 唑吡坦zolpidem195. 唑尼沙胺Zonisamide依鲁替尼〔Ibrutinib〕杂质6个,palbociclib杂质6个,泰地唑胺杂质tedizolid phosphate 12个达格列净杂质Dapagliflozin 7个,索非布韦杂质sofosbuvir 20个,替卡格雷杂质Ticagrelor 14个,米拉贝隆杂质Mirabegron 10个,TAK 438杂质10个,沃替西汀杂质Vortioxetine 15个,LCZ696杂质6个非布司他杂质Febuxostat 14个泊沙康唑异构体Posaconazole 14个阿普斯特杂质Apremilast 6个阿奇霉素杂质Azithromycin 14个阿考替胺杂质Acotiamide 14个依托考昔杂质Etoricoxib 14个尼达尼布杂质Nintedanib 8个罗库溴铵杂质Rocuronium Bromide 8个恩杂鲁胺杂质Enzalutamide 4个卢帕他定杂质Rupatadine 6个瑞格非尼杂质Regorafenib 20个色瑞替尼杂质Ceritinib 11个依美斯汀杂质Emedastine8个依匹唑派杂质Brexpiprazole6个依帕司他杂质epalrestat6个乌苯美司杂质Ubenimex 19个福多司坦杂质Fudosteine 6个马来酸匹杉琼杂质Maleic acid Chinese fir, Joan 6个扎鲁司特杂质Zafirlukast 6个贝利司他杂质belinostat 6个奥扎格雷的杂质ozagrel 6个酒石酸伐尼克兰片杂质Varenicline Tartrate Tablets 6个莫扎伐普坦杂质Mozavaptan 5个沙芬酰胺杂质Safinamide 4个沃雷生杂质suvorexant 5个依替巴肽杂质Eptifibatide 5个乐伐替尼杂质lenvatinib 8个。
对原料药中杂质的研究

对原料药中杂质的研究
陶俊菊
【期刊名称】《科技创新与应用》
【年(卷),期】2015(000)019
【摘要】在新药研究过程中,对杂质的研究愈发引起国内外的高度重视。
ICH及国家食品药品监督管理局均颁布了相应的指导原则,国内外的药典也从专业角度对杂质进行界定。
故杂质研究在药物药品研究中所占的比例日益增大。
文章在概述了原料药中杂质的基础上,重点阐述了杂质的分类及其合理的限度、分析方法与建立标准,旨在阐述其在原料药质量控制中的重要性。
【总页数】1页(P300-300)
【作者】陶俊菊
【作者单位】浙江新赛科药业有限公司,浙江上虞 312369
【正文语种】中文
【相关文献】
1.原料药出HDMF注册文件中的杂质研究
2.降低萘呋胺酯草酸盐原料药中杂质方法的研究
3.原料药中的杂质研究
4.盐酸兰地洛尔原料药中基因毒性杂质的定量分析方法研究
5.左亚叶酸钠原料药中两个主要杂质结构的研究
因版权原因,仅展示原文概要,查看原文内容请购买。
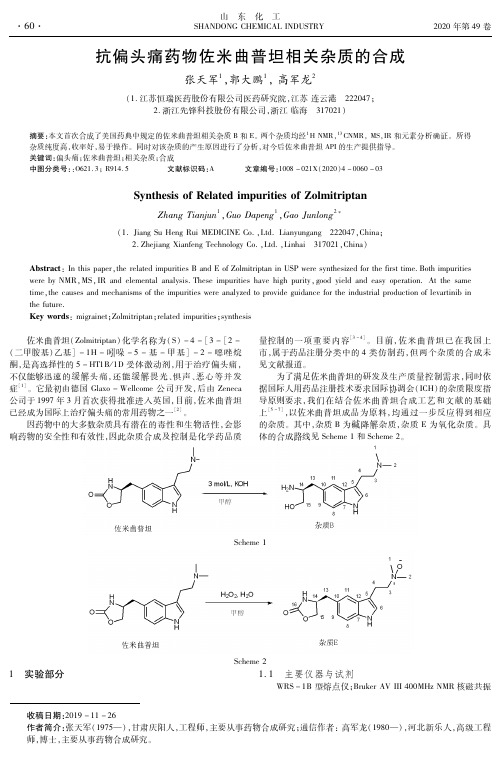
抗偏头痛药物佐米曲普坦相关杂质的合成
Scheme 2
1. 1 主要仪器与试剂
型熔点仪; 核磁共振 WRS - 1B
Bruker AV III 400MHz NMR
收稿日期:
2019 - 11 - 26
作者简介:张天军(1975—),甘肃庆阳人,工程师,主要从事药物合成研究;通信作者:高军龙(1980—),河北新乐人,高级工程
症[1]。它最初由德国Glaxo - Wellcome 公司开发,后由Zeneca 据国际人用药品注册技术要求国际协调会(ICH)的杂质限度指
公司于1997 年3 月首次获得批准进入英国,目前,佐米曲普坦 导原则要求,我们在结合佐米曲普坦合成工艺和文献的基础
已经成为国际上治疗偏头痛的常用药物之一[2]。
上[5 - 7],以佐米曲普坦成品为原料,均通过一步反应得到相应
因药物中的大多数杂质具有潜在的毒性和生物活性,会影 的杂质。其中,杂质B 为碱降解杂质,杂质E 为氧化杂质。具
响药物的安全性和有效性,因此杂质合成及控制是化学药品质 体的合成路线见Scheme 1 和Scheme 2。
Scheme 1
1 实验部分
·60·
山东化工 年第 卷 SHANDONG CHEMICAL INDUSTRY 2020 49
抗偏头痛药物佐米曲普坦相关杂质的合成
张天军1,郭大鹏1,高军龙2
(1. 江苏恒瑞医药股份有限公司医药研究院,江苏连云港 222047; 2. 浙江先锋科技股份有限公司,浙江临海 317021)
业级,上海凌凯医药科技有限公司。
( ), ( ), ( ), ( ), ( 119. 92 11 C 112. 59 9 C 110. 69 5 C 71. 46 4 C 70. 48 15'
呋塞米相关杂质
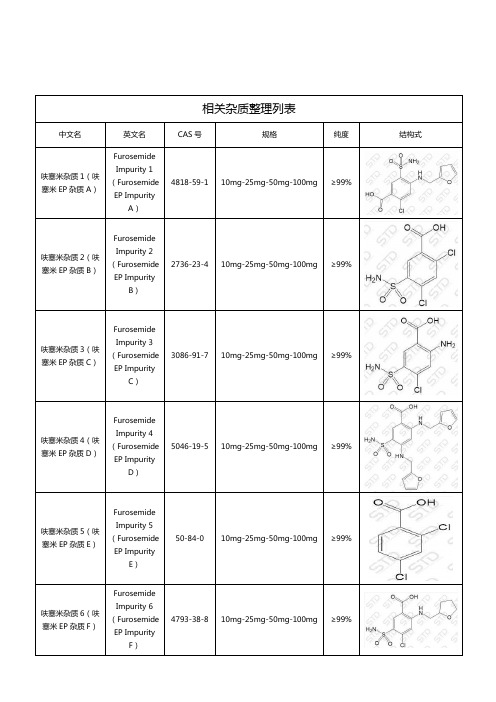
相关杂质整理列表中文名英文名CAS号规格纯度结构式呋塞米杂质1(呋塞米EP杂质A)FurosemideImpurity 1(FurosemideEP ImpurityA)4818-59-1 10mg-25mg-50mg-100mg ≥99%呋塞米杂质2(呋塞米EP杂质B)FurosemideImpurity 2(FurosemideEP ImpurityB)2736-23-4 10mg-25mg-50mg-100mg ≥99%呋塞米杂质3(呋塞米EP杂质C)FurosemideImpurity 3(FurosemideEP ImpurityC)3086-91-7 10mg-25mg-50mg-100mg ≥99%呋塞米杂质4(呋塞米EP杂质D)FurosemideImpurity 4(FurosemideEP ImpurityD)5046-19-5 10mg-25mg-50mg-100mg ≥99%呋塞米杂质5(呋塞米EP杂质E)FurosemideImpurity 5(FurosemideEP ImpurityE)50-84-0 10mg-25mg-50mg-100mg ≥99%呋塞米杂质6(呋塞米EP杂质F)FurosemideImpurity 6(FurosemideEP ImpurityF)4793-38-8 10mg-25mg-50mg-100mg ≥99%呋塞米杂质7 FurosemideImpurity 74753-68-8 10mg-25mg-50mg-100mg ≥99%湖北扬信医药科技有限公司经营上万种杂质对照品(优势供应硫酸羟氯喹杂质、硝苯地平杂质、沙丁胺醇杂质、达格列净杂质、厄贝沙坦杂质、阿莫西林克拉维酸钾杂质、利伐沙班杂质、阿托伐他汀钙杂质、西格列汀杂质、利格列汀杂质等),并代理销售中检所、STD、LGC、TLC、EP、USP、TRC等多个品牌产品,提供上万种标准品对照品,真诚为您服务。
舒马曲坦注射液美国药典标准

B RIEFINGSumatriptan Injection. Because there is no existing USP monograph for this dosage form, a new monograph based on the validated methods of analysis is proposed. The isocratic liquid chromatographic procedure for the Assay is based on analyses performed withInertsil ODS-3V brand of L1 column in which the sumatriptan retention time is about 6 min.The gradient elution liquid chromatographic procedure for Organic Impurities is based on analyses performed with Inertsil ODS-3V brand of L1 column in which the sumatriptan retention time is about 13 min.(SM4: R. Ravichandran, H. Ramanathan, R. Tirumalai.)Correspondence Number—C98122Comment deadline: November 30, 2011Add the following:Sumatriptan InjectionDEFINITIONSumatriptan Injection is a sterile solution of Sumatriptan Succinate in Water for Injection. It contains NLT 90.0% and NMT 110.0% of the labeled amount of sumatriptan (C14H21N3O2S).IDENTIFICATION• A.The retention time of the major peak in the Sample solution corresponds to that of the Standard solution, as obtained in the Assay.ASSAY• P ROCEDUREBuffer: Add 1.7 mL of butylamine, 0.66 mL of phosphoric acid, and 3.7 g of monobasicsodium phosphate to 900 mL of water. Mix, and adjust with 1 N sodium hydroxide to a pH of7.5 ±0.1. Dilute with water to 1000 mL.Mobile phase: Acetonitrile and Buffer (17:83)Diluent: Acetonitrile and water (50:50)Standard solution: 0.14 mg/mL of USP Sumatriptan Succinate RS in DiluentSample solution: Nominally 0.1 mg/mL of sumatriptan from the Injection in DiluentChromatographic system(See Chromatography 621, System Suitability.)Mode: LCDetector: UV 227 nmColumn: 4.6-mm × 25-cm; 5-µm packing L1Flow rate: 1.5 mL/minInjection size: 10 µLRun time: About 3 times the retention time of sumatriptanSystem suitabilitySample: Standard solutionSuitability requirementsTailing factor: NMT 2.0Relative standard deviation: NMT 2.0%AnalysisSamples: Standard solution and Sample solutionCalculate the percentage of the labeled amount of sumatriptan (C14H21N3O2S) in theInjection taken:Result = (r U/r S) × (C S/C U) × (M r1/M r2) × 100r U= peak response from the Sample solutionr S= peak response from the Standard solutionC S= concentration of USP Sumatriptan Succinate RS in the Standard solution(mg/mL)C U= nominal concentration of sumatriptan in the Sample solution (mg/mL)M r1 = molecular weight of sumatriptan free base, 295.40M r2 = molecular weight of sumatriptan succinate, 413.49Acceptance criteria: 90.0%–110.0%IMPURITIES• O RGANIC I MPURITIESSolution A: Add 2 mL of triethylamine to 1 L of a solution containing 3.7 g/L of monobasic sodium phosphate monohydrate. Adjust with phosphoric acid to a pH of 7.5 ±0.1.Solution B: AcetonitrileDiluent: Acetonitrile and water (20:80)Mobile phase: See Table 1.Table 1Time (min) Solution A (%) Solution B (%) 0 95 5 12 75 25 25 75 25 30 95 5 40955System suitability solution: 2 mg/mL of USP Sumatriptan Succinate RS and 8 µg/mL of USP Sumatriptan Related Compound C RS in Diluent . Sonication may be used to aid dissolution.Standard solution: 0.01 mg/mL of USP Sumatriptan Succinate RS in Diluent . Sonication may be used to aid dissolution.Sample solution: Nominally 1.4 mg/mL of sumatriptan from the Injection in Diluent . Chromatographic system(See Chromatography 621, System Suitability .) Mode: LCDetector: UV 227 nmColumn: 4.6-mm × 25-cm; 5-µm packing L1 Column temperature: 30 Flow rate: 1 mL/min Injection size: 10 µL System suitabilitySamples: System suitability solution and Standard solution Suitability requirementsResolution: NLT 1.5 between sumatriptan related compound C and sumatriptan, System suitability solutionTailing factor: NMT 2.0, Standard solutionRelative standard deviation: NMT 5.0%, Standard solution AnalysisSamples: Standard solution and Sample solutionCalculate the percentage of each impurity as well as any individual unspecified degradation product in the portion of Injection taken:Result = (r U/r S) × (C S/C U) × (M r1/M r2) × (1/F) × 100r U= peak response for each impurity from the Sample solutionr S= peak response from the Standard solutionC S= concentration of USP Sumatriptan Succinate RS in the Standard solution(mg/mL)C U= nominal concentration of sumatriptan in the Sample solution (mg/mL)M r1 = molecular weight of sumatriptan free base, 295.40M r2 = molecular weight of sumatriptan succinate, 413.49F= Relative response factor (see Table 2)Acceptance criteria: See Table 2.Table 2Name RelativeRetentionTimeRelativeResponseFactorAcceptanceCriteriaNMT(% w/w)Sumatriptan monomethyl a0.83 0.83 0.3 Sumatriptan N-oxide b0.88 1.0 0.2 Sumatriptan related compound C c0.96 0.81 0.5 Sumatriptan 1.0 ——Sumatriptan methyl 2-carboxylate d 1.31 0.43 0.1 Specified unidentified degradation product(molecular weight 531)e1.92 1.0 0.5Any individual unspecified degradation product — 1.0 0.2 Total impurities —— 2.0a N-Methyl-1-{3-[2-(methylamino)ethyl]-1H-indol-5-yl}methanesulfonamide.b N-Methyl-1-{3-[2-(dimethylaminoN-oxide)ethyl]-1H-indol-5-yl}methanesulfonamide.c3-[2-(Dimethylamino)ethyl]-1-(hydroxymethyl)-1H-indol-5-yl]-N-methylmet hanesulfonamide.d Methyl3-[2-(dimethylamino)ethyl]-5-(N-methylsulfamoylmethyl)-1H-indole-2-carboxy late.e Chemical information not available.SPECIFIC TESTS•P H791:4.2–5.3• O SMOLALITY AND O SMOLARITY 785:270–330 mOsmol• P ARTICULATE M ATTER IN I NJECTIONS 788:Meets requirements• B ACTERIAL E NDOTOXINS T EST 85:It contains NMT 20 USP Endotoxin Units/mg of sumatriptan.• S TERILITY T ESTS 71:Meets the requirements• O THER R EQUIREMENTS:It meets the requirements under Injections 1, Labeling.ADDITIONAL REQUIREMENTS• P ACKAGING AND S TORAGE:Preserve in single-dose containers, preferably of Type 1 glass.Store between 2and 30, protected from light.• USP R EFERENCE S TANDARDS 11USP Endotoxin RSUSP Sumatriptan Related Compound C RS[[3-[2-(Dimethylamino)ethyl]-1-(hydroxymethyl)-1H-indol-5-yl]-N-methylmethanesulfonamide succinate salt]. C15H23N3O3S·0.5 C4H6O4 384.47USP Sumatriptan Succinate RS2S (USP35)。
地塞米松杂质整理列表(重点部分)
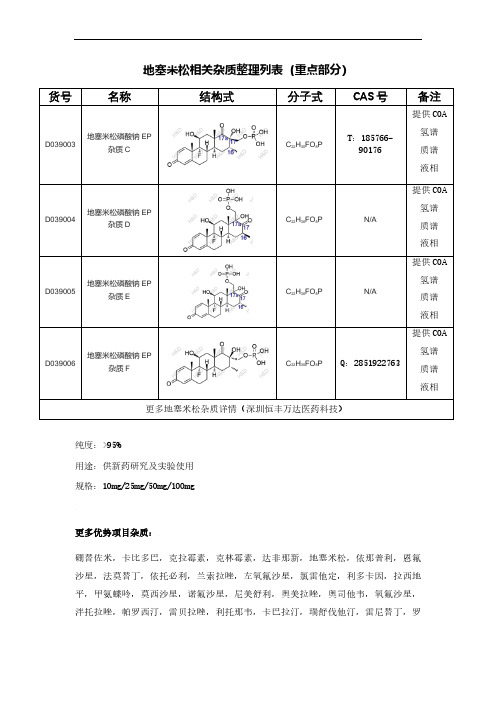
地塞米松相关杂质整理列表(重点部分)
货号
名称
结构式 分子式 CAS 号 备注
D039003 地塞米松磷酸钠EP
杂质C
C 22H 30FO 8P
T :185766-90176
提供COA 氢谱 质谱 液相 D039004
地塞米松磷酸钠EP
杂质D
C 22H 30FO 8P
N/A
提供COA
氢谱
质谱 液相 D039005
地塞米松磷酸钠EP
杂质E
C 22H 30FO 8P
N/A
提供COA
氢谱
质谱 液相 D039006
地塞米松磷酸钠EP
杂质F
C 22H 30FO 8P
Q :2851922763
提供COA
氢谱
质谱 液相
更多地塞米松杂质详情(深圳恒丰万达医药科技)
纯度:>95%
用途:供新药研究及实验使用 规格:10mg/25mg/50mg/100mg
更多优势项目杂质:
硼替佐米,卡比多巴,克拉霉素,克林霉素,达非那新,地塞米松,依那普利,恩氟沙星,法莫替丁,依托必利,兰索拉唑,左氧氟沙星,氯雷他定,利多卡因,拉西地平,甲氨蝶呤,莫西沙星,诺氟沙星,尼美舒利,奥美拉唑,奥司他韦,氧氟沙星,泮托拉唑,帕罗西汀,雷贝拉唑,利托那韦,卡巴拉汀,瑞舒伐他汀,雷尼替丁,罗
红霉素,沙丁胺醇,西他列汀,舍曲林,索菲那新,舒马曲坦,辛伐他汀,西洛多辛,托莫西汀,氨甲环酸,替卡格雷,替卡西林,替米沙坦,伐地那非等。
舒马曲坦的合成

舒马曲坦的合成摘要:目的合成抗偏头痛药舒马曲坦。
方法以对硝基氯苄为起始原料,经取代、胺化、还原、重氮化、环合等10步反应得到目标化合物舒马曲坦,总收率为18%。
结果与结论目标化合物的结构经1H-NMR、IR和MS确证。
该合成方法,反应条件温和,操作简便,原料易得,适合工业化生产。
舒马曲坦(sumatriptan,1),化学名为3-(2-二甲氨基)乙基-N-甲基-1H-吲哚-5-甲磺酰胺,是由英国Glaxo公司研制开发的用于治疗急性偏头痛的首个曲坦类药物。
该药于1991年首先在荷兰、瑞典等国上市,属于高选择性的5-HT1B/1D受体激动剂,毒副作用小,对于中到重度偏头痛或应用止痛药无效的患者,舒马曲坦是最为合适的一线治疗药物,具有良好的临床应用价值[1]。
以N-甲基-4-肼基苯甲磺酰胺盐酸盐(8)为起始原料,舒马曲坦的合成按照环合方法的不同主要分为如下两种[2-3]:1)起始原料与4-二甲氨基丁醛二甲缩醛形成腙,最后经Fischer吲哚环合得目标产物。
该路线环合反应收率较低,副产物较多,需要柱色谱分离产物,无法实现工业化。
2)起始原料与1-羟基-4-氯丁磺酸钠缩合后经Grandberg环合、还原胺化反应得到舒马曲坦。
该路线环合收率较高,因此本文以该方法为基础,参考文献[4],对其合成工艺进行了优化。
N-甲基-4-肼基苯甲磺酰胺盐酸盐(8)的合成参照文献[5],以4-硝基氯苄为起始原料,与亚硫酸钠经取代反应得到4-硝基苯甲磺酸钠(2),再经过氯代得到4-硝基苯甲磺酰氯(3),3经甲胺胺化得到N-甲基-4-硝基苯甲磺酰胺(4),再经催化氢化、重氮化、还原和成盐反应得到N-甲基-4-肼基苯甲磺酰胺盐酸盐(8),8经3步反应,采用“一勺烩”方法合成目标产物(1)。
合成路线见图1 实验部分熔点采用YRT-3型熔点测定仪测定,温度未经校正。
红外光谱采用岛津IR-27G红外分光光度计测定,溴化钾压片。
核磁共振氢谱采用BrukerARX-300型核磁共振仪测定,TMS为内标。
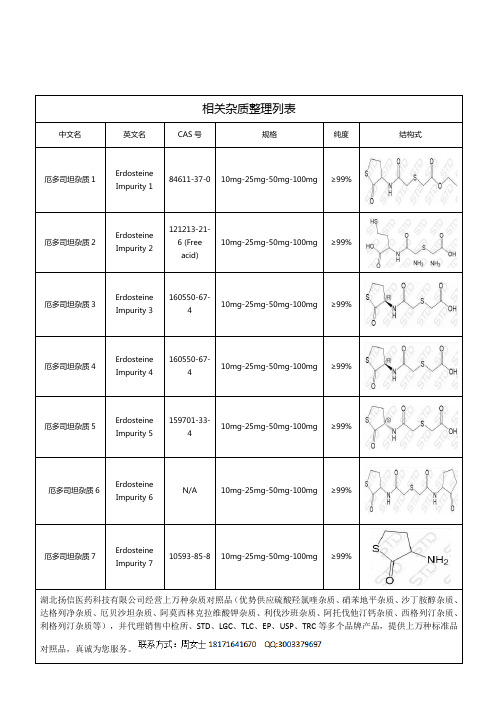
厄多司坦相关杂质
相关杂质整理列表中文名英文名CAS号规格纯度结构式厄多司坦杂质1 ErdosteineImpurity 184611-37-0 10mg-25mg-50mg-100mg ≥99%厄多司坦杂质2 ErdosteineImpurity 2121213-21-6 (Freeacid)10mg-25mg-50mg-100mg ≥99%厄多司坦杂质3 ErdosteineImpurity 3160550-67-410mg-25mg-50mg-100mg ≥99%厄多司坦杂质4 ErdosteineImpurity 4160550-67-410mg-25mg-50mg-100mg ≥99%厄多司坦杂质5 ErdosteineImpurity 5159701-33-410mg-25mg-50mg-100mg ≥99%厄多司坦杂质6 ErdosteineImpurity 6N/A 10mg-25mg-50mg-100mg ≥99%厄多司坦杂质7 ErdosteineImpurity 710593-85-8 10mg-25mg-50mg-100mg ≥99%湖北扬信医药科技有限公司经营上万种杂质对照品(优势供应硫酸羟氯喹杂质、硝苯地平杂质、沙丁胺醇杂质、达格列净杂质、厄贝沙坦杂质、阿莫西林克拉维酸钾杂质、利伐沙班杂质、阿托伐他汀钙杂质、西格列汀杂质、利格列汀杂质等),并代理销售中检所、STD、LGC、TLC、EP、USP、TRC等多个品牌产品,提供上万种标准品对照品,真诚为您服务。
厄多司坦杂质8 ErdosteineImpurity 884611-22-3 10mg-25mg-50mg-100mg ≥99%厄多司坦杂质9 ErdosteineImpurity 9N/A 10mg-25mg-50mg-100mg ≥99%。
阿托西班杂质种类整理列表

中文名称英文名称CAS规格用途结构式
阿托西班醋酸盐Atosiban Acetate914453-95-510mg-25mg-50mg-100mg
项目报批
纯度高于98.89%
阿托西班杂质 B Atosiban Impurity B N/A10mg-25mg-50mg-100mg
项目报批
纯度高于98.89%
阿托西班杂质 D Atosiban Impurity D N/A10mg-25mg-50mg-100mg
项目报批
纯度高于98.89%
阿托西班杂质 F Atosiban Impurity F N/A10mg-25mg-50mg-100mg
项目报批
纯度高于98.89%
阿托西班杂质 G Atosiban Impurity G N/A10mg-25mg-50mg-100mg
项目报批
纯度高于98.89%
武汉斯坦德供应各种杂质对照品:泊沙康唑杂质、替卡格雷杂质、索拉非尼杂质、索拉菲尼相关杂质、去氧肾上腺素杂质、维生素BI 杂质、马来酸氯苯那敏杂质、瑞格列奈杂质等;并提供COA、NMR、HPLC、MS等图谱。
详情请点用户名。
专注各种杂质对照品 代理中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/STD等品牌
阿托西班杂质种类整理列表。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
相关杂质整理列表
中文名英文名CAS号规格纯度结构式
舒马曲坦杂质1(舒马曲坦EP杂
质A)Sumatriptan
Impurity 1
(Sumatripta
n EP Impurity
A)
545338-89-
4
10mg-25mg-50mg-100mg ≥99%
舒马曲坦杂质2(舒马曲坦EP杂
质B)Sumatriptan
Impurity 2
(Sumatripta
n EP Impurity
B)
88919-51-1 10mg-25mg-50mg-100mg ≥99%
舒马曲坦杂质3(舒马曲坦EP杂
质C)Sumatriptan
Impurity 3
(Sumatripta
n EP Impurity
C)
N/A 10mg-25mg-50mg-100mg ≥99%
舒马曲坦杂质4(舒马曲坦EP杂
质D)Sumatriptan
Impurity 4
(Sumatripta
n EP Impurity
D)
212069-94-
8
10mg-25mg-50mg-100mg ≥99%
舒马曲坦杂质5(舒马曲坦EP杂
质E)Sumatriptan
Impurity 5
(Sumatripta
n EP Impurity
E)
88919-22-6 10mg-25mg-50mg-100mg ≥99%
舒马曲坦杂质6(舒马曲坦EP杂
质F)Sumatriptan
Impurity 6
(Sumatripta
n EP Impurity
F)
N/A 10mg-25mg-50mg-100mg ≥99%
舒马曲坦杂质7(舒马曲坦EP杂
质G)Sumatriptan
Impurity 7
(Sumatripta
n EP Impurity
G)
N/A 10mg-25mg-50mg-100mg ≥99%
舒马曲坦杂质8(舒马曲坦EP杂
质H)Sumatriptan
Impurity 8
(Sumatripta
n EP Impurity
H)
1391052-5
9-7
10mg-25mg-50mg-100mg ≥99%
湖北扬信医药科技有限公司经营上万种杂质对照品(优势供应硫酸羟氯喹杂质、硝苯地平杂质、沙丁胺醇杂质、达格列净杂质、厄贝沙坦杂质、阿莫西林克拉维酸钾杂质、利伐沙班杂质、阿托伐他汀钙杂质、西格列汀杂质、利格列汀杂质等),并代理销售中检所、STD、LGC、TLC、EP、USP、TRC等多个品牌产品,提供上万种标准品
对照品,真诚为您服务。
