常见高中化学物质颜色(精)
高中化学有色物质大全

物质的颜色一、红色1、Li 的焰色:紫红色(用于元素锂元素存在的检验)2、Ca 的焰色:砖红色(用于元素钙元素存在的检验)3、Sr 的焰色:洋红色(用于元素锶元素存在的检验)4、固体铜:红色(有金属光泽)5、红磷:暗红色6、液溴:深红棕色(水溶液为橙色,蒸汽为红棕色)7、氧化铁粉末:红棕色(通常用作颜料,俗称铁红)8、氢氧化铁胶体或沉淀:红褐色(通常用来检验Fe2、Fe3的存在)9、氧化亚铜沉淀:砖红色(用于检验有机物中醛基的存在)10、二氧化氮气体:红棕色11、Fe3+溶液中加入SCN-:棕色溶液变成血红色(用来检验Fe3的存在)12、碱性溶液中滴入酚酞溶液:溶液变红色13、酸性溶液中滴入石蕊试液:溶液变红色二、黄色1、Au:金黄色(有金属光泽)2、Na 的焰色:黄色(用于检验Na 元素的存在)3、白磷:黄色或白色4、硫固体:淡黄色晶体5、AgBr:淡黄色(不溶于稀硝酸,用于检验溴离子的存在)6、AgI:黄色(不溶于稀硝酸,用于检验碘离子的存在)7、Ag3PO4:黄色(溶于稀硝酸)8、Na2O2:淡黄色固体(用于潜水艇中的制氧气)9、Fe3的溶液:棕黄色10、工业盐酸:因含有Fe3而显黄色11、浓硝酸:因长久放置分解出NO2 而显黄色12、鸡蛋白溶液:遇浓硝酸而变黄色三、绿色1、Cu 的焰色:绿色(用于检验铜元素的存在)2、Ba 的焰色:黄绿色(用于检验钡元素的存在)3、白磷自燃:绿色(俗称鬼火)4、FeSO47H2O:绿色(俗称绿矾)5、CuOH2CO3:绿色(铜锈)6、氯气:黄绿色气体7、氯水:黄绿色8、氟气:淡黄绿色气体9、Fe 溶液:浅绿色四、蓝色:淡蓝色1、O2(液态或固态)2、CuSO45H2O 晶体:蓝色(俗称蓝矾,又叫胆矾)3、Cu(OH)2 沉淀:蓝色4、CuSO4 溶液:蓝色5、CuCl2 溶液:蓝绿色(与溶液浓度有关)6、CO 在空气中燃烧:蓝色火焰7、H2、H2S、CH4、C2H5OH、S 在空气中燃烧:淡蓝色火焰8、淀粉遇上I2:变蓝色9、葡萄糖溶液中加入氢氧化铜悬浊液:变成绛蓝色溶液(若加热煮沸则生成砖红色沉淀Cu2O)10、碱性溶液中加入石蕊试液:变蓝色11、湿润的红色石蕊试纸遇氨气变蓝色12、白色的碘化钾淀粉试纸:遇氧化性物质变蓝色(如H2O2、Cl2、NO2 等)五、紫色1、I2 固体:紫黑色(有金属光泽)2、I2 蒸汽:紫色3、I2 的CCl4 溶液或苯溶液:紫红色(I2 水呈褐色)4、KMnO4 溶液:紫色或紫红色5、石蕊试液:紫色6、苯酚溶液中滴加FeCl3 溶液:变紫色7、K 的焰色:紫色(透过蓝色钴玻璃,用于检验钾元素的存在)8、Rb(铷)的焰色:紫色(用于检验铷元素的存在)六、白色1、大多数金属固体都是银白色(铯略带金色光泽)2、AgCl:白色沉淀(不溶于稀硝酸,用于检验氯离子的存在)3、BaSO4:白色沉淀(不溶于稀硝酸,用于检验钡离子或硫酸根离子的存在)4、Fe(OH)2:白色絮状沉淀(接触空气后迅速变为灰绿色,最后变为红褐色氢氧化铁,可用于检验Fe2的存在)5、澄清石灰水中通入过量的CO2 或SO2:先出现白色浑浊,后又澄清。
高中化学物质颜色大全

高中化学物质颜色大全一、气体:1、氢气:无色透明、无臭无味且难溶于水的气体2、氧气:无色无味气体,不易溶于水,1 L水中溶解约30 mL氧气。
液氧为天蓝色。
固氧为蓝色晶体。
3、氯气:常温常压下为黄绿色,有强烈刺激性气味的剧毒气体,可溶于水和碱溶液,易溶于有机溶剂(如二硫化碳和四氯化碳)4、硫化氢:无色,低浓度时有臭鸡蛋气味,浓度极低时便有硫磺味,能溶于水,易溶于醇类、石油溶剂和原油。
5、二氧化硫:无色有刺激性气味的气体。
6、三氧化硫:无色,常温下是液体,标准状况下是固体,加热后是气体。
7、氯化氢:常温常压下,为无色有刺激性气味的气体。
其水溶液俗称盐酸。
氯化氢极易溶于水,在0 ℃时,1体积的水大约能溶解500体积的氯化氢。
8、一氧化碳:通常状况下为是无色、无臭、无味的气体。
难溶于水。
9、二氧化碳:常温常压下是一种无色无味或无色无嗅(嗅不出味道)而略有酸味的气体,溶于水。
10、氮气:无色气体。
有强烈的刺激气味。
易被液化成无色的液体。
也易被固化成雪状固体。
溶于水、乙醇和乙醚。
11、一氧化氮:无色无味气体难溶于水的有毒气体。
12、二氧化氮:二氧化氮是指高温下棕红色有毒气体。
在常温下(0~21.5 ℃)二氧化氮与四氧化二氮混合而共存。
与水作用生成硝酸和一氧化氮。
与碱作用生成硝酸盐。
能与许多有机化合物起激烈反应。
13、四氧化二氮:在常温下时无色气体,在标准状况下的状态是无色液体。
14、氟化硅:无色、有毒、有刺激性臭味的气体,易潮解,在潮湿空气中可产生浓烟雾。
二、固体单质:1、锂:银白色固体,是密度最小的金属,存放于固体石蜡或者白凡士林中(在液体石蜡中锂也会浮起)。
2、钠:银白色有金属光泽固体,保存在煤油或者石蜡中。
3、铍:灰白色的碱土金属4、镁:银白色的轻质碱土金属5、钙:常温下呈银白色晶体6、碳:黑色粉状或颗粒状多孔结晶。
7、硅:有无定形硅和晶体硅两种同素异形体,晶体硅为灰黑色,无定形硅为黑色,极少以单质的形式在自然界出现,8、硫:黄色的晶体,又称作硫磺。
高中化学常见物质颜色

高中化学常见物质颜色1、黑色系列铁粉、碳粉、FeO、Fe3O4、FeS、CuS、Cu2S、MnO2、Ag2S、Ag2O、CuO、活性炭、2、绿色系列Fe2+:浅绿溶液Cu2(OH)2CO3:绿色固体Cl2、氯水:黄绿色F2:淡黄绿色气体Cu的焰色:绿色FeSO4溶液:浅绿色Ba的焰色:黄绿色3、黄色系列Fe3+:黄色溶液Na2O2:淡黄色固体S:淡黄色固体Ag3PO4:黄色沉淀AgBr:浅黄色沉淀AgI:黄色沉淀碘水:深黄色FeCl3:棕黄色固体CuCl2:棕黄色固体工工业盐酸:黄色(含Fe3+)浓硝酸发黄:(分解后溶有NO2)蛋白质遇浓硝酸:变黄4、红色系列Fe(OH)3:红褐色沉淀Fe2O3:红棕色粉末Fe(SCN)3:血红色溶液铜单质:紫红色Cu2O:红色KMnO4溶液:紫(红)色NO2:红棕色气体I2的有机溶液:紫(红)色Br2的有机溶液:橙红色I2:紫黑色固体、蒸汽为紫红色苯酚露置空气中:变为粉红色5、白色系列Al(OH)3、Fe(OH)2:白色絮状沉淀CuSO4:白色粉末白色沉淀:BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl、Mg(OH)2、三溴苯酚、BaSO3、Ag2SO3、CaSO3H2SiO3、H4SiO4:白色胶状沉淀6、蓝色系列Cu2+:蓝色溶液CuSO4•5H2O:蓝色晶体Cu(OH)2:蓝色沉淀7、灰色物质灰色:Se、As、单质及Fe3C浅灰色:焦炭深灰色:石墨8、紫色物质紫色:Rb的焰色,KMnO4溶液,pH在5—8时的石蕊溶液,苯酚溶液中滴加FeCl3溶液浅紫色:K的焰色,(透过钴玻璃看)紫蓝色:氩气灯光酚类物质遇Fe3+:紫色9、其它溴水:橙色溶液甲基橙变色范围(3.4.4):红橙黄酚酞变色范围(8~10):无粉红石蕊变色范围((5~8)):红紫蓝Cu在Cl2中燃烧时产生的烟、固体FeCl3:棕色溴苯中溶解了溴:褐色煤焦油:黑褐色。
高中化学物质颜色总结

高中化学物质颜色总结1、红色世界1基态:Fe2O3红褐色、FeOH3红棕色、FeSCN2+血红色、Cu紫红色、Cu2O砖红色、NO2红棕色、P红磷、暗红色、Br2深红棕色、红色石蕊试纸、品红溶液;2激发态:充氦气的灯光呈粉红色,充氖气的灯光呈红色,钙元素的焰色呈砖红色;3化学变化:①紫色石蕊在酸性溶液pH<中变红,②润湿的蓝色石蕊试纸遇酸性CO2、SO2、H2S、HCl变红,③酚酞在碱性溶液中呈浅红色<pH<或红色pH>10,④甲基橙在酸性溶液pH<中呈红色,⑤甲基红在酸性溶液pH<中呈红色,⑥pH试纸黄色遇酸性溶液pH<2变红,⑦已经被二氧化硫褪色的品红溶液在加热时会出现红色,⑧CNaHSO4>L时遇甲基橙变红;2、橙色世界1基态:浓溴水、甲基橙试剂、Br2CCl4呈橙红色;2化学变化:甲基橙在酸性溶液<pH<中呈橙色,甲基红在酸性溶液<pH<中呈橙色;3、黄色世界1基态:工业盐酸含有Fe3+、Au、S8、N2激发态:钠元素焰色呈黄色3化学变化:①甲基橙在pH>溶液中呈黄色,②久置的浓硝酸因溶有自身分解产生的二氧化氮而变黄4、绿色世界A1基态:F2浅黄绿色、Cl2黄绿色、Cu2OH2CO3绿色CuCl2浓溶液呈绿色、FeSO4浅绿色2激发态:铜元素的焰色呈绿色3化学变化:FeOH2白色——灰绿色——FeOH3红棕色5、青色世界1基态:铁粉、银粉及大多数金属粉末、石墨、CuO、CuS、Cu2SFeO、Fe3O4、MnO22化学变化:①蔗糖遇浓硫酸被炭化变黑,②润湿的白色醋酸铅试纸遇H2S变黑,③硫磺粉与白色的水银反应生成黑红色的HgS,④H2S通入PbNO32、AgNO3、CuSO4溶液产生不溶于水也不溶于稀盐酸和稀硫酸的黑色沉淀;6、蓝色世界1基态:CuSO4溶液、CuSO45H2O晶体、液氧、臭氧a2O2淡黄色、AgBr淡黄色、AgI、Ag3PO42化学变化:①紫色石蕊在碱性溶液pH>8中变蓝,②润湿的红色石蕊试纸遇碱性气体变蓝,③无水CuSO4白色粉末遇水变蓝,④H2、H2S、CH4、C2H5OH燃烧火焰呈淡兰色,CO燃烧火焰呈蓝色,⑤S8在空气中燃烧呈淡蓝色火焰,在纯氧中燃烧呈现明亮的蓝紫色火焰,⑥淀粉遇I2aq变蓝,⑦Cl2、Br2、NO2、O3遇湿润的淀粉碘化钾试纸变蓝7、紫色世界ioqasdla吧SL;JD1基态:KMnO4H+、紫色石蕊、碘单质呈紫黑色2激发态:充氩气的灯光呈紫蓝色,钾元素的焰色呈紫色透过蓝色钴玻璃观察3化学变化:①I2升华生紫烟,②NH4I受热生紫烟,③紫色石蕊在<pH<溶液中呈紫色,④锌粉与碘的混合物中滴入水会生紫烟反应放热使碘升华8、白色世界1基态:Pb蓝白色、Hg、铝粉、大多数块状金属、PbSO4、BaSO4、AgCl、BaCO3、Ba3PO42、BaSO3、CaCO3、FeOH2不稳定、MgOH2、AlOH3、ZnS2化学变化:①H2在Cl2中燃烧呈现苍白色火焰,②NH3遇HCl产生白烟,③Mg、Al在氧气中燃烧发出耀眼的白光④红磷在氯气中燃烧时产生白色烟雾,⑤红磷在氧气中燃烧时产生白烟;高中化学元素知识点1金属及其化合物一、金属的通性1.金属的物理性质:有金属光泽、有延展性、导电、导热;但不同金属在密度、硬度、熔沸点等方面差别较大;这也是金属单质的一大特点;2.金属的化学性质:还原性,可表示为M–ne-→M n+,金属的还原性主要表现在金属能与非金属、水、酸、某些盐发生反应;4Na+O2==2Na2O2Na+O2Na2O22Na+Cl2==2NaCl二、知识点归纳一钠的化合物⑴钠的重要化合物⑵氧化钠和过氧化钠的比较氧化钠Na2O 过氧化钠Na2O2化合价氧的化合价为-2价氧的化合价为-1价类别碱性氧化物过氧化物,不是碱性氧化物颜色白色固体淡黄色固体与H2O反应Na2O+H2O==2NaOH2Na2O2+2H2O==4NaOH+O2↑与CO2反应Na2O+CO2==Na2CO3Na2O2+2CO2==2Na2CO3+O2与酸反应Na2O+2HCl==2NaCl+H2O2Na2O2+4HCl==4NaCl+2H2O+O2↑漂白作用无有用途制NaOH作生氧剂,氧化剂保存密封密封转化Na2O→Na2O2NaHCO3:俗名小苏打,不稳定,加热易分解,在水中溶解度小于Na2CO3,饱和Na2CO3溶液中通入CO2可见沉淀析出Na2CO3:俗名苏打,纯碱,稳定,加热难分解,晶体Na2CO310H2O易风化NaCl食盐:存在于海水中盐类NaOH:白色固体,易潮解,俗名苛性钠,烧碱碱2Na2O2+2H2O==4NaOH+O2↑漂白剂2Na2O2+2CO2==2Na2CO3+O2供氧剂Na2O2:淡黄色固体Na2O:白色固体,溶于水生成NaOH,不稳定,继续跟O2反应生成淡黄色的Na2O2氧化物钠的重要化合物⑶碳酸钠与碳酸氢钠的比较Na2CO3NaHCO3俗称纯碱、苏打小苏打溶解性易溶于水易溶于水,但溶解度比Na2CO3小状态白色固体白色晶体热稳定性加热难分解2NaHCO3Na2CO3+CO2↑+H2O 与酸反应CO32-+2H+==CO2↑+H2O H++HCO3-==CO2↑+H2O。
高中化学物质颜色及总结

高中化学物质颜色及总结高中化学物质颜色及总结 1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属 8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液 13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液 14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液 15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体二(化合价口诀一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫都齐全;汞铜二价最常见,正负价,要分清,莫忘单质价为零三(盐的溶解性:钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶。
四常见根价口诀一价铵根硝酸根;氢卤酸根氢氧根。
高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。
暂记铵根为正价;负三有个磷酸根。
五(有机化学只含C、H称为烃,结构成链或成环。
双键为烯叁键炔,单键相连便是烷。
脂肪族的排成链,芳香族的带苯环。
异构共用分子式,通式通用同系间。
烯烃加成烷取代,衍生物看官能团。
羧酸羟基连烃基,称作醇醛及羧酸。
羰基醚键和氨基,衍生物是酮醚胺。
苯带羟基称苯酚,萘是双苯相并联。
去H加O叫氧化,去O加H叫还原。
醇类氧化变酮醛,醛类氧化变羧酸。
羧酸都比碳酸强,碳酸强于石碳酸。
光照卤代在侧链,催化卤代在苯环。
高中化学常见物质的颜色和状态

1、黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O42、红色固体:Cu、Cu2O、Fe2O3、HgO、红磷3、淡黄色固体:S、 Na2O2、 AgBr4.紫黑色固体:KMnO4、5、黄色固体: AgI 、Ag3PO46、绿色固体: Cu2(OH)2CO37、蓝色晶体:CuSO4·5H2O8 、蓝色沉淀 Cu(OH)29、红褐色沉淀: Fe(OH)310、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,MnO4-溶液为紫红色,其余溶液一般无色。
12、不溶于酸的白色沉淀: BaSO4 、AgCl13、不溶于水的白色沉淀 CaCO3 (溶于酸)、BaCO3(溶于酸)、Al(OH)3、 Mg(OH)2 等14、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)(3) 红棕色气体: Br2(气体) NO2(4)黄绿色气体:Cl2(5)臭鸡蛋气味气体:H2S15、具有刺激性气味的液体:盐酸、硝酸、醋酸、酒精16、有毒的: 气体:CO SO2 H2S 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)中学常见物质颜色归纳2、单质化学式颜色化学式颜色化学式颜色Cu 紫红 Au 黄 S 黄B 黄或黑 F2 淡黄绿 C(石墨)黑Cl2 黄 Br2 红棕 C(金刚石)无Si 灰黑 I2紫黑 P 白、黄、红棕3、氧化物化学式颜色化学式颜色化学式颜色NO2 棕红 ClO2 黄 Na2O2 浅黄K2O 黄 Pb3O4 红 MnO 绿化学式颜色化学式颜色化学式颜色CuO 黑 MnO2 黑 Ag2O 棕黑FeO 黑 ZnO 白 Fe3O4 黑Hg2O 黑 Fe2O3 红棕 HgO 红或黄Cu2O 红4、氧化物的水化物化学式颜色化学式颜色化学式颜色Fe(OH)3 红褐 HNO2 亮蓝 Cu(OH)2 蓝5、盐化学式颜色化学式颜色化学式颜色CuFeS2 黄 ZnS 白 Ag2S 黑FeS 黑棕 FeS2 黄 Sb2S3 黑或橙红HgS 红 PbS 黑 CuS 黑Cu2S 黑FeCl3·6H2O 棕黄 FeSO4 9H20 蓝绿Fe2(SO4) 棕黄 Fe3C 灰 FeCO3 灰Ag2CO3 黄 Ag3PO4 黄 CuCl2 棕黄AgF 黄 CuCl2 7H2O 蓝绿 AgCl 白CuSO4 白 AgBr 浅黄 CuSO4 5H2O 蓝AgI 黄 Cu2(OH2)CO3 暗绿6、盐溶液中离子特色:化学式颜色化学式颜色化学式颜色Cu2+ 蓝 MnO4-紫红 [CuCl4]2- 黄Cr2O72- 橙红 Fe2+ 浅绿 Fe3+ 棕黄7、非金属互化物物质颜色物质颜色物质颜色氯水黄绿溴水黄-橙碘水黄褐溴的有机溶液橙红-红棕 I2的有机溶液紫红8、其它:蛋白质遇浓变黄、遇淀粉变蓝、 TNT 淡黄、遇酚酞溶液变紫黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄--橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加硝酸。
中学化学中常见物质颜色归纳

中学化学中常见物质颜色归纳一、无色物质纯净水,各种常见的稀酸、稀碱溶液,O2,还应特殊掌握SO3是无色固体等。
二、白色物质1、纯白色:MgO、CaO、P2O5、AgCl、NaOH固体、NaCl粉末等。
2、银白色:Li、Na、K、Rb、Mg、Al、 Hg、Te等。
3、光亮的银白色:纯铁、银镜。
4、苍白色:H2在Cl2中燃烧时的焰色。
5、白烟:氨气分别与氯化氢、溴化氢气体化合生成的微小的氯化铵晶体。
6、白雾:氯化氢、溴化氢气体遇到水蒸气。
7、耀眼的白光:Mg、Al在O2中燃烧时。
三、红色物质1、红色pH在0—3.1时甲基橙溶液;pH在10—14时酚酞溶液;pH在0—5时的石蕊溶液;Cu2O(氧化亚铜),氖气灯光。
2、浅红色:pH在8—10时酚酞溶液。
3、粉红色:氦气灯光。
小部分在空气中氧化后的苯酚。
4、深棕红色:液溴。
5、红棕色:NO2气体,红磷单质,Fe2O3粉末,溴水,Fe(OH)3及胶体。
6、紫红色:锂的焰色。
7、洋红色:Sr的焰色。
8、砖红色:Ca的焰色。
四、黑色物质1、黑色:Fe3O4、 FeO、 FeS、CuS、Cu2S 、Ag2S 、Ag2O、 Ag 的细小颗粒、CuO (氧化铜)、MnO2、活性炭等。
2、紫黑色:单质I2。
3、灰黑色:木炭。
五、灰色物质1、灰色:Se、As、单质及Fe3C等。
2、浅灰色:焦炭。
3、深灰色:石墨。
六、绿色物质1、绿色:Cu的焰色,CuCl2的浓溶液,碱式碳酸铜Cu2(OH)2CO3等。
2、浅绿色:FeSO4溶液等。
3、黄绿色:Cl2单质,Ba的焰色;氯水(淡黄绿色)。
七、紫色物质1、紫色:Rb的焰色,KMnO4溶液,pH在5—8时的石蕊溶液,苯酚溶液中滴加FeCl3溶液等。
2、浅紫色:K的焰色,(透过钴玻璃看)水合Fe3+等。
3、紫蓝色:氩气灯光。
八、黄色物质1、黄色:Na的焰色,Ag3PO4,AgI,FeS2、溴水(黄色→橙色)、pH在4.4—14时的甲基橙溶液、某些蛋白质遇浓硝酸等。
高中化学有颜色的物质

高中化学有颜色的物质
①黑色:CuO、Fe3O4、MnO2、炭粉、铁屑
②白色:AgCl、BaSO4、CaCO3、BaCO3、无水CuSO4、NaOH、Mg(OH)2、KClO3、KCl等。
③红色:Cu、HgO、Fe2O3(红棕)、Fe(OH)3(红褐)。
④蓝色:Cu(OH)2、含Cu2+的盐溶液、
CuSO4·5H2O。
⑤紫黑色:KMnO4。
⑥银白色:一般为金属,如Mg、Al、Hg。
⑦淡黄色:硫粉。
⑧含Fe3+的盐溶液呈棕黄色,含Fe2+的盐溶液呈浅绿色。
1.红色:
Fe(SCN)]2+(血红色); Cu2O(砖红色); Fe2O3(红棕色); 红磷(红棕色);液溴(深红棕色); Fe(OH)3(红褐色); I2的CCl4溶液(紫红色); MnO4-(紫红色); Cu(紫红色); 在空气中久置的苯酚(粉红色).
2.橙色:
溴水; K2Cr2O7溶液.
3.黄色:
AgI(黄色); AgBr(浅黄色); K2CrO4(黄色); Na2O2(淡黄色); S(黄色); FeS2(黄色); 久置浓HNO3(溶有NO2); 工业浓盐酸(含Fe3+); Fe3+水溶液(黄色); 久置的KI溶液(被氧化成I2)
4.绿色:。
高中化学物质颜色总结

(一)红色:Fe(SCN3(红色;Cu 2O(砖红色;Fe 2O 3(红棕色;红磷(红棕色);液溴(深红棕色);Fe(OH3(红褐色;Cu (紫红色);溴蒸气、NO 2(红棕色);品红溶液(红色);在空气中久置的苯酚(粉红);石蕊在酸性溶液中(红色);酚酞在碱性溶液中(红色)。
(二)棕色;FeCl 3固体(棕黄色;CuCl 2固体(棕色)。
(三)紫色:石蕊在中性溶液中(紫色);Fe 3+与苯酚反应产物(紫色);I 2(紫黑色;KMnO 4固体(紫黑色);MnO 4(紫红色;固态O 3(紫黑色);钾的焰色反应(紫色);I 2蒸气、I 2在非极性溶剂中(紫色)。
(四)蓝色:Cu(OH2、CuSO 4·5H 2O 、Cu 2+在水溶液中(蓝色);石蕊在碱性溶液中(蓝色);硫、氢气、甲烷、乙醇在空气中燃烧(火焰淡蓝色);一氧化碳在空气中燃烧(蓝色火焰);淀粉遇I 2变蓝色;Co 2O 3(蓝色;O 2(液态——淡蓝色);*Cu(OH2溶于多羟基化合物(如甘油、葡萄糖等)对水溶液中(绛蓝色);O 3(气态——淡蓝色;液态——深蓝色;固体——紫黑色)。
(五)橙色:溴水;黄色:Agl (黄色);AgBr(淡黄色;Ag 3PO 4(黄色;Na 2O 2(淡黄色;S (黄色);FeS 2(黄色;工业浓盐酸(黄色)(含有Fe 3+);FeCl 3固体(棕黄色);Fe 3+的水溶液(黄色);硝基苯(黄色)(溶有NO 2);Na 的焰色反应(黄色);TNT (淡黄色针状);I 2的水溶液(黄色);久置的KI 溶液(黄色)(被氧化为I 2);碘酒(黄褐色);久置的浓硝酸(黄色)(溶有分解生成的NO 2);浓硝酸粘到皮肤上(天然蛋白质)(显黄色)(六)黑色:FeO ;Fe 3O 4;FeS ;CuO ;CuS ;Cu 2S ;MnO 2;C 粉;Ag2S ;Ag 2O ;PbS 。
AgCl ,AgBr ,Agl ,AgNO 3光照分解变黑。
高中化学常见物质颜色

高中化学“颜色”1、黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O42、红色固体:Cu、Cu2O、Fe2O3 、HgO、红磷3、淡黄色固体:S、Na2O2、AgBr4.紫黑色固体:KMnO4、I25、黄色固体:AgI 、Ag3PO46、绿色固体: Cu2(OH)2CO37、蓝色晶体:CuSO4·5H2O8 、蓝色沉淀Cu(OH)29、红褐色沉淀:Fe(OH)310、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,MnO4-溶液为紫红色,其余溶液一般无色。
12、不溶于酸的白色沉淀:BaSO4 、AgCl13、不溶于水的白色沉淀CaCO3 (溶于酸)、BaCO3(溶于酸)、Al(OH)3、Mg(OH)2 等14、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)( 3 ) 红棕色气体:Br2(气体)NO2( 4 )黄绿色气体:Cl2(5)臭鸡蛋气味气体:H2S15、具有刺激性气味的液体:盐酸、硝酸、醋酸、酒精16、有毒的: 气体:CO SO2 H2S 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄--橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加硝酸。
淡黄色:S、Na2O2、TNT、PCl5、AgBr、浓HNO3(混有NO2)、浓HCl(混有Fe3+)、硝基苯(溶有NO2)。
灰黄色:Mg3N2棕黄色:FeCL3溶液、碘水(深黄--褐)黑色:CuS、Ag2S、Cu2S、PbS、HgS(黑色或红色)、FeS、FeO、Fe3O4、MnO2、CuO、Ag2O、I2(紫黑)、Si(灰黑)、C、Ag、KMnO4(紫黑)、石油绿色:CuCl2溶液、Cu2(OH)2CO3、FeSO4/7H2O(浅绿)、F2(浅黄绿)、Cl2(黄绿)、氯水(浅黄绿)红色:CuO、Cu、Fe(SCN)2+、甲基橙在酸性环境中、紫色石蕊试液在酸性环境中、酚酞在碱性环境中、品红试液、红磷(暗红)、Br2(深红棕)、Br2在CCl4溶液中(紫红)、苯酚被空气氧化(粉红)棕色:固体FeCl3、固体CuCl2、NO2(红棕)、Fe2O3(红棕)紫色:KMnO4溶液、I2在CCl4溶液中灰色:As、Sn、Fe3C褐色:碘酒、2Fe2O3/3H2O、Fe(OH)3(红褐)蓝色:CuSO4/5H2O、Cu(OH)2、淀粉遇碘、紫色石蕊试液在碱性环境中,Cu2+的稀溶液有色反应产生的沉淀有颜色红褐色絮状沉淀:Fe(OH)3浅绿色沉淀:Fe(OH)2蓝色絮状沉淀:Cu(OH)2白色沉淀:CaCO3,BaCO3,AgCl,BaSO4,(其中BaSO4、AgCl是不溶于HNO3的白色沉淀,CaCO3 BaCO3是溶于HNO3的白色沉淀),Mg(OH)2.淡黄色沉淀(水溶液中)----S微溶于水------------Ca(OH)2,CaSO4,生成的溶液或气体有颜色1、水溶液中含有Fe3+的为黄色. 如:Fe2(SO4)3、FeCl3 、Fe(NO3)3溶液2、水溶液中含有Cu2+为蓝色,如:CuCl2、Cu(NO3)2、CuSO4溶液;但是,CuSO4?5H2O是蓝色,无水CuSO4是白色3、红棕色液体:Br24、红棕色的气体:NO2;SO2,无色有刺激性的气体;H2S,有臭鸡蛋气味的气体物质名称化学式颜色和状态金属镁 Mg 银白色固体铜粉 Cu 红色固体粉末铁粉 Fe 黑色固体粉末硫磺 S 淡黄色粉末木炭 C 黑色固体氯气 Cl2 黄绿色气体氧化铜 CuO 黑色粉末氧化铁 Fe2O3 红色粉末四氧化三铁 Fe3O4 黑色固体二氧化锰 MnO2 黑色粉末氢氧化铜 Cu(OH)2 蓝色粉末氢氧化铁 Fe(OH)3 红褐色固体氢氧化镁 Mg(OH)2 白色固体无水硫酸铜 CuSO4 白色粉末胆矾CuSo4·5H2O蓝色固体硫酸铜溶液 CuSO4 蓝色溶液碱式碳酸铜 Cu2(OH)2CO3 绿色固体粉末硫酸亚铁溶液 FeSO4 淡绿色溶液高锰酸钾 KMnO4 紫色晶体氢氧化铝 Al(OH)3 白色固体沾上铜离子,就记住蓝绿色(铜溶液)铜的沉淀也是蓝色沾上亚铁离子,就记住钱绿色(亚铁溶液)氢氧化亚铁是白色沾上铁离子,就记住黄褐色(铁溶液)三价铁沉淀也是红棕色的二价铁沉淀暴露在空气中会被氧化成三价铁沉淀(例如氢氧化亚铁在空气中会被氧化成氢氧化铁,颜色有浅绿色变成灰色在变成棕黄色)黑色固体有二氧化锰,铁粉,高锰酸钾(紫黑色),四氧化三铁红色固体有氧化铁(铁锈)红褐色固体有三价铁离子沉淀淡黄色固体有硫单质(还有过氧化钠,不记得是初中还是高中学的了)蓝色固体一般就是沾着铜的,例如孔雀石,碱式碳酸铜等CU2+蓝色(稀)绿色(浓) FE3+黄色FE2+浅绿MNO4-紫色,紫红色沉淀的颜色MG(OH)2 ,AL(OH)3 ,AGCL,BASO4,BACO3,BASO3,CASO4等均为白色沉淀CU(OH)2蓝色沉淀FE(OH)3红褐色沉淀AGBR淡蓝色AGI ,AG3PO4黄色CuO 黑Cu2OFe2O3 红棕FeO 黑Fe(OH)3红褐Cu(OH)2 蓝FeS2 黄PbS 黑FeCO3 灰Ag2CO3 黄AgBr 浅黄AgCl 白Cu2(OH)2CO3 暗绿氢氧化铜(蓝色);氢氧化铁(红棕色)氯化银(白色)碳酸钡(白色)碳酸钙(白色)2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温CaO+ CO2↑ 工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4•H2O 蓝色晶体变为白色粉末CuSO4•H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成MgCl2+B a(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2 ↑MgCO3+2HCl= MgCl2+H2O+ CO2 ↑NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色。
高中化学常见物质颜色总结

高中化学常见物质的颜色铁:铁粉是黑色的;一整块的固体铁是银白色的。
Fe2+——浅绿色Fe3O4——黑色晶体Fe(OH)2——白色沉淀Fe3+——黄色Fe (OH)3——红褐色沉淀 F e(S C N)3——血红色溶液FeO——黑色的粉末Fe2O3——红棕色粉末FeS——黑色固体Fe (NH4)2(SO4)2——淡蓝绿色铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4〔无水〕—白色CuSO4·5H2O——蓝色Cu(OH)2——蓝色Cu2 (OH)2CO3 —绿色[Cu(NH3)4]SO4——深蓝色溶液白色沉淀:BaSO4 、BaCO3 、Ag2CO3 、CaCO3 、AgCl 、Mg (OH)2 、三溴苯酚Al(OH)3 白色絮状沉淀H4SiO4〔原硅酸〕白色胶状沉淀Cl2、氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体I2——紫黑色固体H F、HCl、HBr、HI 均为无色气体,在空气中均形成白雾CCl4——无色的液体,密度大于水,与水不互溶KMnO4--——紫色MnO4-——紫色Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—浅黄色沉淀AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味、有毒的气体SO3—无色固体〔沸点 44.8 0C〕N2O4、NO——无色气体NO2——红棕色气体1、单质颜色Cu 紫红Au 黄S 黄 B 黄或黑F2 淡黄绿C〔石墨〕黑Cl2 黄Br2 红棕C〔金刚石〕无Si 灰黑I2 紫黑P 白、黄、红棕2、氧化物颜色NO2 棕红ClO2 黄Na2O2 浅黄K2O 黄Pb3O4 红MnO 绿CuO 黑MnO2 黑Ag2O 棕黑FeO 黑ZnO 白Fe3O4 黑Hg2O 黑Fe2O3 红棕HgO 红或黄Cu2O 红3、盐颜色CuFeS2 黄ZnS 白Ag2S 黑FeS 黑棕FeS2 黄Sb2S3 黑或橙红HgS 红PbS 黑CuS 黑Cu2S 黑FeCl3·6H2O棕黄FeSO4 9H20 蓝绿Fe2(SO4)3 9H2O 棕黄Fe3C 灰FeCO3 灰Ag2CO3 黄Ag3PO4 黄AgF 黄AgCl 白AgI 黄CuCl2 7H2O 蓝绿CuCl2 棕黄CuSO4 白AgBr 浅黄CuSO4 5H2O 蓝Cu2(OH2)CO3 暗绿4、非金属互化物颜色氯水黄绿溴水黄-橙碘水黄褐溴的有机溶液橙红-红棕I2 的有机溶液紫红5、黑色CuS、Ag2S、Cu2S、PbS、HgS〔黑色或红色〕、FeS、FeO、Fe3O4、MnO2、CuO、Ag2O、I2〔紫黑〕、Si〔灰黑〕、C、Ag、KMnO4〔紫黑〕、石油6、绿色CuCl2 溶液、Cu2〔OH〕2CO3、FeSO4/7H2O〔浅绿〕、F2〔浅黄绿〕、Cl2〔黄绿〕、氯水〔浅黄绿〕7、红色CuO、Cu、Fe〔SCN〕2+、甲基橙在酸性环境中、紫色石蕊试液在酸性环境中、酚酞在碱性环境中、品红试液、红磷〔暗红〕、Br2〔深红棕〕、Br2 在 CCl4 溶液中〔紫红〕、苯酚被空气氧化〔粉红〕8、棕色固体 FeCl3、固体 CuCl2、NO2〔红棕〕、Fe2O3〔红棕〕9、紫色KMnO4 溶液、I2 在 CCl4 溶液中10、褐色碘酒、2Fe2O3/3H2O、Fe〔OH〕3〔红褐〕11、蓝色CuSO4/5H2O、Cu〔OH〕2、淀粉遇碘、紫色石蕊试液在碱性环境中,Cu2+的稀溶液12 、有色反响产生的沉淀有颜色红褐色絮状沉淀:Fe(OH)3 浅绿色沉淀:Fe(OH)2蓝色絮状沉淀:Cu(OH)2白色沉淀:CaCO3,BaCO3,AgCl,BaSO4,(其中 BaSO4、AgCl 是不溶于 HNO3 的白色沉淀,CaCO3BaCO3 是溶于HNO3 的白色沉淀),Mg(OH)2. 淡黄色沉淀(水溶液中)----S微溶于水------------Ca(OH)2,CaSO4,生成的溶液或气体有颜色1、水溶液中含有 Fe3+的为黄色. 如:Fe2(SO4)3、FeCl3 、Fe(NO3)3 溶液2、水溶液中含有 Cu2+为蓝色,如:CuCl2、Cu(NO3)2、CuSO4 溶液;但是,CuSO4?5H2O 是蓝色,无水 CuSO4 是白色3、红棕色液体:Br24、红棕色的气体:NO2;。
高中化学颜色大全

高中化学颜色大全1、黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O42、红色固体:Cu、Cu2O、Fe2O3 、HgO、红磷3、淡黄色固体:S、Na2O2、AgBr4、紫黑色固体:KMnO4、5、黄色固体:AgI 、Ag3PO46、绿色固体:Cu2(OH)2CO37、蓝色晶体:CuSO4•5H2O8、蓝色沉淀Cu(OH)29、红褐色沉淀: Fe(OH)310、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,MnO4—溶液为紫红色,其余溶液一般无色。
12、不溶于酸的白色沉淀:BaSO4 、AgCl13、不溶于水的白色沉淀CaCO3 (溶于酸)、BaCO3(溶于酸)、Al(OH)3、Mg(OH)2 等14、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)(3)红棕色气体:Br2(气体) NO2(4)黄绿色气体:Cl2(5)臭鸡蛋气味气体:H2S15、具有刺激性气味的液体:盐酸、硝酸、醋酸、酒精16、有毒的:气体:CO SO2 H2S 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)化学式颜色化学式颜色化学式颜色Cu 紫红Au 黄S 黄B 黄或黑F2 淡黄绿C(石墨) 黑Cl2 黄Br2 红棕C(金刚石) 无Si 灰黑I2 紫黑P 白、黄、红棕化学式颜色化学式颜色化学式颜色NO2 棕红ClO2 黄Na2O2 浅黄K2O 黄Pb3O4 红MnO 绿化学式颜色化学式颜色化学式颜色CuO 黑MnO2 黑Ag2O 棕黑FeO 黑ZnO 白Fe3O4 黑Hg2O 黑Fe2O3 红棕HgO 红或黄Cu2O 红化学式颜色化学式颜色化学式颜色Fe(OH)3 红褐HNO2 亮蓝Cu(OH)2 蓝化学式颜色化学式颜色化学式颜色CuFeS2 黄ZnS 白Ag2S 黑FeS 黑棕FeS2 黄Sb2S3 黑或橙红HgS 红PbS 黑CuS 黑Cu2S 黑FeCl3•6H2O 棕黄FeSO4 9H20 蓝绿Fe2(SO4)3.9H2O 棕黄Fe3C 灰FeCO3 灰Ag2CO3 黄Ag3PO4 黄CuCl2 棕黄AgF 黄CuCl2 7H2O 蓝绿AgCl 白CuSO4 白AgBr 浅黄CuSO4 5H2O 蓝AgI 黄Cu2(OH2)CO3 暗绿六、盐溶液中离子特色:化学式颜色化学式颜色化学式颜色Cu2+ 蓝MnO4—紫红[CuCl4]2- 黄Cr2O72—橙红Fe2+ 浅绿Fe3+ 棕黄物质颜色物质颜色物质颜色氯水黄绿溴水黄—橙碘水黄褐溴的有机溶液橙红—红棕I2的有机溶液紫红其它:蛋白质遇浓变黄、遇淀粉变蓝、TNT 淡黄、遇酚酞溶液变紫黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄-—橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加硝酸.淡黄色:S、Na2O2、TNT、PCl5、AgBr、浓HNO3(混有NO2)、浓HCl (混有Fe3+)、硝基苯(溶有NO2).灰黄色:Mg3N2棕黄色:FeCl3溶液、碘水(深黄--褐)黑色:CuS、Ag2S、Cu2S、PbS、HgS(黑色或红色)、FeS、FeO、Fe3O4、MnO2、CuO、Ag2O、I2(紫黑)、Si(灰黑)、C、Ag、KMnO4(紫黑)、石油绿色:CuCl2溶液、Cu2(OH)2CO3、FeSO4.7H2O(浅绿)、F2(浅黄绿)、Cl2(黄绿)、氯水(浅黄绿)红色:CuO、Cu、Fe(SCN)2+、甲基橙在酸性环境中、紫色石蕊试液在酸性环境中、酚酞在碱性环境中、品红试液、红磷(暗红)、Br2(深红棕)、Br2在CCl4溶液中(紫红)、苯酚被空气氧化(粉红)棕色:固体FeCl3、固体CuCl2、NO2(红棕)、Fe2O3(红棕)紫色:KMnO4溶液、I2在CCl4溶液中灰色:As、Sn、Fe3C褐色:碘酒、2Fe2O3.3H2O、Fe(OH)3(红褐)蓝色:CuSO4.5H2O、Cu(OH)2、淀粉遇碘、紫色石蕊试液在碱性环境中,Cu2+的稀溶液常见的焰色反应含钠元素Na 黄含锂元素Li 紫红含钾元素K 浅紫焰色反应(透过蓝色钴玻璃观察,因为钾里面常混有钠,黄色掩盖了浅紫色)含铷元素Rb 紫含钙元素Ca 砖红色含锶元素Sr 洋红含铜元素Cu 绿含钡元素Ba 黄绿含钴元素Co 淡蓝。
高中化学常见化学颜色
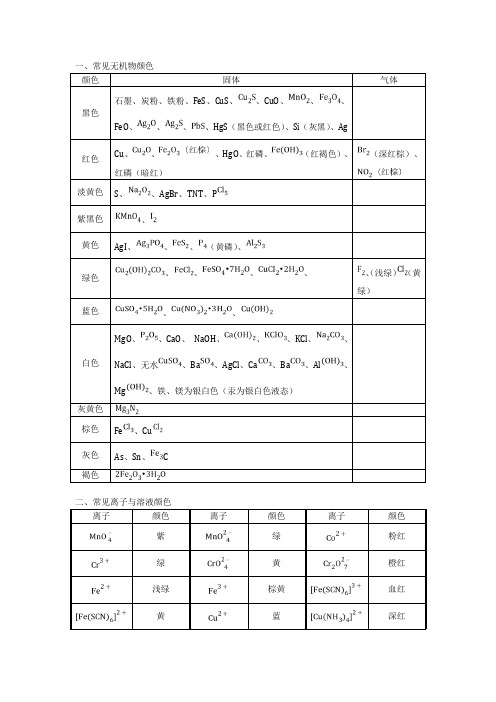
一、常见无机物颜色
颜色固体气体
黑色
石墨、炭粉、铁粉、FeS、CuS、、CuO、、、
FeO、、、、HgS(黑色或红色)、Si(灰黑)、Ag
红色
Cu、、、HgO、红磷、(红褐色)、
红磷(暗红)
(深红棕)、淡黄色S、、AgBr、TNT、P
紫黑色、
黄色AgI、、、(黄磷)、
绿色
、、、、、(浅绿)(黄
绿)
蓝色、、
白色MgO、、CaO、NaOH、、、KCl、、NaCl、无水、Ba、AgCl、Ca、Ba、Al、Mg、铁、镁为银白色(汞为银白色液态)
灰黄色
棕色Fe、Cu
灰色As、Sn、 C
褐色
二、常见离子与溶液颜色
离子颜色离子颜色离子颜色紫绿粉红
绿黄橙红
浅绿棕黄血红
黄蓝深红
黄
其它溶液:
黄色溴水(黄--橙)、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加硝酸淡黄色浓HN(混有N)、浓HCl(混有)、硝基苯(溶有N)
棕黄色碘水(深黄--褐)
浅黄绿氯水
红色甲基橙在酸性环境中、紫色石蕊试液在酸性环境中、酚酞在碱性环境中、品红试液、Br2在CCl4溶液中(紫红)、苯酚被空气氧化(粉红)
紫色在C溶液中
蓝色淀粉遇碘、紫色石蕊试液在碱性环境中
含钾元素K 浅紫(透过蓝色钴玻璃观察,因为钾里面常混有钠,黄色掩盖了浅紫色)含钠元素Na 黄含锂元素Li 紫红含铷元素Rb 紫
含钙元素Ca 砖红色含锶元素Sr 洋红含铜元素Cu 绿
含钡元素Ba 黄绿含钴元素Co 淡蓝。
高中化学常见物质的颜色总结

高中化学常见物质的颜色总结化学常见物质颜色有很多,为了方便同学们学习高中化学,掌握更多高中化学颜色反应,小编整理的高中化学常见物质的颜色总结,供大家学习参考!高中化学常见物质的颜色总结:1.棕色:FeCl3固体(棕黄色);CuCl2固体(棕色)2.蓝色:Cu(OH)2、CuSO4·5H2O、Cu2+在水溶液中(蓝色);石蕊遇碱性溶液(蓝色);硫、氢气、甲烷、乙醇在空气中燃烧(淡蓝色火焰);一氧化碳在空气中燃烧(蓝色火焰);淀粉遇I2变蓝色;Co2O3(蓝色);O2(液态--淡蓝色);Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色);O3(气态--淡蓝色;液态--深蓝色;固态--紫黑色)。
3.黑色:FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2OPbS;AgCl、AgBr、AgI、AgNO3光照分解均变黑;绝大多数金属在粉末状态时呈黑色或灰黑色。
4.白色:常见白色固体物质如下(呈白色或无色的固体、晶体很多):AgCl;Ag2CO3;Ag2SO4;Ag2SO3;BaSO4;BaSO3;BaCO3;Ba3(PO4)2;BaHPO4;Ca O;Ca(OH)2;CaCO3;MgO;Mg(OH);MgCO3;Fe(OH)2;AgOH;PCl5;SO3;三溴苯酚CuSO4铵盐(白色固体或无色晶体);Fe(OH)2沉淀在空气中的现象:白色→(迅速)灰绿色→(最终)红褐色pH试纸:干燥时呈黄色;中性时呈淡绿色;酸性时呈红色,酸性越强,红色越深;碱性时呈蓝色,碱性越强,蓝色越深。
红色石蕊试纸:红色(用于检验碱性物质)蓝色石蕊试纸:蓝色(用于检验酸性物质)淀粉试纸:白色(用于检验碘单质)KI-淀粉试纸:白色(用于检验氧化性物质)石蕊:pH8时呈蓝色。
酚酞:pH10时呈红色。
甲基橙:pH4.4时呈黄色。
甲基红:pH6.2。
高中化学常见物质颜色总结

高中化学常见物质颜色总结红色:Fe2O3红棕色;Fe(OH)3红褐色;[Fe(SCN)]2+ 红色(或血红色) ;Cu2O 红色(或砖红色) ;被氧化的苯酚(即苯醌) 粉红色;石蕊在pH<5的溶液中呈红色;酚酞在pH 8~10的溶液中呈浅红色;NO2 红棕色;红磷暗红色;Br2深棕红色;品红溶液红色;Bi微红色;充氦气、氖气的灯管红色;CoCl2·6H2O红色;Cu 紫红色;*甲基橙在pH<3.3的溶液中显红色。
紫色:MnO4—紫红色;I2紫黑色;I2蒸汽紫色;I2的CCl4溶液紫红色;碘溶于苯或汽油呈紫色或紫红色;石蕊在pH 5~8的溶液中呈紫色。
灰色:硒;Fe(OH)2变成Fe(OH)3的中间产物灰绿色。
棕色:CuCl2晶体棕黄色;FeCl3晶体棕红色黄色:S、AgI、Ag3PO4、Fe3+、不纯硝基苯黄色;Na2O2、三硝基甲苯、AgBr、F2、硝化甘油、NaNO2黄色;尿素白色或淡黄色;*甲基橙在pH>4.4的溶液中呈黄色。
蓝色:Cu2+、Cu(OH)2、CuSO4·5H2O、Co2O3蓝色;石蕊在pH>8的溶液中呈蓝色;I2遇淀粉变蓝色;液态、固态的氧气淡蓝色;CoCl2天蓝色。
黑色:木炭、焦炭、黑色火药、MnO2、CuO、CuS、Cu2S、PbS、Ag2S、FeS、Fe3O4黑色;Si 灰黑色;石油黑色或深棕色;煤焦油黑褐色。
绿色:Fe2+浅绿色;Cl2淡黄绿色;CuCl2浓溶液绿色(很浓黄绿色、稀则蓝色) ;碱式碳酸铜绿色。
褐色:Ag2O褐色;溶解了溴的溴苯褐色;碘酒褐色。
黄色:氯气,过氧化钠,单质硫蓝色:铜离子,淀粉遇碘黑色:四氧化三铁(磁性),氧化铜,碳血红色:硫氰化铁紫色:苯酚遇三氯化铁紫黑色:碘白色:硫酸钡,氯化银铁:铁粉是黑色的;一整块的固体铁是银白色的。
浅绿色Fe2+黑色晶体Fe3O4白色沉淀Fe(OH)2黄色Fe3+红褐色沉淀Fe (OH)3血红色溶液Fe (SCN)3 FeO——黑色的粉末Fe (NH4)2(SO4)2——淡蓝绿色Fe2O3——红棕色粉末FeS——黑色固体铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4(无水)—白色CuSO4•5H2O——蓝色Cu2 (OH)2CO3—绿色Cu(OH)2——蓝色[Cu(NH3)4]SO4——深蓝色溶液BaSO4 .BaCO3 .Ag2CO3 .CaCO3 .AgCl . Mg (OH)2 .三溴苯酚均是白色沉淀Al(OH)3白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀Cl2.氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体I2——紫黑色固体HF.HCl.HBr.HI均为无色气体,在空气中均形成白雾CCl4——无色的液体,密度大于水,与水不互溶KMnO4--——紫色MnO4-——紫色Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—浅黄色沉淀AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味.有毒的气体SO3—无色固体(沸点44.8 0C)品红溶液——红色氢氟酸:HF——腐蚀玻璃N2O4.NO——无色气体NO2——红棕色气体NH3——无色.有剌激性气味气体有色都有毒,有色都刺激。
高中化学常见物质颜色总结

高中化学常见物质颜色总结红色:Fe2O3红棕色;FeOH3红褐色;FeSCN2+ 红色或血红色;Cu2O 红色或砖红色;被氧化的苯酚即苯醌粉红色;石蕊在pH<5的溶液中呈红色;酚酞在pH 8~10的溶液中呈浅红色;NO2 红棕色;红磷暗红色;Br2深棕红色;品红溶液红色;Bi微红色;充氦气、氖气的灯管红色;CoCl2·6H2O红色;Cu 紫红色;甲基橙在pH<3.3的溶液中显红色;紫色:MnO4—紫红色;I2紫黑色;I2蒸汽紫色;I2的CCl4溶液紫红色;碘溶于苯或汽油呈紫色或紫红色;石蕊在pH 5~8的溶液中呈紫色;灰色:硒;FeOH2变成FeOH3的中间产物灰绿色;棕色:CuCl2晶体棕黄色;FeCl3晶体棕红色黄色:S、AgI、Ag3PO4、Fe3+、不纯硝基苯黄色;Na2O2、三硝基甲苯、AgBr、F2、硝化甘油、NaNO2黄色;尿素白色或淡黄色;甲基橙在pH>4.4的溶液中呈黄色;蓝色:Cu2+、CuOH2、CuSO4·5H2O、Co2O3蓝色;石蕊在pH>8的溶液中呈蓝色;I2遇淀粉变蓝色;液态、固态的氧气淡蓝色;CoCl2天蓝色;黑色:木炭、焦炭、黑色火药、MnO2、CuO、CuS、Cu2S、PbS、Ag2S、FeS、Fe3O4黑色;Si 灰黑色;石油黑色或深棕色;煤焦油黑褐色;绿色:Fe2+浅绿色;Cl2淡黄绿色;CuCl2浓溶液绿色很浓黄绿色、稀则蓝色;碱式碳酸铜绿色;褐色:Ag2O褐色;溶解了溴的溴苯褐色;碘酒褐色;黄色:氯气,过氧化钠,单质硫蓝色:铜离子,淀粉遇碘黑色:四氧化三铁磁性,氧化铜,碳血红色:硫氰化铁紫色:苯酚遇三氯化铁紫黑色:碘白色:硫酸钡,氯化银铁:铁粉是黑色的;一整块的固体铁是银白色的;浅绿色Fe2+黑色晶体Fe3O4白色沉淀FeOH2黄色Fe3+红褐色沉淀Fe OH3血红色溶液Fe SCN3 FeO——黑色的粉末Fe NH42SO42——淡蓝绿色Fe2O3——红棕色粉末FeS——黑色固体铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4无水—白色CuSO4•5H2O——蓝色Cu2 OH2CO3—绿色CuOH2——蓝色CuNH34SO4——深蓝色溶液BaSO4 .BaCO3 .Ag2CO3 .CaCO3 .AgCl . Mg OH2 .三溴苯酚均是白色沉淀AlOH3白色絮状沉淀H4SiO4原硅酸白色胶状沉淀Cl2.氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体I2——紫黑色固体HF.HCl.HBr.HI均为无色气体,在空气中均形成白雾CCl4——无色的液体,密度大于水,与水不互溶KMnO4--——紫色MnO4-——紫色Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—浅黄色沉淀AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味.有毒的气体SO3—无色固体沸点44.8 0C 品红溶液——红色氢氟酸:HF——腐蚀玻璃N2O4.NO——无色气体NO2——红棕色气体NH3——无色.有剌激性气味气体有色都有毒,有色都刺激;1、有色气体:F2淡黄绿色、Cl2黄绿色、Br2g红棕色、I2g紫红色、NO2红棕色、O3淡蓝色,其余均为无色气体;2、有刺激性气味的气体:HF、HCl、HBr、HI、NH3、SO2、NO2、F2、Cl2、Br2g;有臭鸡蛋气味的气体:H2S;3、极易溶于水能做喷泉实验的气体:NH3、HF、HCl、HBr、HI;能溶于水的气体:CO2、SO2、Cl2、Br2g、H2S、NO2;4、易液化的气体:NH3、Cl2 ;5、有毒的气体:F2、HF、Cl2、H2S、SO2、CO、NO2、NO、Br2g、HCN;6、在空气中易形成白雾的气体:NH3、HF、HCl、HBr、HI;7、常温下不能共存的气体:H2S和SO2、H2S和Cl2、HI和Cl2、NH3和HCl、NO和O2、F2和H2;8、其水溶液呈酸性的气体:HF、HCl、HBr、HI、H2S、SO2、CO2、NO2、Br2g;可使湿润的红色石蕊试纸变蓝的气体:NH3;9、有漂白作用的气体:Cl2有水时和SO2,但两者同时使用时漂白效果减弱;检验Cl2常用Cl2能使湿润的紫色石蕊试纸先变红后褪色;10、能使澄清石灰水变浑浊的气体:CO2和SO2,但通入过量气体时沉淀又消失;11、在空气中可以燃烧的气体:H2、CO、CH4、C2H4、C2H2、H2S;在空气中燃烧火焰呈蓝色或淡蓝色的气体:H2S、H2、CO、CH4;12、具有强氧化性的气体:F2、Cl2、Br2g、NO2、O2、O3;具有强或较强还原性的气体:H2S、H2、CO、NH3、HI、HBr、HCl、NO;SO2和N2既具有氧化性又具有还原性;13、与水可反应的气体:Cl2、F2、NO2、Br2g、CO2、SO2、NH3;其中Cl2、NO2、Br2g 与水的反应属于氧化还原反应而且都是歧化反应,只有F2与水剧烈反应产生O2;14、能使湿润的淀粉碘化钾试纸变蓝的气体:Cl2、NO2、Br2g、O3;15、能使溴水和酸性高锰酸钾溶液褪色的气体:H2S、SO2、C2H4、C2H2;16、可导致酸雨的主要气体:SO2;导致光化学烟雾的主要气体:NO2等氮氧化物和烃类;导致臭氧空洞的主要气体:氟氯烃俗称氟利昂和NO等氮氧化物;导致温室效应的主要气体:CO2和CH4等烃;能与血红蛋白结合导致人体缺氧的气体是:CO和NO;17、可用作致冷剂或冷冻剂的气体:CO2、NH3、N2;18、用作大棚植物气肥的气体:CO2;19、被称做地球保护伞的气体:O3;20、用做自来水消毒的气体:Cl2、氢氧化银AgOH 白色磷酸银Ag3PO4白色硫酸钙CaSO4白色碳酸银Ag2CO3淡黄色二硫化铁FeS2 黄色氢氧化镁MgOH2 白色硫酸铅PbSO4白色碱式碳酸铜CuOH2CO3暗绿色BaSO4白色,CaSO4微溶,白色,BaCO3白色,CaCO3白色,MgCO3白色,CaOH2微溶,白色,MgOH2白色,CuOH2蓝色,AgOH灰色, ZnOH2白色, FeOH3红褐,FeOH2灰白,AgCl白色CO一氧化碳、SO2二氧化硫、SO3三氧化硫、NO一氧化氮、NO2二氧化氮、H2S硫化氢HCl氯化氢NH3氨气、COCl2光气HF 氟化氢HCHO甲醛HCN氰化氢H2As砷化氢CH2=CHCl氯乙烯分类即其他有毒物质铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4无水—白色CuSO4 5H2O——蓝色Cu2OH2CO3—绿色Cu OH2——蓝色CuNH34SO4——深蓝色溶液FeS——黑色固体BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl 、Mg OH2、三溴苯酚均是白色沉淀AlOH3白色絮状沉淀H4SiO4原硅酸白色胶状沉淀Cl2、氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体I2——紫黑色固体HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾CCl4——无色的液体,密度大于水,与水不互溶Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—浅黄色沉淀AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味、有毒的气体SO3—无色固体沸点44.8度品红溶液——红色氢氟酸:HF——腐蚀玻璃N2O4、NO——无色气体NO2——红棕色气体NH3——无色、有剌激性气味气体镁,铝等均无焰色反应.碱金属及其离子均有焰色反应.如锂焰色为紫红色,钠焰色是黄色,钾焰色呈浅紫色.其它金属及其离子的常见焰色为:铜焰色为绿色,钡焰色为黄绿色,钙为砖红的焰色.而镁,铝等均无焰色反应.钠的焰色常可掩盖其它的金属离子焰色,比如钾,钠离子共同在火焰中灼烧,则只能显黄色.这时可用蓝玻璃钴玻璃放于焰前,使其滤去黄光,可清楚地看到钾的浅紫色焰色.在用铂丝蘸取金属盐做焰色反应时,铂丝要事先用酸洗净,更不得用手撸摸铂丝,以防汗液中的Na+影响焰色反应实验.铜离子:蓝三价铁离子:棕红Cu2+:浓度低是蓝色,浓度高时绿色.MNO4-:紫红Fe3+:棕黄浓,柠檬黄浅Fe2+:浅绿Cr2O72-:桔红CrO42-:黄色Cr2+:天蓝Cr3+:紫Ni2+:绿Mn2+:肉红一、有色的沉淀:FeOH2——白色沉淀在空气中变成灰绿,最后变红褐色沉淀Fe OH3——红褐色沉淀Cu OH2——蓝色沉淀FeS——黑色沉淀AgBr—浅黄色沉淀AgI—黄色沉淀MnO2黑色沉淀S单质黄色沉淀二、有色液体含Fe2+——浅绿色Fe3+——黄色Cu2+——蓝色MnO4-紫红色溴单质红棕一般是溴的CCl4溶液溴水橙色KSCN和Fe3+——血红,苯酚和Fe3+紫色。
高中化学物质颜色大全

高中化学颜色大全1、黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O42、红色固体:Cu、Cu2O、Fe2O3 、HgO、红磷3、淡黄色固体:S、 Na2O2、 AgBr4、紫黑色固体:KMnO4、5、黄色固体: AgI 、Ag3PO46、绿色固体: Cu2(OH)2CO37、蓝色晶体:CuSO4•5H2O8、蓝色沉淀 Cu(OH)29、红褐色沉淀: Fe(OH)310、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,MnO4-溶液为紫红色,其余溶液一般无色。
12、不溶于酸的白色沉淀:BaSO4 、AgCl13、不溶于水的白色沉淀 CaCO3 (溶于酸)、BaCO3(溶于酸)、Al(OH)3、 Mg(OH)2 等14、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)(3)红棕色气体: Br2(气体) NO2(4)黄绿色气体:Cl2(5)臭鸡蛋气味气体:H2S15、具有刺激性气味的液体:盐酸、硝酸、醋酸、酒精16、有毒的: 气体:CO SO2 H2S 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)化学式颜色化学式颜色化学式颜色Cu 紫红 Au 黄 S 黄B 黄或黑 F2 淡黄绿 C(石墨) 黑Cl2 黄 Br2 红棕 C(金刚石) 无Si 灰黑 I2 紫黑 P 白、黄、红棕化学式颜色化学式颜色化学式颜色NO2 棕红 ClO2 黄 Na2O2 浅黄K2O 黄 Pb3O4 红 MnO 绿化学式颜色化学式颜色化学式颜色CuO 黑 MnO2 黑 Ag2O 棕黑FeO 黑 ZnO 白 Fe3O4 黑Hg2O 黑 Fe2O3 红棕 HgO 红或黄Cu2O 红化学式颜色化学式颜色化学式颜色Fe(OH)3 红褐 HNO2 亮蓝 Cu(OH)2 蓝化学式颜色化学式颜色化学式颜色CuFeS2 黄 ZnS 白 Ag2S 黑FeS 黑棕 FeS2 黄 Sb2S3 黑或橙红HgS 红 PbS 黑 CuS 黑Cu2S 黑 FeCl3•6H2O 棕黄 FeSO4 9H20 蓝绿Fe2(SO4) 棕黄 Fe3C 灰 FeCO3 灰Ag2CO3 黄 Ag3PO4 黄 CuCl2 棕黄AgF 黄 CuCl2 7H2O 蓝绿 AgCl 白CuSO4 白 AgBr 浅黄 CuSO4 5H2O 蓝AgI 黄 Cu2(OH2)CO3 暗绿六、盐溶液中离子特色:化学式颜色化学式颜色化学式颜色Cu2+ 蓝 MnO4- 紫红 [CuCl4]2- 黄Cr2O72- 橙红 Fe2+ 浅绿 Fe3+ 棕黄物质颜色物质颜色物质颜色氯水黄绿溴水黄-橙碘水黄褐溴的有机溶液橙红-红棕 I2的有机溶液紫红其它:蛋白质遇浓变黄、遇淀粉变蓝、 TNT 淡黄、遇酚酞溶液变紫黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄--橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加硝酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
卤族(VIIA):Solid:I2 紫黑;ICl 暗红;ICl3 橙;I2O5 白;IBr 暗灰;IF3 黄色;I2O4 黄;I4O9 黄. Liquid:Br2 红棕;BrF3 浅黄绿;IBr3 棕;Cl2O6暗红;Cl2O7 无色油状;HClO4 无色粘稠状;(SCN)2 黄色油状;(SCN)n 砖红色固体.Gas:F2 浅黄;Cl2 黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2 黄色;Br2O 深棕.氧族(VIA):Solid:S 淡黄;Se 灰,褐;Te 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Sb2S3 橘红↓;SnS 褐色↓;HgS 黑(沉淀),红(朱砂);Ag2S 黑↓;CuS 黑↓;Na2S2O3 白;Na2S2O4 白;SeO2 白,易挥发;SeBr2 红;SeBr4 黄;T eO2 白加热变黄;H2TeO3 白;TeBr2 棕;TeBr4 橙;TeI4 灰黑;PoO2 低温黄(面心立方),高温红(四方);SO3 无色;SeO3 无色易潮解;TeO3 橙色;H6T eO6 无色.Liquid:H2O 无色;纯H2O2 淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4 无色油状;SO4^2-(aq) 无色;SeO2(l) 橙;TeO2(l) 深红.Gas:O2 无色;O3 低浓度无色,高浓度淡蓝;S2(g) 黄,上浅下深;H2S 无色;SO2 无色;H2Se 无色;H2T e 无色.卤化硫(未注明者均为无色):Liquid:SF6;S2F10;SCl4 淡黄;SCl2 红;S2Cl2;S2Br2 红.Gas:SF4;SF2;S2F2.卤砜、卤化亚砜、卤磺酸:Liquid:SOCl2 白色透明;SO2Cl2 无色发烟.氮族(VA):Solid:铵盐无色晶体;氮化金属白;N2O3 蓝色(低温);N2O5 白;P 白,红,黑;P2O3 白;P2O5 白;PBr3 黄;PI3 红;PCl5 无色;P4Sx 黄;P2S3 灰黄;P2S5 淡黄;H4P2O7 无色玻璃状;H3PO2 白;As 灰;As2O3 白;As2O5 白;AsI3 红;As4S4 红(雄黄);As4S6 黄(雌黄);As2S5 淡黄;Sb 银白;Sb(OH)3 白↓;Sb2O3 白(锑白,颜料);Sb2O5 淡黄;SbX3(X<>I) 白;SbI3 红;Sb2S3 黑↓;Sb2S5 橙黄;Bi 银白略显红;Bi2O3 淡黄;Bi2O5 红棕;BiF3 灰白;BiCl3 白;BiBr3 黄;BiI3 黑↓;Bi2S3 棕黑.Liquid:N2H4 无色;HN3 无色;NH2OH 无色;发烟硝酸红棕;NO3^-(l)无色;王水浅黄,氯气味;硝基苯黄色油状;氨合电子(液氨溶液) 蓝;PX3 无色;纯H3PO4 无色粘稠状;AsX3(X<>I) 无色;.Gas:N2 无色;NH3 无色;N2O 无色甜味;NO 无色;NO2 红棕;PH3 无色;P2H6 无色;AsH3 无色;SbH3 无色;BiH3 无色.卤化氮(未注明者均为无色):Solid:NBr3·(NH3)6 紫,爆炸性;NI3·(NH3)6 黑,爆炸性;Liquid:NCl3;Gas:NF3;碳族(IVA):Solid:C(金刚石) 无色透明;C(石墨) 黑色金属光泽;Si 灰黑色金属光泽;Ge 灰白;Sn 银白;Pb 暗灰;SiO2 无色透明;H2SiO3 无色透明胶状↓;Na2SiF6 白晶;GeO 黑;GeO2 白;SnO 黑;SnO2 白;Sn(OH)2 白↓;PbO黄或黄红;Pb2O3 橙;Pb3O4 红;PbO2 棕;CBr4 淡黄;CI4 淡红;GeI2 橙;GeBr2 黄;GeF4 白;GeBr4 灰白;GeI4 黄;SnF2 白;SnCl2 白;SnBr2 淡黄;SnI2 橙;SnF4 白;SnBr4 无色;SnI4 红;PbF2 无色↓;PbCl2 白↓;PbBr2 白;PbI2 金黄;PbF4 无色;GeS 红;GeS2 白;SnS 棕↓;SnS2 黄↓;PbS 黑↓;PbS2 红褐;Pb(NO3)2 无色;Pb(Ac)2·3H2O 无色晶体;PbSO4 白↓;PbCO3 白↓;Pb(OH)2 白↓;Pb3(CO3)2(OH)2 铅白↓;PbCrO4 亮黄↓.Liquid:CCl4 无色;CS2 无色;GeCl4 无色;SnCl4 无色;PbCl4 无色.Gas:CO CO2 CH4 CF4 SiF4 SiH4 均为无色.硼族(IIIA):Solid:B(无定型) 棕色粉末;B(晶体) 黑灰;Al 银白;Ga 银白(易液化);In 银灰;Tl 银灰;B2O3 玻璃状;H3BO3 无色片状;BN 白;Na2B4O7·10H2O 白色晶体;Cu(BO2)2 蓝↓;Ni(BO2)2 绿↓;NaBO2·Co(BO2)2 蓝↓;NaBO2·4H2O 无色晶体;无水NaBO2 黄晶;Al2O3 白晶;AlF3 无色;AlCl3 白;AlBr3 白;AlI3 棕;Al(OH)3 白↓;Ga2O3 白↓Ga(OH)3 白↓;GaBr3 白;GaI3 黄;In2O3 黄;InBr3 白;InI3 黄;TlOH 黄;Tl2O 黑;Tl2O3 棕黑;TlCl 白↓;TlBr 浅黄↓;TlI 黄↓;TlBr3 黄;TlI3 黑.Liquid:BCl3 无色发烟.Gas:硼烷无色;BF3 无色(有窒息气味).碱土(IIA):单质:银白焰色:Ca 砖红;Sr 洋红;Ba 绿.氧化物:均为白色固体.氢氧化物:白色固体Be(OH)2↓,Mg(OH)2↓.盐:多为无色或白色晶体;BaCrO4 黄↓;CaF2 白↓.碱金属(IA):单质:银白焰色:Li 红;Na 黄;K 紫;Rb 紫红;Cs 紫红.氧化物、过氧化物、超氧化物、臭氧化物:Li2O 白;Na2O 白;K2O 淡黄;Rb2O 亮黄;Cs2O 橙红;Na2O2 淡黄;KO2橙黄;RbO2深棕;CsO2 深黄;KO3 橘红.氢氧化物:白色.盐:多为无色或白色晶体且易溶于水.不溶盐↓(未注明者皆为白色晶体):LiF Li2CO3 Li3PO4 LiKFeIO6 Na[Sb(OH)6] NaZn(UO2)3(Ac)9·6H2O 黄绿;M=K,Rb,Cs M3[Co(NO2)6] 亮黄;MBPh4 MClO4 M2PtCl6 淡黄;CsAuCl4.铜副族(IB):单质:Cu 紫红或暗红;Ag 银白;Au 金黄.铜化合物:焰色绿;CuF 红;CuCl 白↓;CuBr黄↓;CuI 棕黄↓;CuCN 白↓;Cu2O 暗红;Cu2S 黑;CuF2 白;CuCl2 棕黄(溶液黄绿);CuBr2 棕;Cu(CN)2 棕黄;CuO 黑;CuS黑↓;CuSO4 无色;CuSO4·5H2O 蓝;Cu(OH)2 淡蓝↓;Cu(OH)2·CuCO3 墨绿;[Cu(H2O)4]2+ 蓝;[Cu(OH)4]2- 蓝紫;[Cu(NH3)4]2+ 深蓝;[CuCl4]2- 黄;[Cu(en)2]2+ 深蓝紫;炔铜红↓.银化合物:AgOH 白(常温分解);Ag2O 黑;新制AgOH 棕黄(混有Ag2O);蛋白银(AgNO3滴手上) 黑↓;AgF 白;AgCl 白↓;AgBr 淡黄↓;AgI 黄↓(胶体);Ag2S 黑↓;Ag4[Fe(CN)6] 白↓;Ag3[Fe(CN)6] 白↓;Ag+,[Ag(NH3)2]+,[Ag(S2O3)2]3-,[Ag(CN)2]- 无色.金化合物:HAuCl4·3H2O 亮黄晶体;KAuCl4·1.5H2O 无色片状晶体;Au2O3 黑;H[Au(NO3)4]·3H2O 黄色晶体;AuBr 灰黄↓;AuI 柠檬黄↓.锌副族(IIB):单质:均为银白,Hg在水溶液中的沉淀为黑色.锌化合物:ZnO 白(锌白颜料)↓;ZnI2 无色;ZnS 白↓;ZnCl2 白色晶体(溶解度极大,水溶液酸性).镉化合物:CdO 棕灰↓;CdI2 黄;CdS 黄(镉黄颜料)↓;HgCl2(升汞) 白色;HgNH2Cl 白↓;Hg2Cl2(甘汞) 白↓.汞化合物:HgO 红(大晶粒)或黄(小晶粒)↓;HgI2 红或黄(微溶);HgS 黑或红↓;Hg2NI·H2O 红↓;Hg2(NO3)2 无色晶体.ZnS荧光粉:Ag 蓝;Cu 黄绿;Mn 橙.钪副族(IIIB):略.钛副族(IVB):钛化合物:Ti3+ 紫红;VO4^3- 黄;[TiO(H2O2)2]2+ 橘黄;H2TiO3 白色↓;TiO2 白(钛白颜料)或桃红(金红石)↓;(NH4)2TiCl6 黄色晶体;[Ti(H2O)6]Cl3 紫色晶体;[Ti(H2O)5Cl]Cl2·H2O 绿色晶体;TiCl4 无色发烟液体.锆、铪:MO2,MCl4 白.钒副族(VB):钒化合物:V2+ 紫;V3+ 绿;V4+ 蓝;V5+ 黄;VO 黑;V2O3 黑;VO2 黄;V2O5 黄或砖红;水合V2O5 棕红;饱和V2O5溶液(微溶) 淡黄.钒酸根缩聚:随着V原子个数的增多,由浅黄——〉深红.铌、钽:略.铬副族(VIB):铬化合物:Cr2+ 蓝;Cr3+ 紫;Cr2O7^2- 橙红;CrO4^2- 黄;Cr(OH)3灰蓝;Cr2O3 绿;CrO3 暗红色针状;[CrO(O2)2]OEt2 蓝;CrO2Cl2 深红色液体;Na2Cr2O7,K2CrO7 橙红;Ag2CrO4 砖红↓;BaCrO4 黄↓;PbCrO4 黄↓.紫红Cr2(SO4)3·18H2O——〉绿色Cr2(SO4)3·6H2O——〉桃红Cr2(SO4)3暗绿[Cr(H2O)4Cl2]Cl—冷却HCl—〉紫色[Cr(H2O)6]Cl3—乙醚HCl—〉淡绿[Cr(H2O)5Cl]Cl2[Cr(H2O)6]3+ 紫;[Cr(H2O)4(NH3)2]3+ 紫红;[Cr(H2O)3(NH3)3]3+ 浅红;[Cr(H2O)2(NH3)4]3+ 橙红;[Cr (NH3)5H2O]3+ 橙黄;[Cr(NH3)6]3+ 黄.钼、钨:MoO3 白;棕色MoCl3;绿色MoCl5;MoS3 棕色↓;(NH4)3[P(Mo12O40)]·6H2O 黄色晶状↓;WO3 深黄;H2WO4·xH2O 白色胶体.锰副族(VIIB):锰化合物:Mn2+ 肉红;Mn3+ 紫红;MnO4^2- 绿;MnO4^- 紫;MnO3^+ 亮绿;Mn(OH)2 白↓;MnO(OH)2 棕↓;MnO2 黑↓;无水锰盐(MnSO4) 白色晶体;六水合锰盐(MnX2·6H2O, X=卤素,NO3,ClO4) 粉红;MnS·nH2O 肉红↓;无水MnS 深绿;MnCO3 白↓;Mn3(PO4)2 白↓;KMnO4 紫红;K2MnO4 绿;K2[MnF6] 金黄色晶体;Mn2O7 棕色油状液体.锝、铼:略.铁系(第四周期VIII族):铁化合物:Fe2+ 浅绿;[Fe(H2O)6]3+ 浅紫;[Fe(OH)(H2O)5]2+ 黄;FeO4^2- 紫红;FeO 黑;Fe2O3 暗红;Fe(OH)2 白↓;Fe(OH)3 棕红↓;FeCl3 棕红晶体;无水FeSO4 白;FeSO4·7H2O 绿;K4[Fe(CN)6](黄血盐) 黄色晶体;K3[Fe(CN)6](赤血盐) 红色晶体;Fe2[Fe(CN)6] 普鲁士蓝↓;Fe[Fe(CN)6] 黑↓;Fe(C5H5)2(二茂铁) 橙黄色晶体;M2Fe6(SO4)4(OH)12(黄铁矾,M=NH4,Na,K) 浅黄色晶体;Fe(CO)5 黄色液体.钴化合物:Co2+ 粉红;CoO 灰绿;Co3O4 黑;Co(OH)3 棕↓;Co(OH)2 粉红↓;Co(CN)2 红;K4[Co(CN)6] 紫色晶体;Co2(CO)8 黄色晶体;[Co(SCN)6]4- 紫;氯化钴脱水变色:粉红CoCl2·6H2O—325K—〉紫红CoCl2·2H2O—3l3K—〉蓝紫CoCl2·H2O—393K—〉蓝CoCl2.镍化合物:Ni2+ 亮绿;[Ni(NH3)6]2+ 紫;Ni(OH)2 绿↓;Ni(OH)3 黑↓;无水Ni(II)盐黄;Na2[Ni(CN)4] 黄;K2[Ni(CN)4] 橙;Ni(CO)4 无色液体.铂系元素(第五、六周期VIII族):Os 蓝灰色易挥发固体;Pd↓(aq) 黑;OsO4 无色有特殊气味气体;H2PtCl6 橙红色晶体;Na2PtCl6 橙黄色晶体;M2PtCl6(M=K,Rb,Cs,NH4) 黄色↓.。
