中和热与燃烧热知识点和习题附答案
高中化学燃烧热和中和热的比较
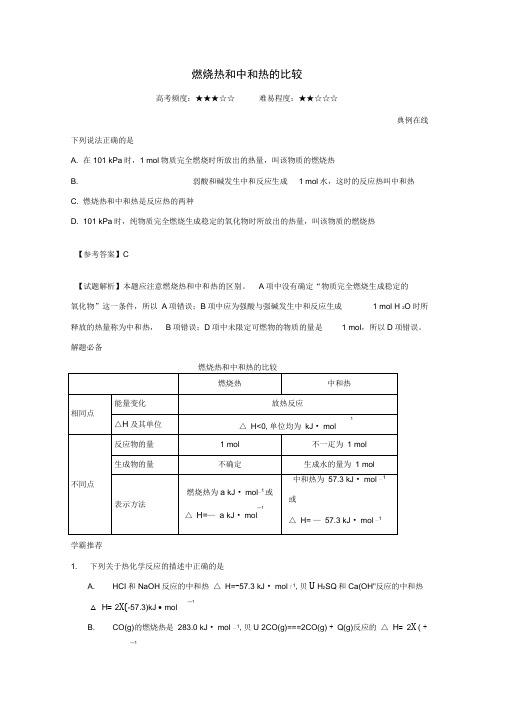
燃烧热和中和热的比较高考频度:★★★☆☆难易程度:★★☆☆☆典例在线下列说法正确的是A. 在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫该物质的燃烧热B. 弱酸和碱发生中和反应生成 1 mol水,这时的反应热叫中和热C. 燃烧热和中和热是反应热的两种D. 101 kPa时,纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫该物质的燃烧热【参考答案】C【试题解析】本题应注意燃烧热和中和热的区别。
A项中没有确定“物质完全燃烧生成稳定的氧化物”这一条件,所以A项错误;B项中应为强酸与强碱发生中和反应生成 1 mol H 2O时所释放的热量称为中和热,B项错误;D项中未限定可燃物的物质的量是 1 mol,所以D项错误。
解题必备学霸推荐1. 下列关于热化学反应的描述中正确的是A. HCI和NaOH反应的中和热△ H=-57.3 kJ • mol「1,贝U H2SQ和Ca(OH"反应的中和热—1△H= 2X(-57.3)kJ • molB. CO(g)的燃烧热是283.0 kJ • mol —1,贝U 2CO(g)===2CO(g) + Q(g)反应的△ H= 2X ( +—1283.0 kJ • mol )C. 需要加热才能发生的反应一定是吸热反应D. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热2. 已知反应热:①25 C、101 kPa 时,2C(s) + O2(g)== =2CO(g) △ H=-221 kJ • mol②稀溶液中,H (aq) + OH(aq)===H2O(l) △ H= —57.3 kJ • mol弱电解质电离时吸热。
下列结论正确的是A. C的燃烧热大于110.5 kJ • mol —1—1B. ①的反应热为221 kJ • molC. 稀硫酸与稀NaOH溶液反应的中和热为—57.3 kJ • mol —1D. 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量3. 已知下列热化学方程式:①CaCO(s) ^CaO(s)+CQ(g) △ H=+177.7 kJ②C(s)+H 2O(g) ^CO(g)+H2(g) △ H=+131.3 kJ • mol-1③HCI(l)+NaOH(l) ^=NaCI(l)+H 2O(I) △ H=-57.3 kJ • mol-1④C(s)+O2(g) ^CO(g) △ H=-393.5 kJ • mol -1⑤CO(g)+O2(g) ^CO(g) △ H=-283 kJ • mol-1⑥2H2(g)+O 2(g) ^2fO(l) △ H=-571.6 kJ • mol -1(1) _____________________________________________________ 上述热化学方程式中,不正确的有。
燃烧热和中和热

思考1:说出燃烧热和中和热的定义及要点2:热化学方程式2H2(g)+O2(g)====H2O(l);ΔH=-571.6 kJ·mol-1中ΔH表示H2的燃烧热3:液化气的主要成分是丁烷,当10g丁烷完全燃烧生成CO2和液态水时,放出热量为500kJ,写出丁烷燃烧的热化学方程式:丁烷的燃烧热为 kJ /mol。
已知1mol液态水汽化时需要吸收44kJ的热量,则C4H10(g)+13/2O2(g)=== 4CO2(g)+5H2O(g);△H= kJ /mol。
18.答案:C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(l); ΔH= -2900 kJ/mol丁烷的燃烧热为2900 kJ /mol;-2680。
解析:当10g丁烷完全燃烧生成CO2和液态水时,放热500kJ,则1mol丁烷(58g)完全燃烧时放热2900 kJ,由此可写出热化学方程式:C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(l);ΔH= -2900 kJ /mol;进而判断出丁烷的燃烧热为2900 kJ /mol;由题意:H2O(l)=H2O(g);ΔH=+44kJ/mol,即5H2O(l)=5H2O(g);ΔH=+220kJ/mol,与C4H10(g)燃烧的热化学方程式相加即可求出C4H10(g)+13/2O2(g)=== 4CO2(g)+5H2O(g);△H=-2680 kJ /mol。
4:25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式中正确的(D )A.C(s)+1/2O2(g)=CO(g) △H=-393.5 kJ/molB.2H2(g)+O2(g)=2H2O(g) △H=+571.6 kJ/molC.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ/molD. 1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) △H=-1400 kJ/mol1.下列热化学方程式中的反应热下划线处表示燃烧热的是(B )A.NH3(g)+ 5/4O2(g)NO(g)+ 6/4H2O(g);ΔH=-a kJ·mol-1B.C6H12O6(s)+6O2(g)6CO2(g)+6H2O(l);ΔH=-b kJ·mol-1C.2CO(g)+O2(g)2CO2(g);ΔH=-c kJ·mol-1D.CH3CH2OH(l)+ 1/2O2(g)CH3CHO(l)+H2O(l);ΔH=-d kJ·mol-12. 1.00 L 1.00 mol·L-1 H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ的热量,该反应的中和热为___________,表示其中和热的热化学方程式为________________57.3 kJ/mol 1/2H2SO4(aq)+NaOH(aq)===1/2Na2SO4(aq)+H2O(l);ΔH=57.3 kJ/mol3.下列说法中,正确的是(B)A.1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热B.中和反应都是放热反应,盐类水解反应都是吸热反应C.在101 kPa时,1 mol碳燃烧所放出的热量一定叫碳的燃烧热. D.CO燃烧是吸热反应4、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ/mol,下列说法中正确的是(D )。
选修四《-热化学方程式--燃烧热-中和热》精品习题及答案

热化学方程式 燃烧热 中和热习题一、选择题(每小题4分,每小题有1~2个正确选项)1.由氢气和氧气反应生成1mol 水蒸气放热241.8kJ ,则反应2H 2(g)+O 2(g)=====点燃2H 2O(g)的ΔH 为( )A .-483.6kJ·mol -1B .-241.8kJ·mol -1C .-120.6kJ·mol -1D .+241.8kJ·mol -12.下列说法或表示方法正确的是( )A .等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多B .由C(石墨)===C(金刚石);ΔH =+1.90kJ·mol -1可知,金刚石比石墨稳定C .在101kPa 时,2gH 2完全燃烧生成液态水,放出285.8kJ 热量,氢气燃烧的热化学方程式表示为:2H 2(g)+O 2(g)===2H 2O(l);ΔH =-285.8kJ·mol -1D .在稀溶液中,H +(aq)+OH -(aq)===H 2O(l);ΔH =-57.3kJ·mol -1,若将含0.5mol H 2SO 4的浓硫酸与含1mol NaOH 的溶液混合,放出的热量大于57.3kJ3.分析下面的能量变化示意图,下列热化学方程式正确的是( )A .2A(g)+B(g)===2C(g);ΔH =a (a >0)B .2A(g)+B(g)===2C(g);ΔH =a (a <0)C .2A +B===2C ;ΔH =a (a <0)D .2C===2A +B ;ΔH =a (a >0)4.常温下14g CO 在足量O 2中充分燃烧,放出141.3kJ 的热,则CO 燃烧的热化学方程式为( )A .2CO(g)+O 2(g)===2CO 2(g);ΔH =-141.3kJ·mol -1B .CO(g)+12O 2===CO 2; ΔH =-141.3kJ·mol -1C .CO(g)+12O 2(g)===CO 2(g); ΔH =-282.6kJ·mol -1D.12CO(g)+14O 2(g)===12CO 2(g); ΔH =-141.3kJ·mol -15.沼气是一种能源,它的主要成分是CH 4。
高中化学燃烧热和中和热 练习解析旧人教第三册必修+选修

燃烧热和中和热练习解析一、选择题1.反应热是()A.燃烧热的集中表现B.中和热的集中表现C.溶解热的集中表现D.键能变化的集中表现解析:燃烧热、中和热,仅是反应热的一种。
答案:D2.下列各组物质的燃烧热相等的是()A.碳和一氧化碳B.1摩尔碳和2摩尔碳C.3摩尔乙炔和1摩尔苯D.淀粉和纤维素解析:燃烧热与某物质的量无关。
答案:B3.天然气、液化石油气燃烧的化学方程式为:CH4+2O2−−→−点燃CO2+2H2O C3H8+5O2−−→−点燃3CO2+4H2O现有一套以天然气为燃料的灶具,欲改为燃烧液化石油气,应采取的正确措施是()A.减小空气进入量,增大石油气进入量B.增大空气进入量,减小石油气进入量C.增大空气进入量,也增大石油气进入量D.增大空气进入量,或减小石油气进入量解析:根据燃烧方程式知单位体积的液化石油气消耗的O2比天然气多。
答案:BD4.炎热夏季里,能喝上一口冰镇饮料那是多么惬意的事情。
目前,一种人称“摇摇冰”的即冷即用饮料开始上市。
所谓“摇摇冰”是指吸食前将饮料罐隔离层中的制冷物质和水混合摇动能使罐中饮料冷却。
若该制冷物质可以在下列物质中选择,它应该是()A.氯化钠B.固体硝酸铵C.生石灰D.固体氢氧化钠答案:B5.化学反应中的能量变化,通常表现为热量的变化,如Ba (OH )2·8H 2O 与NH 4Cl 的反应要吸收热量,在化学上叫做吸热反应。
其原因是( )A.反应物所具有的总能量高于生成物所具有的总能量B.反应物所具有的总能量低于生成物所具有的总能量C.在化学反应中需要加热的反应就是吸热反应D.在化学反应中需要降温的反应就是放热反应 答案:B6.为了提高煤燃料的热效率并减少CO 有害物质的污染,可采取的措施有( ) A.通入大量的空气B.将固体燃料粉碎,使之充分燃烧C.将煤经过处理,使之转化为气体燃料D.控制煤的生产解析:属于煤的综合利用方法的考查。
答案:BC7.下列有关光合作用的说法不正确的是( ) A.将无机物转化为有机物B.反应物的总能量高于生成物的总能量C.将太阳能转变为化学能D.是自然界碳元素循环的重要途径 答案:B8.一定条件下,充分燃烧一定量的丁烷放出热量为Q kJ (Q >0),经测定完全吸收生成的二氧化碳需消耗5 mol ·L -1的KOH 溶液100 mL ,恰好生成正盐。
高中化学中和热和燃烧热的知识点

高中化学中和热和燃烧热的知识点化学的学习中,有很多的知识点,学生想要学好化学需要了解各方面的知识点,下面店铺的小编将为大家带来中和热和燃烧热的知识点的介绍,希望能够帮助到大家。
高中化学中和热和燃烧热的知识点介绍重点:中和热的测定实验原理的理解和操作要点的把握燃烧热的概念,有关燃烧热计算难点:中和热的测定,中和热和燃烧热的有关计算[知识分析]一、中和热:强酸和强碱的稀溶液完全中和生成1mol水时所放出的热量称为中和热;常温常压下,酸和碱的稀溶液反应产生的中和热为△H=-57.4kJ/mol。
中和热的测定:在50mL烧杯中加入20mL 2mol/L的盐酸,测其温度。
另用量筒量取20mL 2mol/L NaOH溶液,测其温度,并缓缓地倾入烧杯中,边加边用玻璃棒搅拌。
观察反应中溶液温度的变化过程,并作好记录。
数据处理:△H=-Q/n=-cm△t/n水其中:c=4.18J/(g?℃),m为酸碱溶液的质量和,△t=t2-t1,t1是盐酸温度与NaOH溶液温度的平均值,n水为生成水的物质的量。
说明:1. 燃烧不一定要有氧气参与,如氢气在氯气中燃烧,钠在氯气中燃烧等。
2. 物质在氧气中燃烧的条件是:要与空气(即氧气)接触;并且温度要达到物质的着火点;而燃料充分燃烧的条件则是:要有适当过量的氧气,可燃物与空气要有足够多的接触面积。
以上两者既有相同的地方,也有不同的地方。
3. 燃料不完全燃烧时主要存在以下问题:浪费能源的同时可能对环境产生污染。
4. 理解燃烧热时,我们要从四个方面入手:①25℃、101kPa;②1mol纯物质;③完全燃烧;④稳定的化合物。
5. 一般情况下,物质燃烧生成的稳定的化合物有:C→CO2;H→H2O(液态);S→SO2。
6. 燃烧热表示的意义:C的燃烧热为393.5kJ/mol,表示在25℃、101kPa时,1molC完全燃烧生成CO2时放出393.5kJ的热量。
7. 书写热化学方程式时,燃烧热是以1mol物质完全燃烧所放出的热量来定义的,因此在书写它的热化学方程式时,应以1mol可燃物为标准来配平其余物质的化学计量数。
燃烧热和中和热习题带答案

燃烧热和中和热 班级: 姓名:一、选择题 1.下列说法中,正确的是A .1 mol H 2SO 4与1 mol BaOH 2完全中和所放出的热量为中和热B .中和反应都是放热反应;C .在101 kPa 时,1 mol 碳燃烧所放出的热量一定叫碳的燃烧热D .CO 燃烧是吸热反应2.下列说法正确的是A .在101 kPa 时,1 mol 物质完全燃烧时所放出的热量,叫做该物质的燃烧热B .酸和碱发生中和反应生成1 mol 水,这时的反应热叫中和热C .燃烧热或中和热是反应热的种类之一D .在稀溶液中,1 mol CH 3COOH 和1 mol NaOH 完全中和时放出的热量为57.3 kJ3.已知下列热化学方程式:2H 2g +O 2g===2H 2Og ;ΔH =-483.6 kJ/molH 2g +21O 2g===H 2Og ;ΔH =-241.8 kJ/mol H 2g +21O 2g===H 2Ol ;ΔH =-285.8 kJ/mol 则氢气的燃烧热为A .-438.6 kJ/molB .-241.8 kJ/molC .-285.8 kJ/molD .无法确定 4.已知Zns +21O 2g===ZnOs ;ΔH =-350 kJ/mol,则1 g Zn 在氧气中燃烧放出的热量约为 A .5.4 kJB .350 kJC .3.5 kJD .8.5 kJ 5.已知:Cs +O 2g===CO 2g ;ΔH =-393.5 kJ/mol,2H 2g +O 2g===2H 2Og ;ΔH =-483.6 kJ/mol, 现有0.2 mol 的炭粉和氢气组成的悬浮气,因混合物在氧气中完全燃烧,共放出63.53 kJ 热量,则混合物中C 与H 2的物质的量之比为A .1∶1B .1∶2C .2∶3D .3∶2 6.已知:CH 4g +2O 2g===CO 2g +2H 2Ol ;ΔH 1=-Q 1,H 2g +21O 2g===H 2Og ;ΔH 2=-Q 2,H 2g +21O 2g===H 2Ol ;ΔH 3=-Q 3, 常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L 已折合成标准状况经完全燃烧恢复到常温,放出的热量为A .0.4Q 1+0.05Q 2B .0.4Q 1+0.1Q 2C .0.4Q 1+0.05Q 3D .0.4Q 1+0.1Q 37.根据热化学方程式在101 kPa 时:Ss +O 2g===SO 2g ;ΔH =-297.23 kJ/mol,分析下列说法中不正确的是A .S 的燃烧热为297.23 kJ/molB .Sg +O 2g===SO 2g 放出的热量大于297.23 kJC .Sg +O 2g===SO 2g 放出的热量小于297.23 kJD .形成1 mol SO 2的化学键所释放的总能量大于断裂1 mol Ss 和1 mol O 2g 的化学键所吸收的总能量8.天然气、石油、煤等在地球上的蕴藏量是有限的,则下列说法正确的是①可砍伐树木、野草作能源 ②可用酒精作能源 ③可利用电解水的方法制得氢气作能源 ④应开发太阳能、核能等新能源 ⑤大量应用风能、水能等可再生能源A .①B .①⑤C .②③D .④⑤9.已知2H 2g +O 2g===2H 2Ol ;ΔH =-569.6 kJ·mol -1,2H 2Og===2H 2g +O 2g ;ΔH =+482.1 kJ·mol -1;现有1 g 液态H 2O,蒸发时吸收的热量是A .2.43 kJB .4.86 kJC .43.8 kJD .87.5 kJ 二、填空题12分+10.家用液化气中主要成分之一是丁烷;在101 kPa 时,10 kg 丁烷完全燃烧生成CO 2和H 2Ol 放出热量5×105 kJ,丁烷的燃烧热为___________,丁烷燃烧的热化学方程式为________________________________________________;11.1.00 L 1.00 mol·L -1 H 2SO 4溶液与2.00 L 1.00 mol·L -1 NaOH 溶液完全反应,放出114.6 kJ 的热量,由此可推知H 2SO 4与NaOH 发生中和反应的中和热为___________,表示该中和热的热化学方程式为___________;参考答案一、1.B 2.C 3.C 4.A 5.A 6.D 7.C 8.D 9.A 二、10.2900 kJ/mol 2C 4H 10g +13O 2g===8CO 2g +10H 2Ol ;ΔH =-5800 kJ/mol 11.57.3 kJ/mol21H 2SO 4aq +NaOHaq=== 21Na 2SO 4aq +H 2Ol ;ΔH =-57.3 kJ/mol。
燃烧热和中和热

例2:0.3mol的气态高能燃料乙硼烷(B2H6)在氧 气中燃烧,生成固态B2O3和液态水,放出649.5kJ 热量,其热化学方程式
为 B2H6 (g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2165 kJ·mol-1 。
已知;H2O(l)= H2O(g) H= +44kJ/mol, 则11.2L(标准状况)乙硼烷完全燃烧生成气态水 时放出热量是 1016.5 kJ。
二、中和热
1、定义:在稀溶液中,酸跟碱发生中和反应,生成 1mol水时的反应热。
强酸和强碱反应,实质都是H++OH-= H2O,中和热 都为 57.3kJ/mol 的热量(中学阶段我们只讨论强酸和 强碱反应的中和热)。
2、注意:
① 条件-稀溶液(一般是指浓度均≤ 1mol /L) 若是浓溶液,则在中和时还要考虑溶液的稀释,此
现有80t纯炭不完全燃烧,所得气体中CO 占 3/4体积,与80t纯炭完全燃烧相比较, 此反应损失了多少热量?
4、发射卫星用肼 N2H4为燃料和NO2作氧化剂, 两者反应生成N2 和 H2O(g)。 已知:①
②
+ 2H2O (g)
那么发射卫星时,燃烧1mol肼放出的热量
是 567.6 kJ。
结束语
A.2912kJ B.2953kJ C.3236kJ D.3867kJ
2、
;△H =- 572 kJ/mol
;△H =- 484 kJ/mol
若在标准状况下,将H2和O2组成的混合气体点 燃爆炸后再恢复到标况,气体体积减少33.6L,
则反应放出的热量是___________2k8J6。
3、已知热化学方程式
时除发生中和反应外,稀释过程也要放出热量,影响 中和热的数值。
中和热和燃烧热

没加催 化剂
活化分子
活化分子变成 生成物分子放
出的能量
E1 E2
反应物
反应热
加了催化剂
生成物 反应过程
3. 怎样改变反应的活化能为来加快反应的速 率?是何措施?
5、焓变与键能的关系(微观)
ΔH = 反应物的键能总和 – 生成物的键能总和
6、焓变与物质能量的关系(宏观)
ΔH = ∑ E 生成物 – ∑ E 反应物
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 C
吸热
Na2SO4•10H2O 放热 Na2SO4•nH2O + (10-n)H2O 由于芒硝随环境温度的变化,会得失结晶水,在
得失结晶水的过程中伴随着能量的变化,因此,
芒硝可作储能材料。
一个反应要发生一般要经历哪些过程?
合理
普通 分子
活化 能
活化 分子
取向的 碰撞
有效 碰撞
新物质
能量
活化能 能 量
Q = 0.418(t2-t1)kJ ③ 5、③式表示的是中和热吗?为什么?
ΔH= -
0.418 (t2-t1) kJ/mol
0.025
强酸、强碱反应: H+(aq)+OH-(aq)=H2O(l); △H= - 57.3kJ/moL
差别=-(57.3-53.8)kj/mol=-3.5 kj/mol
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第2讲中和热与燃烧热❖基本知识
要点一:燃烧热、中和热及其异同
特别提醒:
1.燃烧热指的是1 mol可燃物燃烧生成稳定的化合物
时所放出的热量,注意:稳定的化合物,如H2→H2O(l)
而不是H2O(g)、C→CO2(g)而不是CO 、S→SO2(g)
而不是SO3。
2.中和热是指酸、碱的稀溶液发生中和反应生成1 mol
水所放出的热量。
注意:弱酸、弱碱电离出H+、OH-
需要吸收热量,故所测定中和热的数值偏小;浓硫酸与
碱测定中和热时,因浓硫酸释稀要放热,故测定的中和
热的数值偏大。
3.因燃烧热、中和热是确定的放热反应,具有明确的
含义,故在表述时不用带负号,如CH4的燃烧热为
890KJ/mol。
4.注意表示燃烧热的热化学方程式和燃烧的热化学方
程式;表示中和热的热化学方程式和表示中和反应的热
化学方程式的不同。
燃烧热以可燃物1mol为标准,且
燃烧生成稳定的化合物;中和热以生成1mol
要点二:能源
关于能源问题,应了解下面的几个问题:
(1)能源的分类:常规能源(可再生能源,如水等,非再
生能源,如煤、石油、天然气等);新能源(
如太阳能、风能、生物能;非再生能源,如核聚变燃料)
(2)能源的开发;①太阳能:每年辐射到地球表面的能量
为5×1019kJ,相当于目前全世界能量消耗的1.3万倍。
①生物能:将生物转化为可燃性的液态或气态化合物,
再利用燃烧放热。
①风能:利用风力进行发电、提水、
扬帆助航等技术,风能是一种可再生的干净能源。
①地
球能、海洋能。
❖习题一:中和热实验
1、50mL0.5 mol·L-1的盐酸与50mL0.55 mol·L-1的
NaOH溶液在下图所示的装置中进行中和热的测定。
请
回答下列问题
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
_________;由图可知该装置有不妥之处,应如何改正?
_______________________________
酸溶液测定中和热.测定中和热的实验装置如图1所示.
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热
第1页
第 2 页
NaOH 溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V 1+V 2=50mL).下列叙述正确的是______
A 做该实验时环境温度为22①
B 该实验表明化学能可转化为热能 CNaOH 溶液的浓度约为1.2mol/L
D 该实验表明有水生成的反应都是放热反应.
参考答案
1、(1)环形玻璃搅拌棒;在大小烧杯间填满碎塑料泡沫(或碎纸条)使小烧杯口与大烧杯口相平 (2)减少实验过程中的热量损失 (3)偏小
(4)不相等;因为酸、碱发生中和反应放出的热量与生成水的物质的量有关;相等;中和热是指强酸与强碱的稀溶液发生反应生成lmolH 2O 所放出的热量 (5)偏小
2、(1)NaOH(aq)+HCl (aq)═NaCl (aq)+H 2O △H=-57.3 kJ/mol ,
(2)①4.0;②-53.5kJ/mol ;③选:①②③④;(3)BC .
❖ 习题二:综合练习 1.下列说法中,正确的是
A .1 mol H 2SO 4与1 mol Ba(OH)2完全中和所放出的热量为中和热
B .中和反应都是放热反应。
C .在101 kPa 时,1 mol 碳燃烧所放出的热量一定叫碳的燃烧热
D .CO 燃烧是吸热反应 2.下列说法正确的是 A .在101 kPa 时,1 mol 物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B .酸和碱发生中和反应生成1 mol 水,这时的反应热叫中和热
C .燃烧热或中和热是反应热的种类之一
D .在稀溶液中,1 mol CH 3COOH 和1 mol NaOH 完全中和时放出的热量为57.3 kJ 3.已知下列热化学方程式:
2H 2(g)+O 2(g)===2H 2O(g);ΔH =-483.6 kJ/mol
H 2(g)21+O 2(g)===H 2O(g);ΔH =-241.8 kJ/mol
H 2(g)21+O 2(g)===H 2O(l);ΔH =-285.8 kJ/mol 则氢气的燃烧热为 A .-438.6 kJ/mol B .-241.8 kJ/mol C .-285.8 kJ/mol D .无法确定 4.已知Zn(s)2
1+O 2(g)===ZnO(s);ΔH =-350 kJ/mol ,
则1 g Zn 在氧气中燃烧放出的热量约为
A .5.4 kJ
B .350 kJ
C .3.5 kJ
D .8.5 kJ
5.已知:C(s)+O 2(g)===CO 2(g);ΔH =-393.5 kJ/mol , 2H 2(g)+O 2(g)===2H 2O(g);ΔH =-483.6 kJ/mol , 现有0.2 mol 的炭粉和氢气组成的悬浮气,因混合物在氧气中完全燃烧,共放出63.53 kJ 热量,则混合物
中C 与H 2的物质的量之比为 A .1①1 B .1①2 C .2①3 D .3①2 6.已知:CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(l);ΔH 1=-Q 1, H 2(g)21
+
O 2(g)===H 2O(g);ΔH 2=-Q 2, H 2(g)2
1
+O 2(g)===H 2O(l);ΔH 3=-Q 3,
常温下取体积比为4①1的甲烷和氢气的混合气体11.2 L(已折合成标准状况)经完全燃烧恢复到常温,放出的热量为
A .0.4Q 1+0.05Q 2
B .0.4Q 1+0.1Q 2
C .0.4Q 1+0.05Q 3
D .0.4Q 1+0.1Q 3 7.根据热化学方程式(在101 kPa 时):S(s)+
O 2(g)===SO 2(g);ΔH =-297.23 kJ/mol ,分析下列说法中不正确的是
A .S 的燃烧热为297.23 kJ/mol
B .S(g)+O 2(g)===SO 2(g)放出的热量大于297.23 kJ
C .S(g)+O 2(g)===SO 2(g)放出的热量小于297.23 kJ
D .形成1 mol SO 2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O 2(g)的化学键所吸收的总能量
8.天然气、石油、煤等在地球上的蕴藏量是有限的,则下列说法正确的是
①可砍伐树木、野草作能源 ①可用酒精作能源 ①可利用电解水的方法制得氢气作能源 ①应开发太阳能、核能等新能源 ①大量应用风能、水能等可再生能源 A .① B .①① C .①① D .①① 9.已知
2H 2(g)+O 2(g)===2H 2O(l);ΔH =-569.6 kJ·mol -
1,
2H 2O(g)===2H 2(g)+O 2(g);ΔH =+482.1 kJ·mol -
1。
现有1 g 液态H 2O ,蒸发时吸收的热量是 A .2.43 kJ B .4.86 kJ C .43.8 kJ D .87.5 kJ 二、填空题 10.家用液化气中主要成分之一是丁烷。
在101 kPa 时,10 kg 丁烷完全燃烧生成CO 2和H 2O(l)放出热量5×105 kJ ,丁烷的燃烧热为___________,丁烷燃烧的热化学方程式为______________________________________。
11.1.00 L 1.00 mol·L -1
H 2SO 4溶液与2.00 L 1.00
mol·L -
1 NaOH 溶液完全反应,放出114.6 kJ 的热量,由此可推知H 2SO 4与NaOH 发生中和反应的中和热为___________,表示该中和热的热化学方程式为____________________________________。
参考答案 一、1.B 2.C 3.C 4.A 5.A 6.D .C
8.D 9.A
二、10.2900 kJ/mol 2C 4H 10(g)+13O 2(g)===8CO 2(g)+10H 2O(l);ΔH =-5800 kJ/mol 11.57.3 kJ/mol 21
H 2SO 4(aq )+21NaOH(aq )=== Na 2SO 4(aq )+H 2O(l );
ΔH =-57.3 kJ/mol。
