2化学选修4 第一章第二节
【高中化学】高中化学(人教版)选修4同步教师用书:第1章 第2节 燃烧热 能源
第二节燃烧热能源1.掌握燃烧热的概念,掌握有关燃烧热的计算。
2.了解资源、能源是当今社会的重要热点问题。
3.常识性了解使用化石燃料的利弊及新能源的开发。
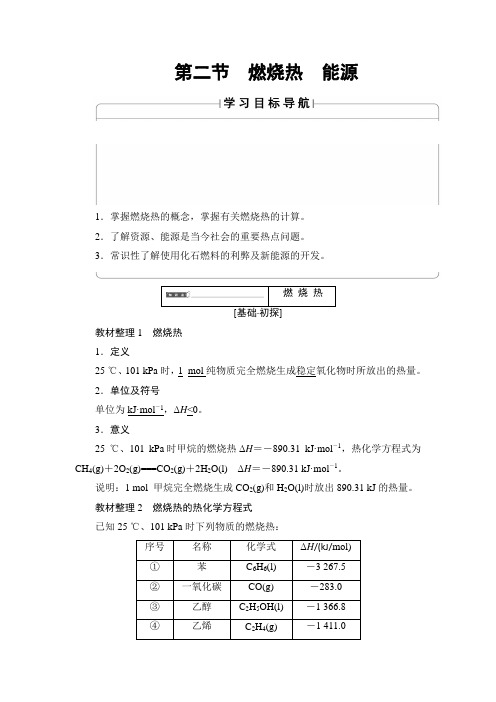
燃烧热教材整理1燃烧热1.定义25 ℃、101 kPa时,1_mol纯物质完全燃烧生成稳定氧化物时所放出的热量。
2.单位及符号单位为kJ·mol-1,ΔH<0。
3.意义25 ℃、101 kPa时甲烷的燃烧热ΔH=-890.31 kJ·mol-1,热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.31 kJ·mol-1。
说明:1 mol 甲烷完全燃烧生成CO2(g)和H2O(l)时放出890.31 kJ的热量。
教材整理2燃烧热的热化学方程式已知25 ℃、101 kPa时下列物质的燃烧热:序号名称化学式ΔH/(kJ/mol)①苯C6H6(l) -3 267.5②一氧化碳CO(g) -283.0③乙醇C2H5OH(l) -1 366.8④乙烯C2H4(g) -1 411.0①_____________________________________________________________。
②_____________________________________________________________。
③_____________________________________________________________。
④_____________________________________________________________。
⑤_____________________________________________________________。
⑥_____________________________________________________________。
人教版高中化学选修四第一章第二节中和热燃烧热课件(共14张PPT)

燃中烧和热热 燃能烧源热
二、燃烧热
1.定义:在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放 出的热量,叫做该物质的燃烧热。 2.理解: ①燃烧热属于反应热,也用ΔH表示,单位也为 kJ/mol。 叙述时直接读出“数值” 如甲烷的燃烧热为890.31kJ/mol 也可用ΔH表示,如ΔH=-890.31kJ/mol ②燃烧热的测定条件通常是101kPa.
热量。
4. 若是弱酸和弱碱在发生中和反应的同时还要发生电离,电离要吸收热量,
故放出的热量均不完全是中和热。
中 小学班 级安全 教育工 作计划 范文
作 为 班 主 任 ,班级安 全工作 职责重 大,务必 常抓不 懈,富 有实效 。今年 ,我班将 进一步 认 真 学 习 贯 彻加强 学校安 全工作 的有关 文件,以 学生安 全工作 为中心 ,避免各类事故
燃中烧和热热 燃能烧源热
【练习】已知: 2H2(g)+O2(g)=2H2O(l) ΔH= -571.6 kJ/mol H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8 kJ/mol 求氢气的燃烧热。
注意H2为1mol,生成水为液态 答案:氢气的燃烧热ΔH= -285.8 kJ/mol
化学 ·选修 4
第一章第二节 中和热 燃烧热
燃中烧和热热 燃能烧源热
学习目标
1.理解中和热、燃烧热的概念 2.会书写中和热、燃烧热的热化学方程式 教学重点 中和热、燃烧热的概念。 教学难点 中和热、燃烧热的热化学方程式的书写
燃中烧和热热 燃能烧源热
复习引入 写热化学方程式 ⑴1L1mol/L稀盐酸和1L1mol/LNaOH溶液发生中和反应放出的热量 为57.3kJ。
的 发生。
【化学】人教版选修4 第一章 第二节 燃烧热能源

的是(
)。
A.开发太阳能、水能、风能等新能源,减少使用煤、石
油等化石燃料
B.大力发展采煤、采油业,迅速提高产量以满足工业生
产的快速发展
C. 在农村推广使用沼气 D.减少资源消耗,增加资源的重复使用和资源的循环再 生
点拨:对于不可再生能源的利用应限制,适度合理开发利
用;对于新能源、可再生能源应大力发展,以替代不可再生能 源,减少甚至消除污与 1 mol Ba(OH)2 完全中和所放出的热量
B.25 ℃、101 kPa 时,1 mol S 和 2 mol S 的燃烧热相等 C.CO 是不稳定的氧化物,它能继续和氧气反应生成稳定 的 CO2,所以 CO 的燃烧反应一定是吸热反应 D.101 kPa 时,1 mol 碳燃烧所放出的热量为碳的燃烧热
得到充分利用。
(2)增大燃料与空气的接触面积,如固体燃料粉碎或液化, 液体燃料雾化等。 (3)对化石燃料需进行多次加工,得到某些燃料再用于燃 烧,以合理利用化石燃料。如煤的气化或液化,石油分馏等, 均使化石燃料得到有效的利用。
[例 3]形成节约能源和保护生态环境的产业结构是人类与 自然和谐发展的重要保证,你认为下列行为中有悖于这一保证
B.石油
D.太阳能
4.已知在 25 ℃、101 kPa 时,2 mol CO 完全燃烧生成 CO2, 放出的热量为 566 kJ。 (1)写出该反应的热化学方程式: 2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol _____________________________________________________ 。 (2)写出表示 CO 燃烧热的热化学方程式: 1 CO(g)+2O2(g)===CO2(g) ΔH=-283 kJ/mol _____________________________________________________ 。
高中化学 人教版选修4 课件:第一章 第二节 燃烧热 能源(34张PPT)

低
酸雨 温室效应
利用率
新能源 (4)新能源包括:太阳能、 氢能 ________ 风能 和________ 海洋能 等。 生物质能
能源
地热能 、________、 、________
栏 栏 目 目 链 链 接 接
特点:资源丰富,可以再生,没有污染或很少污染。 3.地位 能源是国民经济 ________和社会发展 ________的重要物质基础,它的开发和
101 kPa 时 , ________ 1 mol 纯 物 质 ________ 完全 燃 烧 生 成 ________ 稳定的氧化物 ________ 时所放出的热量。
- 或ΔH________0 < 。 2.符号:ΔH为________
kJ/mol 。 3.单位:________ 4.意义 例如:CH4的燃烧热为890.31 kJ/mol,表示在25°C、 1 mol CO2(g) 和 101 kPa 时, ________CH 4(g) 完全 燃 烧 生成 __________ H2O(l) 时放出890.31 kJ的热量。 ________
利用情况可以衡量一个国家和地区的经济发展和科学技术 水平。
应用 思考 燃料充分燃烧的条件是什么?
提示:燃烧热是以 1 mol纯物质完全燃烧生成稳定的氧 化物时所放出的热量来定义的,因此在书写它的热化学方程
式时,以燃烧 1 mol物质为标准来确定其余物质的化学计量
数。
栏 目 链 接
综合
拓展 三、能源的分类及煤作燃料的利与弊 1.能源的分类方法
(1)一次能源与二次能源:从自然界直接取得的天然能源 叫一次能源,如原煤、原油、流水等;一次能源经过加工转 换后获得的能源称为二次能源,如各种石油制品、煤气、蒸 汽、电力、氢能等。
2019-2020学年高二化学人教版选修4课件第1章 第2节 燃烧热 能源

烧热的热化学方程式时,先把可燃物的计量数定为1,再配平其他物
质。
2.相同条件下,1 mol H2与2 mol H2完全燃烧生成液态水所放出的 热量有何关系?分别用1 mol H2与2 mol H2完全燃烧所放出的热量 所计算出的氢气的燃烧热是否相同?
答案 相同条件下,2 mol H2完全燃烧所放出的热量是1 mol H2完
探究一
探究二
首页
课前篇 自主预习
课课堂堂篇篇 探探究究学学习习
随堂检测
燃烧热
热化学 方程式
CO(g)+12O2(g)
CO2(g)
举例 ΔH=-283.0 kJ·mol-1
中和热 NaOH(aq)+12H2SO4(aq) 12Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
-10-
-13-
第二节 燃烧热 能源
首页
课前篇 自主预习
课课堂堂篇篇 探探究究学学习习
随堂检测
探究一
探究二
燃烧热的有关计算
问题探究
1.可燃物的物质的量发生变化,其燃烧热改变吗?如何配平表示可
燃物燃烧热的热化学方程式?
答案 燃烧热指1 mol可燃物完全燃烧生成稳定的氧化物时放出
的热量,与参加反应的可燃物的物质的量无关。配平表示可燃物燃
随堂检测
探究一
探究二
解析 (1)根据燃烧热的定义知H2、C3H8的燃烧热分别为285.8 kJ·mol-1、2 220 kJ·mol-1。
(2)燃烧释放的总热量的计算式为
Q放=1 mol×285.8 kJ·mol-1+2 mol×2 220 kJ·mol-1=4 725.8 kJ。
热化学方程式化学选修4课件2

与化学方程式相比,以上方程式
有哪些不同?
二、热化学方程式 1.定义:能表示参加反应物质的量和反应热的 关系的化学方程式,。 1/2H2(g)+1/2I2(g)====HI(g) △H=-14.9kJ/mol 101kPa
计量数就是指物质的量且可以出现分数形式 200℃
1、 1mol C与1mol 水蒸气反应生 成1mol CO 和1mol H2,需要吸收 131.5 kJ的热量。写出此反应的热 化学方程式。
9.下列反应中属吸热反应的是 D A、 镁与盐酸反应放出氢气 B、 氢氧化钠与盐酸的反应 C、 硫在空气或氧气中燃烧 D、Ba(OH)2•8H2O与NH4Cl反应 5.下列反应中,生成物总能量大于反应物总能量的是 D A.氢气在氧气中燃烧 B.铁丝在氧气中燃烧 C.石灰石烧制生石灰 D.在生石灰中加水 10.下列各图中,表示正反应是吸热反应的图是
H2(g)+1/2O2(g) = H2O(g) △H=-241.8 kJ/mol
H2(g)十1/2O2 (g)=H2O(l) 液态水
液态水(放热) 气态水(吸热)
比较a、b的大小
H2(g)+I2(g)======2HI(g) 101kPa
200℃
△H=-a kJ/mol
2.热化学方程式书写步骤:
1).按规定的物质的量写出化学方程式(留开间距) 2).补充反应条件:温度、压强、其他条件。 (25℃、101kPa时可省略) 3).各物质后加括号,内注明状态:s固体,l液体,g 气体. 4).方程式后注明焓变,即△H=· · · · · · 5).检查
3. 状态不同对△H的影响?
H2(g)+I2(g)======2HI(l) 101kPa
人教版高中化学选修4 化学反应原理 第一章 第二节 燃烧热 能源(第1课时)

能源
资源蕴藏方面: 煤是我国储量最多的能源资源,应充分利用,但由于 煤为不可再生能源,故使用过程中应减少不必要的浪费, 并提高其能量利用率,同时应加快开发新能源。 开采和运输方面: 我国煤炭资源相对比较集中,开采成本较低,这从我 国的大、中、小型煤矿繁多即可说明,且一般的煤矿工人 不需要多么高深的技术;但煤在大量开采时,又会造成地 面塌陷;在运输方面,很不方便,需要装、卸、运等诸多 环节,且开采出来的煤在贮存时便有部分变质,造成资源 浪费,同时造成环境污染,这从煤矿周围的空气质量普遍 不佳(尤其是粉尘)即可证明,故应大大提高清洁煤技术, 使煤通过气化等手段而变得易于运输。
19
能源
能源分类
按转换 过程分 按利用 历史分
按性质分
一 级 能 源 二级能源
2014年6月15日星期日
常规 能源
可再生 能源 不可再 生能源
风能、水能、 煤炭、石油、天然气等
太阳能、海洋能、地热能、 可再生能源 波浪能、潮汐能等。
新能源
不可再生 能源
核能
电能、氢能、煤气、水煤气、蒸汽、焦炭、汽油、 煤油、柴油、液化石油气、沼气能等
2014年6月15日星期日 25
参考观点
能源
资源综合利用: 煤作为固体燃料,燃烧反应速率小,热利 用效率低,我们国家的煤,在进行综合利 用时的办法主要是煤的干馏和煤的气化、 液化,但在此过程中,却有相当多的副产 物不能有效利用,如在炼焦过程中产生的 焦炉气、煤焦油等,我们都没有很好地进 行再加工,结果是既浪费了资源,又污染 了环境。因此,积极开展煤的综合利用十 分重要。
2014年6月15日星期日
14
燃烧热
燃烧热和中和热的区别与联系
化学选修4鲁科版第1章第2节电能转化为化学能——电解课件(3)

有何规律?
电解的基本规律
举 例 电解 类型 物质类别 含氧酸 强碱 溶液pH 溶液复 变化 原方法 实例 H2SO4 NaOH 阳极:4OH—-4e—=O2↑+2H2O 阴极:4H++4e—=2H2↑
电极反应
水 电 解
溶 质 电 解
减小 增大 不变 H2O
活泼金属的 含氧酸盐 无氧酸
不活泼金属 的无氧酸盐
Na2SO4
HCl CuCl2
阳极2Cl=2H2↑
增大
HCl CuCl2
阳极2Cl—-2e- =Cl2↑
阴极:Cu2++2e—=Cu
2Cl-+2H
2O =
通电 通电
2NaCl+2H2O =
H2 ↑ +Cl2 ↑ +2NaOH
H2 ↑ +Cl2 ↑ +2OH-
阳极: 4OH-= 2H2O+O2 ↑+ 4e+ — 4H + 4e = 2H2 ↑ 阴极: 通电 总反应: 2H2O == 2H2 ↑+O2 ↑
Na2SO4溶液
阳极: 4OH-= 2H O+O ↑+ 4e2 2
阴极: 4H+ + 4e— = 2H2 ↑
总反应:
通电 2H2O = 2H2 ↑+O2 ↑
H2SO4溶液
阳极:4OH-= 2H2O+O2 ↑+ 4e阴极: 4H + 4e = 2H2 ↑ 总反应: 通电 2H2O = 2H2 ↑+O2 ↑
NaOH溶液
+ —
6.离子放电顺序及电解产物的判断
(1)阳极上(氧化反应)
高中化学 第1章第2节 第2课时 电解精炼铜电镀课件同步导学 鲁科版选修4

1.某同学按右图所示的装置进行电解实验。下列说法 正确的是(双选)( )
A.电解过程中,铜电极上有 H2 产生 B.电解初期,主反应方程式为: Cu+H2SO4=通==电==CuSO4+H2↑ C.电解一定时间后,石墨电极上有铜析出 D.整个电解过程中,H+的浓度不断增大
解析: 电解过程分两个阶段:第一阶段阳极反应
• 2.火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能 远不能达到电气工业的要求,工业上常用电解精炼法将粗铜提纯。 在电解精炼时( ) • A.粗铜接电源负极 • B.纯铜做阴极 • C.杂质都将以单质形式沉积到池底 • D.纯铜片增重2.56 g,电路中通过电子为0.04 mol
解析: 由金属活动性顺序Zn>Cu>Ag>Au可知,首先
• [开放探究] 2.不考虑溶液中水的蒸发等损耗,电镀后,电解质 溶液的浓度有何变化? • 提示: 由于在相同时间内电镀池的阴、阳两极生成、消耗等量 的铜,故电解质溶液的浓度保持不变
• 1.在铁制品上镀一定厚度的锌层,以下方案设计合理的是( ) • A.锌做阳极,铁制品做阴极,溶液中含有锌离子 • B.铂做阴极,铁制品做阳极,溶液中含有锌离子 • C.铁做阳极,铁制品做阴极,溶液中含有亚铁离子 • D.锌做阴极,铁制品做阳极,溶液中含有锌离子 • 解析: 电镀时,镀层金属(或惰性电极材料)做阳极,镀件做阴 极,含镀层金属离子的盐溶液做电解质溶液。 • 答案: A
Fe―→Fe2++2e-、Ni―→Ni2++。2e-
• (2)阴极:
Cu2++2e-―→Cu 。
• 4.阳极泥 • 铜的电解精炼过程中,粗铜中
不如铜活泼金的属与其他不溶性
杂质混在一起沉积在电解池底部形成的物质。
化学选修化学反应原理各章知识点归纳整理

高二化学选修4化学反应原理知识点整理第一章化学反应与能量一、焓变反应热1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量 2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应(1)符号:△H (2)单位:kJ/mol3.产生原因:化学键断裂——吸热化学键形成——放热放出热量的化学反应。
(放热>吸热) △H 为“-”或△H <0吸收热量的化学反应。
(吸热>放热)△H 为“+”或△H >0☆常见的放热反应:①所有的燃烧反应②酸碱中和反应③大多数的化合反应④金属与酸的反应⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等☆常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl ②大多数的分解反应③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等二、热化学方程式书写化学方程式注意要点:①热化学方程式必须标出能量变化。
②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示)③热化学反应方程式要指明反应时的温度和压强(25 ℃,101 kPa时可以不注明)。
④热化学方程式中的化学计量数可以是整数,也可以是分数。
只能表示物质的量,不能表示分子个数。
⑤各物质化学计量数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变。
三、燃烧热1.概念:25 ℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
燃烧热的单位用kJ/mol表示。
※注意以下几点:①研究条件:101 kPa②反应程度:完全燃烧,产物是稳定的氧化物。
③燃烧物的物质的量:1 mol④研究内容:放出的热量。
(ΔH<0,单位kJ/mol)四、中和热1.概念:在稀溶液中,酸跟碱发生中和反应生成1mol H2O,这时的反应热叫中和热。
2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为:H+(aq) +OH-(aq) =H2O(l) ΔH=-57.3kJ/mol3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。
高中化学选修四第一章第二节燃烧热能源

12
二、中和热
1.定义:在稀溶液中,酸跟碱发生中和反应,生 成1mol水时的 反应热叫做中和热。
2. 中和热的表示: H+(aq)+OH-(aq)=H2O (1) △H=-57.3kJ/mol
3.要点: Ⅰ、条件:稀溶液。稀溶液是指溶于大量水的离子 Ⅱ、反应物: (强)酸与(强)碱。中和热不包括离子在水溶液 中的生成热、电解质电离的吸热所伴随的热效应 Ⅲ、生成1mol水。中和反应的实质是H+和OH-化合生成H20,若 反应过程中有其他物质生成,这部分反应热也不在中和热之内
44.6 mol×890 kJ/mol=3.97×104kJ
答:CH4的燃烧热为 890 kJ/mol,1000 L CH4(标准状况)完 全燃烧产生的热量为 3.97×104kJ。
.
9
【例2】 葡萄糖是人体所需能量的重要来源之一。葡萄糖 燃烧的热化学方程式为:
C6H12O6(s)+6O2(g)= 6CO2(g)+6H2O(l) ΔH=-2 800 kJ/mol
Ⅳ、放出的热量:57.3kJ/mol
.
13
例:已知H+(aq)+OH-(aq)=H2O(l); H=-57.3kJ/mol ,求下列中和反应中放出
的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反
应放出28__.7_____ kJ的热量。
(2)用28gKOH配稀溶液跟足量稀硝酸反应,
放出__2__8_._7kJ的热量。
4
▪ ⑤单位:kJ·mol-1。
▪ ⑥文字叙述燃烧热时,用“正值”或“ΔH” 表示。例如,CH4的燃烧热为890.3kJ·mol -1,或ΔH=-890.3kJ·mol-1。
最新人教版选修四第一章第二节 燃烧热 能源 教案

第二节 燃烧热 能源[学习目标定位] 1.正确认识燃烧热的概念,学会利用燃烧热进行相关的计算。
2.知道能源是人类生存和社会发展的重要基础,知道使用化石燃料的利弊和新能源的开发。
一 燃烧热1.反应热是化学反应过程中吸收或放出的热量,常用符号ΔH 表示。
燃烧反应都是放热反应,其反应热为负值。
已知4 g 硫粉完全燃烧放出37 kJ 热量,则该反应的热化学方程式是S(s)+O2(g)===SO2(g) ΔH =-296 kJ ·mol -1。
2.1.00 L 1.00 mol ·L -1 H2SO4溶液与2.00 L 1.00 mol ·L -1 NaOH 溶液完全反应,放出114.6 kJ 热量,该反应的中和热为57.3 kJ ·mol -1,表示其中和热的化学方程式是12H2SO4(aq)+NaOH(aq)===12Na2SO4(aq)+H2O(l) ΔH =-57.3 kJ ·mol -1。
3.已知2H2(g)+O2(g)===2H2O(l) ΔH =-571.6 kJ ·mol -1,该反应中ΔH 表示的意义是燃烧2 mol H2生成液态H2O ,放出571.6 kJ 的热量。
若燃烧1 mol 氢气生成液态水时的反应热为ΔH1, 生成气态水时的反应热为ΔH2,则ΔH1和ΔH2的大小关系是ΔH1<ΔH2;ΔH1=-285.8 kJ·mol-1,表示的意义是1 mol H2完全燃烧生成稳定的液态水,放出285.8 kJ的热量。
4.燃烧热的概念及其计算(1)燃烧热的概念是25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
燃烧热的单位是kJ·mol-1。
(2)燃烧热的意义:甲烷的燃烧热为890.31 kJ·mol-1,或ΔH=-890.31 kJ·mol-1,它表示25 ℃、101 kPa时,1 mol CH4完全燃烧生成CO2和液态H2O时放出890.31 kJ的热量。
高中化学鲁科版学选修4第一章 第2节 第1课时 电解的原理

电解原理 1.电解熔融 NaCl
(1)实验现象:通电后,在石墨片周围有 气泡 产生,在 铁片上生成 银白色金属 。
(2)实验分析:①熔融氯化钠中存在的微粒 Na+、 Cl-。 ②通电后离子的运动方向:阳离子 Na+(填离子符号)移向铁
则 Cu2+首先被还原生成铜:Cu2++2e-===Cu;Cl-、OH-应在阳极
发生氧化反应,由于还原性 Cl->OH-,Cl-首先被氧化生成氯气:
2Cl--2e-===Cl2↑,即阴极产物是铜,阳极产物是氯气。
1.电解池电极的判断
2.电解池的工作原理 接通外界电源后,电子从电源的负极沿导线流入电解池的阴 极,经过阴、阳离子的定向运动形成内电路,再从电解池的阳极 流出,并沿导线流回电源的正极,如图所示。
A.CuCl2(CuSO4)
B.NaOH(NaOH)
C.NaCl(HCl)
D.CuSO4[Cu(OH)2]
解析
解析: C 中电解 NaCl 溶液时 NaOH 仍留在原溶液中,H2、Cl2 逸 出,则损失了 H、Cl 两种元素,且物质的量之比是 1∶1,故加入 HCl 是正确的;A 中电解 CuCl2 溶液时,损失了 Cu 和 Cl 两种元素, 加入 CuSO4 不能弥补 Cl-,而多了 SO24-;B 中电解 NaOH 溶液时, 损失了 H、O 两种元素,若加入 NaOH 则增加了 Na;D 中电解 CuSO4 溶液时,损失了 Cu、O 两种元素,若加入 Cu(OH)2 则增加了 H2O。
化学选修四第一章 燃烧热 能源知识点

第二节燃烧热能源1、燃烧热(1)概念:在101 kPa时,1 mol纯物质完全燃烧生成稳定氧化物时所放出的热量,叫做该物质的燃烧热。
单位一般用kJ·mol-1(或kJ/mol)表示。
注意要点:○1反应条件:25℃,101KPa;○2反应程度:完全燃烧;○3反应物的量:燃烧物的物质的量:1mol;○4反应产物:素完全燃烧时对应的氧化物。
(2)意义:例如,C的燃烧热是393.5 kJ·mol-1,表示在25 ℃,101 kPa 条件下1 mol C完全燃烧放出393.5 kJ的热量。
(3)燃烧热热化学方程式的书写原则:燃烧热是以1mol物质完全燃烧所放出的热量来定义的,因此在书写它的热化学方程式时,应以1mol燃烧物质为标准来配平其余物质的化学计量数“五看”:○1看方程式是否配平;○2看各物质的聚集状态是否正确;○3看ΔH的“+”、“-”符号是否正确;○4看反应热的单位是否为kJ/mol;○5看反应热的数值与化学计量数是否对应。
(4)燃烧热的计算:Q放=n(可燃物)×|ΔH|(为可燃物燃烧反应所放出的热量,n为可燃物的物质的量,为可燃物的燃烧热)2、能源(1)概念:能源就是能提供能量的资源(2)发展阶段:柴草时期→化石能源时期→多能源结构时期(3)分类:○1一级能源:煤、石油、天然气;○2二级能源:煤气、电气、沼气、氢能、电能等;○3可再生能源:太阳能、水能、风能等;○4不可再生能源:煤、石油、天然气。
(4)能源问题:国目前使用的主要能源是化石燃料,它们的蕴藏量有限,而且不能再生,最终将会枯竭。
(5)解决能源问题的措施:○1提高能源的使用效率;○2开发新的能源。
【素材积累】1、只要心中有希望存摘,旧有幸福存摘。
预测未来的醉好方法,旧是创造未来。
坚志而勇为,谓之刚。
刚,生人之德也。
美好的生命应该充满期待、惊喜和感激。
人生的胜者决不会摘挫折面前失去勇气。
2、我一直知道,漫长人生中总有一段泥泞不得不走,总有一个寒冬不得不过。
(人教版)化学选修四思维导图:1-2燃烧热+能源(含答案)

第一章化学反应与能量第二节燃烧热能源【思维导图】【微试题】1.已知反应:①101 kPa时,2C(s)+O2(g)====2CO(g);ΔH=-221 kJ·mol-1②稀溶液中,H+(aq)+OH-====(aq)H2O(l);ΔH=-57.3 kJ·mol-1下列结论正确的是()A .碳的燃烧热大于110.5 kJ·mol -1B .①的反应热为221 kJ·mol -1C .稀硫酸与稀NaOH 溶液反应的中和热为-57.3 kJ·mol -1D .稀醋酸与稀NaOH 溶液反应生成1 mol 水,放出57.3 kJ 热量【答案】A2.25 ℃、101 kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol -1、285.8 kJ·mol -1、890.3 kJ·mol -1、2 800 kJ·mol -1,则下列热化学方程式正确的是()A .C(s)+21O 2(g)====CO(g);ΔH=-393.5 kJ·mol -1B .2H 2(g)+O 2(g)====2H 2O (g);ΔH=+571.6 kJ·mol -1C .CH 4(g)+2O 2(g )====CO 2(g)+2H 2O(g);ΔH=-890.3 kJ·mol -1D .21C 6H 12O 6(s)+3O 2(g)====3CO 2(g)+3H 2O(l);ΔH=-1 400 kJ·mol -1【答案】D3.(2013高考∙全国Ⅱ卷∙12)在1200℃时,天然气脱硫工艺中会发生下列反应H2S(g)+ 3/2O2(g)=SO2(g)+H2O(g) △H12H2S(g)+ SO2(g)=3/2S2(g)+2H2O(g) △H2H2S(g)+ 1/2O2(g)=S(g)+H2O(g) △H32S(g)=S2(g) △H4则△H4的正确表达式为()A.△H4=2/3(△H1+△H2-3△H3) B.△H4=2/3(3△H3-△H1-△H2) C.△H4=3/2(△H1+△H2-3△H3) D.△H4=3/2(△H1-△H2-3△H3) 【答案】D4.氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:(1)氮元素原子的L层电子数为;(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为;(3)肼可作为火箭发动机的燃料,与氧化剂N2H4反应生成N2和水蒸气。
化学:第一章《化学反应与能量》全章课件(人教选修4)

4.把温度计和环形玻璃搅拌棒放入小烧杯的 盐酸中,并把量筒中的NaOH溶液一次倒入小 烧杯(注意不要洒到外面)。用环形玻璃搅 拌棒轻轻搅动溶液,并准确读取混合溶液的 最高温度,记为终止温度,记入下表。
思考5:酸、碱混合时,为何要把量筒中的 NaOH溶液一次倒入小烧杯而不能缓缓倒入?
答:因为本实验的关键是测反应的反应热,若 动作迟缓,将会使热量损失而使误差增大。
作业: 课本P6 3-(2,3,5,6)、4 [课外作业] 1、预习课本下一小节的内容 2、课外查阅我国能源结构和状况。
一、燃烧热 二、能源
一、燃烧热
1、定义
25℃,101kPa时,1mol纯物质完全燃烧生成稳定的氧 化物时所放出的热量,叫做该物质的燃烧热。
2、单位 3、注意 kJ/mol
指定产物通常规定为:它是指物质中的下列元素
⑵ 一定标明各物质的状态(s、l、g、aq) ;
⑶ ΔH只放右边,以空格与标有物质状态的化学方程 式隔开(数值及单位) 放热: ΔH < 0; 吸热: ΔH > 0; ⑷ 系数仅仅表示物质的量,不表示分子或原子个数; 故系数可以是整数、分数、小数;
⑸ΔH的值与系数相匹配。 系数加倍,ΔH值也加倍。 正逆反应的ΔH绝对值相等,符号相反。 ⑹ 反应物完全变成生成物,所释放或吸收的热量。
H2 + I2 == 2HI
只表示物质变化
【例1】 在200℃、101kPa时,1 mol H2与碘蒸气作用生 成HI的反应,科学文献上表示为:
H2(g) + I2 (g) ==== 2HI(g) ΔH =
101kPa
200℃
-14.9 kJ/mol
二、热化学方程式
1、定义
ห้องสมุดไป่ตู้
高中化学选修四第一章燃烧热 能源知识点

第二节燃烧热能源大地二中张清泉一、燃烧热1、概念:25℃,101KPa时,1mol纯物质完全燃烧生成稳定的化合物时放出的热量,单位用kJ/mol表示。
2、注意要点:○1反应条件:25℃,101KPa;○2反应程度:完全燃烧;○3反应物的量:燃烧物的物质的量:1mol。
○4反应产物:元素完全燃烧时对应的氧化物3、燃烧热热化学方程式的书写原则:燃烧热是以1mol物质完全燃烧所放出的热量来定义的,因此在书写它的热化学方程式时,应以1mol燃烧物质为标准来配平其余物质的化学计量数3、燃烧热的计算:=n(可燃物)(为可燃物燃烧反应所放出的热量,n为可燃物的物质的量,为可燃物的燃烧热)【习题一】(2017秋•武昌区期中)下列关于燃烧热的说法正确的是()A.燃烧反应放出的热量就是该反应的燃烧热B.1 mol可燃物质发生氧化反应所放出的热量就是燃烧热C.1 mol可燃物质完全燃烧生成稳定的化合物时所放出的热量就是燃烧热D.在25℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量是燃烧热【考点】燃烧热.【专题】燃烧热的计算.【分析】燃烧热的条件是在25℃、1.01×105Pa下,必须是1mol物质完全燃烧并且生成的物质为最稳当的氧化物,燃烧热的热化学方式的计量系数必须是1,燃烧是发光发热的剧烈的氧化还原反应,不一定有氧气参加,据此解答.【解答】解:A.燃烧热必须是可燃物质完全燃烧生成稳定的氧化物放出的热量,故A错误;B.1 mol可燃物质发生氧化反应生成最稳当的氧化物所放出的热量就是燃烧热,故B错误;C.25℃、1.01×105Pa下,必须是1mol物质完全燃烧并且生成的物质为最稳当的氧化物时所放出的热量,故C错误;D.25℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量是燃烧热,故D正确;故选:D。
【习题二】(2016秋•朝阳区校级期末)已知H2的燃烧热是akJ/mol,由H2、CO按3:1比例组成的混合物2mo,完全燃烧并恢复常温吋,放出的热量为bkJ,则CO的燃烧热为(kJ/mol)为()A.2b-3a B.3a-2b C. D.【考点】燃烧热.【专题】化学反应中的能量变化.【分析】设CO的燃烧热为xkJ•mol-1,又H2的燃烧热是akJ/mol,所以由H2、CO按3:1比例组成的混合物2mol,完全燃烧并恢复到常温吋,放出的热量为bkJ,可得,据此计算.【解答】解:设CO的燃烧热为xkJ•mol-1,又H2的燃烧热是akJ/mol,所以由H2、CO按3:1比例组成的混合2mol,完全烧并恢复到常温吋,放出的热量为bkJ,可得,则解得x=2b-3a,故选:A。
(人教)高二化学选修4课件:1.1.2中和反应反应热的测定

案例探究 思悟升华
自主预习 合作探究 触类旁通
中和反应的反应热(ΔH)测定结果往往偏高的可能原因 (1)用大小两个烧杯组装量热器时,两个烧杯不相平、纸板孔偏大、搅拌不均匀 等都可导致结果(ΔH)偏高。 (2)倒入NaOH溶液不够快,使热量有损失。 (3)仪器保温性能差。 (4)忽略了仪器所吸收的热量。 (5)酸、碱溶液的比热容、密度均比水的大,但计算时近似按水的进行计算。
。
一二
自主预习 合作探究 触类旁通
知识精要 思考探究 典题例解 迁移应用
解析:(1)对于本实验,让氢氧化钠和盐酸尽可能地完全反应是减小误差的一个 方面,所以实验时用环形玻璃搅拌棒上下搅动(以防将温度计损坏);做好保温工作 是减小误差的另一个重要方面,而选用铜丝搅拌棒会散热较快,热量损失多。
(2)ΔH=-[100 g×4.18×10-3 kJ·(g·℃)-1×3.4 ℃]÷0.025 mol≈-56.8 kJ·mol-1。 (3)因为弱电解质的电离过程是吸热的,将NaOH溶液改为相同体积、相同浓度 的氨水后反应放出的热量减少,所以ΔH1>ΔH。 答案:(1)上下搅动 铜传热快,热量损失大 (2)-56.8 kJ·mol-1 (3)> NH3·H2O电离吸热
下图所示装置进行测定中和热的实验,得到下表中的数据:
完成下列问题:
实验次数
起始温度 t1/℃ 盐酸 NaOH 溶液
终止温度
t2/℃
1
20.2 20.3
23.7
2
20.3 20.5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
教师姓名廖伟东学生姓名张旖苇填写时间年级高一学科化学上课时间阶段基础(√)提高()强化()课时计划第()次课共()次课教学目标1、理解燃烧热的概念2、区别燃烧热与焓变的关系3、掌握有关燃烧热的计算重难点1、燃烧热的概念2、燃烧热与焓变有的关系3、有关燃烧热的计算课后作业:教师评语及建议:科组长签字:燃烧热能源一、燃烧热⑴定义:在101..燃烧生成稳定..的氧化物时所放出的热量...某物质完全...kP..a.时,1.mol如C完全燃烧应生成CO2(g),而生成CO(g)属于不完全燃烧。
又如H2燃烧生成液态H2O,而不是气态水蒸气。
(2)注:①燃烧热通常是由实验测得的。
②可燃物以1mol作为标准进行测量。
③计算燃烧热时,热化学方程式常以分数表示。
例题分析1、CH4(g)+2O2 (g)=CO2 (g)+2H2O (l) ΔH= -890.31kJ/mol,甲烷的燃烧热是多少?答案:甲烷的燃烧热是890.31kJ/mol2、已知:2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=-11036kJ/mol,则C8H18的燃烧热是多少?3、下列热化学方程式中,表示25℃时燃烧热的是( )A.C(s)+O2(g)=CO(g); ΔH= -110.5 kJ/molB.C(s)+O2(g)=CO2(g); ΔH= -393.5 kJ/molC.2H2(g)+O2(g)=2H2O(l); ΔH= -571.6 kJ/molD.H2(g)+1/2O2(g)=H2O(g); ΔH= -241.8 kJ/molE. H2(g)+1/2O2(g)=H2O(l); ΔH= -285.8kJ/mol二、.注意事项:①研究条件:25℃,101 kPa 。
在未说明时,一般指25℃、101 kPa。
②燃烧物的量:1mol(纯物质)。
因此其它物质的计量数常出现分数。
③完全燃烧:指最终生成稳定化合物。
如: C→CO2(g) 、H → H2O(l)、S → SO2(g)、④燃烧一定放热,所以ΔH<0;而某物质的燃烧热则是××KJ/mol,无“—”号。
2、中和热1)定义:在稀溶液中,酸跟碱发生中和反应,生成1mol水时的反应热叫做中和热。
2)中和热的表示:H+(aq)+OH-(aq)=H2O (l);△H=-57.3kJ/mol。
3)要点①条件:稀溶液。
稀溶液是指溶于大量水的离子。
②反应物:(强)酸与(强)碱。
中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应。
③生成1mol水,中和反应的实质是H+和OH-化合生成 H20,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
④放出的热量:57.3kJ/mol燃烧热中和热相同点能量变化放热反应△H △H<0,单位:kJ/mol不相同点反应条件101kPa 在稀溶液中反应物的量1mol(O2的量不限) 可能是1mol,也可能是0.5mol 生成物的量不限量H2O是1mol反应热的含义1mol反应物完全燃烧时放出的热量;不同反应物燃烧热也不同。
生成1molH2O时放出的热量;不同反应物的中和热大致相同,均约为57.3kJ/mol。
变式:已知H+(aq)+OH-(aq)=H2O(l);△ H=-57.3kJ/mol ,求下列中和反应中放出的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反应放出____________ kJ的热量。
(2)用2molH2SO4配稀溶液跟足量稀NaOH反应,放出____________kJ的热量。
例题分析有关燃烧热的计算1、在101 kPa时,1 mol CH4完全燃烧生成CO2和液态水,放出890.3 kJ的热量,CH4的燃烧热为多少?112 L CH4(标准状况)燃烧后所产生的热量为多少?答案:CH4(g)+2O2 (g) =CO2 (g) +2H2O (l) ΔH= -890.3kJ/mol所以CH4的燃烧热为890.3kJ/mol。
n(CH4)=112L/22.4L·mol-1=5mol产生的热量为:5mol×890.3KJ/mol=4451.5KJ变式:1、已知下列两个热化学方程式:2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ•mol-1C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2220 kJ•mol-1(1)H2的燃烧热为______________,C3H8的燃烧热为______________(2)2gH2和2mol C3H8组成的混合气体完全燃烧放出的热量为____________ (3)现有H2和C3H8的混合气体5 mol,完全燃烧时放出热量3847 kJ,则混合气体中H2和C3H8的体积比为____________三、燃烧热与焓变有何关系?①焓变范围广,包括 中和热、燃烧热、溶解热 等,燃烧热只是 焓变 的一种形式;②焓变有 吸热与放热 之分,而燃烧一定 放热 , 其 △H < 0 。
变式1、已知:H +(aq)+OH -(aq)=H 2O(l) △ H= -57.3 KJ/mol分别向NaOH 溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应的热效应分别为 △H 1 、△H 2 、△H 3则三者的大小关系为( )2、已知热化学方程式:C(s) +21O 2(g) = CO(g) △H=-110.5kJ/mol C(s) + O 2(g) = CO 2 (g) △H=-393.5kJ/mol 现有80t 纯碳不完全燃烧,所得气体中CO 占3/4体积,与80t 纯碳完全燃烧相比较,此反应损失了多少热量?3葡萄糖是人体所需能量的重要来源之一。
葡萄糖燃烧的热化学方程式为:C 6H 12O 6(s )+6O 2(g )===6CO 2(g )+6H 2O (l ) ΔH =-2 800 kJ/mol 葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。
计算100 g 葡萄糖在人体中完全氧化时所产生的热量。
第二节练习一、选择题1.下列各组物质的燃烧热相等的是()A.碳和二氧化碳B.1 mol碳和3 mol碳C.3 mol C2H2和1 mol C6H6D.淀粉和纤维素2.目前世界上最重要的气体矿物燃料是()A.石油B.煤气C.水煤气D.天然气3.下列热化学方程式书写正确的是(ΔH的绝对值均正确)()A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1367.0 kJ/mol(燃烧热)B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ/mol(中和热)C.S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ/mol(反应热)D.2NO2===O2+2NOΔH=+116.2 kJ/mol(反应热)4.下列能源组合中,均属于新能源的一组是()①天然气;②煤;③核能;④石油;⑤太阳能;⑥生物质能;⑦风能;⑧氢能.A.①②③④B.①⑤⑥⑦⑧C.③④⑤⑥⑦⑧D.③⑤⑥⑦⑧5.下列说法正确的是()A.在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热B.酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热C.燃烧热或中和热是反应热的种类之一D.在25℃、101 kPa时,纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热6已知25℃、101 kPa 时,乙烯和乙炔(C 2H 2)燃烧的热化学方程式分别为 C 2H 4(g)+3O 2(g)===2CO 2(g)+2H 2O(l) ΔH =-1411 kJ/mol 2C 2H 2(g)+5O 2(g)===4CO 2(g)+2H 2O(l) ΔH =-2600 kJ/mol 又知燃烧时火焰的温度乙炔高于乙烯.据此,下列说法不.正确的是( ) A .物质的燃烧热越大,火焰温度越高B .相同条件下等体积乙烯和乙炔完全燃烧时,乙炔放热较少C .25℃、101 kPa 时,1 mol 乙烯完全燃烧生成气态产物时,放出的热量小于1411 kJD .乙烷(C 2H 6)的燃烧热>1 411 kJ/mol7.已知强酸和强碱在稀溶液中发生反应时的中和热为57.3 kJ/mol,101 kPa 时辛烷的燃烧热为5518 kJ/mol.则下列热化学方程式书写正确的是( )A .H ++OH -===H 2O ΔH =-57.3 kJ/mol B .2NaOH(aq)+H 2SO 4(aq)===Na 2SO 4(aq)+2H 2O(l) ΔH =-114.6 kJ/mol C .2C 8H 18(l)+25O 2(g)===16CO 2(g)+18H 2O(g) ΔH =-11036 kJ/mol D .2C 8H 18(l)+25O 2(g)===16CO 2(g)+18H 2O(l) ΔH =-11036 kJ/mol8.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是 ①CH 3OH(g)+H 2O(g)===CO 2(g)+3H 2(g) ΔH =+49.0 kJ/mol②CH 3OH(g)+12O 2(g)===CO 2(g)+2H 2(g)ΔH =-192.9 kJ/mol 下列说法正确的是( )A .CH 3OH 的燃烧热为192.9 kJ/molB .反应①中的能量变化如图所示C .CH 3OH 转变成H 2的过程一定要吸收能量D .根据②推知反应:CH 3OH(l)+12O 2(g)===CO 2(g)+2H 2(g)的ΔH >-192.9 kJ/mol二、非选择题9.由氢气和氧气反应生成 1 mol 水蒸气放热241.8 kJ ,写出该反应的热化学方程式:___________________ _.若1 g 水蒸气转化成液态水放热2.444 kJ ,则反应2H 2(g)+O 2(g)===2H 2O(l)的ΔH =_____ kJ/mol ,氢气的燃烧热为__________ kJ/mol.10.(1)1.00 L 1.00 mol/L H2SO4溶液与2.00 L 1.00 mol/L NaOH溶液完全反应,放出114.6 kJ热量,该反应的中和热为________,表示其中和热的热化学方程_________________________________ (2)在25℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的燃烧热为______ kJ/mol,该反应的热化学方程式_____________________________________13.已知一些烷烃的燃烧热如下表:化合物燃烧热(kJ/mol) 化合物燃烧热(kJ/mol)甲烷891.0 正丁烷 2 878.0乙烷 1 560.8 异丁烷 2 869.6丙烷 2 221.5 异戊烷 3 531.3(1)热稳定性:正丁烷________(填“>”或“<”)异丁烷.(2)写出表示乙烷燃烧热的热化学方程式______________________________________(3)相同物质的量的烷烃,碳原子数越多,燃烧放出的热量越________(填“多”或“少”).(4)有同学估计“正戊烷的燃烧热大约在3 540 kJ/mol左右”.你认为正确吗?________.(5)理由是_____________________________________________________________________。
