原料药批生产记录模板
原料药批生产记录模板

********有限公司****批生产记录
品名:
规格:
批号:
理论产量:
成品数:
成品率:
生产日期:
生产部审阅:
质管部审阅:
目录
批生产指令单
开工前现场检查表
检查日期:年月日
生产管理员:QA检查员:
***** 岗位生产记录(三)
***** 岗位生产记录(四)
原料药一般生产区岗位清场记录
生产管理员:QA检查:
***** 岗位生产记录(一)
***** 岗位生产记录(二)
***** 岗位生产记录(三)
原料药一般生产区岗位清场记录
生产管理员:QA检查:
***** 岗位生产记录(一)
原料药一般生产区岗位清场记录
生产管理员:QA检查:
***** 干燥岗位生产记录
原料药洁净区岗位清场记录
生产管理员:QA检查:
批包装指令单
可编辑
***** 粉碎过筛岗位生产记录
原料药洁净区岗位清场记录
生产管理员:QA检查:
可编辑
***** 混合包装岗位生产记录(一)
***** 混合包装岗位生产记录(二)
原料药洁净区岗位清场记录
生产管理员:QA检查:
原料药包装岗位清场记录
生产管理员:QA检查:
***** 批生产汇总表
生产管理员:QA检查员:
产品生产检验报告单记录表
日期:年月日
生产管理员:QA检查员:
***** 关键岗位工艺查证记录(一)
生产管理员:QA检查员:
生产管理员:QA检查员:
批生产记录部门审核表
日期:年月日
可编辑
精品。
批生产记录模板

批生产记录模板1. 引言本文档为批生产记录模板,用于记录生产过程中的关键信息和操作步骤,以确保生产过程的可追溯性和一致性。
批生产记录是生产过程中的重要记录,对于质量管理和监督具有重要意义。
2. 批生产记录表格模板序号日期产品批号生产线生产工艺操作员审核员1 yyyy-mm-dd 这里填写产品批号这里填写生产线信息这里填写生产工艺信息这里填写操作员姓名这里填写审核员姓名2 yyyy-mm-dd 这里填写产品批号这里填写生产线信息这里填写生产工艺信息这里填写操作员姓名这里填写审核员姓名…………………3. 批生产记录的内容3.1 生产信息记录包括生产日期、产品批号、生产线、生产工艺等关键信息。
3.2 原料使用记录记录使用的原料的名称、批号、用量等信息,确保生产过程中使用正确的原料。
3.3 设备操作记录记录设备的启动、调整和停机过程,包括设备编号、操作员、操作时间等信息。
3.4 生产操作记录记录生产过程中的关键操作步骤,包括操作员、操作时间、操作内容等信息。
例如:•准备生产原料•混合原料•注入容器•运输产品•包装产品3.5 质量控制记录记录生产过程中的质量控制操作和结果,包括原料检验、产品检验等。
确保产品达到质量标准。
3.6 清洁和消毒记录记录清洁和消毒操作,确保生产环境符合卫生要求。
3.7 销售和分发记录记录产品的销售和分发情况,包括销售日期、销售数量、销售对象等信息。
4. 批生产记录的保存和归档完成生产后,批生产记录应按照规定的归档程序进行保存,确保可追溯性和安全性。
5. 批生产记录的审批和验证批生产记录应经过相应部门的审批和验证,确保内容真实可信。
6. 总结批生产记录是生产过程中的重要记录,对于质量管理和监督具有重要意义。
使用本文档的批生产记录模板可以有效地规范和记录生产过程中的关键信息和操作步骤,保证生产的可追溯性和一致性。
在进行生产过程中,请根据实际情况填写各项信息,并按照归档程序进行保存。
药品生产片剂批生产记录(全套完整版)

XXXX制药有限公司
XXXX片批生产记录
产品批号:
生产日期:
有效期至:
包装规格:
投料总数:
成品数量:
XXXX制药有限公司XXXX片批生产记录总汇
XXXX片批生产记录,第2页
XXXX制药有限公司
XXXX制药有限公司岗位清场记录
XXXX制药有限公司
XXXX片批生产记录,第5页
XXXX制药有限公司岗位清场记录
XXXX制药有限公司浓缩岗位生产记录
XXXX片批生产记录,第7页
XXXX制药有限公司岗位清场记录
XXXX制药有限公司矾沉岗位生产记录
XXXX片批生产记录,第9页
XXXX制药有限公司岗位清场记录
XXXX制药有限公司
XXXX片批生产记录,第11页
XXXX制药有限公司岗位清场记录
XXXX制药有限公司粉碎岗位生产记录
XXXX制药有限公司岗位清场记录
XXXX制药有限公司配料称量记录
XXXX制药有限公司
配料、混合、制粒记录
XXXX制药有限公司干燥岗位生产记录
XXXX制药有限公司
整粒、总混记录
XXXX制药有限公司岗位清场记录
XXXX制药有限公司
XXXX制药有限公司岗位清场记录
岗位清场记录
内包装(瓶装)记录
岗位清场记录
XXXX制药有限公司
铝塑包装记录
岗位清场记录
XXXX制药有限公司
外包装岗位操作记录
XXXX制药有限公司
岗位清场记录
XXXX片批生产记录,第31页。
原料药批生产记录模板示例

原料药批生产记录模板示例1. 批次信息* 批号:* 生产日期:* 有效期至:2. 原料药信息* 原料名称:* 生产厂家:* 生产日期:* 到货日期:* 供应商:* 批号:* 数量:* 级别:* 备注:3. 生产记录3.1 制备原料药* 配方名称:* 配方号:* 原料名称:* 批号:* 规格:* 生产日期:* 到货日期:* 供应商:* 用量:* 是否符合要求:* 生产人员:* 备注:3.2 加工步骤* 步骤号:* 步骤描述:* 环境温度:* 环境湿度:* 操作人员:* 质量检查结果:* 备注:3.3 灭菌/并装* 部件名称:* 批次号:* 灭菌日期:* 灭菌设备:* 灭菌时间:* 灭菌温度:* 灭菌压力:* 包装日期:* 包装人员:* 包装数量:* 包装规格:* 包装方式:* 装箱数量:* 检查结果:* 备注:4. 检测结果4.1 物理指标* 检测项目:* 检测结果:* 单位:* 检测人员:* 备注:4.2 化学指标* 检测项目:* 检测结果:* 单位:* 检测人员:* 备注:4.3 微生物学指标* 检测项目:* 检测结果:* 单位:* 检测人员:* 备注:5. 存储条件* 温度:* 湿度:* 存放位置:* 存放方式:* 包装状态:* 备注:6. 质量记录* 样品编号:* 检测日期:* 检测项目:* 检测结果:* 备注:以上是原料药批生产记录模板示例,根据自身生产情况的需求进行实际操作和调整。
片剂批生产记录表格模板

片剂批生产记录
产品名称
批号
成品量
生产周期:车间审核意见
规格
理论量
包装规格
********有限公司
月日至年月
审核人审核日期
日期
领料人
领料单
保管人
批生产指令单
起草人审核人接收人
称量配料岗位生产记录
年月曰
物料核对记录年月曰
清场记录
年月曰
原产品名称: 批 号: 调换产品名称: 批 号: 清场人: 质监员:
清场日期:年月日时 有效期至:年月日时
备注
清场人:
质监员:
清场合格证(正本)
M-J
>
岗
位:
称量配料
粉碎岗位生产记录
产品名称生产日期规格
清场记录
年月日
混合制粒干燥岗位生产记录
年月曰产品名称规格
清场记录
年月曰
整理总混岗位生产记录
年月曰
清场记录
年月曰
清场人:质监员:
填充装囊岗位生产记录
年月日
清场记录
年月日
领料单
保管人:
退料单
日期:年月日
退料人:
塑瓶内包装岗位生产记录
年月日
清场记录
年月日。
新版GMP批生产记录模板

目的:建立阿胶补血口服液批生产记录,用于追溯每批产品的生产历史以及与质量有关的情况。
范围:适用于阿胶补血口服液生产全过程。
责任:生产部、质量保证部、制剂车间。
内容:1生产处方依据:注册批件:湖南省食品药品监督管理局药品再注册批件(批件号:2009R000033)。
执行标准:《中国药典》2010年版一部P790。
2生产处方和制法:【处方】阿胶62.5g 熟地黄125g 党参125g黄芪62.5g 枸杞子62.5g 白术62.5g【制法】以上六味,熟地黄加水煎煮三次,第一次2小时,第二、三次每次1.5小时,煎液滤过,滤液合并,静置,取上清液,备用;白术、枸杞子用60%乙醇作溶剂,党参、黄芪用25%乙醇作溶剂,浸渍,渗漉,收集渗漉液,静置,滤过,滤液回收乙醇并浓缩至适量,备用;阿胶加水适量,加热使溶化,滤过,滤液与上述浓缩液及熟地黄提取液混合,滤过,加苯甲酸钠3g或山梨酸2g及矫味剂适量,加热至沸,加水至1000ml,混匀,即得。
阿胶补血口服液提取生产操作记录生产批号:T-药圣堂(湖南)制药有限公司提取批生产指令熟地黄提取液煎煮生产操作记录述熟地黄(400kg)加水煎煮三次,第一次加约1600Kg饮用水,加热至沸腾,煎煮2小时;第二次加约1200Kg饮用水,加热至沸腾,煎煮1.5小时;第三次加约1000Kg饮用水,加热至沸腾,煎煮1.5小时,熟地黄提取液浓缩收膏生产操作记录度:18~26℃;湿度:45~65%)进行收膏,盛装于洁净的不锈钢桶内,QA员同时进行取样送检,称重醇提渗漉液渗漉生产操作记录用60%乙醇作溶剂,党参、黄芪用25%乙醇作溶剂。
先用3倍药材量指定浓度的乙醇浸渍约3小时,润透,再加1倍药材量指定浓度的乙醇,浸渍36小时后再用2倍药材量指定浓度的乙醇渗漉,收集渗漉液,工序负责人:QA员:工艺员:乙醇配制记录、渗漉速度监控记录枸杞子浸渍、渗漉共用60%乙醇约为药材总量的6倍量(约3600L);黄芪、党参浸渍、渗漉共用25%乙醇提渗漉液乙醇回收、浓缩生产操作记录1、工前检查:2、浓缩操作:严格执行“浓缩岗位标准操作规程”等有关文件。
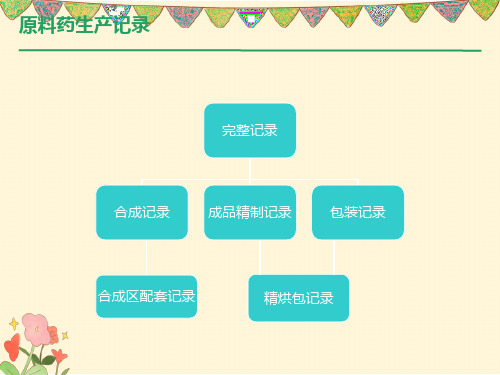
原料药生产记录
填写生产中遇到一些生产或设备运转异常情况及处理方法,并要有操作人签字,没有异常就划“/” (有异常写偏差)
清场检查记录 6.特殊问题或异常 事件记录
合成、成品精制记录
生产操作记录
生产操作记录中的内容是根据工艺规程按步骤编定的,操作记录针对操作内容主要从时间、温度、数量、检测结果、收率等方面全面、准确地反映生产情况 。 例如( 1) 投料时:操作记录需填写投料时间、净重; 升温(降温)至保温反应nhr:要填写开始升温(降温)时间,此时的温度;中间保温反应较长的,根据工艺要求每间隔一段时间记录时间、温度;
合成、成品精制记录
2.称量记录 需有原料名称、批号、日期、毛重、余重、净重、操作者、复核者、 QA签字审核,备注,称量时首先检查秤是否调零,按投料的时间先后顺序填写,试剂级(或固体)可以一起称量并记录;液体需每桶称量并记录,以kg为单位保留小数点后一位,以g为单位保留到g,物料均按“先进先出”的顺序使用。记录中填写内容与上项相同时应重复抄写,不得用“…”或“同上”表示;不得留有空格,如无内容填写要用 “/”划掉。
具体如下:
合成、成品精制记录组成
合成、成品精制记录
封面(包含公司名称)
品名:写工艺上统一的名称,不得随意简写,若是成品应按现行标准写全称。
产品批号:原料药的合成和成品批号均由年-月-年流水号6位数组成,合成(中间体)批号中“月”按投料当月月份定,成品批号中“月”按收料当月月份定。成品返工批号在原批号后加2,合成返工批号在原批号后加-1、-02…..
精烘包记录
设备日志(精制釜、微粉机、离心机、烘箱、粉碎机) 每次生产使用上述这些设备时填写,主要操作内容是指XX产品精制或微粉等。
精烘包记录
批生产记录--模板

主要设备
胶塞清洗机(设备编号)、电子秤(设备编号)
计划产量
瓶
执行SOP
操作指令
记录
操作人
复核人
胶塞洗涤灭菌标准操作程序
全自动胶塞清洗机标准操作程序
准备(班组质检员执行):
1)确认岗位有效期内的《清场合格证》,并附批记录。
2)确认设备内、生产线、生产区内无上次生产遗留物品,无与生产无关的物品。
3)确认操作间相对A/B级区负压>10pa、
7)“自动上料”时将待清洗胶塞(<46000个)加入料斗。漂洗后QA人员取样检查洗涤胶塞的注射用水的可见异物及细菌内毒素应合格。
8)灭菌结束时,记录灭菌结束时间。
9)打印灭菌曲线,确认灭菌温度、时间应符合要求。
10)灭菌曲线签字后附在本记录后面。
11)通知灌装岗位灭菌结束时间。
12)允许卸料后QA人员取样检查胶塞外观应合格。
3)确认操作间相对A/B级区负压>10pa、
温度18~35℃、
相对湿度45~75%。
4)确认设备、器具在清洁有效期内。
5)确认注射用水、纯化水、电、压缩空气供应正常。
6)设备试运转正常。
7)洗瓶机及隧道烘箱挂“运行中”状态标志。
8)岗位挂“正在生产”状态标志。
:
□已进行
□已进行
Pa
℃
%
□确认
□确认
□正常
13)清洗100支供QA人员检查合格。
14)确认烘箱温度升到设定温度后,关闭网带。
15)开始连续清洗,西林瓶进入隧道烘箱进行干燥、灭菌和除热原。
16)每小时检查记录一次注射用水压力、循环水的温度和压力、压缩空气压力、洗灌间压差。
□确认
药品批生产记录(最新整理)
规格:
日期 时间
操
作
制粒前准备
代号: 批号:
步
骤
批量: 万粒 工序:制粒
生
产
记
录
—对作业场所、环境的检查
* 检查操作间温湿度、压差是否符合要求
□符合要求
* 检查工作区域是否有与本批生产无关的物品
□无
* 检查生产区域卫生是否符合要求
□符合要求
—对生产介质进行检查
* 纯化水 * 压缩空气
□正常 □正常
—对计量器具进行检查
拭与产品接触的部位
□清洁
* 检查搅拌桨、切碎刀是否正常运转
□正常
—清洁准备好的工器具,并用 75%的乙醇消毒
□已清洁□已消毒
□不符合要求 □有 □不符合要求
□不正常 □不正常
□不完好清洁□否 □不完好清洁
编号: □不正常 □不符合规定 □未擦拭 □不清洁 □不正常 □未清洁□未消毒
—替换状态标志
* 用生产许可证替换清场合格证 * 用正在运行标志替换已清洁标志
□已清洁 □已消毒 □未清洁 □未消毒
—对工作区域进行清洁
□已清洁
□未清洁
—对工器具、卫生洁具进行清洁、消毒,并按规定存放
□已清洁 □已消毒 □未清洁□未消毒
批生产记录
页号: 3/3
品名:胶囊 日期 时间
规格: 操
代号:
批号:
作
步
骤
—替换状态标志 * 用已清洁标志替换正在运行标志 * 用清场合格证替换生产许可证
* 检查操作间温湿度、压差是否符合要求
□符合要求
□不符合要求
* 检查工作区域是否有与本批生产无关的物品 □无
□有
* 检查生产区域卫生是否符合要求
原料药空白批生产记录 定稿 2

峨眉山天梁星制药有限公司
批生产记录
产品名称
包装规格
批号
批量
车间主任
生产日期:年月日
批生产记录目录
批生产指令
批包装指令
物料收领记录
产品名称:批号:
产品名称:批号:执行SOP:
产品名称:批号:
清场日期:年月日执行SOP:
设备名称:□设备名称:□设备名称:□操作间名称:
清场人:复核人:
QA现场监控员检查结果:QA现场监控员签名
年月日
产品名称:批号:执行SOP:水环泵操作SOP、喷射泵操作SOP、烘箱操作SOP等
产品名称:批号:
清场日期:年月日执行SOP:合成区清洁SO P及相关现行SO P
设备名称:□设备名称:□设备名称:□操作间名称:
清场人:复核人:
QA现场监控员检查结果:QA现场监控员签名
年月日
成品包装记录产品名称:批号:
生产日期:年月日理论量:
执行SOP:包装操作SOP
包装清场记录
产品名称:规格:批号:
清场时间:年月日执行SOP:洁净区清场SOP及相关现行SOP
操作间名称:设备名称:
清场人:复核人:
QA现场监控员检查结果:QA现场监控员签名
年月日。
药品生产技术《原料药批生产记录》

XXXXXX
X X X X X批生产记录
品名:
规格:
批号:
理论产量:
成品数:
成品率:
生产日期:
生产部审阅:
质管部审阅:
目录
生产管理员:QA检查员:XXXXXXXX岗位生产记录〔三〕
生产管理员:QA检查员:
原料药洁净区岗位清场记录
生产管理员:QA检查:
批包装指令单
日期:年月日
XXXXX粉碎过筛岗位生产记录
生产管理员:QA检查员:
原料药洁净区岗位清场记录
生产管理员:QA检查:
生产管理员:QA检查员:
生产管理员:QA检查员:
原料药洁净区岗位清场记录
生产管理员:QA检查:
原料药包装岗位清场记录
生产管理员:QA检查:
XXXXX批生产汇总表
生产管理员:
QA检查员:
产品生产检验报告单记录表
日期:年月
日
生产管理员:QA检查员:
XXXXX关键岗位工艺查证记录〔一〕
生产管理员:QA检查员:
XXXXX关键岗位工艺查证记录〔二〕
生产管理员:QA检查员:
生产管理员:QA检查员:
批生产记录部门审核表
日期:年月日
成品检验报告单
检验单号:
成品审核记录
XXXXXXXXXXXXXX RQA027-00
第
一
联
‥
生
产
部
第
二
联
‥
仓
库。
药品生产企业批生产记录

批生产(shēngchǎn)记录产品名称:规格:批号:投料量:入库数:生产(shēngchǎn)车间:******制药有限公司(yǒu xiàn ɡōnɡ sī)批生产指令编号(biān hào):SOR-SC001-00指令(zhǐlìng)号:号批包装指令编号(biān hào):SOR-SC002-00指令(zhǐlìng)号:号签 发 者:签发(qi ānf ā)日期:清 场 合 格 证正本(zh èngb ěn)清场合格证原辅料处理生产前确认(quèrèn)记录编号(biān hào):年月日班粉碎(fěn suì)、筛粉岗位生产记录编号(biān hào):SOP-SC301-00配料室配料生产前确认(quèrèn)记录编号(biān hào):年月日班配料(pèi liào)室配料记录编号(biān hào):SOP-SC302-00制粒生产前确认记录编号(biān hào):年月日班粘合剂(润湿剂)配制(pèizhì)记录编号(biān hào):SOP-SC307-00制粒生产记录编号(biān hào):SOP-SC303-00总混生产前确认记录编号(biān hào):年月日班总混合生产记录编号(biān hào):SOP-SC304-00压片生产(shēngchǎn)前确认记录编号(biān hào):年月日班压片岗位生产记录编号(biān hào):SOP-SC305-00包衣(bāo yī)生产前确认记录编号(biān hào):年月日班第1页,共3页编号(biān hào):SOP-SC306-00第2页,共3页编号(biān hào):SOP-SC306-00包衣岗位生产记录第3页,共3页编号(biān hào):SOP-SC306-00包衣浆液(jiāngyè)配制记录编号(biān hào):SOP-SC308-00称量记录中间(zhōng j iān)产品交接单(正本(z hèn g běn))编号(b iān hào):S O R-S C011-00中间(zhōng j iān)产品交接单(副本(fùběn))编号(b iān hào):S O R-S C011-00内包装生产前确认(quèrèn)记录编号(biān hào):年月日班内包装岗位生产记录编号(biān hào):SOP-SC312-00铝塑包装岗位生产记录编号(biān hào):SOP-SC31 -00外包装生产前确认记录编号(biān hào):年月日班外包装岗位生产记录编号(biān hào):SOP-SC313-00残次说明书、印字包装(bāozhuāng)销毁记录号(biānhào):SOR-SC007-00车间(chējiān)化验室检查记录合箱记录片剂生产过程监督(jiāndū)检查记录QA :年月日清场记录编号(biān hào):片剂(piàn jì)批生产记录汇总编号(biān hào):SOP-SC314-00车间主任:生产(shēngchǎn)技术部部长:内容总结。
药品批生产记录

批生产记录
药业有限公司
批生产记录
页号:1/2
批生产记录
页号:2/2
称量单
页号:1/1
批生产记录
页号:1/2
批生产记录
页号:2/2
批生产记录
页号:1/2
批生产记录
页号:2/2
批生产记录
页号:1/3
批生产记录
页号:2/3
批生产记录
页号:3/3
批生产记录
页号:1/3
批生产记录
页号:2/3
批生产记录
页号:3/3
充填中间控制记录
页号:1/3
充填中间控制记录
页号:2/3
充填中间控制记录
页号:3/3
批生产记录
页号:1/2
批生产记录
页号:2/2
批生产记录
页号:1/3
批生产记录
页号:2/3
批生产记录
页号:3/3
内包装中间控制记录
页号:1/2
内包装中间控制记录
页号:2/2
批生产记录
页号:1/3
批生产记录
页号:2/3
批生产记录
页号:3/3
外包装中间控制记录
外包装中间控制记录
附页
变更记载。
药品批生产记录

☆★☆★☆批生产记录产品名称:规格:代号:制定人:制定日期:年月日审核人:审核日期:年月日审核人:审核日期:年月日批准人:批准日期:年月日文件编号:生效日期:年月日产品批号:批量:车间QA☆★☆★☆药业有限公司批生产记录页号:1/2品名:胶囊规格:代号:批号:批量:万粒工序:称量文件编号:日期时间操作步骤生产记录操作人复核人称量前准备—对作业场所、环境的检查* 检查操作间温湿度、压差是否符合要求□ 是□ 否* 检查工作区域是否有与本批生产无关的物品□ 无□ 有* 检查生产区域卫生是否符合要求□ 符合要求□ 不符合要求—对电子台秤进行检查* 检查是否完好清洁待用□ 完好清洁□ 不完好清洁* 检查是否在其检验有效期内□ 是□ 否—检查生产所需物料是否备齐* 批生产指令单中的物料□ 已备齐□ 未备齐—清洁准备好的工器具,并用75%的乙醇消毒□ 已清洁□ 已消毒□ 未清洁□ 未消毒—替换状态标志* 用生产许可证替换清场合格证□ 已替换□ 未替换称量开始1.检查称量所用物料的品名、代号、批号、性状及检验报告应无□ 无偏差□ 有偏差〔见偏差或备注〕偏差☆★☆★☆* 检查应能过 100 目筛网□ 符合规定□ 不符合规定* 检查低取代羟丙基纤维素应能过80 目筛网□ 符合规定□ 不符合规定* 检查微晶纤维素应能过80 目筛网□ 符合规定□ 不符合规定* 检查淀粉应能过80 目筛网□ 符合规定□ 不符合规定* 检查滑石粉应能过80 目筛网□ 符合规定□ 不符合规定* 检查碳酸氢钠应能过80 目筛网□ 符合规定□ 不符合规定批生产记录页号:2/2品名:胶囊规格:代号:批号:批量:万粒工序:称量文件编号:日期时间操作步骤生产记录操作人复核人* 检查硬脂酸镁应能过80 目筛网□ 符合规定□不符合规定2.按批生产指令单对原辅料进行称量配料见称量单称量结束清场—去除现场与本批生产有关的物品□ 已去除□未去除—对计量器具进行清洁,并用75%的乙醇消毒* 电子台秤□ 已清洁□ 已消毒□未清洁□ 未消毒—对工作区域进行清洁□ 已清洁□未清洁—对工器具、卫生洁具进行清洁、消毒,并按规定存放□ 已清洁□ 已消毒□未清洁□ 未消毒□ 已定置□未定置—替换状态标志* 用清场合格证替换生产许可证□ 已替换□未替换—检查 BPR 的完整性,有关凭证应已附到BPR 上□ 完整□不完整☆★☆★☆备注:称量单页号: 1/1品名:胶囊规格:代号:批号:批量:万粒工序:称量文件编号:代号品名处方量分度值批号检验证号称量数量称量人复核人复核数量核对人复核人备注料次:第一料4213kg kg4237低取代羟丙基纤维素kg kg4241微晶纤维素kg kg4204淀粉kg kg料次:第二料4213kg kg4237低取代羟丙基纤维素kg kg4241微晶纤维素kg kg☆★☆★☆4204淀粉kg kg料次:第三料4213kg kg4237低取代羟丙基纤维素kg kg4241微晶纤维素kg kg4204淀粉kg kg外加辅料4210滑石粉kg kg4252碳酸氢钠kg kg4207硬脂酸镁kg kgQA :备注:批生产记录页号:1/2品名:胶囊规格:代号:批号:批量:万粒工序:制粒文件编号:日期时间操作步骤生产记录操作人复核人制粒前准备—对作业场所、环境的检查* 检查操作间温湿度、压差是否符合要求□ 符合要求□ 不符合要求* 检查工作区域是否有与本批生产无关的物品□无□ 有* 检查生产区域卫生是否符合要求□ 符合要求□ 不符合要求☆★☆★☆—对生产介质进行检查* 纯化水□ 正常□ 不正常* 压缩空气□ 正常□ 不正常—对计量器具进行检查* 电子台秤是否完好清洁待用,是否在其检验有效期内□ 完好清洁□ 是□ 不完好清洁□ 否* 检查酒精计是否完好清洁待用□ 完好清洁□ 不完好清洁—对湿法混合颗粒机进行检查设备型号: SHK-220B编号:* 检查搅拌桨、切碎刀中心部位的进气气流是否正常□ 正常□ 不正常* 调节流量计控制进气气流〔气压P 应大于 0.5MPa 〕□ 符合规定□ 不符合规定* 检查设备是否清洁,并用浸润75%乙醇的洁净抹布擦□ 已擦拭□ 未擦拭拭与产品接触的部位□ 清洁□ 不清洁* 检查搅拌桨、切碎刀是否正常运转□ 正常□ 不正常—清洁准备好的工器具,并用75%的乙醇消毒□ 已清洁□ 已消毒□ 未清洁□ 未消毒—替换状态标志* 用生产许可证替换清场合格证□ 已替换□ 未替换* 用正在运行标志替换已清洁标志□ 已替换□ 未替换批生产记录页号:2/2品名:胶囊规格:代号:批号:批量:万粒工序:制粒文件编号:日期时间操作步骤生产记录操作人复核人制粒开始1.按批生产指令单领取称量好的制粒用原辅料,核对品□ 无偏差□ 有偏差名、代号、批号、数量应无偏差☆★☆★☆2.向 95%的乙醇中参加适量纯化水,制备50%的乙醇水见粘合剂配制记录溶液〔量具:酒精计〕3.关闭湿法混合颗粒机出料活塞;待门信号灯亮后,翻开第一锅第二锅第三锅物料锅盖,将、低取代羟丙基纤维素、微晶纤维素、淀混合时间粉倒入锅内;关闭物料锅盖,调整时间继电器为240 秒,秒秒秒开始搅拌混合4.将制备好的50%乙醇水溶液均匀洒入湿法混合颗粒机原辅料中,按下“启动〞按钮,混合搅拌 120-240 秒,混合搅拌过程中切碎 60-180 秒制成适宜湿颗粒,要求颗粒能够到达“捏之成团,一弹那么散〞制粒结束—检查 BPR 的完整性备注:第一锅第二锅Ⅰ速Ⅱ速Ⅰ速Ⅱ速搅拌时间秒秒秒秒切碎时间秒秒秒秒粘合剂用量kg kg 搅拌电流A A第三锅Ⅰ速Ⅱ 速搅拌时间秒秒粘合剂用量kg 切碎时间秒秒搅拌电流A 粘合剂实际总用量:kg□ 完整□不完整批生产记录页号:1/2☆★☆★☆品名:胶囊规格:代号:批号:批量:万粒工序:枯燥整粒文件编号:日期时间操作步骤生产记录操作人复核人枯燥整粒前准备—对作业场所、环境的检查* 检查操作间温湿度、压差是否符合要求□ 符合要求□ 不符合要求* 检查工作区域是否有与本批生产无关的物品□ 无□ 有* 检查生产区域卫生是否符合要求□ 符合要求□ 不符合要求—对生产介质进行检查* 蒸汽□ 正常□ 不正常—对烘房进行检查设备型号: CT-C-Ⅱ编号:* 检查是否完好清洁待用□ 完好清洁□ 不完好清洁* 接通电源,开启排水阀门,翻开风机,将烘房□ 正常□ 不正常温度设定符合要求,翻开预警装置,将烘房试运行—对摇摆式颗粒机进行检查* 检查是否完好清洁待用□ 完好清洁□ 不完好清洁* 装上 24 目铁质筛网,接通电源,按下启动按钮,实际筛网目数:目将摇摆式颗粒机试运行□ 正常□ 不正常—清洁准备好的工器具,并用75%的乙醇消毒□ 已清洁□ 已消毒□ 未清洁□ 未消毒—替换状态标志* 用正在运行标志替换已清洁标志□ 已替换□ 未替换枯燥整粒开始1. 将湿颗粒均匀摊布于烘盘中;将推车推入烘房,翻开风机,并适量调节排水阀门;开启蒸汽阀;开启预警装置;并控制:批生产记录页号:2/2品名:胶囊规格:代号:批号:批量:万粒工序:枯燥整粒文件编号:日期时间操作步骤生产记录操作人复核人*铺盘厚度≤ 2cm□ 符合要求□ 不符合要求*湿颗粒进烘房前烘房温度应控制在80-90 ℃进烘房时的实际温度:℃*枯燥温度≤ 95℃枯燥时间 1 小时 2 小时 3 小时 4 小时烘干温度℃℃℃℃*枯燥时间 3-4 小时,每隔 1小时翻盘一次枯燥开始时间:枯燥结束时间:*枯燥结束时水分≤ 1.0%实际水分:%2.将干颗粒送整粒岗位,用摇摆式颗粒机进行整粒,□ 未损坏□ 损坏整粒时应随时观察筛网有无损坏,如有损坏应及时更换。
原料药生产记录

精烘包记录
六、75%乙醇消 毒液配制使用 记录
每次生产前或生 产完清场后对设备内 外表面、地面、墙面 、容器具、操作台、 外包装等消毒,消毒 液配制7天内有效。 (车间现在每次配制 10L,每次使用5L)
精烘包记录
七、70%乙醇内含0.5%醋酸 八、0.1%新洁尔灭
洗必泰消毒液配制使用记录 消毒液配制使用记录
在下列4种清场情况下需填写上述对应洁净区记录:1.洁净区间歇式 生产(或包装),停产后再生产(或包装)时,上次清场时间已超过3天 有效期需重新大清场和消毒;2.连续生产(或包装)超过七天,需做大清 场和消毒; 3.连续生产,洁净区短期不打算再生产此产品,本次生产结 束后需做大清场和消毒,3种情况下需做(4)或(5)+(7)+(8)+ (9)+(11)记录。 4.连续生产(或包装)并在7天有效期内需做清洁和消毒,精烘包需只做 (7)+(8)+(11)记录。
包装记录
3.成品外包装
毛重=小纸箱/或(小纸箱+大纸箱 )/或纸桶
4.物料、包材销毁记录
包装记录
5.清场内容
包装记录
6. 清场检查内容
包装记录
包装记录
五、填写成品放行 单
在成品生产、包装、 检验完毕后,车间主任 填写成品放行审核单, 填写产品的品名、产品 批号、规格、生产车间 、包装入库数量、检验 单号及上述审查结果。 (放行单一式两份,一 份放记录最后,一份给 质管部)
合成、成品精制记录
4.清场记录
清洁内容和方 法是根据工艺规程 中清洁SOP来编订 的,将生产中所用 到的釜、烘箱、离 心机等设备按同产 品或换产品两种情 况来清洁:并真实 的填写清场的日期 、清场人和清洁起 止时间、清场所使 用的溶剂数量、清 场是否符合要求。 并有QA、车间主任 签字。(换产品清 场:连续生产超过 15批或换产品生产 )
原料药生产记录按新版GMP

原料药生产记录按新版GMPXXXXXX有限公司XXXXX批生产记录产品名称:批号:生产日期:车间主任:生产技术部:质量保证部:上海迪冉郸城制药有限公司生产指令单编号生产指令号第号指令下达时间年月日时限定指令完成时间年月日时产品名称替比培南酯批号批量代码生产车间合成车间发放部门生产技术部制表人审核人批准人物料配料单代码物料名称进厂批号包装规格生产厂家含量量批准用量6-MAP侧链二异丙基乙胺乙腈10%钯炭正丁醇异丙醇丙酮乙酸乙酯DMAP特戊酸碘甲酯碳酸钾DMF(水分<0.2%)活性炭标签热封塑料袋备料核料单编号生产指令号产品名称替比陪南批号批量代码物料名称进厂批号生产厂家理论用量料量操作人复核人6-MAP侧链二异丙基乙胺乙腈10%钯炭乙酸乙酯DMAP特戊酸碘甲酯碳酸钾DMF(水分<0.2%)活性炭标签药用低密度聚乙烯袋操作方法: 1、检查物料的包装情况,包装完好□包装不完好□2、核对物料的品名、规格、批号、数量及检验合格证情况3、按原辅料预处理标准操作规程中有关操作执行,将领料单附本记录上。
4、在“净皮室”去皮的物料,须在“备注”栏注明皮重.工序负责人:QA检查员:开工前现场检查表检查日期:年月日原生产产品批号待生产产品批号检查情况(打“√)检查项目合格不合格门窗清洁、明亮□□天花板清洁、无剥落物□□墙面清洁、无剥落物□□地面清洁、无剥落物□□台面清洁□□物料外包装清洁□□清洁状态标志□□清洁场合格证□□设备清洁、光亮□□操作工人着装符合要求□□按净化程序进行净化□□无上次生产遗留物□□经检查符合生产要求,同意开工。
□检查结果不符合生产要求,请按“检查项目”要求重新整理。
□备注工序负责人:QA检查员:产品名称批号替比培南酯中间体1的制备生产记录本工序开始时间:___年___月___日___时___分备料1、复查清场是否合格,房间挂有“清场合格证”,设备挂有“完好清洁”标识,检查衡器按置零键置零;是否在校验合格期内。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
********有限公司****批生产记录
品名:
规格:
批号:
理论产量:
成品数:
成品率:
生产日期:
生产部审阅:
质管部审阅:
目录
批生产指令单
开工前现场检查表
检查日期:年月日
生产管理员:QA检查员:
***** 岗位生产记录(三)
***** 岗位生产记录(四)
原料药一般生产区岗位清场记录
生产管理员:QA检查:
***** 岗位生产记录(一)
***** 岗位生产记录(二)
***** 岗位生产记录(三)
原料药一般生产区岗位清场记录
生产管理员:QA检查:
***** 岗位生产记录(一)
原料药一般生产区岗位清场记录
生产管理员:QA检查:
***** 干燥岗位生产记录
原料药洁净区岗位清场记录
生产管理员:QA检查:
批包装指令单
可编辑
***** 粉碎过筛岗位生产记录
原料药洁净区岗位清场记录
生产管理员:QA检查:
可编辑
***** 混合包装岗位生产记录(一)
***** 混合包装岗位生产记录(二)
原料药洁净区岗位清场记录
生产管理员:QA检查:
原料药包装岗位清场记录
生产管理员:QA检查:
***** 批生产汇总表
生产管理员:QA检查员:
产品生产检验报告单记录表
日期:年月日
生产管理员:QA检查员:
***** 关键岗位工艺查证记录(一)
生产管理员:QA检查员:
生产管理员:QA检查员:
批生产记录部门审核表
日期:年月日
可编辑
精品。
