碳钢在碳酸铵溶液
微合金钢中Nb、Ti的溶解、析出行为研究

[1- ]2 -
北京科技大学硕士学位论文
A Study on Dissolution and Precipitation of Nb and Ti in Microalloyed Steels
Abstract
Determining behavior of dissolution and precipitation of microalloy elements in steels is a necessary precondition to finding out appropriate process of microalloyed steels and fully exerting effect of microalloy elements in steels. In the present investigation, TEM, EDX and stress relaxation test were employed to investigate behavior of dissolution and precipitation of Nb and Ti in steels. Mathematical models were proposed to compute the kinetics of dissolution and precipitation in term of thermodynamic principles. It was find out that: (1) The precipitates in (Nb+Ti) microalloyed steel is always single phase containing Nb and Ti, rather than NbC surrounded by TiN. (2) the thermal stability of (Nb,Ti)(C,N) is far higher than that of Nb(C,N). (3) Compared to PTT curve of Nb microalloyed steel, that of (Nb+Ti) microalloyed steel shifts right and up. (4) Isothermal relaxation after deformation of Nb containing microalloyed steel causes elevation of transformation temperature of ferrite and bainite during subsequent continuous cooling. The phenomenon is more obvious with higher cooling rate. (5) The computation values are consistent to experimental results.
碳钢在碳酸铵溶液中的钝化行为 教师辅导ppt课件

2018/11/13
实验仪器、试剂
LK98-II电化学工作站 辅助电极(Pt电极)
碳钢去氧化装置(WSJ直流电流控制表) 参比电极(饱和甘汞电极) 金相砂纸和普通砂纸 研究电极(自制碳钢电极) 三电极电解池 (NH4)2CO3(分析纯) KCl(分析纯)
2018/11/13
实验装置图
2018/11/13
2018/11/13
实验原理
二、影响金属钝化过程的因素
影响金属钝化过程的因素有以下几个因素:溶 液的组成、金属的化学组成和结构、外界因素(如 温度、搅拌等)201 Nhomakorabea/11/13
实验原理
三、研究金属钝化的方法
恒电势阳极极化曲线的测量原理和方法: 控制电势法测量极化曲线时,一般采用恒电位仪, 它能将研究电极的电势恒定地维持在所需值,然后测量 对应于该电势下的电流。由于电极表面状态在未建立稳 定状态之前,电流会随时间而改变,故一般测出的曲线 为“暂态”极化曲线。实际测量中方法有:①、静态法; ②、动态法。
碳钢在碳酸铵溶 液中的钝化行为 教师辅导
实验目的
1.了解金属钝化行为的原理和测量方法。
2.掌握用线性电位扫描法测量碳钢在碳酸铵溶 液中的恒电势阳极极化曲线和钝化行为。
3.测定Cl-、氧化性阴离子CrO42-、氧化性阴离
子MnO4-浓度对碳钢钝化的影响。
2018/11/13
实验原理
一、金属的阳极过程:
K2CrO4(分析纯) KMnO4(分析纯)石蜡及电炉
十二烷基硫酸钠 亲油型MOA-3 蒸馏水 乙氧基化烷基硫酸钠(AES)3090吐温-80
碳钢在碳酸铵溶液中的电化学行为分析

Ke y wo r d s :o x y g e n ; c a r b o n s t e e l ; c i r c u l a t i o n c u r r e n t —v o l t a g e C u I V e ; e l e c t r o c h e mi c l a i mp e d a n c e ; p o l a r i z a t i o n c u r v e
t i o n w a s t h e f a s t e s t , t h e o x y g e n a t e d s t a t e w a s t h e s e c o n d, a n d t h e c o ro s i o n s t a t e i n d e o x y g e n i z e d s t a t e wa s t h e s l o w e s t .
系 中测得 的循 环伏安 曲线 。图 4为碳 钢在 三种充 气
状态 下 的 ( N H ) C O , 溶 液 体 系 中循 环 伏 安 曲线 的
电化学 过程 。
±1 5 0 mV, 交 流 阻 抗 频 率 范 围为 1 0 0—0 . 0 1 k H z , 交 流激励 信号 幅值 为 5 m V。空 白条件 设 定 为 : 1 m o l / L 的碳 酸铵溶 液 , 温度为 3 0 ℃, 通 过 改 变 氧 气 量 进 行
电化 学性能 测试 。
i n( N H4 ) 2 C O3 S o l u t i o n
Hua n g We n h e n g, Wa ng Pi n g
Ab s t r a c t :T o e x p l o r e t h e d u a l f u n c t i o n o f o x y g e n o n c a r b o n s t e e l , i n l f u e n c e o f o x y g e n o n c o r r o s i o n r a t e o f c a r b o n s t e e l
二乙醇胺在酸洗介质中对碳钢的缓蚀性能研究

二 乙醇 胺为 工业 品 , 盐酸 、 硫 酸 和硝 酸均 为分 析纯 , Q 2 3 5 A钢和 2 0号 碳钢 腐蚀 挂片 。
的氢 氟 酸 、 盐 酸、 硫酸及 硝酸 ) 中对 Q 2 3 5 A 钢 和 2 0号碳 钢 的缓蚀 性能 , 并 确定 二 乙醇 胺在 上 述 酸
式 中: 叼为 缓蚀 剂 的缓 蚀 率 , %; , 分 别 为 碳 钢 腐 蚀挂 片 在 添 加 缓 蚀 剂 及 空 白溶 液 下 的腐 蚀 速
为3 %氢 氟酸 中 , 随着二 乙醇 胺 添 加量 的增 加 , 其
对Q 2 3 5 A钢及 2 0号碳 钢 的缓蚀 性 能 呈现 逐 渐 增 加 的趋 势 。 当二 乙 醇 胺 的 添加 量 为 0 . 3 %( 质 量 分数 ) 时, 其对 Q 2 3 5 A钢挂片在质量分 数为 3 %
清洗 , 冷 干后 称 质 量 。按 式 ( 1 ) 计算 Q 2 3 5 A 钢及
1 8
基金项 目: 安 徽省 级 大 学 生 创 新 训 练 项 目( 2 0 1 5 1 0 3 7 5 0 1 5 ) ; 黄 山学 院 校级 项 目( 2 0 1 5 x k j q 0 0 2 ) 。
率, g / ( m ・ h ) 。
2 结 果与讨 论 2 . 1 质 量分 数为 3 % 氢氟 酸
性 环境 中 的最 佳 使 用 量 , 从 而 为 其工 业 缓 蚀 应 用
提供 指 导 。
1 试验 部分
山东省临沂市高考化学二模试卷附解析答案

高考化学二模试卷一、单选题1.“嫦娥五号”成功着陆月球,实现了中国首次月球无人采样返回。
下列说法错误的是()A. 运载火箭使用了煤油液氧推进剂,其中煤油是由煤干馏获得B. 探测器装有太阳能电池板,其主要成分为晶体硅C. 上升器用到碳纤维复合材料,主要利用其质轻、强度大和耐高温性能D. 返回器带回的月壤中含有3He,与地球上的4He互为同位素2.下列应用涉及氧化还原反应的是()A. 用TiCl4制备纳米级TiO2B. 高铁酸钾(K2FeO4)用作新型水处理剂C. 用明矾溶液除去铜制品表面的铜绿D. 工业上将NH3和CO2通入饱和食盐水制备小苏打3.一水合甘氨酸锌是一种矿物类饲料添加剂,其结构简式如图所示。
下列说法正确的是()A. 第一电离能:O>N>C>HB. 分子中C和N的杂化方式相同C. 基态Zn原子的核外电子有15种空间运动状态D. 该物质中,Zn 的配位数为4,配位原子为O、N4.短周期主族元素X、Y、Z、W的原子半径依次增大。
X、Y位于同一主族,Z元素在第三周期中离子半径最小,Z和W的原子序数之和是X的3倍。
下列说法错误的是()A. 简单氢化物的热稳定性:X>YB. 氧化物的熔点:Z>WC. 含Z元素的盐溶液可能显碱性D. X与Y组成的分子中所有原子均满足8电子稳定结构5.实验室提供的仪器有:试管、导管、酒精灯、容量瓶、玻璃棒、烧杯、蒸发皿、分液漏斗(非玻璃仪器任选),选用上述仪器不能完成的实验是()A. 用苯萃取溴水中的溴B. 配制0.5 mol/L的硫酸C. 制备乙酸乙酯D. 硫酸铜溶液的浓缩结晶6.合成环己酮缩乙二醇的原理为+ HOCH2CH2OH +H2O。
在反应体系中加入适量苯,利用如图装置(加热及夹持装置省略)可提高环已酮缩乙二醇产率。
下列说法错误的是()A. b是冷却水的进水口B. 对甲基苯磺酸可能起催化作用C. 苯可将反应产生的水及时带出D. 当苯即将回流烧瓶中时,必须将分水器中的水和苯放出7.CuCl是一种白色晶体,难溶于水,在潮湿的空气中易被氧化。
金属缓蚀剂

第十一讲 金属缓蚀剂陈旭俊 徐瑞芬缓蚀剂是一种在低浓度下能阻止或减缓金属在环境介质中腐蚀的物质。
缓蚀剂又叫作阻蚀剂、阻化剂或腐蚀抑制剂等。
缓蚀剂保护技术已经发展为一项重要的防腐蚀技术,广泛用在石油、冶金、化工、机械制造、动力和运输等部门。
一、缓蚀剂的分类缓蚀剂的品种繁多,常用的如亚硝酸钠、铬酸盐、磷酸盐、石油磺酸钡、亚硝酸二环已胺等,至今尚难以有统一的分类方法。
常见到的分类方法有以下几种。
1.按缓蚀剂作用的电化学理论分类(1)阳极型缓蚀剂 通过抑制腐蚀的阳极过程而阻滞金属腐蚀的物质。
这种缓蚀剂通常是由其阴离子向金属表面的阳极区迁移,氧化金属使之钝化,从而阻滞阳极过程。
例如,中性介质中的铬酸盐与亚硝酸盐。
一些非氧化型的缓蚀剂,例如苯甲酸盐、正磷酸盐、硅酸盐等在中性介质中,只有与溶解氧并存,才起到阳极抑制剂的作用。
(2)阴极型缓蚀剂 通过抑制腐蚀的阴极过程而阻滞金属腐蚀的物质。
这种缓蚀剂通常是由其阳离子向金属表面的阴极区迁移,或者被阴极还原,或者与阴离子反应而形成沉淀膜,使阴极过程受到阻滞。
例如ZnSO 4、Ca(HCO 3)2、As 3+、Sb 3+可以分别和OH-生成Zn(OH)2、Ca(OH)2沉淀和被还原为As 、Sb 覆盖在阴极表面,以阻滞腐蚀。
(3)混合型缓蚀剂这种缓蚀剂既可抑制阳极过程,又可抑制阴级过程。
例如含氮和含硫的有机化合物。
2.按化学成分分类(1)无机缓蚀剂,如铬酸盐、亚硝酸盐、磷酸盐等。
(2)有机缓蚀剂,如胺、硫脲、乌洛托品等。
3.按缓蚀剂所形成保护膜的特征分类(1)氧化膜型缓蚀剂通过使金属表面形成致密的、附着力强的氧化膜而阻滞金属腐蚀的物质。
例如,铬酸盐、重铬酸盐、亚硝酸钠等。
由于它们具有钝化作用,故又称为钝化剂。
(2)沉淀膜型缓蚀剂由于与介质中的有关离子反应并在金属表面生成有一定保护作用的沉淀膜,从而阻滞金属腐蚀的物质。
例如在中性介质中的硫酸锌、聚磷酸钠、碳酸氢钙等。
(3)吸附膜型缓蚀剂能吸附在金属表面形成吸附膜从而阻滞金属腐蚀的物质。
2021年山西省吕梁市汾阳县三泉中学高三化学模拟试题含解析

2021年山西省吕梁市汾阳县三泉中学高三化学模拟试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 已知亚硝酸(HNO2)是一种弱酸,其酸性略强于醋酸。
亚硝酸钠能与氢碘酸(HI)发生反应生成一氧化氮和碘单质。
下列说法不正确的是()A.亚硝酸钠与氢碘酸反应的离子方程式是2H++NO2-+2I-=I2+NO↑+H2OB.相同温度下,同浓度的醋酸钠溶液的pH大于亚硝酸钠溶液的pHC.氮氧化物与雨水反应生成硝酸和亚硝酸,是酸雨的成分D.用淀粉碘化钾试纸.食醋.冷开水可以区别食盐和亚硝酸钠参考答案:答案:A2. PM2.5是指大气中直径小于或等于2.5微米(1微米=10-6米)的可吸入肺的有害颗粒。
上海从2012年6月起正式公布PM2.5监测数据,规定日均限值为0.075mg/ m3。
下列与形成PM2.5肯定无关的是A.汽车尾气排放 B.建筑扬尘 C.煤燃烧 D.风力发电参考答案:D略3. 参考答案:答案:B4. 下列各组离子一定能大量共存的是A.pH=0的溶液中:Fe2+、K+、Cl-、NO3-B.无色透明的溶液中:MnO4-、SO42-、Na+、H+C.使石蕊试液变蓝色的溶液中:K+、Cl-、SO32-、SiO32-D.加入铝粉能产生氢气的溶液中:NH4+、SO42-、Cu2+、HCO3-参考答案:C略5. X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。
已知:甲+乙=丁+己,甲+丙=戊+己;0.1mol·L-1丁溶液的pH为13(25℃)。
下列说法正确的是()A.原子半径:W>Z>Y>XB.Y元素在周期表中的位置为第二周期第VIIA族C.1L0.1mol·L-1戊溶液中阴离子总的物质的量小于0.1molD.1 mol甲与足量的乙完全反应共转移了1mol电子参考答案:D略6. 向饱和NaOH溶液中加入一定量Na2O2,充分反应后恢复到原温度下列说法正确的是A.有晶体析出,原溶液质量不变 B.有晶体析出,原溶剂质量不变C.溶液仍为饱和溶液,浓度增大 D.溶液仍为饱和溶液,浓度不变参考答案:A略7. 下列说法错误的是A.除去MgCl2溶液中少量的FeCl3,可选用MgCO3B.稀硫酸中加入Zn粉,随着反应的进行,溶液中水的电离程度逐渐增大C.能溶解氧化铝的溶液中可能大量存在:HCO3-、SO42-、NO3-、Na+D.等物质的量浓度的(NH4)2SO4溶液和(NH4)2CO3溶液中浓度前者大于后者参考答案:C8. 下列说法不正确的是A.赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色B.可以用Si3N4、Al2O3制作高温结构陶瓷制品C.污水处理的方法有多种,常用的化学方法有:混凝法、中和法、沉淀法D.是世界通用的循环再生标志,简称回收标志参考答案:A略9. 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
电化学实验——精选推荐

实验一碳钢在碳酸铵溶液中的极化曲线【目的要求】1. 掌握准稳态恒电位法测定金属极化曲线的基本原理和测试方法。
2. 了解极化曲线的意义和应用。
3. 掌握电化学分析仪的使用方法。
【实验原理】1. 极化现象与极化曲线为了探索电极过程机理及影响电极过程的各种因素,必须对电极过程进行研究,其中极化曲线的测定是重要方法之一。
我们知道在研究可逆电池的电动势和电池反应时,电极上几乎没有电流通过,每个电极反应都是在接近于平衡状态下进行的,因此电极反应是可逆的。
但当有电流明显地通过电池时,电极的平衡状态被破坏,电极电势偏离平衡值,电极反应处于不可逆状态,而且随着电极上电流密度的增加,电极反应的不可逆程度也随之增大。
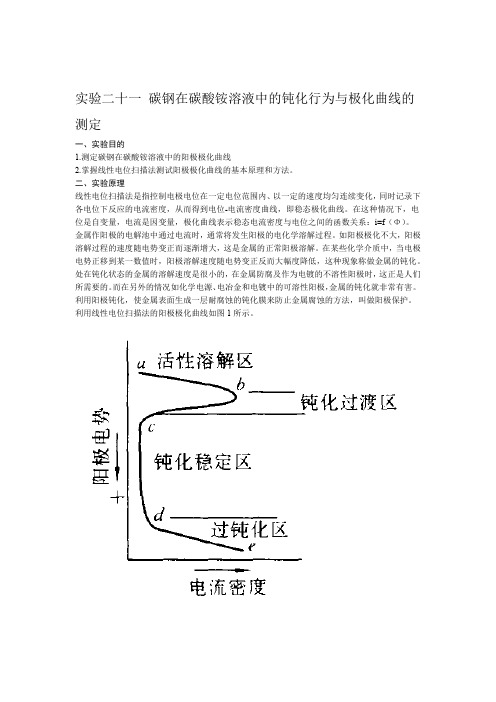
由于电流通过电极而导致电极电势偏离平衡值的现象称为电极的极化,描述电流密度与电极电势之间关系的曲线称作极化曲线,如图2-19-1所示。
图2-19-1 极化曲线AB:活性溶解区;B:临界钝化点;B-C:过渡钝化区;C-D:稳定钝化区;D-E:超(过)钝化区(1)AB段为活性溶解区,此时金属进行正常的阳极溶解,阳极电流随着电势的正移而不断增大。
(2)BC段为过渡钝化区(负坡度区)。
随着电极电势变正达到B点之后,此时金属开始发生钝化,随着电势的正移,金属溶解速率不断降低,并过渡到钝化状态。
对应于B点的电极电势称为临界钝化电势ψ钝化,对应的电流密度叫临界钝化电流密度i钝化。
(3)CD段为稳定钝化区,在此区域内金属的溶解速率降低到最小值,并且基本上不随电势的变化而改变,此时的电流密度称为钝态金属的稳定溶解电流密度。
(4)DE段为超钝化区。
此时阳极电流又重新随电势的正移而增大,电流增大的原因可能是高价金属离子的产生,也可能是O2的析出,还可能是两者同时出现。
金属的阳极过程是指金属作为阳极时在一定的外电势下发生的阳极溶解过程,如下式所示:M→M n++n e此过程只有在电极电势正于其热力学平衡电势时才能发生。
阳极的溶解速度随电位变正而逐渐增大,这是正常的阳极溶出,但当阳极电势正到某一数值时,其溶解速度达到最大值,此后阳极溶解速度随电势变正反而大幅度降低,这种现象称为金属的钝化现象。
物理化学-实验二十一:碳钢在碳酸铵溶液中的钝化行为与极化曲线的测定

实验二十一碳钢在碳酸铵溶液中的钝化行为与极化曲线的测定一、实验目的1.测定碳钢在碳酸铵溶液中的阳极极化曲线2.掌握线性电位扫描法测试阳极极化曲线的基本原理和方法。
二、实验原理线性电位扫描法是指控制电极电位在一定电位范围内、以一定的速度均匀连续变化,同时记录下各电位下反应的电流密度,从而得到电位-电流密度曲线,即稳态极化曲线。
在这种情况下,电位是自变量,电流是因变量,极化曲线表示稳态电流密度与电位之间的函数关系:i=f(Φ)。
金属作阳极的电解池中通过电流时,通常将发生阳极的电化学溶解过程。
如阳极极化不大,阳极溶解过程的速度随电势变正而逐渐增大,这是金属的正常阳极溶解。
在某些化学介质中,当电极电势正移到某一数值时,阳极溶解速度随电势变正反而大幅度降低,这种现象称做金属的钝化。
处在钝化状态的金属的溶解速度是很小的,在金属防腐及作为电镀的不溶性阳极时,这正是人们所需要的。
而在另外的情况如化学电源、电冶金和电镀中的可溶性阳极,金属的钝化就非常有害。
利用阳极钝化,使金属表面生成一层耐腐蚀的钝化膜来防止金属腐蚀的方法,叫做阳极保护。
利用线性电位扫描法的阳极极化曲线如图1所示。
图1 阳极极化曲线曲线表明,电势从a点开始上升(即电势向正方向移动),电流也随之增大,电势超过b点以后,电流迅速减至很小,这是因为在碳钢表面上生成了一层电阻高、耐腐蚀的钝化膜。
到达c点以后,电势再继续上升,电流仍保持在一个基本不变的、很小的数值上。
电势升至d点时,电流又随电势的上升而增大。
从a点到b点的范围称为活性溶解区;b点到c点称为钝化过渡区;c点到d点称为稳定区;d点以后称为过钝化区。
对应于b点的电流密度称为致钝电流密度;对应于c-d段的电流密度称为维钝电流密度。
如果对金属通以致钝电流(致钝电流密度与表面积的乘积)使表面生成一层钝化膜(电势进入钝化区),再用维钝电流(维钝电流密度与表面积的乘积)保持其表面的钝化膜不消失,金属的腐蚀速度将大大降低,这就是阳极保护的基本原理。
物理化学-试验二十一:碳钢在碳酸铵溶液中的钝化行为与极化曲线的测定
实验二十一碳钢在碳酸铵溶液中的钝化行为与极化曲线的测定一、实验目的1.测定碳钢在碳酸铵溶液中的阳极极化曲线2.掌握线性电位扫描法测试阳极极化曲线的基本原理和方法。
二、实验原理线性电位扫描法是指控制电极电位在一定电位范围内、以一定的速度均匀连续变化,同时记录下各电位下反应的电流密度,从而得到电位-电流密度曲线,即稳态极化曲线。
在这种情况下,电位是自变量,电流是因变量,极化曲线表示稳态电流密度与电位之间的函数关系:i=f(Φ)。
金属作阳极的电解池中通过电流时,通常将发生阳极的电化学溶解过程。
如阳极极化不大,阳极溶解过程的速度随电势变正而逐渐增大,这是金属的正常阳极溶解。
在某些化学介质中,当电极电势正移到某一数值时,阳极溶解速度随电势变正反而大幅度降低,这种现象称做金属的钝化。
处在钝化状态的金属的溶解速度是很小的,在金属防腐及作为电镀的不溶性阳极时,这正是人们所需要的。
而在另外的情况如化学电源、电冶金和电镀中的可溶性阳极,金属的钝化就非常有害。
利用阳极钝化,使金属表面生成一层耐腐蚀的钝化膜来防止金属腐蚀的方法,叫做阳极保护。
利用线性电位扫描法的阳极极化曲线如图1所示。
图1 阳极极化曲线曲线表明,电势从a点开始上升(即电势向正方向移动),电流也随之增大,电势超过b点以后,电流迅速减至很小,这是因为在碳钢表面上生成了一层电阻高、耐腐蚀的钝化膜。
到达c点以后,电势再继续上升,电流仍保持在一个基本不变的、很小的数值上。
电势升至d点时,电流又随电势的上升而增大。
从a点到b点的范围称为活性溶解区;b点到c点称为钝化过渡区;c点到d 点称为稳定区;d点以后称为过钝化区。
对应于b点的电流密度称为致钝电流密度;对应于c-d 段的电流密度称为维钝电流密度。
如果对金属通以致钝电流(致钝电流密度与表面积的乘积)使表面生成一层钝化膜(电势进入钝化区),再用维钝电流(维钝电流密度与表面积的乘积)保持其表面的钝化膜不消失,金属的腐蚀速度将大大降低,这就是阳极保护的基本原理。
碳钢在碳酸铵溶液中极化曲线的测定误差分析

碳钢在碳酸铵溶液中极化曲线的测定误差分析
碳钢在碳酸铵溶液中的极化曲线测定误差分析主要受以下几个方面影响:
1. 仪器误差:包括电位计、电流计等测量仪器的精度和误差。
建议使用精度较高的仪器,避免仪器本身带来的误差。
2. 电极准备误差:电极的制备过程中,可能出现电极尺寸、电极表面质量等方面的差异。
为了减小这种误差,可以采用标准化的电极制备程序,并在同一批次中制备多个电极进行测试。
3. 实验环境误差:环境温度、湿度等参数变化可能会对实验结果产生影响。
建议在恒温恒湿的条件下进行测定,并在进行测试时尽量控制环境的稳定。
4. 溶液组分浓度误差:碳酸铵溶液的浓度变化也会对测定结果产生影响。
为了减小这种误差,可以使用标准溶液进行校准,并保持溶液浓度的稳定。
5. 测量时间误差:测量时间的选择也可能会对结果产生影响。
需要根据具体实验目的和样品特性进行合理的测量时间选择。
在实际测定中,较好的操作规范和标准化程序能够有效地减小上述误差的影响,并提高测定的准确性和可重复性。
同时,多次测量并取平均值也可以降低随机误差的影响。
尿素及车用尿素溶液简介

车用尿素溶液车用尿素是重型柴油车达到国四排放标准的必备产品。
车用尿素是指尿素浓度为32.5%且溶剂为超纯水的尿素水溶液,原料为尿素晶体和超纯水。
重型卡车、客车等柴油车要达到国四排放标准,在尾气处理上就要选用适合的SCR系统,而这项系统必须利用尿素溶液对尾气中的氮氧化物进行处理。
因此,车用尿素溶液成了重型卡车及客车达到国四排放标准的必备产品。
SCR是我国减排的最优选择。
目前国内现行的柴油国标GB19147-2009要求含硫量≤350ppm,而ECR-DOC技术要求油品含硫量在10ppm以下,因此在中国暂不具有推广条件。
SCR则可耐350ppm 的含硫油品,因此有推广的技术基础。
由于采用SCR技术的国四发动机燃油经济性比EGR技术好、对发动机改动小、对燃油和机油要求较低、在技术升级连续性上具有优势、SCR催化器耐久性好且不存在催化器堵塞的风险,因此SCR技术是最适合我国国情的重型柴油车减排技术路线。
车用尿素是浓度为32.5%且溶剂为超纯水的尿素水溶液,生产原料为尿素晶体和超纯水,其关键点在于原料纯度。
从生产工艺来看,虽然车用尿素对原料纯度要求高于一般工业用需求,但目前国内工艺已然可以满足实际应用需求。
车用尿素的生产工艺不足以构建高进入壁垒。
国内车用尿素主要是从工业尿素提纯得来,其主要原理是:1)在温度70-75℃时,尿素在水溶液中发生水解。
2)在温度30℃以下时,尿素重新从水溶液中结晶出来。
3)每水解结晶一次,其纯度会得到大幅提高,一般利用工业一级尿素水解结晶一次,就可达到车用尿素标准要求,其产出比例为1.5:1。
车用尿素必须使用电子行业一级超纯水。
车用尿素的由于SCR催化剂载体极易发生金属离子中毒从而失去催化效果,因此车用尿素溶液必须使用电子行业一级超纯水(电阻率≥18MΩ?cm)。
车用尿素溶液会在-11℃下开始结冰,实际使用中在-20℃时会完全上冻。
目前技术是通过加入改性剂降低溶液凝固点、外加加热装置等手段防止溶液凝固。
43 碳酸氢铵工艺技术方案
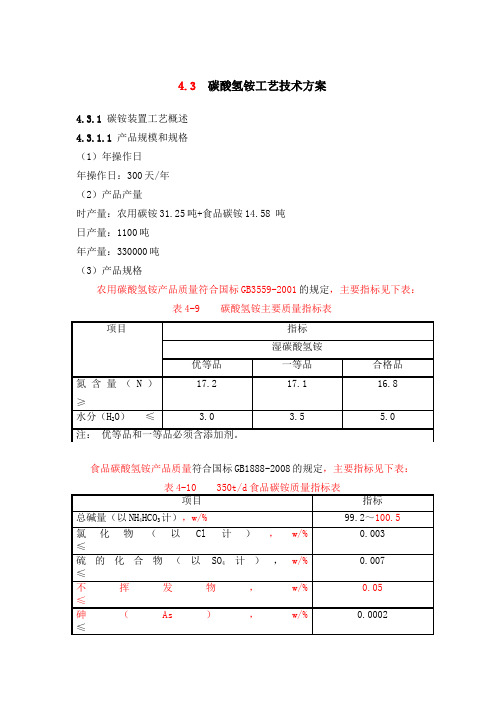
4.3 碳酸氢铵工艺技术方案4.3.1 碳铵装置工艺概述4.3.1.1 产品规模和规格(1)年操作日年操作日:300天/年(2)产品产量时产量:农用碳铵31.25吨+食品碳铵14.58 吨日产量:1100吨年产量:330000吨(3)产品规格农用碳酸氢铵产品质量符合国标GB3559-2001的规定,主要指标见下表:4-9 碳酸氢铵主要质量指标表表4.3.1.2 碳铵装置工艺技术方案(1)工艺生产方法的比较碳化生产流程根据压力的不同总的可分为低压碳化和高压碳化。
目前生产中采用的有以下几种操作压力:1)低压碳化采用低压碳化压力为0.3~0.34MPa进入碳化系统。
2)高压碳化采用高压碳化压力为0.6~0.7MPa。
(2)工艺技术选择碳化生产流程操作压力虽有大小不一,但碳化系统的生产工艺过程和操作控制原理相同,上述二种方法技术均成熟可靠。
由于高压碳化不但可以把原料气中二氧化碳和氨清除得比较干净,而且该项目是由天然气为原料生产合成氨,以氨及副产的CO2和部分弛放气为原料生产碳酸氢铵。
因此本项目的可研报告则选择采用0.7MPa左右高压并联碳化流程,用浓氨水吸收二氧化碳,同时产出成品农用及食品碳酸氢铵作为碳铵装置的工艺方案。
(3)碳铵装置工艺原理及流程叙述1)工艺原理用氨水吸收二氧化碳,在很早以前就用于焦炉气深度冷冻前少量二氧化碳的脱除,我国的小合成氨厂将此法发展成为碳化法合成氨生产流程。
氨水溶液的碳化过程是一个伴有化学反应的吸收过程,其总反应如下:CO2+NH3+H2O=NH4HCO3吸收过程的总反应按如下两个反应进行:2NH3+CO2+H2O=(NH4)2CO3 碳酸铵 (1)NH3+CO2+H2O=NH4HCO3 碳酸氢氨 (2)实际上的反应过程是氨与二氧化碳首先反应生成氨基甲酸铵2NH3+CO2=NH4COONH2氨基甲酸铵水解进一步反应生成碳酸氢铵NH4COONH2+H2O=NH4HCO3+NH3氨和水作用生成氢氧化铵NH3+H2O=NH4OH水解的碳酸氢铵与氢氧化铵作用生成碳酸铵NH4HCO3+NH4OH=(NH4)2CO3+H2O碳酸铵再吸收二氧化碳生成碳酸氢铵(NH4)2CO3+CO2+H2O=2NH4HCO3实际上反应过程是比较复杂的,具体的反应机理尚有待进一步研究,但大致反应可分述如下:A.吸氨过程气氨溶于水中,大部分与水结合成一水合氨NH3(气)+H2O(液)=NH3·H2O(溶液)氨 水 一水合氨由于母液稀氨水中尚存在NH4+、NH2COO-,CO32-等离子。
物化实验——精选推荐

物化实验⼀、蔗糖⽔解反应速度常数的测定蔗糖:本来⼆级反应可看成准⼀级反应:由于本反应中⽔作为溶剂,其量远⼤于蔗糖)蔗糖⽔解:蔗糖⾥加盐酸,蔗糖在盐酸的催化作⽤下反应,盐酸⾥加蔗糖反应速率太快:蔗糖⽔解⽤的仪器:(旋光仪)及测出的量:( 旋光度、⽐旋光度)(随着反应的进⾏,体系的右旋⾓不断减⼩,反应⾄某⼀瞬间,体系的旋光度可恰好等于零,⽽后就变成了左旋,直⾄蔗糖完全转化,这是左旋叫达到最⼤)蔗糖⽔解旋光度的变化:由于⽣物中果糖的左旋性⽐葡萄糖右旋性⼤,所以⽣物呈左旋性质。
因此随着反应的进⾏,体系的右旋⾓不断减⼩,反应⾄某⼀瞬间,体系的旋光度可恰好等于零,⽽后就变成了左旋,直⾄蔗糖完全转化,这是左旋叫达到最⼤5.在旋光度的测量中,为什么要对零点进⾏校正?在蔗糖⽔解反应速率常数的测定实验中若不进⾏校正,对结果是否有影响?如果在实验过程中记录反应开始的时间晚了⼀些,是否会影响到k值的测定?为什么?答:除了被测物有旋光性,可能还有其他物质有旋光性,⼀般要⽤空⽩试剂对零点进⾏校正。
本实验不需要校正,在数据处理中⽤的是两个旋光度的差值。
不影响。
不同时间所作的直线位置不同⽽已,但k(所作直线的斜率)相同。
8.在蔗糖⽔解反应速率常数的测定实验中,配制蔗糖溶液时称量不够准确,对测量结果k有⽆影响?若取⽤盐酸的体积不准呢?在混合蔗糖溶液和盐酸溶液时,我们将盐酸溶液加到蔗糖溶液⾥去,可否将蔗糖溶液加到盐酸溶液中?为什么?答:蔗糖的浓度不影响斜率,因⽽蔗糖的浓度不准对k的测量⽆影响。
H+在该反应体系中作催化剂,它的浓度会影响k的⼤⼩。
如果将蔗糖溶液加到盐酸溶液中,在瞬间体系中氢离⼦浓度较⾼,导致反应速率过快,不利于测定。
⼆、电导法测定弱电解质的电离平衡常数电导测定的应⽤(电离平衡常数、⽔的离⼦积、难容盐的溶度积)三、溶液表⾯张⼒的测定——最⼤⽓泡法如最⼤⽓泡法测表⾯张⼒,R的变化趋势(R的变化趋势先减⼩后增⼤;最⼤附加压⼒△Pm与R的趋势刚好相反;溶质的表⾯吸附量Γ先增⼤后趋于某个数值四、丙酮碘化速度常数的测定丙酮:⼆级反应丙酮碘化:先盐酸与碘混合再加丙酮15、丙酮的碘化反应实验中,通过分光光度法测定碘浓度随时间的变化来量度反应进程,所测量出来的量是:吸光度2.在丙酮的碘化反应实验中,实验时⽤分光光度计测量什么物理量?它和碘浓度有什么关系?在此实验中,将丙酮溶液加⼊盛有I2和HCl溶液的容量瓶中时,反应即开始,⽽反应时间却以溶液混合均匀并注⼊⽐⾊⽫中才开始计时,这样操作对实验结果有⽆影响?为什么?答:溶液吸光度、A=εLc、没有影响、原因:因为测得的是不同时间上的吸光度,根据吸光度作图得其斜率,不同时间所作的直线位置不同⽽已,但k(所作直线的斜率)相同。
碳钢电极(阳极)极化曲线的测定(精)

碳钢电极(阳极)极化曲线的测定一、实验目的1、掌握恒电位法测量阳极极化曲线的方法。
2、测量碳钢在碳铵溶液中的钝化曲线。
二、原理动态法,控制电极电位以较慢速度连续改变(扫描),测量对应电势下的瞬时电流。
三、仪器与药品JS-292型恒电位仪; 2mol/L碳酸铵;饱和氯化钾;0.5mol/L硫酸;及硝酸钾盐桥等四、操作:1.按图接好线路。
用三电极。
a.向两小烧杯中分别倒饱和KCl和(NH4)2CO3溶液,放置盐桥;b.分别在溶液中放入碳钢、辅助和参比电极;c.将仪器插孔分别与各电极连接。
2.JS-292型恒电位仪实验操作:a.实验前的准备:正确联接电化学实验装置。
检查220V交流电源是否正常,将K6:; K10:,打开电源开关,将仪器预热30分钟。
b.参比电位的测将K5K60.860左, 即参比电极相对于研究电报的开路电位(平衡电位)。
由于研究电极处于“虚地”点,研究电极相对于参比电极的开路电位即与此数值相同,符号相反。
电极处理方法:把K1。
将K5K4,让K61.0—1.2V,观察到辅助电极上有连续气泡产生,3--5分钟后,将K50.86V左右即好。
C.平衡电位的设置:将K5K4,让K6电位显示为零,该给定电位即是所要设置的平衡电位。
3.极化测量。
将K5K4,让K6a.K1。
K80.02 V,(即过电位数值)。
把K8,读出电流,即为极化电流数值。
b.重复操作a。
c. 当电位降低0.0V后,把K1,使电位增加0.02 V,把K8显示选择开关置于“电流”,读出电流,即为极化电流数值。
d. 量到电位增加到-1.20V,电流大于100mA,可以结束实验。
五、数据处理1.计算恒定(给定)的碳钢电极电位;2.计算对应的电流密度;3.作电流密度对电极电位图;4.讨论各段的意义。
六、思考问题1.参比电位的意义是什么?2.参比电位与给定电位的差的意义是什么?3.研究电极与辅助电极之间有无电流?研究电极与参比电极之间有无电流?4.阳极保护法,碳钢电位应控制在什么范围内?5.是否任何金属都可用阳极保护法防腐?6.甘汞电极构造如何,实验结束为什么要将上面小孔封闭?7.盐桥是如何制备的?。
碳钢

152 实验十六 碳钢在碳酸铵溶液中的极化曲线的测定—恒电位法(手动)一、目的要求1.了解平衡电极电位和电极电位的区别2.掌握用恒电位法测定碳钢在碳酸铵溶液中的极化曲线。
3.学会恒电位仪的使用方法及操作规程一、实验原理测定极化曲线实际上是测定有电流流过电极时电极的电位与电流的关系,极化曲线的测定可以用恒电流和恒电位两种方法。
恒电流法是控制通过电极的电流(或电流密度),测定各电流密度时的电极电位,从而得到极化曲线。
恒电位法是将研究电极的电位恒定地维持在所需的数值,然后测定相应的电流密度,从而得出极化曲线。
由于在同一电流密度下,碳钢电极可能对应有不同的电极电位,因此用恒电流法不能完整的描述出电流密度与电位间的全部复杂关系。
本实验采用控制电极电位的恒电位法测定碳钢在碳酸溶液中的阳极极化曲线,该曲线可分为四个区域.,如图Ⅲ-16-1所示。
1.从点A 到点B 的电位范围称金属活化溶解区。
此区域内的AB 线段是金属的正常阳极溶解,铁以二价形式进入溶液,即Fe Fe 2+ + 2e -。
A 点称为金属的自然腐蚀电位。
2.从B 点到E 点称为钝化过渡区。
BE 线是由活化态到钝化态的转变过程,B 点所对应的电位称为致钝电位,其对应的电流密度I 称为致钝电流密度。
3.从E 点到F 点的电位范围称为钝化区。
在此区域内由于金属的表面状态发生了变化,使金属的溶解速度降低到最小值,与之对应的电流密度很小,基本上不随电位的变化而改变。
此时的电流密度称为维持钝化的电流密度,其数值几乎与电位变化无关。
4。
FC段的电位范围称为过钝化区。
在此区阳极电流密度又重新随电位增大而增大,金属的 图Ⅲ-16-1 阳极极化曲线溶解速度又开始增大,这种在一定电位下使钝化了的金属又重新溶解的现象叫做过钝化。
电流密度增大的原因可能是产生了高价离子(如,铁以高价转入溶液),如果达到了氧的析出电位,则析出氧气。
凡是能使金属保护层破坏的因素都能使钝化了的金属从新活化。
碳钢在碳酸铵溶液中的腐蚀研究实验改进

碳钢在碳酸铵溶液中的腐蚀研究实验改进杜艳芳【摘要】采用线性扫描伏安法和交流阻抗法研究了碳钢在不同实验条件下的腐蚀规律,碳钢在碳酸铵溶液中的阳极过程为溶解、钝化、过钝化溶解,溶解初期在电极界面的传质为线性扩散控制;随着溶液温度的升高,阻抗谱表示为单一时间常数的容抗弧,容抗弧直径逐渐减小,电阻变小,碳钢的腐蚀速度增大;Cl-浓度越大,钝化区域变小,碳钢更容易腐蚀;加入硫脲缓蚀剂,碳钢容抗弧直径增大,电阻变大,有利于保护碳钢.【期刊名称】《大学化学》【年(卷),期】2019(034)006【总页数】5页(P33-37)【关键词】碳钢腐蚀;极化曲线;缓蚀剂【作者】杜艳芳【作者单位】华东师范大学化学与分子工程学院,化学实验教学中心,上海 200241【正文语种】中文【中图分类】G64;O6碳钢广泛应用在石油化工设备管道、工农业生产等领域,但碳钢腐蚀问题已涉及到安全生产。
碳钢在不同的酸碱性环境[1–3]、盐水体系[4–6]、不同气体和土壤[7,8]中的腐蚀行为以及在工业腐蚀体系中添加缓蚀剂的方式控制腐蚀[9,10]已有大量的报道,因此研究碳钢与环境介质作用的规律,探究腐蚀过程的机理一直是人们关注的热点。
碳钢腐蚀极化曲线的测定是我院本科生大三下学期的物化实验,实验目的是让学生采用电化学工作站测定碳钢腐蚀的极化曲线,但是目前学生实验操作局限于用线性扫描伏安法改变扫描速度、氯离子浓度这样一些简单的实验参数,实验装置陈旧,实验数据现象不明显,教学效果差,达不到对学生的综合能力的锻炼。
本文在调研文献的基础上结合实验教学,改进实验装置,增加实验内容,与最新的防腐蚀技术相结合,拓宽学生实验思路,提高学生的科研研究能力。
采用线性扫描伏安(LSV)法和交流阻抗(EIS)法研究不同条件(温度、扫描速度、氯离子介质及硫脲缓蚀剂)对碳钢腐蚀的影响规律,计算得出相关腐蚀动力学参数,对碳钢防护具有指导意义。
主要仪器:实验采用上海辰华仪器公司CHI650C电化学分析仪,以Q235碳钢(1 cm × 1 cm)为工作电极,铂网电极为辅助电极,饱和甘汞电极为参比电极的三电极体系,电势均为相对于饱和甘汞电极的数值。
上海音乐学院安师附属实验中学 2021年高三化学上学期期末试卷含解析

上海音乐学院安师附属实验中学 2021年高三化学上学期期末试卷含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 由两种气态烃组成的混合物,体积为10ml.与过量的氧气混合再充分燃烧,将生成物通过浓H2SO4气体体积减少15ml,再通过碱石灰气体体积又减少20ml(气体体积均为同温同压下).混合烃的组成可能为()2. 采用下列装置和操作,不能达到实验目的的是参考答案:B【知识点】化学实验【答案解析】B 解析:A、苯与液溴在铁粉做催化剂的条件下可制取溴苯并产生HBr,进入四氯化碳中后与四氯化碳分层,故A正确;B、电石为粉末状,不能放在多孔板上,故B错误;C、再接一个导管置于水中,用手握住烧瓶底部片刻,导气管冒泡,松开手后形成一段水柱,表明气密性良好。
故C 正确;D、根据强酸与弱酸盐可制取弱酸,D正确。
故答案选B【思路点拨】本题考查了化学实验装置,是高考中常见的考点,应注意平时知识的积累。
3. U(铀)常见化合价有+4和+6。
硝酸铀酰加热分解:UO2(NO3)2→U X O Y+NO2↑+O2↑反应未配平,收集满一试管气体产物,倒扣于水中,水充满试管。
则生成的铀氧化物中铀元素的化合价是 ()A.+4 B.+6 C. +6和+4 D.+4和0参考答案:B略4. 下列各组表述中,两个微粒一定不属于同种元素原子的是 ( )A.3p轨道有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子C.最外层电子数是核外电子总数1/5的原子和价电子排布为4s24p5的原子D.2p轨道有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子参考答案:B略5. 常温下,下列各组离子在指定溶液中能大量共存的是A.滴入KSCN显红色的溶液:Na+、Cu2+、Br-、SO42-B.滴入酚酞显红色的溶液:Na+、Al3+、SO42-、Cl-C.c(Fe2+)=1mol/L的溶液:H+、Na+、Cl-、NO-3D.加入铝粉能产生大量H2的溶液:Na+、K+、Cl-、HCO-3参考答案:A6. 生活是化学的源泉,下列有关生产、生活中的化学叙述不正确的是A.铁强化酱油可通过膳食补充人体所需的铁元素B.变质的植物油有难闻的特殊气味,是由于植物油发生了酯化反应C.一定浓度的双氧水可用于伤口的消毒D.采煤工业上,爆破时把干冰和炸药放在一起,既能增强爆炸威力,又能防止火灾参考答案:B略7. 下列关于氧化还原反应的说法不正确的是()A.反应SiO2+3C=SiC+2CO中,氧化剂与还原剂的物质的量之比为1:2B.向蔗糖中加入浓硫酸,蔗糖变黑并有刺激性气味气体生成,说明浓硫酸具有脱水性和强氧化性C.浓硫酸,浓硝酸在加热条件下都能将木炭氧化为二氧化碳D.铁粉与足量稀硝酸反应时,产物为硝酸亚铁、NO、H2O参考答案:D略8. 下列分子或离子在指定的分散系中能大量共存的一组是A.银氨溶液:Na+、K+、NO3-、NH3·H2OB.空气:C2H2、CO2、SO2、NOC.氢氧化铁胶体:H+、K+、S2-、B r-D.高锰酸钾溶液:H+、Na+、SO42-、葡萄糖分子参考答案:A9. 下列说法不正确的是A.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同B.用溴水即可鉴别苯酚溶液、2,4-已二烯和甲苯C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OHD.蔗糖、麦芽糖的分子式都是C12H22O11,二者都属于低聚糖参考答案:C略10. 下列表示对应化学反应的离子方程式正确的是A.用铜为电极电解饱和食盐水:2Cl—+2H2O Cl2↑+H2↑+2OH—B.小苏打溶液中加少量Ba(OH)2溶液:2HCO3—+Ba2++2OH—=BaCO3↓+2H2O+CO32—C.醋酸溶液与水垢中的CaCO3反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑D.向NaAlO2溶液中通入过量CO2:2AlO2- + CO2 + 3H2O = 2A(OH)3↓+ CO32-参考答案:B略11. 丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法正确的是()A.丹参素在C上取代H的一氯代物有4种B.在Ni催化下1mol丹参素最多可与4molH2加成C.丹参素能发生取代、消去、中和、氧化等反应D.1mol丹参素在一定条件下与足量金属钠反应可生成4molH2参考答案:C【分析】该物质中含有酚羟基、醇羟基和羧基、苯,具有酚、醇、羧酸和苯的性质,能发生取代反应、氧化反应、消去反应、酯化反应、缩聚反应、加成反应等,据此分析解答.【解答】解:A.该分子中H原子有5种,其一氯代物同分异构体有5种,故A错误;B.苯环能和氢气发生加成反应,所以在Ni催化下1mol丹参素最多可与3molH2加成,故B错误;C.醇羟基、羧基能发生取代反应,醇羟基能发生消去反应,羧基能发生中和反应,酚羟基和醇羟基能发生氧化反应,故C正确;D.能与钠反应的官能团有酚羟基、醇羟基和羧基,所以且官能团与氢气关系之比为2:1,所以1mol 丹参素在一定条件下与足量金属钠反应可生成2molH2,故D错误;故选C.12. 下列分子结构中,原子的最外层电子不能都满足8电子稳定结构的是()A.CS2 B.PCl3 C .BeCl2D.CCl4参考答案:C13. 下列实验过程中,始终无明显现象的是( )A. Cl2通入Na2CO3溶液中B. CO2通入CaCl2溶液中C. NH3通入AgNO3溶液中D. SO2通入Ba(OH)2溶液中参考答案:B略14. 下列表示对应化学反应的离子方程式正确的是()A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I 2+6OH-B.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++6OH-NH3↑+H2OC.将过量二氧化硫气体通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++3NO3-=Ag++NO↑+H2O参考答案:C略15. (08东莞调研)下列金属或氧化物可以完全溶解的是()A.1mol Zn与含1mol HCl的稀盐酸共热B.1mol Cu与含2mol H2SO4的浓硫酸共热C. 1mol Cu与含4mol HNO3的浓硝酸D.1mol MnO2与含4mol HCl的浓盐酸共热参考答案:答案:C二、实验题(本题包括1个小题,共10分)16. 将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。
