浙教版科学八下第二章微粒模型与符号第五节
浙教版 年 八年级科学(下册) 课件 第2章 粒子的模型与符号(共117张PPT)

积大约为( )
【解题思路】 先用一定方法测量并估算出高锰酸钾晶体的体积 V; 再用一 定方法测量并估算出高锰酸钾晶体中高锰酸根离子(MnO-4 )的个数 n(从原液到第 一次稀释,稀释了 10 倍,从第一次稀释到第二次稀释,稀释了 100 倍,从第 2 次到第 3 次依次稀释了 1 000 倍,原来晶体中高锰酸根离子的个数是 1 000n)。
(4)化学反应的实质:在化学反应中分子可分,原子不可分,化学反应的本 质是反应前的分子分解成原子再重新组合成新的分子的过程。
【例 3】 当水的温度和压强升高到临界点(t=374.3 ℃,p=22.05 MPa)以
上时,水就处于超临界状态,该状态的水即称之为超临界水。超临界水具有通常 状态下水所没有的特殊性质,它可以和空气、氧气及一些有机物均匀混合。如果 超临界水中同时溶有氧气和有机物,则有机物可迅速被氧化为二氧化碳、氮气、 水等小分子化合物。有关超临界水的叙述错误的是( )
A.超临界水可处理有机废物 B.水转化为超临界水时微观结构发生了变化 C.超临界水是一种优良溶剂 D.水转化为超临界水属于化学变化
【解题思路】 超临界水可处理有机废物,A 叙述正确;水转化为超临界水 时微观结构发生了变化,B 叙述正确;超临界水是一种优良溶剂,C 叙述正确; 水转化为超临界水属于物理变化,D 叙述错误;故选 D。
①原子核和核外的电子所带的电荷总数相等,电性相反,整个原子不显电性。 ②质子和中子又是由更小的微粒夸克构成。 ③核电荷数=质子数=核外电子数=原子序数;相对原子质量≈质子数+中 子数。
(3)原子结构模型的发展历史: 道尔顿:“实心球模型”→汤姆生:“西瓜模 型”→卢瑟福:“核式模型”→玻尔:“分层模型”→“电子云模型”。
浙教版八年级科学下“第二章微粒的模型和符号”复习课件共20张PPT

分子在化学变化中分子 。 A.原子序数:X > Z 表示一个水分子的相对分子质量为18
模仿本节课采用读图联想、比较法、模型法等方法以列表格或知识结构图等形式将第一章电和磁的知识进行自主梳理。
(2)图乙为元素周期表的一部分,X、Y、Z分别表示三种不同的元素,下列判断正确的是( )
④ 表示水由氧元 模仿本节课采用读图联想、比较法、模型法等方法以列表格或知识结构图等形式将第一章电和磁的知识进行自主梳理。
(2)分析微观示意图,你能获得的信息(各写一 条宏)观:方面:在化学变化中,元素的种类保持。不变。
微观方面:在化学变化中,原子的种类和个。数保持不变。
+4
9、5CO32- 符号中各数字表示的意义?
①“2”一个碳酸根离子带两个单位的负电荷,
②“3”一个碳酸根离子中有三个氧原子 ,
③“4”碳元素的化合价为+4价
D .Y 和X的化学性质存在明显的差异
C. 5S
D. C
请采用分类的思想,以知识结构图的形式将上述几种物质进行分类。
属于化合物的是______, 属于混合物的是______。
3、用化学符号填空:1个硫原子 S ;2个氮分 在化学变化中,元素的种类保持不变。
A.原子序数:X > Z
子 2N ,我发现若化学符号前面的数字大于1, 分子在化学变化中分子 。
A.质子数 B.电子数
在化学变化中,元素的种类保持不变。
素和氢元素这
D .Y 和X的化学性质存在明显的差异
请采用分类的思想,以知识结构图的形式将上述几种物质进行分类。
两种元素组成
7、下列各图中“○”和“●”分别表示两种质子数不同的原子,其中能表示由两种化合物组成的混合物的图是( )
④“5” A.原子序数:X > Z
(完整版)浙江科学八年级下册第二章知识点

(完整版)浙江科学⼋年级下册第⼆章知识点第⼆章微粒的模型与符号⼀、模型、符号的建⽴与作⽤1、模型(1)定义:通过⼀定的科学⽅法,建⽴⼀个适当的模型来反映和代替客观对象,并通过研究这个模型来解释客观对象的形态、特征和本质,这就是模型⽅法。
(2)作⽤:可以帮助⼈们认识和理解⼀些不能直接观察到的或复杂的事物。
模型可以是⼀幅图、⼀张表或计算机图象,也可以是⼀个复杂的对象或过程的⽰意。
2、符号:(1)代表事物的标记(2)符号的作⽤:(1)简单明了地表⽰事物(2)可避免由于事物形态不同引起的混乱(3)可避免由于表达的⽂字语⾔不同引起的混乱注:模型与符号的区分:模型可以反映或代替客观对象;符号只能简单明了的表⽰事物。
⼆、物质与微观粒⼦模型1、分⼦与原⼦的区别和联系1、卢瑟福的α粒⼦轰击⾦箔实验:1、⼤多数α粒⼦穿透⾦箔,且不改变前进⽅向,说明原⼦核很⼩,原⼦中有很⼤的空间2、有⼀⼩部分α粒⼦改变了原来的运动路径,说明原⼦核带正电3、有极少数的α粒⼦好像碰到了坚硬不可穿透的质点⽽被弹了回来,说明原⼦的质量集中在原⼦核上2、第⼀个提出原⼦概念的⼈是道尔顿;第⼀个发现电⼦的⼈是汤姆⽣。
3、原⼦的结构核外电⼦:带负电荷原⼦质⼦:带正电荷原⼦核质⼦数+中⼦数=相对原⼦质量中⼦:不带电荷注:(1)核电荷数=质⼦数=核外电⼦数(2)根据核电荷数(即质⼦数)区分原⼦和元素;(3)在⼀个原⼦核中⼀定含有质⼦不⼀定含有中⼦(如氢元素)(4)同位素:原⼦中核内质⼦数相同,中⼦数不相等的同类原⼦的总称。
四、组成物质的元素1、元素:具有相同核电荷数(即质⼦数)的⼀类原⼦的总称。
注:元素和原⼦的区别2、元素的分类1、⾦属元素2、⾮⾦属元素(包括稀有元素)注:稀有元素:性质⾮常稳定,在通常情况下很难与其他元素或物质发⽣化学反应,在⾃然界的含量稀少的元素3、混合物、纯净物(单质、化合物)混合物:由两种或两种以上物质组成的物质。
(空⽓、海⽔、盐酸)物质单质:由⼀种元素组成的纯净物。
一对一教学 新浙教版 八下科学 第二章第4-5节 粒子的模型与符号(2)

浙基教育个性化教学授课教案教师:居建忠学生:时间:
4
A B C D
例2-5】下列说法正确的是()
A.水是由一个氧元素和2个氢元素组成B.水是由氢氧两种元素组成的
C.水是由2个氢原子和一个氧原子构成D.水是由氢气和氧气组成
例2-6】下列关于二氧化硫的说法不正确的是()
A.二氧化硫是由硫和氧气组成的B.二氧化硫是由二氧化硫分子构成的
C.二氧化硫由硫元素和氧元素组成D.二氧化硫分子是由硫原子和氧原子构成的
例2-7】市售的“脑黄金”是从深海的鱼油中提取的,其主要成分是不饱和的脂肪酸,化学式是
该不饱和脂肪酸属(单质、化合物、氧化物),它由种元素组成,它的一个分子中共有
例2-8】(2010济宁)我国的酒文化源远流长,但现实生活中因饮用劣质酒引发的中毒事件时有发生,原因是劣质酒中的甲醇(化学式为CH3OH)含量严重超标.甲醇易引起视神经萎缩、甚至导致双目失明.下面关于甲醇的说法中,正确的是()
3-4】(2011株洲)如图是地壳中各元素的含量(质量分数)图,据此判断下列说法正确的是(A.含量最多的元素是非金属元素
B.含量最多的元素是金属元素
C.铁的元素符号为FE
世纪中叶开始,硅成了信息
技术的关键材料,是目前应用最多的半导体材料.请回答
e”
】夏天一场雷雨后,空气特别清新,这是因为大气中的少量氧气在雷电的作用下变成了臭氧,转变过程于物理变化
)氟原子得到一个电子形成氟离子,钠离子与氟离子结合成氟化钠.请用化学符号表示:。
八下科学课件-2.5.1 元素符号

第2章 微粒的模型与符号
第5节 表示元素的符号 第1课时 元素符号
夯实基础·巩固练
1.写出下列元素符号或名称。 硫___S_____; 硅___S__i ___; 钙___C_a____; 钾___K_____; C___碳_____; N____氮____; P____磷____; He___氦_____;
元素符号 C Hg Mn CA AU fe CL
改正 碳 汞 锰 Ca Au Fe Cl
夯实基础·巩固练
13.经研究发现,在地球上发现的28块火星陨石中含钠、 镁、铝、氯、钾、氧、碳、氢等元素。请用这些信息 填表。
写出金属元素的元素符号 Na、Mg、Al、K 写出非金属元素的元素符号 Cl、O、C、H
夯实基础·巩固练
5.我国有关“矽”元素的记载最早出现于1871年的《化学
鉴原》,它在地壳中的含量排第二位。现代化学中
“矽”元素的名称和元素符号分别是( D ) A.锡 Sn B.铝 Al
C.氧 O
D.硅 Si
夯实基础·巩固练
6.化学符号中常见的表示方法有2Al、Mg2+、I2等,化 学符号中不同部位所出现的数字的意义是不同的。2H 的意义( C ) A.只能表示两个氢元素 B只能表示两种氢元素 C.只能表示两个氢原子 D.既能表示两个氢元素,又能表示两个氢原子
D.S Mg N Ar
夯实基础·巩固练
9.为了书写和学术交流的方便,常采用国际统一的符号, 下列符号中表示2个氮原子的是( A )
夯实基础·巩固练
10.原子序数很大的元素大多都是在实验室中人工合成的。 1982年,德国的达姆施塔特研究所用高速铁离子轰击铋 靶,一个星期后,一个第109号元素的原子诞生了,而且 存在了0.005秒,后来人们将其命名为Meitnerium,中文 名为 。其元素符号的正确写法是( A ) A.Mt B.mt C.mT D.MT
浙教版八年级科学下册第二章微粒的模型和符号复习课课件

D 、L-多巴中H、N元素质量比为
11:14
在这次竞赛中,你有什么收获? 你还有什么困惑?
学以致用
蛋白质的机体生长及修补受损组织的主要原
料,人体通过食物获得的蛋白质在胃肠中与水
反应,生成氨基酸。蛋氨酸(化学式为
C5H11O2NS)就是其中的一种。请回答下列问题。 ⑴蛋氨酸中各元素的质量比C∶H∶O∶N∶S = 60:11:32:14:32; ⑵蛋氨酸中氮元素的质量分数为9.4% ;
A、+3 B、+5 C、+6 D、+7
3、氯元素有多种化合价,它在高氯
酸中显最高价。下列表示高氯酸的化 学式为(B )
A、 HClO3 C、 HClO
B、 HClO4 D、 HCl
同种元素在不同物质中可显不同的化合价
4、已知某元素R只有一种
化合价,其氯化物的化学
式为RCl3,那么其氧化物
的化学式为 R2O3
⑶合格奶粉每100克含蛋白质约18克,蛋白质中氮元 素的平均质量分数为16%,则每100克合格奶粉中氮 元素的质量为 2.88 克;现测定某奶粉每100克中含 有氮元素0.5克。则这种奶粉属于不合格(填“合格” 或“不合格”)奶粉。
⑵蛋氨酸中氮元素的质量分数为
;
。
• 原子构成: 金刚石、铜 在这次竞赛中,你有什么收获?
微粒的模型和符号
则这种奶粉属于
(填“合格”或“不合格”)奶粉。
。
• 离子构成: 氯化钠、硫酸铜。 B、硫化氢气体由三种元素组成
B、 L-多巴是由4种元素组成的物质 C.表示两个氮原子
其化学式
。
3、蔗糖是常见的食用糖,它的化学式是C12H22O11,蔗糖属于-------( ).
浙教版八年级科学下册课件第2章 微粒的模型与符号同步教学课件5

核心笔记
夯实基础
能力提升
自我挑战
2.解题方法
市场上有不法商贩用其溶液浸泡生姜,使生姜发黄发亮,食用此种生姜可能使人中毒。
1(根1克)x/=1据00克化;表示学每10式0克食的盐中意含钠义元素,质量可为3推5. 导出下列计算公式。以化合物AxBy为例,
(1)相对分子质量=
;
根1设.据有化A关学、化式学的B式意的的义计,相算可题推对型导包出原括下:列子计算质公式量。 分别为a、b(注意:若含原子团,则它们表
15.焦亚硫酸钠有毒,不能直接用于食品加工。
(1)计算物质的相对分子质量;
使人中毒。已知焦亚硫酸钠的化学式为Na S O ,相对分子质量 19.我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人
的13生.命食”醋而是获厨得房20中15常年用诺的贝调尔味生品理,学它或的医主学要奖成。分是乙酸,乙酸分子的模型如图所示,其中2 ○代2 表x一个氢原子, 代表一个氧原子,●代表
原子,●代表一个碳原子。下列说法不正确的是( C )
A.乙酸是一种化合物 B.乙酸的相对分子质量为60 C.乙酸中碳元素的质量分数为60% D.乙酸分子中的碳原子、氢原子、氧原子的个数比为1∶2∶1
核心笔记
夯实基础
能力提升
自我挑战
14.Na2S2O3(硫代硫酸钠)是常用的化工原料,下列说法正确的 是( C )
(2)焦亚硫酸钠中硫元素与氧元素的质量比是 ;
市场上有不法商贩用其溶液浸泡生姜,使生姜发黄发亮,食用此种生姜可能使人中毒。
A.C8O.B.健NO 康C.的NO2身D.体SO2需要洁净的饮用水,明矾晶体[化学式
(2021年整理)浙教版科学八年级下册教案第2章《微粒的模型与符号》

浙教版科学八年级下册教案第2章《微粒的模型与符号》编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(浙教版科学八年级下册教案第2章《微粒的模型与符号》)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为浙教版科学八年级下册教案第2章《微粒的模型与符号》的全部内容。
教师教案程教学过程A.世博会会徽 B.眼球结构 C.地球仪 D.动物细胞结构二.物质与微观粒子模型1.分子:在由分子构成的物质中,分子是保持物质的最小粒子.2。
原子:原子是中的最小粒子。
即在化学变化中原子不能。
3.用粒子观点解释物理变化和化学变化。
物质状态改变时,只是构成物质的分子的发生变化;而化学变化中,分子的发生变化,但构成分子的原子和没有发生变化.4.原子和分子区别和联系区别:在化学变化中可分,不可分。
联系: 是由构成的。
分子在化学变化中可以分成原子.【例2】下列关于分子和原子的叙述中正确的是()A.分子比原子的体积大得多B.分子比原子的质量大得多C.海绵能吸水说明分子间有间隔D.氧气O和臭氧具有不同的化学性质三。
原子结构的模型1、对原子结构的认识是通过科学家不断地建立与原子结构模型而得到的.2、原子结构模型的发展历史:____的实心原子结构模型→____的“西瓜模型”→____的“核式模型”→____的“分层模型”→现代“电子云模型”。
物质分裂构成直接构成构成⑷海水中:元素含量由多到少的前四位是_________ 3、物质、元素、分子、原子间的关系五。
表示元素的符号1、熟记下列元素的符号和名称:氢 氦 锂 铍碳 氮 氧 氟 氖 钠 镁 铝 硅 磷B硫 氯锰 铁 铜 锌 金 银 碘 钡 汞 铅 钾A rC a2、元素称号所表示的意义 ①表示一种____(宏观)。
浙教版科学八下第二章微粒的模型与符号第五节

浙教版科学八下第二章微粒的模型与符号第五节第5节表示元素的符号(一)元素符号学习目标1.了解元素符号的书写规则及中文名称规则。
2.熟记常见元素的中文名称和元素符号。
3.理解元素符号所表示的意义。
夯实基础巩固1.请按照元素符号的书写规则判断,下列元素符号中书写正确的是()。
A.镁MGB.铜CuC.锰mnD.锌ZN2.目前已发现的元素达112种,所以很多元素都是由第一个大写字母带一个小写字母来表示的。
下列各组元素中,其元素符号的第一个大写字母完全相同的一组是()。
A.氯、钙、铁B.铝、银、氩C.氖、钠、硅D.镁、锰、锌”“S2+”3.化学符号中常见表示法有“3Al”“I2“”等,化学符号中不同部位所出现的数字意义是不同的。
“2H”表示的意义是()。
A.只能表示两个氢元素B.只能表示两种氢元素C.只能表示两个氢原子D.既表示两个氢元素,又表示两个氢原子4.查找下列元素符号所对应的元素中文名称,判断下列符号所表示的元素全部为金属元素的是()。
A.O、H、ClB.Al、Fe、ZnC.H、P、SiD.Hg、N、Au5.元素符号是最基本的化学语言之一,元素符号通常用该元素的第一个字母大写来表示,当两种元素第一个字母相同时,则附上作为该元素的符号。
6.以H为字头的元素符号有He、Hg等。
请你写出分别以B、C、M、N为字头的元素符号(每空写出两种元素符号即可)。
以字母B开头的元素符号。
以字母C开头的元素符号。
以字母M开头的元素符号。
以字母N开头的元素符号。
7.填写并强记下表中元素的中文名称及符号。
能力提升培优8.大序号的元素大多都是实验室中人工合成的。
1982年,德国的达姆斯塔特用高速铁离子轰击铋靶,一个星期后,一个第109号元素的原子诞生了,而且存在了0.005 s。
后来定名为“Mertnerium”,中文名为“”。
其元素符号的正确写法是()。
A.MtB.mtC.mTD.MT9.化学中元素符号能表示一定的意义,不同的元素符号表示的意义不同。
2020年春浙教版八年级科学下册课件第2章 微粒的模型与符号同步教学课件2

,科学家把所有的已知元素
地排列起来,这样就得到了
。
13.如图是元素周期表的一部分,X、Y、Z分别代表不同的元素。
A.291 B.174 C.117 D.57
2.元素符号表示的意义:
D.Y和Mg属于同一周期
12.2017年5月9日,由中国科学院等相关部门正式发布了113号、115号、117号、118号元素的中文名称。
第5节 表示元素的符号
核心笔记
夯实基础
能力提升
自我挑战
一、元素符号 1.元素符号通常用该元素 拉丁文 的 第一个 字母
大写 来表示。当两种元素的第一个字母相同时,则再附 上 一个小写字母 以示区别。 2.元素符号表示的意义: (1) 一种元素 ; (2) 该元素的一个原子。 3.原子个数的表示: 在元素符号前面添加数字。
电子数,元素的化学性质,等等。
(2)C元素的原子核内有 个质子。
(1)D元素属于 (填“金属”“非金属”或“稀有”)元素。
(2)Cl:
A.氧的元素符号 下列判断不正确的是( )
①Na、Cl ②O、S ③F、Cl ④Cl、Ar
D.Y和Mg属于同一周期
(2)C元素的原子核内有 个质子。
B.地壳中氧元素的含量 (5)5个铝原子: ________
核心笔记
夯实基础
能力提升
自我挑战
二、元素周期表
1.为了便于研究元素的 性质 和 用途 ,科学家把所
有的已知元素 科学有序 元素周期表 。
地排列起来,这样就得到了
2.元素周期表是按 质子数 从小到大有序排列起来的,它共
有7
个横行, 18
个纵列,每一个横行叫做一个
周期 ,每一个纵列叫做一个 族 (其中8、9、10三个
浙教版八年级科学下册思维导图(全册)
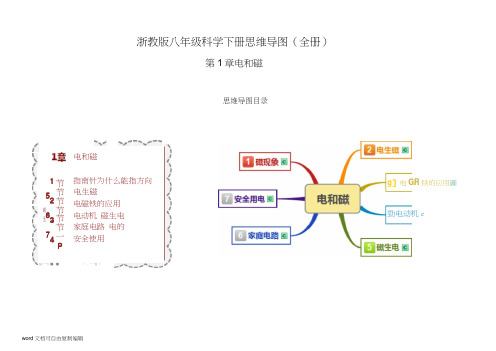
浙教版八年级科学下册思维导图(全册)第1章电和磁思维导图目录电和磁节节节节节节一P1 2 3 4 56 7M H指南针为什么能指方向 电生磁 电磁铁的应用 电动机 磁生电 家庭电路 电的安全使用编十"*0 ■< ■J — * "恤 f勁电动机Cg ]电GR 铁的应用圖1BE休上磁性最强的部位H If理N祀険决淇*同名拠相互抖E斥异名磁极相互啪引衙极间的作用f使没有谨性的物体得到遊性的过程-晦念用蛊箱在钢棒上沿同一方向摩擦十第次「方法磁现象附地暉场地理南极是地磁场的北饭,地理北饭是地磁场的南扱指南针南极指南(地磁场北极)小谨针北极所着的方向为磁场方向百箭头義顽磁场方向;磁感红密磁场强r疏磁场弱夕HE场:从N到S内部逑场:从5到N底屯导件同围存在葩场-冥斯桔实殓醯场电导融中心的同「匕圍「吕通电导録垂亘「向夕曲场逐渐林电生蹿调节R,比较A喙弓I大头针的雰少-赳施大<1、探究电晞铁r-晡性强弱的影响因索羽右手:如图大拇指方向为电磴方向,0 指环毙方向为磁场方向咏变,血中有无枝芯比较大头針旁少自无扶苗用右手:四指坯绕庁叵为电踰方向「大拇指戶鬥旨万向为电竝铁N战方向fVF变B下面大淘+的雰少-戒圏降电遵扶的磁场廿在卑条形磁铁相似通过目隔的佔无殛制歯钳肖无电珮趙重机电拎:随温度上升接通担制宙源,产生魏生吸引衔铁,电铃咂电徳蹩电器具悴应用来垃自动控制:随着水上升,达到嘗戒水位时接11控制电懑「产生磁性吸引衔铁,红XJ亮电訖夭小至化的叫輯电隹号匣过电主v彖決听-> 生兀同的逑注,丛而校薄全屋版产生石同'吃(転訪來圧愿肖电詛专提哥輕=挖制电番工柞乜毒廩理:挖制电勝幵驻整通衔誹吸下,每灯亮,览制电痒幵爻断幵「匚弹蚩吸引D与与惑ftawcr亮臓:低电庄翦电舷制茗电压强电渝r 并巨可以实验巨商咼制通电导体在磁场中受力运动。
运动方向与电漩方向、磁场方向有芙基本原理运动方向判断(左手定律)如图磁感纯穿过手心,四指方向为电流方电‘大拇拒方向国受力运动的方向电动机画电动机廈理通电注昌在金场牛受巧转动,乙圏中线困受力转动,转到甲厘所示位置* 田于二力平衡「不能继绽转动。
浙教版科学八年级下册第2章微粒的模型与符号知识点归纳

浙教版科学⼋年级下册第2章微粒的模型与符号知识点归纳第1节模型、符号的建⽴与作⽤A.模型1.模型:帮助⼈们认识和理解⼀些不能直接观察到的或复杂的事物。
⼀个模型可以是⼀幅图、⼀张表或计算机图像,也可以是⼀个复杂的对象或过程的⽰意2.模型⽅法:通过⼀定的科学⽅法,建⽴⼀个适当的模型来代替和反映客观对象,并通过研究这个模型来揭⽰客观对象的形态、特征和本质的⽅法3.作⽤:帮助⼈们认识和理解⼀些不能直接观察到的或复杂的事物4.⽔的状态模型:由右侧模型可直接地得出⽔在状态变化中,没有变成其他物质,构成⽔的⽔分⼦也没有变成其他分⼦。
在液态⽔变成⽓态⽔的变化中,⽔分⼦之间的距离发⽣了变化B.符号1.定义:代表事物的标记2.意义:简单明了地表⽰事物,可避免由于事物外形不同和表达的⽂字语⾔不同⽽引起的混乱第2节物质的微观粒⼦模型A.构成物质的粒⼦模型1.分⼦的构成1)⼀般常⽤模型来表⽰分⼦由原⼦构成篮球表⽰氧原⼦,⽩球表⽰氢原⼦,⿊球表⽰碳原⼦,棕球表⽰氮原⼦,黄球表⽰硫原⼦2)构成分⼦的原⼦可以是同种原⼦,也可以是不同种原⼦2.分⼦构成物质:在由分⼦构成的物质中,分⼦是保持物质化学性质的最⼩粒⼦。
例如:⽔的性质是由⽔分⼦保持的。
电解⽔时,⽔分⼦变成了氢分⼦和氧分⼦,它们不再保持⽔的化学性质3.有些物质是直接由原⼦构成的。
例如:⾦属铝由铝原⼦构成、铅笔芯内的⽯墨由碳原⼦构成等B.粒⼦的⼤⼩与质量1.分⼦和原⼦都有⼀定的质量和体积1)原⼦的体积很⼩,原⼦半径⼀般在10—10m数量级2)分⼦和原⼦的质量也⾮常⼩。
氢分⼦是最轻的分⼦,其分⼦质量的数量级是—27图⽰2.不同种类的分⼦和原⼦质量不同,体积也不同组成某个分⼦的原⼦,肯定⽐分⼦更⼩,如氢分⼦由2个氢原⼦构成,氢原⼦⽐氢分⼦⼩。
但并不能说原⼦⼀定⽐分⼦⼩,某些原⼦⽐某些分⼦⼤,如铁原⼦⽐氢分⼦⼤第3节原⼦结构的模型A.原⼦结构模型的建⽴2.原⼦的构成原⼦核(带正电荷)原⼦核外电⼦(带负电荷)1)原⼦呈电中性,原因是原⼦核与核外电⼦所带的电量——⼤⼩相等,电性相反2)原⼦核在原⼦中所占的体积极⼩,其半径⼤约是原⼦半径的⼗万分之⼀,但它⼏乎集中了原⼦全部的质量3)核外电⼦在核外空间做⾼速运动B.揭开原⼦核的秘密1.原⼦核的构成1)核电荷数:原⼦核所带的电荷数2)原⼦中:核电荷数= 质⼦数= 核外电⼦数2.夸克1)质⼦和中⼦都是由更微⼩的基本粒⼦——夸克构成的2)夸克还可以再分C.带电的原⼦——离⼦1.离⼦1)离⼦:带电的原⼦或原⼦团。
科学-(完整版)浙教版八年级下册科学第二章《微粒的模型和符号》知识点归纳

(完整版)浙教版八年级下册科学第二章《微粒的模型和符号》知识点归纳第二章微粒的模型与符号知识点归纳第1节模型、符号的建立与作用1、符号: 用符号能简单明了地表示事物,可避免由于事物外形不同和表达地文字语言不同而引起地混乱。
(常见的符号有电路元件符号,交通符号,物理量符号,天气现象符号等)2、水在三态变化中,分子没有发生变化;分子间的距离发生了变化。
3、建立模型的意义:可以帮助人们认识和理解一些不能直接观察到的事物。
模型可以是一幅图、一张表格、一个公式、一个复杂对象或过程的示意。
第2节物质的微观粒子模型1、分子和原子的区别:在化学变化中,分子可分,原子不可再分。
由分子构成的物质中,保持物质化学性质的最小微粒是,由原子构成的物质中,保持物质化学性质的最小微粒则是。
原子是化学变化中最小微粒。
2、化学变化的实质:分子分裂成原子,原子重新组合成新的分子。
化学反应中,一定发生改变的是分子种类(物质种类),一定不发生改变的是原子的种类和数目,可能发生改变的是分子的数目。
3、化学变化和物理变化的本质区别:在变化中,物质的分子变成了其它物质的分子,就是。
在变化中,物质的分子还是原来的分子,只是分子间的距离发生了变化,就是。
(填“物理变化”与“化学变化”)4、分子是由原子构成的。
一些气体、液体主要由分子构成。
5、原子直接构成的物质:金属和固体非金属(硫、碳、磷、硅)及稀有气体6、金刚石和石墨物理性质不同是由于原子排列不同。
7、粒子的大小与质量(1)分子和原子都有一定的质量和体积。
原子的体积很小,半径的数量级在10-10米。
原子的质量也非常小,数量级在10-26千克。
(2)不同质量的原子质量不同,体积也不同。
第3节原子结构的模型一、原子结构模型的建立与修正1、道尔顿--实心球原子结构--发现原子2、汤姆森--“葡萄干面包模型”:原子是一个平均分布着正电荷的球体,带负电荷的电子嵌在中间。
--发现电子3、卢瑟福--“核式(行星绕太阳)模型”:电子绕原子核运行——发现带正电荷质量很大的原子核——α粒子轰击金属箔实验4、波尔--“分层模型”:电子在固定的轨道上运动5、“电子云模型质子(带正电) 夸克二、原子的结构:1、原子:原子核:(带电) 中子(不带电) 夸克(不显电性)核外电子:(带电)(1)原子中,核电荷数=质子数=核外电子数。
浙教版科学八年级(下)第二章粒子的模型与符号讲义(化学)2023.4.14

姓名_________ 班级_________浙教版科学八年级(下)第二章粒子的模型与符号讲义(化学部分2023年4月)本章要点:1.构成物质的微粒2.组成物质的元素3.物质的分类4.表示物质的符号(化学式)5.有关化学式的计算2.1 模型、符号的建立与作用(一)模型一、人们认识客观世界主要有三种方法:逻辑推理法、实验法、模型法。
二、为什么要建立模型?模型法是我们了解和探索客观世界的最有力、最方便、最有效的方法。
三、模型方法的定义:在自然科学研究中,人们通过一定的科学方法,建立一个适当的模型来反映和代替客观对象,并通过研究这个模型来揭示客观对象的形态、特征和本质,这样的方法就是模型方法。
四、模型的五种表现形式:1、某种物体放大或缩小的复制品(地球仪);2、一幅画(地球上水的分布图);3、一张表、计算机图像(密度表);4、一个复杂的过程的示意(细胞分裂过程);5、一个复杂的对象的示意(人耳结构示意图)。
五、模型的作用:帮助人们认识和理解一些不能直接观察到的或复杂的事物。
(二)符号一、符号的举例:二、符号有什么作用?1、用符号能简单明了地表示事物;2、用符号可避免表达的文字语言不同而引起的混乱;3、用符号可避免由于外形不同引起的混乱。
2.2 物质的微观粒子模型(一)构成物质的粒子模型一、原子怎样构成物质?1、不同种类和不同数量的原子就能构成各种不同的分子;2、构成分子的原子可以是同种原子,也可以是不同种原子;3、在由分子构成的物质中,分子是保持物质化学性质的最小粒子;4、一种原子能构成多种物质;5、原子也是构成物质的一种微粒。
原子可以构成分子,也可以直接构成物质。
(二)粒子的大小与质量一、分子非常小,原子也非常小。
二、部分粒子的大小与质量及其得出的结论:1、分子和原子都有一定的质量和体积2、原子的体积很小,原子半径一般在10-10米数量级;3、原子的质量也非常小;4、不同种类的分子和原子质量不同,体积也不相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第5节表示元素的符号(一)元素符号学习目标1.了解元素符号的书写规则及中文名称规则。
2.熟记常见元素的中文名称和元素符号。
3.理解元素符号所表示的意义。
夯实基础巩固1.请按照元素符号的书写规则判断,下列元素符号中书写正确的是()。
A.镁MGB.铜CuC.锰mnD.锌ZN2.目前已发现的元素达112种,所以很多元素都是由第一个大写字母带一个小写字母来表示的。
下列各组元素中,其元素符号的第一个大写字母完全相同的一组是()。
A.氯、钙、铁B.铝、银、氩C.氖、钠、硅D.镁、锰、锌3.化学符号中常见表示法有“3Al”“I2”“S2+”“”等,化学符号中不同部位所出现的数字意义是不同的。
“2H”表示的意义是()。
A.只能表示两个氢元素B.只能表示两种氢元素C.只能表示两个氢原子D.既表示两个氢元素,又表示两个氢原子4.查找下列元素符号所对应的元素中文名称,判断下列符号所表示的元素全部为金属元素的是()。
A.O、H、ClB.Al、Fe、ZnC.H、P、SiD.Hg、N、Au5.元素符号是最基本的化学语言之一,元素符号通常用该元素的第一个字母大写来表示,当两种元素第一个字母相同时,则附上作为该元素的符号。
6.以H为字头的元素符号有He、Hg等。
请你写出分别以B、C、M、N为字头的元素符号(每空写出两种元素符号即可)。
以字母B开头的元素符号。
以字母C开头的元素符号。
以字母M开头的元素符号。
以字母N开头的元素符号。
7.填写并强记下表中元素的中文名称及符号。
能力提升培优8.大序号的元素大多都是实验室中人工合成的。
1982年,德国的达姆斯塔特用高速铁离子轰击铋靶,一个星期后,一个第109号元素的原子诞生了,而且存在了0.005 s。
后来定名为“Mertnerium”,中文名为“”。
其元素符号的正确写法是()。
A.MtB.mtC.mTD.MT9.化学中元素符号能表示一定的意义,不同的元素符号表示的意义不同。
下列对元素符号所表示的意义的解释中,正确的是()。
10.中国对某些化学元素名称在统一规范前曾有其他叫法。
其中“矽”元素在1871年的《化学鉴原》最早出现,它的含量在地壳中占第二位。
现代化学中“矽”的元素名称和元素符号分别是()。
A.锡、SnB.铝、AlC.氧、OD.硅、Si11.元素符号前是否带上数字所表达的意义不完全相同,不同种类的元素符号所表示的意义也不完全相同。
(1)“N”既可以表示,又可以表示,而“3N”只表示。
(2)金属、稀有气体、某些非金属单质(如碳、硫、磷)等一些元素的单质,其元素符号还可以表示该元素的单质。
请写出“Cu”符号所表达的三层意思:①;②;③。
12.在前一课时中,我们曾学习了元素的分布及某些元素的性质、作用等相关知识。
请按要求写出下列有关元素符号:(1)地壳中分布最多的两种非金属元素。
(2)地壳中分布最多的两种金属元素。
(3)一种呈黄色固态的非金属单质。
(4)构成人体骨骼、牙齿等必不可少的金属元素。
13.请根据初中科学学习阶段所要求的30多种元素的名称进行分析,按要求用元素符号填写下列空格:(1)除氦、氖、氩等稀有气体外,常温常压下其单质为气体的元素有。
(2)常温下其单质为液体的非金属元素有。
(3)常温下其单质为液体的金属元素有。
(4)常温下为固体的非金属有。
中考实战演练14.【泰州】国际通用的元素符号是用1个或2个拉丁文字母表示的,其中第一个字母大写,第二个字母小写。
镍元素的拉丁文名称为Niccolum,则镍的元素符号为()。
A.NiB.NIC.ND.Na15.【滨州】下列各组元素中,元素符号的第一个字母相同的一组是()。
A.氯、碳、钙、铜B.氢、汞、铁、银C.钠、镁、氧、氮D.锰、硫、锌、钡16.【聊城】规范书写是我们学习中必须遵循的原则,小明在元素周期表中查找到如图所示的一格后,明白了不能把一氧化碳写成“Co”的原因。
(1)“Co”表示(填名称)元素。
(2)“CO”是由(填名称)两种元素组成的(填“单质”或“化合物”)。
开放应用探究17.根据资料分析并回答下列问题:自从丹麦科学家玻尔建立了核外电子分层排布的原子模型后,许多科学家进一步深入研究,找到了核外电子排布的许多规律。
其中最基本的核外电子排布规律是“288”规则,即当一个原子核外有许多电子分层排布时,先排第一层且最多排2个,再排第二层且最多排8个……最外层最多排8个电子。
当最外层电子排满时,该原子(或离子)是最稳定的。
一般,当其最外层电子数少于4个时,这种原子易失去电子成为阳离子,显示出金属性;当最外层电子数大于等于4时,该原子易得到电子成为阴离子,该元素显示出非金属性。
(第17题)如图所示为某原子结构示意图,则:(1)根据该原子结构示意图,可确定该元素序号为,该元素名称为,元素符号为。
(2)该原子最外层电子数为,在化学反应中容易(填“得到”或“失去”)3个电子而成为离子。
(3)该元素在分类上属于元素。
(二)元素周期表学习目标1.了解元素周期表的基本结构,了解元素周期表中的周期和族的含义。
2.了解元素周期表中的每一格所包含的信息,了解元素周期表的排列与元素单质的性质等之间的关系。
3.了解元素周期表的发现及其对我们的启发。
夯实基础巩固1.下列关于元素、元素符号、元素周期表的说法中,不正确的是()。
A.元素本身没有好与坏之分,而人们对元素的应用却存在合理与不合理之分B.元素种类的确定取决于其原子核内的质子数,与中子数无关C.科学家创建元素符号、化学式等化学用语,是为了增加化学科学的神秘色彩D.从元素周期表中可以获取元素名称、原子序数、相对原子质量等信息2.如图所示为元素周期表第三周期的局部,据此判断下列说法中正确的是()。
A.它们都属于金属元素B.1个铝原子的质量是26.98 gC.硅元素的原子序数为14D.镁元素的相对原子质量为123.初步认识元素周期表。
请参照教材附录4“元素周期表”,回答下列问题:(1)化学历史上曾出现过多种元素周期表,最科学的元素周期表是由俄国化学家制定的。
(2)元素周期表中的行称为,列称为。
(3)元素周期表共有个周期。
(4)元素周期表共有纵列,分为个族。
(5)元素周期表纵列上端的“ⅥA”的含义是。
4.如图所示为元素周期表中硫元素的信息示意图。
大写字母A~D所对应的部分所代表的意义分别为:A ;B ;C ;D 。
5.仿照元素周期表,在下表的相应空格内默写出核电荷数从1~20的元素名称及元素符号。
6.现有硫、钾、钙、钠、镁、氧六种元素,请参照第5题的局部元素周期表,回答下列问题:(1)属于第三周期元素的有(按元素序号从小到大用符号填写,下同)。
(2)属于第ⅥA族元素的有。
(3)分析这几种元素的核电荷数与相对原子质量,两者之间存在的数量关系为。
能力提升培优7.已知氢有氕、氘、氚三种同位素原子,这三种同位素原子在元素周期表中所占的格子情况应该是()。
A.分占三个格子B.共占一个格子C.只有氕占一个格子D.都不占格子8.按元素周期表(局部)提供的信息,下列有关判断中错误的是()。
A.铍(Be)和镁属于同一个族B.第二、第三周期元素的原子最外层电子数从左到右依次增多C.铝原子的核内中子数为13D.同一族元素的原子最外层电子数相等9.元素周期表的一个重要意义是推测新元素和元素的性质。
氯、溴、碘都是ⅦA族的元素,分处于第三、第四、第五周期。
同一族元素的性质相近且变化具有规律性。
当年门捷列夫在排元素周期表时,就根据已知的氯和碘两元素单质的性质成功地推测了未知溴元素的性质,为发现溴元素指明了方向。
已知氯是一种黄绿色气体,而碘是一种紫黑色固体。
请仿照门捷列夫的思路推测,处于两者之间的溴元素单质的有关性质。
(1)常温下溴元素的单质的状态可能为。
(2)溴元素的单质颜色可能为(填字母)。
A.无色B.白色C.红棕色D.深黑色10.下面是元素周期表的一部分,观察分析其中的数据总结规律(至少写出两条):规律1 。
规律2 。
11.如图所示为元素周期表中的一部分,请根据该周期表回答下列问题:(1)表内的第二、第三行元素中,左侧的元素类型为(填“金属元素”“非金属元素”或“稀有气体”,下同),右侧的元素类型为,每一行的最后一列为。
(2)①碳、氮、氧三种元素处在周期表的第周期。
②第三周期中的稀有气体元素为(填元素符号)。
③在第ⅥA族中,表中出现的元素有(填元素符号)。
④元素Al出现在第族中。
中考实战演练(第12题)12.【兴安】如图所示为元素周期表中铈元素的信息,下列有关说法中错误的是()。
A.铈原子核内中子数为58B.铈原子核外电子数为58C.铈的相对原子质量为140.1D.铈的原子序数为5813.【天津】元素周期表是学习和研究化学的重要工具,请回答下列问题:(1)元素周期表中不同元素间最本质的区别是(填字母,下同)。
A.质子数不同B.中子数不同C.相对原子质量不同(2)1869年,发现了元素周期律并编制出元素周期表。
A.张青莲B.门捷列夫C.拉瓦锡(3)元素周期表中氟元素的有关信息如图所示,下列说法中正确的是。
A.氟属于金属元素B.氟的原子序数是9C.氟的相对原子质量是19.00 g14.【舟山】元素周期表将已知元素科学有序地排列起来,便于我们研究它们的性质和用途。
如图所示为元素周期表的一部分,请回答下列问题:(1)元素在周期表中的分布是有规律的,表中①②③所代表的三种元素中,属于非金属元素的是。
(2)随着新元素的不断发现,元素周期表还将逐渐完善。
最近,科学家用大量高速钙原子轰击铕原子,形成了第117号元素的原子,该元素原子核中一定含有117个。
15.【泉州】元素周期表是学习和研究化学的重要工具。
请根据下表(元素周期表的部分内容)回答下列问题:1 (1)请从上表中查出关于硼元素的一条信息。
(2)第三周期(横行)中,属于金属元素的是(填一种)。
(3)第11号元素与第17号元素组成的化合物名称叫,构成该物质的微粒是(填“分子”“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质,则下列各组元素中具有相似化学性质的是(多选,填字母)。
A.C和NeB.Be和MgC.Al和SiD.F和Cl能力提升培优16.【自贡】(1)人体中必需的微量元素铁、氟、锌、硒、碘等,虽然含量少,但对健康至关重要。
根据这几种微量元素的相关信息可知:上述微量元素中属于金属元素的有种;锌原子核外电子数为。
(2)如图所示为元素周期表的一部分,X、Y、Z代表三种不同元素,下列判断中正确的是(多选,填字母)。
A.原子序数:Z>YB.核外电子数:X=YC.Y和Z处于同一周期17.有A、B、C、D、E五种元素,都属于第1~第18号元素。
A元素的单质是密度最小的气体;B元素的次外层电子数占电子总数的;C元素的阳离子C2+比B原子多2个电子;D 和C具有相同的电子层数;D-的离子结构与氩原子结构相同;E和B具有相同的最外层电子数,但E比B多一个电子层。
