非金属及其化合物关系图及方程式
第11讲 常见非金属及其重要化合物(课件)-2023届高考化学二轮复习(全国通用)

化学
2023
二轮精准复习45讲
第11讲
常见非金属及其重要化合物
有关非金属元素单质及其化合物的性质和用途的思维途径
1.硅及其化合物
(1)硅及其化合物的“价类二维”转化。
理清知识主线:
-
H4
-
H4
+
O
+
+
O2
+
O2(H2 O3)
(2)重要反应的方程式。
ClO-+Cl-+2H+═Cl2↑+H2O
⑦将SO2和Cl2混合,漂白性减弱的原因(用离子方程式表示)。
SO2+Cl2+2H2O
+
4H +S +2Cl
(3)扫除易忘知识盲点。
①液氯密封在钢瓶中,而氯水、次氯酸应保存在棕色试剂瓶中。
②酸性KMnO4溶液应用硫酸酸化。
酸化KMnO4溶液不能用盐酸,也不能用硝酸
③ClO-不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO-与
-、Fe2+均不能大量共存。
、I
SO23
④当Fe与Cl2在加热条件下反应时,不论Fe过量还是不足,由于Cl2的强氧化
性,产物一定是FeCl3。
⑤“84”消毒液的有效成分为NaClO,漂粉精的有效成分为Ca(ClO)2。“84”消
3S↓+3H2O
④书写下列反应的化学方程式。
a.将 SO2 通入 H2S 溶液中。
2H2S+SO2
3S↓+2H2O
b.Cu 与浓硫酸混合加热。
Cu+2H2SO4(浓)
元素化合物的转化关系网络图

元素化合物的转化关系一、常见金属元素(Na 、Al 、Fe 、Cu )单质及其重要化合物。
1、钠及其重要化合物间的转化关系。
写出图中标号反应的化学方程式或离子方程式。
① 2Na + O 2 Na 2O 2(淡黄色)② 2Na 2O 2 + 2H 2O = 4NaOH + O 2↑ 2Na + 2H 2O = 2Na + + 2OH - + H 2↑ ③ 2Na 2O 2 + 2H 2O = 4NaOH + O 2↑ 2Na 2O 2 + 2H 2O = 4Na + + 4OH -+ O 2↑ ④ 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2⑤ 2NaCl +2 H 2O 2NaOH + H 2↑ + Cl 2↑(氯碱工业)2Cl - +2 H 2O 2OH - + H 2↑ + Cl 2↑⑥ Na 2CO 3 + H 2O +CO 2 = 2NaHCO 3 CO 3 2-+ H 2O +CO 2 = 2HCO 3- ⑦ 2NaClO + H 2O +CO 2 = Na 2CO 3+ HClO2、铝及其重要化合物间的转化关系。
写出图中标号反应的化学方程式或离子方程式。
① 4Al + 3O 2 2Al 2O 3 2Al + Fe 2O 3 2Fe + Al 2O 3 ② 2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑ 2Al +2OH - +2H 2O = 2AlO 2- +3H 2↑③ 2Al 2O 3 4Al+3O 2↑④ Al 2O 3+6HCl = 2AlCl 3+3H 2O Al 2O 3 + 6H + = 2Al 3+ + 3H 2O通电 通电 通电 点燃 高温⑤ Al 2O 3 + 2NaOH = 2NaAlO 2 +H 2O Al 2O 3 + 2OH - = 2AlO 2- + H 2O ⑥ AlCl 3 +3NH 3·H 2O = Al(OH)3↓+ 3NH 4Cl Al 3+ + 3 NH 3·H 2O = Al(OH)3↓+ 3NH 4+ AlCl 3 +3Na OH = Al(OH)3↓+ 3NaCl Al 3+ + 3OH - = Al(OH)3↓ ⑦ Al(OH)3 + NaOH =NaAlO 2 +2 H 2O Al(OH)3 + OH - = AlO 2- +2H 2O ⑧ Al 3+ +3 AlO 2- +6H 2O = 4Al(OH)3↓3、铁及其重要化合物间的转化关系。
必修1_物质转化关系图及相应化学方程式

必修1 物质转化关系图及相应化学方程式一、金属钠及其重要化合物的相互转化(括号内写离子方程式)1、4 Na + O 2 === 2 Na 2O2、2 Na +O 2△Na 2O 23、2 Na +2 H 2O===2 NaOH +H 2↑ (2 Na +2 H 2O===2 Na ++2 OH -+H 2↑)4、Na 2O + H 2O===2 NaOH (Na 2O +H 2O===2 Na ++2 OH -) *5、2Na 2O 2 +2H 2O === 4 NaOH +O 2↑ (2Na 2O 2+2 H 2O =4Na ++4OH -+O 2↑) *6、2 Na 2O 2 + 2 CO 2 === 2 Na 2CO 3+O 27、2 NaOH + CO 2 === Na 2CO 3+H 2O (CO 2+ 2 OH - = CO 32-+H 2O ) 8、NaOH + HCl === NaCl +H 2O (OH — + H += H 2O)9、Na 2CO 3+2HCl =2NaCl +CO 2↑+H 2O (CO -23+ 2H + = CO 2↑ + H 2O )10、NaHCO 3+HCl =NaCl +CO 2↑+H 2O (HCO -3+ H + = CO 2↑ + H 2O )11、Na 2CO 3+CO 2+H 2O= 2 NaHCO 3 (CO 32— + CO 2 + H 2O= 2 HCO 3—)12、NaHCO 3+NaOH =Na 2CO 3+H 2O (HCO -3+OH - = CO -23 + H 2O )2 NaHCO 3△Na 2CO 3+CO 2↑+H 2ONa 2O Na ①NaCl NaHCO 3Na 23Na 2O 2 ② ③ ④ ⑤ ⑥⑦ ⑧ ⑨⑩ ⑾ ⑿二、非金属氯及其化合物的相互转化(括号内写离子方程式)1、H 2 + Cl 2点燃2HCl 2、2Na + Cl 2 点燃2NaCl3、Cu + Cl 2 点燃CuCl 24、2Fe + 3Cl 2点燃2FeCl 35、HCl +AgNO 3 = AgCl↓+HNO 3 (Cl -+Ag +=Ag Cl↓)6、NaCl +AgNO 3 = AgCl↓+NaNO 3 (Cl -+Ag +=AgCl↓)7、CuCl 2+2AgNO 3 = 2AgCl↓+Cu(NO 3)2 (Cl -+Ag +=AgCl↓)8、FeCl 3+3AgNO 3 = 3AgCl↓+Fe(NO 3)3 (Cl -+Ag +=AgCl↓)9、Cl 2 + 2NaOH = NaCl + NaClO + H 2O (Cl 2 + 2OH - = Cl - + ClO - + H 2O) 10、2Cl 2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H 2O(Cl 2 + 2OH - = Cl - + ClO - + H 2O)11、Cl 2 + H 2O = HCl + HClO (Cl 2 + H 2O = H ++Cl -+ HClO) 12、NaClO +HCl = NaCl + HClO (ClO - +H += HClO)2NaClO+H 2O+CO 2= Na 2CO 3+ 2HClO (2ClO -+H 2O+CO 2= CO 32-+ 2HClO) 13、Ca(ClO) 2+2HCl = CaCl 2 + 2HClO (ClO - +H += HClO)Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO (Ca 2++2ClO -+H 2O+CO 2=CaCO+ 2HClO)14、2HClO 2HCl+O 2↑NaCl 23AgCl⑤ ⑥ ⑦ ⑧光照三、金属铝及其重要化合物的相互转化(括号内写离子方程式)1.4Al +3O 2点燃2Al 2O 3 2.2 Al (OH )3△Al 2O 3 +3H 2O3.2Al +6HCl==2AlCl 3+3H 2↑ ( 2Al +6H +==2 Al 3++3H 2↑) 4.2Al +2NaOH +2H 2O==2NaAlO 2+3H 2↑ (2 Al +2OH -+2H 2O =2AlO 2-+3 H 2↑)5.Al 2O 3+6HCl =2AlCl 3+3H 2O ( Al 2O 3+6H +=2Al 3++3H 2O ) 6. Al 2O 3+2NaOH =2Na AlO 2+H 2O (Al 2O 3+2OH -=2 AlO 2-+H 2O )7、Al (OH )3+3HCl =AlCl 3+3H 2O ( Al (OH )3+3H + = Al 3++3H 2O )8、Al (OH )3+NaOH =NaAlO 2+2H 2O ( Al (OH )3+OH - = AlO 2-+2H 2O )9、实验制取Al (OH )3: AlCl 3+3NH 3·H 2O = Al (OH )3↓+3NH 4Cl (Al 3++3 NH 3·H 2O = Al (OH )3 ↓+ 3NH 4+ )AlAl (OH )3NaAlO 2Al 2O 3AlCl 3①②③④ ⑤ ⑥⑦ ⑧四、金属铁及其化合物的相互转化(括号内写离子方程式)1、3Fe +2O2 点燃Fe3O42、Fe+2HCl=FeCl2+H2↑(Fe+2H+=Fe2++H2↑)Fe+CuCl2=FeCl2+Cu (Fe+Cu2+=Fe2++Cu)3、FeO+2HCl=FeCl2+H2O(FeO+2H+=Fe2++H2O)4、Fe2O3+6HCl=2 FeCl3+3H2O (Fe2O3+6H+=2Fe2++3H2O)5、FeCl2+2NaOH =Fe(OH)2↓+2NaCl (Fe2++2OH-=Fe(OH) 2)↓6、Fe(OH)2 + 2HCl=FeCl2+2H2O(Fe(OH)2+2H+=Fe2++2H2O)7、FeCl3+3NaOH =Fe(OH)3↓+3NaCl ( Fe3++3OH-=Fe(OH) 3↓)8、Fe(OH) 3+3HCl=FeCl3+3H2O (Fe(OH) 3+3H+=Fe3++3H2O)9、2FeCl2+Cl2=2FeCl3 (2Fe2++Cl2=2 Fe3++2Cl—)10、属于化合反应的:Fe+2FeCl3 =3FeCl2(Fe +2 Fe3+=3 Fe2+) 印刷腐蚀电路板:Cu+2FeCl3 =CuCl2+2FeCl2 (Cu+2 Fe3+=Cu2++2 Fe2+)11、2 Fe(OH)3△Fe2O3+3H2O12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色4 Fe(OH)2+ O2 + 2 H2O ═ 4 Fe(OH) 3①Fe3O4②23⑾⑿。
非金属及其化合物重要化学方程式总结(答案)

非金属及其化合物重要化学方程式总结一.碳、硅及其化合物Si 和NaOH 溶液的反应Si +2OH -+H 2O===SiO 2-3+2H 2↑;SiO 2和NaOH 溶液的反应SiO 2+2OH -===SiO 2-3+H 2O ;SiO 2和C 的反应SiO 2+2C=====高温Si +2CO ↑;SiO 2和氢氟酸的反应SiO 2+4HF===SiF 4↑+2H 2O ;向Na 2SiO 3溶液中通入过量CO 2气体SiO 2-3+2CO 2+2H 2O===H 2SiO 3↓+2HCO -3;Mg 在CO 2中燃烧2Mg +CO 2=====点燃2MgO +C ;向澄清石灰水中通入少量CO 2气体Ca 2++2OH -+CO 2===CaCO 3↓+H 2O ;向澄清石灰水中通入过量CO 2气体OH -+CO 2===HCO -3;⑨除去CO 2中的COCO +CuO=====△CO 2+Cu ;生产普通玻璃的原理Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑、CaCO 3+SiO 2=====高温CaSiO 3+CO 2↑。
二.氯气及其化合物Cl 2和H 2O 的反应Cl 2+H 2O H ++Cl -+HClO ;Cl 2和NaOH 溶液的反应Cl 2+2OH -===Cl -+ClO -+H 2O ;Cl 2和石灰乳的反应Cl 2+Ca(OH)2===Ca 2++Cl -+ClO -+H 2O ;把Cl 2通入到Na 2SO 3溶液中Cl 2+SO 2-3+H 2O===SO 2-4+2H ++2Cl -; 将Cl 2和SO 2混合通入H 2O 中SO 2+Cl 2+2H 2O===4H ++2Cl -+SO 2-4;将Cl 2通入到氢硫酸溶液中Cl 2+H 2S===S ↓+2H ++2Cl -;将浓盐酸和MnO 2混合加热MnO 2+4H ++2Cl -=====△Mn 2++Cl 2↑+2H 2O ;电解饱和食盐水2Cl -+2H 2O=====电解Cl 2↑+H 2↑+2OH -;将浓盐酸与漂白液混合Cl -+ClO -+2H +===Cl 2↑+H 2O ;将浓盐酸与KClO 3溶液混合6H ++5Cl -+ClO -3===3Cl 2↑+3H 2O ;向KMnO 4固体滴加浓盐酸2MnO -4+16H ++10Cl -===2Mn 2++5Cl 2↑+8H 2O ;向漂白粉溶液中通入少量CO 2气体Ca 2++2ClO -+CO 2+H 2O===CaCO 3↓+2HClO 。
非金属及其化合物化学方程式汇总

非金属及其化合物化学方程式汇总1.硅的化学性质:Si + O2 SiO2Si + 2NaOH + H2O === Na2SiO3 + 2 H2↑Si + 4HF === SiF4↑+ 2 H2↑2.二氧化硅的化学性质:①酸性氧化物的通性:SiO2+ 2NaOH == Na2SiO3+ H2O离子方程式SiO2+ CaO △CaSiO3②弱氧化性:SiO2+2C高温2CO+Si③与酸(只与氢氟酸)反应——腐蚀玻璃4HF+SiO2==SiF4↑+2H2O3.氯气的化学性质:2Fe+3Cl2点燃2FeCl3Cu+Cl2点燃CuCl2注意:Cl2的氧化性强,和可变价金属反应生成高价的金属氯化物!2Na+ Cl2点燃2NaClH2+ Cl2点燃2HClCl2+ H2O ==== HCl + HClO2HClO ==== 2HCl + O2↑离子方程式Cl2 + 2NaOH ===== NaCl + NaClO + H2O离子方程式Cl2 + 2Ca(OH)2 ===== CaCl2 + Ca(ClO)2 + H2O离子方程式Ca(ClO)2+2HCl==CaCl2+2HClO离子方程式注意:①Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO②2HClO==2HCl +O2↑③Ca(ClO)2+2HCl==CaCl2+2HClO①漂白原理;①②在空气中变质;③工业上应用4.卤素的性质:①与氢气反应:H 2+F 2==2HFH 2+ Cl 2 点燃2HCl H 2+ Br 2加热2H Br H 2+ I 2加热2HI ②与水反应:2H 2O+2F 2==4HF+O 2Cl 2+ H 2OHCl + HClO 离子方程式Br 2+ H 2OHBr+ HBrO 离子方程式 I 2+ H 2OHI + HIO 离子方程式③与碱反应:Cl 2 + 2NaOH ===== NaCl + NaClO + H 2O离子方程式Br 2+ 2NaOH ===== NaBr + NaBrO + H 2O离子方程式I 2 + 2NaOH ===== NaI+ NaIO + H 2O离子方程式④置换反应:Cl 2 + 2NaBr===== 2NaCl + Br 2离子方程式Cl 2 + 2NaI===== 2NaCl + I 2离子方程式Br 2 + 2NaI===== 2NaBr + I 2离子方程式5.硫的化学性质: ①还原性:S+O 2 点燃 SO 2 ②氧化性:S+H 2△ H 2S 2Cu+S△ Cu 2S Fe+S △FeS注意:S 的氧化性较弱,和可变价金属反应生成低价的金属硫化物! 2Na+ S == 2Na 2S③3S+6NaOH △2Na 2S+Na 2SO 3+3H 2O离子方程式④硫的特性:S+2Hg==HgS (用硫粉除去洒落的Hg 珠) 2Ag+S==Ag 2S6.二氧化硫的化学性质:①酸性氧化物的通性:SO 2+H 2O H 2SO 3SO 2+ 2NaOH == Na 2SO 3+ H 2O离子方程式 SO 2+ NaOH == NaHSO 3离子方程式 SO 2+ CaO == CaSO 3②还原性:SO 2+2H 2O+Cl 2== H 2SO 4+2HCl离子方程式 SO 2+2H 2O+Br 2== H 2SO 4+2HBr离子方程式 SO 2+2H 2O+I 2== H 2SO 4+2HI离子方程式 SO 2+2H 2O+X 2== H 2SO 4+2HX (X= Cl 、Br 、I ) 离子方程式 ③氧化性:SO 2+2H 2S== 3S ↓+2H 2O7.硫酸的化学性质:①酸的通性:H 2SO 4+Zn== ZnSO 4+ H 2↑CuO +H 2SO 4== CuSO 4 + H 2O2NaOH +H 2SO 4==Na 2SO 4 +H 2ONa 2CO 3 +H 2SO 4==Na 2SO 4 +H 2O +CO 2↑②浓硫酸具有强氧化性:S+2H 2SO 4(浓) △3SO 2↑+2H 2OC+2H 2SO 4(浓) △ CO 2↑+2SO 2↑+2H 2O(浓H 2SO 4与非金属反应时只作氧化剂) Cu+2H 2SO 4(浓)△ CuSO 4+SO 2↑+2H 2O (浓H 2SO 4与金属反应既表现出氧化剂有表现出酸性)③吸水性:④脱水性:8. 硝酸的化学性质:①酸的通性:CuO +2HNO 3== Cu(NO 3)2 + H 2ONaOH +HNO 3==NaNO 3 +H 2ONa 2CO 3 + 2HNO 3==2NaNO 3 +H 2O +CO 2↑ ②浓硝酸具有强氧化性:S+6HNO 3(浓) △H 2SO 4+6NO 2↑+2H 2OC+4HNO 3(浓) △ CO 2↑+4NO 2↑+2H 2O(浓H 2SO 4与非金属反应时只作氧化剂) Cu+2H 2SO 4(浓)△ CuSO 4+SO 2↑+2H 2O Cu+4HNO 3(浓) △Cu(NO 3)2+2NO 2↑+2H 2O离子方程式 (浓HNO 3与金属反应既作氧化剂又作酸)9. H 2S 、HI 通入浓硫酸中H 2S+H 2SO 4(浓)==SO 2↑+S ↓+2H 2O2H 2S+H 2SO 4(浓)==3S ↓+4H 2O2HI+H 2SO 4(浓)==SO 2↑+I 2+H 2O10.工业上用接触法制硫酸:4FeS 2+11O 2 催化剂 △ 2Fe 2O 3+8SO 22SO 2+O 2 催化剂 高温高压 2SO 3SO 3+H 2O==H 2SO 411.工业上生产HNO 3:4NH 3+5O 2 催化剂 △ 4NO+6H 2O2NO+O 2==2NO 23NO 2+H 2O==2HNO 3+NO12.工业上生产晶体硅/玻璃:①晶体硅: SiO 2+2C==2CO+Si (粗硅,后两步用于提纯)Si+2Cl 2==SiCl 4(g )SiCl 4+2H 2==Si+4HCl ②玻璃:Na 2CO 3+SiO 2 高温 Na 2SiO 3+CO 2↑ CaCO 3+SiO 2 高温CaSiO 3+CO 2↑(CaSiO 3的热稳定性比CaCO 3强) 13.实验室制NH 3、Cl 2:①制取NH 3:2NH 4Cl (固)+C a (O H )2(固) △ CaCl 2+2NH 3↑+2H 2O (此方程式不能写离子反应方程式。
常见金属非金属及其化合物的化学方程式

常见金属非金属及其化合物的化学方程式好嘞,今天我们来聊聊那些常见的金属和非金属,还有它们的化合物。
这些东西可真是咱们日常生活中随处可见,搞得我一想到就忍不住想笑。
先说说金属吧,听起来高大上,其实它们在我们生活中可真是亲民啊。
比如说铁,咱们的“铁哥们”,不管是做成铁钉还是锅,都是陪伴着我们。
铁和氧气一旦碰上,哎呀,锈就来了,这可不是好事。
我们说“铁锈生锈”,这个道理大家都懂。
化学方程式上写成这样:4Fe + 3O₂ →2Fe₂O₃,听起来挺复杂,其实就是铁在空气中和氧气玩捉迷藏,最后变成了铁锈。
再说说铝,很多人都知道铝箔吧,包食物、烤东西,真是个好帮手。
铝和氧气结合成氧化铝,这可真是个有趣的过程。
化学方程式是4Al + 3O₂ → 2Al₂O₃。
铝在高温下和氧气反应,就像在炫技一样,真是个调皮捣蛋的小家伙。
然后是铜,铜的电线可是咱们家电的“命根子”。
铜和氧结合后也能产生氧化铜,这化学式写成2Cu + O₂ →2CuO。
真是简单明了,铜就像是在和氧气进行一场“贴贴”的游戏。
转过头来聊聊非金属,别看它们不如金属那样“闪闪发光”,其实也是个“厉害角色”。
像氯,这家伙可真调皮,单独一个氯气是绿色的,跟小绿人似的。
氯跟钠结合成氯化钠,就是咱们平常用的盐,听说过“盐能治百病”吧,这可不是说说而已。
氯和钠反应的方程式是2Na + Cl₂ → 2NaCl。
简简单单就把两个元素结合在一起,成就了咱们的美味。
还有硫,硫可是一位“火山之神”,在自然界中可是个大忙人。
硫和氧反应,生成了二氧化硫,这化学方程式是S + O₂ → SO₂。
听说这个东西一多就会造成酸雨,大家可得注意,别让它把咱们的屋顶给腐蚀了。
然后再说说碳,碳是个万用的元素,能跟很多东西“搭伙”。
比如说,碳和氧结合成二氧化碳,化学式是C + O₂ → CO₂。
这个小家伙可是我们呼吸时的“老朋友”,虽然有时候也被人说成“坏蛋”,但其实它在植物的光合作用中可是个“大功臣”。
元素(金属、非金属)及其化合物化学方程式

金属及其化合物1、钠放置在空气中 4Na + O2 = 2Na2O2、钠在空气中燃烧(黄色的火焰)2Na + O2 Na2O2(淡黄色固体)3、铝箔被氧气氧化 4Al + 3O2 △2O34、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2NaOH + H2↑【2Na + 2H2O = 2Na+ + 2OH - + H2 ↑】5、高温下铁与水反应 3Fe + 4H2O(g) 高温Fe3O4 + 4H26、铝片与稀盐酸反应 2Al + 6HCl = 2AlCl3 + 3H2↑【2Al + 6H+ = 2Al3+ +3H2↑】7、铝与氢氧化钠溶液反应(实际是钠和水反应) 2Al + 2NaOH + 2H2O = 2NaAlO2(偏铝酸钠) + 3H2↑【2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑】8、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O = 4NaOH + O2↑【2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑】9、过氧化钠可用在呼吸面具和潜水艇中作为【供氧剂】,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O210、苏打(纯碱)与盐酸反应 Na2CO3 +2HCl=2NaCl+H2O +CO2↑【 CO32- + 2H+ = H2O + CO2↑】11、小苏打(碳酸氢钠)溶液与盐酸反应 NaHCO3 + HCl= NaCl+H2O +CO2↑【HCO3- + H+ = H2O + CO2↑】12、小苏打受热分解 2NaHCO3△Na2CO3 + H2O +CO2 ↑13、小苏打和氢氧化钠溶液溶液反应NaHCO3+NaOH= Na2CO3 + H2O 【HCO3-+ OH - = H2O + CO32- 】14、氧化铝溶于氢氧化钠溶液Al2O3 + 2NaOH ===2NaAlO2 +H2O 【Al2O3 + 2OH - === 2AlO2- + H2O】15、氧化铝溶于硫酸Al2O3+ 3H2SO4==Al2(SO4)3+3H2O 【Al2O3 +6H+ = 2Al3+ +3H2O】16、硫酸铝溶液中滴加过量氨水Al2(SO4)3 +6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4【Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+】17、氢氧化铝中加盐酸 Al(OH)3 + 3HCl = AlCl3 + 3H2O 【Al(OH)3 + 3H+ = Al3+ + 3H2O】18、Al(OH)3与NaOH溶液反应: Al(OH)3 + NaOH NaAlO2 +2H2O【Al(OH)3 + OH - = AlO2- +2H2O】19、氢氧化铝受热分解 2Al(OH)3△Al2O3+3H2O20、铁与盐酸反应 Fe + 2HCl = FeCl2 + H2↑【Fe + 2H+ = Fe2+ + H2↑】21、氧化铁溶于盐酸中 Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O 【Fe 2O 3 + 6H + = 2Fe 3++ 3H 2O 】 22、氧化亚铁溶于盐酸中 FeO + 2HCl = FeCl 2 + H 2O 【FeO + 2H += Fe 2++ H 2O 】 23、氯化铁溶液中滴入氢氧化钠溶液 FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl【Fe 3++ 3OH - = Fe(OH)3 ↓(红褐色沉淀)】 24、硫酸亚铁溶液中滴加氢氧化钠溶液Fe SO 4+ 2NaOH = Fe(OH)2↓+ Na 2SO 4 【Fe 2++ 2OH - = Fe(OH)2 ↓(白色沉淀)】25、氢氧化亚铁在空气中被氧化(白色沉淀迅速变为灰绿色,最后变为红褐色沉淀) 4Fe(OH)2 + O 2 +2H 2O = 4Fe(OH)3 26、氢氧化铁受热分解 2Fe(OH)3△Fe 2O 3+3H 2O27、氯化亚铁溶液中通入氯气 2FeCl 2 + Cl 2 = 2FeCl 3 【2Fe 2++ Cl 2 = 2Fe 3++ 2Cl - 】 28、氯化铁溶液中加入铁粉2FeCl 3 + Fe =3FeCl 2 【2Fe 3++ Fe =3Fe 2+】非金属及其化合物1、硅及其化合物的转化关系※ ①SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)※ ②SiO 2+2NaOH = Na 2SiO 3+H 2O( SiO 2+2OH -= SiO 32-+H 2O )※ ③Na 2SiO 3+2HCl = H 2SiO 3(胶体)+2NaCl ( SiO 32-+2H += H 2SiO 3(胶体))④ SiO 2+CaO 高温 CaSiO 32、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3②Cu +Cl 2 点燃CuCl 2③2FeCl 3+Cu = 2FeCl 2+CuCl 2(2Fe 3++Cu = 2Fe 2++Cu 2+)④H 2+Cl 2 2HCl ※⑤MnO 2+4HCl(浓)△MnCl 2+Cl 2↑+2H 2O(MnO 2+4H ++2Cl -△Mn 2++Cl 2↑+2H 2O) ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑(不稳定性)(Cl 2+H 2O = H ++Cl -+HclO) (2HClO 2H ++2Cl -+O 2↑)※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O (工业制漂白粉) Ca(ClO)2+CO 2+H 2O = CaCO 3↓+2HClO(漂白原理)3、硫及其化合物的转化关系Na 2SiO 3 SiF 4 SiO 2 H 2SiO 3CaSiO 3 ① ② ③④ CuCl 2 HClO HCl Cl 2 FeCl 3 NaClO Ca(ClO)2 ① ② ③④ ⑤ ⑥ ⑦ ⑧ ⑨点燃或光照 光照光照①S +O 2 点燃 SO 2 ※②SO 2+O 2 催化剂 加热 2SO 3③SO 3+H 2O = H 2SO 4(工业制硫酸) ④SO 2+H 2O H 2SO 3⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O(SO 2+Ca 2++2OH -=CaSO 3↓+H 2O )⑥SO 3+CaO = CaSO 4 或 SO 3+Ca(OH)2 = CaSO 4+H 2O※⑦Cu+2H 2SO 4(浓) △ CuSO 4+SO 2↑+2H 2O ※⑧C +2H 2SO 4(浓) △CO 2↑+2SO 2↑+2H 2O4、氮及其化合物的转化关系※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2 ※③3NO 2+H 2O = 2HNO 3+NO ( 3NO 2+H 2O =2H ++2NO 3-+NO)※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O (Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O)※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂高温高压 2NH 3 (3Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O ) (工业制氨气)⑦NH 3+HCl = NH 4Cl NH 4HCO 3 △NH 3↑+H 2O+CO 2↑(铵盐受热易分解)⑧NH 4Cl△NH 3↑+HCl ↑(水溶液中)( NH 3+H += NH 4+) ⑧NH 4Cl +NaOH △ NaCl+NH 3↑+H 2O (NH 4++OH-△NH 3↑+H 2O) ※⑧2NH 4Cl +2Ca(OH)2 △ CaCl 2+2NH 3↑+2H 2O⑨4NH 3+5O 2 催化剂△ 4NO +6H 2OSO 42 3 CaSO 3 4① ⑨ ⑧⑦ ⑥ ④ ③ N 2 NH 3 NH 4Cl NO 3② ③高温或放电。
非金属方程式(二)氮、硅化学方程式

碳、硅及其化合物方程式1.碳在氧气中燃烧化学方程式: 氧气不足: 氧气充足:2.碳与SiO 2、CO 2、Fe 2O 3、H 2O 等氧化反应化学方程式:2C+ SiO 22CO ↑+ Si C+CO 22CO 3C+Fe 2O 33CO ↑+2Fe C+H 2O(g) CO+H 2 注:高温下,以C 为还原剂还原氧化物一般生成CO3.碳被浓硫酸、浓硝酸氧化化学方程式:.C+2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O C+4HNO 3(浓)CO 2↑+4NO 2↑+2H 2O4. 常温下,Si 化学性质不活泼,只能与F 2、氢氟酸、强碱(如NaOH)反应,写出化学方程式: Si +2F 2 =SiF 4Si +2NaOH +H 2O =Na 2SiO 3+2H 2↑ Si +4HF =SiF 4↑+2H 2↑5.加热条件下,Si 与O 2、Cl 2反应化学方程式:Si +O 2 SiO 2 Si +2Cl 2 SiCl 46.高温条件下Si 与C 反应方程式:Si +CSiC(金刚砂)7.高纯硅的制备化学方程式:①制粗硅:SiO 2+2C Si+2CO↑②提纯(与Cl 2反应):粗Si 中含碳,造成SiCl 4中含CCl 4等杂质,通过分馏得纯SiCl 4 ③还原(用H 2还原): 8.CO 2分别与H 2O 、NaOH 溶液、CaO 反应化学方程式:CO 2+H 2O H 2CO 3 CO 2+2NaOH=Na 2CO 3+H 2O CO 2+CaO=CaCO 39. SiO 2与H 2O 不反应,与NaOH 溶液、CaO 反应化学方程式:SiO 2+2NaOH=Na 2SiO 3+H 2O (装碱性溶液试剂瓶不能用玻璃塞,要用橡胶塞) 离子方程式:SiO 2+2OH -= SiO 32-+H 2OSiO 2+CaO CaSiO 310. SiO 2与氢氟酸反应方程式: SiO 2+4HF=SiF 4↑+2H 2O(刻蚀玻璃、装氢氟酸不能用玻璃瓶,一般用铅制容器或塑料瓶)11. 制硅酸(水玻璃中加入盐酸或通入二氧化碳)化学方程式:Na 2SiO 3+2HCl=H 2SiO 3↓+2NaCl Na 2SiO 3+CO 2+H 2O=H 2SiO 3↓+Na 2CO 312.硅酸受热分解化学方程式:H 2SiO 3SiO 2+H 2O 13. 制普通玻璃化学方程式(两个):Na 2CO 3+SiO 2Na 2SiO 3+CO 2↑ CaCO 3+SiO 2CaSiO 3+CO 2↑氮及其化合物方程式1.氮气和氧气反应化学方程式:=== 高温 === 高温 === 高温 === 高温2.镁在氮气中燃烧化学方程式:3.工业合成氨气化学方程式:N2+3H22NH34. 一氧化氮在空气中变成红棕色化学方程式:2NO+O2=2NO25.NO 和O2按照4:3通入水中化学方程式:4NO+3O2+2H2O =4HNO36. NO氧化NH3化学方程式:6NO+4NH35N2+6H2O7.NO2氧化NH3化学方程式:6NO2+8NH3 7N2+12H2O8. NO2氧化SO2化学方程式:9. NO2和O2按照4:1通入水中化学方程式:4NO2+O2+2H2O =4HNO310. NO2和H2O反应化学方程式:3NO2+H2O=2HNO3+NO11. 用NaOH溶液除去NO2尾气化学方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O离子方程式:2NO2+2OH-=NO3-+NO2-+H2O12. NO 2 与N2O4之间的转化化学方程式:2NO2(g)N2O4(g) △<013. NO2与NO按照1:1通入NaOH溶液中:NO2+NO+2NaOH=2NaNO2+H2O14. 氨的实验室制法化学方程式:2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑(不能写离方)实验室加热浓氨水制NH3化学方程式:NH3·H2O NH3↑+H2O15.解释:NH3溶于水显弱碱性NH 3+H2O NH3·H2O NH4++OH-或NH3+H2O NH4++OH-16. 氨气与盐酸、硝酸、硫酸反应化学方程式:NH3+HCl=NH4Cl; NH3+HNO3=NH4NO3 ; 2NH3+H2SO4=(NH4)2SO4;离子方程式:NH3+H+=NH4+17. 氨气与CO2反应化学方程式:CO2少量:2NH3+CO2+H2O=(NH4)2CO3CO2过量:NH3+CO2+H2O=NH4HCO3(碳铵)18. 氨气被氯气氧化化学方程式:2NH3(少量)+3Cl2=N2+6HCl8NH3 (过量)+3 Cl2= N2+6 NH4Cl(用于检验氯气管道是否泄漏,现象:产生大量白烟)19.氨气还原氧化铜化学方程式:2NH3+3CuO N2+3Cu+3H2O20. 氨水与可溶性铝盐制备氢氧化铝离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+21. NH 4Cl水解离子方程式:NH4++H2O NH3·H2O+ H+22. NH4+与SiO32-、AlO2-发生完全双水解离子方程式:SiO32-+2NH4+ =H2SiO3↓+2NH3↑AlO2-+NH4+ +H2O=Al(OH)3↓+2NH3↑23. 铵盐与强碱发生复分解,在水溶液中不加热时,反应的离子方程式为:NH+4+OH-=NH3·H2O加热时反应的离子方程式为:NH 4++OH - NH 3↑+H 2O浓溶液混合时离子方程式为:NH 4++OH -=NH 3↑+H 2O24. NH 4Cl 、NH 4HCO 3受热分解化学方程式:NH 4Cl NH 3↑+HCl↑; NH 4HCO 3NH 3↑+H 2O↑+CO 2↑25. NH 4+的检验方法:取少量溶液于试管中,加过量的浓强碱,加热,用湿润的红色石蕊试纸检验放出的气体,观察试纸是否变蓝26.稀硝酸加入紫色石蕊:变红色 浓硝酸加入紫色石蕊:先被红,再褪色27.硝酸分解化学方程式: 4HNO 3 Δ或光照 4NO 2↑+O 2↑+2H 2O28. 铜与浓硝酸反应化学方程式:Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O;离子方程式:Cu+4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O29.铜与稀硝酸反应化学方程式:3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO↑+4H 2O;离子方程式:3Cu+8H ++2NO 3-= 3Cu 2++2NO↑+4H 2O30. 稀硝酸与铁反应时离子方程式:铁少量:Fe +NO -3+4H +=Fe 3++NO↑+2H 2O铁过量:3Fe +2NO -3+8H +=3Fe 2++2NO↑+4H 2O31. 碳与浓硝酸反应化学方程式:C+4HNO 3(浓)CO 2↑+4NO 2↑+2H 2O32. 稀硝酸与Fe 2+、SO 2、SO 32-、I -反应离子方程式:3Fe 2++4H ++NO=3Fe 3++NO↑+2H 2O3SO 2+2H 2O +2NO=3SO 42-+2NO +4H +3SO 32-+2H ++2NO=3SO 42-+2NO↑+H 2O6I -+8H ++2NO=3I 2+2NO↑+4H 2O33. 苯的消化反应化学方程式:34.实验室制硝酸化学方程式:NaNO 3(固)+H 2SO 4(浓) NaHSO 4+HNO 3↑35.工业制硝酸(氨的催化氧化,也叫接触氧化)化学方程式:4NH 3+5O 24NO+6H 2O; 2NO+O 2 = 2NO 2; 3NO 2+H 2O=2HNO 3+NO=== 微热。
高中化学 金属与非金属的思维导图
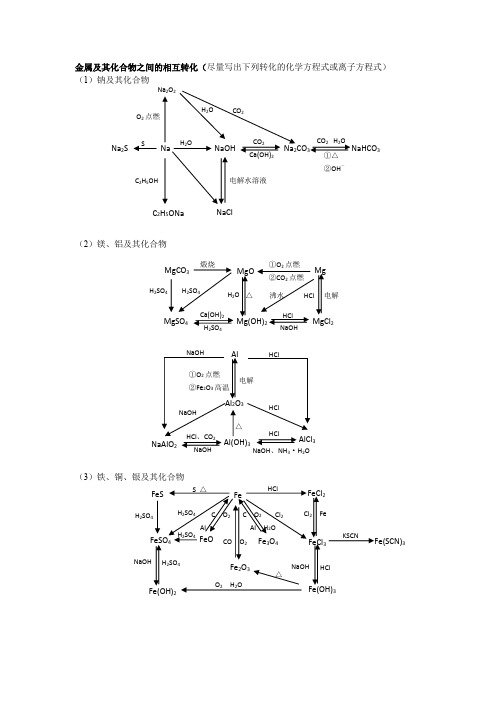
金属及其化合物之间的相互转化(尽量写出下列转化的化学方程式或离子方程式) (1)钠及其化合物(2)镁、铝及其化合物(3)铁、铜、银及其化合物Na Na 2S NaOH Na 2CO 3 NaHCO 3 CO 2 H 2O ①△②OH -CO 2 Ca(OH)2 H 2O SNa 2O 2 H 2O O 2点燃 CO 2C 2H 5ONa NaCl C 2H 5OH 电解水溶液HCl △ Mg MgOMgCO 3 Mg(OH)2 MgCl 2MgSO 4 H 2SO 4 H 2SO 4 H 2SO 4 电解 沸水HClNaOH Ca(OH)2H 2O 煅烧 ①O 2点燃 ②CO 2点燃 Cl 2 Fe FeO H 2SO 4 Cl 2 FeFeCl 2 FeS FeSO 4 Fe 2O 3 FeCl 3Fe(SCN)3 Fe(OH)3 Fe(OH)2 Fe 3O 4 H 2SO 4 H 2SO 4H 2SO 4 HCl NaOH HCl NaOH C O 2 Al H 2O C O 2 AlCO O 2 O 2 H 2O△S △ KSCN Al Al 2O 3 NaAlO 2AlCl 3 Al(OH)3 ①O 2点燃②Fe 2O 3高温电解 NaOH NaOHNaOH NaOH 、NH 3·H 2O HCl HCl HClHCl 、CO 2 △H 2SO 4 △ NaOHFeFe HNO 3Cu H 2SO 4△HNO 3 CuO Cu(OH)2Cu 2OCu(NO 3)2CuSO 4Cu 2S CuSH 2S浓H 2SO 4S 点燃O 2 △CO △ HNO 3 高温 RCHO 水浴加热 AgOHNa 2SS △FeAgAgNO 3Ag 2SAg(NH 3)2OHRCHO 水浴加热Ag 2CO 3AgI AgBr AgClH 2SHNO 3 HNO 3 NH 3·H 2O NH 3·H 2OHCl硅及其化合物之间的相互转化关系氯气及其化合物相互转化关系Cl2PCl 3、PClO 2②点燃NaClAgClNaOH光照3硫及其化合物相互转化关系H3Na SO 4223H 22SO 4O ,燃烧2NaOHO 2BaCl 2H 2O2氮及其化合物相互转化关系NH 4N NO 3243N 23·H 2ONH 4+ OH +H 2,催化剂高温 高压O 2 , 放电2O 2浓H 2SO 4△①浓酸,Cu ②见光或△③C点燃2O。
非金属及其化合物知识点总结

化学1《非金属及其化合物》知识点总结、硅及其化合物的转化关系Nii 2sio.4- n 2o脱水=n 2si c 尸 si<>2 +n 2o 弱酸性:酸性比礪酸还弱Nfl 2SiOj+ II 2O +CO 2=Nrt 2COj +11^810^① Si 的还原性大于 C,但C 却能在高温下还原出 S 。
2C + SiO2=====Si + 2C0f ; ② Si 能与NaOH 溶液反应放出H2,而其他非金属单质无此性质; ③ 非金属单质一般为非导体,但Si 为半导体,石墨为良导体;④ 非金属氧化物一般为分子晶体,但SiO2晶体为原子晶体。
1、二氧化硅和二氧化碳比较二氧化硅二氧化碳类别 酸性氧化物 _酸性氧化物晶体结构 原子晶体分子晶体 熔沸点 高低与水反应方程式 不反应 CO+HOH 2CO与酸反应方程式 SiO 2 + 4HF==SiF" +2H 2O 不反应与烧碱反应方程式SiO 2+2NaOH == N&SiO s +HO少:2NaOH+CO=Na€O+HO 过:NaOH+CO=NaHCO与CaO 反应方程式高温SiO 2+CaO CaSiO sCaO+C 2==CaCO存在状态水晶、玛瑙、石英、硅石、沙子人和动物排放2、硅以及硅的化合物的用途物质 用途「存在: 結构 性质 用途 〔存在八結构广物理性质:黑色,金属光泽.硬而溶沸点高的固体「Si+2F 2- SiF 4Si+ 4HF= SiF 4 +2H. *彳七学性质< st + 2N^on + ir z o= 「物理性质Nit 曲a+f 盟Si+ 2CL== SiCLiSiO :- 4Hb =割卜丁一 H 2() 性质<I 用途 化学性败SiO,+ NaOPI=制备:可落性的硅隈議与酸的反应illl ;2H<、1 =2Na<?l-H 2Si<)3化学性烦:I 用途二氧化硅..:硅单质 半导体材料、光电池(计算器、人造卫星、登月车、探测器) SiO 2饰物、仪器、光导纤维、玻璃 硅酸钠矿物胶SiC砂纸、砂轮的磨料ClNaOHSiCL1、玻璃的主要成分之一是二氧化硅。
金属非金属方程式归纳

金属与非金属及其化合物方程式总结一、硅的单质及其化合物1.Si(s) + 2Cl 2(g)SiCl 4(g) 2.Si +CSiC(金刚砂) 3.Si(粉)+O 2 SiO 24.Si +4HF = SiF 4↑+2H 2↑(硅也能与某些氧化性酸反应)5.3Si +4HNO 3 =3SiO 2 + 4NO↑ +2H 2O6.Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑7.SiO 2+2C2CO↑ + Si Si+2Cl 2SiCl 4(气体) SiCl 4+2H 2Si+4HCl 应用:工业制取粗硅、粗硅的提纯 8.SiO 2 + 4HF = SiF 4↑+2H 2O (刻蚀玻璃) (二氧化硅不和其他酸反应,只与氢氟酸反应。
氢氟酸不能用玻璃瓶盛放,只能用塑料瓶装。
应用:玻璃雕花)9.SiO 2+2NaOH = Na 2SiO 3+H 2O ( SiO 2是酸性氧化物)(盛放碱性溶液的玻璃瓶不能用磨口玻璃塞,只能选用软木塞或者橡皮塞)10.SiO 2+CaCO 3CaSiO 3+CO 2↑ (水泥制备过程中发生的反应) 11.SiO 2+Na 2CO 3Na 2SiO 3+CO 2↑ (玻璃制备过程中发生的反应)12.H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O13.Na 2SiO 3+H 2O +CO 2 = H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2 = H 2SiO 3↓+2NaHCO 3原理:强酸制弱酸14.H 2SiO 3H 2O +SiO 2 (用于制取硅胶)15..SiO 2+CaOCaSiO 3高温 点燃 高温 高温 高温△ 高温二、氯气和氯的化合物16.2Fe +3Cl 22FeCl 3 (现象:产生棕褐色的烟) (氯气和变价金属反应生成高价产物) 17. Cu + Cl 2 CuCl 2 (现象:产生棕黄色的烟) 18.Cl 2 + Mg MgCl 2 19.2Na + Cl 22NaCl (现象:黄色火焰,产生白色的烟)20.H 2+Cl 2 2HCl (现象:苍白色火焰,同时产生白雾;混合时见光爆炸) 21.3Cl 2 + 2P2PCl 3 (现象:产生白雾) 22.5Cl 2 + 2P2PCl 5 (现象:产生白烟)23. Cl 2 +PCl 3 PCl 524.Cl 2+H 2O HCl +HClO (湿润的氯气有漂白性、酸性)25.Cl 2+SO 2 +2H 2O===H 2SO 4 +2HCl(单独的氯气和SO 2都有漂白性,但将两者1:1混合将不再有漂白性)26.2Cl 2 + 2CaO === CaCl 2 + Ca(ClO)2 (湿润的氯气有酸性,能和碱性氧化物反应)27. Cl 2 + 2HBr = Br 2 + 2HC l Cl 2 + 2HI = I 2 + 2HC lCl 2 + H 2S = S ↓ + 2HCl Cl 2 + H 2SO 3 + H 2O = H 2SO 4 + 2HC l(氯气能和某些还原性的酸发生氧化还原反应)28.Cl 2+2NaOH = NaCl +NaClO +H 2O(工业上制备漂白液的反应——漂白液的主要成分为NaClO )29.Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O工业制漂白粉的反应,其中漂白粉的主要成分为CaCl 2和Ca(ClO)2,有效成分是Ca(ClO)230.Ca(ClO)2 + H 2O + CO 2 = CaCO 3↓ + 2HClO(此反应为漂白粉的漂白原理,也是漂白粉结块失效的反应,此反应也证明了次氯酸为弱酸,其酸性比碳酸弱)NaClO + H 2O + CO 2 = NaHCO 3 + HClO31.3Cl 2 + 8NH 3 = N 2 + 6NH 4C l(工业上用浓氨水检验黄绿色气体,若产生白烟则该黄绿色气体为氯气)32.Cl 2 + 2FeCl 2 === 2FeCl 3 Cl 2 + Na 2SO 3 + H 2O = Na 2SO 3 + 2HCl2Cl 2+2NaBr===2NaCl +Br 2 Cl 2 +2NaI ===2NaCl +I 2(氯气能和某些还原性的盐发生氧化还原反应)点燃 点燃 点燃点燃 点燃 点燃 点燃 点燃浓硫酸 33.实验室制取氯气:(教材实验中最容易考的一个实验)MnO 2 + 4HCl(浓)MnCl 2 + Cl 2↑ + 2H 2O 2KMnO 4 + 16HCl(浓) = 2MnCl 2 + 5Cl 2↑ + 2KCl +8H 2O 或者:ClO -+ Cl - + 2H += H 2O + Cl 2↑ClO 2-+ 3Cl - + 4H + = 2H 2O +2Cl 2↑工业上制备氯气(氯碱工业)——电解饱和食盐水2NaCl + 2H 2O H 2↑ + Cl 2↑ + 2NaOH 工业上用于制取氯气、烧碱、盐酸等物质实验室制氯化氢气体:NaCl + H 2SO 4(浓)HCl↑ + NaHSO 4 原理:高沸点制低沸点 HCl(浓) HCl↑ 原理:浓硫酸的吸水性33.2HClOO 2 + 2HCl (用自来水养鱼需将自来水至于阳光下暴晒) (次氯酸的漂白性源于其氧化性,所以次氯酸能和某些还原性的酸、盐反应)三、氮气和氮的化合物34.N 2 + O 2 2NO (雷雨发庄家的第一个反应,属于自然固氮的一种)35.N 2+ 3H 22NH 3 (合成氨工业,人工固氮的主反应)36.3Mg+N 2Mg 3N 2 N 2+6Na2Na 3N (活泼金属能在氮气中燃烧)37.2NO +O 2 = 2NO 2 (无色气体遇空气变为红棕色,则该气体为NO )38.4NO +3O 2+2H 2O = 4HNO 3 4NO 2+O 2+2H 2O = 4HNO 339.3NO 2+H 2O = 2HNO 3+NO40.2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2ONO + NO 2 + 2NaOH = 2 NaNO 2 + H 2O(实验室利用NaOH 溶液处理氮氧化物尾气)41. 8HNO 3 + 3Cu = 3Cu(NO 3)2 + 2NO↑ + 4H 2OCu + 4HNO 3(浓) = Cu(NO 3)2 + 2NO 2↑ + 2 H 2O※稀硝酸的被还原生成NO ,浓硝酸的还原产物为NO 2,硝酸浓度非常小时被还原有铵根或者氨气生成,硝酸和金属单质反应没有氢气产生△△ △ 催化剂 高温高压 点燃 高温或放电 电解30HNO 3+8Fe===8Fe(NO 3)3+3NH 4NO 3+9H 2O42. Fe + 4HNO 3 = Fe(NO 3)3 + NO↑+2H 2O (稀硝酸过量)3Fe + 8HNO 3 = 3Fe(NO 3)2 + 2NO↑+4H 2O (稀硝酸不足)Al + 4HNO 3 = Al(NO 3)3 + NO↑+2H 2O2Al + 6HNO 3(浓) = Al 2O 3 + 6NO 2↑ + 3H 2O3Fe + 8HNO 3(浓) = Fe 3O 4 + 8NO 2↑+3H 2O※铁或者铝与浓硝酸、浓硫酸发生钝化,产生能起保护作用的致密金属氧化物,阻止了酸和金属的进一步反应,所以鉄制容器或铝制容器常温低温下可盛放浓硝酸43.S+6HNO 3(浓)===H 2SO 4+6NO 2↑+2H 2OS + 2HNO 3 === H 2SO 4 + 2NO↑44.CuO + 2HNO 3 = Cu(NO 3)2 + H 2OFe 2O 3 + 6HNO 3 =2 Fe(NO 3)2 + 3H 2O(此类反应为复分解反应)3FeO + 10HNO 3===3Fe(NO 3)3 + NO↑ + 5H 2O (此反应为氧化还原反应)45.2HNO 3 + 3H 2SO 3 = 3H 2SO 4 + 2NO↑+ H 2O (硝酸能和还原性酸发生氧化还原反应)46.硝酸和还原性盐的反应:3Na 2S + 8HNO 3 ===6NaNO 3+2NO↑ + 3S↓ + 4H 2O3Na 2SO 3+2HNO 3 ===3Na 2SO 4 + 2NO↑ + H 2O47.4HNO 3 4NO 2↑+O 2↑+2H 2O见光或受热分解,所以硝酸需要避光保存,用棕色瓶盛放。
非金属及其化合物反应方程式

硅及其化合物的化学方程式和离子方程式一、硅1、硅和氟气反应:Si+2F2SiF42、硅和氯气加热:Si+2Cl2SiCl43、硅与氧气加热:Si+O2SiO24、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑5、硅和氢氟酸反应:Si+4HF SiF4+2H2↑二、二氧化硅1、工业上用二氧化硅制备粗硅:SiO2+2C Si+2CO↑2、工业上二氧化硅制备金刚砂:SiO2+3C SiC+2CO↑3、碳酸钙高温条件下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑4、碳酸钠高温条件下与二氧化硅反应:Na2CO3+SiO2Na2SiO3+CO2↑5、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O6、将二氧化硅溶于氢氟酸:SiO2+4HF SiF4+2H2O7、二氧化硅高温与生石灰反应:CaO+SiO2CaSiO3三、硅酸1、硅酸溶于氢氧化钠溶液:H2SiO3+2NaOH Na2SiO3+2H2OH2SiO3+2OH-SiO32-+2H2O2、加热硅酸:H2SiO3SiO2+H2O四、硅酸钠1、硅酸钠溶液加入氯化钙溶液:Na2SiO3+CaCl2CaSiO3↓+2NaClSiO32-+Ca2+CaSiO3↓2、硅酸钠溶液呈碱性:Na2SiO3+H2O NaHSiO3+NaOHSiO32-+H2O HSiO3-+OH-3、向硅酸钠溶液中加入盐酸:Na2SiO3+2HCl2NaCl+H2SiO3↓SiO32-+2H+H2SiO3↓4、向硅酸钠通入中通入少量的二氧化碳:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3SiO32-+CO2+H2O CO32-+H2SiO3↓5、向硅酸钠通入中通入过量的二氧化碳:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓6、硅酸钠溶液与氯化铵溶液混合:Na2SiO3+2NH4Cl2NaCl+H2SiO3↓+2NH3↑SiO32-+2NH4+H2SiO3↓+2NH3↑氯及其化合物的化学方程式和离子方程式1.实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O2.在氯气中燃烧钠在氯气中燃烧:2Na+Cl2 2NaCl铁在氯气中燃烧:2Fe+3Cl2 2FeCl3铜在氯气中燃烧:Cu + Cl2 CuCl2氢气在氯气中燃烧:H2 + Cl2 2HCl3.氯气和水反应:Cl2 + H2O = HCl + HClO离子方程式:Cl2 + H2O = H++Cl- + HClO4.次氯酸光照分解:2HClO 2HCl + O2↑5.氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-6.氯气与氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O离子方程式:Cl2+2OH-=Cl-+ClO-+H2O7.工业生产漂白粉:2Ca(OH)2 + 2Cl2=Ca(ClO)2 + CaCl2 + 2H2O8.漂白粉漂白原理: Ca(ClO)2 + CO2 + H2O =CaCO3↓ + 2HClO9.向漂白粉溶液中加入稀盐酸:Ca(ClO)2 + 2HCl=CaCl2 + 2HClO10.氯气与卤化银反应氯气通入溴化钾溶液:Cl2 + 2KBr = Br2 + 2KCl离子方程式:Cl2 + 2Br- = Br2 + 2Cl-氯气通入碘化钾溶液:Cl2 + 2KI = I2 + 2KCl 离子方程式:_ Cl2 + 2I- = I2 + 2Cl-溴水和碘化钾溶液反应:Br 2 +2KI = I 2+2KBr 离子方程式:Br 2 +2I -= I 2+2Br -11.卤化钠反应氯化钠和硝酸银溶液:AgNO 3 + NaCl = AgCl ↓ + NaNO 3 离子方程式:Ag ++Cl -= AgCl ↓ 溴化钠和硝酸银溶液:AgNO 3 + NaBr = AgBr ↓ + NaNO 3 离子方程式:Ag ++Br - = AgBr ↓ 碘化钠和硝酸银溶液:AgNO 3 + NaI = AgI ↓ + NaNO 3 离子方程式:Ag ++I -= AgI ↓硫及其化合物的化学方程式和离子方程式一、硫单质 Fe + S FeS (黑色不溶于水固体) 2Cu + S Cu 2S (黑色不溶于水固体)3Cl 2+2Fe 2FeCl 3 (棕黄色的固体,溶液为棕黄色) Cl 2+CuCu Cl 2(棕黄色的固体,稀溶液为蓝色,浓溶液为绿色)二、硫化氢与氢硫酸 1、受热分解H 2SH 2 + S2、往氢氧化钠溶液中通硫化氢气体H 2 S+ 2NaOH → Na 2S +2 H 2OH 2 S+ Na 2S → 2NaHS (连续反应) H 2 S+ 2NaOH → Na 2S +2 H 2OH 2 S+ NaOH → NaHS + H 2O (平行反应)3、硫化氢通入氯水、溴水、碘水中都产生浅黄色沉淀。
非金属及其化合物

硅酸钠:水玻璃(溶液) 显碱性、可以与酸反应 水玻璃久置空气中会变浑浊?
存放碱液、水玻璃应注意什么? 玻璃中含有的SiO2与碱反应而黏结 SiO2 + 2NaOH = Na2SiO3 + H2O
有如下各种化学药品: 氢氟酸 、硝酸银、 氢氧化钠、 钠、 白磷 、浓硝酸 、水玻 璃 、 氯水保存方法
A、稀硝酸
B、浓硝酸
C、浓硫酸
D、浓盐酸
将铁屑溶于滴有KSCN溶液的过量盐酸后,再加 入下列物质,溶液呈红色的是(B D ) A、硫酸 B、氯水 C、氯化铜 D、硝酸锌
铜粉放入稀硫酸溶液中,加热后无明显现象
发生,当再加入下列一种物质后,铜粉的质量减 少,溶液呈蓝色,同时有气体逸出。加入的物质 是 (C )
稀硫酸只能跟排在H之前的金属反应,还原 产物一般是H2
吸水性
氧化性
浓硫酸 脱水性 浓硝酸 挥发性
氧化性 酸性
不稳定性 酸性
关于浓硫酸与稀硫酸的叙述正确的是 D ) A、常温时都能与铁发生反应放出气体 B、加热时都能与铜发生反应放出气体 C、都能作为气体的干燥剂 D、硫元素的化合价都是+6价
为了除去镀在铝表面的铜镀层,可选用的 试剂是( B )
点燃
3Cl2+2Fe===2FeCl3 置换出Br2、I2
高价 Cl2、SO2、H2O 之间的反应
• 2、HClO的性质 思考:氯水的成分有哪些?
HClO不稳定,容易分解反出氧气
有强氧化性、漂白性、弱酸性(比碳酸弱)
3、漂白粉
制备:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
金属+非金属化学方程式整理(全)

金属化学方程式整理一、钠、镁、铝及其化合物1、 钠暴露在空气中4Na+O 2==2Na 2O ; 钠在空气中点燃:2Na+O 2 == Na 2O 22、 2Na+2H 2O==2NaOH +H 2↑3、 2Na+2HCl==2NaCl +H 2↑4、 钠投入硫酸铜溶液中:2Na+2H 2O==2NaOH +H 2 ↑ CuSO 4+2NaOH==Cu(OH)2↓+Na 2SO 4 总:2Na+2H 2O+CuSO 4== Cu(OH)2↓+Na 2SO 4 +H 2 ↑ 5、 Mg+2HCl==MgCl 2+H 2↑ ( Mg+2H +==Mg 2++H 2 ↑ ) 2Al+6HCl ==2AlCl 3+3H 2↑ ( 2Al+6H +==2Al 3++3H 2 ↑ ) 6、 2Al+2NaOH+2H 2O ==2NaAlO 2+3 H 2↑( 2Al+2OH -+2H 2O ==2AlO 2-+3 H 2↑ )7、 2Na 2O 2+2H 2O==4NaOH+O 2↑ ( 2Na 2O 2+2H 2O==4Na ++4OH -+O 2↑) 8、 2Na 2O 2+2CO 2==2Na 2CO 3+O 29、 Na 2O + 2HCl == 2NaCl + H 2O ( 说明Na 2O 是碱性氧化物 ) 10、2Na 2O 2 + 4HCl==4NaCl + 2H 2O + O 2↑ ( Na 2O 2不是碱性氧化物 ) 11、Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2↑ ( CO 32- +2H +== H 2O + CO 2↑) 12、NaHCO 3 + HCl== NaCl + H 2O + CO 2↑ ( HCO 3- + H +== H 2O + CO 2↑)13、2NaHCO 3= Na 2CO 3+H 2O+CO 2↑ 14、Al 2O 3 + 6HCl == 2AlCl 3 + 3H 2O ( Al 2O 3 + 6H +== 2Al 3++ 3H 2O ) 15、Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O ( Al 2O 3 + 2OH -==2AlO 2-+ H 2O ) 16、AlCl 3 + 3NH 3·H 2O== Al(OH)3↓+ 3NH 4Cl (实验室制氢氧化铝)Al 3++3NH 3· H 2O== Al(OH)3↓+3NH 4+17、Al(OH)3+3HCl==AlCl 3+3H 2O ( Al(OH)3+3H +== Al 3++3H 2O ) 18、Al(OH)3+NaOH==NaAlO 2+2H 2O ( Al(OH)3+OH -==AlO 2-+2H 2O )19、2Al(OH)3 == Al2O 3+3H 2O 20、少量CO 2通入NaOH 溶液:△ △ △2NaOH+ CO 2== Na 2CO 3+ H 2O ( 2OH -+ CO 2==CO 32-+ H 2O ) 21、足量CO 2通入NaOH 溶液:NaOH+ CO 2== NaHCO 3 ( OH -+ CO 2==HCO 3-) 22、少量NaOH 加入AlCl 3溶液:AlCl 3+3NaOH== Al(OH)3↓+3NaCl ( Al 3++3OH -==Al(OH)3↓ ) 23、足量NaOH 加入AlCl 3溶液:AlCl 3+4NaOH== NaAlO 2+3NaCl+2 H 2O ( Al 3++4OH -== AlO 2-+2H 2O ) 24、Na 2CO 3 与NaHCO 3相互转化Na 2CO 3+ H 2O+ CO 2==2NaHCO 3 (CO 32-+ H 2O+ CO 2== 2HCO 3-) NaHCO 3+NaOH== Na 2CO 3+ H 2O (HCO 3-+ OH -== CO 32-+ H 2O )25、氯碱工业(电解饱和食盐水):2NaCl +2 H 2O==== 2NaOH +H 2↑+Cl 2↑26、侯氏(侯德榜)制(纯)碱法(饱和食盐水中先通氨气,再通二氧化碳)①NaCl +NH 3+H 2O+ CO 2==NaHCO 3↓+NH 4Cl②2NaHCO 3=== Na2CO 3+H 2O+CO 2↑ 二、铁及其化合物1、Fe+2HCl==FeCl 2+H 2↑ ( Fe +2H +=Fe 2++H 2↑) Fe+CuSO 4==FeSO 4+Cu ( Fe +Cu 2+=Fe 2++Cu ) 2、FeO+2HCl=FeCl 2 +H 2O ( FeO +2H +=Fe 2++H 2O ) 3、Fe 2O 3+6HCl=2FeCl 3 +3H 2O ( Fe 2O 3+6H +=2Fe 3++3H 2O ) 4、Fe 3O 4+8HCl=FeCl 2 +2FeCl 3+4H 2O ( Fe 3O 4+8H += Fe 2++2Fe 3++4H 2O ) 5、Fe 2+ 2OH = Fe(OH)2 6、Fe 3+ 3OH= Fe(OH)37、4Fe(OH)2+O 2+2H 2O=4Fe(OH)3 (现象:白色沉淀迅速变成灰绿色,最后变为红褐色)8、2Fe(OH)3 == Fe 2O 3+3H 2O9、Fe(OH)2+2HCl=FeCl 2 +2H 2O ( Fe(OH)2 +2H +=Fe 2++2H 2O ) 10、Fe(OH)3+3HCl=FeCl 3+3H 2O ( Fe(OH)3 +3H +=Fe 3++3H 2O )11、Fe 3+3SCN =Fe(SCN)3 (现象:溶液呈红色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、氯及氯的化合物Cl 2⑴金属Na/Fe/Cu不活泼的非金属H 2/P⑵非金属阴离子X -/S 2-/NH 3⑶SO 2/SO 3/Fe /FeI 2/FeBr 2HClH 2SO 4AgCl MnO (△)/KMnO /KClO HClO-KClO 3KClHCl/MnO 2(△)Ca(ClO)221, 氧化性: nF 2 +2M=== F 2 + H 2 === F 2 +Xe(过量)=== 2H 2O+2F 2===4HF+O 2 2F 2 +2NaOH=== Cl 2 +2Na点燃2NaCl(黄色火焰,冒白烟)3Cl 2 +2Fe 点燃2FeCl 3(红棕色烟,溶于水显黄色) Cl 2+Cu点燃CuCl 2(棕黄色烟,溶于水浓绿色,稀蓝色)Cl 2 +H 2光或点燃2HCl(点燃,苍白色火焰,瓶口冒白雾。
光照爆炸) Si(粗)+2Cl 2高温SiCl 4 3Cl 2 +2P点燃2PCl 3(白雾)Cl 2 +PCl 3点燃PCl 5(白烟)2Cl 2+2NaBr===2NaCl+Br 2(无色变黄色,加CCl 4橙红色) Cl 2 +2NaI ===2NaCl+I 2(无色变棕黄色,加CCl 4紫红色)5Cl 2+I 2+6H 2O===2HIO 3+10HCl(碘化钾淀粉溶液中滴加氯水直至过量,先变蓝色后蓝色消失)[NaCl + AgNO 3 === AgCl ↓(白色) + NaNO 3 NaBr + AgNO 3 = AgBr ↓(淡黄色)+ NaNO 3 NaI + AgNO 3 = AgI ↓(黄色) + NaNO 3] Cl 2 +Na 2S===2NaCl+S(黄色浑浊) Cl 2 +H 2S===2HCl+S(黄色浑浊) Cl 2 +2FeCl 2 ===2FeCl 3(绿色变黄色)X 2+SO 2 +2H 2O===H 2SO 4 +2HX(X=Cl/Br/I ,氯气与二氧化硫等体积混合后无漂白性) H 2SO 3+X 2+H 2O===H 2SO 4+2HXCl2 +H2O2 ===2HCl+O2还原性:SO32->I->Fe2+>Br-2(水或碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O(尾气吸收)2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O(制漂白粉)3Cl2+6KOH(浓)@5KCl+KClO3+3H2OCa(ClO)2 + CO2 + H2O =CaCO3↓+ 2HClO(漂白原理)2HClO光2HCl+O2(漂白粉失效)3.氯气的制法工业制法电解氯化钠溶液2NaCl +2 H2O 2NaOH + H2↑+ Cl2↑(氯碱工业)电解熔融氯化钠2NaCl 2Na + Cl2↑实验室制法MnO2 + 4HCl(浓) MnCl2 +Cl2↑+ 2H2O16HCl+2KMnO4==2KCl+2MnCl2+5 Cl2↑+8H2O14HCl+K2Cr2O7===2KCl+2CrCl3+3 Cl2↑+7H2O6HCl+KClO3=3 Cl2↑+KCl+3H2OCl-+ClO-+2H+=Cl2↑+H2OMnO2+HCl---(地康法)4HCl+O2催化剂、加热2Cl2+2H2O4、HX的制法H2SO4(浓) +CaF2@CaSO4+2HF↑H2SO4(浓)+NaCl微热NaHSO4+HCl↑H2SO4(浓) +2NaCl强热Na2SO4+2HCl↑H3PO4(浓)+NaBr@NaH2PO4+HBr↑H3PO4(浓)+NaI@NaH2PO4+HI↑5.HClO的氧化性3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2KClO3二氧化锰加热2KCl+3O2↑通电通电二、氧及氧的化合物(1)O 2⑴金属Na/Fe/Cu不活泼的非金属S/P/C/Si/H 2⑵非金属阴离子X -/S 2-/NH 3⑶SO 2/SO 32-/Fe 2+/NO/CO/CS 2/CH 4O 2-KClO 3F 2/电解F 2(低温)OF 2O 3PbSKI(Cl/NO )放电紫外光H 2O 2KMnO 4(H +)I -/Fe 2+/SO 32-MnO 2Na 2O 2Ba 2O 2Na(点燃)H 2SO 4MnO 2(△)1、O 22Na + O 2=== Na 2O(钠放置在空气中变暗) 2Na + O 2 Na 2O 2(黄色的火焰,生成淡黄色固体) 4Al + 3O 2点燃2Al 2O 3 铝箔在氧气中剧烈燃烧3Fe +2O 2点燃Fe 3O 44FeS 2+11O 2煅烧2Fe 2O 3+8SO 2N 2 + O 2 放电 2NO S+O 2===SO 2 4P+5O 2点燃P 4O 10(常写成P 2O 5,冒白烟) 2C+O 2(少量)点燃2COC+O 2(足量)点燃CO 2Si + O 2SiO 2(硅粉在氧气中燃烧 )4NH 3 +5O 2(空气) 4NO + 6H 2O 4NH 3+3O 2(纯)点燃2N 2+6H 2O2H 2S+3O 2点燃2H 2O+2SO 2 2NO + O 22NO 22SO 2+O 2催化剂 加热2SO 32CaSO 3+O 2=== 2CaSO 4 P 4S 3+8O 2点燃3SO 2+2P 2P 5SiH 4+2O 2=SiO 2+2H 2O 2.O 32 O3 NO Cl 或3 O 2(氮氧化物或氟里昂破坏臭氧层)PbS+2 O 3=PbSO 4+O 22KI+ O 3+ H 2O=I 2+2KOH+O 2(湿KI-淀粉试剂检验空气中的臭氧含量) 3O 2放电或紫外光 2O 3(雷电、复印机、高压电机)3、H 2O 2 不稳定性:2H 2O 22MnO 2H 2O+O 2↑弱酸性:BaO 2+H 2SO 4=BaSO 4↓+H 2O 2 氧化性:H 2O 2+2KI+H 2SO 4=K 2SO 4+I 2+2H 2O Cu+H 2O 2+2H +=Cu 2++2H 2OSO 2+H 2O 2=H 2SO 4还原性:2MnO 4-+5H 2O 2+6H +=2Mn 2++8H 2O+5O 2 ↑二、硫及硫的化合物(2)⑴金属Na/Fe/Cu/Hg H S S 2 SO SO 32-PbSPb(CH 3(FeS)322504Cu(△)C (△)S (△)2241. S氧化性:3S+2Al△Al 2S 3 S+Fe @FeS S+2Cu△Cu 2SS+Hg=HgS(除去洒落地上的水银) 2S+C△CS 2 S+H 2△H 2S还原性:S+O 2点燃SO 2S+H 2SO 4(浓)△3SO 2↑+2H 2O S+6HNO 3(浓)△H 2SO 4+6NO 2↑+2H 2O3S+6NaOH △2Na 2S+Na 2SO 3+3H 2O2. H 2S不稳定性:H 2S△H 2+S还原性:Cl 2+H 2S=2HCl+S ↓ 2H 2S+O 2(少量)===2S ↓+2H 2O 2H 2S+SO 2===3S ↓+2H 2OH 2S+H 2SO 4(浓)===S ↓+SO 2↑+2H 2O 3H 2S+2HNO 3(稀)===3S ↓+2NO ↑+4H 2O5H 2S+2KMnO 4+3H 2SO 4===2MnSO 4+K 2SO 4+5S ↓+8H 2O 3H 2S+K 2Cr 2O 7+4H 2SO 4===Cr 2(SO 4)3+K 2SO 4+3S ↓+7H 2O H 2S+4Na 2O 2+2H 2O===Na 2SO 4+6NaOH 酸性:H 2S+Fe===FeS+H 2↑ H 2S+CuCl 2===CuS ↓+2HClH 2S+Pb(CH 3COO)2===PbS ↓+2CH 3COOH H 2S+FeCl 2===不反应H 2S+2AgNO 3===Ag 2S ↓+2HNO 33.SO 2与SO 3 酸性氧化物的通性: SO 2+H 2O===H 2SO 3SO 3+H 2O===H 2SO 4(要形成酸雾,常用98.3%的浓硫酸吸收三氧化硫) SO 2+2NH 3+H 2O===(NH 4)2SO 3(这是硫酸厂回收SO 2的反应.先用氨水吸收SO 2,2NH 4HSO 3+H 2SO 4===(NH 4)2SO 4+2H 2O+2SO 2(生成的硫酸铵作化肥,SO 2循环作原料气) SO 2+Ca(OH)2===CaSO 3+H 2O(不能用澄清石灰水鉴别SO 2和CO 2.可用品红鉴别) SO 3+Ca(OH)2===CaSO 4+H 2O还原性:2SO 2+O 2250V O 450C垐垐?噲垐?2SO 3 2SO 2+O 2+2H 2O===2H 2SO 4(这是SO 2在大气中缓慢发生的环境化学反应) SO 2+X 2+2H 2O===H 2SO 4+2HX(X=Cl/Br/I) SO 2+NO 2===SO 3+NO氧化性:SO 2+2H 2S===3S+2H 2O SO 3+2KI===K 2SO 3+I 2 4、亚硫酸不稳定性:H 2SO 3===H 2O+SO 2↑ 氧化性:2H 2SO 3+2H 2S===3S+2H 2O还原性:H 2SO 3+X 2+H 2O===H 2SO 4+2HX(X 表示Cl 2,Br 2,I 2) 2H 2SO 3+O 2===2H 2SO 4 H 2SO 3+H 2O 2===H 2SO 4+H 2O5H 2SO 3+2KMnO 4===2MnSO 4+K 2SO 4+2H 2SO 4+3H 2O H 2SO 3+2FeCl 3+H 2O===H 2SO 4+2FeCl 2+2HCl 3Na 2SO 3+2HNO 3(稀)===3Na 2SO 4+2NO ↑+H 2O 5.硫酸H 2SO 4(稀)+Fe===FeSO 4+H 2浓硫酸的氧化性:H 2SO 4+Fe(Al) 室温下钝化 6H 2SO 4(浓)+2Fe △Fe 2(SO 4)3+3SO 2↑+6H 2O2H 2SO 4(浓)+Cu △4+SO 2↑+2H 2O2H 2SO 4(浓)+C △CO 2+2SO 2↑+2H 2O2H 2SO 4(浓)+S△3SO 2↑+2H 2OH 2SO 4(浓)+2HBr △SO 2↑+Br 2+2H 2OH 2SO 4(浓)+2HI△SO 2↑+I 2+2H 2OI 2 + 2Na 2S 2O 3 ===2NaI + Na 2S 4O 6 S 2O 32- + 2H +=== SO 2↑+ S ↓+H 2O三、氮及氮的化合物(△)NH 3N 2NONO 2HNO 3NH 4Cl(NH 4)2SO4NH 4NO 3(炸药)化肥HCl△CaONaOHH 2O NH 3·H 2O H 2(高温高压催化剂)Mg 纯O 2(点燃)CuO(△)NO x (催化剂)Ca(OH)2NaNO 3(溶液)O 2(放电)CO (催化剂)(催化剂)NH 3O 2O 2+H 2O △或光Cu 、Ag (除Pt/Au 外) (点燃)Mg 3N 2O 2(Pt △)NaOHNaNO 2NaNO 3浓硫酸(△)KNO 3S +C (△)H +HNO 2存在化合态土壤NH 4+/NO 3-生物体中蛋白质游离态:空气加C 除O 2加压降温液态升温NH 4++OH-A.N 21.性质:由于N ≡N 键很牢固,通常状况下性质稳定,在高温、高压、放电等条件下,能与一些物质反应。
