高中金属、非金属及化合物的相互转化关系图
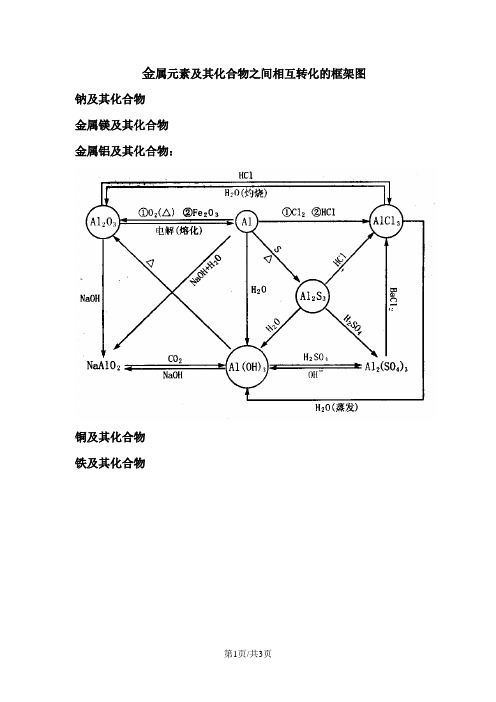
人教高中化学 必修一 第 3章 金属元素及其化合物之间相互转化的框架图
物质的特殊转化关系及框图推断

物质的特殊转化关系及框图推断1.直线型转化关系 A ――→XB ――→XC (1)X 为O 2Na ―→Na 2O ―→Na 2O 2N 2―→NO ―→NO 2或NH 3―→NO ―→NO 2 S ―→SO 2―→SO 3或H 2S ―→SO 2―→SO 3 C ―→CO ―→CO 2或CH 4―→CO ―→CO 2 醇―→醛―→羧酸 (2)X 为CO 2NaOH ――→CO 2Na 2CO 3――→CO 2NaHCO 3 (3)X 为强酸,如HClNaAlO 2――→HClAl(OH)3――→HClAlCl 3 Na 2CO 3――→HClNaHCO 3――→HClCO 2 (4)X 为强碱,如NaOH AlCl 3――→NaOHAl(OH)3――→NaOHNaAlO 2 2.交叉型转化3.三角型转化4.注意反应形式与物质的关系,特别是置换反应 (1)金属―→金属:金属+盐―→盐+金属,铝热反应。
(2)金属―→非金属:活泼金属+H 2O(或H +)―→H 2,2Mg +CO 2=====点燃2MgO +C 。
(3)非金属―→非金属:2F 2+2H 2O===4HF +O 2,2C +SiO 2=====高温Si +2CO ↑,C +H 2O(g)=====高温CO +H 2,X 2+H 2S===2HX +S ↓。
(4)非金属―→金属,用H 2、C 冶炼金属。
通过反应形式梳理化学反应,培养归纳、整理的能力。
5.抓住化学反应与反应条件的关系多数化学反应需要一定条件,条件不同化学反应也不同。
(1)“催化剂”,无机化学反应需要的催化剂不同,但是根据“催化剂”这一条件,可将氯酸钾分解、双氧水分解、工业合成氨、SO 2催化氧化、氨催化氧化联系起来,形成知识链。
(2)“通电”或“电解”,可以锁定在电解水、氯化钠、氯化镁、氯化铜、硫酸铜、硝酸盐等溶液,熔融氯化钠和氧化铝范围内。
(3)“高温”,常见的有碳酸钙分解、SiO 2和C 的置换反应、制造普通玻璃的反应、铝热反应等。
必修1_物质转化关系图及相应化学方程式

必修1 物质转化关系图及相应化学方程式一、金属钠及其重要化合物的相互转化(括号内写离子方程式)1、4 Na + O 2 === 2 Na 2O2、2 Na +O 2△Na 2O 23、2 Na +2 H 2O===2 NaOH +H 2↑ (2 Na +2 H 2O===2 Na ++2 OH -+H 2↑)4、Na 2O + H 2O===2 NaOH (Na 2O +H 2O===2 Na ++2 OH -) *5、2Na 2O 2 +2H 2O === 4 NaOH +O 2↑ (2Na 2O 2+2 H 2O =4Na ++4OH -+O 2↑) *6、2 Na 2O 2 + 2 CO 2 === 2 Na 2CO 3+O 27、2 NaOH + CO 2 === Na 2CO 3+H 2O (CO 2+ 2 OH - = CO 32-+H 2O ) 8、NaOH + HCl === NaCl +H 2O (OH — + H += H 2O)9、Na 2CO 3+2HCl =2NaCl +CO 2↑+H 2O (CO -23+ 2H + = CO 2↑ + H 2O )10、NaHCO 3+HCl =NaCl +CO 2↑+H 2O (HCO -3+ H + = CO 2↑ + H 2O )11、Na 2CO 3+CO 2+H 2O= 2 NaHCO 3 (CO 32— + CO 2 + H 2O= 2 HCO 3—)12、NaHCO 3+NaOH =Na 2CO 3+H 2O (HCO -3+OH - = CO -23 + H 2O )2 NaHCO 3△Na 2CO 3+CO 2↑+H 2ONa 2O Na ①NaCl NaHCO 3Na 23Na 2O 2 ② ③ ④ ⑤ ⑥⑦ ⑧ ⑨⑩ ⑾ ⑿二、非金属氯及其化合物的相互转化(括号内写离子方程式)1、H 2 + Cl 2点燃2HCl 2、2Na + Cl 2 点燃2NaCl3、Cu + Cl 2 点燃CuCl 24、2Fe + 3Cl 2点燃2FeCl 35、HCl +AgNO 3 = AgCl↓+HNO 3 (Cl -+Ag +=Ag Cl↓)6、NaCl +AgNO 3 = AgCl↓+NaNO 3 (Cl -+Ag +=AgCl↓)7、CuCl 2+2AgNO 3 = 2AgCl↓+Cu(NO 3)2 (Cl -+Ag +=AgCl↓)8、FeCl 3+3AgNO 3 = 3AgCl↓+Fe(NO 3)3 (Cl -+Ag +=AgCl↓)9、Cl 2 + 2NaOH = NaCl + NaClO + H 2O (Cl 2 + 2OH - = Cl - + ClO - + H 2O) 10、2Cl 2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H 2O(Cl 2 + 2OH - = Cl - + ClO - + H 2O)11、Cl 2 + H 2O = HCl + HClO (Cl 2 + H 2O = H ++Cl -+ HClO) 12、NaClO +HCl = NaCl + HClO (ClO - +H += HClO)2NaClO+H 2O+CO 2= Na 2CO 3+ 2HClO (2ClO -+H 2O+CO 2= CO 32-+ 2HClO) 13、Ca(ClO) 2+2HCl = CaCl 2 + 2HClO (ClO - +H += HClO)Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO (Ca 2++2ClO -+H 2O+CO 2=CaCO+ 2HClO)14、2HClO 2HCl+O 2↑NaCl 23AgCl⑤ ⑥ ⑦ ⑧光照三、金属铝及其重要化合物的相互转化(括号内写离子方程式)1.4Al +3O 2点燃2Al 2O 3 2.2 Al (OH )3△Al 2O 3 +3H 2O3.2Al +6HCl==2AlCl 3+3H 2↑ ( 2Al +6H +==2 Al 3++3H 2↑) 4.2Al +2NaOH +2H 2O==2NaAlO 2+3H 2↑ (2 Al +2OH -+2H 2O =2AlO 2-+3 H 2↑)5.Al 2O 3+6HCl =2AlCl 3+3H 2O ( Al 2O 3+6H +=2Al 3++3H 2O ) 6. Al 2O 3+2NaOH =2Na AlO 2+H 2O (Al 2O 3+2OH -=2 AlO 2-+H 2O )7、Al (OH )3+3HCl =AlCl 3+3H 2O ( Al (OH )3+3H + = Al 3++3H 2O )8、Al (OH )3+NaOH =NaAlO 2+2H 2O ( Al (OH )3+OH - = AlO 2-+2H 2O )9、实验制取Al (OH )3: AlCl 3+3NH 3·H 2O = Al (OH )3↓+3NH 4Cl (Al 3++3 NH 3·H 2O = Al (OH )3 ↓+ 3NH 4+ )AlAl (OH )3NaAlO 2Al 2O 3AlCl 3①②③④ ⑤ ⑥⑦ ⑧四、金属铁及其化合物的相互转化(括号内写离子方程式)1、3Fe +2O2 点燃Fe3O42、Fe+2HCl=FeCl2+H2↑(Fe+2H+=Fe2++H2↑)Fe+CuCl2=FeCl2+Cu (Fe+Cu2+=Fe2++Cu)3、FeO+2HCl=FeCl2+H2O(FeO+2H+=Fe2++H2O)4、Fe2O3+6HCl=2 FeCl3+3H2O (Fe2O3+6H+=2Fe2++3H2O)5、FeCl2+2NaOH =Fe(OH)2↓+2NaCl (Fe2++2OH-=Fe(OH) 2)↓6、Fe(OH)2 + 2HCl=FeCl2+2H2O(Fe(OH)2+2H+=Fe2++2H2O)7、FeCl3+3NaOH =Fe(OH)3↓+3NaCl ( Fe3++3OH-=Fe(OH) 3↓)8、Fe(OH) 3+3HCl=FeCl3+3H2O (Fe(OH) 3+3H+=Fe3++3H2O)9、2FeCl2+Cl2=2FeCl3 (2Fe2++Cl2=2 Fe3++2Cl—)10、属于化合反应的:Fe+2FeCl3 =3FeCl2(Fe +2 Fe3+=3 Fe2+) 印刷腐蚀电路板:Cu+2FeCl3 =CuCl2+2FeCl2 (Cu+2 Fe3+=Cu2++2 Fe2+)11、2 Fe(OH)3△Fe2O3+3H2O12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色4 Fe(OH)2+ O2 + 2 H2O ═ 4 Fe(OH) 3①Fe3O4②23⑾⑿。
物质的转化

2H2O22H2O+O2↑ _____________________
典型例题
金属、非金属、氧化物、酸、碱、盐相互转化关 系图
2.按照反应类型研究物质的转化 为了更好地研究物质间的相互转化,根据化学 反应的特征,将化学反应分为化合反应、分解 反应、置换反应和复分解反应等,请根据所学 知识填写下列表格:
+2 +4 -2
0 △ +2 C 项中MnO2+4HCl (浓)=====MnCl2+Cl2↑ +2H2O,化合价有变化,属于氧化还原反应。 △ D 项中 NaCl(s)+H2SO4(浓)===== NaHSO4 + HCl↑为复分解反应,属于非氧化还原反应。
+4 -1
【答案】
BC
5.下列说法中正确的是( ) A.凡没有单质参加的化合反应一定是非氧化还 原反应 B.有单质参加的反应一定是氧化还原反应 C.凡有盐参加的反应,都是复分解反应 D.置换反应一定是氧化还原反应
【解析】 A 的说法太绝对,因为有些化合物 间的化合反应也可能是氧化还原反应; 选项的 B 说法也不正确,如石墨在一定条件下变成金刚 石的反应,它既不是四种类型的反应,也不是 氧化还原反应。对 C 而言,有盐参加反应可能 是化合反应: 2FeCl3+Fe===2FeCl2; 置换反应: Cl2 + 2KBr===Br2 + 2KCl ; 分 解 反 应 : 高温 CaCO3=====CaO+CO2↑。 【答案】 D
(3)写出下列对应反应的化学方程式。 化合反应:________________________, 分解反应:________________________。
【解析】 该诗描述了由石灰石的开采到熟石灰 的制备过程,第一句描述了开采石灰石的景象, 第二句描述了 CaCO3 高温分解制生石灰的过程, 第三句描述了 CaO 与水反应生成 Ca(OH)2 的过程, 第四句描述了熟石灰在建筑中的广泛应用,所涉 高温 及的化学方程式有 CaCO3=====CaO+CO2↑, CaO + H2O===Ca(OH)2 , Ca(OH)2 + CO2===CaCO3↓+H2O。
各类物质之间的相互转化关系
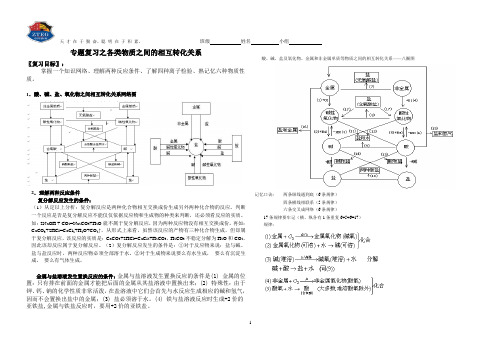
天才在于勤奋,聪明在于积累。
班级姓名小组专题复习之各类物质之间的相互转化关系〖复习目标〗:掌握一个知识网络、理解两种反应条件、了解四种离子检验、熟记忆六种物质性质。
1.酸、碱、盐、氧化物之间相互转化关系网络图2.理解两种反应条件复分解反应发生的条件:(1)从定以上分析:复分解反应是两种化合物相互交换成份生成另外两种化合物的反应。
判断一个反应是否是复分解反应不能仅仅依据反应物和生成物的种类来判断,还必须看反应的实质。
如:2NaOH + CO2=Na2CO3+H2O就不属于复分解反应,因为两种反应物没有相互交换成份。
再如:CaCO3+2HCl=CaCl2+H2O+CO2↑,从形式上来看,虽然该反应的产物有三种化合物生成,但却属于复分解反应,该反应的实质是:CaCO3+2HCl=CaCl2+H2CO3,H2CO3不稳定分解为H 2O和CO2,因此该却反应属于复分解反应。
(2)复分解反应发生的条件是:①对于反应物来说:盐与碱、盐与盐反应时,两种反应物必须全部溶于水。
②对于生成物来说要么有水生成,要么有沉淀生成,要么有气体生成。
金属与盐溶液发生置换反应的条件:金属与盐溶液发生置换反应的条件是(1) 金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2) 特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3) 盐必须溶于水。
(4) 铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时,要用+2价的亚铁盐。
酸、碱、盐及氧化物、金属和非金属单质等物质之间的相互转化关系——八圈图记忆口诀:两条纵线通到底(6条规律)四条横线相联系(5条规律)六条交叉成网络(6条规律)17条规律要牢记(横、纵各有1条重复6+5+6=17)规律:天才在于勤奋,聪明在于积累。
班级姓名小组分解反应以上规律的应用:①可知某物质性质②某物质制法(箭尾)(箭头指向)③各类物质间相互关系从上述规律中可以总结出制盐的十种方法,包括:(2)~(16)【典型例题】[例1] 现有石灰石、水、碳酸钠,怎样制取烧碱(不能引入其他物质),写出化学方程式。
物质的转化规律全解

(5)用含杂质的铁 10 g(杂质不溶于水,也不参加反应)与 100 g 稀硫酸恰好完全 反应, 滤去杂质, 得到滤液质量为 108.1 g, 则含杂质的铁中, 铁的质量分数为__ __。
1. (2014· 天津)某钢铁厂高炉炼铁的主要原料是焦炭、 赤铁矿石(主要含 Fe2O3)、 空气等,主要反应过程如下: 请回答: (1)A 的化学式__CO2__。 高温 2CO__。 (2)反应②的化学方程式__CO2+C===== 高温 2Fe+3CO __。 (3)反应③的化学方程式__Fe2O3+3CO===== 2 (4)向硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤, 得到滤渣和滤液。 向滤渣中滴加稀盐酸, 无气泡产生, 则滤渣中一定含有__Ag__(填 化学式),滤液中一定含有的溶质是__Fe(NO3)2__(填化学式)。 (5)用含杂质的铁 10 g(杂质不溶于水,也不参加反应)与 100 g 稀硫酸恰好完全 反应,滤去杂质 ,得到滤液质量为 108.1 g,则含杂质的铁中, 铁的质量分数为 __84%__。
物质的转化规律
一、非金属及其化合物之间的转化
1.非金属单质与其化合物的转化
2.非金属在一定条件下可以转化为相应的化合物,如: 点燃 SO S+O2===== 2 CO2+H2O===H2CO3 SO3+H2O===H2SO4 点燃 CO C+O2===== 2 SO2+H2O===H2SO3 3.某些非金属氧化物可的转化
1.金属单质与其化合物的转化
2.金属单质和非金属单质在一定条件下可以相互反应,生成相应的盐或 金属氧化物。如: △ __FeS__ Fe+S===== △ __2FeCl __ 2Fe+3Cl2===== 3 点燃 __Fe O __ 3Fe+2O =====
新浙教版九年级科学上册习题课件:2.5 物质的转化 第1课时 非金属、金属及其化合物之间的转化

①
A—C 反应的化学方程式
C__+__2_C_u_O__=_高=_=_温=_=_2__C_u_+__C__O_2_↑__(_或__C__O_+__C__u_O_=__=△_=_=_=_C_u__+__C_O__2)__;
② D→F 反应的化学方程式_ _N_a_2_C_O__3_+__C_a_(_O_H__)_2=__=_=_C_a_C__O_3_↓__+______ __2_N_a_O__H__[或__N__a_2C__O__3+__B__a_(O__H__)2_=_=_=_B__a_C_O__3↓___+__2_N_a_O__H_或__K__2_C_O__3+_____ _C__a_(O__H__)2_=_=_=_C__a_C_O__3_↓__+__2_K_O__H__或__K_2_C_O__3_+__B_a_(_O_H__)_2=_=__=_B_a_C__O_3_↓__+___
7.有如下化学反应过程:X―+―H→ClY+―N―aO→HZ――△→X。其中 X 代表的
物质是( D )
A.Mg
B.AgNO3
C.Na2O D.Fe2O3
8.下列物质的制备方案理论上正确的是( C )
A.S加O―2―,→点燃SO3加――H2→OH2SO4 B.C在空―气―中→燃烧CO加――H2→OH2CO3 C.CaO加――H2→OCa(OH)2 溶液加―N―a2→CO3NaOH 溶液 D.Cu加O―2―,→加热CuO加――H2→OCu(OH)2
为反应物,将图中指定序号的转变过程用化学方程式表示。(所写化学方程式
不得重复) 例:①C+O2=点==燃==CO2 ②_ CO2+H2O===H2CO3 __。 ③_Fe+2HCl===FeCl2+H2↑__。 ④_CaO+2HCl===CaCl2+H2O __。 ⑤_Ca(OH)2+2HCl===CaCl2+2H2O __。 ⑥_CaO+H2O===Ca(OH_)2_。 ⑦__3_F_e_+__2_O_2_=_点=_=_燃=_=__F_e_3O__4_____。
元素化合物转化关系图(高中)
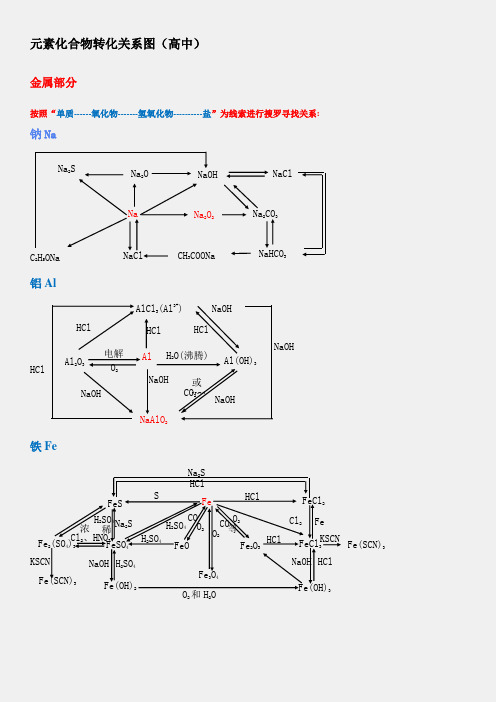
元素化合物转化关系图(高中)金属部分按照“单质------氧化物-------氢氧化物----------盐”为线索进行搜罗寻找关系:钠Na铝Al铁FeNa 2SNa 2ONaOHNaClNa 2CO 3Na 2O 2NaC 2H 5ONaNaCl CH 3COONaNaHCO 3Al 2O 3Al Al(OH)3NaAlO 2AlCl 3(Al 3+)H 2O(沸腾) 电解 O 2HCl NaOHNaOHCO 2或HCl NaOHNaOH HClHClHClNaOH稀 FeFeO FeCl 3 Fe(OH)2FeSFe 2O 3 Fe 3O 4FeCl 2Fe(OH)3 FeSO 4 Fe 2(SO 4)3 Fe(SCN)3 Fe(SCN)3SHClH 2SO 4 O 2 CO 等HCl Cl 2 Fe KSCN KSCN Na 2S H 2SO 4 Cl 2、HNO 3 浓 O 2和H 2ONaOH HClNaOH H 2SO 4H 2SO 4 CO O 2O 2 Na 2S HCl镁Mg铜Cu钙CaMg 3N 2MgOMg(OH)2MgX 2Cl 2CO 2H 2OX 2Mg MgO Mg(OH)2 MgCO 3△ MgCl 2 H 2OH 2ON 2HCl NaOH HCl 电解Mg(HCO 3)2 煅烧O 2HClH 2O CO 2 △或 OH -HCl CuCuO Cu(OH)2Cu 2+(NO 3-、SO42-)Cu 2SNH 3•H 2O[Cu(NH 3)4]2+CuSCu 2ONa 2S SH + HNO 3或H 2SO 4(浓)NaOH O 2 CO 、Al 、H△H +Ca(OH)2HClHCl H 2OHClNa 2CO 3CO 2+H 2OCaCaO CaHPO 4△CaCl 2CaCO 3 CaC 2 C(电炉)Ca(HCO 3)2O 2 H 2OH 3PO 4HClCO 2Ca(ClO)2H 2OCl 2或 CO 2非金属部分按照“化合价”寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐:氯Cl硫SCl2HCl CH3ClCa(ClO)FeCl3CuCl2PCl3、PCl5NaClOHClOCH2ClCH2ClO 2FeCl2CO2NaClCuCl2H2CH2=CHClHBr NaBrAgBrHI NaIAgIBr2I2ClFeS2S H2S Na2SSO2Na2SO3FeSSO3 Na2SO4BaSO4PbSCuSBaSO3 H2SO3H2SO4氮N碳与硅 C 、SiMg 3N 2N 2NONO 2N 2O 4NH 4Cl NH 3 NaNO3 HNO 3 Cu(NO 3)2[Ag (NH 3)2]+NH 3·H 2O(C 6H 7O 2) NO 2NO 2NO 2 n或 NO 2 Si C SiO 2H 2SiO 3CaSiO3H 4SiO 4Na 2SiO 3 SiH 4 SiF 4 SiCl 4CO 2 CO H 2CO 3 Ca(HCO 3) 2CaCO 3CaC 2CaOCa(OH)2磷P\氢与氧 H 、OPP 2O 5PCl 3PCl 5HPO 3H 3PO 4Na 3PO 4Ca 3(PO 4)2Ca (H 2PO 4)2CaHPO 4 H 2 H 2OO 2CH 3COOHCH 3CH 2OHKMnO 4HgOKClO 3 Na 2O 2H 2SO 4 CH 4ZnNH 4ClNH 3Cu Ca(OH)2Fe 3O 4 SO 2 CO 2+H 2O。
高中化学 金属与非金属的思维导图
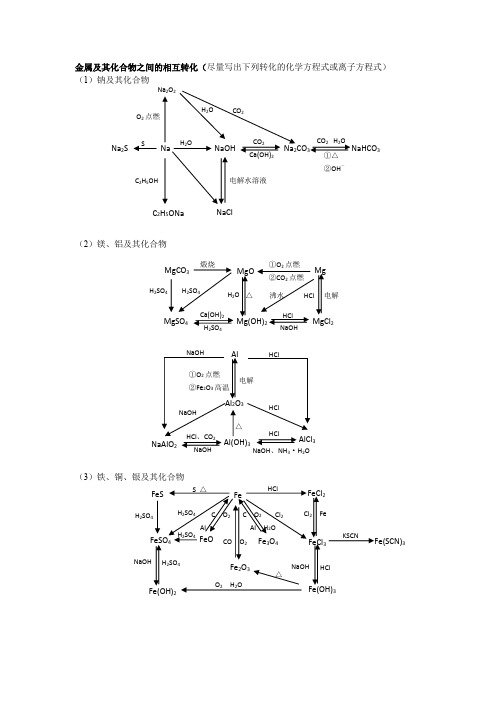
金属及其化合物之间的相互转化(尽量写出下列转化的化学方程式或离子方程式) (1)钠及其化合物(2)镁、铝及其化合物(3)铁、铜、银及其化合物Na Na 2S NaOH Na 2CO 3 NaHCO 3 CO 2 H 2O ①△②OH -CO 2 Ca(OH)2 H 2O SNa 2O 2 H 2O O 2点燃 CO 2C 2H 5ONa NaCl C 2H 5OH 电解水溶液HCl △ Mg MgOMgCO 3 Mg(OH)2 MgCl 2MgSO 4 H 2SO 4 H 2SO 4 H 2SO 4 电解 沸水HClNaOH Ca(OH)2H 2O 煅烧 ①O 2点燃 ②CO 2点燃 Cl 2 Fe FeO H 2SO 4 Cl 2 FeFeCl 2 FeS FeSO 4 Fe 2O 3 FeCl 3Fe(SCN)3 Fe(OH)3 Fe(OH)2 Fe 3O 4 H 2SO 4 H 2SO 4H 2SO 4 HCl NaOH HCl NaOH C O 2 Al H 2O C O 2 AlCO O 2 O 2 H 2O△S △ KSCN Al Al 2O 3 NaAlO 2AlCl 3 Al(OH)3 ①O 2点燃②Fe 2O 3高温电解 NaOH NaOHNaOH NaOH 、NH 3·H 2O HCl HCl HClHCl 、CO 2 △H 2SO 4 △ NaOHFeFe HNO 3Cu H 2SO 4△HNO 3 CuO Cu(OH)2Cu 2OCu(NO 3)2CuSO 4Cu 2S CuSH 2S浓H 2SO 4S 点燃O 2 △CO △ HNO 3 高温 RCHO 水浴加热 AgOHNa 2SS △FeAgAgNO 3Ag 2SAg(NH 3)2OHRCHO 水浴加热Ag 2CO 3AgI AgBr AgClH 2SHNO 3 HNO 3 NH 3·H 2O NH 3·H 2OHCl硅及其化合物之间的相互转化关系氯气及其化合物相互转化关系Cl2PCl 3、PClO 2②点燃NaClAgClNaOH光照3硫及其化合物相互转化关系H3Na SO 4223H 22SO 4O ,燃烧2NaOHO 2BaCl 2H 2O2氮及其化合物相互转化关系NH 4N NO 3243N 23·H 2ONH 4+ OH +H 2,催化剂高温 高压O 2 , 放电2O 2浓H 2SO 4△①浓酸,Cu ②见光或△③C点燃2O。
(完整)高中化学知识结构图
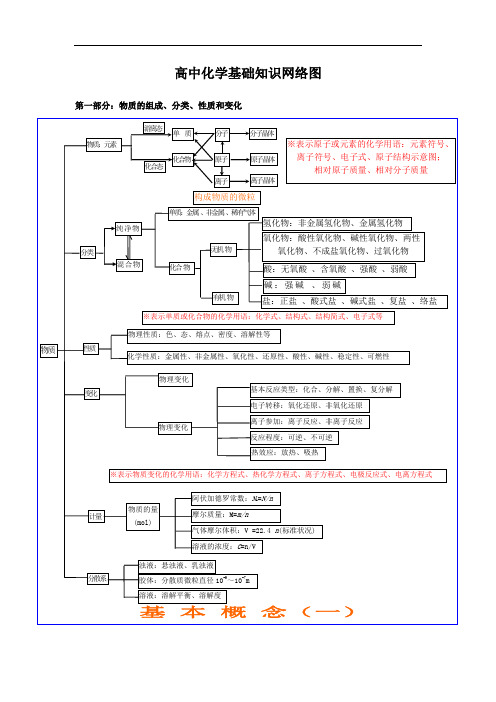
或 4OH-—4e H2O+O2↑
金属电极做阳极,电极本身被氧化 M-n氧e→化 Mn+
第三部分:元素化合物转化关系
Na2S C2H5ONa
Na2O
NaOH
NaCl
Na
Na2O2
Na2CO3
NaCl
CH3COONa
NaHCO3
N2 Mg3N2
CO2 MgO
H2O Mg(OH)2
X2 MgX2
煅烧
O2 Mg
Ⅷ族
0族
比较
类型
构成晶体微粒
形成晶体作用力
熔沸点
硬度
物 理
导电性
性 质
传热性
延展性
溶解性
典型实例
离子晶体 阴、阳离子
离子键 较高
硬而脆 不良 水熔溶融液.导电
不. 良 不良 易溶于极性溶剂
NaCl,KBr
原子晶体 原子 共价键 很高 大
绝缘体(半导体) 不良 不良
不溶于任何溶剂 单质:金刚石、SiC、
H2O MgO
Mg(OH)2
H2O MgCO3
△
HCl
△
Cl2
HCl NaOH H2O HCl
或
电解
CO2 OH-
HCl
MgCl2
Mg(HCO3)2
CaCl2 HCl Cl2 或 HCl
Na2CO3 HCl
CaCO3
HCl CO2
CO2+H2O
△
O2 Ca
CaO H2O
H3PO4 Ca(OH)2
CaHPO4
CaC2
Ca(OH)2
CaO
非金属:按照化合价寻找各类物质,主要有氢化物、
单质、氧化物、含氧酸、及其盐
必修一物质转化关系图示
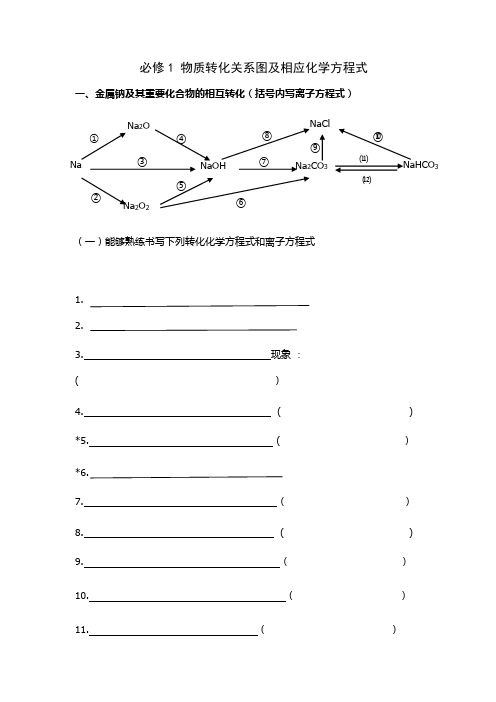
必修1 物质转化关系图及相应化学方程式一、金属钠及其重要化合物的相互转化(括号内写离子方程式)(一)能够熟练书写下列转化化学方程式和离子方程式1. 2.3. 现象 : ( )4. ( ) *5. ( ) *6.7. ( ) 8. ( ) 9. ( ) 10. ( ) 11. ( )Na 2O Na ①NaCl NaHCO 3Na 2CO 3NaOH Na 2O 2②③④⑤⑥⑦⑧ ⑨ ⑩⑾⑿[NaHCO 3固体](二) 熟记下列物质的颜色状态Na: Na 2O: Na 2O 2: NaHCO 3: Na 2CO 3:(三) 熟记下列信息溶解度: NaHCO 3 Na 2CO 3溶液碱性强弱: NaHCO 3 Na 2CO 3 俗名: NaHCO 3: Na 2CO 3: Na 的保存: Na 2O 2的用途:二、金属铝及其重要化合物的相互转化(括号内写离子方程式)1. 2.3. ( )AlAl (OH )3NaAlO 2Al 2O 3AlCl 3 ①② ③ ④ ⑤ ⑥ ⑦ ⑧5. ( ) 6. ( ) 7. ( ) 8. ( ) 9.实验制取Al (OH )3:( ) 10.Al 2O 3的用途:三、金属铁及其化合物的相互转化(括号内写离子方程式)1.2. ( )3. ( )4. ( )5. ( )①Fe 3O 4②23⑿7. ( )8. ( )9. ( )10.属于化合反应的 ( )印刷腐蚀电路板的 ( )11.12.白色沉淀,然后迅速变为灰绿色,最后变为红褐色13.离子颜色:Fe2+ Fe3+四、非金属氯及其化合物的相互转化(括号内写离子方程式)1.2.3.4. NaCl23AgCl⑤⑥⑦⑧6. ( )7. ( )8. ()9. ()10. ()11. ()12. ()13. ()()14.五、非金属硫及其化合物转化关系1.2.3.9.10111213182021六、氮及其化合物相互转化。
常见无机物间的转化关系(19张PPT)

本章热点专题
常见无机物间的转化关系
2.三角型转化关系
(1)铁三角: (2)碳三角: (3)铝三角: (4)氯三角:
(5)硅三角:
人教版化学
本章热点专题
常见无机物间的转化关系
3.交叉型转化关系 (1)硫及其重要化合物间的转化:
(2)氮及其重要化合物间的转化:
(3)钠及其重要化合物间的转化:
人教版化学
般有两种考查方式:一是给出一定的转化关系,分析满足给定
转化关系的物质,一般以选择题形式考查;二是结合无机框图 推断题考查,一般作为框图的一部分,通常是解答该题的突破
口。
人教版化学
本章热点专题
常见无机物间的转化关系
D D 1.直线型连续转化关系 A――→B――→C
(1)氧化还原反应型 O2 O2 O2 ①NH3( 或 N2) ――→ NO ――→ NO2 或 NH3 ――→ O2 N2――→NO
[答案] C
人教版化学
本章热点专题
常见无机物间的转化关系
[例2] 选项 化合物 Y W
(2011· 福建高考)下表各选项中,不能利用 ( )
置换反应通过Y得到W的一组化合物是
A
CO2 MgO
B Fe2O3 Al2O3
C
C2H5OH C2H5ONa
D
FeCl3 CuCl2
人教版化学
本章热点专题
常见无机物间的转化关系
O2 O2 O2 O2 ②H2S(或 S)――→SO2――→SO3 或 H2S――→S――→ SO2 O2 O2 C C ③C――→CO――→CO2 或 O2――→CO2――→CO
人教版化学
本章热点专题
常见无机物间的转化关系
物质转化规律

物质的分类和转化规律一.物质的转化规律:1.金属+氧==金属氧化物2.金属氧化物+还原剂=金属+非金属氧化物①CuO+H2== 现象:,H2还原优点是反应生成物之一是,且产物较纯净。
②CuO+CO== (CO有剧毒,实验时一定)③2CuO+C;现象:(虽然C的还原能力强于H2,但固体还原剂与氧化物的充分接触程度没有固体与气体还原剂充分,自然反应温度就比H2要高,最好使用酒精喷灯或加罩的酒精灯。
C要稍微过量。
)④2Fe2O3+3C;⑤Fe2O3+3CO;(加热时一定要持续高温)⑥Fe2O3+3H2 ;现象:3.金属氧化物+水==碱4.碱==金属氧化物+水5.非金属+氧==非金属氧化物①氢气在空气中燃烧:2H2+O2现象:相关知识点: (1)氢气是一种常见的还原剂; (2)点燃前,一定要检验它的纯度否则会爆炸。
②红磷在空气中燃烧:4P+5O2现象:相关知识点: (1)烟是固体小颗粒;雾是液体小颗粒. (2)测量氧气在空气中的体积分数。
(3)可做烟雾弹。
③硫粉在空气中燃烧: S+O2现象:在空气中是发出微弱的火焰,在氧气中是发出明亮的火焰. 有强烈气味。
相关知识点:(1)反应后的产物可用紫色的石蕊试液来检验(紫色变成红色);(2)SO2污染空气,要用溶液进行尾气处理。
(3)SO2是气体,所以测量氧气在空气中的体积分数,若将水改为溶液,也可以测量氧气在空气中的体积分数。
④碳在氧气中充分燃烧:C+O2现象:在空气中是发出 ,在氧气中是发出。
相关知识点:反应后的产物可用来进行检验.⑤碳在氧气中不充分燃烧:2C+O26.非金属氧化物 + 活泼金属 == 非金属+金属氧化物①金属钠与水反应:2Na+2H2O== ,现象:浮(钠块浮在水面上)、游(钠块在水面上无规则游动)、熔(钠块熔化为小球)、响(发出嘶嘶的响声)、红(使滴入酚酞试液的溶液变红)②金属镁与CO2反应:2Mg+CO22MgO+C 现象:发出白光,有白色粉末(MgO)生成,有黑色固体(C)生成,同时放出大量的热。
置换反应归纳

中学化学中的置换反应归纳置换反应类型在解答无机框图推断试题过程中具有其特殊的功用,以其特殊的形式往往成为解题的突破口。
但由于学生在学习过程中,不善于积累,缺乏总结,置换反应的实例在头脑中没贮存多少,因而对这类试题总是感到束手无策。
现将置换反应的实例类型归纳如下。
一、按元素的性质划分,金属与非金属单质间的置换。
1、金属置单质换金属单质2Al+Fe2O3Al2O3+2Fe (铝热反应。
Al还可与V2O5、CrO3、WO3、MnO2FeSO4+Cu等发生置换) Fe+CuSO2、金属单质置换非金属单质O 2NaOH+H22Mg+CO22MgO+C2Na+2H3Fe+4H2O(g)Fe3O4+4H23、非金属单质置换金属单质H2+CuO Cu+H2O C+FeO Fe+CO Si+2FeO Fe+SiO24、非金属单质置换非金属单质2F 2+2H2O4HF+O22C+SiO2Si+2COC+H2O CO+H2二、按元素在周期表的位置划分,同族元素单质间的置换与不同族元素单质间的置换。
1、同主族元素单质间的置换Na+KCl NaCl+K 2Na+2H 2O2NaOH+H22H2S+O22S+2H2O 2C+SiO2Si+2CO+2HI2HCl+I2F2+2HCl2HF+Cl2Cl2、不同主族元素单质间的置换Mg+2HCl MgCl 2+H22Mg+CO22MgO+C2Al+6HCl2AlCl 3+3H22F2+2H2O4HF+O2C+H2O CO+H22H2+SiCl4Si+4HClS+Cl2S+2HCl 3Cl2+8NH36NH4Cl+N2H4NH3+3O22N2+6H2O3、主族元素单质置换副族元素的单质H2+CuO Cu+H2O 2Al+Fe2O3Al2O3+2FeC+CuO Cu+CO 2Al+3Hg2+2Al3++3HgNa+TiCl44NaCl+Ti4、副族元素的单质置换主族元素单质O(g)Fe3O4+4H2Zn+2H+Zn2++H23Fe+4H5、副族元素的单质置换副族元素的单质FeSO4+CuFe+CuSO三、按物质类别划分,单质与氧化物间的置换和单质与非氧化物间的置换。
初中化学27.初高中化学衔接——物质间的相互转化

初高中化学衔接——物质间的相互转化初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为: 两条纵线通到底(七条规律)(1)~(7) 四条横线相联系(四条规律)(8)~(11) 六条交叉成网络(六条规律)(12)~(17) 17条规律须牢记 反应规律 示例纵向:(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ CuO O Cu 222∆+(2)碱性氧化物(可溶)+水→碱(可溶)NaOH O H O Na 222=+(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水∆==2)(OH Cu O H CuO 2+(4)酸+碱→盐+水O H PO Na PO H NaOH 2434333+=+O H CuSO SO H OH Cu 244222)(+=+(5)非金属+−−→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+(6)酸性氧化物(易溶)+水→酸(易溶)3222CO H O H CO =+ 4325223PO H O H O P =+(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)↑+=2232CO O H CO H 2232SiO O H SiO H +∆从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属+非金属→(无氧酸)盐NaCl Cl Na 222点燃+(9)碱氧+酸氧→(含氧酸)盐32CaSiO SiO CaO 高温+(10)含氧酸盐→碱氧+酸氧↑+23CO CaO CaCO 高温(11)盐+盐→两种新盐↓+=+AgCl NaNO AgNO NaCl 33交叉:(12)酸+碱氧→盐+水O H CuSO CuO SO H 2442+=+(13)碱+酸氧→盐+水O H CO Na CO NaOH 23222+=+(14)酸+盐→新酸+新盐32423242CO H SO Na CO Na SO H +=+↑+=2232CO O H CO H (15)碱+盐→新碱+新盐↓+=+2424)(2OH Cu SO Na CuSO NaOH(16)金属+酸→盐+↑2H↑+=+2442)(H ZnSO SO H Zn 稀(17)金属+盐→新盐+新金属44ZnSO Cu CuSO Zn +=+以上十七条规律的应用: (1)可知某物质的性质。
3物质相互转化

三、物质间的相互转化班级姓名初中化学所涉及的元素化合物知识主要包括以O2、H2、C、S、P等为代表的非金属单质,以Fe为代表的金属单质,以CO、CO2等为代表的非金属氧化物,以Fe2O3、CuO等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)(1)金属+O2点燃/△—————→金属氧化物(碱性氧化物)4Na+ O2=2Na2O、(2)碱性氧化物(可溶)+水→碱(可溶)Na2O+H2O=2NaOH、(3)碱(难溶)高温/△—————→碱氧(难溶)+ 水Cu(OH)2===△2CuO、(4)酸+碱→盐+水3NaOH+H3PO4=Na3PO4+3H2O、(5)非金属+ O2点燃—————→非金属氧化物(酸性氧化物)C+O2点燃——CO2、(6)酸性氧化物(易溶)+水→酸(易溶)CO 2 +H 2O=H 2CO 3 、(7)酸(易挥发 / 难溶)→酸酐+水(易挥发 / 难溶)H 2CO 3 = CO 2↑+H 2O 、(8)金属+非金属→(无氧酸)盐2Na+Cl 2点燃————2NaCl 、(9)碱性氧化物+酸性氧化物→(含氧酸)盐Na 2O+CO 2=Na 2CO 3、(10)含氧酸盐→碱性氧化物+酸性氧化物CaCO 3===△CaO+ CO 2↑、(11)盐+盐两种新盐NaCl+AgNO 3=NaNO 3+AgCl↓ 、交叉:(12)酸+碱性氧化物→盐+水 H 2SO 4+CuO=CuSO 4+H 2O(13)碱+酸性氧化物→盐+水 2NaOH+CO 2=Na 2CO 3+H 2O(14)酸+盐→新酸+新盐 Na 2CO 3+ H 2SO 4= Na 2SO 4 +CO 2↑+H 2O(15)碱+盐新碱+新盐 2NaOH+ CuSO 4= Na 2SO 4+Cu(OH)2↓(16)金属+酸→盐+H 2↑ Zn+H 2SO 4=ZnSO 4+H 2↑(17)金属+盐新盐+新金属 Zn+H 2SO 4=ZnSO 4+H 2↑ Zn+CuSO 4=ZnSO 4+Cu总结:物质是可以相互 ,转化往往是有 。
