药物及其制剂粒度测定法探讨_陈祝康
药品粒度和粒度分布测定法

药品粒度和粒度分布测定法一目的:制定粒度和粒度分布测定法,规范粒度和粒度分布的测定操作。
二适用范围:适用于粒度和粒度分布的测定。
三责任者:品控部。
四正文本法用于测定原料药和药物制剂的粒子大小或粒度分布。
其中第一法、第二法用于测定药物制剂的粒子大小或限度,第三法用于测定原料药或药物制剂的粒度分布。
第一法(显微镜法)本法中的粒度,系以显微镜下观察到的长度表示。
目镜测微尺的标定用以确定使用同一显微镜及特定倍数的物镜、目镜和镜筒长度时,目镜测微尺上每一格所代表的长度。
将镜台测微尺置于显微镜台上,对光调焦,并移动测微尺于视野中央;取下目镜,旋下接目镜的目镜盖,将目镜测微尺放入目镜筒中部的光栏上(正面向上),旋上目镜后反置镜筒上。
此时在视野中可同时观察到镜台测微尺的像及目镜成测微尺的分度小格,移动镜台测微尺和旋转目镜,使两种量尺的刻度平行,并令左边的“0”刻度重合;寻找第二条重合刻度,记录两条刻度的读数,并根据比值计算出目镜测微尺每小格在该物镜条件下所相当的长度(um)。
由于镜台测微尺每格相当于10um,故目镜测微尺每1小格的长度为:10×相重区间镜台测微尺的格数相重区间目镜测微尺的格数当测定时要使用不同的放大倍数时,应分别标定。
测定法取供试品,用力振匀,黏度较大者可按品种项下的规定加适量甘油溶液(1→2)稀释,照该剂型或品种项下的规定,量取供试品,置载玻片上,覆以盖玻片,轻压使颗粒分布均匀,注意防止气泡混入,半固体可直接涂在载玻片上,立即在50~100倍显微镜下检视盖玻片全部视野,应无凝聚现象,并不得检出该剂型或品种项下规定的50um及以上的粒子。
再在200~500倍的显微镜下检视该剂型或品种项下规定的视野内的总粒数及规定大小的粒数,并计算其所占比例(%)。
第二法(筛分法)1、单筛分法称取各品种项下规定的供试品,置规定号的药筛内,筛上加盖并在筛下配有密合的接受容器。
按水平方向旋转振摇至少3分钟,并不时在垂直方向轻叩筛。
高效液相色谱法对坎地沙坦酯固体分散体颗粒溶出度的测定

高效液相色谱法对坎地沙坦酯固体分散体颗粒溶出度的测定目的建立用于测定坎地沙坦酯固体分散体颗粒溶出度的高效液相测定方法。
方法采用《中国药典》2010年版二部溶出度测定法二法,以乙腈-水-冰醋酸(57∶43∶1)为流动相,流速为1 mL/min,检测波长为254 nm,测定溶出液的浓度。
结果所得溶液线性范围为0.42~67.20 mg/L(A = 29.436 3C+31.424 4,r = 0.999 8),平均回收率99.7%(RSD = 0.3%)。
结论本方法准确可靠,可用于坎地沙坦酯速释、缓释颗粒及片剂的溶出度测定。
标签:坎地沙坦酯;高效液相色谱法;溶出度;固体分散体;颗粒坎地沙坦酯(Candesartan Cilexetil,CC)是一种前体药,在胃肠道吸收后代谢成活性物质坎地沙坦。
坎地沙坦是一种选择性血管紧张素Ⅱ受体1(AT1)阻断剂,通过与AT1受体的特异性结合来阻断AT1收缩血管和促进醛固酮释放的效应,可松弛血管平滑肌,增加盐排泄,降低血压而不改变心率或心输出[1-2],对各种程度的肾功能不全及轻中度肝功能受损患者的药物代谢无明显改变[3-4]。
CC在水中溶解度极低,为82.57 mg/L[5],制剂的溶出度为药物吸收的重要因素。
现行的《中国药典》2010年版尚未收载CC原料药及制剂的质量标准。
企业使用的标准中用分光光度法测溶出度量,因CC使用剂量小,采用《中国药典》2010年版一法和二法测量时,样品溶液的吸光度较低,往往达不到标曲中的线性范围,影响了测试的准确性;在研制CC速释和缓释固体分散体时需用溶出度作为指标加以考察,试液浓度范围变化大,分光光度法也不能完全胜任。
本课题在分析研究文献的基础上[6-10],通过色谱条件确定、专属性试验、线性试验、精密度、稳定性、回收率试验、溶出度测定等,以建立用HPLC测定CC固体分散体颗粒溶出度的方法。
1 仪器与试药高效液相色谱仪(安捷伦Agilent-1220);色譜工作站(安捷伦ChemStation for LC systems);溶出度仪(RC-8D,天津光学仪器厂);紫外分光光度计(UV-1801,北京瑞利分析仪器有限公司)。
药物固有溶出测定法、影响因素、溶出介质的选择总结:圆盘法、颗粒法

药物固有溶出测定法、影响因素、溶出介质的选择总结:圆盘法、颗粒法药物的固有溶出(apparent intrinsic dissolution)是指一定量的药物(一般指原料药)在一定介质中,单位面积和单位时间内药物溶出的质量。
通常表示为固有溶出速率(intrinsic dissolution rate,IDR),其值以mg·cm-2·min-1表示。
药物的固有溶出不同于溶出度。
固有溶出是药物理化性质的重要参数之一,是药物固有的特性;而溶出度是指药物在规定介质中从药物制剂溶出的速度和程度,受到制剂辅料、制剂类型、工艺、纯度、介质等因素的影响,不能反映药物自身的特性。
同时,固有溶出也不同于溶解度。
固有溶出反映的是药物溶解的速度和程度,与体内溶出动力学密切相关;而溶解度只能反映化合物的溶解程度。
固有溶出可以在一定程度上反映药物的纯度,也可以用于评价原料药不同来源、批次间、不同结晶条件或不同晶型的一致性,还可用于考察药物不同盐基、晶型、粒度、表面活性剂、pH值等因素对溶出的影响,在一定程度上预测药物制剂的溶出行为,从而预测药物的生物利用度和疗效。
因此,药物的固有溶出速率可以为原料药质量评价、生产工艺的筛选提供数据支撑,为药物剂型的选择和处方的设计提供指导意见。
药物固有溶出的测定方法主要有2种:圆盘法和颗粒法。
圆盘法是将一定量的药物压制成薄片,放入溶出介质中,测定单位面积和单位时间内药物溶出的质量。
根据圆盘放置位置又可以分为转盘法和定盘法。
由于圆盘法测定结果比较稳定,使用范围比较广,所以被多国药典所收载。
颗粒法是将一定粒径的药物原料颗粒放置在溶出介质中,测定单位时间内药物溶出的质量。
根据溶出介质是否含有助悬稳定剂,颗粒法又分为粗颗粒法和悬浮粒子法。
本文将重点对转盘法、定盘法、粗颗粒法及悬浮颗粒法的试验方法、影响因素及应用情况进行介绍。
4种固有溶出测定装置示意图如图1所示。
圆盘法圆盘法是采用适宜的装置将药物压成直径固定的非崩解薄片,将药物薄片及载药模具一起放入一定量的溶出介质中,调整模具及搅拌桨的位置,在一定的转速下、特定的时间点取样分析。
粒度检测方法研究及其在口服吸入制剂研发中的应用分析

粒度检测方法研究及其在口服吸入制剂研发中的应用分析摘要:医药行业的快速发展,使得相关法律法规逐渐对医药检测的要求越来越高,针对药品的原料、辅料以及粉体性质的重视,尤其是在吸入制剂领域,粒度的检测对药品质量和性能都有着重要的意义,基于此,本文就医药粒度检测方法进行研究分析,实现对粒度检测在口服吸入制剂中的应用进行深入分析。
关键词:粒度检测;口服吸入制剂;分析引言:大部分药品在研发过程中,其原材料以及辅料都是以粉末的状态形式存在,而粉末是由尺寸不一的颗粒群体组成,这些颗粒的额质量、粒子形状、分子间作用力等都会影响到粉体质量的性质,这对粉末的粒度进行分布,能够有效提高医药产品的质量,从而确保医药产品实现对人类健康的有效保护。
1.粒度检测方法1.1筛分法在粒度检测方法中,筛分法相比于其他检测方法而言,是一种较为传统的粒度检测方法,根据药品颗粒度的大小不同,借助筛分法实现对这些药品粒度的有效测试。
由于筛分法是一种直观、分级粗糙的方式,因此适用于大颗粒的药品检测,而对于颗粒度更细的药品,这种方法并不适用,这是因为会受到不同因素的影响,如人为因素、筛孔变形等因素[1]。
而筛分法又可以分为干筛和湿筛两种不同的方式,所以筛分法通常使用单个筛子控制单一的粒径颗率,能够实现对多个筛子的叠加检测,最终检测出药品质量。
1.2沉降法根据药品颗粒在液体中的沉降速度进行检测,被称为沉降法,这种检测方法一般需要将药品的样本放置在液体并制成具有一定浓度的悬浮液,随后在重力或者离心力的作用下实现沉降。
由于在液体中,大颗粒的沉降速度比较快,而小颗粒的沉降速度相对比较慢,但在实际颗粒度的测量中,液体中的颗粒度数量比较多,如果想要对每一个颗粒度的沉降进行检测,那是不现实的,因此在沉降法中,通常使用悬浮液的光强方式进行检测,并随着施加的变化反映颗粒的沉降速度。
因此在粒度检测的沉降法中,需要做到精确测量,但随着测量时间变长,最终的测量结果会受到人为操作因素的影响。
【技术】粒度测试方法多,究竟哪个最准确?

【技术】粒度测试方法多,究竟哪个最准确?测试颗粒粒径的技术和方法主要有筛分法、沉降法、显微镜法、光散射法、电阻法(库尔特计数法)、比表面积法、超声波衰减法等。
测试颗粒粒径的技术和方法主要有筛分法、沉降法、显微镜法、光散射法、电阻法(库尔特计数法)、比表面积法、超声波衰减法等。
在众多的测试方法中,除显微镜法属于直接测量颗粒的绝对几何尺寸外,其余方法测得的粒径都不是绝对的几何概念的尺寸,而是所谓的“等效粒径”。
本文通过对多种粒度测试方法,如显微镜法、沉降法、电阻法、激光衍射法和比表面积法进行对比试验,研究所得结果的异同并分析其原因,为工程应用寻找出利用现有粒度测试技术更真实更准确地反映颗粒粒度及其分布的方法。
1粒度测试方法1.1 显微镜图像法显微镜图像法能同时观察颗粒的形貌及直观地对颗粒的几何尺寸进行测量,经常被用来作为对其他测量方法的一种校验或标定。
该类仪器由显微镜、CCD 摄像头(或数码相机)、图形采集卡、计算机(图像分析仪)等部分组成。
它的工作原理是由CCD 摄像头将显微镜的放大图形传输到计算机中,再通过专用分析软件对图像进行处理和计算,得出颗粒的粒径和粒径分布。
该方法减少了人为观测误差,提高了测试速度,但它的制样要求高、操作复杂且设备昂贵。
显微镜图像法的测量结果主要表征颗粒的二维尺寸(长度和宽度),而无法表征其高度。
1.2 沉降法沉降法是基于颗粒在液体中的沉降符合斯托克斯定律这一原则,根据颗粒在液体中的最终沉降速度来计算颗粒的粒径。
在实际操作中,由于测试颗粒的最终沉降速度存在较大困难,因此,所有沉降仪都是测量与最终沉降速度相关的其它物理参数,如压力、密度、重量、浓度或光透过率等,进而求得颗粒的粒径分布。
沉降法又分为重力沉降和离心沉降两种,重力沉降的测试范围通常为0.5 ~100μm ,离心沉降可测量的粒径范围为0.05 ~5μm 。
目前,沉降式颗粒仪一般都采用重力沉降和离心沉降相结合的方式。
【精品文章】激光粒度测定法在药物研制和质量把控中的应用与思考

激光粒度测定法在药物研制和质量把控中的应用与
思考
颗粒是组成粉体的基本单元,颗粒的大小称为粒度。
大多数原料药和部分药物制剂呈粉状或颗粒状。
对于难溶性药物口服固体制剂,粒度与药物的吸收可能存在一定的关系:
(1)从临床疗效讲,减小粒度有可能对生物利用度产生积极的作用; (2)从安全角度讲,粒度范围未得到合理控制则可能出现批次间体内溶出度和吸收度的不一致,血药浓度曲线峰谷波动大,可能出现不安全问题或导致不良反应的增加。
已上市的甲苯磺酸索拉非尼片、左炔诺孕酮片等,为了获得良好的生物利用度,研发厂家均对原料进行了微粉化处理。
对于注射用乳剂、脂质体等,药物通过输注进入血液循环系统,药物粒度大小、粒度分布的均一性和稳定性等因素也将大大影响药物的安全性和有效性。
因此,药物的粒度控制对药物的有效性、稳定性及安全性都具有重要影响。
甲苯磺酸索拉非尼片与其粉体
关于药物粒度的控制方法,各国药典均有详细的控制手段。
常见的分析方法有沉降法、显微镜法、激光粒度测量、库尔特全自动颗粒粒径分析、电感应法等。
目前,作为原料药和制剂粒度控制检测手段,激光粒度分析法呈现快速发展的趋势。
常见粒度测定方法优缺点汇总
一、激光粒度测定方法的原理及使用。
药物及其制剂粒度测定法上海药检所amp中国药典委员会济南

3.光散射法
3.4 适用范围
• 湿法测定适用于水中不溶或难溶的原料药物以及混悬剂等; • 干法
可 • 颗粒必须能被气流所悬浮 • 材料不粘或潮 • 颗粒不会被气流或碰撞所粉碎
不可 • 颗粒太重而不用下落样品池 • 易碎,特别是有机颗粒 • 样品太少与贵重
2020/8/11 • 材料不安全(有毒或爆炸性)
2020/8/11
3.光散射法
3.1 概述 3.2 仪器设备
样品颗粒
颗粒的光散射
散射光的强度分布
激光束 激光
2020/8/11 样品池
富利艾镜
探测器
3.光散射法
3.3 样品测试 • 湿法测定 a)分散介质的选择;
①液体与颗粒无反应;b)分散剂及其浓度的选择;
②③④醇样激信可超间压方号采法颗液液水品光声的力• , 取 为粒 体 体 溶 颗 功 处 表 ,干干不要的与在在与液粒率理面保法同法求帮湿液 激 颗 、 因 较 、 张 证测粒测样 助 法体 光 粒 乙 有 强 机 力 样定径定品 分 的中 波 的 醇 较 的 械 ; 品需的颗 散 测无 长 折 、 强 仪 搅 颗(在样c粒 的 量溶 下 射 乙 的 器 拌 粒)一品添浓外结解应率醇光(等被定cd对加))度力果,是不和散通;完的外稳浓离更有相也可同丙射常全(加加定度b子低:比不透。三性为分)料机体要使化。。会过常醇,散5(速械系求ma合用使用混浓但(W)度力的稍不物)使表颗的合度未下及保有吸,用,面粒分液可被选其持区收在机因活膨 散 等 略 粉择强。别颗)械有性胀 介 。 低 碎的适度,粒方较剂; 质 于 。;宜的较表法强,有 大 通的选小面处的降水 颗 常空择粒形理散低、 粒 的气;径成,射固丙 。 验分的双如光/三 证液散
左旋多巴原料药粒度分析方法的研究

ZH ANG e— on , A NG e~ ng M ir g W W iho
( . c o l fP ama e t a i c s S a d n ie s y J n n 2 0 1 ;. h n o g Xih a P a ma e t a C , L d , io 2 5 0 ) 1S h o h r c u i l e e , h n o g Unv ri ,i a 5 0 2 2 S a d n n u h r c u i l o , t . Z b 5 0 5 o c S n c t c
.
北 京 : 文 出版 社 , 晓丽 , 明 月 , 4裴 刘 张小 山 , . L 等 HP C测 定 雷 贝拉 唑钠 原 料 的 含 量 及 有关 物 质 [] J。中国 药 学杂 志 ,0 43 ()6 1 2 0 ,9 8 :3 .
经 破 坏 性 试 验结 果 表 明 , 样 品 在碱 性 环 境 条 件 下 相 对 该
稳 定 , 高温 、 对 高湿 、 、 照 、 化均 不 稳 定 。但 在 所 选 定 的 酸 光 氧
左 旋 多 巴原料 药粒 度分 析方 法 的研 究
张 美 荣“ , 唯 红 。王
( .山 东大 学 药 学 院 , 东 济 南 2 0 1 ; .山 东新 华 制 药 股份 有 限公 司 , 东 淄博 2 5 0 ) 1 山 502 2 山 5 0 5
片 的含 量 和 有 关 物 质 , 属 性 好 、 敏 度 高 、 收 率 高 、 作 专 灵 回 操
3 讨 论
方 法 简 便 、 确 , 用 于雷 贝拉 唑 钠 肠溶 片的 质量 控 制 。 准 适
参 考 文 献
在 建 立 色谱 条 件 时 , 考 有 关 文 献 先 采 用 2 2 m 波 长 、 参 9n 以 乙腈 一水 一三 乙 胺 ( O: 0: . ) 磷 酸 调 p . ) 流 动 3 7 05( H7 O 为 相 、 温 为 2  ̄ 行 测 定 , 贝 拉 唑 钠 的 峰 形 不 好 , 定 有 柱 0 C进 雷 测
药物及其制剂粒度测定法上海药检所amp中国药典委员会济南

3.光散射法
3.4 适用范围
• 湿法测定适用于水中不溶或难溶的原料药物以及混悬剂等; • 干法 可 • 颗粒必须能被气流所悬浮 • 材料不粘或潮 • 颗粒不会被气流或碰撞所粉碎 不可 • 颗粒太重而不用下落样品池 • 易碎,特别是有机颗粒 • 样品太少与贵重 • 材料不安全(有毒或爆炸性)
3.光散射法
前言
常用粒度测定方法
主要方法
显微镜法 筛分法 光学法 电阻法
介绍内容
1. 概述 2. 仪器设备
3. 样品测试
4. 注意事项
5. 适用范围
6. 书写格式
1.显微镜法
1.1 概述
1.2 仪器设备
光学显微镜 透射电子显微镜 扫描电子显微镜 颗粒图像处理仪
1.显微镜法
1.3 样品测试
合适的样片介质 试样具有代表性
药物及其制剂粒度测定法
陈祝康1 陈桂良1 李慧义2* (1 上海市食品药品检验所;2 国家药典委员会)
报告内容
1 1
前言 前言 前言 常用粒度测定方法 常用粒度测定方法 粒度研究的注意事项 粒度研究的注意事项 粒度研究的注意事项 粒度标准物质
2 2
3 3
4 4
前言
中国药典2010年版二 部附录制剂通则
3.光散射法
3.1 概述
3.2 仪器设备
样品颗粒 颗粒的光散射 散射光的强度分布
激光束 激光
样品池
富利艾镜
探测器
3.光散射法
3.3 样品测试 a)分散介质的选择; • 湿法测定
b)分散剂及其浓度的选择; ①液体与颗粒无反应; 不同粒径的样品对浓度要求稍有区别,较小粒径的 c)外加机械力及其强度的选择; ②颗粒在液体中无溶解,也不会使颗粒膨胀; • 干法测定 样品颗粒因有较强的光散射性,浓度可略低于大颗粒。 d)稳定体系的保持。 可采取的帮助分散的外力有: (a) 使用机械方法处理,如 ③液体在激光波长下应是可透过 ( 不吸收 )的; 干法测定需在一定的加料速度下选择适宜的空气分散 超声处理、机械搅拌等; (b)使用表面活性剂,降低固 /液 激光功率较强的仪器(通常为 5mW),因有较强的散射光 ④液体与颗粒的折射率不同。常用的分散介质有水、丙三 压力,保证样品颗粒被完全分散但未被粉碎。通常的验证 信号,要求样品颗粒浓度更低。 间的表面张力; (c)添加离子化合物,在颗粒表面形成双 方法为与湿法的测量结果相比。 醇水溶液、乙醇、乙醇和丙三醇混合液等。 电子层; (d)改变分散体系的pH值,使颗粒表面带有适量 制备的样品分散体系的浓度既要满足仪器检测灵敏度的要 ⑤很多样品还需要加入分散剂。常用的分散剂有六偏磷酸 在理想的情况下,二者结果应该是一样的,检查分散 求,又要保证粒子以单个原始态存在,未发生团聚。 电荷,当排斥力大于吸引力 (范德华引力) 时,颗粒会互 钠、焦磷酸钠、氨水、水玻璃、氯化钠等。 或粉碎的程度也可在改变分散能量如空气压力的同时观察 相排斥而形成稳定的分散体系。 粒度分布的变化。
小容量注射液和注射用无菌粉末中不溶性微粒的测定方法研究

小容量注射液和注射用无菌粉末中不溶性微粒的测定方法研究陈祝康;彭兴盛;陈桂良
【期刊名称】《药学实践杂志》
【年(卷),期】2004(22)2
【摘要】目的:研究用光阻法对小容量注射液和注射用无菌粉末中的不溶性微粒的测定方法.方法:分别采用全体积取样法、合并内容物直接测定法以及用适当溶剂稀释后测定法,测定每个容器中≥10μm和≥25μm的微粒数.结果:不同测定方法结果存在差异,不同仪器测定结果略有差异,大多数测试样品能符合规定,即每瓶含
≥10μm的微粒数不超过6 000个,含≥25μm的微粒数不超过600个.结论:制定不溶性微粒检查的品种,应在该品种项下具体指出测定方法.小容量注射液可根据样品性质分别采用合并直接测定法或用适宜溶剂稀释后测定法,注射用无菌粉末可根据样品溶解度选用合适溶剂溶解稀释后测定.
【总页数】4页(P88-91)
【作者】陈祝康;彭兴盛;陈桂良
【作者单位】上海市药品检验所,上海,200233;上海市药品检验所,上海,200233;上海市药品检验所,上海,200233
【正文语种】中文
【中图分类】R94
【相关文献】
1.ZWF-J6激光注射液微粒分析仪测定注射液中不溶性微粒含量 [J], 裴艳萍;钱桂华;于小红
2.小容量注射液不溶性微粒检查取样方法的考察 [J], 王晖;徐腾
3.小容量注射液不溶性微粒检查方法探讨 [J], 陈芸生;杨晶晶
4.超声处理对光阻法测定注射液中不溶性微粒的影响 [J], 嵇扬;狄亚敏;郭琪
5.注射用双黄连与葡萄糖注射液配伍后不溶性微粒变化的考察 [J], 谢本树;廖建宁;赵凤山;金圣智;邱寿宁
因版权原因,仅展示原文概要,查看原文内容请购买。
药物制剂粒度的控制与评价研究

药物制剂粒度的控制与评价研究药物制剂粒度的控制与评价研究摘要:药物制剂粒度的控制与评价是药物研发过程中的重要环节,直接影响药物的稳定性、溶解度和生物利用度。
本文从粒度的定义、控制与评价方法等方面进行综述,探讨了药物制剂粒度控制与评价研究的现状和未来发展方向。
关键词:药物制剂、粒度、控制、评价、溶解度1. 引言药物制剂粒度是指药物颗粒的大小分布,是药物形态学特征之一。
粒度的控制与评价是药物研发过程中的关键环节之一,对于药物的质量、疗效和药物制剂的稳定性有着重要影响。
因此,深入研究药物制剂粒度的控制与评价是非常有意义的。
2. 研究目的本文的研究目的是对药物制剂粒度的控制与评价进行综述,总结目前的研究现状,并展望未来的发展方向,为药物研发提供参考和指导。
3. 粒度的定义粒度是指药物颗粒的大小分布,可以用粒径来表示。
粒径一般用平均体积粒径或者平均表面粒径来表示。
药物制剂的粒径很大程度上决定了其药物的溶解速率、生物利用度和稳定性。
4. 粒度的控制粒度的控制是指通过调整药物制剂的制备工艺和添加助剂等手段,控制药物的颗粒大小和分布。
常用的粒度控制方法包括机械法、成核法、湿法和干法等。
4.1 机械法机械法是指通过机械力对药物进行研磨、粉碎和研磨,以缩小药物的颗粒大小。
常用的机械法包括球磨法、超声波法和喷雾干燥法等。
4.2 成核法成核法是指通过加入助剂或者改变溶剂系细,调整药物的溶剂-抑制剂比,以控制药物的颗粒大小。
常用的成核法包括溶剂晶体云点法、凝胶法和溶剂再结晶法等。
4.3 湿法湿法是指通过加入溶剂和乳化剂等,调整药物的颗粒形态和分布。
常用的湿法包括溶液结晶法、凝胶法和乳化剂法等。
4.4 干法干法是指通过蒸发溶剂或者超临界流体等,使药物从溶液或者胶体状态转变为固体粒子。
常用的干法包括干燥法、喷雾法和冷冻干燥法等。
5. 粒度的评价方法粒度的评价是指通过一定的方法和手段,对药物制剂的粒度进行测量和分析,以获得粒度分布和平均粒径等参数。
浅谈中药注射剂的不溶性微粒监测

浅谈中药注射剂的不溶性微粒监测摘要】目的测定中药注射剂在输液中的不溶性微粒。
方法采用2005年版《中国药典》规定的不溶性微粒检查法—光阻法。
结果 5种中药注射剂均含不同粒径和不同数量的不溶性微粒。
结论加强中药静脉注射刘的质量控制,并密切注意监控。
【关键词】中药注射剂不溶性微粒随着西药的不良反应日益增多,医疗纠纷也层出不穷,中药注射剂也开始愈受人们喜爱,尤其是静脉输液充分发挥中药多靶点使用的特点[1],且药效迅速,生物利用度高,副作用较小,成为人们的最理想选择。
然而,中药注射剂中的不溶性微粒给人体带来的危害亦应引起重视。
据文献报道,中药静脉注射中的不溶性微粒可造成局部血管堵塞和供血不足,更为甚者可产生水肿,静脉,肉芽肿从而引起过敏反应和热原反应[2]。
2005年版《中国药典》[3]要求对注射剂不溶性微粒进行检查,故笔者在此对5种中药注射剂与输液进行临床配伍后的不溶性微粒进行监测,现将监测结果报告如下。
1 材料1.1 仪器GWJ-5E型注射液微粒分解仪天津天大天发科技有限公司净化工作台苏州净化设备厂2S-515型振荡筛常州市华星干燥厂PH-3C酸度计上海雷磁仪器厂1.2、试药0.9%氯化钠注射液(湖南金健药业批号 080208)5%葡萄糖注射液(湖南金健药业批号 080608)10%葡萄糖注射液(湖南金健药业批号 080706)灯盏花针(山西银湖制药批号 07102402)丹参注射液(福建三爱批号 080301)双黄连注射液(黑龙江多多批号 080603312)刺王加注射液(黑龙江多多批号 071114211)参麦注射液(四川川大批号 080905)2 方法和结果2.1 供试品溶液的制备将上述5种中药注射剂各取10ML,分别加入到250ML的3种输液中即得15种供品。
2.2 空白注射液微粒数测定根据2005年版《中国药典》规定不溶性微数粒检查法—光阻法测定,记录≥2um,≥5um,≥10um,≥25um的微粒数。
粒度及溶化性,外观均匀度

二、颗粒剂
颗粒剂(中国药典2005年版二部附录 ⅠN )系指药物与适宜的辅料制成具 有一定粒度的干燥颗粒状制剂。粉末 状或细粒状称细粒剂。 分为可溶颗粒(通称颗粒)、混悬颗 粒、泡腾颗粒、肠溶颗粒、缓释颗粒 和控释颗粒等,供口服用。
二、颗粒剂
对颗粒剂的质量要求,除应干燥,粒 径均一,外观色泽一致,无吸潮、结 块、潮解等现象,以及药典品种项下 规定的检验项目外;还应检查“粒 度”,“干燥失重”,“装量差异” 或“装量”。
“粒度”检查法 与溶化性检查法
一、 “粒度”检查法简述
粒度系指颗粒的粗细程度及粗细颗粒的分 布,用于测定药物制剂的粒子大小或限度。 中国药典2005 年版二部附录XI E “粒度”测 定法项下有两种不同的测定方法,第一法 为(显微镜法)和第二法为(筛分法); 应根椐药典品种正文或制剂通则的规定, 选用检测方法。
本项检查的目的在于控制散剂在生产 中混合不匀,色泽不一致,以免影响 质量。
“外观均匀度”检查法
仪器与用具:
1、光滑纸
2、
短尺20cm 3、 玻板10cm- 10cm
“外观均匀度”检查法
操作方法:取供试品适量(0.2-0.5g), 置光滑纸上,平铺约5cm2,用玻板将 其表面压平; 将表面压平的供试品移至亮处观察。 结果与判定:
结果与判定
除另有规定外,照粒度测定法〔附录Ⅸ E 第二法(2)〕检查,不能通过一号筛(2000μm) 与能通过五号筛(180μm)的总和不得超过供 试量的15%。 细粒剂的粒度:不能通过五号筛(180μm)与 能通过九号筛(75μm)的总和不得超过供试量 的10.0%。 判为符合规定。
坎地沙坦酯片的溶出度测定

坎地沙坦酯片的溶出度测定谢万清【摘要】目的:建立坎地沙坦酯片的溶出度试验方法.方法:采用C18色谱柱,乙腈-水-醋酸(68∶32∶1)为流动相,检测波长为254nm.结果:坎地沙坦酯在5.0~15.0μg/mL浓度范围内线性关系良好(r=0.9999),片剂的平均回收率为99.4%(RSD 0.8%).【期刊名称】《北方药学》【年(卷),期】2016(013)007【总页数】2页(P17,128)【关键词】坎地沙坦酯;溶出度;高效液相色谱法【作者】谢万清【作者单位】海南美兰史克制药有限公司海口570216【正文语种】中文【中图分类】R927.1坎地沙坦酯(Candesartan Cilexetil)是一种血管紧张素II受体(AT)拮抗剂(ARBs),是继血管紧张素转化酶抑制剂(ACEI)后又一类新型降压药。
该药可阻滞产生于血管紧张素II(AngII)的有害作用,适应症包括充血性心力衰竭(CHF)、动脉粥样硬化(AS)、心肌梗死、左心室肥厚(LVH)、糖尿病肾病、代谢综合征以及ACEI引起咳嗽的高血压。
坎地沙坦酯在水中不溶,在强酸、强碱条件下发生酯水解,故制剂的溶出度成为药物吸收、发挥疗效的限制因素。
本文对坎地沙坦酯片的溶出度从各方面进行考察并验证,建立准确的溶出度测定方法,保证其用药安全有效。
RCZ-8型药物溶出度仪(黄海药检仪器有限公司);LC-20AT型高效液相色谱仪(岛津公司)。
坎地沙坦酯工作对照品(批号:D2*******,含量99.69%);坎地沙坦酯片(商品名:必洛斯,规格8mg,批号:020A)由天津武田药品有限公司提供;坎地沙坦酯片(规格8mg,批号:20101004、20101005、20101006)由海南美兰史克制药有限公司提供。
2.1色谱条件:参考坎地沙坦酯片JX20000248质量标准中的溶出度测定条件:色谱柱C18(4.6mm×150mm,5μm),乙腈-水-醋酸(68∶32∶1),流速:1mL/min,检测波长254nm,理论板数按坎地沙坦酯峰计算不低于3000。
浅析激光散射法测定盐酸坦洛新原料药粒度

浅析激光散射法测定盐酸坦洛新原料药粒度摘要以光散射法进行盐酸坦洛新原料药的粒度分析并进行方法学考察。
采用Malvern2000激光粒度仪以及SCIROCCO2000(A)干法进样器进行人员比对和微调仪器设备测试条件振动速率和分散气压实验。
以参数D(0.1)、D(0.5)和D(0.9)表示其粒度分布特征[1],考察此方法的精密度和耐用性。
结果表明,此方法准确、简便、重复性好,适用于盐酸坦洛新原料药的粒度分析。
关键词激光粒度分析仪;干法;粒度分布;盐酸坦洛新原料药引言盐酸坦洛新在医药行业中可用于临床治疗良性前列腺增生和前列腺肥大引起的排尿障碍[2]。
在《中国药典》粒度和粒度分布测定方法中表明,药物的颗粒度对于药物的质量有着直接的影响,颗粒度对药物的溶出性能也起着决定作用。
溶出性对体内吸收影响较大,不同批次药物的粒度有差异,可能导致溶出的不一致,进而可能造成在体内吸收不一致,对药性及安全性都有直接的影响[3]。
目前测试颗粒粒度的方法有多种,例如筛分法、镜检法、激光散射法等,找到合适的检测方法才能真实的表征粒度结果。
传统的激光散射测试方法可分为干法和湿法两种[4]。
干法使用干燥洁净气体(一般为空气或氮气)作为分散介质,利用紊流分散原理,能够使样品颗粒得到充分分散,被分散的样品再导入光路系统中进行测试。
湿法则是把样品直接加入到液体(水或者乙醇等)分散介质中进行分散,然后再经过光路系统,计算出粒径分布。
盐酸坦洛新原料藥易溶解于水或乙醇介质,湿法测试过程中使用其他类型介质造价均高且不可重复利用,而干法测试过程中仅需控制气压、振动速率、进样量等即可准确测量出颗粒的粒度分布。
特做此实验找出干法检测中合适的参数设置,进行测定盐酸坦洛新原料药粒度及其粒度分布。
实验部分1 激光粒度仪干法测量构造及原理[5]1.1 主机主要部件是光学校准系统、光源和检测器。
适用粒径范围0.02um-2000um。
1.2 进样系统目的是将样品分散混匀充分并传送到主机,以便于测量。
浅析原料药粒度分析方法开发思路

浅析原料药粒度分析方法开发思路干法测定:系指选用干法进样器及样品池,通常采用密闭测量法,以减少供试品吸潮,并需克服偏流效应,根据供试品分散的难易,调节分散器的气流压力,使不同大小的粒子以同样的速度均匀稳定地通过检测窗口,以得到准确测定结果[1]。
干粉末取样要求:取样是获得良好粒径测定结果的关键,所测量的少量样品必须真实反映大量产品的特征。
对于原料药粒度测定来说,需要指出的是大多数测量误差往往是由于取样不准确导致的,并不是仪器本身存在问题。
对于颗粒粒度范围较宽的样品而言,细颗粒往往通过大颗粒间缝隙沉积在样品底部,最佳的取样方法是使用旋转取样器,将样品颗粒从一个振动储藏箱流入,旋转样品盘中的储样器收集样品。
如果没有旋转取样器,不要简单的直接用勺子从样品容器中取样,因为这样不能解决颗粒分布的问题,而应将样品放入一个带盖的容器中,装满半瓶,将容器盖旋紧,来回转动容器保证颗粒充分混合,再使用勺子从容器的顶部取样。
以上操作均是为了取样尽可能具有代表性,此外,根据不同品种的要求,取样过程中应控制所需温度和湿度。
光学参数要求:颗粒大小和散射光强之间的关系通常用米氏理论阐述,应用米氏理论常需要引入3个光学参数,分别是分散介质的折射率,样品物质的折射率,样品物质的吸收率,干法采用的是气流分散,则无需分散介质折射率。
颗粒折射率要求:通常有三种途径获得样品颗粒的折射率:(1)查找参考文献,手册;(2)使用折射计测量;(3)使用显微镜。
绝大多数原料都可以通过查找资料获得数据,折射率往往对D(10)的测定结果有一定影响,若折射率参数选择的不够准确,必要的情况下可进行考察。
颗粒吸收率要求:可以通过光学显微镜观察样品颗粒的性状,透光率和内部结构获得。
吸收率通常只需要精确到10的倍数即可,例如可以为0.1或0.01,折射率最大值为1,吸收率参数往往对D(90)结果有一定影响,若选择不够准确,必要的情况下可进行考察。
残差:残差可以帮助评估参数拟合的情况,即实际测量结果与理论计算是否一致。
颗粒测定技术及其在药品检验中的应用

动态光散射法:粒子悬浮在 某一溶剂中作布朗运动,一 定波长的激光光线照射到粒 子上,发生雷利散射,粒子 的运动产生多普勒振动,根 据振动光的变化测定粒径分 布。
S ta ti s ti c s G r a p h ( 1 m e a s u r e m e n ts ) 25 Volume (%) 20 15 10 5 0 1 10 100 D i a m e te r ( n m ) 1000 10000
颗粒测定技术及其在 药品检验中的应用
Technology for the measurement of particle size and application in pharmaceutical analysis
上海市食品药品检验所 闻宏亮
粒度及粒度分布测定的意义 药品检验中粒度测定的主要方法 几种药物剂型的粒度控制
Particle Size Distribution
10 Particle Size (μm) 阿奇霉素1, Tuesday, September 27, 2005 3:54:08 PM 阿奇霉素2, Tuesday, September 27, 2005 3:55:51 PM 阿奇霉素3, Tuesday, September 27, 2005 3:57:16 PM
凝胶剂
测定粒度的目的 粒度测定方法 显微镜法 控制限度 混悬型凝胶剂不得检出大于180µm 的粒子
气雾剂
粒度控制的意义 评价气雾剂雾粒大小、分布及其形态特征的方 法
显微镜法 激光全息照相法 激光粒度分析仪测定法 安迪松园盘冲撞器(Andersen cascade impactor)及多级液体 撞击器(Multistage liquid impinger) 飞行时间雾粒测定法(time-of-flight aerosol beam spectrometry, TOFABS)
化橘红粉末饮片颗粒度适宜性研究
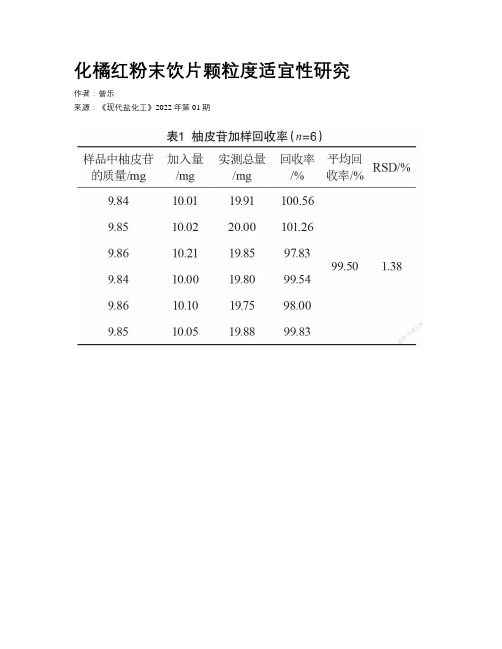
化橘红粉末饮片颗粒度适宜性研究作者:***来源:《现代盐化工》2022年第01期摘要:為了将化橘红原饮片粉碎分级处理,研究粉碎度对质量的影响。
将化橘红饮片粉碎成不同粒径的粉末,分别加相当于饮片质量15倍的水量,设置水浴温度90℃,加热30 min,将化橘红内柚皮苷的溶出度、高效液相色谱图谱及浸出物量作为指标,考察不同粉粹度的影响。
结果发现,2号样品饮片粒径为24~50目时所含有效成分柚皮苷的溶出度最大(平均为48.50 mg/g),是原样品0号(平均为37.77 mg/g)的1.29倍;其次是3号和4号样品,质量分数分别为47.72、47.52 mg/g。
分析总浸出物测定结果发现,9号样品的总浸出物最多,浸膏得率为21.07%;其次是8号样品,浸膏得率为18.85%。
根据上面两项指标可知,化橘红不是粒径越小越好,而是粉碎度在24~50目时最佳。
对化橘红粉末饮片粉碎度进行适宜性研究,为化橘红饮片的实际应用提供借鉴,以期在临床上更好地发挥作用。
关键词:化橘红;柚皮苷;含量测定; HPLC;浸出物化橘红具有理气宽中、燥湿化痰的功效[1-2],主要用于治疗风寒、咳嗽、痰多、胸闷,可健胃[3-4]。
化橘红的成分有黄酮类、多糖[5]、香豆素类等化合物,包括柚皮苷、芳樟醇[6]及野漆树苷等。
药用成分柚皮苷可以改善微血管通透性增强、炎症性白细胞游走等状况,验证了化橘红抗炎的作用。
同时,对棉球肉芽肿也有抑制作用。
但目前对化橘红饮片颗粒度的适宜性研究不多,本研究针对化橘红粉末饮片颗粒度进行适宜性研究,旨在为化橘红饮片的临床应用提供借鉴,使其在临床上发挥更大的疗效。
1 仪器与试药1.1 主要仪器数显鼓风干燥箱(GZX-9070MBE型,上海博迅实业有限公司医疗设备厂)、数控超声波清洗器(KQ-300DB ,昆山市超声仪器有限公司,功率40 Hz)、高效液相色谱仪(Agilent1260,美国Agilent公司)、 Agilent ChemStation工作站以及DAD检测器(Agilent Technologies Co. Ltd.)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国药品标准 2012 年第 13 卷第 6 期 405
谱有一定的影响,但吸收峰强弱变化不大,而盐酸头 孢吡肟原料药与头孢吡肟对照品在结构上一致,因 此建议对该品种红外鉴别项下的规定修订为: 本品 红外光的吸收图谱应与对照品的图谱一致。 3. 2 通过对国内外对照品及样品重结晶前后红外 图谱的比较,发现结晶前后 2 850 cm - 1 ,2 910 cm - 1 波数处吸 收 峰 未 发 生 变 化,因 此 不 存 在 多 晶 现 象。 说明与光谱集对照图谱( 1184 图) 不一致主要原因 并不是由多晶引起的。 参考文献
Drug Standards of China 2012,Vol. 13 No. 6
明显,且在 2 600 ~ 3 200 cm - 1 范围内波形与对照图 谱不一致,见图 1。分析如下: ①由于红外图谱的差 异大多数由多晶现象引起,通过重结晶试验发现图 谱在 2 850 cm - 1 ,2 910 cm - 1 波数处吸收峰仍不明 显,且在 2 600 ~ 3 200 cm - 1 范围内波形没有明显变 化,说明供试品及国内外对照品结构相同,且不存在 多晶现象,见图 2; ②考虑水分的影响,通过不同干 燥条件下试验,发现在约 2 850 cm - 1 ,2 910 cm - 1 波 数处吸收峰有所改变,峰强度虽有所增强,但变化不 大,且在 2 600 ~ 3 200 cm - 1 范围内波形与《药品红 外光谱集》1184 图比较未改变,见图 3。 3 讨论 3. 1 通过试验,虽然水分对盐酸头孢吡肟的红外图
Drug Standards of China 2012,Vol. 13 No. 6
mm /30 再减去筛绳的直径,由于所用筛绳的直径不 同,筛孔大小也不同,因此必须注明筛孔大小 。 1. 2. 3 样品测试 操作步骤详见《中国药典》2010 年版二部附录Ⅸ E 粒度和粒度分布测定法。 1. 2. 4 适用范围 筛分法评估单一药物粉末粒度 分布时,通常适用于至少 80% 的粒子大于 75 μm 的 样品。筛分法的局限在于需要一定量的样品( 通常 至少 25 g,依据粉末或颗粒的密度和试验筛的直径 而定) ,油性和其他粘性粉末或颗粒由于存在堵塞 筛孔的倾向,用筛分法测定存在困难,此外测量小于 400 目( 38 μm) 的干燥粉末非常困难。 1. 2. 5 注意事项 使用筛分法测试时,应在样品不 吸收或丢失水分的条件下进行,应对测试环境的相 对湿度进行控制。筛分法通常是在环境湿度下进行 操作,除另有规定外,一般控制相对湿度在 45% 左 右为佳。对于特殊样品,如果需要在特别的条件下 操作,则应在正文品种中规定条件。采用筛分法测 定时,还应注意: ① 在筛网多次使用后往往发生变 形及阻塞,会造成较大的误差,所以在使用后必须小 心清洗并定时重新校准筛孔大小,理想的清洗药筛 的方法是采用空气流或水流; ② 样品应混合均匀, 取样量取决于筛网的直径,待测样品的性质,一般直 径为 200 mm 的药筛,取样为 25 ~ 100 g; ③ 对易产 生静电的样品,可加入不多于 0. 5% 的胶质二氧化 硅和( 或) 氧化铝等抗静电剂,以减小静电作用产生 的影响; ④ 过筛终止时间一般均根据经验掌握,当 筛中物质量不再有明显变 化,即 可 终 止( 《中 国 药 典》2010 年版附录中机械筛分法与空气喷射筛分法 已规定了终点判断依据) 。 1. 3 光散射法( Light diffraction method) 1. 3. 1 概述 光散射法测定粒度是近几年发展起 来且被广泛应用的新方法,是运用粒子被光束照射 时向各个方向散射和光发生衍射的特征,散射光的 角度与颗粒的直径成反比关系,而散射光强随角度 的增加呈对数规律衰减,通过接受散射光能量的分 布,基于 Fraunhofer 衍射和 Mie 散射理论对这些信 号进行数学处理,即可得到粒度分布。颗粒越小,衍 射角越大,因此它更适合小颗粒测定。本法具有操 作简便,速度快,测定准确的优点。通常,激光散射 仪一般标示可测试范围为 0. 02 ~ 2 000 μm,实际测 定范围为 1 ~ 1 000 μm。 1. 3. 2 仪器设备 激光粒度分析仪通常由激光光 源、透镜、颗粒分散装置、测量散射图谱的检测器及 用于仪器控制和颗粒粒度分布的计算机组成。激光
作者简介: 陈祝康,副主任药师; 研究方向: 药物分析及质量控制。Tel: 021 - 38839900-26712; E-mail: czhukang@ yahoo. com. cn
中国药品标准 2012 年第 13 卷第 6 期 406
1. 1. 2 仪器设备 光学显微镜、透射电子显微镜、 颗粒图像处理仪等。 1. 1. 3 样品测试 显微镜法测定所需的样品量极 少,因此取样和制样时要保证样品的代表性和良好 的分散性。制备样片的介质应具有良好的浸润性而 且不溶解 样 品,且 与 样 品 的 折 射 率 接 近。 《中 国 药 典》选用甘油( 1 →2) 作为黏度较大样品的分散介 质,除甘油外,全氟化碳、癸烷等长链烷烃等也是较 常用的分 散 介 质。 操 作 步 骤 详 见《中 国 药 典 》2010 年版二部附录Ⅸ E 粒度和粒度分布测定法。 1. 1. 4 注意事项 显微镜法测定时,还应注意: ① 物镜、目镜的正确选择; ②所用器具应清洁; ③盖盖 玻片时,用 镊 子 夹 取 盖 玻 片,先 使 其 一 边 与 药 物 接 触,慢慢放下,以防止气泡混入,轻压使颗粒分布均 匀; ④盖玻片、载玻片应平整、光洁、无痕、透明度良 好,以免引起散射等现象; ⑤直接取样时,取样量应 适量,若量过多时,粒子重叠不易观察、判断,若过少 代表性差; ⑥如为混悬液,振摇时要有一定力度,振 摇后应快速取样; ⑦如为混悬型软膏剂、混悬型眼用 半固体制剂或混悬凝胶剂,在取样混匀过程中应缓 慢混匀,以免产生气泡。 1. 1. 5 适用范围 显微镜法是《中国药典》2010 年 版规定粒度测定的第一法,可用于测定原料药、混悬 剂、乳剂、混悬型乳膏剂、散剂和其他粉粒的粒子大 小或限度。 1. 2 筛分法( Sieving method) 1. 2. 1 概述 筛分法是粒径分布测量中使用最早 的方法 。制药方面,通常选择筛分法对较粗的粉末 或颗粒进行分级。筛分法可采用湿法过筛或干法过 筛,湿法过筛常用于液体中的物质或干筛时易成团 的粒子,脆性物质最好也用湿筛方法; 但目前各国药 典中采用的方 法 均 为 干 法 过 筛。 《中 国 药 典 》2010 年版二部附录粒度与粒度分布测定法第二法( 筛分 法) 中,分人工筛分法、机械筛分法与空气喷射筛分 法; 人工筛分法的重复性有时不理想,机械筛分法规 定了振动方式与振动频率,避免了人为误差; 当筛孔 较细时( 一般小于 75μm) ,其精确度不易保证,粉 末也不易快速通过筛子,为了防止筛孔被粒子所堵 塞,宜采用空气喷射筛分法。 1. 2. 2 仪器设备 各国药典所用试验筛的标准筛 号及筛孔大小有所不同,《中国药典》在 R40 /3 系列 规定了药筛的九个筛号。筛号常用“目”表示,“目” 系指在筛面的 25. 4 mm( 1 英寸) 长度上开有的孔 数,如开有 30 个 孔,称 30 目 筛,孔 径 大 小 是 25. 4
文献标识码: A
文章编号: 1009 - 3656( 2012) - 6 - 405 - 4
Discussion about Particle Size Analysis for Drug and Pharmaceuticals
Chen Zhukang1 ,Chen Guiliang1 ,Li Huiyi2 ( 1. Shanghai Institute for Food and Drug Control,Shanghai 201203; 2. Chinese Pharmacopoeia
对于湿法测定,选择适宜的分散介质,建立良好 的、稳定的分散体系是获得准确结果的关键。通常 对于一个未知样品,分散体系的制备技术应考虑下 列几个因素: ①分散介质的选择; ②分散剂及其浓 度的选择; ③外加机械力及其强度的选择; ④稳定 体系的保持。选择的分散介质应满足最基本的条件 是: ①液体与颗粒无反应; ②颗粒在液体中无溶解, 也不会使颗粒膨胀; ③液体在激光波长下应是可透 过( 不吸收) 的,为不带入外来杂质,应使用高纯的 分散介质,若使用有机介质时,若样品或介质内有微 量的水,会使颗粒团聚难以分散,此时样品就应注意 脱水,要预先烘干; ④液体与颗粒的折射率不同。常 用的分散介质有水、丙三醇水溶液、乙醇、乙醇和丙 三醇混合液等。不同粒径的样品对浓度要求稍有区 别,较小粒径的样品颗粒因有较强的光散射性,浓度 可略低于大颗粒。同样,较强激光功率的仪器( 通 常为 5mW) ,也因有较强的散射光信号,而要求更低 的样品颗粒浓度。制备的样品分散体系的浓度既要 满足仪器检测灵敏度的要求,又要保证粒子以单个 原始态存在,未发生团聚。分散后再凝结的程度,一 方面取决于粉末颗粒及分散液体的特性,另一方面 取决于使用的外力。可采取的帮助分散的外力有: ①使用机械方法处理,如超声处理、机械搅拌等; ② 使用表面活性剂,降低固 / 液间的表面张力; ③添加 离子化合物,在颗粒表面形成双电子层; ④改变分散 体系的 pH 值,使颗粒表面带有适量电荷,当排斥力 大于吸引力 ( 范德华引力) 时,颗粒会互相排斥而 形成稳定的分散体系。
定方法时,同一样品在一定的条件下获得的粒度及 其分布应一致,且各方法间的总体趋势应是一致的。 本文对常用粒度测定方法、粒度测定注意事项以及 粒度标准物质的情况进行了探讨,供开展此项研究 工作参考。 1 常用粒度测定方法 1. 1 显微镜法( Microscopic method) 1. 1. 1 概述 显微镜法是应用最广泛的一种粒度 测定方法,是将粒子放在显微镜下,根据投影像测得 粒径的方法,光学显微镜可以测定微米级粒径,电子 显微镜可以测定纳米级粒径。显微镜法除了测定粒 径,同时还可以观察粒子的形态。其优点为简单、直 观,但缺点为操作相对繁琐,测量时间长,易受人为 因素影响,且取样量少,代表性不强,只适合粒度分 布范围较窄的样品。
Commission,Beijing 100061)
