2013-2014学年高一化学苏教版必修一:2.1.4 溴、碘的提取 PPT课件1
合集下载
高一化学苏教版必修一专题而第一单元 溴碘的提取课件(共16张ppt)

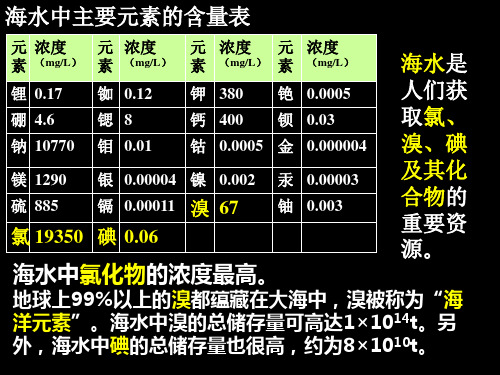
溴元素:海洋总储量1×1014t,“海洋元素” 在海洋中主要存在形式:Br-
碘元素:8×1010t
在海洋中主要存在形式:I-,海带中大 部分为有机碘
实验项目
操作方法
少量氯水滴加到 ① NaBr溶液中振荡
再向其中加入少量 CCl4,振荡,静置
少量氯水滴加到KI 溶液中振荡 ② 再向其中加入少量 CCl4,振荡,静置
A.NaCl和Nal B.NaCl和I2 C.NaCl和NaBr D.NaCl
小结:
氧化性:Cl2>Br2>I2 还原性:I->Br->Cl-
应用: 交流讨论从海水中提取溴、碘的原理
溴的提取
思考:为什么要鼓入热空气?
粗盐
海水
母液 通Cl2
溴易挥发,鼓入热空气使其全 部挥发出来,冷凝得到粗溴。
Br2水 鼓入热空气 Br2蒸汽
冷凝
高纯溴 提纯 粗Br2
碘的提取
海带 ①灼烧
海带灰 ②浸泡
特性:碘I2能使淀粉变蓝
碘(I2)单质
碘蒸气
氯、溴、碘原子的最外层电子都为7个,容易得 1个电子而达到8电子稳定结构。所以它们都具有相 似的化学性质。
与变价金属反应时,氯、溴
1、与金属反应 都能将其氧化到最高价态,而碘
则不能。
2、与H2反应 X2 + H2 = 2HX 反应条件越来越难
3、与水反应 X2 + H2O = HX + HXO 均为可逆反应
水大;在水中溶解度很小;易挥发; 易溶于酒精、四氯化碳等有机溶剂。
常温下, Br2唯一呈液态状的非金属单质
溴的保存:
密闭保存,常往盛溴的 试剂瓶中加入一些水— —水封
溴液体蒸气
碘元素:8×1010t
在海洋中主要存在形式:I-,海带中大 部分为有机碘
实验项目
操作方法
少量氯水滴加到 ① NaBr溶液中振荡
再向其中加入少量 CCl4,振荡,静置
少量氯水滴加到KI 溶液中振荡 ② 再向其中加入少量 CCl4,振荡,静置
A.NaCl和Nal B.NaCl和I2 C.NaCl和NaBr D.NaCl
小结:
氧化性:Cl2>Br2>I2 还原性:I->Br->Cl-
应用: 交流讨论从海水中提取溴、碘的原理
溴的提取
思考:为什么要鼓入热空气?
粗盐
海水
母液 通Cl2
溴易挥发,鼓入热空气使其全 部挥发出来,冷凝得到粗溴。
Br2水 鼓入热空气 Br2蒸汽
冷凝
高纯溴 提纯 粗Br2
碘的提取
海带 ①灼烧
海带灰 ②浸泡
特性:碘I2能使淀粉变蓝
碘(I2)单质
碘蒸气
氯、溴、碘原子的最外层电子都为7个,容易得 1个电子而达到8电子稳定结构。所以它们都具有相 似的化学性质。
与变价金属反应时,氯、溴
1、与金属反应 都能将其氧化到最高价态,而碘
则不能。
2、与H2反应 X2 + H2 = 2HX 反应条件越来越难
3、与水反应 X2 + H2O = HX + HXO 均为可逆反应
水大;在水中溶解度很小;易挥发; 易溶于酒精、四氯化碳等有机溶剂。
常温下, Br2唯一呈液态状的非金属单质
溴的保存:
密闭保存,常往盛溴的 试剂瓶中加入一些水— —水封
溴液体蒸气
溴和碘的提取ppt课件

海洋
矿石
提纯
选择原料
海洋
氯碱工业
预处理 转化
海水 日照 粗盐 提纯 精盐
通电
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑
提纯
NaOH的精制
选择原料 预处理
阅读以下信息,我们应当如何选择提取溴、碘的原料呢?
溴、碘的化学性质活泼,在自然界中主要以Br –、 I –的形式存在
海洋
陆地
成本
选择选料 预处理 转化 提纯
工业生产中,选择氧化剂需要考虑哪些因素呢?
Br -
苦卤
I-
滤液
Cl2 + 2Br Cl2 + 2I -
不同氧化剂氧化生成1吨Br2的成本
Br2 氧化剂
Cl2
I2
KMnO4
成本/元 399.4 40487.5
Br2 + 2Cl I2 + 2Cl -
KClO3 30%H2O2
碘单质
② H2SO4
过滤 固体碘及饱和碘水
该提取过程利用了碘单质的什么特性呢?
碘难溶于水
① 3I2+6OH - 5I-+IO3- +3H2O
溶解度为0.029g/100g水 ② 5I-+IO3-+6H+ 3I2↓ + 3H2O
选择原料 预处理
提取溴、碘的方法 离子交换法
转化
提纯
膜分离法
离子交换法、膜分离法…
化工生产小贴士:提取过程中需考虑能耗、成本。
选择原料 预处理
含溴的苦卤 热空气吹出 含溴的空气 冷凝 粗溴 粗碘 提纯 碘单质
实验室中蒸馏含I2的有机溶液的现象
苏教版必修1化学同步课件:212溴、碘的提取

04
实验:溴、碘的提取实 验
实验目的
掌握溴、碘的提取原理。 学会使用分液漏斗和烧杯等实验器材。
了解溴、碘在工业和生活中的实际应用。
实验步骤
准备实验器材:分液漏斗、烧杯、溴和 碘的混合溶液、蒸馏水等。
将下层液体加热至沸腾,再加入适量氧 化剂,氧化碘离子为碘单质,再利用萃 取剂萃取得到碘。
使用分液漏斗分离出上层液体,即得到 溴的提取液。
通过本实验,可以了解溴、碘 的提取原理和实验操作方法, 为后续的学习和实践打下基础
。
05
溴、碘提取的相关习题 及解析
选择题
选择题1:关于溴和碘的提取,下列 说法正确的是
B. 从海水中提取碘,需经过浓缩、氧 化、萃取、蒸馏等操作
A. 从海水中提取溴,通常将氯气通入 提取溴的海水中,然后用分液漏斗分 离出溴
在此添加您的文本16字
原理:利用智利硝石与溴离子反应生成溴,再通过蒸馏得 到纯溴。
在此添加您的文本16字
步骤:将智利硝石与酸混合加热,得到含溴的溶液,蒸馏 得到纯溴。
碘的提取方法
碘的提取方法一:海带提碘法
01
步骤:将海带灰化处理、酸化后加入氧化 剂氧化碘离子、萃取得到碘单质。
03
02
原理:利用海带中含有的碘离子,通过氧化 还原反应将其转化为碘单质。
溴、碘的氧化性
溴、碘具有强氧化性,能够氧 化某些还原性物质,如硫化氢、 二氧化硫等。
溴、碘的氧化性与其在元素周 期表中的位置有关,位于氯和 氧之间,因此其氧化性介于氯 和氧之间。
在某些反应中,溴、碘的氧化 性可以与氯气相媲美,如: $Br_{2} + SO_{2} = SO_{2} + Br^{-}$。
高中化学 2.1.4 溴、碘的提取课件 苏教版必修1
第二十二页,共37页。
[解析(jiě xī)] (1)A中产生的黄绿色气体为Cl2。 (2)氯气遇湿润的淀粉KI试纸时,发生反应:Cl2+ 2KI===I2+2KCl,产生的I2遇淀粉变蓝,可以证明氯气的氧 化性强于碘。 (3)B中Cl2与NaBr发生置换反应,化学方程式为:Cl2 +2NaBr===2NaCl+Br2。
(3)为提取溶液(róngyè)中的碘单质,实验室里有烧杯、玻璃棒、 集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、 物品,尚缺少的玻璃仪器是________。
(4)从含碘的有机溶液(róngyè)中提取碘和回收有机溶剂,还需 经过蒸馏,指出下列实验装置中的错误之处:
①____________;②____________;③____________。
第二十四页,共37页。
[答案] (1)Cl2 (2)淀粉KI试纸变蓝 (3)Cl2+2NaBr===Br2+2NaCl (4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D 振荡,静置后CCl4层变为紫红色 (5)确认(quèrèn)C的黄色溶液中无Cl2,排除Cl2对溴置换碘实 验的干扰
第三十三页,共37页。
第三十四页,共37页。
点击此图片进入 课堂10分钟练习
第三十五页,共37页。
1.海水提溴、碘发生(fāshēng)的主要反应为: Cl2+2KBr===2KCl+Br2,Cl2+2KI===2KCl+I2。 2.检验Br-、I-的反应分别为: NaBr+AgNO3===AgBr↓+NaNO3, NaI+AgNO3===AgI↓+NaNO3。 AgBr是浅黄色沉淀、AgI是黄色沉淀,它们均不溶于稀硝 酸。
第十九页,共37页。
[例1] (2010·北京高考,有改动)为验证卤素单质氧化性 的相对强弱(qiánɡ ruò),某小组用下图所示装置进行实验(夹 持仪器已略去,气密性已检验)。
[解析(jiě xī)] (1)A中产生的黄绿色气体为Cl2。 (2)氯气遇湿润的淀粉KI试纸时,发生反应:Cl2+ 2KI===I2+2KCl,产生的I2遇淀粉变蓝,可以证明氯气的氧 化性强于碘。 (3)B中Cl2与NaBr发生置换反应,化学方程式为:Cl2 +2NaBr===2NaCl+Br2。
(3)为提取溶液(róngyè)中的碘单质,实验室里有烧杯、玻璃棒、 集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、 物品,尚缺少的玻璃仪器是________。
(4)从含碘的有机溶液(róngyè)中提取碘和回收有机溶剂,还需 经过蒸馏,指出下列实验装置中的错误之处:
①____________;②____________;③____________。
第二十四页,共37页。
[答案] (1)Cl2 (2)淀粉KI试纸变蓝 (3)Cl2+2NaBr===Br2+2NaCl (4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D 振荡,静置后CCl4层变为紫红色 (5)确认(quèrèn)C的黄色溶液中无Cl2,排除Cl2对溴置换碘实 验的干扰
第三十三页,共37页。
第三十四页,共37页。
点击此图片进入 课堂10分钟练习
第三十五页,共37页。
1.海水提溴、碘发生(fāshēng)的主要反应为: Cl2+2KBr===2KCl+Br2,Cl2+2KI===2KCl+I2。 2.检验Br-、I-的反应分别为: NaBr+AgNO3===AgBr↓+NaNO3, NaI+AgNO3===AgI↓+NaNO3。 AgBr是浅黄色沉淀、AgI是黄色沉淀,它们均不溶于稀硝 酸。
第十九页,共37页。
[例1] (2010·北京高考,有改动)为验证卤素单质氧化性 的相对强弱(qiánɡ ruò),某小组用下图所示装置进行实验(夹 持仪器已略去,气密性已检验)。
2.1.4溴、碘的提取课件(苏教版必修1)

(2)写出①→②的化学方程式,若为氧化还原反应,
请标明电子转移的方向和数目__________________。 (3)写出③→④的化学反应方程式_____________。
【解析】溶液显棕黄色,说明溶液中有I2生成,氯水和
KI溶液反应生成I2,而氯水显浅黄绿色,故①为KI溶液, ②为氯水,溶液显蓝色是由于淀粉遇I2形成的,故③为 淀粉溶液;又由于I2+2NaOH====NaI+NaIO+H2O,加入 NaOH后I2逐渐消失,蓝色将逐渐褪为无色,故④为NaOH
【解析】选B。a、d两瓶气体混合见光爆炸,必为H2和Cl2。 而a、b两瓶气体混合瓶壁出现暗红色小液滴(液溴),必 为Cl2和HBr(发生了Cl2+2HBr====2HCl+Br2的反应)。则 c中必盛有HCl,同时推出a中为Cl2、b中为HBr、d中为H2。
6.向KI溶液中加入AgNO3溶液,直到反应完全为止,结 果反应后溶液的质量恰好等于原KI溶液的质量,该 AgNO3溶液中溶质的质量分数为( A.50% B.72.3% C.48.8% ) D. 无法计算
170 g ×100%=72.3%。 235 g
二、非选择题(本题共2小题,共26分) 7.(14分)请按如图的实验流程来回答:
(1)写出过程①、④、⑥的化学方程式,标出反应⑥的电
子转移情况。 ①_______________________________________; ④_______________________________________; ⑥_______________________________________。 (2)请写出反应中的颜色和现象 ②___________,③__________,
高一化学溴 碘提取PPT课件

A C CeCl3 FeCl2 SnCl2
D FeCl2 SnCl2 CeCl3
第13页/共15页
(4)向NaBr 、NaI的混合液中通入足量的氯气后,加热再将溶液蒸干、 灼烧,最后得到的残留物是( )
A NaCl
B NaCl NaBr NaI
A
C NaBr NaI
D NaCl I2
第14页/共15页
氧化性: Cl2 > Br2 > I2
第3页/共15页
溴、碘单质的性质
物理性质:
(深红棕色)
溴单质是易挥发、深棕红色、密 度大于水的液体,在水中溶解度不大。
碘单质是易升华、紫黑色、密度大
于水的固体,在水中溶解度不大。
第4页/共15页
卤族元素
氟 氯溴 碘
第5页/共15页
一些物质的颜色
极易溶
固体 液体 气体 水溶液 有机溶液
现象:氯水与碘化钾:溶液由无色变为褐 色,加CCl4后,下层为深紫色
原理:Cl2+2Kl==2NaCl+I2
第2页/共15页
结论 2NaBr + Cl2 = 2NaCl + Br2
2KI + Cl2 = 2KCl + I2 2KI + Br2 = 2KBr + I2
氧化性: Cl2 > Br2 氧化性: Cl2 > I2 氧化性: Br2 > I2
感谢观看!
第15页/共15页
NaCl+AgNO3==NaNO3+AgCl↓(白色)
溴化银的感光性
光照
2AgBr === 2Ag+Br2
碘化银:人工降雨剂
第9页/共15页
D FeCl2 SnCl2 CeCl3
第13页/共15页
(4)向NaBr 、NaI的混合液中通入足量的氯气后,加热再将溶液蒸干、 灼烧,最后得到的残留物是( )
A NaCl
B NaCl NaBr NaI
A
C NaBr NaI
D NaCl I2
第14页/共15页
氧化性: Cl2 > Br2 > I2
第3页/共15页
溴、碘单质的性质
物理性质:
(深红棕色)
溴单质是易挥发、深棕红色、密 度大于水的液体,在水中溶解度不大。
碘单质是易升华、紫黑色、密度大
于水的固体,在水中溶解度不大。
第4页/共15页
卤族元素
氟 氯溴 碘
第5页/共15页
一些物质的颜色
极易溶
固体 液体 气体 水溶液 有机溶液
现象:氯水与碘化钾:溶液由无色变为褐 色,加CCl4后,下层为深紫色
原理:Cl2+2Kl==2NaCl+I2
第2页/共15页
结论 2NaBr + Cl2 = 2NaCl + Br2
2KI + Cl2 = 2KCl + I2 2KI + Br2 = 2KBr + I2
氧化性: Cl2 > Br2 氧化性: Cl2 > I2 氧化性: Br2 > I2
感谢观看!
第15页/共15页
NaCl+AgNO3==NaNO3+AgCl↓(白色)
溴化银的感光性
光照
2AgBr === 2Ag+Br2
碘化银:人工降雨剂
第9页/共15页
苏教版高中化学必修一课件2-1-4溴、碘的提取

活动性:强弱顺序应为F2>Cl2>Br2>I2
二、从海水或海产品中提取溴和碘 1、从海水中提取溴:
2、从海产品中提取碘:
三、溴和碘的性质
1、物理性质
溴
2 (1)溴是深红棕色液体 (2)密度比水大
(3)易挥发
(4)可溶于水(在水中的溶解度不大)
溴水呈橙黄色
思考:如何保存溴?
保存溴时,常往盛溴的试剂瓶中加入一些水。 (水封)
2
碘
(1)碘是一种紫黑色固体 (2)易升华
(3)在水中的溶解度很小 碘水呈棕黄色
(4)淀粉溶液遇碘变成蓝色 可用于检验碘的存在
溴、碘单质不易溶于水,但却易溶于酒精、CCl4、 苯、汽油等有机溶剂中。
2、化学性质 1、置换反应 2KBr + Cl2 = 2KCl + Br2
2KI + Cl2 = 2KCl + I2 2KI + Br2 = 2 KBr + I2 2、Br-、I-的检验方法:
高中化学课件
灿若寒星整理制作
2-1-4 溴、碘的提取
[实验1]在一支试管中加入2~3mL KBr溶液,滴 加少量新制氯水,再滴加少量CCl4,振荡,静 置,观察实验现象。 [实验2]在一支试管中加入2~3mL KI溶液,分别 滴加少量新制氯水,再分别滴加少量CCl4,振 荡,静置,观察实验现象。
试剂:AgNO3溶液和稀硝酸; 现象:产生浅黄色沉淀(含Br-),
黄色沉淀(含I-)。
思考:鉴别Cl-、Br-、I-可以选用的试剂是( BD) A 、碘水、四氯化碳 B 、氯水、四氯化碳 C 、淀粉、KI溶液 D 、硝酸银溶液、稀HNO3
Hale Waihona Puke [实验1]加新制氯水后,溶液呈橙黄色。注入四 氯化碳后,四氯化碳层呈橙红色。
二、从海水或海产品中提取溴和碘 1、从海水中提取溴:
2、从海产品中提取碘:
三、溴和碘的性质
1、物理性质
溴
2 (1)溴是深红棕色液体 (2)密度比水大
(3)易挥发
(4)可溶于水(在水中的溶解度不大)
溴水呈橙黄色
思考:如何保存溴?
保存溴时,常往盛溴的试剂瓶中加入一些水。 (水封)
2
碘
(1)碘是一种紫黑色固体 (2)易升华
(3)在水中的溶解度很小 碘水呈棕黄色
(4)淀粉溶液遇碘变成蓝色 可用于检验碘的存在
溴、碘单质不易溶于水,但却易溶于酒精、CCl4、 苯、汽油等有机溶剂中。
2、化学性质 1、置换反应 2KBr + Cl2 = 2KCl + Br2
2KI + Cl2 = 2KCl + I2 2KI + Br2 = 2 KBr + I2 2、Br-、I-的检验方法:
高中化学课件
灿若寒星整理制作
2-1-4 溴、碘的提取
[实验1]在一支试管中加入2~3mL KBr溶液,滴 加少量新制氯水,再滴加少量CCl4,振荡,静 置,观察实验现象。 [实验2]在一支试管中加入2~3mL KI溶液,分别 滴加少量新制氯水,再分别滴加少量CCl4,振 荡,静置,观察实验现象。
试剂:AgNO3溶液和稀硝酸; 现象:产生浅黄色沉淀(含Br-),
黄色沉淀(含I-)。
思考:鉴别Cl-、Br-、I-可以选用的试剂是( BD) A 、碘水、四氯化碳 B 、氯水、四氯化碳 C 、淀粉、KI溶液 D 、硝酸银溶液、稀HNO3
Hale Waihona Puke [实验1]加新制氯水后,溶液呈橙黄色。注入四 氯化碳后,四氯化碳层呈橙红色。
苏教版高中化学必修1《溴、碘的提取》优秀课件

课堂练习
(3)写出步骤③所发生的化学反应方程式。
3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O
用硫酸而不用盐酸酸化的原因可能是 溴酸能将Cl-氧化成Cl2。 步骤②的产品有时运输到目的地后再酸化,主要是因
为 Br2有强氧化性 .
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中 ac 。
a.通入HBr
b.加入Na2CO3溶液
c.加入NaBr溶液
d.加入Na2SO3溶液
Thyoaunk
End
结束
新制氯水
CCl4
无色KBr溶液
棕黄色溶液
分层,下层紫红色
Cl2+2KI=I2+2KCl 氧化性: Cl2> I2
交流与讨论
新知讲解
一、溴、碘提取的化学方程式 2KBr + Cl2﹦2KCl + Br2 2KI + Cl2 ﹦ 2KCl + I2 2KI + Br2 ﹦ 2KBr + I2
活泼性比较: Cl2 > Br2 > I2
第一单元 氯、溴、碘及其化合物 溴、碘的提取
ห้องสมุดไป่ตู้习目标
一.了解溴碘在自然界的存在,学会提取 溴碘单质的原理; 二.掌握卤素离子的检验方法。
新课导入
海水中主要元素的含量表
元 浓度 元 浓度 元 浓度 元 浓度mg/L 素 mg/L 素 mg/L 素 mg/L 素
锂 0.17 铷 0.12 钾 380 铯 0.0005
• 加AgNO3溶液, 产生白色沉淀,
加硝酸不溶解。
• 加AgNO3溶液,产 生浅黄色沉淀,加
硝酸不溶解。
§2-1-4溴碘提取-浙江省温州人文高级中学高中化学苏教版必修1课件(共17张PPT)
提取粗食盐后的母液(Br-)
溴水
冷凝
精制
溴和水蒸气
粗溴
高纯度溴单质
2.碘的提取 水
海带 浸泡液
氯气 氧化 过滤 提纯
碘单质
现有三瓶无色溶液: NaCl溶液、NaBr溶液、NaI溶液 应如何鉴别?
重庆高温、干旱
作业: 《作业本》P29—31溴碘的提取
《倍速》P36-37例题; P37T4; P38T2.3.4
如何将碘与沙子两种 固体物质分离?
碘单质
滴加氯水
NaBr溶液
无色变为橙黄色
滴加CCl4, 溶液分层,下层为 充分振荡 橙红色
结论
有Br2生成
KI溶液
无色变为棕黄色
溶液分层,下层为 紫红色
有I2生成
设计实验验证Br2和I2的氧化性强弱
实验
实验现象
解释
溴水与KI溶液 加入CCl4振荡
溶液分层, 下层为紫红色
外,海水中碘的总储存量也很高,约为8×1010t。
溴、碘的提取
溴和碘的物理性质
深红棕色液体,易挥发, 强腐蚀性,密度比水大, 在水中溶解度不大,易溶 于有机溶剂。
溴单质 (液溴)
在实验室中应如何保存液溴?
水封
溴和碘的物理性质 紫黑色,固体,易升 华,可使淀粉变蓝, 在水中溶解度不大,
易溶于有机溶剂。
2KI+ Br2 ==2KBr+I2
巩固应用
向NaBr 、NaI的混合溶液中通入足量Cl2后,加热,
再将溶液蒸干、灼烧,最后得到的残留物是(A )
A.NaCl
B.NaCl、 NaBr 、NaI
C.NaBr、 Nal D.NaCl、l2
变式:若通入少量Cl2呢?
20132014学年高一化学苏教版必修一:2.1.4 溴、碘的提取 ppt课件

14
7.怎样检验萃取后的水中仍含有碘? 萃取后进行分液,取少量水溶液滴加淀粉溶液,
如果溶液显蓝色,则证明水中仍含有碘。 8.从萃取液里分离出碘的方法是什么? 由于碘溶解在萃取剂中,分离碘时还要回收萃取
剂,只能用蒸馏的方法,不能用蒸发的方法, 蒸馏时萃取剂苯或四氯化碳被蒸出。
15
溴、碘离子的检验
AgNO3 溶液
8
海水中主要元素的含量表
元 浓度 元 浓度 素 (mg/L) 素 (mg/L)
锂 0.17 铷 0.12 硼 4.6 锶 8 钠 10770 钼 0.01
元 浓度 元 浓度 素 (mg/L) 素 (mg/L)
钾 380 铯 0.0005 钙 400 钡 0.03 钴 0.0005 金 0.000004
在溶液中IO3-可和I-发生反应:
IO
-
3
+5I-
+6H+=3I2+3H2O,根据此反应,可用试
纸和一些生活中常见物质进行实验,证明食盐中
存在IO3-。可供选用的物质有: ①自来水,②蓝色 石蕊试纸, ③碘化钾淀粉试纸,④淀粉,⑤食糖,
⑥食醋,⑦白酒。进行上述实验时必须使用的物
质是(
)
A.①③
B.③⑥
浸泡液
滤
滤液
粗碘
纯
单
质
12
1.为什么不直接从海水中提取碘? 海水中碘的浓度太低,直接提取效率低、成本高
2.海带的预处理方法有哪些?
海带的预处理方法一般有两种方法,一是浸泡法 ,粉碎泡烂之后再氧化过滤;另一是灼烧法, 将海带灼烧成灰烬再加水进行溶解过滤。
3.滤液中通氯气后过滤为什么能获得碘?
碘在水中溶解度比较小,产生的碘大部分以固体 形式存在,所以可过滤出碘。
7.怎样检验萃取后的水中仍含有碘? 萃取后进行分液,取少量水溶液滴加淀粉溶液,
如果溶液显蓝色,则证明水中仍含有碘。 8.从萃取液里分离出碘的方法是什么? 由于碘溶解在萃取剂中,分离碘时还要回收萃取
剂,只能用蒸馏的方法,不能用蒸发的方法, 蒸馏时萃取剂苯或四氯化碳被蒸出。
15
溴、碘离子的检验
AgNO3 溶液
8
海水中主要元素的含量表
元 浓度 元 浓度 素 (mg/L) 素 (mg/L)
锂 0.17 铷 0.12 硼 4.6 锶 8 钠 10770 钼 0.01
元 浓度 元 浓度 素 (mg/L) 素 (mg/L)
钾 380 铯 0.0005 钙 400 钡 0.03 钴 0.0005 金 0.000004
在溶液中IO3-可和I-发生反应:
IO
-
3
+5I-
+6H+=3I2+3H2O,根据此反应,可用试
纸和一些生活中常见物质进行实验,证明食盐中
存在IO3-。可供选用的物质有: ①自来水,②蓝色 石蕊试纸, ③碘化钾淀粉试纸,④淀粉,⑤食糖,
⑥食醋,⑦白酒。进行上述实验时必须使用的物
质是(
)
A.①③
B.③⑥
浸泡液
滤
滤液
粗碘
纯
单
质
12
1.为什么不直接从海水中提取碘? 海水中碘的浓度太低,直接提取效率低、成本高
2.海带的预处理方法有哪些?
海带的预处理方法一般有两种方法,一是浸泡法 ,粉碎泡烂之后再氧化过滤;另一是灼烧法, 将海带灼烧成灰烬再加水进行溶解过滤。
3.滤液中通氯气后过滤为什么能获得碘?
碘在水中溶解度比较小,产生的碘大部分以固体 形式存在,所以可过滤出碘。
溴、碘的提取 PPT课件5 苏教版

•
13、认识到我们的所见所闻都是假象,认识到此生都是虚幻,我们才能真正认识到佛法的真相。钱多了会压死你,你承受得了吗?带,带不走,放,放不下。时时刻刻发悲心,饶益众生为他人。
•
14、梦想总是跑在我的前面。努力追寻它们,为了那一瞬间的同步,这就是动人的生命奇迹。
•
15、懒惰不会让你一下子跌倒,但会在不知不觉中减少你的收获;勤奋也不会让你一夜成功,但会在不知不觉中积累你的成果。人生需要挑战,更需要坚持和勤奋!
•
5、心情就像衣服,脏了就拿去洗洗,晒晒,阳光自然就会蔓延开来。阳光那么好,何必自寻烦恼,过好每一个当下,一万个美丽的未来抵不过一个温暖的现在。
•
6、无论你正遭遇着什么,你都要从落魄中站起来重振旗鼓,要继续保持热忱,要继续保持微笑,就像从未受伤过一样。
•
7、生命的美丽,永远展现在她的进取之中;就像大树的美丽,是展现在它负势向上高耸入云的蓬勃生机中;像雄鹰的美丽,是展现在它搏风击雨如苍天之魂的翱翔中;像江河的美丽,是展现在它波涛汹涌一泻千里的奔流中。
溴、碘的提取
趣味实验: 白纸显字
谜底:碘化学特性,遇淀粉变蓝色
(注意:变蓝是碘单质不是碘的化合物)
实验观察: 紫黑色固体,蒸气呈紫红色
碘单质
物理特性:具升华性质
思考:如何分离碘和氯化钠的固体 碘蒸气 混合物?
升华
溴单质
溴单质 (液溴)
深红棕色液体,有刺激性气味, 有毒。易挥发,密度比水大, 在水中的溶解度很小,易溶于 有机溶剂(如:酒精、四氯化 碳)。
NaCl
•
15、如果没有人为你遮风挡雨,那就学会自己披荆斩棘,面对一切,用倔强的骄傲,活出无人能及的精彩。
•
16、成功的秘诀在于永不改变既定的目标。若不给自己设限,则人生中就没有限制你发挥的藩篱。幸福不会遗漏任何人,迟早有一天它会找到你。
溴、碘的提取PPT苏教版

(加萃取剂 ) 3、如何将碘水中的碘单质分离出来?
总结:Cl2、Br2、I2的性质比较
性质 颜色 状态 溶解 性 溶液 颜色
Br2 I2
氯气(Cl2)
黄绿色
溴(Br 2)
深红棕色
液体
碘(I2)
紫黑色 固体
气体
但易溶 能溶于水,易 溴和碘在水中的溶解度很小, 溶于有机溶剂 于酒精、四氯化碳等有机溶剂
通Cl2
思考:为什么要鼓入热空气? 溴易挥发,鼓入热空气使其全 部挥发出来。
鼓入热空气或水蒸气
溴水
溴蒸汽 冷凝
高纯度溴
提纯
粗溴
2.海带中提取碘
水 氢氧化 钠溶液 氯气
干海带
浸泡液(含 )
I-
过滤
滤液(含I-)
反应方程式 Cl2 + 2KI = I2 +2KCl
碘 单 质
提纯
过滤 结晶、
粗碘
四、Cl 、Br 、I 的鉴别
方法一:加AgNO3溶液,再加稀硝酸,利用AgX沉淀的颜色不同进行鉴别
方法二:加氯水,再加有机溶剂萃取,根据有机层颜色进行鉴别
1、与H2的反应 Br2 + H2 =2HCl 五 、 其 他 化 学 性 质 I2 + H2 =2 HI 2、与金属的反应 3Br2 + 2Fe = 2FeBr3
I2 + Fe = FeI2 3、与H2O的反应
溴蒸气 水 封 液 溴
2、如何保存单质溴? 用水封,棕色试剂瓶
2、碘(I2)的性质 • • • • • 颜色: 紫黑色 状态: 固体 密度: 比水大 溶解性:微溶于水却易溶于酒精、CCl4等有机溶剂 特性: 1.易升华 2.使淀粉变蓝
化学课件《溴、碘的提取》优秀ppt5 苏教版

87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
【实验2】在一支试管中加入2~3mLNaI溶液, 滴加少量新制氯水,再滴加少量CCl4,振荡, 静置。
原理:Cl2+2NaI=I2+2NaCl
工业上如何从海水或海产品中提取溴和碘 (阅读教材P46)
工业提取Br2: “吹”出来的溴
提 取 粗 盐 通入Cl2 后的母液
溴水
鼓入热空气 或水蒸气
溴 和 水 冷凝 蒸气
91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿·休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯·奥雷利阿斯] 93ห้องสมุดไป่ตู้在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰·纳森·爱德瓦兹]
NaCl
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
【实验2】在一支试管中加入2~3mLNaI溶液, 滴加少量新制氯水,再滴加少量CCl4,振荡, 静置。
原理:Cl2+2NaI=I2+2NaCl
工业上如何从海水或海产品中提取溴和碘 (阅读教材P46)
工业提取Br2: “吹”出来的溴
提 取 粗 盐 通入Cl2 后的母液
溴水
鼓入热空气 或水蒸气
溴 和 水 冷凝 蒸气
91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿·休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯·奥雷利阿斯] 93ห้องสมุดไป่ตู้在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰·纳森·爱德瓦兹]
NaCl
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
高中化学专题2从海水中获得的化学物质第1单元氯、溴、碘及其化合物(第3课时)溴、碘的提取课件苏教版必修1

在一支试管中加入 KI 溶液,先 后滴加少量新制氯水和 CCl4,振 荡,静置
溶C下C液层l4由呈静置紫无后红色,上变色层为溶黄液色无,滴色加,=2==K2IK+Cl+ClI22
在一支试管中加入 后滴加少量溴水和 静置
KCCI 溶l4,液振,荡先,溶C下C液层l4,由呈静无置紫后红色,变上色为层溶黄液色,无滴色加,=2=K=2IK+BrB+rI22
知 识 点
1
学
第3课时 溴、碘的提取
业 分
层
测
评
知 识 点
2
1.了解溴、碘的主要性质及其应用。(重点) 2.了解溴、碘的提取和反应原理。(重、难点) 3.掌握Cl-、Br-、I-的检验方法。(重点)
溴、 碘 的 性 质 及 应 用
教材整理1 溴、碘的性质 1.溴和碘的物理性质
[基础·初探]
色、态 密度 溶解性 特性
深红棕色 溴
液体
均比水 的 大 水中:微溶;
易挥发
有机溶液中:
紫黑色固
碘
易溶
易升华
体
2.单质的化学性质
实验
实验现象
化学方程式
在一支试管中加入 KBr 后滴加少量新制氯水 荡,静置
溶液,先 CCl4,振
溶液由无色变为 橙黄 色,滴加
CCl4 静置后,上层溶液 无色, 下层呈 橙红 色
2KBr+Cl2 ===2KCl+Br2
常温下外观
硝酸银、 稀硝酸法
氯水、四 氯化碳法
Cl-
无色 出现白 色沉淀
Br-
无色
出现淡黄 色沉淀
分层,下层 为橙红色
I-
无色
出现黄色 沉淀
分层,下层 为紫红色
溴、 碘 的 提 取
苏教版溴碘的提取.pptx

A、NaCl和KIB、NaCl、KCl和I2 C、KCl和NaBrD、KCI和NaCl
2、已知硫氰(SCN)2、氰气(CN)2和Cl2性 质相似。试完成下列反应:
(1)(CN)2+NaOH (2)MnO2+HSCN
答:(CN)2+2NaOH=NaCN+NaCNO+H2O MnO2+4HSCN=Mn(SCN)2+(SCN)2+2H2O
溴和碘在不同溶剂中呈现的颜色 水 汽油或苯 四氯化碳
Br2 橙黄 I2 棕黄
橙红色
紫红色
橙红色
紫红色
保存溴时,常往盛溴的试剂瓶中加 入一些水。
溴是深红棕色液体 有刺激性气味 密度比水大 可溶于水 在水中的溶解度不大 溴水呈橙黄色 易挥发 溴的蒸气红棕色
1碘是紫黑色的固体,具有金属光泽,碘 易升华。
卤素离子的检验
(1)沉淀法
Cl-
BrI-
①AgNO3溶液 ②稀HNO3
白↓(AgCl) 淡黄↓(AgBr) 黄↓(AgI)
(2)萃取法
Cl- ①氯水、振荡
Br-
有机层
I- ②CCl4振荡静置
黄绿色 橙色 紫色
用途:p47 AgBr——感光材料; AgI——人工降雨; KIO3——加碘食盐; 碘酒——医用消毒。
性质相似性:单质具有氧化性 ①与金属反应生成金属卤化物; ②与氢气反应生成卤化氢; ③与水反应; ④与碱反应。
1、与金属反应
点燃
2Fe+3Cl2==2FeCl3
点燃
2Fe+3Br2==2FeBr3
点燃
Fe+I2==FeI2
请注意
碘与铁生成FeI2而不是FeI3
2、已知硫氰(SCN)2、氰气(CN)2和Cl2性 质相似。试完成下列反应:
(1)(CN)2+NaOH (2)MnO2+HSCN
答:(CN)2+2NaOH=NaCN+NaCNO+H2O MnO2+4HSCN=Mn(SCN)2+(SCN)2+2H2O
溴和碘在不同溶剂中呈现的颜色 水 汽油或苯 四氯化碳
Br2 橙黄 I2 棕黄
橙红色
紫红色
橙红色
紫红色
保存溴时,常往盛溴的试剂瓶中加 入一些水。
溴是深红棕色液体 有刺激性气味 密度比水大 可溶于水 在水中的溶解度不大 溴水呈橙黄色 易挥发 溴的蒸气红棕色
1碘是紫黑色的固体,具有金属光泽,碘 易升华。
卤素离子的检验
(1)沉淀法
Cl-
BrI-
①AgNO3溶液 ②稀HNO3
白↓(AgCl) 淡黄↓(AgBr) 黄↓(AgI)
(2)萃取法
Cl- ①氯水、振荡
Br-
有机层
I- ②CCl4振荡静置
黄绿色 橙色 紫色
用途:p47 AgBr——感光材料; AgI——人工降雨; KIO3——加碘食盐; 碘酒——医用消毒。
性质相似性:单质具有氧化性 ①与金属反应生成金属卤化物; ②与氢气反应生成卤化氢; ③与水反应; ④与碱反应。
1、与金属反应
点燃
2Fe+3Cl2==2FeCl3
点燃
2Fe+3Br2==2FeBr3
点燃
Fe+I2==FeI2
请注意
碘与铁生成FeI2而不是FeI3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
病有治疗作用的是
( C)
A.钠元素
B.氯元素
C.碘元素
D.铁元素
6.下列物质不能使湿润的淀粉 KI 试纸变蓝的是( C )A.碘水ຫໍສະໝຸດ B.溴水C.碘化钾溶液
D.氯气
7.盛放液溴的试剂瓶中要加入一定量的水,其目的是( D )
A.制得溴水
B.比较水和液溴的密度
C.将液溴隔绝空气 D.防止液溴挥发
8.将适量 Cl2 通入溴化钠溶液中,等反应停止后,从该溶
无 色,下层 紫红 色。
(3)若把溴蒸气通入 KI 溶液中发生反应为:
Br2+2KI===2KBr+I2 。
3.溴、碘的重要应用
(1) AgBr 常被用作感光材料。
(2)碘是重要的药用元素,可用来生产含碘食品。
(3) AgI 用于人工降雨。
思维拓展 1.能否用酒精萃取溴水中的溴或碘水中的碘?
答:不能。因为酒精和水以任意比互溶,溶液 不能分层。 二、溴、碘的提取 1.从海水中提取溴 (1)原料:提取食盐后的海水。 (2)流程:
2.从海水中提取碘 (1)原料:一般从 海产品 (如海带等)中提取。 (2)流程:
三、卤素单质及卤素离子的检验 1.卤素单质的检验
(1)氯气的检验: 黄绿色 气体,能够使湿润的淀粉碘化 钾试纸变 蓝 。 (2)溴单质的检验:深红棕色 液体,能够使湿润的淀粉碘 化钾试纸变 蓝 。 (3)碘单质的检验:遇到淀粉变 蓝 。 2.卤素离子(Cl-、Br-、I-)的检验 (1)AgNO3 溶液/稀 HNO3 法
思维拓展
2.某红棕色蒸气可使湿润的 KI 淀粉试纸变蓝,该气体一
定是溴蒸气吗? 答:不一定。NO2 气体也是红棕色气体,也可使湿润的 淀粉 KI 试纸变蓝。可用 AgNO3 溶液鉴别 NO2 气体和 溴蒸气,通入 AgNO3 溶液产生浅黄色沉淀的为溴蒸气, 不产生沉淀的为 NO2。 3.某无色溶液滴加 AgNO3 溶液,产生黄色沉淀,该溶液 中一定含有 I-或 Br-吗? 答:不一定。PO34-离子可与 Ag+反应生成 Ag3PO4 黄 色沉淀。但 Ag3PO4 可溶于稀 HNO3。
液中提取溴通常所需的主要仪器和方法是
(D )
A.蒸发皿;蒸发后灼热
B.烧杯;冷却、分液
C.分液漏斗;结晶、过滤
D.分液漏斗;加萃取剂,振荡静置后分液
解析 反应停止后,溶液中存在 Br2、NaCl 等溶质,
需选用合适的有机溶剂来提取 Br2。为便于分离可采用 萃取分液操作来完成溴的提取。
( C)
4.某学生为了测定加碘食盐中碘的含量,需要向食盐溶液
中加入碘化钾溶液和稀硫酸,发生如下反应:KIO3+5KI
+3H2SO4===3K2SO4+3I2+3H2O,然后用四氯化碳把碘
单质提取出来,后一过程的操作叫做
(C )
A.蒸馏
B.过滤
C.萃取
D.分液
5.患甲状腺肿大是边远山区常见的地方病,下列元素对该
答案 (1)溶液由无色变为橙色 Cl2+2NaBr===Br2+2NaCl 溶液由无色变为褐色 Br2+2KI===I2+2KBr (2)Cl2>Br2>I2 从海水中提取溴和碘 (3)②④
课时作业
1.欲将食盐固体与碘的混合物分开,最好的方法是( D ) A.溶解、过滤 B.溶解、过滤、蒸发 C.溶解、加 AgNO3 溶解、过滤 D.加热使其升华 解析 方法越简单易行越好。溶解、过滤比较麻烦, 加 AgNO3 会生成其他杂质。因此,直接加热固体,使 碘升华,将碘蒸气收集冷凝,这才是最好的方法。
D
不反应,无 明显现象
不反应,无 明显现象
不能 鉴别
答案 A
2.(1)向溴化钠溶液中通入适量的氯气,产生的现象是 ,
反应的化学方程式是
;向碘化钾溶
液中加入适量的溴水,产生的现象是
,
反应的化学方程式是
。
(2)由上述两个化学反应可知,Cl2、Br2、I2 三种单质氧化
性强弱的关系是
;这样的化学反应
原理,在海水的综合利用中的应用是
(1)试剂瓶①中反应: Cl2+2KBr===2KCl+Br2 现象:无色溶液变为 橙 色。
向上述溶液中加入少量 CCl4,振荡,溶液分两层,上层 无 色,下层 橙红 色。
(2)试剂瓶②中反应: Cl2+2KI===2KCl+I2 现象:无色溶液变为 黄 色。
向上述溶液中加入少量 CCl4,振荡,溶液分两层,上层
。
(3)下列海产品中可以考虑用于工业上大量地提取碘的是
。
①贝壳 ②紫菜 ③鱼 ④海带
解析 Cl2 与 NaBr、Br2 与 KI 反应的化学方程式分别为: ①Cl2+2NaBr===Br2+2NaCl ②Br2+2KI===I2+2KBr, Br2、I2 在水溶液中分别显橙色、褐色。在反应①中 Cl2 是 氧化剂,Br2 是氧化产物,故氧化性 Cl2>Br2。在反应②中 Br2 是氧化剂,I2 是氧化产物,故氧化性 Br2>I2。以适当的 氧化剂将 Br-、I-氧化的化学反应原理可以应用于从海水中 提取溴和碘。 在①贝壳②紫菜③鱼④海带四种海产品中,含碘相对较多的 是紫菜和海带。
2.将氯水注入 KI 溶液中充分反应后,再加入 CCl4,振荡
后静置,看到的现象是 A.液体均一,呈紫红色
(C)
B.液体分两层,上层为紫红色,下层无色
C.液体分两层,下层为紫红色,上层无色
D.液体均一、无色
3.能使溶液中的溴离子增加的是 A.把 Cl2 通入 NaBr 溶液中 B.把溴水滴加到过量的 AgNO3 溶液中 C.把溴水滴加到 NaI 溶液中 D.把溴水滴加到 CCl4 中
随堂训练
1. 稀的碘水和溴水的颜色非常浅,近乎无色。鉴别稀碘水
和稀溴水时,所用的最佳试剂是
()
A.淀粉溶液
B.氯水
C.NaOH 溶液
D.NaBr 溶液
解析
内容指向·联系分析
选项
碘水
溴水
结论
A
变蓝
无明显现象 能够鉴别
B
无明显 现象
C
反应,无 明显现象
无明显 现象
反应,无 明显现象
不能 鉴别
不能 鉴别
第 3 课时 溴、碘的提取
基础梳理
一、溴、碘的性质
1.单质的物理性质及其特性
Br2
色、态
通常状况下为
深红棕 色液体
I2
通常状况下为
紫黑 色固体
溶解 性
微溶于水,易溶于酒精、 四氯化碳 等有机溶剂
微溶于水,易溶于
酒精 、四氯化碳 等
有机溶剂
特性
易 挥发
①易升华 ②淀粉溶 液遇碘变 蓝 色
2.Cl2、Br2、I2 之间的置换反应
