细胞培养基生产企业达标检查标准及实施细则(20171214084025)
培养基国标

培养基国标
培养基的国标,指的是中华人民共和国国家标准(GB)中的细胞培养基标准,全称为《细胞培养基质量标准及检验方法》。
该标准以《中国药典》2010版和《哺乳类动物细胞培养基》(HG/T 3935-2007)行业标准为依据,结合生物制品对细胞培养基原材料的特殊要求制定,增加了牛血清白蛋白残留量、抗生素残留量等检测项目。
该标准分为细胞培养基检验项目和每个项目的检验方法两部分,为评判细胞培养基产品质量提供了依据和方法,从而规范我国细胞培养基行业健康发展。
细胞培养基质量标准及检验方法

细胞培养基质量标准及检验方法中国医药生物技术协会二0一一年四月编写说明一、根据中国医药生物技术协会2010年9月20日组织召开的《动物细胞培养基生产管理及质量控制学术研讨会》纪要,结合我国的实际情况制定本标准。
二、本标准以《中国药典》2010版和《哺乳类动物细胞培养基》(HG/T 3935-2007)行业标准为依据,结合生物制品对细胞培养基原材料的特殊要求制定,增加了牛血清白蛋白残留量、抗生素残留量等检测项目。
三、本标准分为细胞培养基检验项目和每个项目的检验方法两部分,为评判细胞培养基产品质量提供了依据和方法,从而规范我国细胞培养基行业健康发展。
四、结果评定依据本标准和方法对细胞培养基样品进行全项检验,所有项目均符合标准要求,判定该样品为合格;若有一项不符合标准要求,则判定样品为不合格。
细胞培养基质量标准及检验方法一、细胞培养基质量标准细胞培养基质量应符合表1所示的技术要求。
表1 技术要求二、检验方法除非另有说明,检验中仅使用确认为分析纯的试剂和中华人民共和国药典2010年版中规定的纯化水。
澄清度的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版二部附录Ⅸ B进行。
pH值的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版三部附录ⅤA进行。
干燥减量的测定按中华人民共和国药典2010年版三部附录Ⅶ L 干燥失重测定法进行。
渗透压的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版三部附录ⅤH渗透压摩尔浓度测定法进行。
取两次平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于这两个测定值的算术平均值的5%。
细胞培养基质量标准及检验方法

细胞培养基质量标准及检验方法中国医药生物技术协会二0一一年四月编写说明一、根据中国医药生物技术协会2010年9月20日组织召开的《动物细胞培养基生产管理及质量控制学术研讨会》纪要,结合我国的实际情况制定本标准。
二、本标准以《中国药典》2010版和《哺乳类动物细胞培养基》(HG/T 3935-2007)行业标准为依据,结合生物制品对细胞培养基原材料的特殊要求制定,增加了牛血清白蛋白残留量、抗生素残留量等检测项目。
三、本标准分为细胞培养基检验项目和每个项目的检验方法两部分,为评判细胞培养基产品质量提供了依据和方法,从而规范我国细胞培养基行业健康发展。
四、结果评定依据本标准和方法对细胞培养基样品进行全项检验,所有项目均符合标准要求,判定该样品为合格;若有一项不符合标准要求,则判定样品为不合格。
细胞培养基质量标准及检验方法一、细胞培养基质量标准细胞培养基质量应符合表1所示的技术要求。
表1 技术要求二、检验方法除非另有说明,检验中仅使用确认为分析纯的试剂和中华人民共和国药典2010年版中规定的纯化水。
2.1 澄清度的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版二部附录Ⅸ B进行。
2.2 pH值的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版三部附录ⅤA进行。
2.3 干燥减量的测定按中华人民共和国药典2010年版三部附录Ⅶ L 干燥失重测定法进行。
2.4 渗透压的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版三部附录ⅤH渗透压摩尔浓度测定法进行。
取两次平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于这两个测定值的算术平均值的5%。
细胞培养基生产企业质量监控标准及实施细则

细胞培养基生产企业质量监控标准及实施细则简介本文档旨在制定细胞培养基生产企业质量监控标准及实施细则,以确保生产过程中的质量控制和监测。
质量监控标准以下是细胞培养基生产企业质量监控的标准要求:1. 原材料采购:只从合法、可靠的供应商采购经过合规检验的原材料。
2. 生产过程控制:建立严格的生产操作规程,确保每个生产步骤的质量控制。
3. 设备维护和校准:定期维护和校准生产设备,确保其正常运行和准确性。
4. 质量记录和文档:记录生产过程中的关键参数和质量数据,并妥善保存相关文档。
5. 不良品处理:采取适当的措施处置不合格产品,包括隔离、追查原因和预防再次发生。
6. 抽样和检验:定期进行抽样和检验,确保产品符合质量要求。
7. 供应链管理:对供应链进行管理和验证,确保产品的原材料来源可追溯和合规。
实施细则为了落实上述质量监控标准,以下是细胞培养基生产企业应该采取的实施细则:1. 建立质量管理体系:制定适合企业大小和业务特点的质量管理体系,并确保员工熟悉并执行相关规定。
2. 培训与教育:开展定期的培训与教育活动,提高员工的质量意识和操作技能。
3. 风险评估和控制:对可能存在的质量风险进行评估,并采取相应的控制措施进行预防和应对。
4. 内部审核和持续改进:定期进行内部审核,发现问题并采取改进措施,不断提升质量管理水平。
5. 外部审核和认证:积极参与外部审核和认证,提高企业质量管理的公信力和竞争力。
以上质量监控标准和实施细则,将帮助细胞培养基生产企业确保产品质量,提高客户满意度,并符合相关法规和标准要求。
谢谢!。
细胞制剂相关物料管理检查要点和达标要求
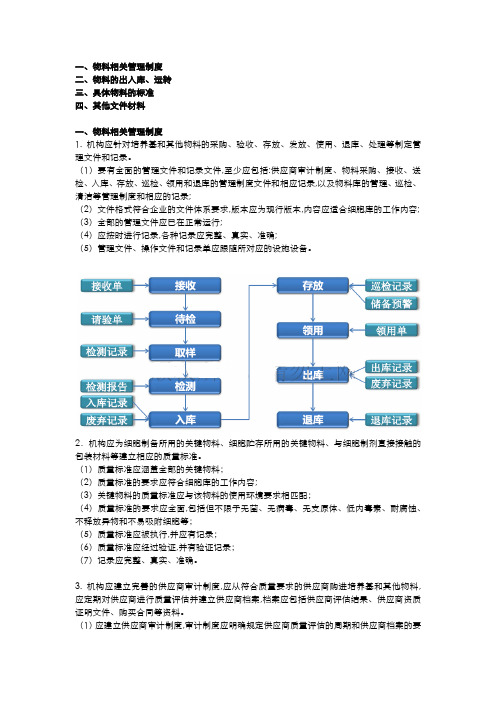
一、物料相关管理制度二、物料的出入库、运转三、具体物料的标准四、其他文件材料一、物料相关管理制度1. 机构应针对培养基和其他物料的采购、验收、存放、发放、使用、退库、处理等制定管理文件和记录。
(1)要有全面的管理文件和记录文件,至少应包括:供应商审计制度、物料采购、接收、送检、入库、存放、巡检、领用和退库的管理制度文件和相应记录,以及物料库的管理、巡检、清洁等管理制度和相应的记录;(2)文件格式符合企业的文件体系要求,版本应为现行版本,内容应适合细胞库的工作内容; (3)全部的管理文件应已在正常运行;(4)应按时进行记录,各种记录应完整、真实、准确;(5)管理文件、操作文件和记录单应跟随所对应的设施设备。
2.机构应为细胞制备所用的关键物料、细胞贮存所用的关键物料、与细胞制剂直接接触的包装材料等建立相应的质量标准。
(1)质量标准应涵盖全部的关键物料;(2)质量标准的要求应符合细胞库的工作内容;(3)关键物料的质量标准应与该物料的使用环境要求相匹配;(4)质量标准的要求应全面,包括但不限于无菌、无病毒、无支原体、低内毒素、耐腐蚀、不释放异物和不易吸附细胞等;(5)质量标准应被执行,并应有记录;(6)质量标准应经过验证,并有验证记录;(7)记录应完整、真实、准确。
3. 机构应建立完善的供应商审计制度,应从符合质量要求的供应商购进培养基和其他物料,应定期对供应商进行质量评估并建立供应商档案,档案应包括供应商评估结果、供应商资质证明文件、购买合同等资料。
(1)应建立供应商审计制度,审计制度应明确规定供应商质量评估的周期和供应商档案的要求;(2)供应商档案应至少包括供应商资质证明文件、购买合同购买记录、不良情况记录、退货记录和供应商评估结果;(3)供应商评估周期应合理,适合细胞库的工作需要;(4)每种关键物料应建立备用供应商清单;(5)供应商审计制度应覆盖全部采购渠道。
二、物料的出入库、运转1. 培养基和其他物料的运输应能满足其质量要求;培养基和其他物料的包装应有标签注明所需的信息,信息应包括但不限于名称、规格、生产厂家、货号、批号、有效期、贮存方式、成分(如适用)等。
细胞培养基生产企业达标检查标准及实施细则

附件1:细胞培养基生产企业达标检查标准及实施细则(征求意见稿)二0一0年十一月编写说明一、根据2010年9月20日《动物细胞培养基生产管理及质量控制学术研讨会纪要》,结合我国的实际情况制定本标准。
二、本标准以2010年新版《药品生产质量管理规范》为依据,结合生物制品对细胞培养基原材料的特殊要求制定。
三、本标准所涉及的生产企业应包括国内细胞培养基生产企业/分装厂及进口细胞培养基在国内的分装企业。
四、本标准共分质量管理、机构与人员、厂房与设施、设备、物料与产品、确认与验证、文件管理、生产管理、质量控制与质量保证、委托生产与委托检验、产品发运与召回、自检等十二个部分,共158项,其中否决项目(△)16项,重要项目(*)74项,一般项目68项。
五、检查中发现不符合要求的项目统称为“缺陷项目”。
其中,重要项目(*)不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”,否决项目(△)不符合要求者称为“否决”。
六、在检查过程中,企业隐瞒有关情况或提供虚假材料的,按否决处理。
检查组应调查取证并详细记录。
七、企业在申请达标检查时还应提交以下资料1、企业营业执照(正本)复印件;2、企业组织机构代码证复印件;3、企业通过权威认证机构进行质量认证的审计报告和认证证书(如ISO9001证书)复印件;4、企业组织机构图;5、企业最近两年的产品清单(不足两年的企业提供所有生产的产品清单)。
八、结果评定1、未发现“否决”,且“严重缺陷”≤10%,且“一般缺陷”≤20%,各类缺陷项目能够立即改正的,企业必须立即改正;不能立即改正的,企业必须提供缺陷整改报告及整改计划,方可通过达标认证。
2、发现“否决”或“严重缺陷”>10%或“一般缺陷”>20%的,不予通过达标认证。
一.质量管理(11项,△1项, *5项)二.机构与人员(12项,△1项,*5项)三.厂房与设施(25项,△2项,* 12项)四.设备(18项,△1项,*6项)五.物料与产品(19项,△2项,*9项)六.确认验证(5项,△1项,* 3项)七.文件管理(14项,△2项,*7项)八.生产管理(22项,△3项,*9项)九.质量控制与质量保证(18项,△2项,*9项)十.委托生产与委托检验(5项,其中*3项)十一.成品发运及投诉处理(6项,△1项,*3项)十二.自检(3项,其中*3项)。
细胞培养基质量标准及检验方法

细胞培养基质量标准及检验方法中国医药生物技术协会二0一一年四月编写说明一、根据中国医药生物技术协会2010年9月20日组织召开的《动物细胞培养基生产管理及质量控制学术研讨会》纪要,结合我国的实际情况制定本标准。
二、本标准以《中国药典》2010版与《哺乳类动物细胞培养基》(HG/T 3935-2007)行业标准为依据,结合生物制品对细胞培养基原材料的特殊要求制定,增加了牛血清白蛋白残留量、抗生素残留量等检测项目。
三、本标准分为细胞培养基检验项目与每个项目的检验方法两部分,为评判细胞培养基产品质量提供了依据与方法,从而规范我国细胞培养基行业健康发展。
四、结果评定依据本标准与方法对细胞培养基样品进行全项检验,所有项目均符合标准要求,判定该样品为合格;若有一项不符合标准要求,则判定样品为不合格。
细胞培养基质量标准及检验方法一、细胞培养基质量标准细胞培养基质量应符合表1所示的技术要求。
表1 技术要求二、检验方法除非另有说明,检验中仅使用确认为分析纯的试剂与中华人民共与国药典2010年版中规定的纯化水。
2、1 澄清度的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共与国药典2010年版二部附录Ⅸ B进行。
2、2 pH值的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共与国药典2010年版三部附录ⅤA进行。
2、3 干燥减量的测定按中华人民共与国药典2010年版三部附录Ⅶ L 干燥失重测定法进行。
2、4 渗透压的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共与国药典2010年版三部附录ⅤH渗透压摩尔浓度测定法进行。
取两次平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于这两个测定值的算术平均值的5%。
细胞培养板检测标准

细胞培养板检测标准细胞培养板是细胞培养实验中常用的携带培养基的基质,用于支持和促进细胞的生长和增殖。
为了确保实验结果的准确性和可重复性,细胞培养板的质量控制至关重要。
本文将介绍细胞培养板的检测标准,以确保在细胞培养实验中获得可靠的结果。
一、外观检查细胞培养板的外观检查是初步评估其质量的重要步骤。
正常的细胞培养板应该是透明的,无明显的瑕疵或污染物。
在光线充足的环境下,仔细观察细胞培养板的表面和侧壁,确保无脏污、变色、裂纹或其他影响实验的问题存在。
二、无菌检测细胞培养实验要求无菌条件,因此,细胞培养板的无菌性是必须验证的。
常用的方法是通过培养基接种实验或无菌测试纸评估其无菌状态。
在培养基接种实验中,将细菌或真菌接种于细胞培养板中,然后在适当的培养条件下观察生长情况。
如果培养基无菌,则观察期间不应有任何菌落的出现。
无菌测试纸可以直接放置在细胞培养板内,检测是否会有颜色的发生,用于判断是否存在细菌或真菌的污染。
三、细胞附着性检测细胞附着性是细胞生长的关键步骤,因此,细胞培养板的表面特性对细胞的附着能力至关重要。
常用的检测方法包括浸润角测量、水接触角测量和比色法。
浸润角测量通过观察液体滴在细胞培养板表面的形态以评估其亲水性或疏水性。
水接触角测量可以进一步量化评估,水滴在细胞培养板表面上形成的角度。
比色法可以用于评估附着细胞数量,通过细胞染色和比色分析,确定细胞在细胞培养板上的附着情况。
四、毒性测试细胞培养板材料的毒性是一个必须要考虑的因素。
细胞培养板不应对细胞产生有害影响。
常用的毒性测试方法包括MTT(3-(4,5-二甲基-2-噻唑酰胺基)-2,5-二苯基四唑)试验和细胞增殖试验。
MTT试验通过将MTT溶液加入培养基中,根据细胞的代谢活性生成紫色的产物,然后通过比色分析测定代谢活性水平。
细胞增殖试验则通过比较在培养板中不同时间点的细胞数量来评估细胞的毒性。
五、蛋白吸附检测细胞培养板的表面会与细胞外基质或血清中的蛋白质接触,因此,细胞培养板的蛋白吸附性也是需要评估的一个因素。
细胞培养基质量标准及检验方法

细胞培养基质量标准及检验方法中国医药生物技术协会二0一一年四月编写说明一、根据中国医药生物技术协会2010年9月20日组织召开的《动物细胞培养基生产管理及质量控制学术研讨会》纪要,结合我国的实际情况制定本标准。
二、本标准以《中国药典》2010版和《哺乳类动物细胞培养基》(HG/T 3935-2007)行业标准为依据,结合生物制品对细胞培养基原材料的特殊要求制定,增加了牛血清白蛋白残留量、抗生素残留量等检测项目。
三、本标准分为细胞培养基检验项目和每个项目的检验方法两部分,为评判细胞培养基产品质量提供了依据和方法,从而规范我国细胞培养基行业健康发展。
四、结果评定依据本标准和方法对细胞培养基样品进行全项检验,所有项目均符合标准要求,判定该样品为合格;若有一项不符合标准要求,则判定样品为不合格。
细胞培养基质量标准及检验方法一、细胞培养基质量标准细胞培养基质量应符合表1所示的技术要求。
表1 技术要求二、检验方法除非另有说明,检验中仅使用确认为分析纯的试剂和中华人民共和国药典2010年版中规定的纯化水。
澄清度的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版二部附录Ⅸ B进行。
pH值的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版三部附录ⅤA进行。
干燥减量的测定按中华人民共和国药典2010年版三部附录Ⅶ L 干燥失重测定法进行。
渗透压的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版三部附录ⅤH渗透压摩尔浓度测定法进行。
取两次平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于这两个测定值的算术平均值的5%。
培养基质量测试的方法

培养基质量测试的方法
培养基质量测试的方法主要包括以下步骤:
1. 直观性状的检查:检查培养基的色泽、澄明度、PH值和硬度。
颜色通常不会太深,以避免影响微生物的正常生长和繁殖,并且也不便于观察实验结果。
如果含有指示剂,则还要检查其颜色是否正常。
液体要确保无沉淀,如果是固体应该保证没有絮状物或者沉淀。
每种微生物对PH值的要求不同,只有在适宜的PH环境中微生物才能更好的生长繁殖。
对于固体要检查其软硬度是否合适,包括半固体和半流体。
2. 无菌检查:所有的培养基都需要进行无菌检查,以确保没有微生物污染。
无菌检查合格后才能使用。
3. 性能检查:采用稳定的标准菌株进行性能试验,包括微生物繁殖、分离和鉴别等。
合格后才可以使用。
以上是培养基质量测试的步骤,如需了解更多信息,建议咨询微生物学专家或查阅相关文献资料。
细胞培养基生产企业达标检查标准及实施细则

附件1:细胞培养基生产企业达标检查标准及实施细则(征求意见稿)二0一0年十一月编写说明一、根据2010年9月20日《动物细胞培养基生产管理及质量控制学术研讨会纪要》,结合我国的实际情况制定本标准。
二、本标准以2010年新版《药品生产质量管理规范》为依据,结合生物制品对细胞培养基原材料的特殊要求制定。
三、本标准所涉及的生产企业应包括国内细胞培养基生产企业/分装厂及进口细胞培养基在国内的分装企业。
四、本标准共分质量管理、机构与人员、厂房与设施、设备、物料与产品、确认与验证、文件管理、生产管理、质量控制与质量保证、委托生产与委托检验、产品发运与召回、自检等十二个部分,共158项,其中否决项目(△)16项,重要项目(*)74项,一般项目68项。
五、检查中发现不符合要求的项目统称为“缺陷项目”。
其中,重要项目(*)不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”,否决项目(△)不符合要求者称为“否决”。
六、在检查过程中,企业隐瞒有关情况或提供虚假材料的,按否决处理。
检查组应调查取证并详细记录。
七、企业在申请达标检查时还应提交以下资料1、企业营业执照(正本)复印件;2、企业组织机构代码证复印件;3、企业通过权威认证机构进行质量认证的审计报告和认证证书(如ISO9001证书)复印件;4、企业组织机构图;5、企业最近两年的产品清单(不足两年的企业提供所有生产的产品清单)。
八、结果评定1、未发现“否决”,且“严重缺陷”≤10%,且“一般缺陷”≤20%,各类缺陷项目能够立即改正的,企业必须立即改正;不能立即改正的,企业必须提供缺陷整改报告及整改计划,方可通过达标认证。
2、发现“否决”或“严重缺陷”>10%或“一般缺陷”>20%的,不予通过达标认证。
一.质量管理(11项,△ 1项, *5项)二.机构与人员(12项,△ 1项,*5项)三.厂房与设施(25项,△2项,* 12项)四.设备(18项,△1项,*6项)五.物料与产品(19项,△2项, *9项)六.确认验证(5项,△1项,* 3项)七.文件管理(14项,△2项,*7项)八.生产管理(22项,△ 3项,*9项)九.质量控制与质量保证(18项,△2项,*9项)十.委托生产与委托检验(5项,其中*3项)十一.成品发运及投诉处理(6项,△1项,*3项)十二.自检(3项,其中*3项)。
细胞培养基质量标准及检验方法

细胞培养基质量标准及检验方法中国医药生物技术协会二0一一年四月编写说明一、根据中国医药生物技术协会2010年9月20日组织召开的《动物细胞培养基生产管理及质量控制学术研讨会》纪要,结合我国的实际情况制定本标准。
二、本标准以《中国药典》2010版和《哺乳类动物细胞培养基》(HG/T 3935-2007)行业标准为依据,结合生物制品对细胞培养基原材料的特殊要求制定,增加了牛血清白蛋白残留量、抗生素残留量等检测项目。
三、本标准分为细胞培养基检验项目和每个项目的检验方法两部分,为评判细胞培养基产品质量提供了依据和方法,从而规范我国细胞培养基行业健康发展。
四、结果评定依据本标准和方法对细胞培养基样品进行全项检验,所有项目均符合标准要求,判定该样品为合格;若有一项不符合标准要求,则判定样品为不合格。
细胞培养基质量标准及检验方法一、细胞培养基质量标准细胞培养基质量应符合表1所示的技术要求。
表1 技术要求二、检验方法除非另有说明,检验中仅使用确认为分析纯的试剂和中华人民共和国药典2010年版中规定的纯化水。
澄清度的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版二部附录Ⅸ B进行。
pH值的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版三部附录ⅤA进行。
干燥减量的测定按中华人民共和国药典2010年版三部附录Ⅶ L 干燥失重测定法进行。
渗透压的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。
按中华人民共和国药典2010年版三部附录ⅤH渗透压摩尔浓度测定法进行。
取两次平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于这两个测定值的算术平均值的5%。
培养基配制及适用性检查实用标准操作规程

目的:建立培养基配制及适用性检查的标准操作规程,规范实验人员的操作流程。
范围:适用于微生物检验人员对培养基的规范管理。
依据:《药品生产质量管理规范(2010年修订)》、《中华人民共和国药典》2015年版第四部职责:1.微生物检验员:负责实验室所需求的培养基管理工作,使日常检验可以顺利进行。
2.微生物检验主管:负责对日常配制培养基的规范操作进行监督。
内容1 培养基的申购根据检验项目、工作量和工作进度的需求,提前一个月进行所需的培养基申购。
申购时需指定培养基供应商,必要时进行供应商审计。
2 培养基的验收2.1 培养基到货后,微生物室检验员应进行验收。
验收内容包括核对品名、数量、规格、生产厂商,应与申购单一致;检查培养基包装有无破损、包装是否完整、产品是否在有效期内。
2.2 验收合格后,登记于《培养基领用台账》(附记录文件编号:SMP-10-QC-009-02(00))。
3 培养基的贮藏3.1未开封的脱水培养基贮存于阴凉室,使培养基处于低温、干燥、和避光条件下。
已开封的脱水培养基应盖紧,贮存于阴凉库。
3.2灭菌好的培养基应进行预培养72h检查无菌后,置4~8℃冷藏保存待用。
灭菌后培养基储存期为7天。
4 培养基的配制4.1培养基的配制和使用应填写《培养基配制及使用记录》(附记录文件编号:SMP-10-QC-009-02(00))。
4.2培养基配制批号原则:原材料批号-配制日期:比如2011年1月1日配制的培养基,培养基干粉批号000000,配制批号为:000000-110101。
配制好的培养基贴《培养基标签》(附记录文件编号:R-SMP-10-QC-009-03)。
(注:同一天同一培养基配置多次的,在原批号后加“-”加“数字”表示,如000000-110101-01)4.3培养基配制方法4.3.1 使用商品化脱水合成培养基时,应严格按照厂商提供的使用说明配制,如重量/体积、pH、灭菌条件和操作步骤等。
实验室使用各种基础成分制备培养基时,应按照配方准确配制,并记录相关信息如:培养基名称和类型及试剂级别,每个成分物质含量、制造商、批号,pH值,培养基体积/分装体积,灭菌条件(灭菌方式、温度及时间),配制日期、人员等,以便溯源。
细胞培养基检验项目及检验方法 - 中国医药生物技术协会

附件2:细胞培养基质量标准及检验方法(征求意见稿)二0一0年十一月编写说明一、根据中国医药生物技术协会2010年9月20日组织召开的《动物细胞培养基生产管理及质量控制学术研讨会》纪要,结合我国的实际情况制定本标准。
二、本标准以《哺乳类动物细胞培养基》(HG/T 3935-2007)行业标准为依据,结合生物制品对细胞培养基原材料的特殊要求制定,增加了细胞培养基安全性检测项目。
三、本标准分为细胞培养基检验项目和每个项目的检验方法两部分,为评判细胞培养基产品质量提供了依据和方法,从而规范我国细胞培养基行业健康发展。
四、结果评定依据本标准和方法对细胞培养基样品进行全项检验,所有项目均符合标准要求,判定该样品为合格;若有一项不符合标准要求,则判定样品为不合格。
细胞培养基质量标准及检验方法一、细胞培养基质量标准动物细胞培养基质量应符合表1所示的技术要求。
表1 技术要求注:细胞生长试验应根据细胞培养基种类选择相应的检测用细胞。
二、检验方法除非另有说明,检验中仅使用确认为分析纯的试剂和中华人民共和国药典2010年版中规定的纯化水。
2.1 澄清度的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水1 000ml,搅拌至溶解。
按中华人民共和国药典2010年版二部附录Ⅸ B进行。
2.2 pH值的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水1 000ml,搅拌至溶解。
按中华人民共和国药典2010年版附录Ⅵ H进行。
2.3 干燥减量的测定按中华人民共和国药典2010年版二部附录Ⅷ L 干燥失重测定法进行。
2.4 渗透压的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水1 000ml,搅拌至溶解。
按中华人民共和国药典2010年版二部附录Ⅸ G 渗透压摩尔浓度测定法进行。
取两次平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于这两个测定值的算术平均值的5%。
2.5 细菌内毒素的测定按中华人民共和国药典2010年版附录Ⅺ E 细菌内毒素检查法中的凝胶法进行。
培养基生产标准

培养基生产标准培养基是微生物学实验中常用的一种培养基质,它提供了微生物生长所需的营养物质和环境条件。
培养基的质量对于实验结果的准确性和可重复性至关重要。
因此,制定一套严格的培养基生产标准是非常必要的。
首先,培养基生产的原材料需要选择优质的成分。
常见的培养基成分包括碳源、氮源、矿物质和生长因子等。
这些成分应该符合国家相关标准,且具有较高的纯度和活性。
在选择原材料时,需要注意避免使用可能含有抗生素、重金属或其他有害物质的成分,以免对微生物生长产生干扰。
其次,培养基的配制需要按照一定的比例和步骤进行。
首先,需要准确称量各种原材料,并按照配方比例加入适量的水中。
在配制过程中,需要注意溶解度和稳定性,避免出现沉淀或析出现象。
同时,还需要注意搅拌均匀,以确保各种成分充分混合。
在配制过程中,需要保持清洁卫生,避免外界污染对培养基质量的影响。
第三,培养基生产过程中需要进行无菌操作。
无菌操作是保证培养基质量的重要环节。
在培养基配制完成后,需要对其进行高温高压灭菌处理,以杀灭其中可能存在的细菌、真菌和病毒等微生物污染物。
同时,在无菌操作过程中,需要使用无菌器皿和工具,并采取适当的防护措施,确保无菌条件下进行。
最后,培养基生产后需要进行质量检验和包装。
质量检验包括外观检查、pH值测定、菌落计数等。
外观检查主要是观察培养基是否均匀透明、无沉淀或异物等。
pH值测定是为了确保培养基的酸碱度符合要求。
菌落计数是为了确定培养基中微生物的数量。
在包装过程中,需要使用无菌容器,并在包装前对容器进行高温高压灭菌处理,以确保产品的无菌性。
总之,制定一套严格的培养基生产标准对于保证培养基质量具有重要意义。
通过选择优质原材料、严格配制、无菌操作和质量检验等环节,可以保证培养基的稳定性和可靠性,为微生物学实验提供可靠的支持。
只有在符合标准的培养基上进行实验,才能获得准确可靠的实验结果。
细胞制剂相关物料管理检查要点和达标要求

细胞制剂相关物料管理检查要点和达标要求一、物料相关管理制度二、物料的出入库、运转三、具体物料的标准四、其他文件材料一、物料相关管理制度1.机构应针对培养基和其他物料的采购、验收、存放、发放、使用、退库、处理等制定管理文件和记录。
1)要有全面的管理文件和记录文件,至少应包括:供应商审计制度、物料采购、接收、送检、入库、存放、巡检、领用和退库的管理制度文件和相应记录,以及物料库的管理、巡检、清洁等管理制度和相应的记录;2)文件格式符合企业的文件体系要求,版本应为现行版本,内容应适合细胞库的工作内容;(3)全部的管理文件应已在正常运行;4)应按时进行记录,各种记录应完整、真实、准确;5)管理文件、操作文件和记录单应跟随所对应的设施设备。
2.机构应为细胞制备所用的关键物料、细胞贮存所用的关键物料、与细胞制剂直接接触的包装材料等建立相应的质量标准。
1)质量标准应涵盖全部的关键物料;2)质量标准的要求应符合细胞库的工作内容;3)关键物料的质量标准应与该物料的利用环境要求相匹配;4)质量标准的要求应周全,包孕但不限于无菌、无病毒、无支原体、低内毒素、耐腐蚀、不释放异物和不容易吸附细胞等;5)质量标准应被执行,并应有记录;6)质量标准应经过验证,并有验证记录;7)记录应完全、实在、准确。
3.机构应建立完善的供应商审计制度,应从符合质量要求的供应商购进培养基和其他物料,应定期对供应商进行质量评估并建立供应商档案,档案应包括供应商评估结果、供应商资质证明文件、购买合同等资料。
1)应建立供应商审计制度,审计制度应明确规定供应商质量评估的周期和供应商档案的要求;2)供应商档案应至少包括供应商资质证明文件、购买合同购买记录、不良情况记录、退货记录和供应商评估结果;3)供应商评估周期应合理,适合细胞库的事情需要;4)每种关键物料应建立备用供应商清单;5)供应商审计制度应覆盖全部采购渠道。
二、物料的出入库、运转1.培养基和其他物料的运输应能满足其质量要求;培养基和其他物料的包装应有标签注明所需的信息,信息应包括但不限于名称、规格、生产厂家、货号、批号、有效期、贮存方式、成分(如适用)等。
细胞培养基检验项目及检验方法 - 中国医药生物技术协会

附件2:细胞培养基质量标准及检验方法(征求意见稿)二0一0年十一月编写说明一、根据中国医药生物技术协会2010年9月20日组织召开的《动物细胞培养基生产管理及质量控制学术研讨会》纪要,结合我国的实际情况制定本标准。
二、本标准以《哺乳类动物细胞培养基》(HG/T 3935-2007)行业标准为依据,结合生物制品对细胞培养基原材料的特殊要求制定,增加了细胞培养基安全性检测项目。
三、本标准分为细胞培养基检验项目和每个项目的检验方法两部分,为评判细胞培养基产品质量提供了依据和方法,从而规范我国细胞培养基行业健康发展。
四、结果评定依据本标准和方法对细胞培养基样品进行全项检验,所有项目均符合标准要求,判定该样品为合格;若有一项不符合标准要求,则判定样品为不合格。
细胞培养基质量标准及检验方法一、细胞培养基质量标准动物细胞培养基质量应符合表1所示的技术要求。
表1 技术要求注:细胞生长试验应根据细胞培养基种类选择相应的检测用细胞。
二、检验方法除非另有说明,检验中仅使用确认为分析纯的试剂和中华人民共和国药典2010年版中规定的纯化水。
2.1 澄清度的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水1 000ml,搅拌至溶解。
按中华人民共和国药典2010年版二部附录Ⅸ B进行。
2.2 pH值的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水1 000ml,搅拌至溶解。
按中华人民共和国药典2010年版附录Ⅵ H进行。
2.3 干燥减量的测定按中华人民共和国药典2010年版二部附录Ⅷ L 干燥失重测定法进行。
2.4 渗透压的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水1 000ml,搅拌至溶解。
按中华人民共和国药典2010年版二部附录Ⅸ G 渗透压摩尔浓度测定法进行。
取两次平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于这两个测定值的算术平均值的5%。
2.5 细菌内毒素的测定按中华人民共和国药典2010年版附录Ⅺ E 细菌内毒素检查法中的凝胶法进行。
细胞培养基检验项目及检验方法 - 中国医药生物技术协会

附件2:细胞培养基质量标准及检验方法(征求意见稿)二0一0年十一月编写说明一、根据中国医药生物技术协会2010年9月20日组织召开的《动物细胞培养基生产管理及质量控制学术研讨会》纪要,结合我国的实际情况制定本标准。
二、本标准以《哺乳类动物细胞培养基》(HG/T 3935-2007)行业标准为依据,结合生物制品对细胞培养基原材料的特殊要求制定,增加了细胞培养基安全性检测项目。
三、本标准分为细胞培养基检验项目和每个项目的检验方法两部分,为评判细胞培养基产品质量提供了依据和方法,从而规范我国细胞培养基行业健康发展。
四、结果评定依据本标准和方法对细胞培养基样品进行全项检验,所有项目均符合标准要求,判定该样品为合格;若有一项不符合标准要求,则判定样品为不合格。
细胞培养基质量标准及检验方法一、细胞培养基质量标准动物细胞培养基质量应符合表1所示的技术要求。
表1 技术要求注:细胞生长试验应根据细胞培养基种类选择相应的检测用细胞。
二、检验方法除非另有说明,检验中仅使用确认为分析纯的试剂和中华人民共和国药典2010年版中规定的纯化水。
2.1 澄清度的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水1 000ml,搅拌至溶解。
按中华人民共和国药典2010年版二部附录Ⅸ B进行。
2.2 pH值的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水1 000ml,搅拌至溶解。
按中华人民共和国药典2010年版附录Ⅵ H进行。
2.3 干燥减量的测定按中华人民共和国药典2010年版二部附录Ⅷ L 干燥失重测定法进行。
2.4 渗透压的测定称取每升标示量的实验室样品,置于1 000ml烧杯中,加水1 000ml,搅拌至溶解。
按中华人民共和国药典2010年版二部附录Ⅸ G 渗透压摩尔浓度测定法进行。
取两次平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于这两个测定值的算术平均值的5%。
2.5 细菌内毒素的测定按中华人民共和国药典2010年版附录Ⅺ E 细菌内毒素检查法中的凝胶法进行。
