化学反应工程知识点梳理
(完整word版)化学反应工程学知识点总结

第一章1、过程工业:以物质转化为核心2、装置与产品制造工业:以物件的加工和组装为核心3、化工过程:原料获取(预处理)、化学反应过程、产品分离和提纯4、本科目研究的对象:以工业规模进行化学反应过程,目的:实现工业反应过程的优化5、实现工业反应过程的优化分两类:设计优化、操作优化6、反应过程优化的技术指标:反应速率、反应选择率、反应收率、能量消耗7、决策变量:结构变量、操作方式、工艺条件(结构变量:反应器类型,单相:均相管式反应器和均相釜式反应器,两相,:固定床反应器,液化床,气液相反应器,三相:)(操作方式:间歇、连续、半连续,加料方式:一次性、分批加料、分段加料)8、化学反应工程研究的内容:1化学反应过程(容积、表面反应过程)1、物理传递过程(反混合不均匀性、传质过程、传热过程)9、研究方法(数学模型法):数学表达式即动力学方程式(一反)、物料、热量、动量衡算式(三传)、参数计算式10、数学模型法基本特征:过程分解、过程简化第二章1、化学反应动力学是研究化学反应速率和机理的科学2、本征动力学(微观):排除物理过程,表观动力学(宏观):包含物理过程3、反应速率定义:反应量/(反应时间)(反应区)4、均相前提:分子尺度上混合均匀、特征:无物理过程5、复杂反应(可逆反应、自催化反应、平行反应、串联反应)6、固体催化剂的组成及活化:特点:活性、选择性、稳定性,组成:活性成分、载体、助催化剂,活化:还原。
7、化学反应过程分为:容积反应过程、表面反应过程8、气固相催化反应过程包括:(内、外)扩散过程、表面反应过程9、吸附模型:理想吸附模型、真实吸附模型10、反应级数的工程意义是:表示反应速率对于反应物浓度变化的敏感程度11、气液非均相反应过程的反应区取法分为:选用液相体积、选用反应器体积12、在包含物理过程影响下测得的反应速率称为表观反应速率。
13、物理传质过程与化学反应过程串联时,通常是慢一步速率的决定表现反应速率(过程速率的控制步骤)14、均相反应动力学是研究反应在同一项中进行的规律性.15、工程上实际的均相反应应满足两个条件:反应系统可以成为均相、预混合过程的时间远小于反应时间吸附分为物理、化学吸附16、化学吸附可分为:活化化学吸附、非活化化学吸附17、化学反应速率特征可以概括地表示为反应速率的浓度效应、温度效应18、基本的物理过程有:返混、传质、传热19、气固相催化反应是指气体在固体催化剂上进行的催化反应第三章1、反应器设计的基本内容:选择合适的反应器类型、确定最佳工艺条件、计算反应器体积2、反应器设计的基本方程包括反应动力学方程式、物料衡算方程式、热量衡算方程式、动量衡算方程式3、物料衡算和反应速率式式描述反应器性能的两个最基本的方程式4、辅助时间是指装料、升温、降温、卸料、清洗时间的总和5、反应后期转化问题的严重程度顺序是:二级>一级>零级6、反应物同时进行两个或两个以上的反应成为平行反应7、平行反应选择率的温度效应是:高温度有利于活化能高的反应8、串联反应:反应物能进一步反应生成其他副产物的反应9、间歇反应器的反应体积是指反应物在反应器中所占的体积第四章1、反应前后物料浓度变化不明显:衡容反应系统2、表征反应前后分子数变化程度的方法的有:膨胀率发、膨胀因子法3、膨胀率¢的定义是指反应组分全部转化后系统体积变化的分率第五章1、全混流:釜式反应器中,一边连续加料、另一边连续出料2、返混:停留时间不同物料的混合3、造成返混的原因:设备中存在不同尺度的环流、不均匀的速度分布4、限制返混的主要措施:分割(横向、纵向)5、连续釜反应器特点:反应物料浓度降低至出料水平,降低了反应速度6、返混是连续化反应时伴生的现象,原因是空间的反向运动和不均匀速度分布第六章1、混合现象:宏观、微观混合2示踪物的输入方法有阶跃注入法、脉冲注入法、周期注入法3、连续反应过程的考察方法:以反应器、反应物料为对象的的考察方法4、非理想流动模型分为:数学模型方法、扩散模型(适合于返混程度较小的非理想流动模型)、多级全混流模型。
化学反应工程知识点梳理
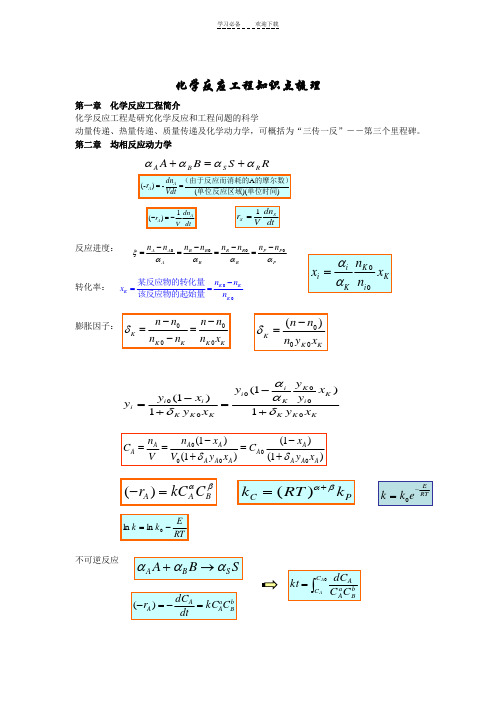
化学反应工程知识点梳理第一章化学反应工程简介化学反应工程是研究化学反应和工程问题的科学动量传递、热量传递、质量传递及化学动力学,可概括为“三传一反”--第三个里程碑。
第二章均相反应动力学反应进度:转化率:膨胀因子:不可逆反应A(-)-()()AAdnrVdt==(由于反应而消耗的的摩尔数)单位反应区域单位时间RSBARSBAαααα+=+1()AAdnrV dt-=-dtdnVr SS1=PPPRRRBBBAAAnnnnnnnnααααξ0-=-=-=-=K KKKn nxn-==某反应物的转化量该反应物的起始量KiKKiixnnxαα=0000KK K K Kn n n nn n n xδ--==-00()KK Kn nn y xδ-=KKKKiKKiiKKKiii xyxyyyxyxyy1)1(1)1(δααδ+-=+-=000(1)(1)(1)(1)A AA AA AA A A A A An xn xC CV V y x y xδδ--===++()A A Br kC Cαβ-=()C Pk RT kαβ+=ERTk k e-=RTEkk-=lnlnSBASBAααα→+bBaAAACkCdtdCr=-=-)(⎰=0AACC bBaAACCdCkt均相催化反应 CC 为催化剂浓度自催化反应A + C → 2C + R …串联反应总收率瞬时收率得率yield总选择性 目的产物P 所生成的摩尔数与副产物S 生成的摩尔数之比,用S0表示:平行反应串联反应()()AA C A dC r kC C dt-=-=CA A A C kCdt dCr =-=-)(A + B P R+S 00PP P A A n n n n -Φ=-/()/p P P A A A r dC dt dC P A r dC dt dC φ====---单位时间内生成的摩尔数单位时间内消耗的摩尔数00/)(A P P P n n n X -=000PP S S n n S n n -=-αA2A αS S (副)αA1A αP P (主),11A A r k C -=(),22A A r k C -=(),1,212()()AA A A A dC r r r k k C dt-=-+-=+=()()A A P A A p P P C k r dt dC r 11,1,1,)(αααα-=--==AA S S S C k dt dC r 22,αα-==tk k A A eC C )(021+-=A P S (均为一级反应)k 1k 2P A P P C k C k dt dC r 21-==PSS C k dt dC r 2==第三章 理想均相反应器 间歇反应器(BSTR)反应时间实际操作时间(operating time)= 反应时间(t) + 辅助时间auxiliary time (t') 反应体积V 是指反应物料在反应器中所占的体积 V = v0 (t + t')为装料系数(the volume charge coefficient),通常在0.4~0.85平推流反应器PFR 空时全混流反应器(CSTR)绝热操作恒容间歇反应器的设计式为:变温平推流反应器⎰⎰--=-=A A A C C A Ax A A A r dC r dx C t 0)()(00等容过程,液相反应 VV ϕ=实际实际的反应器体积为:0V v τ==反应器的容积进料的体积流量0R V dV t v ==⎰反应器中物料反应期的容积的体积流量000()()A A A AA A C C C x V v r r τ-===--0()A A A x V F r =-005000024R R R F v C M ==⨯00000000()(1)A A A A A A x x x A AA A A A E nx x x n n A ART A A dx dx dx t C C C r kC k e C x -===--⎰⎰⎰1001()A A x A A n xA t I x dx k C -=⎰20()()4A A A P A F dx r dV r D dl π=-=-20()4A A A dx D r dl F π-=00000()A x A A A A A dx V V F r v C C τ===-⎰化学反应工程研究的目的是实现工业化学反应过程的优化 全混流平推流多级CSTR 串联的优化对于一级不可逆反应应有PFR: 同间歇釜CSTR:全混流反应器的热衡算方程第四章 非理想流动 停留时间分布()⎰-==A x AAA B A B r dx C t F V 000BR : ()⎰-==Ax A AA P A P r dxCF V 000τPF R: ()000m m A A A A V x F C r τ-==-CST R: 112100010200...(1)(1)(1)Am Am A A A R A A A A A A Am x x x x x V v C kC x kC x kC x -⎛⎫---=+++ ⎪---⎝⎭0121110(1,2,.....1)(1)1Ai RAi Ai Ai v x V i m x k x x -+⎡⎤-∂=-==-⎢⎥∂--⎣⎦11111Ai Ai Ai Ai Ai Ai x xx x x x -++--=--221max 1max 02()k k k P P A C k X C k -==max max 1202211[(/)1]P P A C X C k k ==+1212ln(/)opt k k k k τ=-121opt k k τ=)()1())((0000Pm P P r A c v UAT T c v UA T c v H r V ρρρ+-+=∆--)()1(000P m P r c v UAT T c v UAT Q ρρ+-+= (){}E t P t residence time t t ∆=<<+停留时间分布函数 (){}=<F t P residence time t方差PFRCSTR最大层流流动 轴向扩散模型 0()()d t F t E t t=⎰22222()()()()()()t t t E t dtt t E t dt t E t dt tE t dtσ∞∞∞∞-==-=-⎰⎰⎰⎰0 t t () t t 0 t t E t <⎧⎪=∞=⎨⎪>⎩2220()()()0t t t E t dt t t σ∞=-=-=⎰0 t t () 1 t tF t <⎧=⎨≥⎩()11()t tt tF t e E t et---=-=222 1.0ttθσσ==22()()[2()]r r F t R R =-222/222()2()(1)212()(1)Z t uL E z z Pe tE Ee uL uL e Pe Peθσσ--==--=--。
化学反应工程知识点1~3讲义

知识点1.绪论一、主要讲解内容介绍化学反应工程相关的基本知识,包括化学反应工程的定义、化学反应工程学科的发展、化学反应工程的任务、化学反应工程和其他学科的关系。
二、学习要求本章要求学生能够掌握化学反应工程的定义,明确化学反应工程的任务。
三、视频(已录制完成)四、讲义1.1化学反应工程的定义在工业规模上开发和应用化学反应的工程活动。
1.2化学反应工程学科的发展自然界的物质的运动或变化过程由物理或化学的两类,物理过程不牵涉化学反应,但化学过程却总是与物理因素有着紧密联系。
所以化学反应过程是物理与化学两类因素综合体。
远溯古代,陶瓷制作、酿酒等工艺,但直到本世纪五十年代一直还未形成一门专门研究的独立学科,到1957年举行的第一次欧洲反应工程会议上确立了这一学科的名称。
1.3 化学反应工程的任务化学反应工程学是一门研究化学反应的工程问题的科学,既以化学反应作为研究对象,又以工程问题为研究对象,把二者结合起来的学科体系。
其主要任务包括:分析化学反应的特点、确定合适的反应条件;选择合适的反应器并对其进行最优化设计;对反应器进行最优操作和控制。
1.4 化学反应工程和其他学科的关系a. 数学,微积分、方程的解析求解和数值求解、极值问题等,均是化学反应工程问题求解的基础。
b. 反应动力学:专门阐明学反应速率与各项物理因素(如温度、压力、催化剂等)之间的定量关系。
为实现某一反应,要选定合易的条件及反应器的结构型式、尺寸和处理能力等,这些都依赖于对反应动力学特性的认识。
c. 化工热力学:确定物系的各种物性常数(热容、研所引资、反应热等),看化学反应是否能进行及其反应程度。
为化学反应工程提供反应热、反应平衡常数等基础数据。
d. 催化作用e. 传递工程和流体力学:装置中有动量、热量、质量传递(三传),当规模放大时,出现放大效应。
“三传一反”是三传和反应动力学。
五、小结本章介绍了化学反应工程的定义、学科的发展、任务极其与数学、化工热力学、催化作用及传递工程等学科之间的密切关系。
化学反应工程知识点回顾

化学反应⼯程知识点回顾第⼀章知识点1.化学反应⼯程学的范畴和任务2.化学反应⼯程学的基本⽅法3.化学反应⼯程学的学科系统和编排第⼆章均相反应动⼒学基础知识点 1、概念:①化学计量⽅程:反应物 - ,产物 + ②化学反应速率等温定容反应dtdc r AA -=-反应速率之⽐等于各计量系数的⽐值。
③反应转化率反应程度膨胀因⼦δA 关键组分A 的膨胀因⼦物理意义:每反应掉⼀个摩尔A 所引起反应体系总摩尔数的变化量。
④反应速率⽅程:反应级数 a 、b 由实验确定 k 遵循Arrhenius ⽅程i α1A A dn r V dt-=-00-=K KK K n n x n 0kk k n nξα-=1sii A A αδα==∑a bA AB r kC C -=2、单⼀反应的速率⽅程重点:求取动⼒学参数 1)不可逆反应微分⽅程: 积分⽅程: 2)可逆反应微分⽅程: 反应平衡时: 3)均相催化反应微分⽅程积分⽅程4)⾃催化反应当C A = C M0/2 时,反应速率最⼤ 3、复合反应:平⾏反应串联反应总收率选择性exp[]a E k k RT=-a bA A A BdC r kC C dt-==-0A A C Aa b C ABdC kt C C =?'A A A SdC r kC k C dt-=-=-0A Ae Se r kC k C '-=-=()AA C A dC r kC C dt-=-=A A A C dC r kC C dt-=-=0max 0001ln[]A M M A C t C kC C =-0121()ln ln1A C A A C k k C t C x +==-A B P R +→+A B S +→A B P R S+→→+0000()/()///--Φ==P P P P P A A n n p C C pn a C a 0000()/()/;;()/()/--==--p p p p p p A A A A n n P C C PS S n n a C C a第三章理想反应器1返混的基本定义2⼏个时间的定义反应持续时间t r--在间歇反应器中反应达到⼀定转化率所需时间(不包括辅助时间)。
化学反应工程知识点

化学反应工程知识点1.反应机理和动力学反应机理是指反应的分子层面的步骤和中间产物,它对理解和控制反应过程非常重要。
动力学研究反应速率与反应物浓度的关系,了解反应速率规律,通过动力学模型可以预测反应速率和产物选择性。
2.反应条件的选择反应条件的选择包括温度、压力、反应物浓度、反应物配比和催化剂等。
化学反应的速率和选择性往往受到反应条件的影响,优化反应条件可以提高反应速率和产物质量。
3.反应器的设计和优化反应器是进行化学反应的设备,其设计和优化对反应过程的效率和产品质量具有重要影响。
常见的反应器类型有批式反应器、连续式反应器和循环式反应器等。
反应器的选择和设计要考虑反应物性质、反应过程的控制方式、热传导和质量传递等因素。
4.反应工艺的控制反应工艺的控制包括对反应过程的监测和调节,以维持所需的反应条件和优化产品质量。
常用的控制策略有温度、压力和反应物供给的控制等。
控制系统的设计和优化需要考虑反应机理、反应动力学和工艺实际操作的特点。
5.安全与环保化学反应过程中会产生化学品和能量的变化,单个反应步骤可能会产生副产物和废物。
因此,反应工程也需要关注安全性和环保性。
安全性考虑的因素包括反应物和产物的毒性、易燃性和爆炸性等,以及反应条件的选择和操作的威胁。
环保方面,需要考虑减少废物的生成,回收利用资源,优化反应条件以减少能耗和污染物排放。
6.规模放大与工业化化学反应工程要实现从实验室到工业生产的规模放大和工艺转化。
这涉及到规模放大的技术、成本评估和安全规范,以及将实验室的合成路线或方法转化为适合大规模生产的工艺。
同时,也需要考虑工艺的稳定性和连续运营的可行性。
以上是化学反应工程的一些基本知识点,化学反应工程涵盖了多个学科领域,是化学工程和化学的交叉学科。
化学反应工程的研究和应用有助于解决实际生产中的技术问题,提高反应过程的效率和产品质量,同时也倡导可持续发展和环保意识。
李绍芬主编反应工程知识点

反应工程知识点第1章 绪论1. 反应动力学主要研究化学反应进行的机理和速率。
2. 反应工程一般是按反应物系的相态来分类,将化学反应分为均相反应和多相反应两大类。
3. 根据反应过程是否使用催化剂,将化学反应分为催化反应和非催化反应两大类。
4. 反应进度是指任何反应组分的反应量与其化学计量系数之比,反应进度永远为正值。
5. 转化率是针对反应物而言的,收率则是对反应产物而言,转化率、收率和选择性三者的关系:Y=SX 。
6. 化学反应工程的主要研究对象是工业反应器,反应器设计的核心内容是确定反应体积,反应器设计最基本的内容是:①选择合适的反应器型式;②确定最佳的操作条件;③确定反应体积。
7. 工业反应器放大主要方法是逐级经验放大法和数学模型法。
8. 反应器类型可以搞看图填写。
9. 工业反应器有三种操作方式:①间歇操作;②连续操作;③半间歇(或半连续操作)。
第2章 反应动力学基础1.反应速率是指单位时间内单位体积反应物系中某一反应组分的反应量。
2.以R v v A v R B A →+反应为例,其反应速率的表达式是dtdn V r A A 1-=或dt dn V r B B 1-=或dt dn V r R R 1=,用反应进度表式反应速率的表达式:dtd V r ξ1-=-,其反应物转化量与反应产物生产量之间的关系R B A R B A v v v dn dn dn ::::=。
3.在溶剂及催化剂和压力一定的情况下,定量描述反应速率与温度及浓度的关系的关系式叫做速率方程或动力学方程,其数学函数表达式),(T c f r =,以以R v v A v R B A →+不可逆基元反应为例,其速率方程为B A v B v A A c kc r =。
4.k 为反应速率常数,为温度的函数,其关系式为)/exp(RT E A k -=。
5.绝大多数反应都是非基元反应,但是非基元反应可以看成是若干基元反应的综合结果,即反应机理。
化学反应工程知识点

化学反应工程知识点—郭锴主编1、化学反应工程学不仅研究化学反应速率与反应条件之间的关系,即化学反应动力学,而且着重研究传递过程对宏观化学反应速率的影响,研究不同类型反应器的特点及其与化学反应结果之间的关系。
2、任何化工生产,从原料到产品都可以概括为原料的预处理、化学反应过程和产物的后处理这三个部分,而化学反应过程是整个化工生产的核心。
3.化学反应工程的基本研究方法是数学模型法。
数学模型法是对复杂的、难以用数学全面描述的客观实体,人为地做某些假定,设想出一个简化模型,并通过对简化模型的数学求解,达到利用简单数学方程描述复杂物理过程的目的。
模型必须具有等效性,而且要与被描述的实体的那一方面的特性相似;模型必须进行合理简化,简化模型既要反映客观实体,又有便于数学求解和使用。
4.反应器按型式来分类可以分为管式反应器、槽式反应器(釜式反应器)和塔式反应器。
5反应器按传热条件分类,分为等温反应器、绝热反应器和非等温非绝热反应器。
第一章 均相单一反应动力学和理想反应器1、目前普遍使用关键组分A 的转化率来描述一个化学反应进行的程度,其定义为:00A A A A A A n n n x -==组分的起始量组分量转化了的 2、化学反应速率定义(严格定义)为单位反应体系内反应程度随时间的变化率。
其数学表达式为dtd V r ξ1=。
3、对于反应D C B A 432+=+,反应物A 的消耗速率表达式为dt dn V r A A 1-=-;反应产物C 的生成速率表达式为:dtdn V r C C 1= 4.反应动力学方程:定量描述反应速率与影响反应速率之间的关系式称为反应动力学方程。
大量的实验表明,均相反应的速率是反应物系的组成、温度和压力的函数。
5.阿累尼乌斯关系式为RT E C C e k k -=0,其中活化能反应了反应速率对温度变化的敏感程度。
6、半衰期:是指转化率从0变为50%所需时间为该反应的半衰期。
7、反应器的开发大致有下述三个任务:①根据化学反应动力学特性来选择合适的反应器型式;②结合动力学和反应器两方面特性来确定操作方式和优化操条件;③根据给定的产量对反应装置进行设计计算,确定反应器的几何尺寸并进行评价。
反应工程考点总结

1.BR的特点:1)由于充分搅拌、混合,以至于反应器有效容积内各个位置物料的特性(T+C)都相同。
2)由于是一次投料和一次放料,在反应过程中既无物料的加入,也无物料的放出,则在反应器内所有物料的空间停留时间相同,无空间停留时间不同的无聊之间的混合,即不存在反混。
3)反应器出料口的物料组成与反应器内最终得到的物料组成相同。
4)间歇操作过程存在辅助生产时间。
2.PFR的特点:1)由于物料都是沿着同一方向、且同一速度在反应器内向前推进,则所有物料流出反应器的时间都相同。
2)在垂直流动方向的任意一截面上,不同径向位置的物料的特性一致,即不存在反混。
3)在定常态下操作,反应器内状态只随轴向位置改变,不随t改变。
3.CSTR特点:1)物料在反应器内充分反混。
2)反应器内各处物料参数均一。
3)反应器的出口组成与器内物料组成相同。
4)反应过程中连续进料出料,是一定常态操作。
4.化学反应工程学研究的主要内容:1)化学的------化学反应动力学特性的研究。
2)物理的------流动、传递过程对反应的影响的研究。
3)工程的------反应器的设计计算、过程的分析及最优化。
5.利用数学模型解决化学工程问题的基本步骤:1)小试研究化学反应规律。
2)大型冷模实验研究传递过程规律。
3)通过计算机或其它手段综合化学反应规律与传递过程规律,预测大型反应器的特性,寻找优化条件。
4)热模检验数学模型的等效性。
6.气固相催化反应的七个步骤、三个过程:1)反应组分从气流主体扩散到催化剂外表面。
2)反应组分从催化剂外表面扩散到催化剂的内表面。
3)反应组分在催化剂活性表面中心上吸附。
4)吸附在表面活性中心上的反应物进行化学反应。
5)产物在催化剂表面活性中心上脱附。
6)产物从催化剂的内表面扩散到催化剂的外表面。
7)产物从催化剂的外表面扩散到气流主体。
其中1)、7)过程是外扩散过程,2)、6)是内扩散过程,3)、4)、5)是化学反应动力学过程。
化学反应工程知识点复习

三传一反
动量传递 热量传递 质量传递 反应工程
2·1 概 述
• 均相反应--在均一液相或气相中进行的反应 • 均相反应动力学是解决均相反应器的选型、操
作与设计计算所需的重要理论基础 • 公式:P15
1、化学反应速率及其表示
对于均相反应aA+bB=rR+sS反应速率定义为:
rA
1 V
dpA dt
k1 pA
k2 pP
k1 pA
2.5k2 pA0
pA
积分,得
(k1 2.5k2 )t
ln
pAe pA0 pA pAe
以(-ln(pA-pAe))对t作图
y 0.1633t 2.5035
k1 2.5k2 0.1633
K
k1 k2
2.5( pA0 pAe
pAe )
2.5(1 0.2) 0.2
10
k1 0.131 k2 0.0131
rA 0.131pA 0.0327 pA0 pA
2.2.2 复合反应
复合反应是指同时存在两个以上独立进行反应的反应过 程。
从相同的反应物按各自的计量关系同时地发生的过程称为 平行反应。
如果这些反应是依次发生的,这样的复合反应称为串联反 应。
反应的反应级数或总反应级数:指浓度函数中各组分 浓度的幂数之和。
对可逆反应,有正反应的反应级数和逆反应的反应级数 。
分子数:
对于基元反应:aA+bB=rR+sS
(rA ) k AcA cB
• 分子数:基元反应中反应物分子或离子的个数。 对于基元反应来讲α,β必须是正整数,α+β是基
元反应的分子数,不能大于3(根据碰撞理论, α+β的取值不能大于3,必须是一个小于等于3 的正整数)。
化学反应工程期末总结重点知识点

1、化学反应分类:(按相类分类)均相反应,非均相反应,(按操作分类)间歇操作,连续操作,半连续操作。
2、反应器分类:⑴ 管式反应器,一般长径比大于30⑵ 槽式反应器,一般高径比为1—3 ⑶ 塔式反应器,一般高径比在3—30之间;按传热条件分类:等温反应器,绝热反应器,非等温、非绝热反应器3、化学反应速率:4、化学反应动力学方程: 阿累尼乌斯关系:5、反应级数:m ,n :A ,B 组分的反应级数,m +n 为此反应的总级数。
如果反应级数与反应组份的化学计量系数相同,即m =a 并且n =b ,此反应可能是基元反应。
基元反应的总级数一般为1或2,极个别有3,没有大于3级的基元反应。
6、有如下基元反应过程,请写出各组分生成速率与浓度之间的关系。
7、动力学方程的方法:积分法、微分法8、化学反应器的设计基础:按混淆分类:间歇反应器,平推流反13s m mol d d 1--⋅=t V r ξ13B A c A s m mol --⋅=-n m c c k r RT Ek k -=ec0c 222A B C A C DB D E +↔+↔+↔222123422125622212342345656222222A A BC A CD B A B C B DE C A B C A C DD A C D B D EE B D Er k c c k c k c c k c r k c c k c k c c k c r k c c k c k c c k c r k c c k c k c c k c r k c c k c =-+-+=-+-+=--+=--+=-应器(理想置换反应器、活塞流反应器),全混流反应器9、间歇反应器的特点:①由于剧烈搅拌、混合,反应器内有效空间中各位置的物料温度、浓度都相同;②由于一次加料,一次出料,反应过程中没有加料、出料,所有物料在反应器中停留时间相同,不存在不同停留时间物料的混合,即无返混现象;③出料组成与反应器内物料的最终组成相同;④为间歇操作,有辅助生产时间。
化学反应工程基础知识总结(笔记)

化学反应工程基础知识总结(笔记)化学反应工程基础知识总结(笔记)1、化学反应工程是一门研究涉及化学反应的工程问题的学科。
如何将其在工业规模上实现是化学反应工程的主要任务。
2、理想置换反应器的特点:①由于流体沿同一方向,以相同速度向前推进,在反应器内没有物料的返混,所有物料通过反应器的时间都是相同的②在垂直于流动方向上的同一截面,不同径向位置的流体特性是一致的③在定常态下操作,反应器内状态只随轴向位置改变,不随时间改变。
3、全混流反应器的特性①物料在反应器内充分返混②反应器内各物料参数均一③反应器的出口组成与器内物料组成相同④反应过程中连续进料与出料,是一定常态过程。
4、返混的定义:物料在反应器内不仅有空间上的混合而是有时间上的混合,这种混合过程称返混。
5、非均相催化反应过程步骤①反应组分从流体主体向固体催化剂外表面传递②反应组分从外表面向催化剂内表面传递③反应组分在催化剂表面的活性中心上吸附④在催化剂表面上进行化学反应⑤反应产物在催化剂表面上解吸⑥反应产物从催化剂内表面向外表面传递⑦反应产物从催化剂的外表面向流体主体传递6、兰格缪尓(Langmuir)吸附模型条件①催化剂表面上活性中心分布是均匀的②吸附活化能和脱附活化能与表面吸附的程度无关③每个活性中心仅能吸附一个气相分子④被吸附分子间互不影响,也不影响空位对气相分子的吸附。
7、焦姆金(Temkhh)吸附模型:一般吸附活化能随覆盖率的增加而增大,脱附活化能则随覆盖率的增加而减小,因此吸附热必然随覆盖率的增加而减小。
8、催化剂颗粒内气体扩散:多孔催化剂颗粒内的扩散现象是很复杂的。
除扩散路径极不规则外,孔的大小不同时,气体分子扩散机理亦有所不同。
当孔径较大时,分子的扩散阻力要是由于分子间碰撞所致,这种扩散通常所称的分子扩散或容积扩散。
当微孔的孔径小于分子的平均自由程时,分子与孔壁的碰撞机会超过了分子间的相互碰撞,从而使分子与孔壁的碰撞成为扩散阻力的主要因素,称为克努森(Knudson)扩散。
化学反应工程

1、化学反应工程学是一门研究涉及化学反应的工程问题的学科。
其主要任务是:对已经在实验室中实现的化学反应,如何将其在工业规模上实现。
2、化工生产从原料到产品可概括为:原料的预处理、化学反应过程、产物的后处理。
而化学反应过程是整个化工生产的核心。
3、三传一反是指:动量、热量、质量传递和反应动力学。
它是反应工程学的核心。
4、化学反应工程的基本研究方法:数学模型法。
5、化学反应式的计量系数恒大于0,化学反应式与化学反应计量式的计量系数的关系:若是产物,二者相等;若是反应物,二者数值相等,符号相反。
化学反应计量式不含除1以外的任何公因子。
6、反应程度ξ:描述反应进行的深度。
ξ=(n I-n I0)/αI. αI对反应物小于0,对产物大于0.ξ恒为正值,具有广度性质,因次为mol.7、关键组分A选取原则: A必须是反应物,可以完全反应掉(转化率可达100%),选取重点关注的、经济价值相对高的组分。
8、转化率定义:转化了的A组分量与A组分的起始量的比值。
9、反应动力学方程:r=-r A=k c c A m c B n.适用范围:体系中只进行一个不可逆反应且a=1。
10、建立动力学方程的方法:积分法、微分法。
11、简单混合:发生在停留时间相同的物料之间的均匀化过程。
12、返混: 发生在停留时间不同的物料之间的均匀化过程。
13、按返混情况不同反应器可分为:间歇反应器BR,平推流反应器PFR,全混流反应器CSTR.14、反应持续时间t r用于间歇反应器。
15、停留时间t和平均停留时间t-用于平推流及全混流反应器。
16、空间时间η=V R/V0. V0为特征体积流率,是在反应器入口温度及入口压力下的体积流率。
17、空间速度S V =1/η.标准空速S V=V NO/V R. V NO为进口流体在标准状态下的体积流率。
18、间歇反应器特性:①反应器内有效空间中各位置的物料温度、浓度都相同②所有物料在反应器中停留时间相同,无返混现象③出料组成与反应器内物料的最终组成相同④为间歇操作,有辅助生产时间。
反应工程重点笔记

反应工程重点笔记1. 反应工程基本概念反应工程是研究化学反应在工业生产中的应用过程的一门学科,它主要涉及到化学反应动力学、反应器设计和操作等方面的知识。
通过对反应工程的研究,可以提高反应的效率,减少资源的浪费,实现工业化生产的稳定性和可持续性发展。
2. 反应动力学反应动力学是研究反应速率与反应物浓度、温度、压力和催化剂等因素之间关系的学科。
反应速率可以用速率方程来描述,一般为: [rate = k[A]a[B]b[C]^c…]其中,[k]为反应速率常数,([A])、([B])、([C])等为反应物的浓度,(a)、(b)、(c)等为反应物的反应级数。
反应动力学的研究可以提供反应速率与反应条件之间的关系,进而可以帮助我们优化反应条件,提高反应效率。
3. 反应器设计反应器是进行化学反应的设备,常见的反应器有批式反应器、连续流动反应器和催化剂床等。
反应器的设计需要考虑反应动力学、传热传质、材料强度等因素。
反应器的设计目标包括:提高产率、提高选择性、降低副产物生成、减少能量消耗、提高安全性等。
为了实现这些目标,可以通过控制反应温度、压力和催化剂用量等方式进行优化。
4. 反应器操作反应器的操作包括起始阶段、稳态运行和关闭阶段。
在起始阶段,需要进行原料的投与、加热和搅拌等操作,以实现反应体系的建立。
稳态运行阶段是为了维持反应物的浓度和温度在合适的范围内,保证反应能够持续进行。
在反应器操作过程中,需要掌握反应器的温度、压力和流量等参数,并及时采取措施以调整反应条件,保证反应在可控的范围内进行。
5. 催化剂的应用催化剂在反应工程中起到了至关重要的作用。
催化剂可以降低活化能,提高反应速率,同时还可以提高反应的选择性和效果。
催化剂的应用可以大大提高反应工程的效率和经济性。
常见的催化反应有氧化反应、氢化反应、加氢反应、脱氢反应等。
选择合适的催化剂对于不同的反应系统来说至关重要。
6. 质量传递和传热问题在反应工程中,质量传递和传热问题是非常重要的。
化学反应工程复习+公式指导

化学反应工程复习总结一、知识点1.化学反应工程的研究对象与目的,研究内容。
化学反应工程的优化的技术指标。
2.化学反应动力学转化率、收率与选择性的概念。
反应速率的温度效应和活化能的意义。
反应速率的浓度效应和级数的意义。
3.理想反应器与典型反应特征理想反应器的含义。
等温间歇反应器的基本方程。
简单不可逆反应和自催化反应的特征和计算方法。
可逆反应、平行反应和串联反应的动力学特征和计算方法。
4.理想管式反应器管式平推流反应器的基本方程典型反应的计算。
停留时间、空时和空速的概念。
膨胀因子和膨胀率的概念。
5.连续流动釜式反应器全混流模型的意义。
全混流反应器的基本方程全混流反应器的计算。
循环反应器的特征与计算方法。
返混的概念、起因、返混造成的后果。
返混对各种典型反应的利弊及限制返混的措施。
6.停留时间分布与非理想流动停留时间分布的意义,停留时间分布的测定方法。
活塞流和全混流停留时间分布表达式,固相反应的计算方法。
多釜串联模型的基本思想,模型参数微观混合对反应结果的影响。
7.反应器选型与操作方式简单反应、自催化和可逆反应的浓度效应特征与优化。
平行反应、串联反应的浓度效应特征与优化。
反应器的操作方式、加料方式。
8.气固催化反应中的传递现象催化剂外部传递过程分析,极限反应速率与极限传递速率。
Da和外部效率因子的定义及相互关系。
流速对外部传递过程的影响。
催化剂内部传递过程分析,Φ和内部效率因子的定义及相互关系。
扩散对表观反应级数及表观活化能的影响。
一级反应内外效率因子的计算。
内外传递阻力的消除方法。
9.热量传递与反应器热稳定性定态、热稳定性、临界着火温度、临界熄火温度的概念。
催化剂颗粒热稳定性条件和多态特性。
全混流反应器、管式固定床反应器热稳定条件。
最大允许温差。
绝热式反应器中可逆放热反应的最优温度分布。
二、具体内容解析 一、 绪论 1.研究对象是工业反应过程或工业反应器研究目的是实现工业反应过程的优化 2. 决策变量:反应器结构、操作方式、工艺条件 3.优化指标——技术指标:反应速率、选择性、能耗 掌握转化率、收率与选择性的概念 4.工程思维方法二、化学反应动力学1. 反应类型:简单反应、自催化、可逆、平行、串联反应基本特征、分析判断2. 化学反应速率的工程表示))((反应区反应时间反应量反应速率=3. 工业反应动力学规律可表示为:)()(T f C f r T i C i ⋅=a) 浓度效应——n 工程意义是:反应速率对浓度变化的敏感程度。
化学反应工程的基础和应用

反应动力学是化学反应工程的另一个基础内容,它研究反应速率、反应机制等,为反应工程的设计和优化提供基础数据。常用的反应动力学指标有反应速率常数、反应级数和反应阶数等。反应动力学可以通过实验测定,也可以通过理论模型预测。
3.反应工程设计
反应工程设计是化学反应工程的核心内容,它研究反应器的类型、尺寸、搅拌方式、加料方式等反应工艺参数的选择和优化,以实现反应工艺的高效、低成本、高品质生产。反应工程设计的基础数据来自反应热学和反应动力学研究。
化学反应工程的基础和应用
化学反应工程是研究化学反应在工业生产中的应用的学科,它涉及多个学科的知识,如化学、物理、数学、机械工程等。化学反应工程的目的是设计和优化化学反应过程,以实现产品的高效、低成本、高品质生产。下面我们来详细了解一下化学反应工程的基础和应用。
一、化学反应工程的基础
1.反应热学
反应热学是化学反应工程的基础内容之一,它研究化学反应的能量变化和热力学性质,为反应工程设计提供基础数据。反应热学常用的指标有反应热、反应焓、反应熵等,它们可以通过化学热学实验获得。此外,反应热学还涉及化学平衡的研究,以及热力学计算方法的应用等。
3.电化学反应
电化学反应涉及电化学原理和化学反应工程原理,它常用于发电、电池制造、金属电镀等领域提高电镀质量。
综上所述,化学反应工程是化学、物理、数学、机械等多个学科的交叉应用,它涉及反应热学、反应动力学、反应工程设计等基础知识,可以应用于中药提取和制剂、化工及石油加工、电化学反应等多个领域。在未来的发展中,化学反应工程将会继续发挥其重要的实际应用价值,为人类的生活和社会经济的发展发挥积极作用。
二、化学反应工程的应用
1.中药提取和制剂
中药提取和制剂是化学反应工程的重要应用之一,它涉及多种化学反应过程,如溶剂提取、超临界萃取、微波辅助提取等。通过化学反应工程的优化设计,可以提高中药制品的质量和产量,减少制造成本。
化学反应工程-第1章

按参数空间分布程度:集中参数模型和分布参数模
型。 按参数与时间关系:定态模型和非定态模型。 按参数性质:确定模型和随机模型。 按建立模型的方法:机理模型和经验模型。
按参数连续性:连续体模型和细胞室模型。
按数学关系:线性模型和非线性模型。
2.数学模型的建立 过程分析:把握过程实质和影响因素, 区分主次。 合理简化提出模型:不失真、满足应 用要求、适应现有的实验条件和适应现有 的计算能力。 组织实验和参数估计。 模拟计算。
第一章 绪
论
1.1.2 化学反应工程的范畴和任务
化学反应工程学是一门研究化学反应的工程问题的科 学。 只研究化学反应本身的规律以及反应结果(反应速 率、选择性等)与温度和浓度的关系,而不涉及传递过 程,属化学动力学问题。 研究反应器构型,物料在其中的流动、传热和传质的 传递规律,以及传递过程对反应结果的影响。这属工程 问题。 根据化学动力学问题,解决工程问题,确定与反应特 性相适应的反应器型式、结构尺寸和操作条件,达到较 好的反应结果。这就是化学反应工程开发的核心内容。
反应器最优化有: 设计优化 管理优化 控制优化
1.5 反应器类型
第一章 绪
论
1.5.1 反应器分类
按反应相态:均相和非均相 按结构型式:固定床反应器、移动床反应器和流 化 床反应器;搅拌槽、鼓泡塔和管式反应器;特殊 反应器,如火焰反应器、气流床反应器、板式塔、光 化学反应器、砖窑等。 按操作方式:间歇操作反应器、连续操作反应器 和半连续操作反应器。 按物流流动状态:理想反应器(全混流反应器和 平推流反应器)和非理想反应器。 按传热方式:间接换热式反应器和直接换热式反 应器。
通过本课程的学习,要求考生正确理 解反应工程有关基本概念、基本原理,掌 握化学反应学科的学习方法及理论联系实 际方法,提高分析问题和解决问题的能力。
工程化学总结全解

工程化学总结第一章 化学反应的基本原理第一节 化学反应的热效应 一、基本概念和基本知识 1、系统和环境 2、状态和状态函数 3、内能4、热和功:正负号规定5、能量守恒定律:ΔU =Q +W6、理想气体分压定律:( )T,V 时, p =Σp i ,p i /p =n i /n 二、化学反应的热效应和焓变 1、Q ν=ΔU (W ’=0)2、Q p =ΔH (W ’=0) ;H =U +PV3、Q p =Q ν+Δn (g)RT 三、盖斯定律反应式相加减对应着热效应相加减。
四、标准摩尔生成焓和化学反应标准焓变的计算Δ)298(θm H =∑νB Δf θm H (298,B)第二节 化学反应的方向 一、自发过程 二、混乱度、熵和熵变1、S =k lnΩ2、熵值大小的判断3、热力学第三定律4、化学反应的熵变: Δ)298(θm S =∑νB θm S (298,B) 三、吉布斯函数和反应方向的判断 1、ΔG =ΔH -T ΔS2、恒温恒压、不作非体积功条件下:ΔG < 0 反应正向自发ΔG > 0 正向不自发,逆向自发 ΔG = 0 化学反应处于平衡状态四、标准状态下吉布斯函数变的求算Δ)(θm T G ≈Δθm H -T Δθm S五、非标准状态下吉布斯函数变的求算b a dc p p p p p p p p RT G G ]/)B ([]/)A ([]/)D ([]/)C ([lnθθθθθm m +∆=∆第三节 化学反应进行的程度和化学平衡 一、化学平衡与化学平衡常数b a dc p p p p p p p p K ]/)B ([]/)A ([]/)D ([]/)C ([θθθθθ=二、平衡常数的热力学求算ln K θ=-Δθm G /(RT )三、化学平衡的移动 吕·查德理原理 四、平衡常数的有关计算 只要求简单计算。
第四节 化学反应的速率 一、化学反应速率的表示方法t c dt c c t c b t c a ∆∆=∆∆=∆∆-=∆∆-=/)D (1/)C (1/)B (1/)A (1υ 二、浓度对反应速率的影响 1、基元反应:υ=kc a (A)c b (B) 2、复合反应:υ=kc α(A) c β(B) 3、反应级数三、温度对反应速率的影响k =Ae -ε/RT四、活化能的物理意义活化分子的平均能量与普通分子的平均能量的差值。
反应工程重点笔记

反应工程重点笔记反应工程是化学工程的一个重要分支,主要研究化学反应的过程和机理,以及如何设计和优化化学反应过程。
在实际工程中,反应工程的目标是实现高效、可持续和经济的化学反应。
以下是反应工程的重点笔记:1. 反应动力学:反应动力学研究反应速率如何随着反应物浓度变化以及温度变化而变化。
了解反应动力学可以帮助工程师选择合适的反应条件,并预测反应过程中可能出现的问题。
2. 反应器设计:反应器是进行化学反应的关键设备。
反应器设计需要考虑反应物质的传质、传热和混合问题,以及反应过程中可能的副反应和催化剂失活问题。
工程师需要选择合适的反应器类型,并进行流体力学和传质传热计算,以确保反应器能够实现预期的反应效果。
3. 反应条件优化:选择合适的反应条件对于提高反应效率和产率非常重要。
反应条件包括温度、压力、反应物浓度、催化剂选择等。
工程师需要通过试验和模拟计算来确定最佳的反应条件,以及优化反应过程中可能出现的问题。
4. 安全与环境:在设计和操作化学反应过程时,安全与环境是非常重要的考虑因素。
工程师需要评估反应过程中可能的危险和污染问题,并采取相应的安全措施和环保措施,保护工人和环境免受潜在的风险。
5. 规模放大:从实验室规模到工业规模的反应放大是反应工程的关键任务之一。
工程师需要考虑如何将实验室条件下的反应条件和反应器设计放大到工业生产规模,并解决可能出现的问题,例如传质、传热和混合等。
6. 动态模拟与控制:建立反应过程的动态模型可以帮助工程师预测反应过程中的动态响应,并设计合适的反馈控制策略。
动态模拟和控制有助于提高反应过程的稳定性、响应性和鲁棒性。
总之,反应工程涉及多个方面的知识和技术,需要工程师综合运用化学、传质传热、流体力学、动力学等学科和工程原理,从而实现高效、可持续和经济的化学反应过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应工程知识点梳理第一章化学反应工程简介化学反应工程是研究化学反应和工程问题的科学动量传递、热量传递、质量传递及化学动力学,可概括为“三传一反”--第三个里程碑。
第二章均相反应动力学反应进度:转化率:膨胀因子:不可逆反应A(-)-()()AAdnrVdt==(由于反应而消耗的的摩尔数)单位反应区域单位时间RSBARSBAαααα+=+1()AAdnrV dt-=-dtdnVr SS1=PPPRRRBBBAAAnnnnnnnnααααξ0-=-=-=-=K KKKn nxn-==某反应物的转化量该反应物的起始量KiKKiixnnxαα=0000KK K K Kn n n nn n n xδ--==-00()KK Kn nn y xδ-=KKKKiKKiiKKKiii xyxyyyxyxyy1)1(1)1(δααδ+-=+-=000(1)(1)(1)(1)A AA AA AA A A A A An xn xC CV V y x y xδδ--===++()A A Br kC Cαβ-=()C Pk RT kαβ+=ERTk k e-=RTEkk-=lnlnSBASBAααα→+bBaAAACkCdtdCr=-=-)(⎰=0AACC bBaAACCdCkt均相催化反应 CC 为催化剂浓度自催化反应A + C → 2C + R …串联反应总收率瞬时收率得率yield总选择性 目的产物P 所生成的摩尔数与副产物S 生成的摩尔数之比,用S0表示:平行反应串联反应()()AA C A dC r kC C dt-=-=CA A A C kCdt dCr =-=-)(A + B P R+S 00PP P A A n n n n -Φ=-/()/p P P A A A r dC dt dC P A r dC dt dC φ====---单位时间内生成的摩尔数单位时间内消耗的摩尔数00/)(A P P P n n n X -=000PP S S n n S n n -=-αA2A αS S (副)αA1A αP P (主),11A A r k C -=(),22A A r k C -=(),1,212()()AA A A A dC r r r k k C dt-=-+-=+=()()A A P A A p P P C k r dt dC r 11,1,1,)(αααα-=--==AA S S S C k dt dC r 22,αα-==tk k A A eC C )(021+-=A P S (均为一级反应)k 1k 2P A P P C k C k dt dC r 21-==PSS C k dt dC r 2==第三章 理想均相反应器 间歇反应器(BSTR)反应时间实际操作时间(operating time)= 反应时间(t) + 辅助时间auxiliary time (t') 反应体积V 是指反应物料在反应器中所占的体积 V = v0 (t + t')为装料系数(the volume charge coefficient),通常在0.4~0.85平推流反应器PFR 空时全混流反应器(CSTR)绝热操作恒容间歇反应器的设计式为:变温平推流反应器⎰⎰--=-=A A A C C A Ax A A A r dC r dx C t 0)()(00等容过程,液相反应 VV ϕ=实际实际的反应器体积为:0V v τ==反应器的容积进料的体积流量0R V dV t v ==⎰反应器中物料反应期的容积的体积流量000()()A A A AA A C C C x V v r r τ-===--0()A A A x V F r =-005000024R R R F v C M ==⨯00000000()(1)A A A A A A x x x A AA A A A E nx x x n n A ART A A dx dx dx t C C C r kC k e C x -===--⎰⎰⎰1001()A A x A A n xA t I x dx k C -=⎰20()()4A A A P A F dx r dV r D dl π=-=-20()4A A A dx D r dl F π-=00000()A x A A A A A dx V V F r v C C τ===-⎰化学反应工程研究的目的是实现工业化学反应过程的优化 全混流平推流多级CSTR 串联的优化对于一级不可逆反应应有PFR: 同间歇釜CSTR:全混流反应器的热衡算方程第四章 非理想流动 停留时间分布()⎰-==A x AAA B A B r dx C t F V 000BR : ()⎰-==Ax A AA P A P r dxCF V 000τPF R: ()000m m A A A A V x F C r τ-==-CST R: 112100010200...(1)(1)(1)Am Am A A A R A A A A A A Am x x x x x V v C kC x kC x kC x -⎛⎫---=+++ ⎪---⎝⎭0121110(1,2,.....1)(1)1Ai RAi Ai Ai v x V i m x k x x -+⎡⎤-∂=-==-⎢⎥∂--⎣⎦11111Ai Ai Ai Ai Ai Ai x xx x x x -++--=--221max 1max 02()k k k P P A C k X C k -==max max 1202211[(/)1]P P A C X C k k ==+1212ln(/)opt k k k k τ=-121opt k k τ=)()1())((0000Pm P P r A c v UAT T c v UA T c v H r V ρρρ+-+=∆--)()1(000P m P r c v UAT T c v UAT Q ρρ+-+= (){}E t P t residence time t t ∆=<<+停留时间分布函数 (){}=<F t P residence time t方差PFRCSTR最大层流流动 轴向扩散模型 0()()d t F t E t t=⎰22222()()()()()()t t t E t dtt t E t dt t E t dt tE t dtσ∞∞∞∞-==-=-⎰⎰⎰⎰0 t t () t t 0 t t E t <⎧⎪=∞=⎨⎪>⎩2220()()()0t t t E t dt t t σ∞=-=-=⎰0 t t () 1 t tF t <⎧=⎨≥⎩()11()t tt tF t e E t et---=-=222 1.0ttθσσ==22()()[2()]r r F t R R =-222/222()2()(1)212()(1)Z t uL E z z Pe tE Ee uL uL e Pe Peθσσ--==--=--。
