σ迁移
周环反应

关于2,4-己二烯的电环化反应总结如下:
CH3 H H CH3 CH3
顺旋
CH3 H H CH3
hν
对旋
CH3
顺旋
H CH3 H
H CH3 H
hν
对旋
总:若开链共轭烯有4个或4m个Π电子,加热顺旋关环, 加热顺旋开环。光照对旋关环,光照对旋开环。 练习:写出下列反应的产物或中间产物
Ph
Ph
Ph H H
[1,5] H迁移
H D CH 3 C2H5 (2)
D CH3 H (3) CH3
H H 3C
CH3 D C2H5 (1)
H3C
CH3 D C2H5 H
CH3
[1,5] H迁移
C2H5
2. [ 3,3 ]迁移 结论: 在加热时[ 3,3 ]迁移是轨道对称性允许的 。
以1, 5--己二烯为例:在加热时发生[ 3,3 ]迁移 2 3 1 2 3 1 CH2 CH CH2 CH2 CH CH2
i= 1 Z C 5
注:[ i, j]表示迁移后σ键所连接的两个原子的位置。 i, j 的编号分别从反应物中以σ键连接的两个原子开始编号。
1 H CD2 5 CH 4 CH 3 CH 2 CH2 1 H CD2 CH CH CH CH2
[1, 5] H 迁移
C--H键σ迁移
CH3 3 2 CH CH CH2 3 CH 2
9
℃
40 ℃
CH3
Br
(3)
Br
RMgX
R
R
(
)
R R
Br
(4)
Br
2C6H5S-
Sφ Sφ
二. 环加成 在光或热的作用下在两个 Π电子共轭体系的两端同 时生成两个σ键而闭合成环的反应叫环加成反应。 分类:由两个Π电子体系中参与反应的Π电子的数 目分类。
重排反应总结

重排反应总结1、什么叫重排反应?一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳骨架发生了改变等等,这样的反应称为重排反应。
简单的理解:重排反应是指反应中烃基或氢原子或别的取代基从分子中的一个原子迁移到该分子中的另一个原子上的变化。
(指分子内重排)2、重排的分类按反应机理 ,重排反应可分为:基团迁移重排反应和周环反应中的重排。
基团迁移重排反应 即反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。
常见的迁移基团是烃基。
基团迁移重排反应又包括缺电子重排(亲核重排),富电子重排(亲电重排)和自由基重排.。
周环反应中的重排包括电环反应、σ键迁移。
也可按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应等等。
本讲义把重排分为以下几类:a.从碳原子到碳原子的重排 b.从碳原子到杂原子的重排 c.从杂原子到碳原子的重排 d.其它重排一、从碳原子到碳原子的重排反应1、Wangner-Meerwein 重排(瓦格纳尔—米尔外英重排,简称瓦—米重排)两个相邻原子之间发生的重排叫1,2重排,也叫Wangner-Meerwein 重排。
如:醇或卤代烃在酸催化下进行亲核取代或消除反应时,烯烃进行亲电加成时发生的重排。
例如:a.亲电加成时发生的重排如果反应液中同时存在两种或是两种以上的亲核试剂,则通过中间体碳正离子,能够生成混合加成产物。
R 2C R 3R 1C OHR 4R 5R 2C R 3R 1CR 4R 5R 1CR 2C R 3R4R 5R1CR 2CR 3R 4R 5OH H +(-H O)重排H O(-H +)b.醇进行亲核取代和消除时的重排亲核取代时,除大多数伯醇难以形成正碳离子而按S N 2反应外,仲醇或叔醇反应常伴随着重排产物的产生。
(S N 1)消去时(S N 1):c.卤代烃进行亲核取代和消除时的重排亲核取代按S N 1机理反应时伴随着碳正离子的重排 消去时注意:有碳正离子形成时,就有可能伴随着重排反应 形成C +的方式总结: (a)卤代烃 (AgNO 3醇溶液) (b)含-NH 2,重氮化放氮气(c)-OH ,加 H + (失H 2O),烯烃加H +基团迁移顺序:对迁移顺序的理解:迁移基团的电子云密度越大越容易迁移(但具体情况下,要具体分析)(CH 3)3C-CH 2Cl(CH 3)32Ag (AgNO 3(CH 3)3C-CH 2N 2Cl-N 2(CH 3)3C-CH 2(CH 3)3C-CH 3NH 2NaNO 2△(CH 3)3C-CH 2OH (CH 3)3C-CH 2=CH 2(CH 3)32(CH 3)33H +2H +ClR 3C-R 2CH-RCH 3-CH 3-H->>>>>>OCH 3>反应举例:2、Pinacol (频哪醇)重排(邻二醇重排)当起始物的脱水产物能产生两种不同的正离子时,总是生成更稳定的正碳离子为主,有不同迁移基团时,按迁移的难易程度进行。
迁移率的计算公式

迁移率的计算公式迁移率,这可是个在物理学和材料科学中常常出现的重要概念哟!咱先来说说啥是迁移率。
简单来讲,迁移率就是指某种粒子在电场或者磁场作用下移动的快慢程度。
就好比在操场上跑步,有的人跑得快,有的人跑得慢,而迁移率就是用来衡量这个“快慢”的指标。
那迁移率的计算公式是啥呢?一般来说,迁移率(μ)等于电导率(σ)除以电荷密度(n)和电荷量(q)的乘积。
用公式写出来就是μ = σ / (n × q) 。
给您举个例子吧,就说咱们平常使用的手机电池。
手机电池里的锂离子在充电和放电的过程中,就涉及到锂离子的迁移率。
如果锂离子的迁移率高,那电池充电就快,放电也更稳定;要是迁移率低,那可能手机电池就不耐用,充电慢,用一会儿就没电啦。
再比如,在半导体材料中,电子和空穴的迁移率对于半导体器件的性能有着至关重要的影响。
比如说电脑里的芯片,要是芯片中材料的电子迁移率高,那芯片的运算速度就快,处理信息的能力也就更强。
您看,迁移率这个概念虽然听起来有点专业,但其实在咱们的日常生活中到处都能找到它的影子。
在学习迁移率的计算公式时,可别死记硬背,得理解着来。
就像学骑自行车,光记住动作步骤可不行,得真正上手去骑,感受平衡和力量的运用,才能真正学会。
还有啊,迁移率的计算不仅仅是在物理实验和理论研究中有用,对于工程技术领域也特别重要。
比如说,在设计新型的电子器件时,工程师们就得精确计算材料的迁移率,以确保器件能够达到预期的性能指标。
再想想看,电动汽车的发展也离不开对迁移率的研究和应用。
电池的性能直接关系到汽车的续航里程和充电时间,而这其中,离子的迁移率就是关键因素之一。
总之,迁移率的计算公式虽然看起来简单,但它背后蕴含的科学原理和实际应用可真是广泛又重要。
咱们可得好好掌握它,说不定哪天就能在解决实际问题的时候派上用场呢!。
[3,3]σ迁移反应过渡态立体化学过程的新观点
![[3,3]σ迁移反应过渡态立体化学过程的新观点](https://img.taocdn.com/s3/m/1163b554326c1eb91a37f111f18583d049640f77.png)
[3,3]σ迁移反应过渡态立体化学过程的新观点第21卷第4期大学化学2006年8月[3,3]迁移反应过渡态立体化学过程的新观点许家喜(北京大学化学与分子工程学院生物有机与分子工程教育部重点实验室北京100871)摘要结合环己烷的构象与能量关系,讨论[3,3]迁移反应的立体化学过程.[3,3]迁移反应生成的主产物经过的是椅式过渡态,生成的次要产物经过的是扭船式过渡态,而不是以前认为的船式过渡态.经过环状过渡态的协同反应机理进行的迁移反应是有机化学中的重要重排反应之一,也是在有机合成中广泛应用的重要反应.关于H[1,]迁移反应和c[1,]迁移反应的立体化学过程在现有的有机化学教材中已讨论得很清楚¨,关于C[3,3]迁移反应及含有杂原子的[3,3]迁移反应的立体化学过程也在一些教材,教学和学习辅导材料中有所讨论0,作者本人也曾对含有手性碳原子的[3,3]迁移反应的立体化学过程做过一些讨论.在此,对[3,3]迁移反应生成次要产物的立体化学过程做些深入的讨论,希望能够从能量的观点上对认识反应的立体化学过程有所帮助.本文仍用教材中经常使用的两个经典例子来讨论[3,3]迁移反应的立体化学过程. Doering和Roth曾仔细研究了3,4.二甲基.1,5.己二烯光学异构体的Cope重排反应,并测定了产物的构型,得到如下结果.它的内消旋体在225℃加热6h,得到的2,6一辛二烯型占99.7%,(E,E)构型占0.3%;它的外消旋体在100℃加热18h,得到的2,6一辛二烯中,(E,E)构型占90%,(z,z)构型约为10%,仅有痕量的(z,E)构型产物.这是一个研究得比较深入细致的实例,因而被许多教科书或辅导材料引用(图1).6h一/==\八l\+\八225℃997%(Z_E)03%(EE),一+八:::/'\1oo~C90%(EE)10%(z.z)(±)图13.4-二甲基-1.5-己二烯的Cope重排反应一般认为,由于环己烷椅式构象的能量最低,内消旋1,5.己二烯以经过椅式构象过渡态1和2反应时所需活化能小,构象1和2均各有一个甲基处于直立键,而另一个甲基处于平伏键,该重排反应主要经过椅式过渡态,所以得到99.7%的(z,E)型产物;而次要产物是经过船式过渡态重排得到的,船式构象的能量高于椅式,所以经船式构象过渡态3和4发生重排所需活化能高,得到的次要产物就少.内消旋1,5.己二烯若经船式构象过渡态3时,两个甲基虽均40~HC一HH2一cH—三lH2c—cH+H.MeHC.H3H,C—CH—十一H—H,c—cH—H—CH3H,H,c—cH-F~一H2c—cH—+一H——CH3fH]牛]H广H三/::\八99.7%(Z.E)一\八03%(EE)Me图2meso-3,4-二甲基-1,5-己二烯Cope重排反应的立体化学过程对于外肖旋体,以其中的(R,R)一1,5一己二烯来讨论,在经过椅式构象过渡态5重排时,两个甲基均处于平伏键,过渡态能量低,容易进行,所以主要得到(E,E)构型的产物,占总产物的90%;当它以经过椅式构象过渡态6重排时,两个甲基均处于直立键,过渡态能量稍高,反应也可以进行,但比构象5要难,所以得到(z,z)构型的产物只占总产物的10%;当它以经过船式构象过渡态7重排时,两个甲基虽均处于准平伏键,但其过渡态为船式构象,能量较高,较难进行,即使发生也得到(E,E)构型的产物;当它以经过船式构象过渡态8重排时,一个甲基处于准平伏键,另一个甲基处于准直立键,能量更高,几乎不能进行反应,因此,无(z,E)构型的产物生成(图3)¨.以上回顾了文献和教科书中的解释和观点,这些分析就是目前对[3,3]迁移反应产物的立体化学过程的分析和解释,这种解释通过立体化学分析很好地解释了[3,3]迁移反应中主次产物生成的原因,因此被广泛采用.下面回顾一下环己烷的构象及其势能图(图4).椅式构象的能量最低,半椅式构象的能量最高,但应该注意到,扭船式构象比船式构象的能量要低约6kJ/tool,因为在船式构象中有两对碳原子是以重叠式构象存在的(图5a),而在扭船式构象中(图5b),这种重叠构象被避免了,因此能量较低.同时还应该注意到,[3,3]迁移反应经过扭船式和船式过渡态得到的产物的立体化学是一致的,但经过扭船式过渡态比经过船式过渡态的能量要低.因此,作者认为,在[3,3]迁移反应中,主要产物的生成如同通常描述的那样是经过椅式过渡态进行的,41:1CH3H:C—CH2H,==—+一H CH3(尺,尺)HMeMe,HMeH--~-4-ffMe\/Me卜HMeMe八M0Hl辛H.卜一Me,,H:H-Me6/M.MeM.Me\八一/lO%(ZZ)三/c—\/\\0%(互E)三/c—\/\\0%(Z.)图3(,)-3,4?二甲基-1,5-己二烯Cope重排反应的立体化学过程图4环己烷中各种构象的势能关系图(a)环己烷船式结构的模型图(b)环己烷扭船式结构的模型图图5环己烷船式和扭船式结构的模型图但次要产物的生成是经过扭船式过渡态形成的,而不是以前认为的是经过船式过渡态形成的.上述两个例子中,经过船式过渡态形成的次要产物应该是经过如图6所示的扭船式过渡态形成的.42一一卜士:CH—CH,H—+一Me H+Me CH—CH脚PD CH—CH, Me—+一H H+Me CH—CH, (土) CH—CH2 士. CH—CH2 (土)MeMeHHMeHMeeMeH]丰IL一,Il卜HlMeJe.Mee.Me M.]丰IL一,Il卜M.lHJa.Mea.MeMeH]丰I,I,I一牟,MelHJa.Mee-MeMeH]丰e.Mee.MeMeMe(EE)0.3%HMeee(Z.Z)0%H(EZ)0%HHe(EE)图6[3,3]迁移反应中经过扭船式过渡态形成次要产物的立体化学过程对于下面的Claisen重排反应的例子,含有(E,E).双键的烯醇醚经重排后,可以得到97%的苏式产物和3%的赤式产物,认为经过能量低的椅式过渡态得到主要产物苏式产物,经过能量略高的船式过渡态得到次要产物赤式产物.反应过程如图7.肌H:c—cHH十-+-Hc+HH十~--cCHHOCH—cHCH图7(E,E)-烯醇醚的Claisen重排反应主要产物的形成与文献中的观点一致,这里不再重复,下面看一下经过扭船式过渡态形成次要产物的过程(图8).\入o)MerM01H—_JI『l,II绛H【M0卜MeMeCHoMe—+一HMe—+一HCH—CH,(土)3%e.Mee-Me图8Claisen重排反应中经过扭船式过渡态形成次要产物的立体化学过程经过扭船式过渡态与经过船式过渡态得到的产物的构型一致,但过渡态的能量却要低很43●__r●__『●__『H___-__________________________1_.1________________lLH多,因此,应该是有利的过程.从分析结果来看,不论是经过扭船式过渡态,还是经过船式过渡态,所得产物的立体结构是一致的,虽然从实验上较难证明,但从能量上看,经过扭船式过渡态应该比经过船式过渡态更有利,因此,[3,3]or迁移反应的次要产物的生成应该是经过扭船式过渡态实现的.相信通过以上分析,可以进一步加深对含有手性碳原子的[3,3]or迁移反应的立体化学过程的理解.参考文献SmithMB,MarchJ.AdvancedOrganicChemistry:Reactions,MechanismsandStructures. 5thed.NewY ork:JohnWiley&Sons.2ool邢其毅,周政,徐瑞秋,等.基础有机化学.第2版.北京:高等教育出版社,1994胡宏纹.有机化学.第2版.北京:高等教育出版社,1990张黯.有机化学教程.北京:高等教育出版社,1990梁世懿,成本诚.高等有机化学.北京:高等教育出版社,1993邢其毅.基础有机化学示范教学.北京:北京大学出版社,1983DoeringWvE,RothWR.Tetrahedron,1962,18:67许家喜.大学化学,1998.13:16anicChemistry.2nded.NewJersey:Prentice—Hall,1991(上接第17页)参考文献宗汉兴,俞庆森,钱文汉.大学化学,1994,9(2):9高盘良,常文保,段连运.大学化学,1999,14(2):2l王伯康,王志林,孙尔康.大学化学,2001,16(2):25吴性良,陆靖.实验技术与管理,2001,18(2):108浙江大学,南京大学,北京大学,等.综合化学实验.北京:高等教育出版社,2001施开良,姚天杨,俞庆森.大学化学,2002,17(6):8黄乐览,施开良,童叶翔.大学化学,2003,18(4):l4施开良,姚天杨,俞庆森.中国高等教育,2003,17:27施开良,姚天杨,俞庆森.实验室研究与探索,2004,23(3):1施开良,陈令梅,姚天扬,等.大学化学,2004,19(3):l6杜志强.综合化学实验.北京:科学出版社,2005(上接第27页)参考文献l戴维?P?休梅克,约瑟夫?w?尼布勒,卡尔?W?加兰,等.物理化学实验.第4版.俞鼎琼,廖代伟译.北京:化学工业出版社,19902千原秀昭.物理化学实验.沈鹤柏,郎佩珍,李永孚,等译.北京:高等教育出版社,19873SalzbergHW,Mo~ewJI,CohenSR,eta1.PhysicalChemistryLaboratory—PrinciplesandExperiments.London:MacmillanPub—lishingCoInc,1978l23456789l23456789Ol。
李景宁《有机化学》(第五版)笔记和课后习题(含考研真题)详解-周环反应【圣才出品】

HOMO 决定。
17.2 课后习题详解
1.推测下列化合物电环化反应产物的结构。
((11))
(2) HH
(1)
(2)(1)
(2)
HH
((12))
(2)
)
H H3C
H CH3
H
(3)
H3C
CH3
hv
(2)
HH
H CH3
hv
(3) H(4) H
(3) H3HC HCH3
(3) H3CHH3C CHHC3H3 (5)
8 / 18
圣才电子书
答:
十万种考研考证电子书、题库视频学习平台
9.通过什么反应和条件,完成下面的反应。
Ph
O
O
O
Ph
O
O
Ph
Ph
O
答:通过光照和加热能得到给出的结果,反应过程如下:
Ph
hv
对旋
Ph
Ph
O
O
O
Ph
Ph
Ph
O
O O
10.如何使反-9,10-二氢萘转化为顺-9,10-二氢萘?
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 17 章 周环反应
17.1 复习笔记
一、电环化反应 1.电环化反应 (1)电环化反应的概念 电环化反应是指在加热或光照条件下,共轭多烯烃环合形成环烯烃的反应及其逆反应。 (2)电环化反应的规律性 共轭多烯烃电环化反应有高度的立体选择性,反应与共轭体系的π电子数目有关,主要 分为 4n 型共轭多烯和 4n+2 型共轭多烯。其关系见表 17-1。
子的 HOMO 与另一个反应分子的 LUMO 对称性符合正正重叠或者负负重叠,形成化学键,
电环化反应的宣讲很详细

同面-同面
电环化反应的宣讲很详细
14
第14页
[小结]
环加成反应选择性
电子数 热反应
4n+2 4n
允许 禁阻
光反应
禁阻 允许
电环化反应的宣讲很详细
15
第15页
[4+2]环加成反应即Diels-Alder反应
双烯体
X k1 Y k2
亲双烯体
(a)Diels-Alder反应是可逆反应 正反应二级;逆反应一级
ψ1
电环化反应的宣讲很详细
LUMO
HOMO (对旋成键)
HOMO (顺旋成键)
单分子反应只包括分子HOMO 34 第34页
1)、加热(基态) 2
2
1
(HOMO)
顺旋
3 2
4
1
4
H3C
H H CH3
顺旋
3
H3C H CH3 H
顺旋1
顺旋2
电环化反应立体选择性, 取决于HOMO轨道对称性。
加热条件下, 顺旋对称允许, 对旋对称禁阻。(4n体系) 35
普通情况下, 双烯体含有供电基, 亲双烯体含 有吸电基, 反应活性高(苯醌>顺酐>硝基烯 > α,β-不饱和酯(酮、腈) ;
不过, 当双烯体缺电子时, 亲双烯体含有供电基反 而对反应有利。
Cl Cl
Cl
Cl
Cl
Cl
Cl Cl Cl Cl
Cl Cl
电环化反应的宣讲很详细
19
第19页
(e) Diels-Alder反应立体化学 顺式加成规则:
+
[ 4+2 ] 环加成
括号中数字表示两个体系中参加反应电子数。
电环化反应的很详细

周环反应的特征: ①反应进行的动力,是加热或光照。 ②反应进行时,有两个以上的键同时断裂或形成,是 多中心一步反应。 ③反应时作用物的变化有突出的立体选择性。 ④在反应过渡态中原子排列是高度有序的。
周环反应是分子轨道重新组合的过程,分子轨道对 称性控制化学反应的进程。
4
环加成反应 Diels-Alder反应: 电环化反应: 迁移反应
hv +
[ 2+2 ] 环加成
+
[ 4+2 ] 环加成
括号中的数字表示两个体系中参与反应的电子数。
12
一. [ 4+2 ] 环加成 (4n+2体系) 热反应:允许。 光反应:禁阻。
加成时是立体专一性的,无例外的都是顺式加成。
13
二. [ 2+2 ] 环加成 (4n体系) 热反应:热反应禁阻, 光反应:光反应允许。
Z
C (C C)j
C (C C)j C
23
例:
CH2 [1,5]氢移位
CD2H
△
CD2H
H2C H
CH3 C9H17
[1,7]氢移位
H2CH
CH3 C9H17
H
对旋允许
10
[小结] 电环化反应立体选择性规律:
电子数 热反应 光反应
4n 4n+2
顺旋 对旋
对旋 顺旋
完成下列反应式:
(1)
hv ?
(2)
?
ph
ph
(3)
?
H (4)
HH
?
H ph
ph
H
H 11
环加成反应(Cycloaddition Reactions)
在光或热作用下,两个电子共轭体系的两端同 时生成键而形成环状化合物的反应。
有机化学 第十八章协同反应

规律前沿轨道法用双烯和亲双烯体各部位“轨道系
数”加以说明。在[4 +2]环加成中,双烯体具有给
电子基团时“轨道系数”最大的位置为C4和C1 (3和
4中标记●)。而连有拉电子基团的亲双烯体系数最
大的位置是C2(5中标记● )。这样两种反应物“轨
道系数”最大位置相互作用决定了这种邻对位加成
作用。图18-8 (a)和(b)分别描述了[1,5]和[1,3]
迁移相应前沿轨道与氢原子的相互作用。
从图中可以明显看到,[1,5]同面迁移时,对
称性是允许的,而[1,3]同面迁移时,对称性是禁
阻的,但异面迁移是允许的。但氢[1,3]异面迁移
在几何上是极为不利的,所以在加热条件下很难发
生[1,3 ]迁移而容易发生[1,5 ]迁移。重氢化合
制备七元环化合物。
(2)1,3偶极环加成
除共轭双烯外,很多1,3偶极分子可作为双烯体
进行[4 +2]环加成。这些1,3偶极分子是具有4 π电
子的共轭体系,如重氮烷烃、叠氮化合物分别在C一
N—N和N—N—N三个原子上具有4个共轭π电子。它们
很容易在加热条件下与亲双烯体进行[4+2]环加成,
反应可合成五元杂环化合物。
同面/同面加成对称性是允许的,但在光照作用下[2
+2]反应过程中往往有双基的生成,因此这种加成并
非均有立体选择性。不过因在光照条件下[2 + 2 ]加
成较为容易而且在合成四元环上有很大价值,因此[2
+ 2 ]环加成仍不失为重要反应,下面是利用这个反
应合成四元环和笼状化合物的典型实例。
问题18-2
环戊二烯长时间放置会产生二聚环戊二
σ-键的迁移反应在共轭体系中

§17-1
周环反应
周环反应及其特征
§17-2
§17-3
电环化反应
环加成反应
§17-4 σ-键的迁移反应
§17-1
一、周环反应
周环反应及其特征
一步完成的多中心反应叫周环反应 离子型或游离基型反应:反应物 →
周环反应:反应物 → 产物
中间体
→
产物
二、周环反应的特征
1. 反应进行的动力是△或hv。 2. 反应进行时有两个以上的键同时断裂或形成,经过4或6中心环 的过渡态,一步完成的多中心反应(协同反应)。
(Ⅱ) [1,5]迁移 △ Et CH3 (Ⅲ) CH3 H
Et
CH3 D H
CH3
D
(3)碳的[1,3]同面迁移是伴随着迁移基团构型翻转的,而[1, 5]同面迁移则是构型保留的。
3 1 2
300℃ [1,3]碳迁移 H OAc H CH3
2 1 3 4 5
H D H CH3
OAc
D CH3 [1,5]氢迁移
CH3 CH3 H CH3 H H CH3 H CH3 H CH3 H CH3 H CH3
H
苯酚的烯丙醚在加热时,烯丙基迁移到邻位碳原子上(Claisen 重排)。
1' 1 1' 2' 2 3
Unoccupied Molecular Orbital)。
(2)周环反应中电环化反应的关环方式取决于HOMO,考虑轨道 的对称性,关键是HOMO的对称性质。
单数 基态 HOMO 能级=双键数 双数 单数 hv 激发态 LUMO 能级=双键数+1 双数
对旋 顺旋 对旋 顺旋
(3)电环化反应为可逆反应,正逆反应以同一历程进行,只是所 有的成键和断键过程两者相反(微观可逆原理)。
有机化学的10种反应类型

在σ迁移反应中,σ键在共轭体系中进行迁移,形成环状过渡态,然后生成产物。σ迁移反 应通常涉及π电子和σ电子的相互作用,因此也被称为π-σ反应。
07
酯化反应和酯交换反应
Chapter
酯化反应
酸催化酯化
羧酸与醇在酸性催化剂存在下加热,生成酯和水 。
碱催化酯化
羧酸盐与醇在碱性催化剂存在下加热,生成酯和 相应的盐。
某些芳香族化合物在特定条件下,也可以发生加聚反应生成高分子 化合物。
缩聚反应
酰胺化缩聚反应
羧酸和胺在催化剂的作用下,发 生酰胺化缩聚反应生成聚酰胺。
酚醛缩聚反应
酚和醛在催化剂的作用下,发生 酚醛缩聚反应生成酚醛树脂。
尿素甲醛缩聚反应
尿素和甲醛在催化剂的作用下, 发生尿素甲醛缩聚反应生成脲醛 树脂。
02 反应过程中,酮肟的氮原子上的羟基和碳原子上 的氢原子发生迁移,形成新的碳氮键。
03 贝克曼重排是一种重要的有机合成方法,可用于 制备多种酰胺类化合物。
霍夫曼重排
霍夫曼重排是指酰胺在溴或氯的存在下,加热发生分子 内重排生成少一个碳原子的伯胺的反应。
反应过程中,酰胺的羰基碳原子上的氢原子和氮原子上 的烃基发生迁移,形成新的碳氮键。
烯烃和炔烃的亲电加成
烯烃和炔烃在亲电试剂(如卤素、氢卤酸、硫酸等)的作用 下,可以发生亲电加成反应,生成相应的卤代烃或硫酸酯等 。
芳香烃的亲电加成
芳香烃在亲电试剂(如硝酸、硫酸、氯化铁等)的作用下, 可以发生亲电取代反应,生成相应的硝基化合物、磺酸酯或 氯化物等。
自由基加成反应
烯烃和炔烃的自由基加成
酯化缩聚反应
羧酸和醇在催化剂的作用下,发 生酯化缩聚反应生成聚酯。
乙烯基化合物的缩聚反应
第十八章 协同反应

O
H
O O O
H
H
H H H
Na2CO3 水溶液
Pb(OAc)4
篮烯basketene)
标出下列反应的条件
Me Me +
hv
O
O
+
H2C CH3
CH2 CH3
Me Et
hv
Me
Et
H
hv
加热
H H H
顺旋
对旋
完成下列反应
hv
+
O
O O
+
hv O
O O
O
O
CH3 H H
O
H
H
CH3 CH3
CH3
4、理论解释电环化的高度立体选择性
(1)4n体系 4
CH3 H H CH3
3
2 1
(LUMO)
(HOMO)
(HOMO)
Ground state
Excited state
反应时,前线轨道理论认为是分子的最高占据轨道转化为 一个新的键。同时只有位相相同的一端接近时才能成键。 (a)加热条件,前线分子轨道为ψ2
4 3 2 1
基态 激发态
1,3-丁二烯的分子轨道
(2)轨道对称性 分子轨道可用几何图形表示,不仅有形状的不同,而 且有位相的差别。分子轨道的对称元素主要有对称轴 (C)和对称面(m)
m m
H H
H H
C2
(3)轨道对称性守恒原则
1965年Woodward和Horfmann提出的,内容:对于一个基元 反应,在整个反应过程中,反应物分子轨道、过渡态分子轨道 以及产物分子轨道的对称性,对于所选定的对称元素而言,其 对称性始终保持不变。此时的反应是对称性允许的反应,反应 所需的活化能较低,反应可以顺利进行。反之,对称性禁阻, 不容易发生反应。
第十八章协同反应

者迁移保持碳原子的构型不变,而后者要伴随着碳原子的构 型翻转。
1
烷基
2 3
AC B
2
1
3
C
AB
2
1
3
C
A
B
2
2
2
A
C
B
C
AB 过渡状态(同面迁移)
一、[ 2+2 ]环加成 以乙烯的二聚为例 在加热条件下,当两个乙烯分子面对面相互接近时,由于
一个乙烯分子的HOMO为π轨道,另一乙烯分子的LUMO为 π*轨道,两者的对称性不匹配,因此是对称性禁阻的反应。
Bπ *
LUMO
热反应(对称性禁阻)
Aπ
HOMO
光照条件下,到处于激发态的乙烯分子中的一个电子跃
ψ6
E6
ψ5
E5
ψ4
E4
HOMO
E
ψ3
HOMO
E3
ψ2
E2
ψ1
E1
规律:4n电子体系在加热情况下顺旋允许,对旋禁阻; 在光照情况下对旋允许,顺旋禁阻。
练CH习3 H CH3 顺旋 H
hv 顺旋
CH3 H
+
CH3 H
H CH3 H CH3
+
HH
HH
H H
hv 顺旋
H H
CH3 CH3
顺旋
CH3 CH3
电环合 与开环 是逆反 应,遵 守同一 规则
CH3
第二节 环加成反应
一、 环加成反应和环消除反应
第五章 重排反应

H2O
H R N
O OH RNH2
酰基叠氮可由叠氮化钠与酰化剂反应得到,酰肼与亚 硝酸反应也可形成酰基叠氮。加热重排不需太高温度,大 约100℃左右即可进行。
当羧酸与叠氮酸反应时,经叠氮酸加成反应,生成产物 也可失去一分子氮引起向缺电子氮原子的重排反应,结果 生成胺盐,这个反应是在酸性条件下进行的,称为Schmidt 反应。
.CCl3 1.00 >19
:CBr2 1.00 0.4
Br2 1.00 0.6
3-甲基1-丁烯 0.17
3.2
1.9
13.5
一些与环状共轭体系相连的卡宾如环丙烯卡宾和环庚三 烯卡宾,在这些分子中,空的P轨道参与共轭体系,不显示 明显的缺电子特征,实际上是环丙烯正离子和卓鎓离子的 共轭碱。
+
+
二、卡宾的制备 1、重氮化合物分解制备卡宾 低分子量的重氮甲烷具有毒性、不稳定,在实验室中, 重氮甲烷的制备是由苯磺酰甲胺或苯二甲酰甲胺亚硝化后 再用碱反应制备的。
R hv R O Ar hv CN OMe hv Ar
R R Ar Ar
R R Ar CN OMe Ar
R R Ar Ar Ar MeO
O +
R R
C:
O+
-
O +
Ar NC Ar Ar
C:
O
Ar Ar
O+
-
O +
C:
4、多卤化物的2-消除形成卡宾 无β-氢原子的卤化物在用强碱处理时,进行α-消除卤化 氢形成卡宾,其他的如有机汞化物也可以进行α-消除反应形 成卡宾。
HNO2
O R R O
CH2N2+
第十一章周环反应

CH3 H H CH3 hv
CH3 H CH3 H
(4n个π 电子数的电环化反应)
电环化反应的立体选择性主要由两种因素所决定: (1)多烯烃中π 电子的数目 (2)反应条件是加热还是光照
CH3 H H CH3 hv 顺旋
H CH3 CH3 H
CH3 H H CH3 △ 对旋
H
CH 3 H
H 3C
H H
CH 3
△
H
基态 2 对称 ) (C
CH 3
H
CH 3
对旋允许
H 3C H H CH 3
CH 3
CH 3 CH CH 3 3 H
hv
H
) 激 发 态( m 对 称
H
H
H
顺旋 HOMO Ψ4
H3C H H
CH3 CH3 H
A
CH3
H
对旋 HOMO Ψ3
H3C H H
CH3 H CH3
常用反应机理方法对反应进行研究也未发现其它反应中 间体存在。
•
2.
具有立体专一性。
协同反应:旧的共价键断裂和新的共价键形成同时发生,反 应仅仅经过一个过渡态而没有离子或自由基等中间体生成的 反应。
周环反应(Percyclic reaction)
1. 2. •
周环反应:经过环状过渡态的协同反应。 周环反应特点: 反应过程中,旧的共价键断裂和新的共价键形 成同时发生,反应同时发生于一个过渡态中, 为多中心的一步完成的反应。 反应机理中不涉及离子或自由基中间体。 反应一般在光照或加热下进行。 反应一般有较好的立体选择性。
由一个分子的HOMO流向另一个分子的LUMO; • 两分子相互作用时,轨道必须同相重叠;
σ迁移反应详解
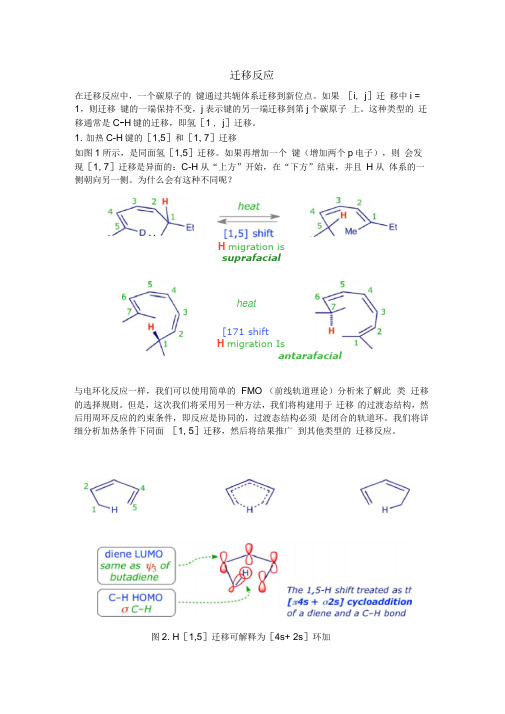
迁移反应在迁移反应中,一个碳原子的键通过共轭体系迁移到新位点。
如果[i, j]迁移中i = 1,则迁移键的一端保持不变,j表示键的另一端迁移到第j个碳原子上。
这种类型的迁移通常是C-H键的迁移,即氢[1 , j]迁移。
1. 加热C-H键的[1,5]和[1, 7]迁移如图1所示,是同面氢[1,5]迁移。
如果再增加一个键(增加两个p电子),则会发现[1, 7]迁移是异面的:C-H从“上方”开始,在“下方”结束,并且H从体系的一侧朝向另一侧。
为什么会有这种不同呢?H migration issuprafacialheat[171 shiftH migration Isantarafacial与电环化反应一样,我们可以使用简单的FMO (前线轨道理论)分析来了解此类迁移的选择规则。
但是,这次我们将采用另一种方法,我们将构建用于迁移的过渡态结构,然后用周环反应的约束条件,即反应是协同的,过渡态结构必须是闭合的轨道环。
我们将详细分析加热条件下同面[1, 5]迁移,然后将结果推广到其他类型的迁移反应。
图2. H[1,5]迁移可解释为[4s+ 2s]环加在上面显示的示例中,C-H 在共轭体系上迁移,因此我们用 C-H 键的HOMO 和 二烯烃的LUMO 或C-H 的LUMO 和二烯的HOMO 来分析,一般来说,用 C-H 的HOMO 和二烯烃的LUMO 更容易识别最佳轨道重叠。
当然,无论选择哪种轨 道组合,结果都是相同的。
从轨道的对称性可知,二烯烃在基态时的 LUMO 轨 道具有2个节点,两端轨道对称性一样,因此 C-H 键的[1,5]迁移是热允许的。
在基态时,迁移过程的环状过渡态更容易实现。
相反,三烯烃在基态时的LUMO 轨道具有3个节点,两端轨道是反对称的,所以,C-H 键的[1,7]迁移是异面的, 很难发生。
下图显示了不同数目 键两端轨道的对称性。
单烯烃LUMO 轨道末端波瓣是不同 相的,是反对称的;二烯烃LUMO 的末端波瓣是同相的,是对称的,并且与 键 HOMO 的末端波瓣相匹配,因此二烯烃与 键的“环加成”是热允许的同面重叠 过程。
σ迁移反应详解
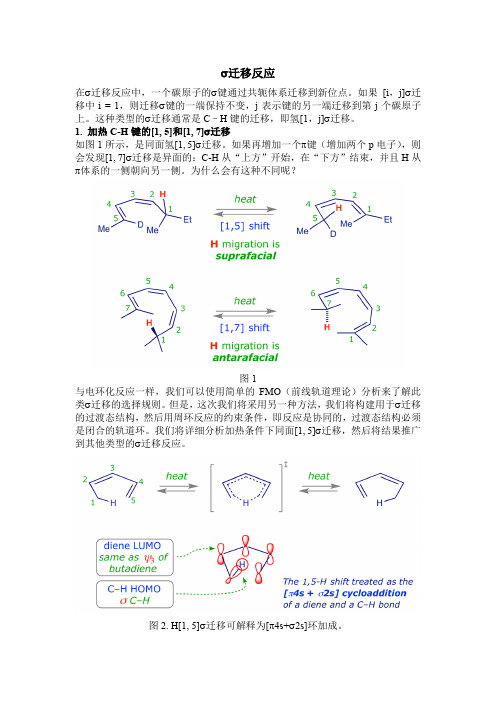
σ迁移反应在σ迁移反应中,一个碳原子的σ键通过共轭体系迁移到新位点。
如果[i,j]σ迁移中i = 1,则迁移σ键的一端保持不变,j表示键的另一端迁移到第j个碳原子上。
这种类型的σ迁移通常是C–H键的迁移,即氢[1,j]σ迁移。
1. 加热C-H键的[1, 5]和[1, 7]σ迁移如图1所示,是同面氢[1, 5]σ迁移。
如果再增加一个π键(增加两个p电子),则会发现[1, 7]σ迁移是异面的:C-H从“上方”开始,在“下方”结束,并且H从π体系的一侧朝向另一侧。
为什么会有这种不同呢?图1与电环化反应一样,我们可以使用简单的FMO(前线轨道理论)分析来了解此类σ迁移的选择规则。
但是,这次我们将采用另一种方法,我们将构建用于σ迁移的过渡态结构,然后用周环反应的约束条件,即反应是协同的,过渡态结构必须是闭合的轨道环。
我们将详细分析加热条件下同面[1, 5]σ迁移,然后将结果推广到其他类型的σ迁移反应。
图2. H[1, 5]σ迁移可解释为[π4s+σ2s]环加成。
在上面显示的示例中,C-H在共轭体系上迁移,因此我们用C-H键的HOMO和二烯烃的LUMO或C-H的LUMO和二烯的HOMO来分析,一般来说,用C-H 的HOMO和二烯烃的LUMO更容易识别最佳轨道重叠。
当然,无论选择哪种轨道组合,结果都是相同的。
从轨道的对称性可知,二烯烃在基态时的LUMO轨道具有2个节点,两端轨道对称性一样,因此C-H键的[1, 5]σ迁移是热允许的。
在基态时,迁移过程的环状过渡态更容易实现。
相反,三烯烃在基态时的LUMO 轨道具有3个节点,两端轨道是反对称的,所以,C-H键的[1, 7]σ迁移是异面的,很难发生。
下图显示了不同数目π键两端轨道的对称性。
单烯烃LUMO轨道末端波瓣是不同相的,是反对称的;二烯烃LUMO的末端波瓣是同相的,是对称的,并且与σ键HOMO的末端波瓣相匹配,因此二烯烃与σ键的“环加成”是热允许的同面重叠过程。
反应类型σ迁移反应命名
(T 迁移反应(Sigmatropic reaction )是反应物一个d 键沿着共轭体系从一个位置转移 到另一个位置的一类周环反应。
⑴通常反应是分子内的,同时伴随有n 键的转移,但底 物总的n 键和d 键数保持不变。
一般情况下d 迁移反应不需催化剂,但少数反应会受到 路易斯酸的催化。
d 迁移反应符合分子轨道对称守恒原理,是协同反应的一种,也就是说原有d 键的断裂, 新d键的生成,以及n 键的转移都是经过环状 过渡态协同一步完成的。
以Cope 重排反 应为例:命名d 迁移反应的命名方法, 是先将迁移前的d 键的两个原子均定为1号,从其两端分别开 始编号,把新生成的d 键所连接的两个原子 的编号i 、j 放在方括号内,记为[迁 移。
习惯上因S U ]o 因此,上面图示的反应是一个[3,30迁移反应。
也可以将迁移 的取代基原子写在前面,写成诸如 X…二迁移反应的形式。
迁移后,如果新形成的d 键在n 体系的同侧,称之为同面迁移;反之,则称为异面迁移。
图示它们也可以写在标记中,同面以 a 表示,异面以s 表示。
下面的 刃[1Q ]迁移反 应对于氢原子和戊二烯基来说都是同面的,因此是一个 ■ N ■ : -■■'l "迁移反应。
2 t2 1 V ■ ■ 2 [3,3](1.7]H H[1.3](1.5)RH在迁移反应中,如果和迁移键相连的碳原子为手性碳,而且迁移后,该碳原子仍在键断裂处形成新键,称为构型保持;如果新键在原键断裂处的相反位置形成,则称为构型翻转。
同芳香性可以在标记中用homo表示。
机理以…•「为例。
根据前线轨道理论,假定反应中发生迁移的厅键首先发生均裂,生成一个氢原子(或碳自由基)和一个奇数碳的共轭体系自由基,而反应的实质是氢原子(或碳自由基)在奇数碳的共轭体系自由基上发生的迁移。
它认为,反应中真正涉及到的是奇数碳共轭体系中含有单电子的前线轨道,它既是最高占有分子轨道(HOMO,也是最低未占有分子轨道(LUMO,而且反应的立体选择性也完全取决于该前线轨道的对称性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四节σ键迁移反应
一、定义、命名:
1.定义:1,3己二烯在加热时变成2,4-己二烯,C1上的一个氢原子迁移到C5上,σ-键也随着移动:
碳碳之间的σ-键也可以迁移,例如:
这些反应都是协同反应,旧的σ键断裂、新的σ-键生成和π-键的移动是同时进行的。
反应在加热或光照下进行,不需要催化剂。
一端或两端与π-键体系相连接的σ-键经过环状过渡迁移到新的位置,π-键体系也随之重新组合,这类反应统称σ-迁移。
2.命名:σ迁移的命名是以作用物中发生迁移的σ键作标准,从它的两端开始分别编号。
把新生成的σ键所连接的两个原子的位置i,j放在方括号中叫做[i,j]迁移。
如上面两个反应分别为[1.5]迁移和[
3.3]迁移。
二、氢原子参加的[i,j]迁移.
1.同面反应异面反应
①同面反应:迁移前后的σ键在共轭平面同一侧。
②异面反应迁移前后的σ键在共轭平面的异侧。
2.氢原子参加的[1,j ]迁移j个碳原子共轭烯自由基的HOMO。
假定C-H键断裂后生成一个氢原子和一个含j个碳原子的自由基(这是分析问题时的假定,并不代表反应历程),自由基的轨道。
如:[1,3]迁移:烯丙基自由基轨道为:
戊二烯自由基轨道为:
结论:
氢原子参加的[1,j]迁移j个碳的共轭自由基的HOMO
3.[1.3] σ键氢迁移
烯丙基自由基HOMO为:
同面禁阻异面对称性允许
[1.3]σ键氢迁移,同面特征是禁阻的,异面转移是允许的。
但由于分子的几何构型,氢从一边转移到平面的另一边所需的能量较高,异面迁移可能使对称性允许过程变的困难或不可能。
4. [1.5] σ键氢迁移
同面允许,异面禁阻。
如:1-氘茚在加热至200℃时,可得到2-氘茚,它是经过氘的σ键[1.5]迁移,而后又经过氢的σ键[1,5]迁移而得到的。
5. [1.7]σ迁移:同面禁阻,异面允许。
三.碳原子参加的[i,j ]迁移
上述迁移的是C-Hσ键,与氢的迁移类似,反应是烷基的迁移,即C-Cσ键的迁移。
氢的迁移时只有同面成键或异面成键问题,涉及到烷基碳的迁移时,既有面的问题还有迁移碳原子轨道以原有的一瓣成键(构型保持)还是以不成键的另一瓣去形成新键(构型反转)的问题。
1.[1.3]迁移:
同面,构型反转(转化),允许同面,构型保持,禁阻
如:
2.[1.5]迁移
同面,构型反转(转化),
同面,构型保持,允许
禁阻
同面,构型保持,允许同面,允许3.[3.3`]σ键迁移
最简单的[3.3`]σ键迁移为:
假定σ键破裂,生成两个烯丙自由基,其最高已占轨道中,3、3`两个碳原子上P轨道最靠近的一瓣位相相同,可以重叠。
在碳原子1和1`之间的键开始破裂时,3,3`之间就开始成键。
这样的过渡状态是轨道对称性允许的,空间条件也是可能的。
[3,3]迁移是例证最多的σ键迁移反应。
Cope重排和Claisen重排就是典型的例子。
①Cope重排:
3,4-二甲基-1,5-正二烯有两个手性碳原子经Cope重排主要可以得顺,反(Z,E)-2,6-辛烯。
这说明反应的过渡态为椅式:
②Claisen重排
这是一种有碳氧键参加的[3,3]迁移反应。
苯酚的烯丙醚加热时,烯丙基迁移到邻位碳原子上,γ碳原子与苯环的邻位相连接。
如邻位全部被占具的情况下,全得对位产物。
а碳原子用同位素标记,然后进行重排,也得到同样的结论。
