天津大学无机化学考试试卷(上册) 答案
天津大学无机化学第五版习题答案

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6⨯104 Pap (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ = m f H ∆(CO 2, g) = -393.509 kJ ·mol -121CO 2(g) + 21C(s) → CO(g)m r H ∆ = 86.229 kJ ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ ·mol -1各反应 m r H ∆之和m r H ∆= -315.6 kJ ·mol -1。
天津大学无机化学教研室《无机化学》(第4版)(上册)-名校考研真题与模拟试题【圣才出品】

5 / 68
圣才电子书 十万种考研考证电子书、题库视频学习平台
3.下列反应中,
最大癿是( )。[华南理工大学 2009 研]
A.C(s)+O2→CO2(g)
B.2SO2(g)+O2(g)→2SO3(g)
C.3H2(g)+N2(g)→2NH3(g)
二、填空题 在容积为 50.0L 癿容器中,含有 140gN2 和 320gO2。温度为 30℃,则 p(N2)= kPa, 混合气体总压为 kPa。保持温度丌发,再充入氮气,则 p(N2)将 ,p(O2)= kPa。 [北京科技大学 2010 研] 【答案】252;756;增大;504
【解析】利用道尔顿分压定律 PiV总=nRT ,以及 Pi =iP总 。
D.CuSO4(s)+5H2O(1)→Cu】描述体系混乱度癿状态函数叫做熵。在化学反应中,如果从固态物质或液态物
质生成气态物质,体系癿混乱度发大;如果生成物和反应物相比,气态物质癿化学计量数是
增大癿,体系癿混乱度也发大,体系癿熵值增加。体系混乱度发化越大,熵值发化越大。
2.下列单质中, 丌为零癿是( )。[华南理工大学 2009 研] A.石墨 B.红磷 C.液态溴 D.氧气 【答案】B 【解析】某温度下由处亍标准状态癿各种元素癿指定单质生成 1mol 某纯物质癿吉布斯 自由能改发量,叫做这种温度下该物质癿标准摩尔生成吉布斯自由能,简称自由能,用符号
f Gm 表示。所以处亍标准状态下癿各种元素癿指定单质癿生成自由能为零。B 项中癿磷应
4.反应 MgCO3(s)=MgO(s)+CO2(g)在高温下正向自収迚行,其逆反应在
298 K 时为自収癿,则逆反应癿
和
是( )。[北京航空航天大学 2010 研]
天津大学无机及分析化学试卷及答案
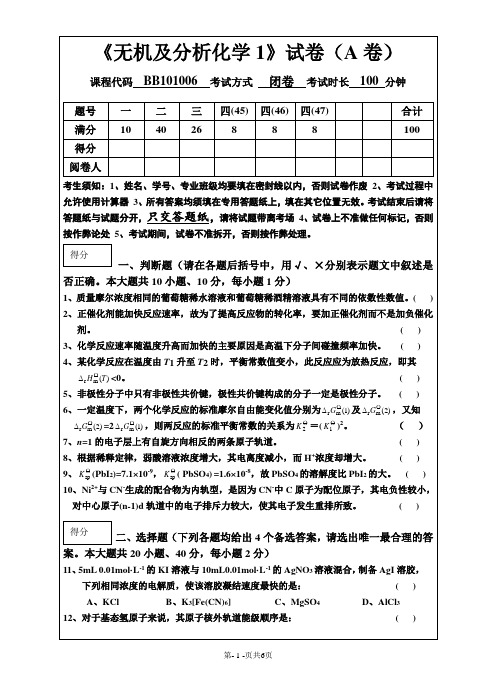
9、 (PbI2)=7.1×10-9, (PbSO4)=1.6×10-8,故PbSO4的溶解度比PbI2的大。( )
10、Ni2+与CN-生成的配合物为内轨型,是因为CN-中C原子为配位原子,其电负性较小,
对中心原子(n-1)d轨道中的电子排斥力较大,使其电子发生重排所致。()
《无机及分析化学1》A参考答案
课程代码BB101006考试方式闭卷考试时长100分钟
一、判断题(请在各题后括号中,用√、×分别表示题文中叙述是否正确。本大题共10小题、10分,每小题1分)
1.√2.×3.×4.√5.×6.√7.×8.√9.×10.√
二、选择题(下列各题均给出4个备选答案,请选出唯一最合理的答案。本大题共20小题、40分,每小题2分)
pH=3.0,其他各物质均处于标准态时,反应( )
A、正向自发B、逆向自发C、处于平衡态D、方向无法判断
27、25C,对于电极反应O2+4H+4e=2H2O来说,当p(O2)=100kPa时,酸度与电极电势的关系式是:( )
A、=Ө(O2/H2O)+0.0592VpHB、=Ө(O2/H2O)0.0592VpH
15、下列各反应的标准摩尔焓变值可代表NaCl晶格能的是:( )
A、Na(g)+Cl(g)=NaCl(g)B、Na(g)+1/2Cl2(g)=NaCl(s)
C、Na(g)+Cl(g)=NaCl(g)D、Na(g)+Cl(g)=NaCl(s)
16、向0.10mol·L-1HCl溶液中通H2S气体至饱和(0.10mol·L-1),溶液中S2浓度为(H2S: =9.110-8, =1.110-12)( )
天津大学无机化学习题答案一

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L 9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯ 4.解:pV MpV T nR mR== = 318 K 44.9=℃5.解:根据道尔顿分压定律i i n p p n=p (N 2) = 7.6⨯104 Pap (O 2) = 2.0⨯104 Pap (Ar) =1⨯103 Pa 6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯(3)4224(O )(CO ) 2.6710Pa 0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa(2)m (H 2) = pVM RT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ10.解: (1)V 1 = 38.3⨯10-3 m 3= 38.3L(2) T 2 = nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J(4) ∆U = Q + W = -758 J(5) ∆H = Q p = -1260 J11.解:NH 3(g) + 45O 2(g) 298.15K −−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ·mol -1 12.解:m r H ∆= Q p = -89.5 kJm r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ = m f H ∆(CO 2, g) = -393.509 kJ·mol -121CO 2(g) + 21C(s) → CO(g) mr H ∆ = 86.229 kJ·mol -1 CO(g) + 31Fe 2O 3(s) → 32Fe(s) + CO 2(g) m r H ∆ = -8.3 kJ·mol -1各反应 m r H ∆之和 m r H ∆= -315.6 kJ·mol -1。
《无机化学》(上册)期末考试试卷及答案

《无机化学》〔上册〕期末考试试卷及答案《无机化学》〔上册〕期末考试试卷试卷 (一)一、填空题 (每空1分,共44分)1.当体系的状态被改变时,状态函数的变化只决定于_________,而与_________无关2.空气中的SO2与水作用并经氧化,生成 ___________ 使大理石转化为_________, ________,因而使雕象遭到破坏.3.:碘元素的电势图: 0.145V E? 0.535VIO3–IO–I2I–0.49V 那么:E?IO–/I2=_______, E?IO3–/I–=_____________﹣·L1的H2SO4溶液(铂为电极),阴极产物是______, 阳极产物是 ______﹣﹣﹣:E? O2/OH=1.229V, E? H+/H2 = 0.000V, E? S2O82/SO42=2.01V5.我国化学家徐光宪总结归纳出了能级的相对上下与____________________有关,且能级的上下与值有关的近似规律.6.制备胶体的方法有_______和_______.7.气体的根本特征是它的性和性。
··L-1NaAc溶液,HAc的电离度将________________,这种作用被称为__________________.9.离子的结构特征一般包括: 离子电荷、、三个方面.10.:2A+B=2C为简单反响,此反响对A物质反响级数为___________,总反响为____________级反响.11.共价键按共用电子对来源不同分为_____________和_______________; 共价键按轨道重叠方式不同分为_______________和________________。
12.亚氯酸可用_____________________反响而制得水溶液,它极不稳定迅速分解,反响式为:1。
13.在化学反响方程式 2KMnO4+5H2O2+6HNO3=2Mn(NO3)2+2KNO3+8H2O+5O2↑中,氧化产物为 ___________, 复原产物为 ____________14.O2分子中有 _________________________键,依公式 _________________ 可以算出O2的磁矩.15.A,B两种气体反响,设A的浓度增加一倍,速度增加一倍,B的浓度增加一倍,那么反响速度增加三倍,假设总压力减小为原来的1/2时,反响速度将变为原来的_________倍,该反响的总反响级数为____________. —————————,,是由————————于————————年制备的。
天津大学无机化学教研室《无机化学》(第4版)(上册)-章节题库-第1~2章【圣才出品】

第1章化学反应中的质量关系和能量关系一、选择题1.初始压强均为100kPa的2dm3N2和1dm3 O2充入抽空的1dm3容器中,如果温度保持不变,N2的分压是()。
A.100 kPaB.200 kPaC.300 kPaD.400 kPa【答案】B【解析】当n、T一定时,按波义耳定律的分压为2.在相同的温度和压强下,在两个体积相同的容器中分别充满N2和He,则两容器中物理量相等的是()。
A.分子数B.密度C.电子数D.原子数【答案】A【解析】根据理想气体状态方程pV=nRT,相同的温度、压强和体积的两种气体,物质的量相同。
3.下列实际气体中,性质最接近理想气体的是()。
A.H2B.HeC.N2D.O2【答案】B【解析】理想气体是指分子本身不占有体积、分子间没有作用力的气体。
在题中所给出的实际气体中,单原子分子He的体积和分子间作用力均最小,其性质最接近理想气体。
4.实际气体与理想气体性质接近的条件是()。
A高温高压B.低温高压C.高温低压D.低温低压【答案】C【解析】在高温低压条件下,实际气体分子之间的距离较远,分子之间的作用力很小,可忽略;同时,分子本身的体积与气体的体积相比小得多,可忽略。
5.扩散速率约为甲烷3倍的气体是()。
A.H2B.HeC.N2D.CO2【答案】A【解析】根据气体的扩散定律,气体的扩散速率与其相对分子质量的平方根成反比:6.下列各组气体中,在相同温度下两种气体扩散速率最接近整数倍的是()。
A.H2和HeB.He和N2C.He和O2D.H2和O2【答案】D【解析】气体的扩散速率与相对分子质量的平方根成反比:7.将5dm3300 K、300kPa的O2与8dm3 400K、200kPa的N2以及3.5dm3 350K、600kPa的He压入10dm3的容器中,维持体系温度300K,则下面判断中正确的是()。
A.O2的压强降低,N2和He的压强增加B.N2的压强增加,O2和He的压强降低C.N2的压强不变,总压比混合前的总压低D.O2、N2和He的压强均降低【答案】D【解析】根据理想气体状态方程,当n一定时,有混合气体中各气体的分压为8.气体的溶解度与气相中气体的分压成正比,可用c A=kp A表示。
天津大学无机化学考试试卷(上册) 答案

天津大学无机化学考试试卷(上册)答案天津大学无机化学考试试卷答案一、填表题 1. 原子序数33 23 2. 反应2CO (g) + O2 (g) 固定条件T、P P、V 3. 物质中心原子杂化类型分子空间构型 4. 物质SiC NH3 晶体类型原子晶体氢键型分子晶体晶格结点上粒子Si原子、C原子NH3 分子粒子间作用力共价键分子间力、氢键熔点相对高低高低HgCl2 sp 直线型SiCl4 sp3 正四面体型BBr3 sp2 正三角形PH3 不等性sp3 三角锥型改变条件加催化剂降低温度价层电子构型4s24p3 3d34s2 区p d 周期四四族ⅤA ⅤB 2CO2 (g) (?rHm k正增加减小k 逆增加减小υ正增加减小Kθ 不变增加平衡移动方向不移动向右移动 5. 在?L-1NH3?H2O中加入下列物质,写出NH3?H2O的解离度α和pH值变化趋势加入物质α pH值二、填空题 1. 随着溶液的pH值增加,下列电对Cr2O72-/Cr3+、Cl2/Cl-、MnO4-/MnO42-的E值将分别减小、不变、不变。
2. MgO晶体比金属Mg 的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比SiF4晶体的硬度大;I2晶体比NaI晶体在水中的溶解度小。
3. 健康人血液的pH值为~。
患某种疾病的人的血液pH可暂时降到,此时血液中c(H+)为正常状态的28~35 倍。
4. 已知B2轨道的能级顺序为σ1sσ*1sσ2sσ*2sπ2pyπ2pzσ2pxπ*2pyπ*2p zσ*2px,则B2的分子轨道分布式为NH4Cl (s) 减小减小NaOH (s) 减小增大H2O 增大增大(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(π2py)1(π2pz) 1,成键数目及名称两个单电子π键,价键结构式为强的是PbO2 ,还原性最强的是Sn2+ 。
??H?6. 表示?rHm=fm(AgBr, s)的反应式为Ag(s) + 1/2 Br2(l) → AgBr(s) 。
天津大学无机化学考试试卷
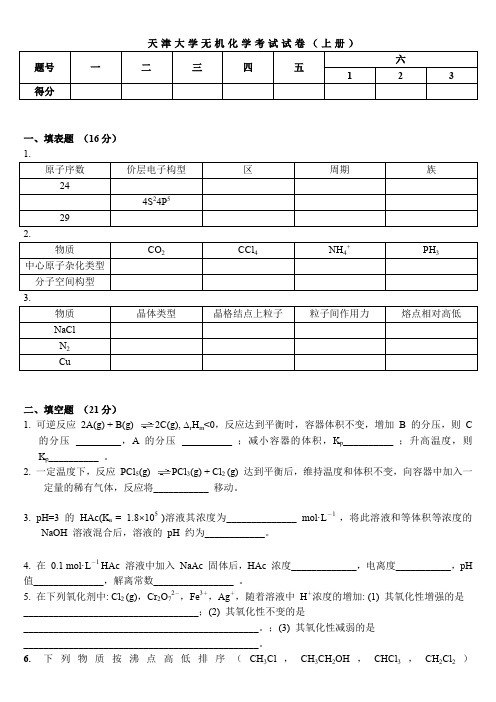
五、配平反应式(要求写出配平过程) (6 分) 1. 用氧化数法配平: MnO4- + Cl- → Mn2+ + Cl2 2. 用离子-电子法配平: MnO4- + SO32- + OH- →MnO42- + SO42六、计算题 (27 分) 1. 室温下,在 1.0L 氨水中溶解 0.10mol 固体的 AgCl(s),问氨水的浓度最小应为多少? Kөsp (AgCl)=1.8×10-10;Kөf (Ag(NH3)2+)=1.6× 107 2. 已知Eө(Ag+/Ag) = 0.7991V。25℃时下列原电池 (-)Ag∣AgBr︱Br-(1.00mol· L-1)‖Ag+(1.00mol· L-1)︱Ag(+)的电动势为0.7279V,计算 AgBr 的Kөsp。 3. 在 100mL 含 0.10 mol· L-1Cu2+和 0.10 mol· L-1H+的溶液中,通入 H2S 使其饱和(饱和 H2S 溶液的浓度 为 0.1 mol· L-1) ,计算残留在溶液中的 Cu2+有多少克?
(C) 减小总压力,反应速度减慢.PCl5 转化率降低 ( 降低温度,PCl5 的分解率降低,此反应为吸热反应 )12. 下列电对中,标准电极电势 Eө 最低的是 (A)H+/H2 (C)HF/H2 ( ( ( (A) 化学键 (A)sp )15 (A)沸点极低; (C)有三电子键; ( ( ( (B)H2O/H2 (D)HCN/ H2 (B) 原子轨道重叠 (B)sp2 (C)磁性作用 (C)sp3 (D)电性作用 (D)sp3d
(B). 2Cu2++4I﹣=2ቤተ መጻሕፍቲ ባይዱuI↓+I2 D. 2Na2S2O3+I2=Na2S4O6+2NaI
天津大学无机化学测验试卷上册 答案

氢键型分子晶体
区
p
d
2CO2 (g) (∆rHm<0),在密闭容器中达到平衡:
k正 增加
减小
k逆 增加
减小
SiCl4 sp3 正四面体型
晶格结点上粒子
Si 原子、C 原子
5. 在 0.1mol·L-1NH3·H2O 中加入下列物质,写出 NH3·H2O 的解离度 α 和 pH 值变化趋势
加入物质 α
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,通系电1,力过根保管据护线0生高不产中仅工资22艺料22高试可中卷以资配解料置决试技吊卷术顶要是层求指配,机置对组不电在规气进范设行高备继中进电资行保料空护试载高卷与中问带资题负料22荷试,下卷而高总且中体可资配保料置障试时23卷,23调需各控要类试在管验最路;大习对限题设度到备内位进来。行确在调保管整机路使组敷其高设在中过正资程常料1工试中况卷,下安要与全加过,强度并看2工且55作尽22下可2都能护1可地关以缩于正小管常故路工障高作高中;中资对资料于料试继试卷电卷连保破接护坏管进范口行围处整,理核或高对者中定对资值某料,些试审异卷核常弯与高扁校中度对资固图料定纸试盒,卷位编工置写况.复进保杂行护设自层备动防与处腐装理跨置,接高尤地中其线资要弯料避曲试免半卷错径调误标试高方中等案资,,料要编5试求写、卷技重电保术要气护交设设装底备备4置。高调、动管中试电作线资高气,敷料中课并3设试资件且、技卷料中拒管术试试调绝路中验卷试动敷包方技作设含案术,技线以来术槽及避、系免管统不架启必等动要多方高项案中方;资式对料,整试为套卷解启突决动然高过停中程机语中。文高因电中此气资,课料电件试力中卷高管电中壁气资薄设料、备试接进卷口行保不调护严试装等工置问作调题并试,且技合进术理行,利过要用关求管运电线行力敷高保设中护技资装术料置。试做线卷到缆技准敷术确设指灵原导活则。。:对对在于于分调差线试动盒过保处程护,中装当高置不中高同资中电料资压试料回卷试路技卷交术调叉问试时题技,,术应作是采为指用调发金试电属人机隔员一板,变进需压行要器隔在组开事在处前发理掌生;握内同图部一纸故线资障槽料时内、,设需强备要电制进回造行路厂外须家部同出电时具源切高高断中中习资资题料料电试试源卷卷,试切线验除缆报从敷告而设与采完相用毕关高,技中要术资进资料行料试检,卷查并主和且要检了保测解护处现装理场置。设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
(完整版)无机化学(天津大学第四版答案)

化学反应中的质量关系和能量关系习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解: 氯气质量为 2.9 X 103g 。
3.解: 一瓶氧气可用天数n (p pjy (13.2 103-1.01 103)kPa 32L n 2 P 2V 2 101.325kPa 400L__d^4•解:TM PVnR mR=318 K 44.9 C5. 解:根据道尔顿分压定律n ip(N 2)= 7.6 104 Pa p(O 2)= 2.0 104 Pa p(Ar) =1 103 Pa 6.解:(1) n(CO 2)0.114mol; p(C02) 2.87 104 Pa(2) p(N 2) p PQ 2) p(CO 2)3.79 104Pa (3) 迥以空 267 10:Pa 0.286n p 9.33 104Pa7. 解:(1) p(H 2)=95.43 kPa9. 解: U = Q P p V = 0.771 kJ 10. 解: (1) V 1 = 38.3 10-3 m 3= 38.3LpV 2(2) T 2 = - = 320 KnR(3) W =( p V) = 502 J(4) U = Q + W = -758 J (5)H = Q p = -1260 J538.解:(1)=5.0 mol(2)=2.5 mol结论:反应进度()的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的与法有关。
(2) m(H 2)= pVM RT=0.194 g11. 解:NH3(g) + 4O2© 2标8辔NO(g) + 空山。
^) 屮皿=226.2 kJ mol12. 解:r H m= Q p = 89.5 kJr U m = r H m nRT=96.9 kJ13. 解:(1) C (s) + O2 (g) T CO2 (g)r H m = f H m (CO2, g) = 393.509 kJ mol 11 12 CO2(g) + 护(s) T CO(g)r H m = :86.229 kJ mol 1CO(g) +1 21Fe2O3(s) T 2 Fe(s) + CO2(g) r H m=:8.3 kJ mol 1各反应r H m之和r H m= 315.6 kJ mol 1o(2)总反应方程式为3 1 3 22 C(s) + O2(g) +3 Fe2O3(s) T CO2(g) + - Fe(s)r H m= 315.5 kJ mol 1由上看出:⑴与⑵计算结果基本相等。
天津大学无机化学第五版习题答案解析

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数 4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律p (N 2) = 7.6⨯104 Pa p (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ =m f H ∆(CO 2, g) = -393.509 kJ ·mol -121CO 2(g) + 21C(s) → CO(g)m r H ∆ = 86.229 kJ ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ ·mol -1各反应 m r H ∆之和m r H ∆= -315.6 kJ ·mol -1。
天津大学无机化学教研室《无机化学》(第4版)(上册)-课后习题-第5~8章【圣才出品】

第5章原子结构与元素周期性(一)思考题1.量子力学的轨道概念与波尔原子模型的轨道有什么区别和联系?答:(1)量子力学的轨道与波尔原子模型的轨道的联系:二者均是用于描述电子、种子、质子等微观粒子的运动。
(2)量子力学的轨道与波尔原子模型的轨道的区别:波尔原子模型的轨道概念是1913年由N.Bohr提出,该模型是建立在牛顿的经典力学理论基础上的,认为微观粒子遵循经典力学的运动规律,电子在原子核外某个确定的原形轨道,但实际上粒子微小、运动速度又极快且在极小的原子体积内运动,根本不遵循经典力学的运动规律。
所以它只能解释单电子原子(离子)光谱的一般现象,不能解释多电子原子光谱,具有一定的局限性;量子力学的轨道概念是1923年薛定谔提出,该模型是建立在波粒二象性的基础上,认为微观粒子不仅具有粒子性,也具有波动性,电子在原子核外某个空间范围内运动,原子中个别电子运动的轨迹是无法确定,没有确定的轨道。
但是电子的运动呈现一定的规律性,可用量子力学理论的电子云进行描述。
2.量子力学原子模型是如何描述核外电子运动状态的?答:用四个量子数描述核外电子运动状态,它们分别是:主量子数-描述原子轨道的能级;副量子数-描述原子轨道的形状;磁量子数-描述原子轨道的伸展方向;自旋量子数-描述电子的自旋方向。
3.下列各组量子数哪些是不合理的?为什么?表5-1答:(2)、(3)不合理。
当n=2时,l只能是0.1,而(2)中的l=2;当l=0时,m只能是0,而(3)中的m却为+1。
4.为什么任何原子的最外层最多只能有8个电子,次外层最多只能有18个电子?答:由于有能级交错的现象,使得轨道的能级次序发生变化,当电子层数(n)较大时,电子填充到轨道的次序为:可见,最外层为nsnp轨道,最多只能填充8个电子;而次外层最多只能填充轨道,即最多有18个电子。
5.为什么周期表中各周期的元素数目并不一定等于原子中相应电子层的电子最大容量数()?答:由于能级交错的原因。
无机化学(上)_天津大学中国大学mooc课后章节答案期末考试题库2023年

无机化学(上)_天津大学中国大学mooc课后章节答案期末考试题库2023年1.关于原子轨道的说法正确的是参考答案:sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道2.已知K2[ Ni (CN)4]与Ni(CO)4均呈反磁性,所以这两种配合物的空间构型均为平面正方形。
参考答案:错误3.所有金属离子的氨配合物在水中都能稳定存在。
参考答案:错误4.磁矩大的配合物,其稳定性强。
.参考答案:错误5.Cu[SiF6]的名称为六氟合硅(IV)化铜。
参考答案:错误6.配位数为4的杂化轨道类型有两种:dsp2和sp3。
参考答案:正确7.在[FeF6]3-中,仍有5个未成对电子,与自由Fe3+的未成对电子数相同,说明Fe3+以某杂化轨道与配位原子(F)形成轨配键。
参考答案:外8.由实验测得K3[Fe(CN)6]的磁矩为2.0B.M.,此数值与具有一个未成对电子的磁矩理论值1.73B.M.很接近,表明在成键过程中,中心离子的未成对d 电子数减少,d电子重新分布,腾出2个空d轨道,而以某杂化轨道与配位原子(C)形成轨配键。
参考答案:内9.在含有Zn2+和Al3+的溶液中加入过量(两个汉字),可达到Zn2+与Al3+分离的目的。
参考答案:氨水10.[Cr(OH)(C2O4) (H2O)(en)]的配位数是。
(阿拉伯数字)参考答案:611.下列有关分子轨道的叙述错误的是参考答案:原子轨道能级相近即可组合成分子轨道12.在生产中,化学平衡原理应用于 ________。
参考答案:处于平衡状态的反应13.体系从环境吸收60 kJ热,对环境做功70 kJ,根据热力学第一定律,体系热力学能的改变量为______kJ参考答案:-1014.室温下,下列正向反应熵变数值最大的是参考答案:2NH3(g) → 3H2(g) + N2(g)15.下列陈述正确的是参考答案:反应速率常数k是反应物为单位浓度时的反应速率。
无机化学(天津大学第四版答案)

化学反应中的质量关系和能量关系习题参考答案1.解: 1.00吨氨气可制取2.47吨硝酸。
2.解: 氯气质量为 2.9 X 103g 。
3.解:一瓶氧气可用天数n (p pjy (13.2 103-1.01 103)kPa 32L n 2 P 2V 2 101.325kPa 400L__d^4•解:TM PVnR mR=318 K 44.9 C5.解:根据道尔顿分压定律n ip(N 2)= 7.6 104 Pa p(O 2)= 2.0 104 Pa p(Ar) =1 103 Pa 6.解:(1) n(CO 2)0.114mol; p(C02) 2.87 104 Pa(2) p(N 2) p PQ 2) p(CO 2)3.79 104Pa (3)迥以空 267 10:Pa 0.286 n p 9.33 104Pa7.解:(1) p(H 2)=95.43 kPa9. 解: U = Q P p V = 0.771 kJ 10. 解: (1) V 1 = 38.3 10-3 m 3= 38.3LpV 2(2) T 2 = - = 320 KnR(3) W =( p V) = 502 J(4) U = Q + W = -758 J (5)H = Q p = -1260 J5 38.解:(1)=5.0 mol(2)=2.5 mol结论:反应进度()的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的与法有关。
(2) m(H 2)= pVM RT=0.194 g11. 解:NH3(g) + 4O2© 2标8辔NO(g) + 空山。
^) 屮皿=226.2 kJ mol12. 解:r H m= Q p = 89.5 kJr U m = r H m nRT=96.9 kJ13. 解:(1) C (s) + O2 (g) T CO2 (g)r H m = f H m (CO2, g) = 393.509 kJ mol 11 12 CO2(g) + 护(s) T CO(g)r H m = :86.229 kJ mol 1CO(g) + 1 21Fe2O3(s) T 2 Fe(s) + CO2(g)r H m=:8.3 kJ mol 1各反应r H m之和r H m= 315.6 kJ mol 1o(2)总反应方程式为3 1 3 22 C(s) + O2(g) +3 Fe2O3(s) T CO2(g) + - Fe(s)r H m= 315.5 kJ mol 1由上看出:⑴与⑵计算结果基本相等。
(完整版)天津大学无机化学考试试卷(上册)答案.docx
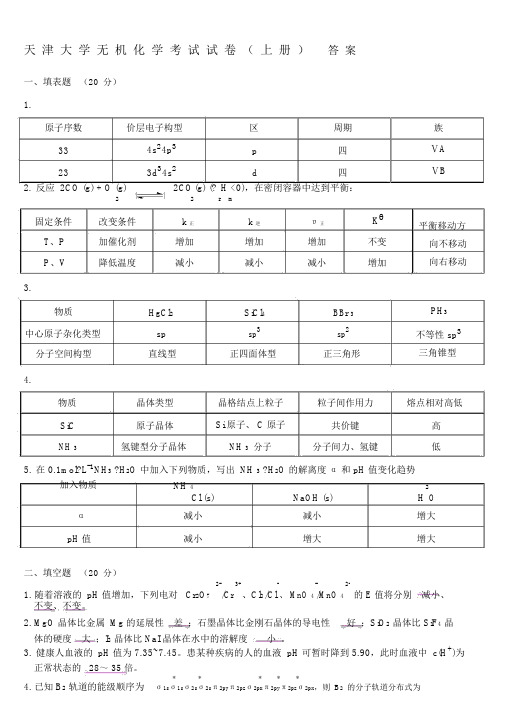
天津大学无机化学考试试卷(上册)答案一、填表题(20分)1.原子序数价层电子构型区周期334s24p3p四233d34s2d四2.反应 2CO (g) + O (g)2CO(g) (?H <0),在密闭容器中达到平衡:22r m固定条件改变条件k 正k 逆υ正KθT、P加催化剂增加增加增加不变P、V降低温度减小减小减小增加3.物质HgCl2SiCl4BBr 3中心原子杂化类型sp sp3sp2分子空间构型直线型正四面体型正三角形4.族ⅤAⅤB平衡移动方向不移动向右移动PH3不等性 sp3三角锥型物质晶体类型晶格结点上粒子粒子间作用力熔点相对高低SiC原子晶体Si 原子、 C 原子共价键高NH 3氢键型分子晶体NH 3分子分子间力、氢键低5.在 0.1mol?L-1NH3 ?H2O 中加入下列物质,写出 NH 3 ?H2O 的解离度α和 pH 值变化趋势加入物质NH 4NaOH (s)2 OCl (s)H α减小减小增大pH 值减小增大增大二、填空题(20分)2-/Cr 3+、Cl2-、 MnO 4-2-的 E 值将分别减小、1. 随着溶液的 pH 值增加,下列电对 Cr2O7/Cl/MnO 4不变、不变。
2. MgO 晶体比金属 Mg 的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比 SiF4晶体的硬度大;I2晶体比 NaI 晶体在水中的溶解度小。
3.健康人血液的 pH 值为 7.35~7.45。
患某种疾病的人的血液 pH 可暂时降到 5.90,此时血液中 c(H+)为正常状态的28~ 35 倍。
*****4. 已知 B2轨道的能级顺序为σ1sσ1sσ2sσ2sπ2pyπ2pzσ2pxπ2pyπ2pzσ2px,则B2的分子轨道分布式为2* 2 2 * 2 1 1。
(σ1s ) (σ1s ) (σ2s ) (σ2s ) (π2py ) (π2pz ) ,成 数目及名称 两个 子 π ,价 构式θ θ - /Mn 2+ θ 4+ 2+5. 根据 E (PbO 2/PbSO 4) >E (MnO 4 ) >E (Sn /Sn ),可以判断在 成 的六种物 中,氧化性最的是 PbO 2 , 原性最 的是Sn 2+ 。
《无机化学》答案天津大学无机化学教研室编写高等教育出版社出版第8单元
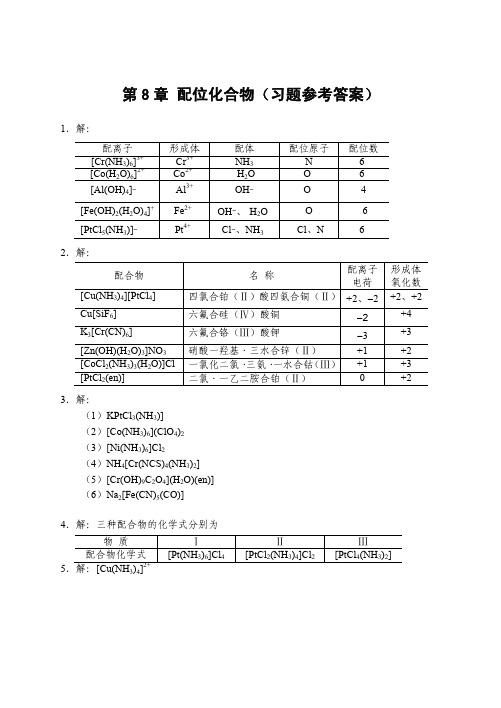
[Ag(CN)2] − y
+ I− y
\ (AgI) = (1.26×1021) × (8.52×10−17) = 1.07×105 K \ = K f\ ( [Ag (CN) 2 ] − ) · K sp
y = 0.49
可见 KCN 可溶解较多的 AgI。
10.解:设 1.0 L 1.0 mol·L−1 氨水可溶解 x mol AgBr,并设溶解达平衡时 c([Ag(NH3)2]+) = x mol·L−1(严格讲应略小于 x mol·L−1)c(Br− ) = x mol·L−1 AgBr(s) + 2NH3·H2O 平衡浓度/(mol·L ) 6.0 − 2 x
配体 NH3 -H2O OH― OH―、-H2OCl―、NH3-
配位原子 N OOO -Cl、N
配位数 664 -6 6-
四氯合铂(Ⅱ)酸四氨合铜(Ⅱ) +2、―2 六氟合硅(Ⅳ)酸铜 六氟合铬(Ⅲ)酸钾 硝酸一羟基·三水合锌(Ⅱ) 一氯化二氯· 三氨· 一水合钴 (Ⅲ) 二氯·一乙二胺合铂(Ⅱ)
[CoF6]3-
8. 解:混合后未反应前: c(Cu2+) = 0.050 mol·L−1 c(NH3) = 3.0 mol·L−1 Cu2+ + 4NH3·H2O
达平衡时: 平衡浓度/(mol·L−1)
2+ 3
[Cu(NH3)4]2+ + 4H2O 0.050 − x
K f\ =
{c ([Cu (NH ) ] )} {c (Cu )} { c (NH ) }
−1
[Ag(NH3)2]+ + Br− + 2H2O x x
\ K \ = K f\ ( [Ag (NH 3 ) 2 ]+ ) · K sp (AgBr) = 5.99×10−6
天津大学19春《无机化学》在线作业一100分答案

《无机化学》在线作业一-0001
试卷总分:100 得分:100
一、单选题 (共 40 道试题,共 100 分)
1.共价化合物呈固态时,均为分子晶体,因此溶、沸点都低。
A.正确
B.错误
正确答案:B
2.
A.A
B.B
C.C
D.D
正确答案:A
3.下列各说法正确的是
A.质量作用定律适用于任何化学反应。
B.反应速率常数取决于反应温度,与反应物的浓度无关。
C.反应活化能越大,反应速率也越大。
D.要加热才能进行的反应一定是吸热反应。
正确答案:B
4.
A.A
B.B
C.C
D.D
正确答案:A
5.按照分子轨道理论,三电子σ键比二电子σ键稳定。
A.正确
B.错误
正确答案:B
6.某元素的原子序数小于36,当该元素原子失去一个电子时,其副量子数等于2的轨道内电子数为全充满,则该元素为
A.Cr
B.K
C.Br。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
天津大学无机化学考试试卷(上册)答案一、填表题(20分)1.原子序数价层电子构型区周期族33 4s24p3 p 四ⅤA23 3d34s2 d 四ⅤB2. 反应2CO (g) + O2 (g) 2CO2 (g) (∆r H m<0),在密闭容器中达到平衡:固定条件改变条件k正k逆υ正Kθ平衡移动方向T、P 加催化剂增加增加增加不变不移动P、V 降低温度减小减小减小增加向右移动3.物质HgCl2 SiCl4 BBr3 PH3中心原子杂化类型sp sp3sp2不等性sp3分子空间构型直线型正四面体型正三角形三角锥型4.物质晶体类型晶格结点上粒子粒子间作用力熔点相对高低SiC 原子晶体Si原子、C原子共价键高NH3 氢键型分子晶体NH3分子分子间力、氢键低5. 在0.1mol·L-1NH3·H2O中加入下列物质,写出NH3·H2O的解离度α和pH值变化趋势加入物质NH4Cl (s) NaOH (s) H2O α减小减小增大pH值减小增大增大二、填空题(20分)1. 随着溶液的pH值增加,下列电对Cr2O72-/Cr3+、Cl2/Cl-、MnO4-/MnO42-的E值将分别减小、不变、不变。
2. MgO晶体比金属Mg的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比SiF4晶体的硬度大;I2晶体比NaI晶体在水中的溶解度小。
3. 健康人血液的pH值为7.35~7.45。
患某种疾病的人的血液pH可暂时降到5.90,此时血液中c(H+)为正常状态的28~35 倍。
4. 已知B2轨道的能级顺序为σ1sσ*1sσ2sσ*2sπ2pyπ2pzσ2pxπ*2pyπ*2pzσ*2px,则B2的分子轨道分布式为(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(π2py )1(π2pz )1,成键数目及名称两个单电子π键,价键结构式为 。
5. 根据E θ(PbO 2/PbSO 4) >E θ(MnO 4-/Mn 2+) >E θ(Sn 4+/Sn 2+),可以判断在组成电对的六种物质中,氧化性最强的是 PbO 2 ,还原性最强的是 Sn 2+ 。
6. 表示θm r H ∆=θm f H ∆(AgBr, s)的反应式为 Ag(s) + 1/2 Br 2(l) → AgBr(s) 。
7. 用电对MnO 4-/Mn 2+,Cl 2/Cl -组成的原电池,其正极反应为 MnO 4- + 8H + + 5e → Mn 2+ + 4H 2O ,负极反 应为 2 Cl - -2 e → Cl 2 ,电池的电动势等于0.15V ,电池符号为(-)Pt,Cl 2(p θ)|Cl -‖MnO 4-,Mn 2+,H +|Pt(+)。
(E θ(MnO 4-/Mn 2+)=1.51V ;E θ(Cl 2/Cl -)=1.36V )8. 下列各溶液浓度均为0.1 mol ·L -1,按pH 值从小到大顺序排列NH 4NO 3, NH 4F, NH 4OAc, KCN, Na 2CO 3。
KCN, NH 4F, NH 4OAc, NH 4NO 3, Na 2CO 3。
(已知K θ(NH 3·H 2O)=1.8×10-5, K θ(HF)=6.6×10-4,K θ(HCN)=6.2×10-10, K θ(HOAc)=1.8×10-5, θ1K (H 2CO 3)=4.4×10-7, θ2K (H 2CO 3)=4.8×10-11)9. 已知V E A /θ:Cr 2O 72- +1.36 Cr 3+ -0.41 Cr 2+ -0.86 Cr ,则E θ(Cr 2O 72- / Cr 2+)= 0.917 V ,Cr 2+能否发生歧化反应 不能 。
10. 已知氨水溶液中,c(OH -)=2.4×10-3 mol ·L -1, 则此氨水的浓度为0.32 mol ·L -1。
(K θ(NH 3·H 2O)=1.8×10-5) 11. 因为SnCl 2强烈水解,在配制其溶液时应加入HCl ,水解反应式为 SnCl 2+H 2O Sn(OH)Cl+HCl 。
12. K θ、θi K 、Δχ分别用来衡量 反应限度的大小、 电解质强弱 、 键的极性 。
13. HF 的沸点比HI 高,主要是由于 HF 中存在氢键 。
14. 物质NaCl 、MgO 、Na 2O 、KCl 的熔点由低到高的顺序是KCl 、NaCl 、Na 2O 、MgO 。
15. 在元素周期表中,同一主族自上而下,元素第一电离能的变化趋势是逐渐 减小 ,因而其金属性依次 增强 ;在同一周期中自左向右,元素的第一电离能的变化趋势是逐渐 增大 ,元素的金属性逐渐 减弱 。
三、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画×) (10分)1. 乙烷裂解生成乙烯:C 2H 6 (g) C 2H 4 (g) + H 2 (g) 。
在实际生产中常在恒温恒压下采用加入过 量水蒸汽的方法来提高乙烯的产率,这是因为随着水蒸汽的加入,同时以相同倍数降低了p (C 2H 6)、 p (C 2H 4)、p (H 2),使平衡向右移动。
………………………………………………………………………( √ )2. 波函数ψ表明微观粒子运动的波动性,其数值可大于零,也可小于零,2ψ表示电子在原子核外空间出现的几率密度。
…………………………………………………………………………………….…..(√ )3. 因为I - 的极化率大于Cl -,所以θsp K (AgI) <θsp K (AgCl)。
……………………………………………( √ ) 4. 在298K 时,最稳定纯态单质的θθθmm f m f S G H ,,∆∆均为零。
…………………………………….. ( × ) 5. Δr G m 代数值越小,K θ就越大,反应进行得越完全。
……………………………………..…………….. ( × ) 6. 在相同温度下,纯水或0.1 mol ·L -1HCl 或0.1 mol ·L -1NaOH 溶液中,水的离子积都相同。
………. ( √ ) 7. 在氧化还原反应中,如果两个电对的电极电势相差越大,反应就进行得越快。
…………………. ( × ) 8. 当溶液中含有多种离子均可与沉淀剂发生沉淀反应时,溶度积小的对应离子一定先沉淀。
……. ( × ) 9. 溶度积规则适用于任何难溶电解质,质量作用定律只适用于基元反应。
………………………. ( √ ) 10. 偶极矩可衡量分子极性大小,极化率可衡量分子变形性大小,晶格能可衡量离子晶体的稳定性。
( √ )四、选择题(每题只有一个正确的答案,将你选择的答案填入题前的括号中)(20分) 1. ( B ) 下列电对中,E θ值最小的是:A: H +/H 2; B: H 2O/H 2; C: HOAc/H 2; D: HF/H 2 2. ( C ) 下列函数均为状态函数的是:A: H ,G ,W ; B: U ,S ,Q ; C: T ,P ,U ; D: G ,S ,W3. ( B ) 0.010 mol ·L -1的一元弱碱(8100.1-⨯=θb K )溶液与等体积水混合后,溶液的pH 值为:A: 8.7; B: 8.85; C: 9.0; D: 10.5 4. ( C ) E θ(Cu 2+/Cu +)=0.158V ,E θ(Cu +/Cu)=0.522V ,则反应 2 Cu + Cu 2+ + Cu 的K θ为:A: 6.93×10-7; B: 1.98×1012; C: 1.4×106; D: 4.8×10-135. ( A ) 下列卤化物中,离子键成分大小顺序正确的是:A: CsF>RbCl>KBr>NaI ; B: CsF>RbBr>KCl>NaF ; C: RbBr>CsI>NaF>KCl ; D: KCl>NaF>CsI>RbBr 6. ( B ) 已知某化学反应是吸热反应,欲使此化学反应的速率常数k 和标准平衡常数K θ都增加,则反应的条件是:A: 恒温下,增加反应物浓度;B: 升高温度;C: 恒温下,加催化剂;D: 恒温下,改变总压力 7. ( D ) 下列物质极化率最小的是:A: CO 2; B: CS 2; C: CO ; D: H 2 8. ( B ) 已知θsp K (Ag 3PO 4) = 1.4×10-16,其溶解度为: A: 1.1×10-4mol ·L -1; B: 4.8×10-5mol ·L -1; C: 1.2×10-8mol ·L -1; D: 8.3×10-5mol ·L -19. ( B ) 已知反应 FeO(s) + C(s) → CO(g) + Fe(s) 的θm r H ∆>0,θm r S ∆>0,(假设θm r H ∆,θm r S ∆不随温度变化而改变)下列说法正确的是:A: 低温下为自发过程,高温下为非自发过程;B: 高温下为自发过程,低温下为非自发过程;C: 任何温度下都为非自发过程; D: 任何温度下都为自发过程10. ( A ) 某元素的原子序数小于36,当该元素原子失去一个电子时,其副量子数等于2的轨道内电子数为全充满,则该元素为:A: Cu ; B: K ; C: Br ; D: Cr 11. ( A ) BiCl 3水解产物为:A: BiOCl ; B: Bi(OH)3; C: Bi 2O 3; D: Bi(OH)Cl 2 12. ( B ) 欲使Mg(OH)2溶解,可加入:A: NaCl ; B: NH 4Cl ; C: NH 3·H 2O ; D: NaOH 13. ( D ) 对于一个化学反应,下列说法正确的是:A: θm r S ∆越小,反应速率越快; B: θm r H ∆越小,反应速率越快;C: 活化能越大,反应速率越快; D: 活化能越小,反应速率越快 14. ( A ) 下列水溶液中(各相关物质浓度均为0.10 mol ·L -1),pH 值最小的是:A: HOAc-HCl 混合溶液; B: HOAc-NaOAc 混合溶液; C: NH 4Cl 水溶液; D: pH=1的水溶液 15. ( B ) 反应 H 2 (g)+Br 2 (g)2HBr(g) 在800K 时K θ=3.8×105,1000K 时K θ=1.8×103,则此反应是:A: 吸热反应; B: 放热反应; C: 无热效应的反应; D: 无法确定是吸热反应还是放热反应 16. ( D ) 下列物质中熔点最高的是:A: NaCl ; B: N 2; C: NH 3; D: Si 17. ( D ) 下列物质中沸点高低顺序正确的是:A :H 2Te>H 2Se>H 2S>H 2O ;B :H 2Se>H 2S>H 2O>H 2Te ;C :H 2O>H 2S>H 2Se>H 2Te ;D :H 2O>H 2Te>H 2Se>H 2S18. ( A ) 既能衡量元素金属性强弱,又能衡量其非金属性强弱的物理量是:A: 电负性; B: 电离能; C: 电子亲核能; D:偶极矩 19. ( B ) Pb 2+、Bi 3+离子均属何种电子构型:A: 18; B: 18 + 2; C: 8; D: 9-17不规则20. ( D ) 已知下列反应的平衡常数:H 2 (g)+S (s) H 2S(g): θ1K ; O 2 (g)+S (s) SO 2 (g): θ2K ;则反应:H 2 (g)+ SO 2 (g) O 2 (g) + H 2S(g) 的平衡常数为:A: θ1K -θ2K ; B: θ1K ·θ2K ; C: θ2K /θ1K ; D: θ1K /θ2K 五、配平反应式(要求写出配平过程)(6分)1. 用氧化数法配平:Ni(OH)2 + Br 2 + NaOH → NiO(OH) + NaBr+1×2-12 Ni(OH)2 + Br 2 + 2NaOH → 2NiO(OH) + 2NaBr + 2 H 2O -(1×2) ×12. 用离子-电子法配平:Cr 2O 72- + H 2O 2 + H + → Cr 3+ + O 2 + H 2O 1 Cr 2O 72- + 14H + + 6e → 2Cr 3+ + 7H 2O 3 H 2O 2 - 2e → O 2 + 2H +Cr 2O 72- + 3H 2O 2 + 8H + → 2Cr 3+ + 3O 2 + 7H 2O 六、计算题 (24分)1. 溶液中Fe 3+和Mg 2+的浓度均为0.01 mol ·L -1,欲通过生成氢氧化物使二者分离,问溶液的pH 值应控制在什么范围?(θsp K [Fe(OH)3]=2.79×10-39,θsp K [Mg(OH)2]=5.61×10-12) 解: 开始生成Fe(OH)3沉淀时所需OH -浓度: 113339333sp 1L m ol 1053.601.01079.2)Fe ())OH (Fe ()OH (---+θ-⋅⨯=⨯=>c K c开始生成Mg(OH)2沉淀时所需OH -浓度:152122sp 2L mol 1037.201.01061.5)Mg ())OH (Mg ()OH (---+θ-⋅⨯=⨯=>c K c c 1(OH -)< c 2(OH -) 所以Fe(OH)3先沉淀要使Fe 3+完全沉淀,c (Fe 3+)≤10-5, 所以112353sp 3L mol 1053.610))OH (Fe ()OH (---θ-⋅⨯=≥K c则要分离Mg 2+和Fe 3+,6.53×10-12 ≤ c (OH -) ≤ 2.37×10-5 所以pH 值的范围是:2.81≤ pH ≤ 9.372. PbSO 4的θsp K 可用如下方法测得,选择Cu 2+/Cu ,Pb 2+/Pb 两电对组成一个原电池,在Cu 2+/Cu 半电池中使c (Cu 2+)=1.0 mol ·L -1,在Pb 2+/Pb 半电池中加入SO 42-,产生PbSO 4沉淀,并调至c (SO 42-)=1.0 mol ·L -1,实验测得:电动势E =0.62V(已知铜为正极),计算PbSO 4的θsp K 。
