22716化妆品良好生产规范GMP手册
ISO22716:2007化妆品良好生产规范(GMP)标准解析

标 准 进 行 确认 ” 即 :质 量 控 制 为 质 量 确保 提 供 依 据 .质 量控 制 和质 量确 保 的工 作 相 辅 相成 ,密 不 可分 .质量 负责 人 可 以 同时兼 任 质 量确 保 部 门 和 质量控 制部 门负 责人 。
口 的 控 制 等 细 节 都 做 出 了 明 确 的 要 求 IO2 7 6 S 2 1
时是 生产 部 或业 务部 负责人 .不 仅 需要 对 交 期延
迟 承 担 责 任 ,也 需 要 对 产 品 质 量 不 合 格 而 承 担 责
任 ,该 如 何取 舍 呢? 这批 货 是 否 一定 能 被 隔离 调 查 暂不放 行 呢7 2、标 准条 款 331 “ 理者 职责 ” ... 管 2 标准 要求 简 述 :最 高 管 理 者负 责 推行 良好 生 产规 范 ( 以下简 称 GMP )并 要求 全员 参与 解 析 :一 个企 业 的命 运 .最终 掌 握 在最 高管 理 者 手 中 。工 厂 在 运 行 GMP过 程 中资 源 的 需 求
质量 部 门独 立性 规 定 的重要 性 .笔 者将 在 标
准 后 面条款 的理 解 中进 ~ 步 阐述 .我们 也 可 以 通 过这 样一个 简单 的例 子来先 行体 会 : 工 厂接 到一个 利 润 可 观 的大 订单 .客 户 对 于 交货 期要 求 相 当 紧迫 .如 果不 能 按 时 出货 .工 厂 将 面 临违 约 赔 偿 和 失 去 与 客 户 长期 合 作 的 机会 就在 出货 前 一天 .成 品 被质 量 控 制 实验 室 检 测 到 细 菌 总数超 标 .由于 超标 数 不 多 .而 半 成 品检 测 结 果显 示质 量 良好 .成 品最 终是 否被 确 定 为不 合 格 品需 要进 一 步调 查 。如 果 质量 负责 人 的直 属 上 司是生 产部 或 业务 部 负责 人 .或 者 质 量 负责 人 同
ISO22716化妆品—良好生产规范(GMP)准则

ISO22716化妆品—良好生产规范(GMP)准则标准号ISO 22716:2007目录介绍 (1)1范围 (1)2术语和定义 (1)3员工 (4)4厂房 (6)5设备 (8)6原料和包材 (10)7 生产 (11)8 成品 (14)9实验室质量控制制 (15)10不合格品的处理 (17)11废弃物 (17)12 外包 (18)13 偏差 (19)14投诉和召回 (19)15变更控制 (19)16 内审 (20)17 文档 (20)介绍这份准则为化妆品良好生产规范做出指导,是适合化妆品行业并考虑了行业的具体要求,在人员,技术和影响产品质量的综合因素方面提供了系统性的和实际性的建议。
这个指导是为了让员工遵守产品接收到装运的流程下如何去利用资源。
为了达到此目的,在每一个章节里都添加了“原则”这一栏。
良好生产规范中的质量保证发展观念是通过描述建立在科学有效的判定和风险评估上的工厂活动来完成的,这份准则的目的是为了界定能让你获得达标产品的活动。
文件是 GMP 不可或缺的一部分。
化妆品良好生产规范准则1范围此国际标准为化妆品生产,控制,储存和装运提供指南这个标准包含产品质量的各个方面但不包括员工安全和对环境的保护方面,安全和环境保护是公司的应的责任,可以通过当地的法律和法规加以管制这些准则并不适用于设计和开发和产品营销活动。
2术语和定义以下术语和定义对于本文件是适用的2.1接收标准数值限度,范围或者其他可作为接受测试结果的方法2.2审核为获得审核证据并对其进行客观评价,以确定满足审核准则的程度而进行的系统的、独立的、形成文件的过程。
2.3批从某个或多个操作获得的、认为是一致的特定数量的原料,包材或产品。
2.4批号单个数字,字母,或字母和数字结合的,用来指定识别一批产品的代码.2.5散装产品经过所有制造工艺过程的产品,除了没有填充到独立包装的产品。
2.6校准在特定条件下,通过一系列操作在测量仪器或测量系统所指示的量值,或事物量具或参考事物表示的值,和按标准实现的相应值间建立起一种关系。
GMPC化妆品良好生产规范手册及程序文件(全套)

化妆品良好生产规范指南(GMPC)GMPC目录什么是GMPC?实施GMP的优点GMPC的五个部分GMPC的主要内容化妆品GMPC认证的起源化妆品GMPC认证的发展趋势什么是GMPC?GMPC 中文名称化妆品良好生产规范GMP(GMP Good Manufacturing Practice)即良好生产规范,最早是美国国会为了规范药品生产而于1963年颁布的。
这也是世界上第一部GMP。
由于GMP在规范药品的生产,提高药品的质量,保证药品的安全方面效果非常明显,FDA即美国食品,药品管理局于1980年颁布了食品GMP以规范食品的生产。
1992年,FDA颁布了化妆品GMP指引以引导化妆品生产企业规范其化妆品的生产,从而保证化妆品的卫生和安全。
欧盟为了保证在其境内生产的和销售的化装品(包括从欧盟境外输入)不会对消费者的健康造成伤害于1976年7月26日颁布了化妆品指令76/768/EE,于2003年2月27日颁布最新的该指令(第七版)。
该最新指令要求生产化妆品的工厂需要符合良好操作规范, 重点是确保化妆品生产过程的安全与卫生,防止异物、毒物、微生物污染产品。
在美国和欧盟市场上销售的化妆品,都必须符合美国联邦化妆品法规或欧盟化妆品指令---- GMPC全称为Guideline for Good Manufacture Practice of Cosmetic Products,中文叫化妆品良好生产规范,以确保消费者正常使用后的健康。
实施GMP的优点• 确保产品安全;• 提高产品质量;• 消除危险事故;• 降低产品对消费者造成的伤害或死亡的风险;• 降低产品公众回收的风险;• 符合法规和贸易准则• 良好的工作环境;• 有效控制成本和国际认可;• 增强产品竞争力;• 有效的产品追溯;GMPC的五个部分质量体系、采购、生产、分包生产和质量管理GMPC的主要内容人员只有入职健康检查合格的人员才能从事化妆品生产,而且员工必须有良好的个人卫生状况和习惯。
ISO22716GMP中文版

1.范围这一国际标准是对化妆品的生产、控制、贮藏和装运的指南。
这些知道包括产品质量方面,但作为一个整体不包括工厂从业人员的安全问题,也不包括环境保护问题。
安全和环境问题是属于公司的责任而且应受制于当地法律和管理条例这些指南不适用于产品的研发和销售活动2.条款和定义本文档的目的是以下条款和定义的应用2.1验收标准数值范围、区间后者其它适于测试结果验收的衡量方法2.2审计通过系统的、独立的检测来判定质量活动和相关结果是否符合计划安排,以及这些计划安排的实施是否有效并且有助于实现既定的目标。
2.3批量明确原材料数量、包装材料或产品发布的一个过程或者一系列过程以期实现材料的合理配置2.4批号识别一个批量所规定的不同的数字组合、字母和/或标志2.5散货任何已完成制造阶段、但不包括最后包装的产品2.6校准在特定的条件下设定一系列操作,建立起以一种测量工具、测量系统或实物测量方法得出的测试值与对应的参考标准已知值之间的关系2.7变更控制为了确保产品的制造、包装和贮藏符合明确的接受标准,GMP所包含的对于任何一种或多种变更计划活动的内部组织和责任。
2.8清洁为了确保一定程度的清洁和美观,利用多种方法分离和清除物体表面不同部分的可见污垢,包括化学方法、物理方法、高温方法、持续应用。
2.9投诉外部信息称一种产品未达到规定的验收标准2.10沾污在产品中出现了任何不良物质,例如化学,物理和/或微生物物质2.11消耗品在清洁、卫生处理或维护工作过程中消耗的例如清洁剂和润滑剂这样的物质。
2.12合同受方代表另一个个人、公司或组织执行一项工作的个人、公司或外部机构。
2.13控制核实验收标准的合格性2.14偏差内部组织和责任涉及到的是由于一种计划之内或计划之外的情况造成的原标准偏离规定的要求问题。
总之,这些问题都属于GMP涵盖项下的一种或多种活动的临时情况。
2.15成品化妆品已经完成了所有的生产阶段,包括为装运进行的最终容器的包装。
ISO22716_GMPC程序文件及质量手册

XX化妆品有限公司根据《化妆品生产许可检查要点》& GMPC编制文件编号:XXXX-QP版本:A版次:0受控状态:受控编制:编写小组审核:批准:2020年07月01日发布 2020年07月15日实施修改页目录一、人员管理制度............................................................................................................................ - 7 -(一)人员培训和考核管理制度............................................................................................ - 7 -(二)人员档案管理制度...................................................................................................... - 11 -二、文件管理制度.......................................................................................................................... - 13 -(三)文件管理制度.............................................................................................................. - 13 -(四)记录管理制度.............................................................................................................. - 18 -三、物料供应管理制度.................................................................................................................. - 21 -(五)供应商筛选、评估、检查和管理制度...................................................................... - 21 -(六)物料采购管理制度...................................................................................................... - 26 -(七)物料索票索证管理制度.............................................................................................. - 29 -(八)物料验收管理制度...................................................................................................... - 31 -(九)物料和产品储存管理制度.......................................................................................... - 34 -(十)有效期管理制度.......................................................................................................... - 37 -(十一)物料发放与使用管理制度...................................................................................... - 39 -(十二)散装物品管理制度.................................................................................................. - 42 -(十三)产品运输管理制度.................................................................................................. - 43 -(十四)仓储作业管理制度.................................................................................................. - 45 -四、检验管理制度.......................................................................................................................... - 48 -(十五)检验管理制度.......................................................................................................... - 48 -(十六)实验室仪器和设备的管理制度.............................................................................. - 52 -(十七)检验仪器及工具的计量管理制度.......................................................................... - 55 -(十八)实验室试剂、试液、培养基管理制度.................................................................. - 58 -(十九)检验结果超标的管理制度...................................................................................... - 61 -(二十)抽样管理制度.......................................................................................................... - 67 -五、放行管理制度.......................................................................................................................... - 69 -(二十一)放行管理制度...................................................................................................... - 69 -六、设施设备管理制度.................................................................................................................. - 71 -(二十二)设备采购、安装、确认、使用管理制度.......................................................... - 71 -(二十三)生产设备及水处理系统清洁、消毒、维护保养程序...................................... - 75 -七、生产工艺管理制度.................................................................................................................. - 79 -(二十四)生产管理制度...................................................................................................... - 79 -(二十五)批号管理制度...................................................................................................... - 83 -(二十六)生产区域及包材清洁消毒管理制度.................................................................. - 84 -(二十七)生产过程中防止混淆、差错、污染和交叉污染管理制度.............................. - 87 -(二十八)生产过程检验管理制度...................................................................................... - 93 -(二十九)废水、废气、废弃物管理制度.......................................................................... - 96 -(三十)清场管理制度.......................................................................................................... - 98 -八、卫生管理制度........................................................................................................................ - 100 -(三十一)人员健康卫生及健康档案管理制度................................................................ - 100 -(三十二)人员进入生产车间卫生管理制度.................................................................... - 102 -(三十三)外来人员进入车间管理制度............................................................................ - 104 -(三十四)虫害控制管理制度............................................................................................ - 106 -(三十五)厂区卫生规范管理制度.................................................................................... - 108 -九、留样管理制度........................................................................................................................ - 112 -(三十六)留样管理制度.................................................................................................... - 112 -十、内部检查及管理评审制度.................................................................................................... - 115 -(三十七)内部审核管理制度............................................................................................ - 115 -(三十八)管理评审程序.................................................................................................... - 120 -十一、追溯管理制度.................................................................................................................... - 123 -(三十九)标识与可追溯控制程序.................................................................................... - 123 -十二、不合格品管理制度............................................................................................................ - 125 -(四十)不合格品管理制度................................................................................................ - 125 -(四十一)纠正预防措施程序............................................................................................ - 129 -(四十二)返工管理制度.................................................................................................... - 133 -十三、投诉与召回管理制度........................................................................................................ - 134 -(四十三)产品销售退换货管理制度................................................................................ - 134 -(四十四)产品质量投诉管理制度.................................................................................... - 136 -(四十五)产品召回与撤回管理制度................................................................................ - 139 -(四十六)顾客满意信息处理程序.................................................................................... - 146 -(四十七)产品销售管理控制程序.................................................................................... - 149 -十四、质量安全控制制度............................................................................................................ - 151 -(四十八)不良反应检测报告控制程序............................................................................ - 151 -(四十九)质量安全事故处置程序.................................................................................... - 153 -(五十)风险管理制度........................................................................................................ - 158 -(五十一)偏差管理制度.................................................................................................... - 164 -(五十二)良好操作规范实施程序.................................................................................... - 169 -(五十三)变更管理制度.................................................................................................... - 175 -(五十四)验证管理制度.................................................................................................... - 182 -(五十五)法规引用管理制度............................................................................................ - 185 -十五、产品设计与开发管理制度................................................................................................ - 187 -(五十六)产品设计与开发管理制度................................................................................ - 187 -(五十七)产品稳定性测试程序........................................................................................ - 190 -(五十八)配方管理制度.................................................................................................... - 192 -(五十九)样品制作管理制度............................................................................................ - 194 -十六、基础设施管理制度............................................................................................................ - 197 -(六十)基础设施管理制度................................................................................................ - 197 -十七、业务管理制度.................................................................................................................... - 200 -(六十一)业务流程管理制度............................................................................................ - 200 -(六十二)订单评审管理制度............................................................................................ - 204 -(六十三)外包过程控制程序............................................................................................ - 207 -(六十四)顾客财产管理制度............................................................................................ - 210 -十八、有毒有害品管理制度........................................................................................................ - 212 -(六十五)有毒有害物品管理制度...................................................................................... - 212 -一、人员管理制度(一)人员培训和考核管理制度编号:XXXX-QP-01-A/01.目的对承担质量管理职责的人员,规定相应岗位的能力要求,通过培训增强员工的意识和能力,使其能胜任岗位工作。
企业验厂GMPC化妆品良好生产规范手册及30个程序文件(最新原创全套)共112页 (2018年度)

化妆品良好生产规范ISO22716(GMPC)管理手册(最版全套)含30个程序文件(原创全套)共112 页2018年* 月* 日颁布令产品质量管理是涉及到我公司生存发展的一个环节,为了进一步完善企业的质量制度,加强各具体操作部门的规范化管理,由公司行政部负责,组织相关部门共同编制了此本“手册”。
现印发给各部门,希望以此能使我公司质量管理水平达到一个新的台阶,从而保证各项产品质量,提高企业整体效益。
同时任命 *** 为GMPC管理体系的管理者代表,负责公司GMPC管理体系的建立、维护和改进。
本手册于2017年9月1日起开始实施。
总经理:公司简介***********有限公司是一家专业研发、生产、销售***的公司。
本公司拥有强大的研发技术及生产能力,立足于自主开发,自主设计新产品,和国际上知名的品牌合作,开发出众多优秀的产品。
产品采用高档进口原材料生产。
ISO22716:2007(GMPC)组织架构图体系职能分配表为了更好地执行ISO22716:2007(GMP)标准,公司编制了体系职能分配表,便于各部门遵照执行。
1. 制订目的规范公司化妆品的生产、控制、贮藏和装运,使之符合ISO22716:2007(GMPC)标准要求。
2. 适用范围公司化妆品的生产、控制、贮藏和装运的全过程。
3. 定义说明3.1 验收标准数值范围、区间后者其它适于测试结果验收的衡量方法。
3.2 审计通过系统的、独立的检测来判定质量活动和相关结果是否符合计划安排,以及这些计划安排的实施是否有效并且有助于实现既定的目标。
3.3 批量明确原材料数量、包装材料或产品发布的一个过程或者一系列过程以期实现材料的合理配置。
3.4 批号识别一个批量所规定的不同的数字组合、字母和/或标志。
3.5 散货任何已完成制造阶段、但不包括最后包装的产品。
3.6 校准在特定的条件下设定一系列操作,建立起以一种测量工具、测量系统或实物测量方法得出的测试值与对应的参考标准已知值之间的关系。
ISO22716化妆品良好生产规范生产车间清洁消毒良好操作规范

3.1.3.3. 填写好品名、浓度、配制人、配制时间贴于盛装容器上,并存放于消毒剂存放柜内。
3.1.3.4. 做好配制记录。
3.1.3.5. 注:一般手消毒使用浓度为0.1%,墙壁、地面使用浓度为0.2~0.3%。
3.2.4. 填写好品名、浓度、配制人、配制时间贴于盛装容器上,并存放于消毒剂存放柜内。
3.2.5. 做好消毒剂配制记录。
3.3. 75%乙醇(V/V)的配制
3.3.1. 配制前准备工作同上。
3.3.2. 取95%药用酒精按不同要求过滤处理,放洁净桶内,按要求加不同级别的水,搅匀,室温下用酒精计测量至规定刻度70%~75%(V/V),即得。
7.7. 凡需带手套操作人员,除正常生产动作外,不应伸手乱摸设备及无关物料。
四、物料进入洁净区清洁程序
1. 在非洁净区核对物料品名、批号、数量,应与领料单相符,并仔细检查物料的外包装是否完好,所有物料应附有检验合格证。
2. 进入外清间后外包装并用吸尘器或其它方法清洁,然后脱去外包装,装物料送入缓冲间。
3. 打开缓冲间外侧门,将物料送入,然后关好外侧门。
4. 车间物料按在缓冲间用75%酒精擦抹物料包装,对包装外表面进行消毒。
5. 不能脱去外包装的物料,在外清间用洁净抹布清洁送入缓冲间。然后用75%酒精按前法进行消毒,必要时可更换包装。
6. 开启传递柜内紫外灯。洁净区内的人员将紫外灯关闭,打开内侧门,将物料传入洁净区,物料在缓冲间停留不少于10min。
编 制
审 核
批 准
一、消毒剂配制与使用
二、洁净区地漏清洗
化妆品良好生产规范质量手册

GMP手册化妆品良好生产规范文件编号:GMPC-01版本号:A/0编写:审核:批准:发放号:批准页本公司《化妆品良好生产规范》,即GMP手册,是依据US022716:2007》和《化妆品生产企业卫生规范》等国内相关的化妆品卫生法规和本公司的实际而编写,规定了建立良好生产规范的要求和方法。
发布本手册目的是为了在本公司内建立良好的生产规范,以确保化妆品卫生质量和消费者的使用安全。
本手册是公司在化妆品良好生产规范方面对消费者和社会的承诺,又是公司在生产时必须遵循的法规性文件,全体员工必须遵照执行。
本文件自2016年7月1日起生效,即GMPC管理体系自2016年7月1日起实施。
总经理:___________________2016年6月30日0.综述0.1GMP手册说明0.1.1公司的GMP手册(化妆品良好生产规范)系依据《IS022716:2007》和《化妆品生产企业卫生规范》等国内相关的化妆品卫生法规并结合本公司的实际编写,是本公司《化妆品良好生产规范》的书面文件。
0.1.2GMP手册的管理0.1.3手册是受控文件,由品管部控制其标识、修改、保存、发放和回收、作废和销毁,依据《文件控制程序》实施。
0.2公司简介XXXX化妆品有限公司于2011年由瑞姿包装和南京野生植物综合利用研究院共同投资建立的一家,集研发、生产、销售为一体的化妆品0EM\0DM代加工企业,拥有优秀的研发团队、设备仪器、检测标准;符合GMPc(化妆品良好生产规范)的要求的厂房设施、设备仪器;有长期合作可靠的原料厂商、包材厂商等合作伙伴;为实现“创一流品牌,做客户信赖的企业”的企业质量目标夯下坚实的基础。
工厂地址:邮编:电话:0.3组织结构0.3.1组织机构图见附件0.4质量方针和目标0.4.1质量方针:“创一流品牌,做客户信赖的企业”0.4.2质量目标1、顾客满意度≥85%2、成品出厂合格率100%3、顾客投诉处理率100%0.5定义0.5.1原料组成或参与散装产品制造过程的物质。
iso22716化妆品良好生产规范画册

iso22716化妆品良好生产规范画册, 挑战随着社会经济、人民生活质量的飞速发展,化妆品的进出口贸易正在快速增长。
化妆品工业的发展,产品技术含量不断增加,质量不断提高,化妆品出口贸易将会有更大的发展。
与之相随,化妆品企业会面临日益严峻的出口竞争压力的挑战,化妆品企业越来越被要求其不仅在品牌影响力而且在产品质量上也要严格把关。
国外化妆品品牌对工厂都有较严格的要求,普遍对工厂的硬件、设施、卫生、人员和管理系统有严格的要求。
为此,化妆品国际认证ISO22716标准——化妆品良好操作规范将逐渐发展成为化妆品出口标准新趋势,通过此认证可以使其管理水平较大幅度的提升;亦对产品进入国际市场起到良好的促进作用。
, ISO22716简介标准化组织(ISO)2007年11月制定了“ISO22716:2007”标准:化妆品——良好操作规范(Cosmetics-Good Manufacturing Practices)。
该标准为化妆品制造商提供:生产、控制、贮存等方面的操作指南。
ISO22716化妆品国际标准规范了化妆品制造商的管理要求;硬件要求(厂房、生产场所、设备等),材料的采购和使用及产品制造过程的卫生与品质控制、人员卫生管理、产品检验、质量异常的处置及产品投诉与召回等内容。
, ISO22716与GMPC的区别两个都是化妆品的认证标准,但两者的区别是:ISO22716是针对欧盟最新法规(EC)NO 1223/2009 面向欧洲市场可以做的认证标准,而GMPC分为三个版本,即GMPC(US)美标, GMPC(EU)欧标, GMPC(ASEAN)东盟标,三个版本的标准监管机构不同,分别为美国FDA,欧盟委员会和东盟委员会。
两者内容都大同小异, GMPC是一个良好操作规范,比较细化到每一步的要求,而ISO22716除了细化要求外,更从一个系统性来强调整个体系,每一步鼓励流程化。
总的来说两者都是通过生产过程中的每一道工序,控制产品质量与安全,提倡持续改进的原则。
ISO22716化妆品—良好生产规范(GMP)准则

ISO22716化妆品—良好生产规范(GMP)准则ISO22716化妆品—良好生产规范(GMP)准则标准号ISO 22716:2007目录介绍 (1)1范围 (1)2术语和定义 (1)3员工 (4)4厂房 (6)5设备 (8)6原料和包材 (10)7 生产 (11)8 成品 (14)9实验室质量控制制 (15)10不合格品的处理 (17)11废弃物 (17)12 外包 (18)13 偏差 (19)14投诉和召回 (19)15变更控制 (19)16 内审 (20)17 文档 (20)介绍这份准则为化妆品良好生产规范做出指导,是适合化妆品行业并考虑了行业的具体要求,在人员,技术和影响产品质量的综合因素方面提供了系统性的和实际性的建议。
这个指导是为了让员工遵守产品接收到装运的流程下如何去利用资源。
为了达到此目的,在每一个章节里都添加了“原则”这一栏。
良好生产规范中的质量保证发展观念是通过描述建立在科学有效的判定和风险评估上的工厂活动来完成的,这份准则的目的是为了界定能让你获得达标产品的活动。
文件是 GMP 不可或缺的一部分。
化妆品良好生产规范准则1范围此国际标准为化妆品生产,控制,储存和装运提供指南这个标准包含产品质量的各个方面但不包括员工安全和对环境的保护方面,安全和环境保护是公司的应的责任,可以通过当地的法律和法规加以管制这些准则并不适用于设计和开发和产品营销活动。
2术语和定义以下术语和定义对于本文件是适用的2.1接收标准数值限度,范围或者其他可作为接受测试结果的方法2.2审核为获得审核证据并对其进行客观评价,以确定满足审核准则的程度而进行的系统的、独立的、形成文件的过程。
2.3批从某个或多个操作获得的、认为是一致的特定数量的原料,包材或产品。
2.4批号单个数字,字母,或字母和数字结合的,用来指定识别一批产品的代码.2.5散装产品经过所有制造工艺过程的产品,除了没有填充到独立包装的产品。
2.6校准在特定条件下,通过一系列操作在测量仪器或测量系统所指示的量值,或事物量具或参考事物表示的值,和按标准实现的相应值间建立起一种关系。
2020年度ISO22716(GMPC)手册及30个程序文件(最新原创全套)共112页

2020年度ISO22716(GMPC)手册及30个程序文件(最新原创全套)共112页化妆品良好生产规范ISO22716(GMPC)管理手册(最版全套)含30个程序文件(原创全套)颁布令产品质量管理是涉及到我公司生存发展的一个环节,为了进一步完善企业的质量制度,加强各具体操作部门的规范化管理,由公司行政部负责,组织相关部门共同编制了此本“手册”。
现印发给各部门,希望以此能使我公司质量管理水平达到一个新的台阶,从而保证各项产品质量,提高企业整体效益。
同时任命 *** 为GMPC管理体系的管理者代表,负责公司GMPC管理体系的建立、维护和改进。
本手册于2017年9月1日起开始实施。
总经理:2020年度ISO22716(GMPC)手册及30个程序文件(最新原创全套)共112页公司简介***********有限公司是一家专业研发、生产、销售***的公司。
本公司拥有强大的研发技术及生产能力,立足于自主开发,自主设计新产品,和国际上知名的品牌合作,开发出众多优秀的产品。
产品采用高档进口原材料生产。
***公司 KA-GD-QM-01 《ISO22716:2007(GMP)手册》页码:4/118ISO22716:2007(GMPC)组织架构图体系职能分配表为了更好地执行ISO22716:2007(GMP)标准,公司编制了体系职能分配表,便于各部门遵照执行。
1. 制订目的规范公司化妆品的生产、控制、贮藏和装运,使之符合ISO22716:2007(GMPC)标准要求。
2. 适用范围公司化妆品的生产、控制、贮藏和装运的全过程。
3. 定义说明3.1 验收标准数值范围、区间后者其它适于测试结果验收的衡量方法。
3.2 审计通过系统的、独立的检测来判定质量活动和相关结果是否符合计划安排,以及这些计划安排的实施是否有效并且有助于实现既定的目标。
3.3 批量明确原材料数量、包装材料或产品发布的一个过程或者一系列过程以期实现材料的合理配置。
ISO22716:2007 化妆品良好生产规范

Reference number ISO 22716:2007(E)© ISO 2007INTERNATIONAL STANDARD ISO 22716First edition 2007-11-15Cosmetics — Good ManufacturingPractices (GMP) — Guidelines on Good Manufacturing PracticesCosmétiques — Bonnes Pratiques de Fabrication (BPF) — Lignes directrices relatives aux Bonnes Pratiques de FabricationCopyright International Organization for Standardization--``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---ISO 22716:2007(E)PDF disclaimerThis PDF file may contain embedded typefaces. In accordance with Adobe's licensing policy, this file may be printed or viewed but shall not be edited unless the typefaces which are embedded are licensed to and installed on the computer performing the editing. In downloading this file, parties accept therein the responsibility of not infringing Adobe's licensing policy. The ISO Central Secretariat accepts no liability in this area.Adobe is a trademark of Adobe Systems Incorporated.Details of the software products used to create this PDF file can be found in the General Info relative to the file; the PDF-creation parameters were optimized for printing. Every care has been taken to ensure that the file is suitable for use by ISO member bodies. In the unlikely event that a problem relating to it is found, please inform the Central Secretariat at the address given below.COPYRIGHT PROTECTED DOCUMENT© ISO 2007All rights reserved. Unless otherwise specified, no part of this publication may be reproduced or utilized in any form or by any means, electronic or mechanical, including photocopying and microfilm, without permission in writing from either ISO at the address below or ISO's member body in the country of the requester. ISO copyright officeCase postale 56 • CH-1211 Geneva 20 Tel. + 41 22 749 01 11 Fax + 41 22 749 09 47 E-mail copyright@ Web Published in Switzerlandii © ISO 2007 – All rights reservedCopyright International Organization for Standardization --``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---ISO 22716:2007(E)© ISO 2007 – All rights reservediiiContents PageForeword............................................................................................................................................................iv Introduction........................................................................................................................................................v 1 Scope......................................................................................................................................................1 2 Terms and definitions ...........................................................................................................................1 3 Personnel................................................................................................................................................4 4 Premises.................................................................................................................................................6 5 Equipment ..............................................................................................................................................8 6 Raw materials and packaging materials ...........................................................................................10 7 Production............................................................................................................................................11 8 Finished products................................................................................................................................14 9 Quality control laboratory...................................................................................................................15 10 Treatment of product that is out of specification.............................................................................17 11 Wastes ..................................................................................................................................................17 12 Subcontracting.....................................................................................................................................18 13 Deviations.............................................................................................................................................19 14 Complaints and recalls .......................................................................................................................19 15 Change control.....................................................................................................................................19 16 Internal audit ........................................................................................................................................20 17 Documentation. (20)Copyright International Organization for Standardization --``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---ISO 22716:2007(E)iv © ISO 2007 – All rights reservedForewordISO (the International Organization for Standardization) is a worldwide federation of national standards bodies (ISO member bodies). The work of preparing International Standards is normally carried out through ISO technical committees. Each member body interested in a subject for which a technical committee has been established has the right to be represented on that committee. International organizations, governmental and non-governmental, in liaison with ISO, also take part in the work. ISO collaborates closely with the International Electrotechnical Commission (IEC) on all matters of electrotechnical standardization. International Standards are drafted in accordance with the rules given in the ISO/IEC Directives, Part 2. The main task of technical committees is to prepare International Standards. Draft International Standards adopted by the technical committees are circulated to the member bodies for voting. Publication as an International Standard requires approval by at least 75 % of the member bodies casting a vote.Attention is drawn to the possibility that some of the elements of this document may be the subject of patent rights. ISO shall not be held responsible for identifying any or all such patent rights. ISO 22716 was prepared by Technical Committee ISO/TC 217, Cosmetics .Copyright International Organization for Standardization--``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---ISO 22716:2007(E)© ISO 2007 – All rights reservedvIntroductionThese guidelines are intended to provide guidance regarding Good Manufacturing Practices for cosmetic products. These guidelines have been prepared for consideration by the cosmetic industry and take into account the specific needs of this sector. These guidelines offer organizational and practical advice on the management of the human, technical and administrative factors affecting product quality.These guidelines have been written to allow them to be used following the flow of products from receipt to shipment. Additionally, in order to clarify the way this document reaches its objectives, a ‘principle’ is added to each major section.Good Manufacturing Practices constitute the practical development of the quality assurance concept through the description of the plant activities that are based on sound scientific judgement and risk assessments. The objective of these GMP guidelines is to define the activities that enable you to obtain a product that meets defined characteristics.Documentation is an integral part of Good Manufacturing Practices.Copyright International Organization for Standardization --``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---Copyright International Organization for StandardizationINTERNATIONAL STANDARD ISO 22716:2007(E)© ISO 2007 – All rights reserved1Cosmetics — Good Manufacturing Practices (GMP) — Guidelines on Good Manufacturing Practices1 ScopeThis International Standard gives guidelines for the production, control, storage and shipment of cosmetic products.These guidelines cover the quality aspects of the product, but as a whole do not cover safety aspects for the personnel engaged in the plant, nor do they cover aspects of protection of the environment. Safety and environmental aspects are inherent responsibilities of the company and could be governed by local legislation and regulation.These guidelines are not applicable to research and development activities and distribution of finished products.2 Terms and definitionsFor the purposes of this document, the following terms and definitions apply. 2.1acceptance criterianumerical limits, ranges, or other suitable measures for acceptance of test results2.2 auditsystematic and independent examination to determine whether quality activities and related results comply with planned arrangements and whether these arrangements are implemented effectively and are suitable for achieving objectives2.3 batchdefined quantity of raw material, packaging material or product issued from one process or series of processes so that it could be expected to be homogeneous2.4batch numberdistinctive combination of numbers, letters and/or symbols, which specifically identifies a batch 2.5bulk productany product which has completed manufacturing stages up to, but not including, final packaging2.6calibrationset of operations that establish, under specified conditions, the relationship between values indicated by a measuring instrument or measuring system, or values represented by a material measure, and the corresponding known values of a reference standardCopyright International Organization for Standardization --``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---ISO 22716:2007(E)2© ISO 2007 – All rights reserved2.7change controlinternal organization and responsibilities relative to any planned change of one or several activities covered by the Good Manufacturing Practices in order to ensure that all the manufactured, packaged, controlled and stored products correspond to the defined acceptance criteria2.8cleaningall operations that ensure a level of cleanliness and appearance, consisting of separating and eliminating generally visible dirt from a surface by means of the following combined factors, in variable proportions, such as chemical action, mechanical action, temperature, duration of application 2.9complaintexternal information claiming a product does not meet defined acceptance criteria2.10contaminationoccurrence of any undesirable matter such as chemical, physical and/or microbiological matter in the product 2.11consumablesmaterials such as cleaning agents and lubricants that are used up during cleaning, sanitization or maintenance operations2.12contract acceptorperson, company or external organization carrying out an operation on behalf of another person, company or organization2.13 controlverification that acceptance criteria are met2.14deviationinternal organization and responsibilities relative to the authorization to deviate from specified requirements due to a planned or unplanned and, in any case, temporary situation concerning one or several activities covered by the Good Manufacturing Practices2.15finished productcosmetic product that has undergone all stages of production, including packaging in its final container, for shipment2.16in-process controlcontrols performed during production in order to monitor and, if appropriate, to adjust the process to ensure that the product meets the defined acceptance criteria2.17internal auditsystematic and independent examination made by competent personnel inside the company, the aim of which is to determine whether activities covered by these guidelines and related results comply with planned arrangements and whether these arrangements are implemented effectively and are suitable for achieving objectivesCopyright International Organization for Standardization --``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---ISO 22716:2007(E)© ISO 2007 – All rights reserved32.18major equipmentequipment specified in production and laboratory documents which is considered essential to the process 2.19maintenanceany periodic or unplanned support and verification operations designed to keep premises and equipment in proper working condition2.20manufacturing operationset of operations from the weighing of raw materials to the making of the bulk product 2.21out-of-specificationexamination, measurement or test result that does not comply with defined acceptance criteria2.22packaging operationall packaging steps including filling and labelling, which a bulk product has to undergo in order to become a finished product2.23packaging materialany material employed in the packaging of a cosmetic product, excluding any outer packaging used for transportationNOTE Packaging materials are referred to as primary or secondary according to whether or not they are intended to be in direct contact with the product.2.24 plantlocation for production of cosmetic products2.25premisesphysical location, buildings and supporting structures used to conduct receipt, storage, manufacturing, packaging, control and shipment of product, raw materials and packaging materials 2.26productionmanufacturing and packaging operations2.27quality assuranceall those planned and systematic activities necessary to provide confidence that a product satisfies given acceptance criteria2.28raw materialany substance going into or involved in the manufacturing of a bulk product2.29 recalldecision made by a company to call back a product batch that has been put on the marketCopyright International Organization for Standardization --``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---ISO 22716:2007(E)4© ISO 2007 – All rights reserved2.30reprocessingre-treatment of all or part of a batch of finished product or bulk product of an unacceptable quality from a defined stage of production so that its quality may be rendered acceptable by one or more additional operations2.31 returnsending finished cosmetic products which may or may not present a quality defect back to the plant 2.32 sampleone or more representative elements selected from a set to obtain information about that set 2.33samplingset of operations relating to the taking and preparation of samples2.34sanitizationoperation, used to reduce undesirable micro-organisms on inert contaminated surfaces depending on the objectives setNOTEIt is the action of reducing generally invisible contaminants from a surface.2.35shipmentset of operations relative to the preparation of an order and its putting in a transport vehicle2.36 wasteany residue of a production operation, transformation or use, any substance, material, product that its holder intends for disposal3 Personnel3.1 PrinciplePersons involved in the implementation of the activities described in these guidelines should have appropriate training to produce, control and store products with a defined quality.3.2 Organization3.2.1 Organization chart3.2.1.1 The organizational structure should be defined in order that the organization and functioning of the staff of the company be understandable. It should be appropriate for the size of the company and the diversity of its products.3.2.1.2 Each company should ensure that there are adequate staffing levels in the different scope of activity, according to the diversity of its production.3.2.1.3 The organization chart should show the independence, from the other units of the plant, of each quality unit, such as quality assurance unit and quality control unit. The quality assurance and quality control responsibilities can be undertaken by a separate quality assurance unit and a quality control unit, or they can be undertaken by a single unit.Copyright International Organization for Standardization --``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---© ISO 2007 – All rights reserved53.2.2 Number of peopleThe company should have an adequate number of properly trained personnel with regards to the defined activities in these guidelines.3.3 Key responsibilities3.3.1 Management responsibilities 3.3.1.1The organization should be supported by the top management of the company.3.3.1.2 The implementation of Good Manufacturing Practices should be the responsibility of top management and should require the participation and commitment of personnel in all departments and at all levels within the company.3.3.1.3 Management should define and communicate the areas in which authorized personnel are allowed to access.3.3.2 Responsibilities of personnel All personnel should:a) know their position in the organizational structure; b) know their defined responsibilities and activities;c) have access to and comply with documents relevant to their particular responsibility scope; d) comply with personal hygiene requirements;e) be encouraged to report irregularities or other non-conformities which may occur at the level of theirresponsibilities; f)have adequate education training and skills to perform the assigned responsibilities and activities.3.4 Training3.4.1 Training and skillsPersonnel involved in production, control, storage and shipment should have skills based on relevant training and experience acquired, or any combination thereof, that are appropriate to their responsibilities and activities.3.4.2 Training and Good Manufacturing Practices3.4.2.1 Appropriate Good Manufacturing Practices training relative to the defined activities of these guidelines should be provided for all personnel.3.4.2.2 The training needs of all personnel, regardless of level or seniority in the company, should be identified and a corresponding training programme should be developed and implemented.3.4.2.3 Considering the expertise and experience of the respective personnel, training courses should be tailored to be appropriate to the jobs and responsibilities of individuals.3.4.2.4 According to the needs and in-house resources available, training courses may be designed and executed by the company itself or with the help of expert external organizations, if necessary.Copyright International Organization for Standardization Provided by IHS under license with ISOLicensee=Hong Kong Polytechnic Univ/9976803100 Not for Resale, 09/19/2009 22:03:41 MDTNo reproduction or networking permitted without license from IHS--``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---6© ISO 2007 – All rights reserved3.4.2.5 Training should be regarded as a constant and on-going process that is subject to regularupdates.3.4.3 Newly recruited personnelBesides basic training on the theory and practice of Good Manufacturing Practices, newly recruited personnel should receive training appropriate to the duties assigned to them. 3.4.4 Personnel training evaluationsKnowledge accumulated by personnel should be evaluated during and/or after training.3.5 Personnel hygiene and health3.5.1 Personnel hygiene3.5.1.1 Hygiene programmes should be established and adapted to the needs of the plant. These requirements should be understood and followed by every person whose activities take them into production, control and storage areas. 3.5.1.2Personnel should be instructed to use hand washing facilities.3.5.1.3 Every person entering production, control and storage areas should wear appropriate clothing and protective garments to avoid contamination of cosmetic products.3.5.1.4 Eating, drinking, chewing, smoking or the storage of food, drink or smoking materials or personal medication in the production, control and storage areas should be avoided.3.5.1.5 Any unhygienic practice within the production, control and storage areas or in any other area where the product might be adversely affected should be forbidden. 3.5.2 Personnel healthSteps should be taken to ensure, as far as is practicable, that any person affected by an apparent illness or having open lesions on the exposed body surface should be excluded from direct contact with product until the condition is corrected or determined by medical personnel that the quality of cosmetic products will not be compromised.3.6 Visitors and untrained personnelVisitors or untrained personnel should preferably not be taken into production, control and storage areas. If this is unavoidable, they should be given information in advance, particularly about personal hygiene and the prescribed protective clothing. They should be closely supervised.4 Premises4.1 Principle4.1.1Premises should be located, designed, constructed and utilized so as:a) to ensure protection of the product;b) to permit efficient cleaning, if necessary, sanitizing and maintenance;c) to minimize the risk of mix-up of products, raw materials and packaging materials.Copyright International Organization for Standardization Provided by IHS under license with ISOLicensee=Hong Kong Polytechnic Univ/9976803100 Not for Resale, 09/19/2009 22:03:41 MDTNo reproduction or networking permitted without license from IHS--``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---© ISO 2007 – All rights reserved 74.1.2 Premises design recommendations are described in these guidelines. Design decisions should be based on the type of cosmetic product produced, existing conditions, cleaning and, if necessary, sanitizing measures used.4.2 Types of areaSeparate or defined areas should be provided for storage, production, quality control, ancillary, washing and toilets.4.3 SpaceSufficient space should be provided to facilitate operations such as receipt, storage and production.4.4 FlowFlow of materials, products and personnel through the building or buildings should be defined in order to prevent mix-ups.4.5 Floors, walls, ceilings, windows4.5.1 Floors, walls, ceilings and windows in production areas should be designed or constructed for ease of cleaning and, if necessary, sanitization and be kept clean and in good repair.4.5.2 Windows should be of non-opening design where ventilation is adequate. If windows are opened to the outside environment, they should be properly screened.4.5.3 New construction of production areas should incorporate considerations for proper cleaning and maintenance. Design of new construction should include smooth surfaces if appropriate and these surfaces should allow for resistance to corrosive cleaning and sanitizing agents.4.6 Washing and toilet facilitiesAdequate, clean, washing and toilet facilities should be provided for personnel. The washing and toilet facilities should be differentiated from, but accessible to, production areas. Adequate facilities for showering and changing clothes should be provided when appropriate.4.7 Lighting4.7.1Adequate lighting, that is sufficient for operations, should be installed in all areas.4.7.2 Lighting should be installed in a manner to ensure containment of any debris from potential breakage. Alternatively, measures should be taken to protect the product.4.8 VentilationVentilation should be sufficient for the intended production operations. Alternatively, specific measures should be taken to protect the product.4.9 Pipework, drains and ducts4.9.1 Pipework, drains and ducts should be installed in such a manner so that drip or condensation does not contaminate materials, products, surfaces and equipment. 4.9.2Drains should be kept clean and should not allow back flow.Copyright International Organization for StandardizationProvided by IHS under license with ISOLicensee=Hong Kong Polytechnic Univ/9976803100 Not for Resale, 09/19/2009 22:03:41 MDTNo reproduction or networking permitted without license from IHS--``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---8© ISO 2007 – All rights reserved4.9.3 Design considerations should be given to the following:a) exposed overhead roof beams, pipes and ducts should be avoided;b) exposed pipes should not touch walls, but be suspended from or supported by brackets, sufficientlyseparated to allow thorough cleaning; c) alternatively, specific measures should be taken to protect the product.4.10 Cleaning and sanitization4.10.1 Premises used for activities described in these guidelines should be maintained in a clean condition. 4.10.2 Cleaning and, if necessary, sanitization should be carried out to achieve the objective of protecting each product.4.10.3 Cleaning and, if necessary, sanitizing agents to be used should be specified and effective.4.10.4 There should be cleaning and, if necessary, sanitization programmes corresponding to specific needs of each area.4.11 MaintenancePremises used in activities described in these guidelines should be maintained in a good state of repair.4.12 ConsumablesConsumables used for premises should not affect the quality of the product.4.13 Pest control4.13.1 Premises should be designed, constructed and maintained so as to restrict access to insects, birds, rodents, pests and other vermin.4.13.2 There should be a pest control programme appropriate for the premises.4.13.3 Measures should be taken to control the exterior of the premises to prevent attracting or harbouring pests.5 Equipment5.1 PrincipleEquipment should be suitable for the intended purpose and capable of being cleaned and, if necessary, sanitized and maintained. This clause applies to all equipment within the scope of these guidelines. If automated systems are introduced into activities described in these guidelines, they should take into account the application of the given relevant principles.5.2 Equipment design5.2.1 Production equipment should be designed to prevent contamination of the product.5.2.2Bulk product containers should be protected from air contaminants, such as dust and moisture.5.2.3 Transfer hoses and accessories that are not in use should be cleaned and, if necessary sanitized, kept dry and protected from dust, splash or other contamination.Copyright International Organization for Standardization Provided by IHS under license with ISOLicensee=Hong Kong Polytechnic Univ/9976803100 Not for Resale, 09/19/2009 22:03:41 MDTNo reproduction or networking permitted without license from IHS--``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---© ISO 2007 – All rights reserved95.2.4 The material used in the construction of equipment should be compatible with products and the cleaning and sanitizing agents.5.3 Installation5.3.1 The design and the installation of equipment should ease its drainage in order to facilitate cleaning and sanitization.5.3.2 Equipment should be placed so that movement of materials, mobile equipment and personnel do not pose a risk to quality.5.3.3 Reasonable access under, inside and around equipment should be provided for maintenance and cleaning. 5.3.4Major equipment should be readily identifiable.5.4 Calibration5.4.1 Laboratory and production measuring instruments that are important for the quality of the product, should be calibrated regularly.5.4.2 If results of calibration are out-of-acceptance criteria, measuring instruments should be appropriately identified and removed from service.5.4.3 An out-of-calibration condition should be investigated to determine if there is any impact to the quality of the product and appropriate steps taken based on this investigation.5.5 Cleaning and sanitization5.5.1 All equipment should be subject to an appropriate cleaning and, if necessary, sanitization programme. 5.5.2Cleaning and sanitizing agents should be specified and effective.5.5.3 Where equipment is assigned to continuous production or production of successive batches of the same product, equipment should be cleaned and, if necessary, sanitized at appropriate intervals.5.6 Maintenance5.6.1 Equipment should be regularly maintained.5.6.2 Maintenance operations should not affect the quality of the product.5.6.3Defective equipment should be identified accordingly, excluded from use and isolated if possible.5.7 ConsumablesConsumables used for equipment should not affect the quality of the product.5.8 AuthorizationsEquipment or automated systems used in production and control should be accessed and used by authorized personnel.5.9 Back-up systemsAdequate alternative arrangements should be available for systems which need to be operated in the event of a failure or breakdown.Copyright International Organization for Standardization Provided by IHS under license with ISOLicensee=Hong Kong Polytechnic Univ/9976803100 Not for Resale, 09/19/2009 22:03:41 MDTNo reproduction or networking permitted without license from IHS--``,,``,,``,,`,``,``,`,,,,`,,`-`-`,,`,,`,`,,`---。
ISO22716国际化妆品良好生产规范介绍及案例分析

预防污染
生产的每一步骤都应预防污染 污染的途径:粉尘、蒸汽、挥发、喷雾、设 备内残留物、虫害、微生物乃至员工的衣着 采取适当的预防措施防止交叉污染,并对预 防效果做定期检查确认 婴儿类或眼部用化妆品还应定期监控微生物 指标
生产前
生产区或生产线应清理干净以防材料或产品相互 混淆-应有书面的并经批准的清洁程序 按照要求对工艺条件和环境条件进行设定 生产容器使用前应做清洁 对设备连接部件和管道进行检查以确保正确传送 产品 测量工具,称量器具,记录仪及其它控制设备应 按照预定的频率校正并记录
灭鼠药,杀虫剂或清洁材料 防止污染 一切皆有可能!
案例:生产车间一瞥
香精:储存温 度11~25o C
生产管理
基本原则
生产设备要清洁 不同产品的生产要分开不同的时间 或-分开不同的区域以防止交叉污染; 或-临近操作要有物理隔离 限制无关人员出入生产区 基于批准的书面程序或指导处理材料和产品,根 据要求做记录
材料应该储存在合适的条件下-监 控并记录
取样/检查
应满足经批准的技术标准并有供应商的检 验证明 不同批次同时到货的处理
-分批取样检验放行
不符合要求的材料立即隔离存放并按照程 序处理。
放行材料
只有质量部门可以有权限 有效的库存管理系统,遵守: 先入先出, 或 先失效先使用
待验 待验
Date Received Signature
材料名称
Expiry Date Date
Name of Material Internal Code Batch No. Status Expiry Date
材料代码
批号/ 收货号 质量状态 有效期 收货日期
ISO22716 执行标准化妆品良好操作规范GMPC标准及内审员培训教材

3.4 培 训
三、人员
3.4.1 培训及技能 员工(从事生产,质量控制,存储, 运输等)应具有与其职责相应的技能, 此技能可由相关的培训或已有经验获 得
3.4.2培训及 GMP
3.4.2.1 应为所有员工提供适合的 GMP 培训。
3.4.2.2 应确定员工的培训需求,不管级别资历,并制订相应的培训计划
2.1 接受标准:对测试结果的可接受性给予 数字化的限值,范围及其他使用的措施。
2.2 审核:一个系统的、独立的、文件化的 过程,即由审核证据获得客观的评估以确定是 否满足既定的安排,及确定满足的程度。
2.3 批:从某个或多个操作获得的、认为是 一致的特定数量的原料,包材或产品
2.4 批次:单个数字,字母,或字母和数 字结合的,用来指定识别一批产品的代码.
ISO22716 执行标准化妆品 良好操作规范GMPC标准及内审
员培训教材
*
ISO22716(体系)目录
范围
01
术语和定义
02
人员
03
厂房
04
仪器
05
原材料及包装
06
生产
07
成品
08
*
ISO22716(体系)目录
实验室质量控制
09
不合格品的处理
10
垃圾
11
分包
12
偏差
13
2.35 运输:操作中涉及准备订单货物及将其放入运输工具的一系列活动 2.36 垃圾:生产,使用中的残留物及用于处理的物料产品等
*
三、人员 3.1 原则
员工应有适当的培训,以满足对产品的生产,监控和存储等操作。
12
*
三、人员
3.2 组织结构
化妆品行业质量管理体系标准ISO22716化妆品良好生产规范内审检查表
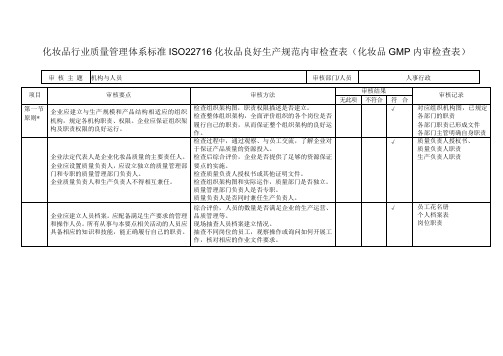
检验人员应具备相应的资质或经相应的专业技术 训证明,其他检验人员的专业技术培训记录,检查
培训,考核合格后上岗。
是否经过考核,并通过观察访谈形式核对开展工作
的能力。
√
质量负责人档案(学历、
个人档案表)
质量负责人及质管部负责
人职责
质管部职责:负责进料检
验、过程检验、出厂检验
等
√
生产负责人档案(学历、
个人档案表)
企业生产负责人应具有相应的生产知识和经验。企 业生产负责人主要职责: 5.1 确保产品按照批准的工艺规程生产、储存; 5.2 确保生产相关人员经过必要和持续的培训; 5.3 确保生产环境、设施设备满足生产质量需求。
检查质量负责人的档案,是否具有相应的资历; 检查是否明确规定质量负责人的职责; 了解其某一职责是如何开展的。 了解其履职的能力是否胜任。
检查有无批生产记录、检验记录、不合格品处理记 录、培训记录、检查记录、投诉记录、厂房设备设 施使用维护保养记录等。
抽查 1—2 批产品进行追溯。
现场检查是否有符合要求的微生物和理化检验室 及相应的仪器设备; 检查检验记录及现场提问,以了解是否有能力检测 产品企业标准中规定的出厂检验指标。 检查是否建立实验室管理制度和检验管理制度。 检查实验室是否按检验需要设立相应的功能间;询 问如何保证微生物实验室环境条件满足要求,进行 评判。
长指甲,不得化浓妆、喷洒香水,不得将个人生活 场抽查 3—5 位直接接触生产的员工是否有有效的
用品、食物等带入生产车间,防止污染。
健康证明。
*
企业应建立人员健康档案,直接接触产品的人员上 检查是否建立人员健康档案;
√
岗前应接受健康检查,以后每年进行一次健康检 现场抽查 3—5 位直接接触生产的员工。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
审核
批准
生效日期
版本号
1范围
2术语和定义
3员工
4厂房及设施
5设备
6原料和包装材料
7生产
8成品
9质量控制实验室
10不合格品处理
11废弃物
12外包
13偏差
14顾客投诉及产品召回
15变更控制
16内部审核
17文件
管理手册批准页
XX化妆品有限公司《化妆品良好生产规范》管理手册,即GMP管理手册,是依据<ISO22716:2007>标准及《化妆品生产企业卫生规范》等国内有关的化妆品卫生法规和本公司的实际而编写。
1.遵守法规——遵守化妆品法规标准,确保产品安全卫生;
2.客户至上——使消费者满意是全体员工永恒的追求;
3.安全第一——防止对消费者伤害事故的发生;
4.持续改进——持续改进GMP体系的有效性。
6.2卫生质量目标
1.成品出厂合格率=100%
2.顾客满意度≥90%
3.消费者严重伤害事故=0
2.1定义
2.1acceptance criteria 接收标准
发布本手册的目的系,以确保化妆品的卫生质量,减少对消费者的伤害风险。本手册是公司在化妆品良好生产规范方面对消费者和社会的承诺,又是公司在生产时必须遵循的法规性文件,全体员工必须遵照执行。
本公司GMP管理体系和ISO9001质量管理体系同时实施,有关原料及包装材料的采购、员工的任职要求和培训、设备管理、仓库管理、生产过程控制、产品检验、不合格品控制、纠正措施和预防措施、内审等条款的基本要求可遵照ISO9001质量管理体系文件要求实施。
4.3主要检测设备有:pH计、电导率仪、罗氏泡沫仪、折光仪、旋转粘度计、比重计、离心沉淀器、电热恒温培养箱、电热鼓风干燥箱、冰箱、高压蒸汽灭菌器、天平(电子天平、分析天平)、超净工作台等。红外线水份计、熔点测定仪、破裂强度机、电磁搅拌器、恒温水浴锅、霉菌培养箱、生物显微镜。
4.4工厂实现了雨水和污水分流,生产废水通过三级沉降曝气池后纳管进入车墩镇松东污水处理管网。废水处理能力为50吨/日。
2.3ISO9001体系无法包括一切行业的特殊性。由此在ISO9001的基础上衍生出了特殊行业的质量管理体系。化妆品和药品、保健食品、食品同属影响人类健康的特殊行业,因此它还需要控制化妆品的安全危害,确保提供给消费者的化妆品对人体是安全无害的。ISO22716就是为了控制化妆品安全危害而制定的,这样的管理体系具有鲜明的针对性,就确保化妆品的安全性,着重于化妆品的卫生质量层面,提出了对员工、厂房及设施、设备、原材料、生产及分包、工厂卫生和个人卫生、质控、不合格品、偏差和变动控制、体系审核及文件管理等控制要求。通过企业的有效实施,确保产品的安全性,实现对消费者的承诺。
3.0GMP手册的管理
3.1手册是受控文件,由品管处文件控制室控制其标识、修改、保存、发放和回收、作废及销毁,依据ISO9001管理体系的《文件管理作业程序书》实施。
3.2手册由研发部编写,管理者代表审核,总经理批准后生效。
3.3手册发放时须有发放号,对领取手册者每人设定一个号码,品管处文件控制室负责编制领取人和发放号的对照表,在手册管理及遗失时可以追溯。
numerical limits, ranges, or other suitable measures for acceptance of test results
数值限度,范围或者其他可作为接受测试结果的方法
2.2audit 审核
systematic and independent examination to determine whether quality activities and related results comply with planned arrangements and whether these arrangements are implemented effectively and are suitable for achieving objectives
4.5公司目前有员工150人,其中管理人员45人,学历:大专23人;大学本科以上36人。
4.6公司产品全部由的贸易公司负责销售,这些贸易公司是本公司的顾客。
公司名称:
总经理:
网址:
电话:
5.0组织结构
5.1组织结构图:略
5.2职责
详见附件1:管理职责说明
附件2:各部门职责分配表
6.1卫生质量方针:遵守法规、客户至上、安全第一、持续改进。
本管理体系文件自2020年4月7日发布,2020年4月7日起生效,即GMP管理体系从2020年4月7日开始运行。
总经理(签名):_________
2020年4月7日
1.0GMP手册说明
1.1公司的GMP(化妆品良好生产规范)手册系依据ISO22716:2007、和《化妆品生产企业卫生规范》等国内相关化妆品卫生法规并结合本公司的实际编写,是本公司《良好生产规范》的书面文件。GMP管理体系对化妆品的生产、质量控制、产品贮存和发运四个方面做出了规定,但不包括成品的设计开发和销售方面的内容,(因为这是ISO9001管理体系的内容);也不包括环境保护和工厂员工安全方面的内容,因为职业健康和安全及环境管理有对应的OHSAS18001及ISO14001标准,企业应当实施这些标准。此外,地方政府经常有环境方面和
安全方面的大检查。如果违反了地方政策和法规,是会受到处罚的。
2.0ISO22716和ISO9001的关系
2.1经验表明:在化妆品生产企业同时建立ISO9001管理体系是必要的选择。
2.2ISO9001是企业最基础的质量管理体系,本公司建立该体系可以证实公司有能力稳定地提供满足顾客和适用的法律法规要求的产品,通过体系的有效运行,预防不合格并持续改进,可以确保产品质量,从而增进顾客满意。
3.4手册的持有者必须妥善保管文件,不准损坏和丢失,离职时由品管处文件控制室依据其发放号收回。
3.5手册如需修改,由提出人申请,研发部着手修改,须经总经理批准后交品管处文件控制室按照《文件控制程序》规定的步骤实施。
4.0公司简介
4.1本公司目前有两大类产品,包括化妆品和日用化工产品。其中,化妆品类包括:活性碳蛋白;抗氧隔离妆前乳。
4.2工厂生产设备设施介绍:
制造车间设备有:搅拌槽6台/真空乳化槽8台/散装产品贮槽9台。
包装车间配7条灌装线。主要生产设备有:充填灌装机12台、喷墨机8台、封箱机10台、收缩机10台、自动检重机2台、旋盖机2台、压盖机3台。
公用工程设备/装有:2T锅炉2台、螺杆制冷压缩机1台、空气净化系统装置1套、纯化水处理系统1套、污水处理装置1套。
