分解反应平衡常数的测定教学内容
氨基甲酸铵分解反应标准平衡常数的测定

宁波工程学院物理化学实验报告专业班级化工112 姓名姚志杰序号_____29_同组姓名金鹏田飞成罗斌_ 指导老师付志强姚利辉实验日期2013 4 8实验名称实验四氨基甲酸铵分解反应标准平衡常数的测定一、实验目的1.掌握测定平衡常数的一种方法。
2.用等压法测定氨基甲酸铵的分解压力并计算分解反应的有关热力学常数。
二、实验原理三、实验仪器与药瓶仪器:实验装置一套(如图9.2所示);氨基甲酸铵(自制): U型压差计;.玻璃钢水浴; 加热器;搅拌器;等压计;温度计;感温元件;缓冲瓶;三通旋塞;毛细管;温度指示控制仪。
试剂:氨基甲酸铵、液体石蜡。
四、实验步骤1. 检漏按图所示安装仪器。
将烘干的小球和玻璃等压计相连,开动真空泵,当测压仪读数约为-94kPa~-95kPa,关闭三通活塞。
检查系统是否漏气,待10min 后,若测压仪读数没有变化,则表示系统不漏气,否则说明漏气,应仔细检查各接口处,直到不漏气为止。
2. 装样品确定系统不漏气后,取下干燥的球状样品管装入氨基甲酸铵粉末,与已装好液体石蜡的等压计连好,再按图示装好。
3. 测量调节恒温槽温度为25℃。
开启真空泵,将系统中的空气排出,约1min 后,关闭二通活塞,然后缓缓开启三通活塞,将空气慢慢分次放入系统,直至等压计两边液面处于水平时,立即关闭三通活塞,若5min内两液面保持不变,即记下低真空测压仪的读数,即是氨基甲酸胺分解的平衡压力。
4. 重复测量重复步骤3操作,如果两次测定结果差值小于0.2kPa,可进行下一步实验。
5. 升温测量调节恒温槽温度,用同样的方法继续测定30℃、35℃、40℃、45℃时的分解压力。
6. 复原实验完毕,将空气放入系统中至测压仪读数为零,切断电源、水源。
五、数据记录与处理室温:21.5 ℃大气压:100.66kpa由图可知K=-212722127221272*8.314=146.855KJ/mol查阅资料知25℃氨基甲酸铵分解的∆rHӨ m=159.32kJ/mol,实验结果偏小,1、从㏑KPθ对1/T作图的结果来看,实验误差较小,实验结果能较好地符合理论值。
分解反应平衡常数的测定
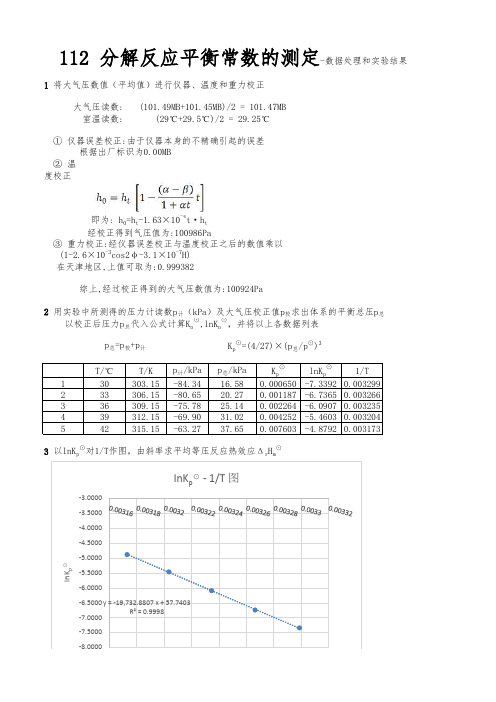
② 温度校正T/℃T/K p 计/kPa p 总/kPa K p⊙lnK p ⊙1/T 130303.15-84.3416.580.000650-7.33920.003299233306.15-80.6520.270.001187-6.73650.003266336309.15-75.7825.140.002264-6.09070.003235439312.15-69.9031.020.004252-5.46030.003204542315.15-63.2737.650.007603-4.87920.003173(1-2.6×10-3cos2φ-3.1×10-7H)112 分解反应平衡常数的测定-数据处理和实验结果1 将大气压数值(平均值)进行仪器、温度和重力校正大气压读数:(101.49MB+101.45MB)/2 = 101.47MB室温读数:(29℃+29.5℃)/2 = 29.25℃① 仪器误差校正:由于仪器本身的不精确引起的误差根据出厂标识为0.00MB即为: h 0=h t -1.63×10-4t·h t 经校正得到气压值为:100986Pa③ 重力校正:经仪器误差校正与温度校正之后的数值乘以在天津地区,上值可取为:0.999382综上,经过校正得到的大气压数值为:100924Pa2 用实验中所测得的压力计读数p 计(kPa)及大气压校正值p 校求出体系的平衡总压p 总p 总=p 校+p 计K p ⊙=(4/27)×(p 总/p ⊙)3以校正后压力p 总代入公式计算K p ⊙,lnK p ⊙,并将以上各数据列表3 以lnK p ⊙对1/T作图,由斜率求平均等压反应热效应Δr H m ⊙16122.15J/mol11.72J·mol -1·K-1由上图可知,35.0℃的K p ⊙为0.001849如图得到斜率为:-19732.8807Δr H m ⊙为19732.88J4 由下式计算35.0℃的反应标准摩尔吉布斯自由能变化Δr G m⊙及反应的标准摩尔熵变Δr S m ⊙-8.00001/T。
物理化学-实验十:氨基甲酸铵分解平衡常数的测定

实验十 氨基甲酸铵分解平衡常数的测定一、实验目的1. 掌握氨基甲酸铵的制备方法2. 用等压法测定一定温度下氨基甲酸铵的分解压力,并计算此分解反应的平衡常数3. 根据不同温度下的平衡常数,计算等压反应热效应的有关热力学函数。
二、实验原理干燥的氨和干燥的二氧化碳接触后,只生成氨基甲酸铵。
2 NH 3(g )+ CO 2(g ) NH 2CO 2NH 4(s )在一定温度下氨基甲酸铵的分解可用下式表示:243(2((NH COONH NH 2固)气)+CO 气)设反应中气体为理想气体,则其标准平衡常数K 可表达为22[][]co p K P P =3NH p (1) 式中,3NH p 和2co p 分别表示反应温度下NH 3和CO 2的平衡分压,P 为100kPa 。
设平衡总压为p ,则23p =3NH p ;213co p p =代入式(5-22),得到23214()()()3327P P P K P P P == (2)因此测得一定温度下的平衡总压后,即可按式(2)算出此温度的反应平衡常数K 。
氨基甲酸铵分解是一个热效应很大的吸热反应,温度对平衡常数的影响比较灵敏。
但当温度变化范围不大时,按平衡常数与温度的关系式,可得:ln r m H K C RT -∆=+ (3)式中,r m H ∆为该反应的标准摩尔反应热,R 为摩尔气体常数,C 为积分常数。
根据式(3),只要测出几个不同温度下的,以ln K 对1/T 作图,由所得直线的斜率即可求得实验温度范围内的r m H ∆。
利用如下热力学关系式还可以计算反应的标准摩尔吉氏函数变化r m G ∆和标准摩尔熵变r m S ∆:ln r m G RT K ∆=- (4)r m r m r m G H T S ∆=∆-∆ (5)本实验用静态法测定氨基甲酸铵的分解压力。
参看图10-1所示的实验装置。
样品瓶A 和零压计B 均装在空气恒温箱D 中。
实验时先将系统抽空(零压计两液面相平),然后关闭活塞1,让样品在恒温箱的温度t 下分解,此时零压计右管上方为样品分解得到的气体,通过活塞2、3不断放入适量空气于零压计左管上方,使零压计中的液面始终保持相平。
氨基甲酸铵分解反应平衡常数的测定

氨基甲酸铵分解反应平衡常数的测定一、实验目的1.熟悉用等压计测定平衡压力的方法。
2.测定各温度下氨基甲酸铵的分解压力,计算各温度下分解反应的平衡常数K p 及有关的热力学函数。
二、预习要求1.掌握氨基甲酸铵分解反应平衡常数的计算及其与热力学函数间的关系。
2.了解氨基甲酸铵的制备方法。
3.熟悉实验装置图,了解做好实验的关键步骤。
三、实验原理氨基甲酸铵为白色固体,很不稳定,其分解反应式为:NH 2COONH 4(s) 2NH 3(g)+CO 2(g)该反应为复相反应,在封闭体系中很容易达到平衡,在常压下其平衡常数可近似表示为:32NH CO p p p K p p ⎡⎤⎡⎤=⎢⎥⎢⎥⎣⎦⎣⎦(1) 式中,3NH p 、2CO p 分别表示NH 3和CO 2平衡时的分压,其单位为Pa 。
设平衡时总压为p ,由于1molNH 2COONH 4(s)分解能生成2molNH 3(g)和1molCO 2(g),又因为固体氨基甲酸铵的蒸气压很小,所以体系的平衡总压就可以看作2CO p 与3NH p 之和,即:322NH CO p p = 则:3221,33NH CO p p p p == (2) (2)式代入(1)式得:23243327p p p p K p p p ⎛⎫⎛⎫⎛⎫== ⎪ ⎪ ⎪⎝⎭⎝⎭⎝⎭(3) 因此,当体系达平衡后,测量其总压p ,即可计算出平衡常数温度对平衡常数的影响可用下式表示:2ln pr m d K H dT RT∆=(4) 式中,T 为热力学温度;r m H ∆ 为标准反应热效应。
当温度在不大的范围内变化时,r m H ∆可视为常数,由(4)式积分得:ln r m pH K C RT ∆'=-+(5) 式中C ′为积分常数。
若以ln p K 对1T 作图,得一直线,其斜率为r m H R ∆- ,由此可求出r m H ∆ 。
氨基甲酸铵分解反应为吸热反应,反应热效应很大,在25℃时每摩尔固体氨基甲酸铵分解的等压反应热r m H ∆ 为159×103J·mol -1,所以温度对平衡常数的影响很大,实验中必须严格控制恒温槽的温度,使温度变化小于±0.1℃。
氨基甲酸铵的分解反应平衡常数的测定

实验报告 课程名称: 大学化学实验p 实验类型: 中级化学实验实验项目名称: 氨基甲酸铵得分解反应平衡常数得测定同组学生姓名: 无 指导老师 厉刚一、实验目得与要求1、熟悉用等压法测定固体分解反应得平衡压力。
2、掌握真空实验技术。
3、测定氨基甲酸铵分解压力,计算分解反应平衡常数及有关热力学函数、二、实验内容与原理氨基甲酸铵(NH 2COON H4)就是就是合成尿素得中间产物,白色固体,不稳定,加热易发生如下得分解反应:NH 2CO ON H4(s) 2NH 3(g)+CO 2(g)该反应就是可逆得多相反应。
若将气体瞧成理想气体,并不将分解产物从系统中移走,则很容易达到平衡,标准平衡常数Kp 可表示为:K p =• (1)式中,、分别为平衡时N H3与CO 2得分压,又因固体氨基甲酸铵得蒸气压可忽略不计,故体系得总压p总为:p 总=+称为反应得分解压力,从反应得计量关系知=2则有 =p 总与=p总K p= (p 总)2 •(p 总) = (2)可见当体系达平衡后,测得平衡总压后就可求算实验温度得平衡常数Kp 。
平衡常数Kp 称为经验平衡常数。
为将平衡常数与热力学函数联系起来,我们再定义标准平衡常数。
化学热力学规定温度为T 、压力为100kp a 得理想气体为标准态,100k pa 称为标准态压力。
ﻩ、或p 总除以100kp a 就得标准平衡常数、= ()2 • () = ()3 =温度对标准平衡常数得影响可用下式表示:= (3)式中,△H m 为等压下反应得摩尔焓变即摩尔热效应,在温度范围不大时△H m 可视为常数,由积分得: ln=-+C(4)作ln -图应得一直线,斜率S=-,由此算得△H m =-RS 、反应得标准摩尔吉布斯函数变化与标准平衡常数得关系为:ΔrG m = - RTln K(5)用标准摩尔热效应与标准摩尔吉布斯函数变可近似地计算该温度下得标准熵变:Δr S m= (Δr H m -Δr Gm ) / T(6)因此,由实验测出一定温度范围内不同温度T 时氨基甲酸铵得分解压力(即平衡总压),可分别求出标准平衡常数 及热力学函数:标准摩尔热效应、标准摩尔吉布斯函数变化及标准摩尔熵变。
氨基甲酸铵分解反应标准平衡常数测定

宁 波 工 程 学 院 物理化学实验报告实验名称 氨基甲酸铵分解反应标准常数的测定一、 实验目的1、 掌握测定平衡常数的一种方法;2、用等压法测定氨基甲酸氨的分解压力并计算分解反应的有关热力学常数。
二、 实验原理氨基甲酸铵(NH 2COONH 4)是白色固体,是合成尿素的中间产物,很不稳定,NH 2COONH 4的分解反应式为:NH 2COONH 4=== 2NH 3↑+CO 2↑该反应为复相反应,该反应正逆向都容易进行,在封闭体系中很容易达到平衡,其标准平衡常数可近似表示为:⎥⎦⎤⎢⎣⎡⎥⎦⎤⎢⎣⎡= p p p p K 2CO 23NH p(1)式中,P NH 3、P CO 2分别表示反应温度下NH 3和CO 2平衡时的分压; p 为标准压。
体系总压: p =p NH 3+p CO从化学反应计量方程式可知:p p p p 31322CO 3NH ==, (2)将式(2)代入式(1)得:32p274332⎪⎪⎭⎫⎝⎛=⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫ ⎝⎛=p p p p p p K (3) 因此可知,当体系达平衡后,测定其总压力p ,即可计算出平衡常数K p 温度对平衡常数的影响一般都很明显,其定量关系为:2m pd ln d RT H TK r∆= (4) 式中,T 为热力学温度;Δr H Ө m 为标准反应热效应。
氨基甲酸铵分解反应是一个热效应很大的吸热反应,温度对平衡常数的影响比较灵敏。
当温度在不大的范围内变化时,Δr H Ө m 可视为与温度无关的常数,由(4)式积分得:C RTH Kr +∆-=m pln (C 为积分常数)(5)若以ln K Ө p 对1/T 作图,应为一直线,其斜率为-Δr H Ө m /R 。
由此可求出Δr H Ө m 。
在一个小的温度区间内,也可用此式计算出此温度区间的平均Δr H Ө m 。
并按下式计算T 温度下反应的标准吉布斯自由能变化Δr G Ө m ,Δr G Ө m =-RT ln K Ө p (6)利用实验温度范围内的平均等压热效应Δr H Ө m 及等温下的自由能变Δr G Ө m ,可近似地计算出该温度下的标准熵变Δr S Ө mTG H S r r rmm m∆-∆=∆ (7)综上所述:通过测定一定温度范围内某温度的氨基甲酸铵的分解压(平衡总压),就可以利用上述公式分别求出 K Ө p ,Δr H Ө m ,Δr G Ө m (T ),Δr S Ө m (T )。
实验9 氨基甲酸铵分解反应标准平衡常数的测定

第次课 4 学时实验9 氨基甲酸铵分解反应标准平衡常数的测定一 实验目的1. 掌握一种测定系统平衡压力的方法—等压法;2. 测定不同温度下氨基甲酸铵的分解压力;3. 计算相应温度下该分解反应的标准平衡常数、标准摩尔反应焓变△r H θm 、标准摩尔反应吉布斯函数变△r G θm 及标准摩尔反应熵变△r S θm ;4. 掌握真空泵、恒温水浴、大气压计的使用。
二 实验原理氨基甲酸铵是合成尿素的中间体,白色固体,很不稳定,加热时按下式分解:()()()g CO g NH s COONH NH 23432+⇔ (9.1) 根据化学势判据,分解达到平衡时,反应的标准平衡常数K θ为:()⎭⎬⎫⎩⎨⎧⎭⎬⎫⎩⎨⎧=θθθp p p p K COg NH 23.2()()Bp p p CO G NH νθ∑-=23.2()Bp K P νθ∑-= (9.2)式中: P K ()23.2CO G NH p p = (9.3) ()()g CO g NH p p 23,分别为平衡系统中()g NH 3、和()g CO 2的平衡分压;B ν∑为反应式中各气体物质计量系数之和,产物的B ν为正,反应物的B ν为负。
因为一定温度下, 固体物质的蒸气压具有定值,与固体的量无关, 因此,平衡系统中氨基甲酸铵的分压()s COONH NH p 42是常数,与平衡常数合并,故在(9.2)式中不出现。
因为温度不高时,固体物质氨基甲酸铵的分压()s COONH NH p 42<<(),3g NH p ()s COONH NH p 42<<(),2g CO p 系统的总压等于()()g CO g NH p p 23,之和,即:()()g CO g NH p p P 23+=总 (9.4)从化学反应计量式可知,1摩尔()s COONH NH 42分解生成2摩尔()g NH 3和1摩尔()g CO 2,则:(),3g NH p =总p 32; ()g CO p 2=总p 31;将上述关系代入(9.3)式,3227431.32总总总p p p K P =⎪⎭⎫ ⎝⎛⎪⎭⎫ ⎝⎛= (9.5)将(9.5)式代入(9.2)式,得标准平衡常数为:()33274-=θθp P K 总 (9.6)因此,化学反应达到平衡时,测量系统的总压强总p , 由总p 计算出P K ,进而计算出标准平衡常数θK 。
氨基甲酸铵的分解反应平衡常数的测定

.实验报告课程名称: 大学化学实验p 实验类型: 中级化学实验实验项目名称: 氨基甲酸铵的分解反应平衡常数的测定 同组学生姓名: 无 指导老师 厉刚 一、实验目的和要求1、熟悉用等压法测定固体分解反应的平衡压力。
2、掌握真空实验技术。
3、测定氨基甲酸铵分解压力,计算分解反应平衡常数及有关热力学函数。
二、实验内容和原理氨基甲酸铵(NH 2COONH 4)是是合成尿素的中间产物,白色固体,不稳定,加热易发生如下的分解反应: NH 2COONH 4(s) 2NH 3(g )+CO 2(g )该反应是可逆的多相反应。
若将气体看成理想气体,并不将分解产物从系统中移走,则很容易达到平衡,标准平衡常数K p 可表示为:K p =23NH p •2CO p (1)式中,3NH p 、2CO p 分别为平衡时NH 3和CO 2的分压,又因固体氨基甲酸铵的蒸气压可忽略不计,故体系的总压p 总为:p 总=3NH p +2CO p称为反应的分解压力,从反应的计量关系知3NH p =22CO p 则有 3NH p =32p 总和2CO p =31p总K p = (32p 总)2•(31p 总) =2743总p (2)可见当体系达平衡后,测得平衡总压后就可求算实验温度的平衡常数K p 。
平衡常数K p 称为经验平衡常数。
为将平衡常数与热力学函数联系起来,我们再定义标准平衡常数。
化学热力学规定温度为T 、压力为100kp a 的理想气体为标准态,100kp a 称为标准态压力。
3NH p 、2CO p 或p 总除以100kp a 就得标准平衡常数。
ΦpK= (Φp p 总32)2 • (Φp p 总31) = 274 (Φp p 总)3 = 31510274总p ⨯ 温度对标准平衡常数的影响可用下式表示:dTk d θln =2RT H m△dTk d θln(3)式中,△H m 为等压下反应的摩尔焓变即摩尔热效应,在温度范围不大时△H m 可视为常数,由积分得:ln Φp K =-RTH m △+C (4)作ln Φp K -T 1图应得一直线,斜率S=-RH m △,由此算得△H m=-RS 。
分解反应平衡常数的测定

实验报告课程名称: 大学化学实验(P ) 指导老师: 成绩:_______________ 实验名称: 分解反应平衡常数的测定 实验类型: 测量型实验 同组学生姓名: 无 【实验目的】1. 熟悉用等压法测定固体分解反应的平衡压力。
2. 掌握真空实验技术。
3. 测定氨基甲酸铵的分解压力,计算分解反应平衡常数及有关热力学函数。
【实验原理】1. 氨基甲酸铵是合成尿素的中间产物,为白色固体,很不稳定,其分解反应式为:NH 2COONH 4(s)2NH 3(g)+CO 2(g)在常压下其平衡常数可近似表示为:⎥⎦⎤⎢⎣⎡⎥⎦⎤⎢⎣⎡=p p p p K 2CO 23NH(1) 其中,p NH 3、p CO 2分别表示反应温度下NH 3和CO 2平衡时的分压;体系总压p =p NH 3+p CO2。
从化学反应计量方程式可知:p p p p 31322CO 3NH ==, (2)将式(2)代入式(1)得:32274332⎪⎪⎭⎫ ⎝⎛=⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫ ⎝⎛=p p p p p p K (3)因此,当体系达平衡后,测量其总压p ,即可计算出平衡常数K 温度对平衡常数的影响可用下式表示:'m ln C RTH K r +∆-=(C ′为积分常数) (4)若以ln K 对1/T 作图,得一直线,其斜率为- m H r ∆/R 。
由此可求出m H r ∆。
并按下式计算T 温度下反应的标准摩尔吉布斯函数变化m G r ∆,m G r ∆=-RT lnK (5)利用实验温度范围内反应的平均等压热效应m H r ∆和T 温度下的标准吉布斯自由能变化m G r ∆,可近似计算出该温度下的熵变m S r ∆TG H S r r rm m m ∆-∆=∆ (6) 因此通过测定一定温度范围内某温度的氨基甲酸铵的分解压(平衡总压),就可以利用上述公式分别装订线求出 K , m H r ∆, m G r ∆ ,m S r ∆。
分解反应平衡常数的测定

p总 p
3
热力学公式
d ln K
r
H
m
dT
RT 2
ln K
r
Hቤተ መጻሕፍቲ ባይዱ
m
C
RT
r Gm0 RT ln K 0
r
S
0 m
r
H
m
r Gm0
T
实验装置
等压计
• U型管两端液面相平, 表明左右两端上方压力相等
• 等压计中的封闭液: 邻苯二甲酸二壬酯、硅油或石腊等 (蒸气压小,不与系统中任何物质发生化学反应)
动态法步骤
1. 抽真空 开放空阀→开真空泵→关放空阀→通气路→开压力计 →500mmHg(68kPa) →停止抽气→开放空阀→关真空 泵→保持2分钟→读数不变
2. 测量 通冷却水→调压器120V →加热丝发红→水沸腾→温度 计读数稳定→记录t1, t2, h, P 放气→改变压力(每次3kPa)→测沸点→记录t1, t2, h, P
P P P P decomp.
NH 3 ( g )
CO2 ( g )
H 2O( g )
实验原理
NH 2COONH 4 (s)
2NH 3 (g) CO2 (g)
K
p NH 3 p
2
pCO2 p
PCO2
1 3 Ptotal
PNH 3
2 3
Ptotal
K
2 3
p总 p
2
1 3
p总 p
4 27
注意事项
• 真空泵使用及关闭前, 应先放空 • 真空泵与系统之间应安装干燥塔, 含浓硫酸的硅
胶干燥塔,用来吸收氨 • 放气时要少量多次, 以防空气倒灌
液体饱和蒸气压的测定
氨基甲酸铵分解反应平衡常数的测定_

氨基甲酸铵分解反应平衡常数的测定
一.实验目的
1.用静态法测定一定温度下氨基甲酸铵的分解压力,求算该反应的平衡常数;
2.了解温度对反应平衡常数的影响,由不同温度下平衡常数的数据,计算反应焓变;
3.进一步掌握真空实验技术和恒温槽的调节使用。
实验方法与实验“静态法测定液体得饱和蒸汽压”实验相同。
因本实验所需真空度较高,试漏时要抽气
至真空系统压力p
s <8.5kPa。
三.注意事项
四.思考题
1.如何检测体系是否漏气?
2.为什么要抽净小球泡中的空气?若体系中有少量空气,对实验结果有何影响?
3.如何判断氨基甲酸铵分解已达平衡?没有平衡就测数据,将有何影响?。
氨基甲酸铵分解反应标准平衡常数的测定

一、 实验目的1、掌握测定平衡常数的一种方法。
2、用等压法测定氨基甲酸铵的分解压力并计算分解反应的有关热力学常数。
二、 实验原理氨基甲酸铵的分解可用下式表示:24322N H C O O N H N H C O →↑+↑Kp=P 2 NH3 ×P CO2 (3-1)设反应中气体为理想气体,则其标准平衡常数可表达为322(/)(/)NH CO Kp p p p θθθ=式中,3NH p 和2co p 分别表示反应温度下NH 3和CO 2的平衡分压,p θ为100kPa 。
设平衡总压为p ,则23p=3NH p ;213co p p=代入式(3-2),得到 34(/)27Kp pθθ=(3-3)因此测得一定温度下的平衡总压后,即可按式(3-3)算出此温度的反应平衡常数K θ。
氨基甲酸铵分解是一个热效应很大的吸热反应,温度对平衡常数的影响比较灵敏。
但当温度变化范围不大时,按平衡常数与温度的关系式,可得: ln r m p H K C RTθθ∆=-+ (3-4)式中,r m H θ∆为该反应的标准摩尔反应焓,R 为摩尔气体常数,C 为积分常数。
根据式(3-4),只要测出几个不同温度下的,以ln pK θ对1/T 作图,所得直线的斜率即为/r m H R θ-∆,由此可求得实验温度范围内的r m H θ∆。
利用如下热力学关系式还可以计算反应的标准摩尔吉氏函数变化r m G θ∆和标准摩尔熵变r m S θ∆:ln r m p G RT K θθ∆=- (3-5) r m r mr m H G S Tθθθ∆-∆∆=(3-6)本实验用静态法测定氨基甲酸铵的分解压力。
参看图3-1所示的实验装置。
样品瓶A 和零压计B 均装在空气恒温箱D 中。
实验时先将系统抽空(零压计两液面相平),然后关闭活塞1,让样品在恒温箱的温度t 下分解,此时零压计右管上方为样品分解得到的气体,通过活塞2、3不断放入适量空气于零压计左管上方,使零压计中的液面始终保持相平。
氨基甲酸铵分解平衡常数的测定

实验十二 氨基甲酸铵分解平衡常数的测定一、实验目的1. 掌握测定平衡常数的一种方法。
2. 用等压法测定氨基甲酸铵的分解压力,并计算反应的标准平衡常数和有关热力学函数。
二、实验原理氨基甲酸铵是白色固体,是合成尿素的中间体,研究其分解反应是具有实际意义的。
氨基甲酸铵很不稳定,易于分解,可用下式表示:243(2((NH COONH NH 2固)气)+CO 气)此复相反应正逆向都很容易进行,若不将产物移去,则很容易达到平衡。
在实验条件下,把反应中的气体均看作理想气体,压力对固体的影响忽略不计,其标准平衡常数可表示为:322()()NH CO p p p K ppθθθ= (1)式中,3NH p 和2CO p 分别表示反应温度下NH 3和CO 2的平衡分压,p θ为100kPa 。
平衡体系的总压p 为3NH p 和2CO p 之和,从上述反应可知:323NH p p =, 213CO p p = 代入式(1)得到:23214()()()3327p p p p K p p pθθθθ== (2)因此,当体系达到平衡后,测定其总压p 即可算出标准平衡常数p K θ。
氨基甲酸铵分解是一个热效应很大的吸热反应,温度对平衡常数的影响比较灵敏。
但当温度变化范围不大时,按平衡常数与温度的关系式,可得:ln rmp H K C RTθθ=-+ (3)式中,rm H θ为该反应的标准摩尔反应热,R 为摩尔气体常数,C 为积分常数。
根据式(3),只要测出几个不同温度下的总压p ,以ln p K θ对1/T 作图,由所得直线的斜率即可求得实验温度范围内的rm H θ。
利用如下热力学关系式还可以计算反应的标准摩尔吉氏函数变化r m G θ和标准摩尔熵变r m S θ:ln r m p G RT K θθ=- (4)r m r m r G H TS θθθ=- (5)本实验用静态法测定氨基甲酸铵的分解压力。
参看图1所示的实验装置。
物化实验报告2-氨基甲酸分解反应标准平衡常数的测定

一、实验目的1.掌握测定平衡常数的一种方法。
2.用等压法测定氨基甲酸铵的分解压力并计算分解反应的有关热力学常数。
二、实验原理NH4COONH4→2NH3 + CO2有上式的方程式得:(平衡常数)K P = P 2NH3*P CO2由于固体NH2COONH4产生的分压很小,可以忽略不计,又因为体系中的NH3和CO2全部是由氨基甲酸铵分解产生的,所以P=P NH3+P CO2由反应方程式可知:P NH3=2P CO2所以P NH3=2/3P , P CO2=1/3P即可以得到Kp0=4/27(P/p0)3因为d(lnKP0)/dT =△rH0m/RT2所以lnKp0= -△rH0m/RT+C若以lnKp0对1/T作图,应为一直线,其斜率为-△rH0m/R,由此可以求出△rH0m。
再根据△rGm0=-RTlnKp0,△rS0m=(rH0m-rG0m)/T可求出△rG0m、△rS0m。
三、实验装置图1-缓冲瓶;2-减压瓶;3-测压仪;4-等压计;5-样品管;6-加热器;7-搅拌器;8-水银接触温度计; 9-1/10刻度温度计; 10、11、12-活塞;四、仪器与药品仪器:循环水泵,低真空数字测压仪,等压计,恒温槽1套,样品管。
药品:氨基甲酸铵,液体石蜡。
五、实验步骤1.由特制的小漏斗将氨基甲酸铵粉末小心装入干燥的球状样品管中,与已装好液体石蜡的等压计连好(注意不要让液体石蜡进入样品管)2.开动循环水泵,旋转活塞10与体系相通,旋转活塞11与减压瓶2想通,旋转活塞12至三个方向都相通,此时观察到的测压仪数字应不断减小,至低真空测压仪示数为-90℃KPa 以下时,关闭活塞11,检查体系的气密性。
3.恒温槽中加水至没过样品管和等压计,调节恒温槽水温为25℃。
4.旋转活塞11,抽吸大约1min,把样品管中的空气抽走,然后关闭活塞11。
慢慢旋转活塞13,缓慢放入空气进入体系,使U型等压计液面水平(注意不可使空气进入过快,避免空气进入样品管)。
分解反应平衡常数

当大气压力与汞槽内的汞面作用达到平衡时,汞就会在玻璃管 内上升到一定高度,通常测量汞的高度,就可确定大气压力的 数值
注意
1. 盛样小球与等压计连接是否可靠。 2. 真空系统各旋塞是否灵活。旋动真空塞
必须两手操作,一手握住活塞套,一手旋 转。 3. 恒温水浴温度是否稳定。波动小于 ±0.1℃,恒温时应关闭加热器开关。
注意
4. 盛样小球内空气是否置换完全。 5. 放空气进入体系时,应分次、缓慢放入,
防止空气进入盛样小球。 6.硅油(被污染后)必要时需要更换。避免
4.测定结束后,应转动C使水银面脱 离象牙针尖。
气压计读数的校正
仪器误差校正 温度校正 纬度和海拔高度的校正
数字式低真空侧压仪
原理:压阻式压力传感器 优点:代替水银压力计无汞污染
使用:将仪器连接在实验系统(不漏气)
预热十分钟 选择测量单位,调节旋钮较零 开动真空泵,测实验系统与大气压之间的差值
若以lnKp 对T -1作图应为一直线, 其斜率 = rHm / R,由可求 rHm。
lnKp
实验原理
T-1
lnKp-T-1图
实验步骤
安装
检漏 开泵
调温 测试
实验步骤
准确读取实验时的大气压和室温值 检漏 恒温槽调至25℃ 抽真空 关闭阀门E不断旋转放空阀c至等压计液面维
持等高并且维持不变,读数 反复做一次,两次读数相差在 2mmHg内 同样方法测不同温度下的分解压。
分解反应平衡常数测定-最全资料PPT

rG m rH mT rSm
rSm
四、实验装置
五、实验步骤
1、安装仪器并检查是否漏气 2、测量调节恒温槽温度为30℃,抽气10min,排尽空气,停 泵。调节平衡管液面平齐,硅油面不再变化,读数。 3、提高恒温槽温度为35、40、45℃、50 ℃ ,重复步骤2测量。 4、实验完毕,将空气放入系统中至压力计压力差为零,切断 电源
R 24、实理验解完温毕度,对将化空学气平放衡入常系数统的中影至响压。力计压力差为零,切断电源
(22、)体理系解必温须度达对平化衡学后平,衡才常能数读的取影压响力。差。
rHm
31、根安据装实仪验器数并据检作查是否漏气~1/T 图,并由计算反应的
。
根据等温方程: 4(2、)体实系验必完须毕达,平将衡空后气,放才入能系读统取中压至力压差力。计压力差为零,切断电源
注意事项: (1) 抽气时,速度不要过快。 (2)体系必须达平衡后,才能读取压力差。
(3) 实验完毕后,应把空气放入反应器。
六、数据记录及处理
1、将有关数据填入下表
室温:
, 大气压:
恒温槽温度
103K/T
p/Pa
t/℃ T/K
,
K
lnK
2、由不同温度下氨基甲酸铵的分解压力,计算反应的 K lnK 填入上表
1、了解氨基甲酸氨分解反应的特点和用等压法测定该反应平衡常数的原理。
2(1、) 由抽不气同时温,度速下度氨不基要甲过酸快铵。的分解压力,计算反应的
填入上表
斜率 H 13氨、 、基安根了甲装据解酸仪实氨铵器验基为并数甲白检据酸色查作氨固是分体否 解,漏反很气应~不1的/稳T特图定点,和并其用由分等计解r压算反法反应测m应式定的为该: 反应平衡。常数的原理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
② 温度校正
T/℃T/K
p 计/kPa p 总/kPa K p
⊙
lnK p ⊙
1/T 130303.15-84.3416.580.000650-7.33920.003299233306.15-80.6520.270.001187-6.73650.003266336309.15-75.7825.140.002264-6.09070.003235439312.15-69.9031.020.004252-5.46030.0032045
42
315.15
-63.27
37.65
0.007603
-4.8792
0.003173
112 分解反应平衡常数的测定-数据处理和实验结果
1 将大气压数值(平均值)进行仪器、温度和重力校正
大气压读数:(101.49MB+101.45MB)/2 = 101.47MB
室温读数:
(29℃+29.5℃)/2 = 29.25℃
① 仪器误差校正:由于仪器本身的不精确引起的误差
根据出厂标识为0.00MB
即为: h 0=h t -1.63×10-4
t·h t 经校正得到气压值为:100986Pa
③ 重力校正:经仪器误差校正与温度校正之后的数值乘以
(1-2.6×10-3cos2φ-3.1×10-7H)在天津地区,上值可取为:0.999382
综上,经过校正得到的大气压数值为:100924Pa
2 用实验中所测得的压力计读数p 计(kPa)及大气压校正值p 校求出体系的平衡总压p 总
p 总=p 校+p 计K p ⊙
=(4/27)×(p 总/p ⊙)3
以校正后压力p 总代入公式计算K p ⊙,lnK p ⊙,并将以上各数据列表
3 以lnK p ⊙对1/T作图,由斜率求平均等压反应热效应Δr H m ⊙
1/T
如图得到斜率为:-19732.8807
Δr H m⊙为19732.88J
4 由下式计算35.0℃的反应标准摩尔吉布斯自由能变化Δr G m⊙
及反应的标准摩尔熵变Δr S m⊙
由上图可知,35.0℃的K p⊙为0.001849
16122.15J/mol
11.72J·mol-1·K-1。
