大学有机化学重点知识总结第五章 芳烃 芳香性[可修改版ppt]
合集下载
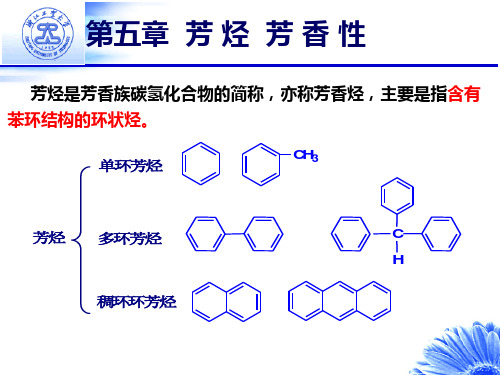
有机化学第五章芳烃芳香性

CH2CH3
1
6
2
5
3
4
CH2CH2CH3
1–乙基–4–丙基苯
编辑课件
9
苯作为取代基
当苯环与较长、较复杂烃基相连或烃基连有多个苯环,或是与不饱和 基相连时,苯环作取代基。
6 54 3 21
CH3CHCH2CH2CHCH3
CH3
6 54 3
21
CH3CH2CH2CH C CH
CH3 CH3
2–甲基–5–苯基己烷
编辑课件
CH3 CH3
1,4–二甲苯 对二甲苯 p–二甲苯
8
命名时的编号
尽量使各取代基编号最小,若有可能,让较最不优先取代基为1位。
CH2CH3 CH2CH2CH3
CH3CH2CH2CH2
CH2CH3 CH2CH2CH3
CH2CH3
2 3
CH2CH2CH3
1
CH3CH2CH2CH2 4 5 6
2–乙基–1–丙基–4–丁基苯
75%
Br Br + FeBr3
+ Br Br FeBr3
H + -
+ Br Br FeBr3
BrH + Br FeBr3
H
BrH
+ Br FeBr3
H 编辑课件
Br
+ H Br + FeBr3 H
22
第一步 Br2分子的极化
Br2 与FeBr3 的络合,Br2分子的极化。
Br Br + FeBr3
编辑课件
28
硝化反应机理
O2N OH +
O H O S OH
O
O O2N OH2 + H O S OH
大学有机化学重点知识总结第五章 芳烃 芳香性

NH2
Cl
OCH3
2-甲 氧 基 -6- 氯 苯 胺
OH
CH3
1
COCH3
3-甲基-4-羟基苯乙酮
大学有机化学重点知识总结第五章 芳烃 芳香性
§5.2 苯的结构
3H2
208.5 kJ/mol
H2
119.3 kJ/mol
苯的氢化热:208.5 kJ • mol-1 环己烯氢化热的3倍:
3×119.3 =357.9 kJ•mol-1
* 5、芳烃侧链的反应
大学有机化学重点知识总结第五章 芳烃 芳香性
一、 芳环上亲电取代反应
试剂中的亲电部分从芳环上取代一个H原子
4–羟基–3–甲氧基苯甲醛
大学有机化学重点知识总结第五章 芳烃 芳香性
C O O H> SO 3H> C O O R> C O C l > C O N H 2> C H O> CO> O H> N H 2> CC >
COOH
1
CC> O R> C l > N O 2
对 -甲 酰 基 苯 甲 酸
CHO
轨道; 6 个π 电子离域在6个C原子上。
p6 6
大学有机化学重点知识总结第五章 芳烃 芳香性
图 5.2 苯的闭合的π轨道 4.环状的共轭体系导致苯分子具有相当高的稳 定性。电子云完全平均化,故无单双键之分。
大学有机化学重点知识总结第五章 芳烃 芳香性
苯分子中的骨架
大学有机化学重点知识总结第五章 芳烃 芳香性
CH3 C CHCH3
2–甲基–3–苯基戊烷 2–苯基–2–丁烯
PhC CH
苯乙炔
CH2
05第五章 芳烃 芳香性4ppt课件

苯乙炔
苄基氯
(benzyl chloride)
精选PPT课件
10
5.2 苯的结构
C6H6
5.2.1 价键理论
•苯分子中所有的C原子都是sp2杂化, sp2–sp2
相互交盖, 构成等同的6个 C-C σ键。
•每个C原子以sp2杂化轨道分别与一个氢原子的
1s轨道相互交盖,构成6 个等同的C-H σ键。
精选PPT课件
14
5.3 单环芳烃的物理性质(不讲)
精选PPT课件
15
5.4 单环芳烃的化学性质
(1)亲电取代反应(先讲机理)
当芳环与亲电试剂作用时,发生取代反应:
+E Y
E +HY
苯环上的π电子云分别位于环的上方 或下方,相当于一个电子源。
供电体: 苯环
精选PPT课件
16
亲电试剂:正离子或带部分正电荷的试剂。
图 5.7 恢复精芳选PPT香课件体系
28
(b) 硝化
硝化反应:苯与浓硝酸和浓硫酸的混
合物于50~60℃反应,则环上的一个氢原
子被硝基取代,生成硝基苯。
)
+ HN3(O浓 浓H2SO4
N2O +H2O
硝基苯
精选PPT课件
29
在较高温度,硝基苯继续反应,主要 生成间硝基苯。
NO2+HN3(O浓浓 1H02SOC0O4
)
NO2 NO2+H2O
精选PPT课件
30
烷基苯反应比苯容易,主要生成邻和 对取代物。
CH3 +HN3O(浓浓 3H02OSCO4
)
CH3
CH3
20
Cl
FeCl3
有机化学课件--第五章芳烃共103页PPT资料

第一节 苯及其同系物
(一)苯的结构
历史上苯的表达方式
Kekul’e式
双环结构式 杜瓦苯
棱形结构式 棱晶烷
2019/9/1
向心结构式
对位键 课件结构式
余价
结构式
5
1825年 法拉第发现了苯。 1857年 凯库勒提出碳四价。
X Y
X Y
1858年 凯库勒提出苯分子具有环 状结构。
1865年 提出摆动双键学说。
2019/9/1
课件
18
5 难以发生加成反应
(1) 其它不饱和键优先发生加成
CH =CH -CH =CH 2 H2/催
CH =CH -CH 2CH 3
(2) 三个双键同时打开
C6H6Cl6
3Cl2 日光
3H2 Pt ,加压
(3) 个别情况只打开部分双键
+
h
6 易发生亲电取代反应
2019/9/1
+
OCH3 H
E
+
OCH3 H
+
E
+
OCH3 H E
最稳定
O C H 3 +H
E
2019/9/1
O C H 3
+
H E
O C H 3
+ H E
课件
O C H 3 H
+E
37
氯苯的情况分析
Cl H
+E
Cl H
E
+
Cl H
E
+
Cl
H
+
E
Cl&E
2019/9/1
C l
+
H E
有机化学第五章芳烃PPT课件

甲苯
乙苯
异丙苯
(2)当苯与烯、炔相连时,习惯上把苯作取代基,不饱和
烃作母体。
-CH=CH2
-C≡CH
苯乙烯(或乙烯第苯1)1页/共114页
苯乙炔
(3) 若烃基的碳链较长或烃链上含有多个苯环时,一般把苯 作取 代基,烃作母体。
CH3 CH3
CH3CH2CH2-CH—CH-CH2
C
2,3-二甲基-1-苯基己烷
的分子,它的真实结构可以用几个经典结构式共同来表示。 这些参与了结构组成的经典结构叫做共振结构式,也叫极
限结构式。
第19页/共114页
+ - ……
O OC
O
O OC
O
OC O O
(二) 共振论的规则 共振结构式的本质是用价键结构式来反映共轭体
系中P电子离域的范围,即用多个合理的价键结构 式来描述电子的瞬间运动状态。
D. 在满足八电子体的共振结构式中,有电荷分离, 负电荷应在电负性较大的原子上。
O
CH3—C—CH2
O-
CH3—C CH2
第24页/共114页
稳定
E. 两个带有相同电荷的原子相隔越近、两个带有相 反电荷的原子 相隔越远,共振式能量高,不稳定, 对杂化体的贡献小
H E
+
+O N
不稳定
O-
三、共振论的优点和缺点 总结:共振论认为共振是一种稳定因素,参与共振 的共振式越多,杂化体越稳定;2)通常以能量最低, 稳定性最高的共振结构为标准,其真实分子即共振 杂化体所降低的能量叫共振能。
芳烃—— 芳香族碳氢化合物
(1)碳氢比高 如:
C : H = 1 : 1 C : H = 10 : 8
有机化学-芳香族PPT课件
亲二烯体
一、芳烃苯环上的反应---聚合反应
A lC l3, C uC l2 n
聚苯
n
第五章 芳 烃 芳 香 性
芳烃的构造异构和命名 苯的结构 单环芳烃的化学性质 a. 芳烃苯环上的反应
b. 芳烃侧链的反应
苯环上亲电取代反应的定位规则 稠环芳烃 芳香性 多官能团化合物的命名
五.苯环上亲电取代反应的定位规则
慢
+ N O 2
H N O 2
NO2+H3O+HSO4 硝 酰 正 离 子
H
N O 2
快
N O 2 + H S O 4
+ H 2 S O 4
亲电取代反应
还 原
Ar NO 2
Ar NH2
偶 氮 染 料
N=N
磺 胺 药 H2N
SO 3H
磺胺嘧啶银
苏丹红Ⅱ号
亲电取代反应
c. 磺化:
浓 硫 酸25℃ H2SO4 SO3
这类定位基在与苯环直接相连的原子上一般具有单键或具 有孤对电子(或带负电荷),具有推电子效应。一般使苯环活 化,反应速度比苯快。
定位规律
b. 间位定位致钝基
N (C H 3)3,N O 2,C F 3,C C I3, 强 第 二 类 定 位 基 C N ,C O O H ,S O 3H ,C H O ,中
CH2
C H
CH2CHCH2CH3 C H CH3
2-甲 基 -3-苯 基 戊 烷
顺 --5 -甲 基 -1 -苯 基 -2 -庚 烯
一、芳烃的构造异构和命名
芳烃从形式上去掉一个氢原子后所剩下的原子团,称为芳基, 常用 Ph-(phenyl的缩写) 。
H2C
有机B第五章 芳烃 芳香性ppt课件

反应过程中 有少量二卤 代苯生成。
C l C l 2 F e C l 3
C l C l
C l
C l
+
C l 3 9 % 5 5 %
+
C l 6 %
C H 3 B r 2 F e C l 5 ℃ 3 2
C H 3 B r
C H 3
C H 3
+
3 2 . 9 % B r 6 5 . 8 %
+
B r 1 . 3 %
有机B第五章 芳 烃 芳香性
第五章 芳烃
5.1 芳香烃的分类 5.2 单环芳烃 5.3 稠环芳香烃 5.4 非苯芳香烃
5.1 芳香烃分类
苯是最简单的芳香烃,按照分子中是否含有苯环
和所含苯环的数目、连接方式的不同,芳香烃可
分为以下几类:
5.2 单环芳香烃
5.2.1 苯的结构
苯的Kekul结构
A C ll 3
HC l +
Z n H g H C l 7 3 %
C H C H C H H C C H C H 2 2 3 3 3 C H C H C H + 3 2 2 C l A C ll 3
+
6 2 % ~ 3 6 %
HC l + 6 4 % ~ 6 8 %
1)付氏烷基化反应
芳烃与卤代烷等烷基化试剂在无水AlCl3的催化下反应,生成 烷基取代的芳烃,这个反应叫付瑞德尔-克拉夫茨 (Friedel-Crafts)烷基化反应,简称付-克烷基化反应。
磺化反应不同于硝化反应。磺化反应是可逆反应,而且温 度对反应产物的影响很大。
S O H 3
H S O 浓 + 2 4
H O + 2
有机化学课件--第五章芳烃

1 O3 2 分解
OO CH3C-CCH3 + 2 OHC-CHO
CH3
CH3 1 O3 2 分解
OO 2CH3C-CH + OHC-CHO
2019/7/30
课件
6
苯现在的表达方式
价键式
分子轨道离域式
共振式
2019/7/30
自旋偶合价键理论 (1986年Copper等提出)
课件
7
2019/7/30
课件
33
取代基分类的规律
分类
分类的依据
苯 、硝基苯、甲苯、氯苯的 硝化的对比实验表明:
硝基是一个致钝的间位定位 基。
甲基是一个致活的邻对位定 位基
氯是一个致钝的邻对位定位 基。
苯环上取代基均可以归入这 三类。
2019/7/30
所有的致活基团都使苯环的电子密度 升高。 所有的致钝基团都使苯环的电子密度 降低。 所有的邻对位定位基都有给电子共轭 效应。 所有的间位定位基具有吸电子共轭效 应和吸电子诱导效应。
37
Cl H
+E
氯苯的情况分析
Cl H
E
+
Cl H
E
+
Cl
H
+
E
Cl + H E
最稳定
Cl +H
E
2019/7/30
Cl
+
H E
Cl
+ H E
课件
Cl H
+E
38
硝化反应的几种情况分析
烷基硝化的实例分析
CH3
58 4 38
CH2CH3
45 6.5 48
CH(CH3)2
第五章芳香烃ppt课件

所以,也可用下式表示苯的结构:
6
第二节 单环芳烃的异构与命名
1.一元取代苯“某苯”
甲苯
乙苯
(toluene)
( ethylbenzene
) 有些取代基,有专门名称,将取代基和苯一 起作为母体。如苯酚 苯胺 苯甲酸 苯磺酸
7
2.二元取代苯的命名
邻二甲苯(1,2 间二甲苯(1,3 对二甲苯(1,4
一、取代反应
1. 卤代反应
16
烷基苯的卤代
苯氯甲烷 苯二氯甲烷 苯三氯甲烷
反应条件不同,产物也不同。原因是两者 反应历程不同,前者(铁粉或FeCl3作催化剂) 为离子型取代反应,光照卤代为自由基历程。
17
侧链较长的芳烃 ,光照卤代主要发生
在α碳原子上。
18
✓自由基的稳定性增加顺序:
<
<
(甲基自由基 < 伯自由基 < 仲自由
间位定位基则对苯环起吸电子作用,使苯 环电子云密度降低,因而不利于苯环的亲电取 代反应,即起钝化作用。
38
三、取代定位效应的应用 1. 指导选择合成路线
例1:
必须先氧化后硝化
39
例2:
40
例3:
41
第六节 稠环芳香烃
一、结构和命名 稠环芳香烃是由两个或两个以上苯环共用 两个邻位碳原子稠合而成的多环芳香烃。
蒽
菲
48
第三节 芳香性:4n+2规则
判断芳香性的规律:在一单环多烯化合物 中,具有共平面的离域体系,其 π 电子数等于 4n+2(n=0,1,2,3…) ,此化合物就具有芳香性。 此 规律称为Hückel 规律,又叫做4n+2规则。
π 电子数 4
大学有机化学芳香烃PPT课件

复合技术
利用纳米技术可以制备出具有特殊功 能的芳香烃纳米材料,如纳米传感器、 纳米催化剂等。
将芳香烃与其他材料复合,可以制备 出具有优异性能的功能复合材料,如 导电高分子材料、耐高温材料等。
表面修饰技术
通过对芳香烃表面进行化学或物理修 饰,可以改变其表面性质,从而赋予 其新的功能,如超疏水、超亲水、抗 菌等。
生物活性评价方法简介
细胞毒性试验
通过测定药物对细胞的毒性作用, 评价药物的生物活性。常用的细 胞毒性试验方法包括MTT法、
LDH法等。
抗菌活性试验
对于具有抗菌作用的药物,可以 通过测定药物对细菌的抑制作用 来评价其生物活性。常用的抗菌 活性试验方法包括琼脂扩散法、
微量肉汤稀释法等。
抗肿瘤活性试验
通过测定药物对肿瘤细胞的增殖 抑制作用,评价药物的抗肿瘤活 性。常用的抗肿瘤活性试验方法 包括MTT法、克隆形成法ቤተ መጻሕፍቲ ባይዱ。
03
钯催化下烯烃与卤代芳烃的偶联反应,可高效构建C-C键,是芳
香烃合成的重要手段。
路线设计原则及实例分析
01
路线设计原则
02
原料易得、价格适中;
03
反应条件温和、操作简便;
04
产物易分离纯化、收率高;
05
符合绿色化学要求,减少废弃物排放。
06
实例分析:以苯乙烯为原料,通过Heck反应合成对甲基苯 乙烯。该路线原料易得,反应条件温和,产物收率高且易于 分离纯化。
高能源利用效率。
04
芳香烃在医药领域应用
药物合成中作用举例
苯环作为核心结构
许多药物都含有苯环,如阿司匹 林、对乙酰氨基酚等,这些药物
的合成离不开芳香烃。
芳香烃侧链修饰
有机化学:第5章 芳烃 芳香性

Br Br FeBr3 H Br
Br + Br FeBr3
H Br
H Br
π电子的离域产生共振杂化体:
H Br
Br FeBr3 H
Br
Br + Br H + FeBr3
催化剂的作用:使卤素变成强亲电试剂,促进反应进行。
第五章 芳烃 芳香性(四、单环芳烃化学性质)
第一步: Br2的极化
Polarization of Br2
苯的闭合共轭体系非常稳定。加成反应, 闭合共轭体系破坏,难以发生。 取代不破坏此稳定结构,且由于离域电 子的流动性较大,向亲电试剂提供电子, 易发生取代反应。
第五章 芳烃 芳香性(二、苯的结构)
2、共振论对苯分子结构的解释
两个或多个经典结构的共振杂化体:
(I) (II) (III) (IV) (V)
苯的氢化热:208.5 kJ • mol-1 环己烯氢化热的3倍: 3×119.3=357.9 kJ•mol-1 离域能149.4kj/mol-1
苯分子的结构是平面正六边形
苯分子中的碳碳键长: 0.14 nm C-C 单键键长: 0.154 nm C C 双键键长: 0.134 nm
键角: 120 °
苯的真实结构式是共振式(I)和(II)产生的杂化体。
其共振能为:149.4 kJ·mol-1 环状的共轭体系导致苯分子具有相当高的稳定性。
第五章 芳烃 芳香性(二、苯的结构)
苯的结构小结:
(1)苯是一个正六边形的平面分子,键长、键角平均化; (2)电子云分布在苯环的上方和下方; (3)π电子高度离域,6个π电子在基态下都在成键轨道
1,4–二甲苯 对二甲苯
o-dimethylbenzene m-dimethylbenzenep-dimethylbenzene
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2. 当苯环上连有两个以上取代基时,需标明取 代基位次或取代基间的相对位置
二取代苯的3个异构体:
CH3
CH3
CH3
CH3
1,2–二甲苯
邻二甲苯
o–
CH3
1,3–二甲苯
间二甲苯
m–
CH3
1,4–二甲苯
对二甲苯
p–
o– : ortho-; m– : meta-; p– : para-
3.多取代苯: (1) 三个相同的取代基
C:SP2杂化
1. 6 个C-C σ键: sp2–sp2相互交盖, 2. 6个 C-H σ键: sp2–1s 相互交盖。
3. 6 个2p 轨道的对称轴垂直于环所在平面,彼
此相互平行,两侧进行侧面交盖,形成闭合的π
轨道; 6 个π 电子离域在6个C原子上。
p6 6
图 5.2 苯的闭合的π轨道
4.环状的共轭体系导致苯分子具有相当高的稳 定性。电子云完全平均化,故无单双键之分。
CH3
CH3
CH3
CH3
CH3
CH3
CH3
H3C
CH3
1,2,3–三甲苯 连三甲苯
1,2,4–三甲苯 偏三甲苯
1,3,5–三甲苯 均三甲苯
(2) 不同取代基,选取最简单的取代基为1位, 将其它取代基位号按尽可能小的方向循苯环编号;
CH2CH3 CH2CH2CH3
CH3(CH2)3
1–乙基–2–丙基–5–丁基苯
醇>酚
2. 编号:
其它的官能团均为取代基,先按照“最低系列” 原则编号;若编号相同,按照“次序规则”较小
基团编号最小,较优基团后列出。
ቤተ መጻሕፍቲ ባይዱCHO
官能团优先次序:
1
35
4
4
OH
OCH3
C H O >O H >O C H 3
4–羟基–3–甲氧基苯甲醛
C O O H> SO 3H> C O O R> C O C l > C O N H 2> C H O> CO> O H> N H 2> CC >
CH3 C 2H 5
C H (C H 3)2
1-甲基-2-乙基-4-异丙基苯
(3) 当苯环与较长、较复杂烃基相连或烃基连有 多个苯环,或是与不饱和基相连时,苯环作 取代基
CH3CH2CH CHCH3 CH3
CH3 C CHCH3
2–甲基–3–苯基戊烷 2–苯基–2–丁烯
PhC CH
苯乙炔
CH2
二苯基甲烷
H+E Y
E +HY
当芳环与亲电试剂作用时,发生取代反应: 苯环上的π电子云分别位于环的上方或下方,相 当于一个电子源。
硝基 卤素
磺酸基
SO 3H NO2
H
X
烷基化
R 酰基化
O
CR
芳环上亲电取代反应的类型
1. 卤化反应—芳烃与卤素作用生成卤代芳烃
X
Fe or + X2 FeX3
+ HX 卤苯
(1)催化剂: Fe粉或FeX3
+ Cl2FeCl3
Cl + HCl
+
FeBr3 Br2
Br + HBr
(2)卤素活性:F2 > Cl2 > Br2 > I2
(3)同时有少量二卤代苯生成,取代基进入 邻、对位。
Cl FeCl3
+ 2Cl2
Cl
Cl
Cl
+
Cl
(4)当苯环上连有烷基时,卤化比苯容 易且取代基进入邻、对位。
CH3 Fe or
+X2 FeX3
CH3 X
+
CH3 X
2. 硝化反应—向有机分子中引入硝基
H2SO4 + HONO2 55-60。C
NO2
+ H2O
硝基苯
(1) 硝化剂:浓HNO3 + 浓H2SO4(简称混酸) (2) 硝化反应的难易与苯环上原有取代基性质有关
H2SO4 + HONO2 55-60。C
苯分子中的骨架
苯分子的p键
6
p6 6
苯分子结构特点:
1. 平面正六边形构型 2. 高度对称、高度离域闭合p键 3. 环骨架很稳定
§5.4 单环芳烃的化学性质
*1、亲电取代反应,易 2、加成反应,难 3、氧化反应,难 4、聚合反应
* 5、芳烃侧链的反应
一、 芳环上亲电取代反应
试剂中的亲电部分从芳环上取代一个H原子
NO2
+ H2O
硝基苯
NO2
发烟HNO3, 浓硫酸
NO2
95。C
间二硝基苯
CH3
+ HNO3
H2SO4 30。C
CH3
O2N
NO2
CH3
NO2 +
CH3
NO2
NO2 TNT
>>
烷底 基物 苯活
性 苯: 硝 基 苯
3. 磺化反应
芳烃与浓H2SO4作用,芳环上H原子被 磺酸基-SO3H取代生成芳磺酸
COOH
1
CC> O R> C l > N O 2
对 -甲 酰 基 苯 甲 酸
CHO
SO3H
NH2
对氨基苯磺酸
COOH
1
HO
NO2
3 -硝 基 -5 -羟 基 苯 甲 酸
C O O H> SO 3H> C O O R> C O C l > C O N H 2> CN> C H O> CO> O H> SH> N H 2> CC > CC > O R> SR> C l > N O 2
大学有机化学重点 知识总结第五章 芳
烃 芳香性
二、命名
芳基:芳烃去掉一个H原子后剩余的部分
苯基:C6H5-, Ph-
芳基:Ar-
CH2
C6H5
Ph或 苯基
C6H5CH2
Bz 苯甲基或苄基
命名原则:
1. 简单的芳烃以苯环为母体, 称“某苯”
CH3 甲苯
Cl 氯苯
CH3
C H C H 3 异丙苯
NO2 硝基苯
357.9-208.5=149.4 kJ/mol
一、苯分子的结构特点:
1865年,Kekule提出了苯的环状构造式
H
0 .1 0 8 n m H
1 2 0o C
C
C
H
1.平面正六边形 2.键角: 120 °
0 .1 4 0 n m 3.碳碳键长: 0.14 nm
C 120o C
H
C
H
H
二、苯分子结构的价键解释
NH2
Cl
OCH3
2-甲 氧 基 -6- 氯 苯 胺
OH
CH3
1
COCH3
3-甲基-4-羟基苯乙酮
§5.2 苯的结构
3H2
208.5 kJ/mol
H2
119.3 kJ/mol
苯的氢化热:208.5 kJ • mol-1 环己烯氢化热的3倍:
3×119.3 =357.9 kJ•mol-1
苯的稳定化能:(离域能或共振能)
CH2 Cl
苄基氯
§5.11 多官能团化合物的命名
1. 选母体:
2. 按照“官能团的优先次序”,以较优的官能团为
官母能体团的优先次序:P197
C O O H> SO 3H> C O O R> C O C l > C O N H 2> C H O> CO> O H> N H 2> CC >
CC> O R> C l > N O 2
H
浓H2SO4
SO3H
(1) 磺化剂: 浓H2SO4 或 发烟H2SO4 (2) 底物活性:烷基苯 > 苯 > 苯磺酸
