过渡元素(一)
实验 过渡系元素(一)(钛、钒、铬、锰)

▪TiO2+2NaOH=Na2TiO3+H2O ▪Na2TiO3+2H2SO4(浓)=
TiOSO4+Na2SO4+2H2O
▪TiO2++H2O2=[TiO(H2O2)]2+
▪ 2.钛(Ⅲ)化合物的生成和还原性
▪ 在盛有0.5mL硫酸氧钛的溶液(用
液体四氯化钛和1mol·L-1(NH4)2SO4 按1﹕1的比例配成硫酸钛溶液)中,
▪ 第三份:滴加0.2 mol·L-1NaOH溶液
NaOH溶液,迅速加入2 mol·L-1盐 酸溶液,有何现象发生?
▪ 第四份:滴加0.2 mol·L-1NaOH溶液
NaOH溶液,迅速加入2 mol·L1NH4Cl溶液,沉淀是否溶解?
▪ 写出上述有关反应方程式。此实验
说明Mn(OH)2具有哪些性质?
▪ 现象:加H+,黄色溶液变为橙红色,
加碱,橙红色溶液变为黄色。
▪ 总结:Cr2O72-和CrO42-离子之间在不同
酸性环境中可以相互转化。
▪ [思考题]
▪ (1)取少量Cr2O72-溶液,加入你
所选择的试剂使其转变为CrO42-。
▪ (2)在上述CrO42-溶液中,加入你
所选择的试剂使其转变为Cr2O72-。
加入两个锌粒,观察颜色的变化,
把溶液放置几分钟后,滴入几滴
0.2 mol·L-1CuCl2溶液,观察现象。 由上述现象说明钛(Ⅲ)的还原性。
▪ 反应方程式如下:
▪ TiOSO4+Zn=Ti2(SO4)3+ZnSO4 ▪ Ti3++Cu2++2Cl-
+2H2O=2CuCl↓+2TiO2++4H+
复旦化学第9章-过渡元素(一)

ⅥB 铬 Cr 3d54s1 钼 Mo 4d55s1 钨 W 5d46s2
辉钼矿MoS2
(Fe、Mn)WO4黑钨矿
CaWO4白钨矿
9.3.2 铬的氧化态与形态变化
Cr(Ⅱ):Cr2+ Cr(Ⅲ):Cr 3+(酸性介质)
CrO2- 、[Cr(OH)4-] (碱性介质) Cr(Ⅵ):Cr2O72- (酸性介质)
电解: 阳极: 2MnO42- -2e→2MnO4- 阴极: 2H2O+2e→H2↑+2OH-
总反应:2K2MnO4+2H2O == 2KMnO4+2KOH+H2↑
Cl2或NaClO氧化:
2K2MnO4+ Cl2 == 2KMnO4 + 2KCl
9.5 铁系元素
9.5.1 概述
Ⅷ
Fe
Co
Ni
3d64s2
3d74s2
3d84s2
价态:+2 +3 (+6) +2 +3 (+5) +2 +3 (+4)
铁、钴、镍在+2、+3氧化态时,半径较小,又有未充满的d轨道,使它们 有形成配合物的强烈倾向,尤其是Co(Ⅲ)形成配合物数量特别多。
许多铁、钴、镍合金是很好的磁性材料。
9.5.2 氢氧化物
Fe(OH)3 Co(OH)3 Ni(OH)3 氧化能力逐渐增加 Fe(OH)2 Co(OH)2 Ni(OH)2 还原能力逐渐减弱
8.3.3 铬的难溶盐
Ag+ Cr2O72- + Ba2+ →
Pb2+
Ag2CrO4↓砖红 BaCrO4↓黄 PbCrO4↓黄
12 过渡元素(一) 铜副族和锌副族

Cu2+的鉴定
—— 在酸性或中性溶液中,
用K4[Fe(CN)6]试剂 2Cu2+ +[Fe(CN)6]4- → Cu2[Fe(CN)6]
红褐色
12-2-2铜的重要化合物
Cu2O CuO 颜色 暗红色 黑色 溶解性 难溶于水,易溶于酸 热稳定性 稳定,1235 C 熔化也不分解 高 加入氨水 [Cu(NH3)2]+(无色) 微溶
12.1.4
氧化态
有多种氧化态。红色为常见的氧化态。
12.1.5 离子的颜色
Mn (Ⅱ) Fe(Ⅱ) Co(Ⅱ) Ni(Ⅱ) Cu(Ⅱ) Zn(Ⅱ)
水合离子呈现多种颜色。
12.1.6 氧化物及其水合物的酸碱性
同种元素,从高价到低价,碱性增强。 Mn2O7 MnO3 MnO2 Mn2O3 MnO 强酸性 酸性 两性 弱碱性 碱性 同一周期最高氧化态的氧化物及水合物, 从左到右碱性减弱,酸性增强。 Sc2O3 TiO2 CrO3 Mn2O7 强碱 两性 酸性 强酸 同族同氧化态,自上而下酸性减弱,碱 性增强。
a
通性
Uuu
ds ⅠB 区 族
Cu 铜
Ag 银
Au 金 岩石 (岩脉金) 砂砾 (冲积金)
主要 矿物
辉铜矿(Cu2S) 黄铜矿(CuFeS2) 赤铜矿(Cu2O) 孔雀石 (Cu2(OH)2CO3) 蓝铜矿 (Cu3(OH)2(CO3)2
闪银矿 (Ag2S) 角银矿 (AgCl)
放 射 性 元 素
通性 ds 区
但Mn特殊, φӨ(Mn2+/Mn)< φӨ(Cr2+/Cr)
φӨ(Ni2+/Ni) =-0.26V φӨ(Pd2+/Pd) = +0.92V
第十八章过渡元素(I)

第十八章 过渡元素(I )Chapter 18 The Transition Elements (I )引 言(Introduction )一、Definition :具有部分充填d 或f 壳层电子的元素。
它包括第四、五、六周期从ⅢB到Ⅷ族的元素,共有8个直列,这些元素都是金属元素,也称为过渡金属。
人们也常将铜分族看作过渡元素,这是由于Cu 2+具有3d 9,Au 3+具有5d 8,且性质也与过渡元素十分相似的缘故。
二、Elements’ Symbol :Ac Pt Ir Os Re W Ta Hf La PdRh Ru Tc Mo Nb Zr Y Ni Co Fe Mn Cr V Ti Sc三、Valence Orbital (n - 1)d 、n s 、n p 共九个轨道 四、Oxidation State :1.过渡元素都有可变氧化态,2.+2氧化态几乎为所有过渡元素的特征氧化态,3.绝大部分过渡元素的最高氧化态等于其族数:Sc 2O 3、CrO 3、Mn 2O 7,4.随着原子序数的增加其高价氧化态越来越稳定:如未发现FeO 4,而发现OsO 4。
其 ∆f 4OsO m,G = -302kJ·mol -1五、Coordination Capacity :过渡元素有很强的配位能力,因为有空的价轨道,与配位原子形成σ配键;又有富的d 电子,可与配体的π*反键轨道或n d 空轨道形成反馈π键。
§18-1 钛分族 The Titanium Subgroup包括: Titanium (Ti) Zirconium (Zr) Hafnium (Ha) Rutherfordium (Rf) Valence electron configuration :(n - 1)d 2n s 2一、General Properties1.Radius :从Ti 到Zr 是增大的,而Zr 和Hf 是相似的,这是由于镧系收缩造成的,使Zr 、Hf 分离困难,只能采取离子交换(ion exchange )法或溶剂萃取(solventextraction )法来分离它们。
第19章 过渡元素(一)

第19章过渡元素(一)19-5 铬的某化合物A是橙红色溶于水的固体.将A用浓HCl处理产生黄绿色刺激性气体B和生成暗绿色溶液C. 在C中加入KOH溶液,先生成灰蓝色沉淀D,继续加入过量的KOH溶液则沉淀消失,变成暗绿色溶液E。
在E中加入H2O2加热则生成黄色溶液F,F用稀硫酸酸化,又变为原来的化合物A的溶液。
问:A, B, C, D, E, F各是什么?并写出相应的反应方程式。
解:Cr2O72- + 6Cl- +14H+ == 2Cr3+ + 3Cl2↑+ 7H2OA(橙红) C(暗绿) B(黄绿)Cr3++3OH- === Cr(OH)3 D(灰兰)Cr(OH)3 + OH- == [Cr(OH)4]- E(绿)2[Cr(OH)4]- + 3H2O2 + 2OH- == 8H2O + 2CrO42- F(黄)2CrO42- + 2H+ == Cr2O72- + H2O========================================================== 19-6 在硫酸铬溶液中,逐渐加入氢氧化钠溶液,开始生成灰蓝色沉淀,继续加碱,沉淀又溶解,再向所得溶液中滴加溴水,直到溶液的绿色转变为黄色。
写出各步的化学反应式。
解:Cr2(SO4)3 + 6NaOH == 2Cr(OH)3↓+ 3Na2SO4Cr(OH)3 + NaOH == Na[Cr(OH)4]2Na[Cr(OH)4] + 3Br2 + 8NaOH == 2Na2CrO4 + 6NaBr + 8H2O19-10 已知[H] = 1.0 mol·L时,锰的元素电位图(ϕ/ V):MnO-4───MnO-24───MnO2───Mn3+───Mn2+───Mn(1) 指出哪些物质在酸性溶液中会发生歧化反应;(2) 求ϕ(MnO4-/Mn2+);2.26 V 0.95 V 1.51 V -1.18 V(3) 写出用电对Mn 2+/Mn 与标准氢电极组成原电池的电池符号及该电池的自发反应的方程式。
实验二十三第一过渡系元素(钛、钒、铬、锰)

THANKS
感谢您的观看
钒(V)
物理性质
钒是一种银灰色的过渡金属,具有体心立方 晶体结构。
化学性质
钒的化学性质较为活泼,可以与氧、卤素等非金属 元素反应。此外,钒还可以形成多种氧化物和盐类 。
用途
钒主要用于钢铁工业中,作为合金元素可以 提高钢的强度、韧性和耐磨性。同时,钒在 化学、陶瓷等领域也有应用。
铬(Cr)
物理性质
酸碱反应
这些元素都能与酸反应生成相应的盐和氢气,同时也能与碱反应生成 相应的氢氧化物和氢气。
用途及应用领域
钛
由于钛具有高强度、低密度和良好的耐腐蚀性,它被广泛 应用于航空、航天、化工等领域。此外,钛及其合金在医 疗器械、珠宝首饰等方面也有应用。
铬
铬是重要的合金元素之一,可以提高钢的硬度、耐磨性和 耐腐蚀性。同时,铬也是电镀、颜料和催化剂等领域的重 要原料。
锰是一种银白色的过渡金属,具有脆性,易氧化。
化学性质
锰属于较活泼的金属,可以与氧、卤素等反应。锰的氧化物具有多 种颜色,可用于制造颜料和玻璃等。
用途
锰主要用于钢铁工业中,作为合金元素可以提高钢的强度、硬度和 耐磨性。同时,锰还用于制造电池、陶瓷和农药等领域。
Part
03
实验方法与步骤
实验材料准备
实验二十三第一过渡系 元素钛、钒、铬、锰
• 引言 • 第一过渡系元素概述 • 实验方法与步骤 • 实验结果与分析 • 第一过渡系元素性质探讨 • 实验总结与反思
目录
Part
01
引言
目的和背景
探究第一过渡系元素钛、 钒、铬、锰的物理和化学 性质。
了解这些元素在自然界中 的存在形式、提取方法和 应用领域。
第13章过渡元素(一)

以上反应体现出CrO42-与Cr2O72-间的平衡移动及铬酸盐 与重铬酸盐溶解度的差异。
16
4.Cr(Ⅵ)的鉴定
向Cr2O72-酸性溶液中加入H2O2,有蓝色CrO5生成: Cr2O7
2-
+ 4H2O2 +
2H+══
乙醚
2CrO5 + 5H2O
CrO5称为过氧化铬,不稳定,易分解为Cr3+和O2,在乙醚或 戊醇中较为稳定.
过过渡元素的原子及离子有空的 ns 、np 及部分空 (n -1)d 轨道, 它们能级相近,可接受配体的孤对电子,形成配合物。
五 . 水合离子的颜色
未成对d 电子
0
水合离子的颜色
未成对 d电子
3
水合离子的颜色
Cr3+ ( 蓝 紫 色 ) 、 Co2+(粉红色) Fe2+(浅绿色) M2+(极浅粉红色)
21
2Mn2+
+ 5S2O8
2-
+ 8H2O ══ 2MnO4- + 10SO42- +16H+
AgNO3
2Mn2++5NaBiO3+14H+ 2MnO4-+5Bi3++5Na++7H2O ═ Mn2+与NaBiO3的反应为鉴定Mn2+的反应 碱性介质: Mn2+ + 2OH- ═ Mn(OH)2↓ (白色) 2Mn(OH)2 + O2 ═ 2MnO(OH)2↓(MnO2的水合物) (棕黑)
H+ OH-
Cr2O72- + H2O
PH=11时,Cr(Ⅵ)几乎100%以CrO42-形式存在 PH=1.2时,Cr(VI)几乎100%以Cr2O72-形式存在
第二十章 过渡元素

f区元素
d 区元素显示出许多区别于主族元素的性质:
● 熔、沸点高,硬度、密度大的金属大都集中在这一区 ● 不少元素形成有颜色的化合物 ● 许多元素形成多种氧化态从而导致丰富的氧化还原行为 ● 形成配合物的能力比较强,包括形成经典的维尔纳配合物
和金属有机配合物 ● 参与工业催化过程和酶催化过程的能力强
20.2.2 氧化态
同周期元素族氧化态稳定性变化趋势
● 红色为常见的氧化 态
● 同同期自左至右形成族 氧化态的能力下降
● 由图清楚说明了由 Sc 至 Cu 族氧化态的热力 学稳定性趋势
● 有人声称已制备出FeO4
同周期元素低氧化态稳定性变化趋势
d 区金属自左至右族氧化态稳定性下降和低氧化态稳定上升的趋
第二十章 过渡元素(Ⅰ)
本章内容:
20.1 引言 20.2 第一过渡系元素的基本性质 20.3 钪 20.4 钛 20.5 钒 20.6 铬 20.7 锰
本章重点: 钛、钒、铬的重要化合物的主要性质
d 区元素的电子分别填充在 3d 亚层、4d 亚层和 5d 亚层上 .
1996年2月德国科学家宣布发现112号元素, 使第四过渡系的空格 终于被填满.
420 593 752 659 661 650 558 373 285 112
431 789 782 851 778 790 669 565 368 61
金属元素的原子化焓是金属内部原子结合力强弱的一种标志,较高的 原子化焓可能是由于较多的价电子(特别是较多的未成对电子)参与形成
金属键.这种结合力似乎也应该反映在过渡元素的上述物理性质上。
Question 3 随周期性的增加,为什么主族元素低氧化
态趋于稳定,而过渡元素高● 过渡元素因 “惰性电子对效应” ● 过渡元素是 I1 和 I2 往往是第 二、三 过渡系列比第 一 过渡系大
第一过渡系元素(一)

目录
绪论 实验 1 仪器的认领和洗涤 实验 2 灯的使用 玻璃管的简单加工 实验 3 称量练习——台秤和分析天平的使用 实验 4 CO2 相对分子质量的测定 实验 5 硫酸铜结晶水的测定 实验 6 溶液的配制 实验 7 酸碱滴定 实验 8 HAC 电离度和电离常数的测定 实验 9 水的净化——离子交换法 实验 10 PbI2 溶度积的测定 实验 11 由海盐制试剂级 NaCl 实验 12 化学反应速率和活化能——数据的表达和处理 实验 13 转化法制备 KNO3 ——溶解、蒸发、结晶和固液分离 实验 14 碱式碳酸铜的制备——设计实验 实验 15 氧化还原反应和氧化还原平衡 实验 16 硫酸亚铁铵的制备——设计实验 实验 17 P 区非金属元素(一)(卤素、氧、硫) 实验 18 P 区非金属元素(二)(氮族、硅、硼) 实验 19 常见非金属阴离子的分离与鉴定 实验 20 硫代硫酸钠的制备 实验 21 主族金属(碱金属、碱土金属、铝、锡、铅、锑、铋) 实验 22 ds 区金属(铜、银、锌、镉、汞) 实验 23 常见阳离子的分离与鉴定(一) 实验 24 第一过渡系元素(一)(钛、钒、铬、锰) 实验 25 第一过渡系元素(二)(铁、钴、镍) 实验 26 磺基水杨酸合铁(III)配合物的组成及其稳定常数的测定 实验 27 一种钴(III)配合物的制备 实验 28 高锰酸钾的制备——固体碱熔氧化法 实验 29 醋酸铬(II)水合物的制备——易被氧化的化合物的制备
实验 30 1. 从烂版液回收硫酸铜——设计实验(本科) 2. CuCl 的制备设计实验 {1,2 选作一个}
过渡元素一

第二十一章过渡元素(一)21-1 钛及其化合物钛是过渡金属元素,在地壳中的丰度是0.63 %,居元素分布序列中的第十位。
钛的主要矿物有钛铁矿FeTiO 3、金红石TiO 2和组成复杂的钒钛铁矿,我国四川攀枝花地区有极丰富的钒钛铁矿。
1. 钛的性质纯净的钛具有银白色的金属光泽,有良好的可塑性,是一种新兴的结构材料。
它的密度为4.54g /cm 3,比钢轻。
机械强度却与钢相似。
钛兼有钢和铝的优点,且耐热性能好,熔点高达1933K ,是制造飞机、火箭和宇宙飞船等最好的材料。
钛被誉为宇宙金属。
在酸性溶液中,φ Aθ(Ti 2+ /Ti )= -1.63V φA θ(TiO 2 /Ti )= -0.88V从标准电极电势看, 钛是还原性很强的金属, 但因在钛的表面容易生成致密的、钝性的氧化物薄膜,使得钛具有优良的抗腐蚀性,特别是对海水的抗腐蚀力很强。
用钛制造的轮船不用涂漆,在海水中也不会生锈。
钛能溶于热的盐酸和热硝酸中。
钛的最好的溶剂是氢氟酸或含有氟离子的酸,因为 F - 与钛生成配合物促进钛的溶解。
Ti + 6HF = [TiF 6 ] 2 - + 2H + + 2H 2 ↑2. 钛的制备由于钛在高温下化合能力极强,可与氧、碳、氮以及其他许多元素化合,甚至连冶金上常用的氧化铝坩埚也不能使用,因此钛的最大的缺点是难于提炼。
现在制备金属钛常用的方法是在1070K ,于氩气氛中用熔融的金属镁还原四氯化钛蒸气。
1070KTiCl 4 + 2Mg == Ti + 2MgCl 2除用镁作还原剂外,还可以用金属钠为还原剂从TiCl4制取金属钛。
TiCl 4 + 4Na == Ti + 4NaCl3 、二氧化钛天然的二氧化钛称为金红石,是一种桃红色的晶体,有时因含有微量的Fe 、Nb 、Sn 、V 、Cr 等杂质而呈黑色。
经过化学处理制造出来的纯净二氧化钛是雪白色的粉末,俗称钛白。
钛白是世界上最白的东西,其遮盖性大于锌白,持久性高于铅白,是一种宝贵的白色颜料。
第一过渡系元素(一)(钛、钒、铬、锰)

第一过渡系元素(一)(钛、钒、铬、锰)第一过渡系元素是指周期表中第3至第12族的元素,它们在化学性质上有相似之处。
其中,钛(Ti)、钒(V)、铬(Cr)和锰(Mn)是第一过渡系元素中的前四个元素,它们具有一些共通的特性,同时也存在一些区别。
本文将从以下几个方面来介绍这四个元素:元素性质、物理性质、化学性质以及地质应用。
一、元素性质1.钛(Ti)钛是一种质轻、高强度、高耐腐蚀性、抗疲劳性能好的金属。
它具有优异的机械性能,被广泛应用于航空、航天、化工、海洋开发等领域。
同时,钛也是一种生物医用材料,被用于制作人体骨骼支架、人造关节、人工心脏瓣膜等。
2.钒(V)钒是一种银白色金属,比铁硬但稍加工艺处理后可以获得良好的延展性和强度。
它还有广泛的应用,用于制造钢、化学试剂和合金等。
不仅如此,钒还是一种强化剂,在钢铁生产过程中起到重要的作用。
3.铬(Cr)铬是一种具有高度耐腐蚀性的银白色金属,它主要应用于不锈钢、电子元器件、航空航天、制药等领域。
除此之外,铬还是一种环保型材料,可以用于净水和净化技术。
4.锰(Mn)锰是金属元素中的一种,它是一种银灰色的金属,具有良好的延展性和韧性。
锰还是钢铁生产中的一种重要元素,可以增强钢的硬度和韧性。
二、物理性质钛是一种具有低密度和高强度的金属,密度为4.54克/厘米立方。
它具有较高的熔点(1668℃)和沸点(3287℃),同时也具有较高的热导率和电导率。
三、化学性质钛是一种化性非常稳定的金属,在常温下不会被大多数酸和碱腐蚀。
它可以与氧、氮、氢反应,产生相应的氧化物、氮化物和氢化物。
此外,钛还可以和卤素反应,如氯、溴和碘等,生成相应的卤化物,例如TiCl4、TiBr3等。
锰可以和许多元素和化合物发生反应。
它可以与氧、氯、酸、弱碱等反应,生成各种不同的化合物。
在大气环境下,锰会逐渐氧化形成氧化锰,该过程是一种蓝黑色的化学反应。
四、地质应用钒是一种重要的工业金属,在地球上的丰度较低,但在一些特定的矿物中含量较高。
实验七 第一过渡系元素 (钛、钒、镉、锰)

实验七第一过渡系元素 (钛、钒、镉、锰)第一过渡系元素是指周期表中第3到第12族元素,它们拥有类似的电子结构和化学性质,具有宽广的应用前景。
其中,钛、钒、镉、锰是较为常见的第一过渡系元素,本篇文章将介绍这些元素的基本性质、应用领域以及相关实验。
一、钛(Ti)钛是一种银白色、质地轻巧的金属,熔点高达1670℃,具有较高的强度和耐腐蚀性。
由于其优良的物理和化学性质,钛被广泛应用于航空、航天、能源、汽车、医药等领域。
目前,钛制品已成为高端制造业的主要材料之一。
钛的化学性质活泼,易于形成氧化物。
在实验中,常用Na2TiO3或K2TiO3作为钛标准溶液,通过络合滴定法测定样品中的钛含量。
此外,钛还可以与硫酰化剂反应,生成具有深色化合物,可以用于反应的定量分析。
二、钒(V)钒是一种银灰色金属,化学性质活泼。
钒元素存在于许多矿物中,主要产地为俄罗斯、中国和南非等地。
钒是重要的合金元素,可以提高钢的韧性和耐磨性。
此外,钒也可以用于生产电池和电导管等。
钒的分析方法比较复杂。
在实验中,可以通过还原-氧化反应测定样品中钒的含量。
首先,将样品转化为VO2+,然后将VO2+还原为V2+,最后再进行氧化反应。
三、镉(Cd)镉是一种银灰色金属,属于类锌金属。
长期以来,镉被广泛用于电池、电子器件、涂料、塑料等领域。
然而,由于其高毒性和紫外线敏感性,镉已被列入高毒性元素之列。
在实验中,可以用电化学或原子吸收光谱法测定样品中的镉含量。
电化学分析时,将样品置于电极中,然后进行电位扫描,以测定镉的还原电位。
原子吸收光谱法则是将样品原子吸收到特殊的光源中,测量其吸收的光谱信号,以得到镉的含量。
四、锰(Mn)锰是一种灰黑色的金属,具有较高的硬度和抗腐蚀能力。
由于其良好的物理和化学性质,锰被广泛应用于铁合金、电池、合成橡胶、开本工业等领域。
在实验中,可用酸碱滴定法测定锰的含量。
首先,将锰溶解为Mn2+,然后加入过量的氧化还原剂,使Mn2+被氧化为MnO4-。
第19章-过渡元素(一)习题

第19章 过渡元素(一)习题1.选择题19-1下列配离子属于反磁性的是……………………………………………( )(A) [Mn(CN)6]4-(B) [Cu(en)2]2+ (C) [Fe(CN)6]3- (D) [Co(CN)6]3-19-2下列氧化物与浓H 2SO 4共热,没有O 2生成的是……………………( ) (A) CrO 3 (B) MnO 2 (C) PbO 2(D) V 2O 5 19-3下列离子中磁性最大的是………………………………………………( )(A) V 2+ (B) Cr 3+ (C) Mn 2+ (D) Fe 2+19-4 在某种酸化的黄色溶液中,加入锌粒,溶液颜色从黄经过蓝、绿直到变为紫色,该溶液中含有……………………………………………………………( )(A) Fe 3+ (B) +2VO (C)-24CrO (D) Fe (CN)-4619-5在碱性溶液中氧化能力最强的是………………………………………( )(A) -4MnO (B) NaBiO 3 (C) Co 2O 3 (D)-272O Cr19-6过渡金属和许多非金属的共同点是……………………………………( )(A) 有高的电负性 (B) 许多化合物有颜色(C) 有多种氧化态 (D) 许多化合物具有顺磁性 19-7 CrO 5中Cr 的氧化数为 …………………………………………………( )(A) 4 (B) 6 (C) 8 (D) 10 19-8在酸性介质中加入过氧化氢(H 2O 2)时不生成过氧化物的化合物是…( )(A) 钛酸盐 (B) 重铬酸盐 (C) 钒酸盐 (D) 高锰酸盐 19-9根据铬在酸性溶液中的元素电势图可知, ϕ(Cr 2+/Cr)为…………… ( )Cr 3+──── Cr 2+ ───── Cr(A) -0.58 V (B) -0.91 V(C) -1.32 V (D) -1.81 V19-10 已知V 3+ / V 2+ 的 ϕ= -0.26 V ,O 2/H 2O 的 ϕ= 1.23 V ,V 2+离子在下述溶液中能放出氢的是………………………………………………………………( )(A) pH = 0的水溶液 (B) 无氧的pH = 7的水溶液 -0.41 V -0.74 V(C) pH = 10的水溶液 (D) 无氧的pH = 0的水溶液19-11对第四周期的过渡元素,不具备的性质是…………………………( )(A) 形成多种氧化态 (B) 形成配位化合物(C) 配位数为4或6 (D) 形成的离子必具有4s 23d n 的电子排布19-12根据价层电子的排布,预料下列化合物中为无色的是………………( )(A) TiCl 3 (B) ScF 3 (C) MnF 3 (D) CrF 319-13由铬在酸性溶液中的元素电势图,可确定能自发进行的反应是……( ) Cr 3+ ───── Cr 2+ ───── Cr(A) 3Cr 2+ → 2Cr 3+ + Cr(B) Cr + Cr 2+ → 2Cr 3+(C) 2Cr → Cr 2+ + Cr 3+(D) 2Cr 3+ + Cr → 3Cr 2+19-14用 Nernst 方程式 ϕ =][][lg 0592.0还原剂氧化剂n + ϕ,计算MnO 4-/Mn 2+的电极电势 ϕ ,下列叙述不正确的是…………………………………………………( )(A) 温度应为298 K (B) Mn 2+ 浓度增大则ϕ 减小(C) H + 浓度的变化对ϕ 无影响 (D) MnO -4浓度增大,则ϕ 增大19-15下列各组自由离子的磁矩从小到大变化顺序,正确的是………( )(A) Cu 2+ < Ni 2+ < Co 2+ (B) Cr 2+ < Fe 2+ <Fe 3+(C) Cr 2+ < Mn 2+ < V 2+ (D) Ti 2+ < V 3+ < Cr 2+19-16在强碱性介质中,钒(Ⅴ)存在的形式是………………………………( )(A) VO (B) VO 3+(C) V 2O 5·n H 2O(D)-34VO 19-17已知某黄色固体是一种简单化合物,它不溶于热水而溶于热的稀盐酸,生成一种橙红色溶液。
第13章过渡元素(一) 铜族和锌族元素
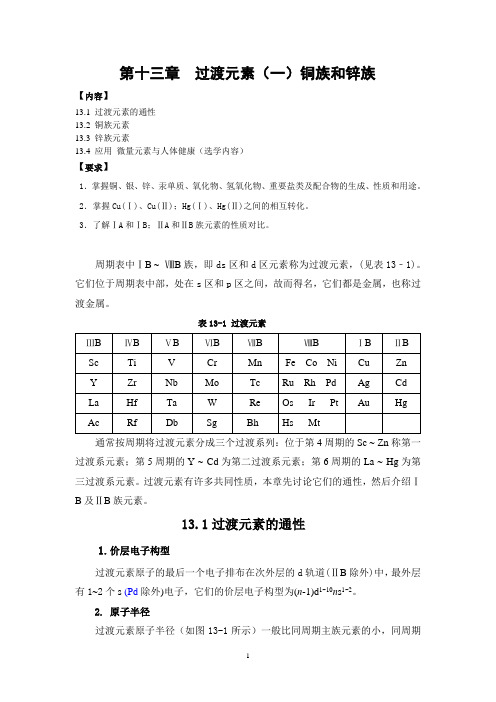
第十三章过渡元素(一)铜族和锌族【内容】13.1 过渡元素的通性13.2 铜族元素13.3 锌族元素13.4 应用微量元素与人体健康(选学内容)【要求】1.掌握铜、银、锌、汞单质、氧化物、氢氧化物、重要盐类及配合物的生成、性质和用途。
2.掌握Cu(Ⅰ)、Cu(Ⅱ);Hg(Ⅰ)、Hg(Ⅱ)之间的相互转化。
3.了解ⅠA和ⅠB;ⅡA和ⅡB族元素的性质对比。
周期表中ⅠB ~ⅧB族,即ds区和d区元素称为过渡元素,(见表13﹣1)。
它们位于周期表中部,处在s区和p区之间,故而得名,它们都是金属,也称过渡金属。
表13-1 过渡元素通常按周期将过渡元素分成三个过渡系列:位于第4周期的Sc ~ Zn称第一过渡系元素;第5周期的Y ~ Cd为第二过渡系元素;第6周期的La ~ Hg为第三过渡系元素。
过渡元素有许多共同性质,本章先讨论它们的通性,然后介绍ⅠB及ⅡB族元素。
13.1过渡元素的通性1.价层电子构型过渡元素原子的最后一个电子排布在次外层的d轨道(ⅡB除外)中,最外层有1~2个s (Pd除外)电子,它们的价层电子构型为(n-1)d1~10n s1~2。
2. 原子半径过渡元素原子半径(如图13-1所示)一般比同周期主族元素的小,同周期元素从左到右原子半径缓慢减小,到铜族前后又稍增大。
同族元素从上往下原子半径增大,但第二、第三过渡系(除ⅢB外)由于镧系收缩使同族元素原子半径十分接近,导致元素性质相似。
图13-1过渡元素原子半径3. 氧化态过渡元素有多种氧化态,因其最外层s电子和次外层部分或全部d电子都可作为价电子参与成键,一般可由+2依次增加到与族数相同的氧化态(Ⅷ族除Ru、Os外,其它元素尚无Ⅷ氧化态),这种氧化态的显著特征以第一过渡系最为典型。
表13-2第一过渡系元素的氧化数(下划线表示常见的氧化态)由13-2表可看出随着原子序数的增加,氧化数先是逐渐升高,后又逐渐降低。
这种变化主要是由于开始时3d轨道中价电子数增加,氧化数逐渐升高,当3d轨道中电子数达到5或超过5时,3d轨道逐渐趋向稳定。
过渡金属(一)
5、原子半径从左到右逐渐减小。
2018年11月27 日11时27分
1. 电子构型 除Pd外,它们都有未充满的d轨道,最外层也仅 有1-2个电子,过渡元素通常指价电子层结构即: (n-1)d1-9ns1-2。 2. 氧化值 它们的(n-1)d和ns轨道能级的能量相差很小,d电 子也可部分或全部作为价电子参加成键。一般由+2价 直到与族数相同的氧化态(VIII例外)。 3. 单质的化学性质 IIIB族是它们中最活泼的金属,性质与碱土金属 接近。同族元素的活泼性从上到下依次减弱。
2、TiCl4:易水解,为偏钛酸及TiOCl2,在浓 HCl中生成H2[TiCl6]
3、Ti2(SO4)3:三价钛的还原性比(Sn2+)稍强 Ti2(SO4)3+Fe2(SO4)3 ⇌ 2Ti(SO4)2+2FeSO4 二价钛具有更强的还原性。
2018年11月27 日11时27分
20-3 钒分族
一、存在和发现 钒的主要矿物有:绿硫钒矿VS2或V2S5,钒铅矿 Pb5[VO4]3Cl等。 Nb和Ta因性质相似,在自然界中共生,矿物为 Fe[(Nb,Ta)O3]2如果Nb的含量多就称铌铁矿,反之为 钽铁矿。 二、单质的性质和用途 电子构型为(n-1)d3ns2价态有+V、+IV、+III、+II, V、Nb、Ta以+V价最稳定,V的+IV价也较稳定。 它们的单质容易呈钝态、都溶于硝酸和氢氟酸的 混合酸中,钽不溶于王水。
20-1
通 性
第一过渡 系元素
VIII 26 Fe 27 Co 28 Ni
过渡元素(1)

VO2 Fe2 2 H VO 2 Fe3 H 2O 2VO2 H 2C2O4 2 H VO 2 2CO2 2 H 2O VO2 2 I 4 H V 3 I 2 2 H 2O 2VO2 3Zn 8H 2V 2 3Zn 2 2 H 2O
在酸性溶液中,VO2+可被Fe2+,SO32-,H2C2O4,I-,Zn等还原剂还原,还原 产物具有丰富多彩的颜色。 Fe2+只能将V(V)还原为VO2+,I-只能将V(V)还原 为V3+,而Zn可将其还原为V2+。如在NH4VO3的酸性溶液中加入Zn,会依次 看到蓝色(VO2+)绿色(V3+)及紫色(V2+),这是一种分级还原的过程。 V(Ⅲ),V(Ⅱ)是强还原剂,尤其在碱性条件下,很容易被空气中的氧所氧化, V(Ⅱ)的化合物还能从水中置换出氢。
二、钛及其化合物
二氧化钛的制取
二氧化钛的工业生产,几乎包括了全部无机化学工艺过程,因而被喻 为“工艺艺术品”。
二氧化钛的生产可采用硫酸法或氯化法,以钛铁矿为原料的二氧化钛 生产常以硫酸法为主。该法主要过程有:(1)硫酸分解精矿制取硫酸氧钛溶 液(2)净化除铁(3)水解制偏钛酸(4)偏钛酸煅烧制二氧化钛。 钛铁矿精矿成分除FeTiO3外,还有Fe2O3以及SiO2, Al2O3, MnO, CaO, MgO等杂质。160~200°C下,用浓硫酸分解精矿的主要反应如下:
四、铬及其化合物
铬的价电子结构为3d54s1,可形成氧化值为+2、+3、+6的化合物,其中 +3、+6的化合物较常见。铬的化合物主要有氧化物、氢氧化物、含氧酸及其 盐类,呈现多种颜色。
第一过渡系元素(一) Fe、 Co、Ni

(6 mol· L-1, 2mol· L-1),NH3H2O (6 mol· L-1),
FeSO4 ( 0.1 mol· L-1) ,FeCl3 (0.2 mol· L-1) ,CoCl2 (0.1 mol· L1)
,NiSO4 (1 mol· L-1) ,KI ( 0.1mol· L-1) 、溴水、氯水、碘
水、CCl4、K4[F、戊醇、乙醚、
KSCN (饱和)、H2O2 (3%) 、KNO2 (饱和) 。 固体试剂:硫酸亚铁铵、NaF。
实验步骤
一.二价Fe、Co、Ni化合物的还原性 1、酸性介质: + Br2
2、碱性介质:
+ 空气
二.三价铁、钴、镍化合物的氧化性 1、碱性介质产物 + 浓盐酸 三.配合物的生成 1、铁的配合物: CN-、SCN- 、NH3· H2O
第一过渡系元素 Fe、 Co、Ni
实验目的
• 试验并掌握二价铁、钴、镍的还原性和 三价铁、钴、镍的氧化性 • 试验并掌握铁、钴、镍配合物的生成和 性质。
实验仪器与试剂
实验材料:
KI – 淀粉
试剂:
液体试剂:H2SO4 (1 mol· L-1),HCL (浓),HAc (6 mol· L1 ),NaOH
2、钴的配合物: SCN- 、NH3· H2O 、NO23、镍的配合物: NH3· H2O; 产物分别用 酸、碱、水和热处理
思考题
1、 如果想观察纯Fe(OH)2的白色,原料硫酸亚铁不含Fe3+是 关键,如何检出和除去原料的Fe3+? 2、综合氧化性实验所观察到的现象,总结+2氧化态的铁、钴、 镍化合物的还原性和+3氧化态的铁、钴、镍化合物的氧 化性的变化规律? 3、制取Co(OH)3、Ni(OH)3时,为什么要以Co(II)、Ni(II)的 盐为原料,在碱性溶液中进行氧化,而不用Co(III)、 Ni(III)的盐为原料直接制取? 4、试从配合物的生成对电极电势的改变来解释为什么 [Fe(CN)6]4-能把I2还原成I-,而Fe2+则不能。 5、根据实验结果比较[Co(NH3)6]2+配离子和[Ni(NH3)6]2+配离 子氧化还原稳定性的相对大小及溶液稳定性。
副族元素

第 20 章
过渡元素 (I)
Chapter 20
The transition elements (I)
20.1.1 过渡区元素简介
过渡元素在元素周期表中的位置
过渡元素
. 过渡元素包括 d 区和 ds 区元素,即周期系第 IIIB ~
VIIB,VIII,IB ~ IIB 元素,不包括镧系和锕系元素。 其在周期表中位于 s 区元素和 p 区元素之间,均为金属, 因此也称为过渡金属。
第一过渡系元素 第二过渡系元素 第三过渡系元素
20.1.4 过渡元素单质的化学性质
过渡元素单质的化学性质概述 过渡金属第一过渡系(四周期):较活泼的轻过渡金属; 过渡金属第二、三过渡系(五、六周期):不活泼的重 过渡金属(原因也是由于“镧系收缩”的结果)。 同一周期元素:从左向右过渡,总的变化趋势是电极电势 E (M2+/M) 值逐渐变大,即其活泼性逐渐减弱。 钝化作用的影响:金属的表面性质,如一些金属的表面易 形成致密的氧化膜,也影响其化学活性。
d6
[Fe(H2O)6]2+ 淡绿色
d2
[V(H2O)6]3+ 绿色
d6
[Co(H2O)6]3+ 蓝色
d3
[Cr(H2O)6]3+ 紫色
d7
[Co(H2O)6]2+ 粉红色
d3
[V(H2O)6]2+ 紫色
d8
[Ni(H2O)6]2+ 绿色
d4
[Cr(H2O)6]2+ 蓝色
d9
[Cu(H2O)6]2+ 蓝色
. 过渡金属元素的原子的价电子层构型 :
(n-1)d1-10 ns1-2 (Pd 为 5s0)
实验七 第一过渡系元素 (钛、钒、镉、锰)
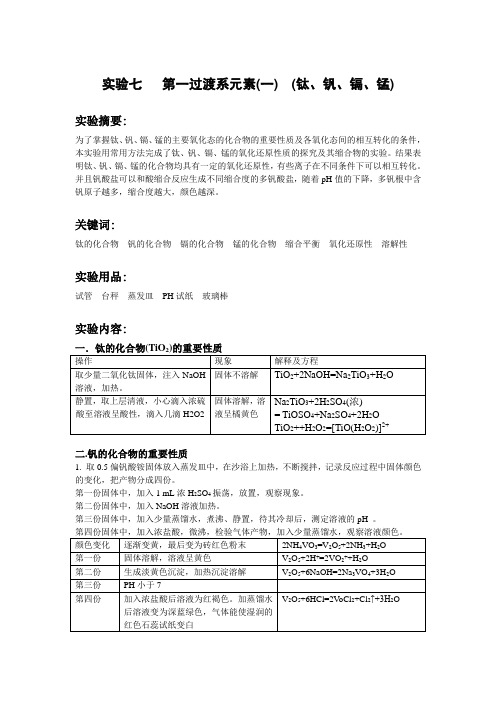
实验七第一过渡系元素(一) (钛、钒、镉、锰)实验摘要:为了掌握钛、钒、镉、锰的主要氧化态的化合物的重要性质及各氧化态间的相互转化的条件,本实验用常用方法完成了钛、钒、镉、锰的氧化还原性质的探究及其缩合物的实验。
结果表明钛、钒、镉、锰的化合物均具有一定的氧化还原性,有些离子在不同条件下可以相互转化。
并且钒酸盐可以和酸缩合反应生成不同缩合度的多钒酸盐,随着pH值的下降,多钒根中含钒原子越多,缩合度越大,颜色越深。
关键词:钛的化合物钒的化合物镉的化合物锰的化合物缩合平衡氧化还原性溶解性实验用品:试管台秤蒸发皿PH试纸玻璃棒实验内容:二.钒的化合物的重要性质1. 取0.5偏钒酸铵固体放入蒸发皿中,在沙浴上加热,不断搅拌,记录反应过程中固体颜色的变化,把产物分成四份。
第一份固体中,加入1 mL浓H2SO4振荡,放置,观察现象。
第二份固体中,加入NaOH溶液加热。
第三份固体中,加入少量蒸馏水,煮沸、静置,待其冷却后,测定溶液的pH 。
三、铬的化合物的重要性质2-3+2-与CrO2-的相互转化)2-转变为CrO2-四、锰的化合物重要性质1.氢氧化锰(Ⅱ)的生成和性质取10mL0.2 mol·L-1MnSO结果及讨论:V2O5具有两性,既溶于酸又溶于碱。
向钒酸盐溶液中加酸,pH值逐渐下降,则生成不同缩合度的多钒酸盐,随着pH值的下降,多钒根中含钒原子越多,缩合度越大。
缩合度增大,溶液的颜色逐渐加深,即由淡黄色变到深红,溶液转为酸性后,缩合度不再改变,而是获得质子的反应。
Cr2O72-和CrO42-离子之间在不同酸性环境中可以相互转化。
Cr(OH)3具有两性,既溶于酸又溶于碱。
CrO2中的Cr(Ⅲ)具有还原性,被氧化为Cr(VI) CrO42-该转化常在碱性介质中进行。
MnO2具有氧化性。
KMnO4具有氧化性,在不同介质中其还原产物不同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第19章过渡元素(一)19.1 引言过渡元素位于周期表中部,原子中d或f亚层电子未填满。
这些元素都是金属,也称为过渡金属。
根据电子结构的特点,过渡元素又可分为:外过渡元素(又称d区元素)及内过渡元素(又称f区元素)两大组。
●外过渡元素包括镧、锕和除镧系锕系以外的其它过渡元素,它们的d 轨道没有全部填满电子,f轨道为全空(四、五周期)或全满(第六周期)。
●内过渡元素指镧系和锕系元素,它们的电子部分填充到f轨道。
d区过渡元素可按元素所处的周期分成三个系列:①位于周期表中第4周期的Sc~Ni------称为第一过渡系元素②第5周期中的Y~Pd称为第二过渡系元素③第6周期中的La~Pt称为第三过渡系元素本章所讨论的过渡元素只包括周期系第4、5、6周期从ⅢB族到ⅧB族的元素,具有(n-1)d轨道未充满的那些元素,共有8个直列,25种元素(如表19-l方框内的元素)。
镧系和锕系元素的性质,在第21章讨论。
19.2 过渡元素的基本性质过渡元素具有许多共同的性质:◆它们都是金属,硬度较大,熔点和沸点较高,有着良好的导热、导电性能,易生成合金。
◆大部分过渡金属与其正离子组成电对的电极电势为负值,即还原能力较强。
例如,第一过渡系元素一般都能从非氧化性酸中置换出氢。
◆大多数都存在多种氧化态,水合离子和酸根离子常呈现一定的颜色。
◆具有部分填充的电子层,能形成一些顺磁性化合物。
◆原子或离子形成配合物的倾向较大。
19.2.1 过渡元素原子的电子构型过渡元素原子电子构型的特点是它们的 d 轨道上的电子未充满(Pd例外),最外层仅有1~2个电子,它们的价电子构型为(n-1)d1-9n s1-2(Pd为4d105s0)。
表19-3 过渡元素原子的价电子层结构和氧化态元素Sc Ti V Cr Mn Fe Co Ni价电子层结构3d14s23d24s23d34s23d54s13d54s23d64s23d74s23d84s2氧化态(+Ⅱ)+Ⅲ+Ⅱ+Ⅲ+Ⅳ+Ⅱ+Ⅲ+Ⅳ+Ⅴ+Ⅱ+Ⅲ+Ⅵ+Ⅱ+Ⅲ+Ⅳ+Ⅵ+Ⅶ+Ⅱ+Ⅲ(+Ⅵ)+Ⅱ+Ⅲ+Ⅱ(+Ⅲ)元素Y Zr Nb Mo Tc Ru Rh Pd 价电子层结构4d15s24d25s24d45s14d55s14d55s24d75s14d85s14d105s0氧化态+Ⅲ+Ⅱ+Ⅲ+Ⅳ+Ⅱ+Ⅲ+Ⅳ+Ⅴ+Ⅱ+Ⅲ+Ⅳ+Ⅴ+Ⅵ+Ⅱ+Ⅲ+Ⅳ+Ⅴ+Ⅵ+Ⅶ+Ⅱ+Ⅲ+Ⅳ+Ⅴ+Ⅵ+Ⅶ+Ⅱ+Ⅲ+Ⅳ+Ⅴ+Ⅵ+Ⅱ+Ⅲ+Ⅳ元素La Hf Ta W Re Os Ir Pt 价电子层结构5d16s25d26s25d36s25d46s25d56s25d66s25d76s25d96s1氧化态+Ⅲ+Ⅲ+Ⅳ+Ⅱ+Ⅲ+Ⅳ+Ⅴ+Ⅱ+Ⅲ+Ⅳ+Ⅴ+Ⅵ+Ⅲ+Ⅳ+Ⅴ+Ⅵ+Ⅶ+Ⅱ+Ⅲ+Ⅳ+Ⅴ+Ⅵ+Ⅷ+Ⅱ+Ⅲ+Ⅳ+Ⅴ+Ⅵ+Ⅱ+Ⅲ+Ⅳ+Ⅴ+Ⅵ注:划横线的表示比较常见、稳定的氧化态;带括号的表示不稳定的氧化态。
多电子原子的原子轨道能量变化是比较复杂的,由于在4s和3d、5s和4d、6s和5d轨道之间出现了能级交错现象,能级之间的能量差值较小,所以在许多反应中,过渡元素的d电子可以部分或全部参加成键。
19.2.2 过渡元素的氧化态及其稳定性过渡元素最外层s电子和次外层d电子可参加成键,所以过渡元素常有多种氧化态。
一般可由+Ⅱ依次增加到与族数相同的氧化态(ⅧB族除Ru、Os 外,其它元素尚无+Ⅷ氧化态)◆同一周期从左到右,氧化态首先逐渐升高,随后又逐渐降低。
随3d轨道中电子数的增加,氧化态逐渐升高;当3d轨道中电子数达到5或超过5时,3d轨道逐渐趋向稳定,高氧化态逐渐不稳定(呈现强氧化性),此后氧化态又逐渐降低。
三个过渡系元素的氧化态从左到右的变化趋势是一致的。
不同的只是第二、三过渡系元素的最高氧化态表现稳定,而低氧化态化合物并不常见。
◆同一族中从上至下,高氧化态趋向于比较稳定-----和主族元素不同。
19.2.3 元素的原子半径和离子半径过渡元素与同周期的ⅠA、ⅡA族元素相比较,原子半径较小。
◆各周期中随原子序数的增加,原子半径依次减小,而到铜副族前后,原子半径增大。
◆各族中从上到下原子半径增大,但第五、六周期同族元素的原子半径很接近,铪的原子半径(146 pm)与锆(146 pm)几乎相同。
同周期过渡元素d轨道的电子未充满,d电子的屏蔽效应较小,核电荷依次增加,对外层电子的吸引力增大,所以原子半径依次减小。
到铜副族前后,充满的d轨道使得屏蔽效应增强,原子半径增大。
由于镧系收缩的影响,第五、六周期同族元素的原子半径相近。
离子半径变化规律和原子半径变化相似,即同周期自左向右,氧化态相同的离子半径随核电荷的增加逐渐变小;同族元素的最高氧化态的离子半径从上到下,随电子层数增加而增大;镧系收缩效应同样影响着第五、六周期同族元素的离子半径。
19.2.4 单质的性质1. 物理性质①过渡元素一般具有较小的原子半径,最外层s电子和次外层d电子都可以参与形成金属键,使键的强度增加。
②过渡金属一般呈银白色或灰色(锇呈灰蓝色),有金属光泽。
③除钪和钛属轻金属外,其余都是重金属。
④大多数过渡元素都有较高的熔点和沸点,有较大的的硬度和密度。
如,钨是所有金属中最难熔的,铬是金属中最硬的。
2. 化学性质①过渡元素的金属性比同周期的p区元素强,而弱于同周期的s区元素。
②第一过渡系比第二、三过渡系的元素活泼-----核电荷和原子半径两个因素。
同一族中自上而下原子半径增加不大,核电荷却增加较多,对外层电子的吸引力增强,核电荷起主导作用. 第三过渡系元素与第二过渡系元素相比,原子半径增加很少(镧系收缩的影响),所以其化学性质显得更不活泼。
第一过渡系单质一般都可以从稀酸(盐酸和硫酸)中置换氢,标准电极电势基本上从左向右数值逐渐增大,这和金属性的逐渐减弱一致。
锰的数值有些例外(比铬还低):失去两个4s电子形成稳定的3d5构型。
钪、钇和镧是过渡元素中最活泼的金属,在空气中能迅速被氧化,与水反应则放出氢,也能溶于酸,这是因为它们的次外层d轨道中仅有一个电子,这个电子很容易失去,所以它们的性质较活泼并接近于碱土金属;19.2.5 过渡元素含氧化合物◆同一周期的过渡元素,从左到右最高氧化态氧化物及其水合氧化物的碱性逐渐减弱,酸性增强。
Sc2O3 TiO2 CrO3 Mn2O7碱性氧化物两性酸酐(铬酸酐)强酸酸酐Fe、Co和Ni不能生成稳定的高氧化态的氧化物。
◆同一族中相同氧化态的氧化物及其水合物自上而下,酸性减弱,碱性逐渐增强。
如Ti、Zr、Hf的氢氧化物M(OH)4(或H2MO3)中,Ti(OH)4的碱性较弱,Zr(OH)4和Hf(OH)4的碱性比酸性强。
这种变化规律和过渡元素高氧化态离子半径变化规律一致。
◆同一元素不同氧化态氧化物及其水合物的酸碱性,在高氧化态时酸性较强,随着氧化态的降低而酸性减弱(或碱性增强),一般是低氧化态氧化物及其水合物呈碱性。
例如,不同氧化态锰的氧化物的酸碱性变化情况表 19-7 锰的氧化物的酸碱性锰的氧化态+Ⅱ+Ⅲ+Ⅳ+Ⅵ+Ⅶ氧化物MnO Mn2O3MnO2MnO3Mn2O7酸碱性碱性弱碱性两性酸性酸性19.2.6 过渡金属及化合物的磁性物质在外加磁场的影响下,表现出三种情况:① 物质本身就有磁性,并随外磁场的加强而增强,它的磁化方向与外加磁场方向一致,这种物质称为顺磁性物质;② 物质本身没有磁性,在外磁场的影响下,会诱导出磁性来,但物质的磁化方向与外磁场的方向相反,当外磁场移走时,磁性也就消失了,这种物质称为反磁性物质;③ 物质被磁化的性质表现得很强烈,随外磁场的加强而急剧提高,并且在外磁场移走后,仍有残留磁性,这种物质称为铁磁质。
物质的磁性和组成物质的原子(或分子)中的电子运动有关 ◆ 单电子的旋转运动所产生的磁矩而使整个物质具有了顺磁性。
◆ 铁磁质是顺磁质的一种极端形式,它是由许多顺磁原子通过集体有规则的配合而产生的。
在通常情况下,顺磁性原子的排列是混乱的,它们的磁效应彼此互相抵消。
当把一种铁磁质放在磁场中时,各顺磁性原子依磁场而取向,使上百万个原子磁体顺排起来,所以铁磁质和磁场间的相互作用要比顺磁性物质大得多。
◆ 过渡元素的单质及其化合物中常含有未成对的d 电子,因而许多过渡金属及其化合物具有顺磁性,且Fe 、Co 、Ni 三种金属有铁磁性。
检测过渡元素的单质或化合物的磁性,了解成键情况,进而判断过渡元素图19-2 在铁磁性物质中磁化的情况未磁化磁 化成键理论的正确性。
19.2.7 过渡金属离子及化合物的颜色过渡元素的大多数离子在水溶液中显示一定的颜色。
过渡元素的水合离子之所以具有颜色,与离子d轨道具有未充满的电子有关。
这些d电子能吸收可见光中某些波长的光,激发到较高的能级,而透过另一些波长的光,这就使它们有一定的颜色。
而Sc3+、Ti4+、Zn2+的d轨道没有电子或具有全充满的电子结构,因此其水合离子是无色的;其它具有未充满电子的离子则呈现出颜色。
表19-8 过渡元素低氧化态水合离子的颜色水合离子Ti3+V2+V3+Cr3+Mn2+Fe2+Fe3+Co2+Ni2+颜色紫红紫绿蓝紫肉色浅绿淡紫粉红绿19.2.8 过渡元素的配位化合物过渡元素的原子或离子具有(n-1)d,n s和n p共9个价电子轨道。
对过渡金属原子和离子而言,其中n s和n p轨道是空的,(n-1)d轨道为部分空或者全空。
这种电子构型为接受配位体孤电子对形成配位键创造了条件。
因此它们的原子和离子都有很强的形成配合物的倾向。
过渡元素一般都容易形成氟配合物、氨配合物、氰配合物、羰基配合物、草酸配合物等。
过渡元素的性质与其它元素不同,和它们具有未充满的d电子有关,这是过渡元素的特点之一。
19.5 铬副族19.5.1概述1. 存在和发现铬(Chromium)、钼(Molybdenum)、钨(Tungsten)同属VIB族元素,它们在地壳中的丰度(质量分数)分别是:铬0.0083%,钼1.1×10-4%,钨1.3×10-4%。
铬铁矿是铬在自然界的主要矿物(FeCr 2O 4)。
钼常以硫化物存在,如MoS 2(辉钼矿)。
我国的钼矿和钨矿储量都很丰富,重要的钨矿有:黑色的钨锰矿(Fe, Mn )WO 4,又称黑钨矿;黄灰色的钨酸钙矿CaWO 4,又称白钨矿。
铬是1797年法国化学家沃克兰(Vauquelin L N )在分析铬铅矿时首先发现的,因为它的化合物都有美丽的颜色而得名。
由于辉钼矿和石墨在外表上相似,是一种黑色柔软的矿物,因而在很长时间内被认为是同一物质。
直到1778年瑞典化学家舍勒(Scheele K W )用硝酸分解辉钼矿时发现有白色的三氧化钼生成,这种错误才得到纠正。
舍勒于1781年又发现了钨。
2. 单质的性质和用途铬和钼的价电子层结构为(n -1)d 5n s 1,钨为5d 46s 2,均可提供6个价电子形成较强的金属键,它们的最高氧化态为+Ⅵ,都具有d 区元素多种氧化态的特征。
