物理化学—动力学练习题及参考答案2
物理化学 表面张力 动力学习题附答案2

物化第8-10试卷一、选择题1. 物质表面张力的值与:( C )A.温度无关B.压力无关C.表面大小无关D.另一相物质无关2.在液面上,某一小面积S周围表面对S有表面张力,下列叙述不正确的是( A )A.表面张力与液面垂直;B.表面张力与S的周边垂直;C.表面张力沿周边与表面相切;D.表面张力的合力在凸液面指向液体内部(曲面球心),在凹液面指向液体外部。
3. 表面活性物质的实质性作用是:( B )A,乳化作用;B,降低表面张力;C,加溶作用;D,降低物质的溶解性4.某温度压力下,有大小相同的水滴、水泡和气泡,其气相部分组成相同,见图。
它们三者表面自由能大小为:(C)A.G a = G c < G b;B.G a = G b > G c ;C.G a < G b < G c ;D.G a = G b = G c 。
5.对于有略过量的KI存在的AgI溶胶,下列电解质中聚沉能力最强的是( D )A . NaCl B. K3[Fe(CN)6]C. MgSO4D. FeCl36.关于胶体和溶液的叙述中正确的是( C )A. 胶体带电荷,而溶液呈电中性B. 胶体加入电解质可产生沉淀,而溶液不能C. 胶体是一种介稳性的分散系,而溶液是一种稳定的分散系D. 胶体能够发生丁达尔效应,而溶液中不存在布朗运动7.某化学反应的计量方程为A 2B C D k +−−→+,实验测定得到其速率系数为3110.25(mol dm )s k ---=⋅⋅,则该反应的级数为 ( C )(A )零级反应 (B )一级反应(C )二级反应 (D )三级反应8.有一个平行反应,①1a,1,A B E k −−−→;②2a,2,A D Ek −−−→。
已知反应①的活化能大于反应②的活化能,即a,1a,2E E >,以下措施中哪一种不能改变获得产物B 和D的比例? ( B )(A) 提高反应温度(B) 延长反应时间 (C) 加入适当催化剂(D) 降低反应温度9. 下列说法错误的是( D )A. 一步完成的反应是基元反应。
物化练习题 第8章动力学练习题doc.

第十一章动力学练习题一、是非题(对的画√错的画×)1、反应速率系数k A 与反应物A 的浓度有关。
( )2、反应级数不可能为负值。
( )3、一级反应肯定是单分子反应。
( )4、对二级反应来说,反应物转化为同一百分数时,若反应物的初始浓度越低,则所需时间越短。
( )5、对同一反应,活化能一定,则反应的起始温度愈低,反应的速率系数对温度的变化愈敏感。
( )6、阿伦尼乌斯活化能的定义是dTkd RT Ea ln 2=。
( ) 7、对于元反应,反应速率系数部随温度的升高而增大。
( ) 8、若反应A →Y ,对A 为零级,则A 的半衰期 AA k C t 20,21=.。
( )9、设对行反应正方向是放热的,并假定正逆都是元反应,则升高温度更利于增大正反应的速率系数。
( )10、连串反应的速率由其中最慢的一步决定,因此速率控制步骤的级数就是总反应的级数。
( )11、催化剂只能加快反应速率,而不有改变化学反应的标准平衡常数。
( ) 12、质量作用定律只适用于元反应。
( )13、某反应,若其反应速率方程式为υA =κA c A 2c B ,则当c B,0>>c A,0时,反应速率方程可约化为假二级反应。
( )14、若反应 A+B −→−Y +Z 的速率方程为 υ= kc A c B , 则该反应是二级反应,且肯定是双分子反应。
( )15、对于反应 2NO + Cl 2 −→− 2NOCl ,只有其速率方程为:υ=k {c (NO)}2c (Cl 2),该反应才有可能为元反应。
其他的任何形式,都表明该反应不是元反应。
( )16、 知道了反应物和产物可写出化学反应方程式, 但不能由配平的化学反应式直接写出反应级数和反应分子数。
( )17、阿仑尼乌斯活化能是反应物中活化分子的平均摩尔能量与反应物分子的平均摩尔能量之差。
( )18、当某反应对物质A 的反应级数为负值时,该反应的速率随物质A 的浓度升高而减少。
【免费下载】 物理化学—动力学练习题及参考答案2

动力学2A 一、选择题1. 水溶液反应 Hg + Tl 3+ ─→ 2Hg 2+ + Tl + 的速率方程为r = k [Hg ][Tl 3+]22+22+/[Hg 2+]。
以下关于反应总级数 n 的意见哪个对? ( )(A) n = 1 (B) n = 2 (C) n = 3 (D) 无 n 可言2. 根据常识, 试确定238U 的半衰期近似为:(a 表示年) ( )(A) 0.3×10-6 s (B) 2.5 min (C) 5580 a (D) 4.5×109 a3. 某反应物反应掉 7/8 所需的时间恰好是它反应掉 1/2 所需时间的 3 倍,则该反应的级数是: ( )(A) 零级 (B) 一级反应 (C) 二级反应 (D) 三级反应4. 1-1 级对峙反应由纯 A 开始反应,当进行到 A 和 B 浓度相等的时间为: (正、逆向反应速率常数分别为 k 1 ,k 2) ( ) (A) t = ln(B) t = 12k k 11221ln kk k k - (C) t =(D) 1121212ln k k k k k +-112121lnk t k k k k =+-5. 一级反应完成 99.9% 所需时间是完成 50% 所需时间的: ( )(A) 2 倍 (B) 5 倍 (C) 10 倍 (D) 20 倍 6. 一个反应的活化能是33 kJ·mol -1, 当 T = 300 K 时,温度每增加 1K ,反应速率常数增加的百分数约是: ( )(A) 4.5% (B) 90% (C) 11% (D) 50% 7. 均相反应 A + BC +D , A + BE +F 在反应过程中具有∆[C]/∆[E] = k 1/k 2的关系, ∆[C],∆[E] 为反应前后的浓差,k 1,k 2是反应 (1),(2)的速率常数。
下述哪个是其充要条件? ( )(A) (1),(2) 都符合质量作用定律 (B) 反应前 C ,E 浓度为零 (C) (1),(2) 的反应物同是 A ,B (D) (1),(2) 反应总级数相等8. 气相反应 A + 2B ─→ 2C ,A 和 B 的初始压力分别为 p A 和 p B ,反应开始时并无 C ,若 p 为体系的总压力,当时间为 t 时,A 的分压为: ( )(A) p A - p B (B) p - 2p A (C) p - p B (D) 2(p - p A ) - p B 9. 某二级反应,反应物消耗 1/3 需时间 10 min ,若再消耗 1/3 还需时间为: ( )(A) 10 min (B) 20 min (C) 30 min (D) 40 min 10. 某具有简单级数反应的速率常数的单位是 mol·dm -3·s -1,该化学反应的级数A B为: ( )(A) 2 级 (B) 1 级 (C) 0 级 (D) 3 级 11. 反应速率的简单碰撞理论中引入了概率因子P ,可表示为反应截面与碰撞截面之比(σ r /σ AB ),于是 ( )(A) P >1 (B) P <1(C) P =1 (D) 不一定二、填空题12. 某反应物的转化率分别达到 50%,75%,87.5% 所需时间分别为 t ,2t ,3t1212,则反应对此物质的级数为 _______ 。
物理化学答案——第九章-化学动力学基础
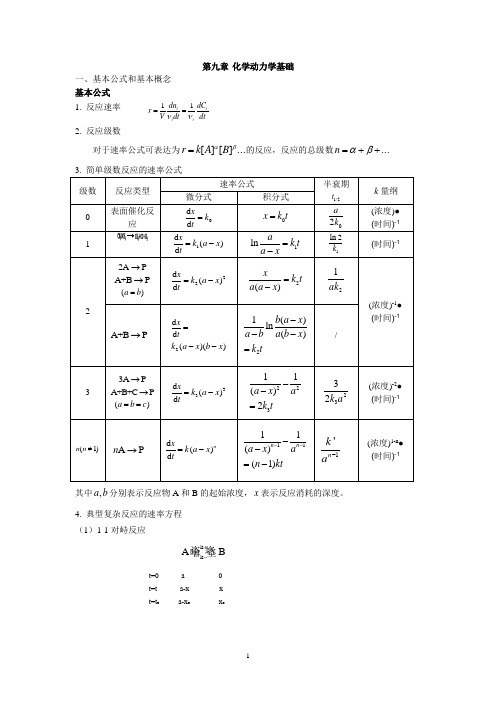
第九章 化学动力学基础一、基本公式和基本概念 基本公式 1. 反应速率 11i ii i dn dC r V dtdtνν==2. 反应级数对于速率公式可表达为...][][βαB A k r =的反应,反应的总级数...++=βαn 3. 简单级数反应的速率公式 级数 反应类型 速率公式半衰期 1/2tk 量纲微分式积分式0 表面催化反应0d d x k t =0x k t = 02a k (浓度)● (时间)-1 11d ()d x k a x t=-1lna k t a x=-1ln 2k(时间)-122A P→A +B P →()a b =22d ()d x k a x t=-2()x k t a a x =-21ak(浓度)-1●(时间)-1A +B P →2d d ()()xtk a x b x =--21()ln()b a x a b a b x k t---=/33A P→A +B +C P→()a b c ==33d ()d x k a x t=-22311()2a x a k t --=2332k a(浓度)-2● (时间)-1(1)n n ≠A P n →d ()d nx k a x t=-1111()(1)n n a x an kt----=-1'n k a-(浓度)1-n ● (时间)-1其中,a b 分别表示反应物A 和B 的起始浓度,x 表示反应消耗的深度。
4. 典型复杂反应的速率方程 (1)1-1对峙反应k k A B +-t=0 a 0 t=t a-x x t=t e a-x e x e速率方程: ()kk te e x x x e +--+-=(2)平行反应最简单的平行反应是由两个一级基元反应组成的平行反应:x=x 1+x 2速率方程:tk k aex a )(21+-=-产物B 和C 的浓度比由竞争反应的速率决定:2121k k x x = (3)连续反应最简单的连续反应是两个单向连续的一级反应:C B A kk −→−−→−21t=0 a 0 0 t=t x y z 速率方程:1k tx ae-=)(21121tk tk eek k a k y ----=]1[21121122tk tk ek k k ek k k a z ---+--=中间产物B 的浓度在反应过程中出现极大值:122)(21k k k m k k a y -=,出现极大值的时间为:2121)ln(k k k k tm-=5. 温度对反应速率的影响 (1)阿累尼乌斯经验公式2ln RTE dTk d a =阿累尼乌斯公式的指数函数式: RTE a Aek -=k 1k 2A a-xCx 2 B x 1(2)阿累尼乌斯活化能基元反应的活化能是活化分子的平均能量与所有分子平均能量之差。
物理化学-动力学练习题及参考答案

动力学1A一、选择题1. 连串反应A k1B k2 C 其中k1= 0.1 min-1,k2= 0.2 min-1,假定反应开始时只有A,且浓度为1 mol·dm-3,则B 浓度达最大的时间为:( )(A) 0.3 min (B) 5.0 min(C) 6.93 min (D) ∞2. 平行反应A k1 B (1);A k2 D (2),其反应(1)和(2)的指前因子相同而活化能不同,E1为120 kJ·mol-1,E2为80 kJ·mol-1,则当在1000K 进行时,两个反应速率常数的比是:( )(A) k1/k2= 8.138×10-3(B) k1/k2= 1.228×102(C) k1/k2= 1.55×10-5(D) k1/k2= 6.47×1043. 如果臭氧(O3) 分解反应2O3→3O2的反应机理是:O3→O + O2(1)O + O3→2O2(2)请你指出这个反应对O3而言可能是:( )(A) 0 级反应(B) 1 级反应(C) 2 级反应(D) 1.5 级反应4. 化学反应速率常数的Arrhenius 关系式能成立的范围是:( )(A) 对任何反应在任何温度范围内(B) 对某些反应在任何温度范围内(C) 对任何反应在一定温度范围内(D) 对某些反应在一定温度范围内5. 如果反应2A + B =2D 的速率可表示为:r = -12d c A /d t = - d c B /d t = 12d c D /d t 则其反应分子数为: ( )(A) 单分子 (B) 双分子(C) 三分子 (D) 不能确定6. 实验测得反应 3H 2+ N 2→ 2NH 3 的数据如下:由此可推知该反应的速率方程 d p (NH 3)/2d t 等于: ( )(A) kp H 23 p N 2(B) kp H 22p N 2 (C) kp H 2 p N 2 (D) kp H 2 p N 227. 在反应 A k 1B k 2C ,A k 3 D 中,活化能 E 1> E 2> E 3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择: ( )(A) 较高反应温度(B) 较低反应温度 (C) 适中反应温度(D) 任意反应温度 8. [X]0 [Y]0 [Z] 增加 0.0050 mol ·dm -3 所需的时间/ s0.10 mol ·dm -3 0.10 mol ·dm -3 720.20 mol ·dm -3 0.10 mol ·dm -3 180.20 mol·dm-30.05 mol·dm-336对于反应X + 2Y →3Z,[Z] 增加的初始速率为:( )(A) 对X 和Y 均为一级(B) 对X 一级,对Y 零级(C) 对X 二级,对Y 为一级(D) 对X 四级,对Y 为二级9. 一级反应,反应物反应掉1/n所需要的时间是:( )(A) -0.6932/k(B) (2.303/k) lg[n/(n-1)](C) (2.303/k) lg n(D) (2.303/k) lg(1/n)10. 关于反应速率理论中概率因子P的有关描述,不正确的是:( )(A) P与≠S m有关(B) P体现空间位置对反应速率的影响(C) P与反应物分子间相对碰撞能有关(D) P值大多数<1,但也有>1的二、填空题12. 60Co广泛用于癌症治疗, 其半衰期为5.26 a (年), 则其蜕变速率常数为:_________________, 某医院购得该同位素20 mg, 10 a后剩余______________ mg。
物理化学动力学测试卷

,
得此结论的理由是 基元反应的反应级数等于反应分子数
。
2.对峙反应 A
B,其正反应的速率可表示为: r 正=k1[A]
;逆
反应的速率为: r 逆=k-1[B] ,该对峙反应的净速率可表示为: r= r 正-r 逆
=k1[A]- k-1[B] ;当反应达到平衡时,正、逆反应速率常数之间的关系可表示为
k1[A]- k-1[B] 或 k1/ k-1 = [B]/ [A] =K
1
《动力学部分》题库及题解
一、填空题:
1.何为具有简单级数的反应:反应速率只与浓度有关,且组分级数和反应总级数
为零或正整数 ,某反应 A+B=P 为基元反应,则该反应的反应级数为: 二级 ,
该反应的反应速率与反应物浓度的关系可表示为 r=k[A][B]
,得此关系
的理由是 基元反应遵守质量作用定律 ,该反应的分子数为: 二
反应是……( D)
A.一级反应
B.二级反应
C.零级反应
D.3/2 级反应
∵3/2 级反应的 t = 2/k([A]01/2-[A]1/2/[A]01/2[A]1/2) t1/t 2=2.22≈2
10、若某反应进行完全所需的时间是有限的,且等于 c0/k,则此反应为……(C )
A.一级反应
B.二级反应
是:测 不同温度下的速率常数 k ,作 lnk~1/T 关系图,通过斜率求
得活化能。
4.某气体反应 A+B—→3C 的速率方程为 r ==kCαACβB,为确定α、β值在常温 下进行实验,当初始压力为 PA,0=102Pa,PB,0=105Pa 时,作反应的 lnPA~t(时间) 图为一直线,当初始压力为 PA,0= PB,0=5×102Pa 时,仍作反应的 lnPA~t 图仍为一 直线,则α= 1 ,β= 0 。(lnc~t 成直线关系的是一级反应)
物理化学-化学动力学答案

第十一章化学动力学1.反应为一级气相反应,320 ºC时。
问在320 ºC加热90 min的分解分数为若干?解:根据一级反应速率方程的积分式答:的分解分数为11.2%2.某一级反应的半衰期为10 min。
求1h后剩余A的分数。
解:同上题,答:还剩余A 1.56%。
3.某一级反应,反应进行10 min后,反应物反应掉30%。
问反应掉50%需多少时间?解:根据一级反应速率方程的积分式答:反应掉50%需时19.4 min。
4. 25 ºC时,酸催化蔗糖转化反应的动力学数据如下(蔗糖的初始浓度c0为1.0023 mol·dm-3,时刻t的浓度为c)使用作图法证明此反应为一级反应。
求算速率常数及半衰期;问蔗糖转化95%需时若干?解:数据标为利用Powell-plot method判断该反应为一级反应,拟合公式蔗糖转化95%需时5. N -氯代乙酰苯胺异构化为乙酰对氯苯胺为一级反应。
反应进程由加KI溶液,并用标准硫代硫酸钠溶液滴定游离碘来测定。
KI只与A反应。
数据如下:计算速率常数,以表示之。
解:反应方程如下根据反应式,N -氯代乙酰苯胺的物质的量应为所消耗硫代硫酸钠的物质的量的二分之一,作图。
6.对于一级反应,使证明转化率达到87.5%所需时间为转化率达到50%所需时间的3倍。
对于二级反应又应为多少?解:转化率定义为,对于一级反应,对于二级反应,7.偶氮甲烷分解反应为一级反应。
287 ºC时,一密闭容器中初始压力为21.332 kPa,1000 s后总压为22.732 kPa,求。
解:设在t时刻的分压为p,1000 s后,对密闭容器中的气相反应,可以用分压表示组成:8.硝基乙酸在酸性溶液中的分解反应(g)的体积如为一级反应。
25 ºC,101.3 kPa下,于不同时间测定放出的CO2下反应不是从开始的。
求速率常数。
(g)可看作理想气体,硝基乙酸的初始量由时放出的解:设放出的CO2(g)算出:CO2在时刻t, 硝基乙酸的量为,列表作图,由于反应不是从开始,用公式拟合得到。
大学物理化学7-动力学课后习题及答案精品资料

动力学课后习题习题 1某溶液中反应 A + B Y 开始时 A 与 B 的物质的量相等,没有 Y ,1h 后 A 的转化率为75%,问2h 后 A 尚有多少未反应?假设:(1)对 A 为一级,对 B 为零级;(2)对 A ,B 皆为一级;(3)对 A ,B 皆为零级。
习题 2某反应 A → Y + Z ,在一定温度下进行,当-3-1的初始速率υA,0 =0.01mOl·dm·s。
试计算反应物-3及 x A =0.75 时,所需时间,若对反应物 At= 0,c A,0 =1mOl ·dm-3时,测定反应A 的物质的量浓度 c A= 0.50mOl ·dm (i) 0 级; (ii) 1 级; (iii) 2 级;习题 3已知气相反应 2A + B2Y 的速率方程为dp Akp A p B。
将气体 A 和 B 按物质的量dt比 2:1 引入一抽空的反应器中,反应温度保持400 K 。
反应经 10min 后测得系统压力为84 kPa,经很长时间反应完了后系统压力为63 kPa。
试求:(1)气体 A 的初始压力 p A,0及反应经 10 min 后 A 的分压力 p A;(2)反应速率系数 k A;(3)气体 A 的半衰期。
习题 4反应 2A(g)+B(g)Y(g)的动力学方程为-dcB= k B c1A.5 c B0. 5。
今将 A 与 B 的摩尔比为dt2∶ 1 的混合气体通入400 K 定容容器中,起始总压力为 3.04 kPa,50s 后,总压力变为 2.03 kPa,试求反应的反应速率系数k B及 k A。
习题 5已知反应 2HI → I2 + H 2,在 508℃下,HI 的初始压力为 10132.5 Pa 时,半衰期为 135 min ;而当 HI 的初始压力为 101 325 Pa 时,半衰期为 13.5 min 。
试证明该反应为二级,并求出反应速率系数 (以 dm3·mol -1· s-1及以P a-1· s-1表示 )。
物理化学练习(动力学2,2006)含答案

动力学(二)练习 化学、高分子2006级 2008。
11。
14一、选择题1. 对于离子间扩散控制反应,碰撞理论建立的公式为k d =4π(D A +D B )(r A +r B )P ,则其P 值应: ( )(A)一定小于1 (B)一定大于1(C)不一定 (D)与离子价正负无关,只与价的绝对值有关2. 对于摩尔熵用统计方法计算了各种运动的典型值,m ()S 平$=150 J ·K -1·mol -1,转动及振动每个自由度的值为m ()S 转$=30 J ·K -1·mol -1,m ()S 振$=1 J ·K -1·mol -1,对于反应A+BC 生成线性过渡态时其m S ≠∆$/J ·K -1·mol -1的数值应为 ( )(A) –147 J ·K -1·mol -1 (B) –148 J ·K -1·mol -1(C) –119 J ·K -1·mol -1 (D) 148 J ·K -1·mol -13. 设某基元反应在500 K 时实验活化能为83.14 kJ ·mol -1,则此反应的临界能为:( ) (A) 81.06 kJ ·mol -1 (B) 2.145 kJ ·mol -1 (C) 162.1 kJ ·mol -1 (D) 4.291 kJ ·mol -14. 已知 E Cl-Cl = 243 kJ/mol ,E H 2= 436 kJ ·mol -1,用光照引发下面反应: H 2+ Cl 2 → 2HCl所用光的波长约为: ( ) (A) 4.92×10-4 m (B) 4.92×10-7 m (C) 2.74×10-7 m (D) 1.76×10-7 m5. 对于气相基元反应,按过渡态理论,不正确的关系式是: ( ) (A)E a =∆≠U m $+RT (B)E a =∆≠H m $+nRT(C)E a =E 0+ RT (D)E a =E 0+mRT6. 下面四种说法中不正确的是: ( )(A) 在具有速控步的反应历程中,达到稳态后,速控步后的各个步骤的反应速 率都等于速控步的反应速率,速控步前的各步骤均处于平衡状态(B) 根据微观可逆性原理,在反应历程中不可能出现 2A → C + 3D 这样的基 元反应(C) 在光化学反应中,体系的Gibbs 自由能总是在不断地降低(D) 在采用温度跃变的驰豫法来研究溶液中的快速反应时,该反应必须是放热或吸热反应7. 实验活化能E a,临界能E c,势垒E b,零度活化能E0概念不同,数值也不完全相等,但在一定条件下,四者近似相等,其条件是:( )(A) E0很小(B) E b很小(C) 温度很低(D) 基态振动频率大8. 溶液中扩散控制反应速率常数的数量级以mol-1·dm3·s-1计约为:()(A)1013(B)105(C)1010(D)1089. 某双分子反应的速率常数为k,根据阿仑尼乌斯公式k=A exp(-E a/RT),若指前因子的实验值很小。
物理化学考试题库及答案(二)

物理化学考试题库及答案第五章相平衡练习题一、判断题:1.1.在一个给定的系统中,物种数可以因分析问题的角度的不同而不同,但独立组分数是一个确定的数。
2.单组分系统的物种数一定等于1。
3.自由度就是可以独立变化的变量。
4.相图中的点都是代表系统状态的点。
5.恒定压力下,根据相律得出某一系统的f = l,则该系统的温度就有一个唯一确定的值。
6.单组分系统的相图中两相平衡线都可以用克拉贝龙方程定量描述。
7.根据二元液系的p~x图可以准确地判断该系统的液相是否是理想液体混合物。
8.在相图中总可以利用杠杆规则计算两相平畅时两相的相对的量。
9.杠杆规则只适用于T~x图的两相平衡区。
10.对于二元互溶液系,通过精馏方法总可以得到两个纯组分。
11.二元液系中,若A组分对拉乌尔定律产生正偏差,那么B组分必定对拉乌尔定律产生负偏差。
12.恒沸物的组成不变。
13.若A、B两液体完全不互溶,那么当有B存在时,A的蒸气压与系统中A 的摩尔分数成正比。
14.在简单低共熔物的相图中,三相线上的任何一个系统点的液相组成都相同。
15.三组分系统最多同时存在5个相。
二、单选题:O、K+、Na+、Cl- 、I- 体系的组分数是:1.H2(A) K = 3 ;(B) K = 5 ;(C) K = 4 ; (D) K = 2 。
2.2.克劳修斯-克拉伯龙方程导出中,忽略了液态体积。
此方程使用时,对体系所处的温度要求:(A) 大于临界温度;(B) 在三相点与沸点之间;(C) 在三相点与临界温度之间;(D) 小于沸点温度。
3.单组分固-液两相平衡的p~T曲线如图所示,则:(A) V m(l) = V m(s) ;(B) V m(l)>V m(s) ;(C) V m(l)<V m(s) ;(D) 无法确定。
4.蒸汽冷凝为液体时所放出的潜热,可用来:(A)(A)可使体系对环境做有用功;(B)(B)可使环境对体系做有用功;(C)(C)不能做有用功;(D) 不能判定。
新版物理化学—动力学练习题及参考答案2-新版-精选.pdf

(A) 0.3 ×10-6 s
(B) 2.5 min
(C) 5580 a
(D) 4.5 ×109 a
3. 某反应物反应掉 7/8 所需的时间恰好是它反应掉 1/2 所需时间的 3 倍,则该
反应的级数是:
()
(A) 零级
(B)
一级反应
(C) 二级反应
(D)
三级反应
4. 1-1
级对峙反应 A
k1 k2
B 由纯 A 开始反应,当进行到
_______________ s。 19. N 2O5 热分解反应速率常数在 288 K 时,为 9.67 × 10-6 s-1 , Ea=100.7 kJ· mol-1,
338 K 时,速率常数为 ____________________。 20. 实验测得反应: 2A + B ─→ 2C + D 的速率方程为: r = k [A][B] ,反应
(A) 2
倍
(B) 5
倍
(C) 10
倍
(D) 20
倍
6. 一个反应的活化能是 33 kJ ·mol-1 , 当 T = 300 K 时,温度每增加
率常数增加的百分数约是:
()
(A) 4.5%
(B) 90%
(C) 11%
(D) 50%
1K ,反应速
7. 均相反应 A + B
k1 C + D , A + B
乘以因子 ___________。
14. 2H 2O2(aq)
2H2O(l) + O2(g) 被 I - 催化,已知 Ea(cat) = 56.5 kJ · mol-1 ,
Ea(uncat)=75.3 kJ ·mol-1 , 则 k(I - ) / k(uncat) =_____________。( T=298 K)
苏州大学物理化学考研、期末考试复习-第十二章化学动力学基础二练习题及答案

第十二章化学动力学基础二练习题一、选择题1. 化学反应发生的条件是:()(A) (Δr G m)T, p<0 (B) (Δr G m)T, p>0(C) (Δr G m)T, p=0 (D) (Δr G m)T, p≠03. 单原子分子A,B间发生反应,若忽略振动基态能量之差,则实验活化能E a,临界能E c,势垒E b间存在关系为:( )(A) E a=E c+12RT=E b+12RT(B) E a=E b+12RT=E c+RT(C) E a=E c-12RT=E b-12RT(D) E a=E b+RT=E c+RT4. 在T = 300 K,如果分子A和B要经过每一千万次碰撞才能发生一次反应,这个反应的临界能将是:( )(A) 170 kJ·mol-1(B) 10.5 kJ·mol-1(C) 40.2 kJ·mol-1(D) -15.7 kJ·mol-15. 选用适当的催化剂后,使反应活化能比未加催化剂时降低了8500J·mol-1,则二者速率常数比(k cat/k0) ( )(A) 31倍 (B) 61倍(C) 92倍 (D) 4.5倍6. 下列双分子反应中:(1) Br + Br → Br2(2) CH3CH2OH + CH3COOH → CH3CH2COOCH3+ H2O(3) CH4+ Br2→ CH3Br + HBr碰撞理论中方位因子P的相对大小是∶( )(A) P(1) > P(2) > P(3)(B) P(1) > P(3) > P(2)(C) P(1) < P(2) < P(3)(D) P(1) < P(3) < P(2)7. 破坏臭氧的反应机理为:NO + O3 NO→2+ O2NO2+ O NO + O→2在此机理中,NO 是:( )(A) 总反应的产物(B) 总反应的反应物(C) 催化剂(D) 上述都不是8. 对于水溶液中的反应[ Co(NH 3)5Br]2+ + OH - [Co(NH →3)5OH]2+ + Br -如果增加离子强度,此反应的速率将: ( ) (A) 不变 (B) 降低(C) 达到爆炸极限 (D) 增大9. 根据活化络合物理论,液相分子重排反应之活化能E a 和活化焓Δ≠H m 之间的关系是:( )(A) E a = Δ≠H m(B) E a = Δ≠H m - RT(C) E a = Δ≠H m + RT(D) E a = Δ≠H m / RT二、填空题11. 化学反应的简单碰撞理论中能发生化学反应的判据有两个,即__________________________________ _______________________________,____________________________________________。
物理化学动力学2的分章习题

物理化学动力学2的分章习题一、选择题1绝对反应速率理论的假设不包括()d(a)反应物分子在相撞时相互作用的势能就是分子间相对边线的函数(b)反应物分子与活化络合物分子之间存有着化学平衡(c)活化络合物的水解就是快速步骤(d)反应物分子的相对碰撞动能达到或超过某个值时才发生反应2按照绝对反应速度理论,实际的反应过程非常复杂,牵涉的问题很多,与其有关的以下观点中恰当的就是()c(a)反应分子组实际经历的途径中每个状态的能量都是最低的(b)势能二垒就是活化络合物分子在马鞍点的能量与反应物分子的平均值能量之差(c)反应分子组抵达马鞍点之后也可能将回到始态(d)活化络合物分子在马鞍点的能量最低3光化反应与黑暗反应的相同之处在于()a(a)反应都需要活化能(b)温度系数小(c)反应都向δg(恒温恒压,w'=0时)增大的方向展开(d)平衡常数需用通常的热力学函数排序4化学反应的过渡状态理论的要点是()b(a)反应物通过简单碰撞就变成产物。
(b)反应物首先必须构成活化络合物,反应速度依赖于活化络合物水解为产物的水解速度。
(c)在气体分子运动论的基础上提出来的。
(d)引入方位因子的概念,并认为它与熵变化有关5以下哪种观点不恰当()d(a)催化剂不发生改变反应热(b)催化剂不发生改变化学平衡(c)催化剂具备选择性(d)催化剂不参予化学反应6按照光化当量定律()c(a)在整个光化过程中,1个光子只能活化1个原子或分子(b)在光化反应的初级过程,1个光子活化1mol原子或分子(c)在光化反应初级过程,1个光子活化1个原子或分子(d)在光化反应初级过程,1个爱因斯坦的能量活化1个原子或分子7温度对光化反应速度的影响()d(a)与热反应大致相同(b)与热反应大不相同,温度升高,光化反应速度上升(c)与热反应大不相同,温度升高,光化反应速度维持不变(d)与热反应大不相同,温度的变化对光化反应速度的影响较小8两个h与m粒子同时磁圈,出现以下反应:h+h+m=h2(g)+m,此反应的活化能ea就是()a.大于零b.小于零c.等于零d.不能确定9化学反应的过渡状态理论认为()a.反应速率决定于活化络合物的生成速率b.反应速率决定于络合物分解为产物的分解速率c.用热力学方法可以记算出速率常数d.活化络合物和产物间可建立平衡10气体反应相撞理论的要点就是()a.全体分子可看作是刚球,一经碰撞便起反应b.在一定方向上发生了碰撞,才能引起反应c.分子迎面碰撞,便能引起反应d.一对反应分子具备足够多能量的相撞,就可以引发反应11在碰撞理论中,有效碰撞分数q为()a.q=exp(-ea/rt)b.q=exp(-ec/rt)c.q=exp(-εc/rt)d.q=pexp(-ea/rt)12按相撞理论,气相双分子反应的温度增高能够并使反应速率减少的主要原因就是()a.碰撞频率减小b.活化分子数减少c.碰撞数增加d.活化能降低13如有一反应活化能就是100kjmol-1,当反应温度由313k跌至353k,此反应速率常数约是原来的()a.77.8倍b.4.5倍c.2倍d.22617倍14根据过渡态理论,液相双分子反应之实验活化能与活化焓之间的关系为()b(a)(b)(c)(d)15设单原子气体a和b出现化合反应,即a(g)+b(g)=c(g),设立一维对应状态配分函数ft=108,一维旋转配分函数fr=10,按过渡态理论,在温度t时,反应的概率因子为()a(a)10-22(b)10-21(c)10-23(d)10-1316某一反应在一定条件下的均衡转化率为25%,当重新加入最合适的催化剂后,反应速率提升10倍,其均衡转化率将()c(a)大于25%(b)小于25%(c)不变(d)不确定17设某种基元反应在500k时的实验活化能为83.14kjmol-1,则此反应的阈能ec为()d(a)2.145kjmol-1(b)162.1kjmol-1(c)83.14kjmol-1(d)81.06kjmol-118有一叶唇柱溶液反应,根据原盐效应,当溶液总的离子强度增加时,反应速率常数值k将()c(a)变大(b)变小(c)不变(d)无确定关系19已知hi是光分解反应机理是则该反应的反应物消耗的量子效率为()b(a)1(b)2(c)4(d)10620在简单硬球碰撞理论中,有效碰撞的定义是(c)(a)互撞分子的总动能超过ec(b)互撞分子的相对动能超过ec(c)于品卿分子的相对平动能在连心线上的分量少于ec(d)互撞分子的内部动能超过ec21某双原子分子水解反应的阈能ec=83.68kjmol-1,则在300k时活化分子所占到的分数就是()d(a)3.719×1014(b)6.17×10-15(c)2.69×1011(d)2.69×10-1522.在碰撞理论中校正因子p小于1的主要因素是:()ba.反应体系不为理想的b.空间的电负性效应c.分子碰撞的激烈程度不够d.分子间的作用力23.对于气相基元反应,以下条件:(1)温度减少;(2)活化熵越正数;(3)活化焓越正数;(4)分子有效率相撞直径越大。
工科大学化学(物理化学)化学动力学部分习题及解答

17.实验测得 N2O5 在不同温度下的分解反应速率常数,试作图求 N2O5 分解反应的活化能。(答 案:103.68kJ·mol-1)
T/K 273.15 k/min 4.7×10-5
298.15 2.0×10-3
318.15 3.0×10-2
338.15
解:以 lnk 对 T -1 作图,可得一条直线 (如右图所示),其斜率=12470,
N2O5
NO2+ NO3 ,
NO2+ NO3
NO2 + O2 + NO (慢),
NO2+ NO3
NO + NO3
2NO2
N2O5 ,
(答案:
)
解: 总反应为:2N2O5 ? 4NO2+O2,
∵
,而:
解得:
,
∴
15.某反应的历程为 A ?D , D + C 在低压下是二级反应。
G,试证明该反应在高压下是一级反应,
解:(1)
(2) 根据
可求得:E1 = E-1= 44.36 kJ.mol-1
(3)
A ========= C + D
t = 0 101325
0
0
t = t 101325 -px
px
px
故:p 总= 101325+ px
故 Ea = 12470R =103.68 kJ·mol-1
3.0×10-1
18.乙酸乙酯与氢氧化钠皂化反应的速率常数在 282.55 K 时为 2.37(mol·L-1)-1·s-1;287.55 K 时增 至 6.024(mol·L-1)-1·s-1,求:(1)活化能 Ea 及频率因子 A;(2) 334.55 K 的反应速率常数;(3) 用以
物理化学—动力学练习题及参考答案2

动力学2A 一、选择题1. 水溶液反应 Hg 22+ + Tl 3+ ─→ 2Hg 2+ + Tl + 的速率方程为r = k [Hg 22+][Tl 3+]/[Hg 2+]。
以下关于反应总级数 n 的意见哪个对? ( ) (A) n = 1 (B) n = 2 (C) n = 3 (D) 无 n 可言 2. 根据常识, 试确定238U 的半衰期近似为:(a 表示年) ( )(A) 0.3×10-6 s (B) 2.5 min (C) 5580 a (D) 4.5×109 a3. 某反应物反应掉 7/8 所需的时间恰好是它反应掉 1/2 所需时间的 3 倍,则该反应的级数是: ( )(A) 零级 (B) 一级反应 (C) 二级反应 (D) 三级反应 4. 1-1 级对峙反应由纯 A 开始反应,当进行到 A 和 B 浓度相等的时间为: (正、逆向反应速率常数分别为 k 1 ,k 2) ( ) (A) t = ln12k k (B) t =11221ln kk k k - (C) t =1121212ln k k k k k +- (D) 112121ln k t k k k k =+- 5. 一级反应完成 99.9% 所需时间是完成 50% 所需时间的: ( )(A) 2 倍 (B) 5 倍 (C) 10 倍 (D) 20 倍 6. 一个反应的活化能是33 kJ ·mol -1, 当 T = 300 K 时,温度每增加 1K ,反应速率常数增加的百分数约是: ( )(A) 4.5% (B) 90% (C) 11% (D) 50% 7. 均相反应 A + Bk 1C +D , A + Bk 2E +F 在反应过程中具有∆[C]/∆[E]= k 1/k 2的关系, ∆[C],∆[E] 为反应前后的浓差,k 1,k 2是反应 (1),(2)的速率常数。
下述哪个是其充要条件? ( )(A) (1),(2) 都符合质量作用定律 (B) 反应前 C ,E 浓度为零 (C) (1),(2) 的反应物同是 A ,B (D) (1),(2) 反应总级数相等8. 气相反应 A + 2B ─→ 2C ,A 和 B 的初始压力分别为 p A 和 p B ,反应开始时并无 C ,若 p 为体系的总压力,当时间为 t 时,A 的分压为: ( )(A) p A - p B (B) p - 2p A (C) p - p B (D) 2(p - p A ) - p B 9. 某二级反应,反应物消耗 1/3 需时间 10 min ,若再消耗 1/3 还需时间为: ( )(A) 10 min (B) 20 min (C) 30 min (D) 40 min 10. 某具有简单级数反应的速率常数的单位是 mol ·dm -3·s -1,该化学反应的级数为: ( )A B 2(A) 2 级 (B) 1 级 (C) 0 级 (D) 3 级 11. 反应速率的简单碰撞理论中引入了概率因子P ,可表示为反应截面与碰撞截面之比(σ r /σ AB ),于是 ( )(A) P >1 (B) P <1 (C) P =1 (D) 不一定二、填空题12. 某反应物的转化率分别达到 50%,75%,87.5% 所需时间分别为 t 12,2t 12,3t 12,则反应对此物质的级数为 _______ 。
物理化学 练习题及答案

4.进行反应A + 2D••3G在298K及2dm3容器中进行,若某时刻反应进度随时间变化率为
0.3 mol·s-1,则此时G的生成速率为(单位:
mol-1·dm3·s-1):
(A)
0.15;(B)
0.9;(C)
0.45;(D)
0.2。
5.基元反应体系aA + dD -----gG的速率表达式中,不正确的是:
(A)电导;(B)电导率;(C)摩尔电导率;(D)极限摩尔电导。
3.在一定温度和较小的浓度情况下,增大强电解质溶液的浓度,则溶液的电导率κ与摩尔电导Λm变化为:
(A) κ增大,Λm增大;(B) κ增大,Λm减少;(C) κ减少,Λm增大;(D) κ减少,Λm减少。
4.在一定的温度下,当电解质溶液被冲稀时,其摩尔电导变化为:
23,不做
第九章电解质溶液练习题
一、判断题:
1.溶液是电中性的,正、负离子所带电量相等,所以正、负离子的迁移数也相等。
2.离子迁移数与离子速率成正比,某正离子的运动速率一定时,其迁移数也一定。
3.离子的摩尔电导率与其价态有关系。限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
14.某化合物与水相作用时,其起始浓度为1 mol·dm-3,1小时后为
0.5 mol·dm-3,2小时后为
0.25 mol·dm-3。则此反应级数为:
(A) 0;(B) 1;(C) 2;(D) 3。
15.某反应速率常数k =
2.31 × 10-2mol-1·dm3·s-1,反应起始浓度为
1.0 mol·dm-3,则其反应半衰期为:
物理化学 表面张力 动力学习题附答案

物理化学第8、9、10章习题一、选择题1.下面关于的物理意义中不正确的是( C )A.σ是沿着与表面相切的方向,垂直作用于表面上单位长度线段上的紧缩力。
B.σ是恒温,恒压下可以可逆的增加单元表面积所需的非体积功。
C.σ是在一定的温度,压力下,单位表面积中的分子所具有G i bb s 函数值。
D.σ是恒温,恒压下增加单位表面所引起的系统Gi bb s 函数值。
2、均相反应aA+bB=lL+mM 以A ν及B ν分别表示A 和B 的消耗速率,L ν为产物L 的生成速率,今若A ν/B ν=0.5,B ν/L ν=0.5,则a: b :l = ( D ) A 4:2:1 B 1:1:1 C 1:2:2 D 1:2:43、在三通活塞两端涂上肥皂液,关闭右端,在左端吹一大泡,关闭左端,在右端吹一小泡,然后打开活塞使左右端相通,将会出现什么现象。
( B ) A.大泡变小,小泡变大 B.小泡变小,大泡变大 C.两泡大小保持不变 D.不能确定4、已知某气相反应 ,在25℃时的k 1和k -1分别是0.2S -1和3.938×10-3Pa/s,在35℃时正逆反应的速率常数k 1和k -1均增加为原来的2倍,则25℃时的平衡常数Kc 为( B ),正反应的活化能为( )A 7.896610-⨯Pa 53kJ/mol -1B 5.066410⨯Pa 53kJ/mol -1C 7.896610-⨯Pa -53kJ/mol -1D 5.066410⨯Pa -53kJ/mol -1 5、若一球形液膜的直径为2×10-3m ,比表面自由能为0.7J·m -2,则其所受的附加压力是( C )A 5.6 kPaB 1.4 kPaC 2.8 kPaD 2.8 Pa6、环氧乙烷的分解是一级反应,380℃的半衰期为363 min ,反应的活化能为217.57 kJ·mol -1。
试求该反应在450℃条件下完成75%所需时间为( B ) A 7.5min B 15min C 45 min D 80 min7、已知水的表面张力σ/N·m -1=0.1139-1.4410-⨯T/K ,试中T 为绝对温度,在恒温283K 及恒压θp 下,可逆地使水的表面积增加1210-⨯m 2时所必须做的功为( C ), 过程中系统的△S=( )A 7.428×210-J 1.4410-⨯ J/KB 7.428×210-J 1.4×610-J/KC 7.428×410-J 1.4×610-J/KD 7.428×210-J 1.4410-⨯ J/K8、反应222HI H I →+,在无催化剂存在时,其活化能E a (非催化) = 184.1 kJ·mol -1;在以Au 作催化剂时,反应的活化能E a (催化) = 104.6 kJ·mol -1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
动力学2A 一、选择题1. 水溶液反应 Hg 22+ + Tl 3+ ─→ 2Hg 2+ + Tl + 的速率方程为r = k [Hg 22+][Tl 3+]/[Hg 2+]。
以下关于反应总级数 n 的意见哪个对? ( ) (A) n = 1 (B) n = 2 (C) n = 3 (D) 无 n 可言 2. 根据常识, 试确定238U 的半衰期近似为:(a 表示年) ( )(A) 0.3×10-6 s (B) 2.5 min (C) 5580 a (D) 4.5×109 a3. 某反应物反应掉 7/8 所需的时间恰好是它反应掉 1/2 所需时间的 3 倍,则该反应的级数是: ( )(A) 零级 (B) 一级反应 (C) 二级反应 (D) 三级反应 4. 1-1 级对峙反应由纯 A 开始反应,当进行到 A 和 B 浓度相等的时间为: (正、逆向反应速率常数分别为 k 1 ,k 2) ( ) (A) t = ln12k k (B) t =11221ln kk k k - (C) t =1121212ln k k k k k +- (D) 112121ln k t k k k k =+- 5. 一级反应完成 99.9% 所需时间是完成 50% 所需时间的: ( )(A) 2 倍 (B) 5 倍 (C) 10 倍 (D) 20 倍 6. 一个反应的活化能是33 kJ ·mol -1, 当 T = 300 K 时,温度每增加 1K ,反应速率常数增加的百分数约是: ( )(A) 4.5% (B) 90% (C) 11% (D) 50% 7. 均相反应 A + Bk 1C +D , A + Bk 2E +F 在反应过程中具有∆[C]/∆[E]= k 1/k 2的关系, ∆[C],∆[E] 为反应前后的浓差,k 1,k 2是反应 (1),(2)的速率常数。
下述哪个是其充要条件? ( )(A) (1),(2) 都符合质量作用定律 (B) 反应前 C ,E 浓度为零 (C) (1),(2) 的反应物同是 A ,B (D) (1),(2) 反应总级数相等8. 气相反应 A + 2B ─→ 2C ,A 和 B 的初始压力分别为 p A 和 p B ,反应开始时并无 C ,若 p 为体系的总压力,当时间为 t 时,A 的分压为: ( )(A) p A - p B (B) p - 2p A (C) p - p B (D) 2(p - p A ) - p B 9. 某二级反应,反应物消耗 1/3 需时间 10 min ,若再消耗 1/3 还需时间为: ( )(A) 10 min (B) 20 min (C) 30 min (D) 40 min 10. 某具有简单级数反应的速率常数的单位是 mol ·dm -3·s -1,该化学反应的级数为: ( )A B 2(A) 2 级 (B) 1 级 (C) 0 级 (D) 3 级 11. 反应速率的简单碰撞理论中引入了概率因子P ,可表示为反应截面与碰撞截面之比(σ r /σ AB ),于是 ( )(A) P >1 (B) P <1 (C) P =1 (D) 不一定二、填空题12. 某反应物的转化率分别达到 50%,75%,87.5% 所需时间分别为 t 12,2t 12,3t 12,则反应对此物质的级数为 _______ 。
13. 碰撞理论中,速率常数以m 3·s -1为量纲换算为以mol -1·dm 3·s -1为量纲时,应乘以因子___________。
14. 2H 2O 2(aq) →2H 2O(l)+O 2(g)被I -催化,已知E a (cat)=56.5 kJ ·mol -1, E a (uncat)=75.3 kJ ·mol -1, 则k (I -)/k (uncat)=_____________。
(T =298 K) 15. 双分子反应,当E a ≥100 kJ ·mol -1,298 K 时有效碰撞率为_____________,1000 K 时为_______。
16. 一级反应半衰期与反应物起始浓度关系 。
在一定温度下,某化学反应的平衡转化率为 33.3%,在相同反应条件下,当有催化剂存在时,其反应的平衡转化率 ________ 。
17. 反应 AB + C k 2D (决速步) 其表观活化能与基元反应活化能的关系为 ________________ ,因为 ___________ 。
18. N 2O 5分解反应 2N 2O 5 ──→ 4NO 2+O 2 在T , p 一定时, 测得d[O 2]/d t =(1.5×10-4 s -1)[N 2O 5], 反应单向进行基本能完全, 则该反应的半寿期t 1/2 = _______________ s 。
19. N 2O 5热分解反应速率常数在288 K 时,为9.67×10-6 s -1, E a =100.7 kJ ·mol -1, 338 K 时,速率常数为____________________。
20. 实验测得反应: 2A + B ─→ 2C + D 的速率方程为: r = k [A][B],反应历程为: A + Bk 1C + F (慢) A + Fk 2C +D (快)则 k 1与 k 的关系为 __________ 。
21. 经验规则“温度每增加 10 K, 反应速率增加 2 倍”。
在T 1=298 K 和T 2= 308K 时, 符合这规则的活化能值 E a =___________________。
三、计算题22. 实验测得N 2O 5分解反应在不同温度下速率常数数据如下: T /K 298 308 318 328 338 105k /s -1 1.72 6.65 24.95 75.0 240求 k = A exp(-E a /RT )中A 与E a 的值,并求反应在323K 时∆≠S m 、∆≠H m 、∆≠G m 。
已知:玻耳兹曼常数k B = 1.3806×10-23 J ·K -1 ,普朗克常数 h = 6.6262×10-34 J ·s 。
23. 反应 A(g)+2B(g)─→12C(g)+D(g) 在一密闭容器中进行, 假设速率方程的形式为r =k p p A a p B b , 实验发现:(1)当反应物的起始分压为 p A 0=26.664 kPa , p B 0=A B k1k-1+AB106.66 kPa 时, 反应中 ln p A 随时间变化无关。
(2)当反应物的起始分压分别为p A 0=53.328 kPa, p B 0=106.66 kPa 时, 反应r /2A p 为常数, 并测得 500 K 和 510 K时, 该常数分别为 1.974×10-3 和 3.948×10-3 (kPa ·min)-1, 试确定: (甲) 速率方程中的 a, b 和 500 K 时的速率常数 k (乙) 反应的活化能 24. 有一个涉及一种反应物种 (A) 的二级反应,此反应速率常数可用下式表示k = 4.0×1010 T 1/2 exp {-145 200/RT } dm 3·mol -1·s -1 (1) 在 600 K 时,当反应物 A 初始浓度为 0.1 mol ·dm -3时,此反应之半寿期为多少 ?(2) 试问 300 K 时,此反应之阿氏活化能 E a 为多少? (3) 如果上述反应是通过下列历程进行A B B + A k 2 C C k 3P其中 B 和 C 是活性中间物,P 为终产物。
试得出反应速率方程在什么条件下这个反应能给出二级速率方程。
25. 请根据下列实验数据确定反应级数 α, β, γ和k 值 。
r ×105/(mol ·dm -3·s -1) 5.0 5.0 2.5 14.1 [A]0/mol ·dm -3 0.010 0.010 0.010 0.020 [B]0/mol ·dm -3 0.005 0.005 0.010 0.005 [C]0/mol ·dm -3 0.010 0.015 0.010 0.010 已知 r =k [A]α[B]β[C]γ。
26. 测定某一溶液反应(298 K),得如下数据:t /min 0 18 57 130 240 337 398 吸光度A 1.39 1.26 1.03 0.706 0.398 0.251 0.1800 假设遵从Lamkert-Beer 定律,证明该反应为一级反应。
四、问答题27. 试证明,相同反应级数的平行反应:E a=i iiiik Ek∑∑k 1k -1动力学2—A 答案 一、选择题1. (A)2. (D)3. (B)4. (C)5. (C)6. (A)7. (A)8. (C)9. (C) 10. (C) 11. (D)二、填空题12.一级 13. 103L (L 为阿佛加德罗常数) 14. 1975 k (I -)/k (uncat) =exp{[E (uncat)-E (I -)]/RT }15. 2.96×10-18 5.97×10-6 计算公式为 exp(E c /RT ) 因为 E a >>RT ,所以E c ≈E a16. (1) 与初始浓度无关 (2) 等于 33.3% 17. k (表) = k 2k 1/k -1 E (表) = E 2+ E 1- E -1 18. t 1/2 =0.693/ k =2310 s 19. 4.87×10-3 s -1 20. k 1 = k 21. 52.9 kJ ·mol -1三、计算题22. [答] ln k ∝ 1/T 作图,或用代入法求平均值得到:E a = 103.1 kJ ·mol -1A = 2.03×1013 s -1当 T = 323 K 时,k = A exp(-E a /RT ) = 4.304×10-4 s -1 ∆≠H m = E a - RT = 101 kJ ·mol -11111111ln()k at k k k a k k x--=+-+A =(kB T /h )eexp(∆≠S /R ) ─→ ∆≠S m = 3 J ·K -1·mol -1 ∆≠G m = ∆≠H m - T ∆≠S m = 100 kJ ·mol -123. [答] (甲) 当 p A 0=26.664 kPa , p B 0=106.66 kPa 时, B 是过量的,故 -d p A /d t =A B a b kp p ≈k 'A apd ln p A /d t =-k 'p A a /p A , d ln p A /d t 与p A 无关, 则 a = 12A /r p = 2A A /b B kp p p , p A =p A 0- p , p B =p B 0- 2p 2A /r p =k 2 b (53.328 kPa - p )b / (53.328 kPa - p ) 2A /r p = 常数, 则 b=1500 K 时, 2A /r p = k p A p B / p A 2= 2 k =1.974×10-3 (kPa ·min)-1k =9.87×10-4 (kPa ·min)-1同理 k (510 K)=1.974×10-3 (kPa ·min)-1(乙) ln(k 2/k 1)=E a /R ·(1/T 1-1/T 2) E a =147 kJ ·mol -124. [答] (1) k = 0.224 dm 3·mol -1·s -1(2) E a = RT 2× dln k /d T = 147.7 kJ ·mol -1 (3) 应用稳态近似得r = k 3[C] = k 1k 2[A]2/(k -1+ k 2[A]) 当k -1 >> k 2[A] 时, r = k 1k 2/k -1× [A]2 为二级反应25. [答]根据准级数反应求α r 1/r 2=([A]01/[A]02)α [B]0, [C]0一定14.1/5.0=(0.020/0.010)α α =1.49≈32同理求得 β=-1 , γ=0k =r /([A]03/2[B]0-1[C]00) 求得 k =2.5×10-4 (mol ·dm -3)-1/2·s -126. [答] k =1tlnA A, 求不同时刻t 下的k ,若为常数,则为一级反应。
