[VIP专享]广东省医疗器械质量监督检验所医疗器械检测资格认可范围及限制要求
广东省医疗器械管理条例

广东省医疗器械管理条例颁布单位:广东省九届人大(第38号)颁布日期:1999年3月1日实施日期:1999年3月1日第一章总则第一条为加强对医疗器械生产、经营、使用的监督管理,规范医疗器械市场秩序,保证产品质量及其使用安全有效,保障人民身体健康,根据国家有关法律、法规的规定,结合本省实际,制定本条例。
第二条凡在本省范围内从事医疗器械科研、生产、经营、检测、使用、临床研究、广告宣传和监督管理的单位及个人,必须遵守本条例。
第三条本条例所称医疗器械是指:用于人体疾病和伤残的预防、诊断、治疗、监护、缓解或者补偿,解剖、生理学过程的研究,组织替代,机体调节及妊娠控制的仪器、设备、材料、相关物品及其软件。
第四条省药品监督管理部门负责全省医疗器械的监督管理工作。
市(地级以上,下同)、县(含县级市,下同)药品监督管理部门负责所辖行政区域内医疗器械的监督管理工作。
第二章医疗器械的分类管理第五条医疗器械分为以下三类:第一类是通过常规管理足以保证安全、有效的医疗器械;第二类是产品机理已取得国际、国内认可,技术成熟,其安全性,有效性必须加以控制的医疗器械;第三类是植入人体,或用于生命支持,或技术结构复杂,对人体可能具有潜在危险,其安全性、有效性必须严格控制的医疗器械。
第六条省药品监督管理部门定期公布医疗器械产品分类目录,并可根据我省实际情况调整第一、第二类目录。
对标明具有本条例第三条所规定功能、但分类目录中未列出的产品,其生产者应报省药品监督管理部门确认。
第七条第一、第二类医疗器械由省药品监督管理部门管理,市药品监督管理部门受省药品监督管理部门委托,可对第一类医疗器械进行管理;第三类医疗器械按照国家药品监督管理部门的要求进行管理。
第三章医疗器械生产、经营的管理第八条企业生产医疗器械,必须经所在市药品监督管理部门审核并向省药品监督管理部门提出申请,经审查批准取得医疗器械生产准许证后,再向工商行政管理部门申领营业执照。
省药品监督管理部门应在收到企业全部申报材料后四十五个工作日内作出是否批准的决定。
医疗器械检测资格认可范围及限制要求
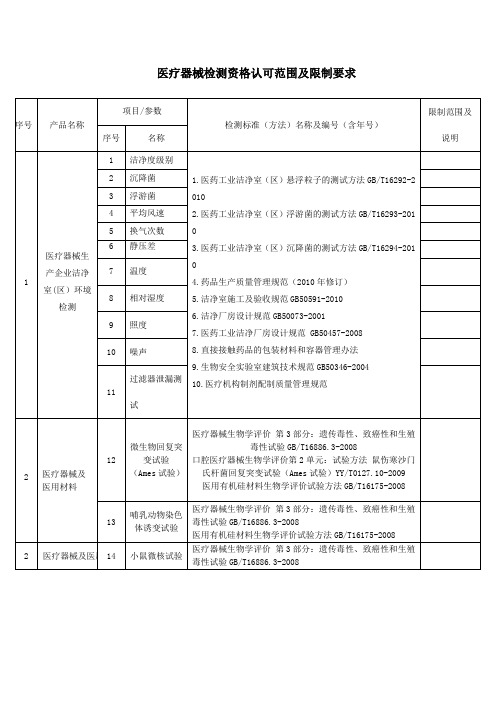
医用有机硅材料生物学评价试验方法GB/T16175-2008
2
医疗器械及医用材料
31
急性全身毒性
医用输液输血、注射器具检验方法 第2部分:生物学试验法GB/T14233.2-2005
医疗器械生物学评价 第11部分:全身毒性试验GB/T16886.11-1997
35
细菌内毒素试验
医用输液输血、注射器具检验方法 第2部分:生物学试验法GB/T14233.2-2005
医疗器械生物学评价 第11部分:全身毒性试验GB/T16886.11-1997
《中国药典》2010年版
36
无菌试验
医用输液、输血、注射器具检验方法 第二部分:生物试验法GB/T14233.2-2005
医用输液输血、注射器具检验方法 第2部分:生物学试验法B/T14233.2-2005
口腔材料生物学评价 第2单元:口腔材料生物试验方法 皮下植入试验YY/T 0127.8-2001
23
皮内反应试验
医用输液输血、注射器具检验方法 第2部分:生物学试验法GB/T14233.2-2005
医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验GB/T16886.10-2005
口腔医疗器械生物学评价第2单位:试验方法急性全身毒性试验:静脉途径 YY/T 0127.2-2009
口腔材料生物实验方法 短期全身毒性试验:经口途径 YY/T 0244-1996
医用有机硅材料生物学评价试验方法GB/T16175-2008
32
亚急性全身毒性
医疗器械生物学评价 第11部分:全身毒性试验 GB/T16886.11-1997
广东省医疗器械经营企业现场检查验收标准

广东省医疗器材经营公司现场检查查收标准〔2021版征采建议稿〕编号验收条款意见人员及组织机构公司负责人、质量管理人应熟习医疗器材监察管理的法例、规章以及食品药品监察管理部门1对医疗器材监察管理的有关规定。
公司组织机构健全,应设置与经营规模和经营范围相适应的质量管理、查收、仓储、销售、售后效力等岗位,各机构和人员职责应明确。
质量管理人在经营过程中对医疗器材的质量具2有判决权。
经营10个类型以上的公司应设置包含质量管理人在内许多于2人的专职质量管理机构。
3公司负责人应拥有大专以上学历。
质量管理人应拥有医疗器材有关专业大专以上学历和1年1患有传得病、皮肤病以上有关工作经验,确实执行岗位职责。
公司负责人不得兼任质量管理人。
公司应有与经营规模和经营范围相适应的负责质量管理、查收、仓储、销售、售后效力等岗4位的专业技术人员,并应拥有医疗器材有关专业大专以上学历,总人数许多于8人。
质量管理人及专业技术人员应任职在岗,不得兼职。
应与公司签订合法有效并已存案的劳动5合同,具备公司人事委任书。
公司负责人、质量管理人及专业技术人员应经地市级以上食品药品监察管理部门专业培训,合格前面可上岗。
公司应按期组织对上述人员进行医疗器材法例、规章、专业知识、内部制度、职业道德等培训或持续教育,并成立有关档案。
公司每年应组织质量管理人及专业技术人员进行健康检查并成立档案。
7的不得从事直接接触医疗器材的工作。
公司应在专业技术人员中指定专人负责本公司计算机管理信息系统及医疗器材经营电子监8管信息的保护、更新及上报工作。
2经营及仓储场所公司注册地点应产权清晰、非住所用途。
其经营场所应装备运行优秀的固定、机、9计算机、网络接入装置、档案柜等办公设备,环境整齐,实质使用面积许多于80平方米。
公司应有切合经营规模和经营范围需要的计算机管理信息系统,拥有稳固、安全的网络环境,可以对医疗器材的质量管理、查收、仓储、销售、售后效力等进行真切、完好、正确的记录10和管理,具备接受食品药品监察管理部门有关医疗器材经营电子看管的技术条件,并按规定办理医疗器材经营电子看管入网手续。
最新国家局组织专家组对广州医疗器械质量监督检验中心的医疗器械检测-精选版整理版
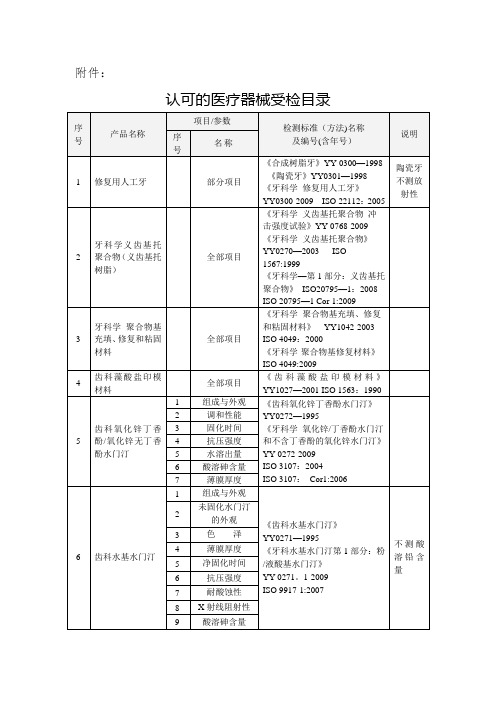
2
尺寸
3
溶解性
4
力学性能
5
钙、磷原子比
6
重金属元素含量极限
7
密度及容重、
显气孔率
28
水胶体印模材料
全部项目
《牙科学可逆和不可逆水解胶体印模材料》ISO 13716:1999
29
牙科复制材料
全部项目
《牙科学复制材料》YY/T 0527—2009 ISO 14356:2003
6
挠曲强度
7
内部孔隙
8
弯曲性能
9
弯曲弹性模量
36
根管清洗剂/润滑剂
1
外观
《牙科EDTA根管润滑/清洗剂》YY/T 0516—2009《根管清洗剂》
YZB/META002 —2004
《根管清洗糊剂》YZB/META001—2004
《根管润滑剂》
YZB/PULPD 006—2006
《根管润滑剂》YZB/赣001-2008《次氯酸钠根管冲洗液》
YZB/赣Q/NPY002—2009
2
乙二胺四乙酸含量
3
清洗剂状态
4
pH值
5
流动性
6
颜色
7
稠度
8
污染程度
9
EDTA/乙二胺四乙酸二钠
含量
10
清除牙本质碎屑和玷污层
11
密度
12
水溶性
13
次氯酸钠含量
14
重金属含量
(以Pb计)
15
砷含量
37
牙科树脂基材料
色稳定性的
测定
《牙科材料色稳定性的测定》YY/T 0631-2008 ISO 7491:2000
广东省药品监督管理局关于印发《广东省药品监督管理局医疗器械注册人、备案人延伸检查管理规定》的通知

广东省药品监督管理局关于印发《广东省药品监督管理局医疗器械注册人、备案人延伸检查管理规定》的通知文章属性•【制定机关】广东省药品监督管理局•【公布日期】2023.07.05•【字号】粤药监规〔2023〕3号•【施行日期】2023.09.01•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】医疗管理正文广东省药品监督管理局关于印发《广东省药品监督管理局医疗器械注册人、备案人延伸检查管理规定》的通知粤药监规〔2023〕3号各地级以上市市场监管局,省药品监管局机关各处室、各直属事业单位:《广东省药品监督管理局医疗器械注册人、备案人延伸检查管理规定》,经广东省药品监督管理局局务会审议和广东省司法厅审查通过,现予以印发,请遵照执行。
广东省药品监督管理局2023年7月5日广东省药品监督管理局医疗器械注册人、备案人延伸检查管理规定目录第一章总则第二章启动第三章检查第四章处理第一章总则第一条为了保证医疗器械质量安全,保障人体健康和生命安全,促进医疗器械产业发展,根据《医疗器械监督管理条例》(国务院令第739号)、《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)、《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号)、《医疗器械生产监督管理办法》(国家市场监督管理总局令第53号),结合我省实际,制定本规定。
第二条本规定所称延伸检查是指药品监督管理部门为综合评价医疗器械注册人、备案人(以下简称“注册人、备案人”)质量管理体系符合性和有效性,对为医疗器械的上市提供产品或服务的单位及个人开展的检查活动。
第三条本规定适用于广东省各级药品监督管理部门开展的医疗器械领域延伸检查活动。
第四条实施延伸检查的人员,应当是医疗器械行政执法人员、依法取得检查员资格的人员或者取得本次检查授权的其他人员。
检查人员应当保守注册人、备案人、被检查单位及个人的商业秘密。
被检查单位及个人应当对延伸检查予以配合,不得隐瞒、拒绝、阻挠,提供的相关文件和资料应当真实、完整、准确。
广东省医疗器械质量体系考核检查指南

医疗器械生产企业质量体系考核办法《医疗器械生产企业质量体系考核办法》于2000年4月29日经国家药品监督管理局局务会审议通过,现予发布,自2000年7月1日起施行。
二○○○年五月二十二日医疗器械生产企业质量体系考核办法第一条为加强医疗器械管理,强化企业质量控制,保证病患者的人身安全,根据《医疗器械监督管理条例》,制定本办法。
第二条本办法适用于申请第二类、第三类医疗器械准产注册企业的审查及对企业的定期审查。
下列情况可视同已通过企业质量体系考核:(一)企业获得国务院药品监督管理部门认可的质量认证机构颁发的GB/T19001和YY/T0287(或GB/T19002和YY/T0288)标准的质量体系认证证书,证书在有效期内的。
(二)已实施工业产品生产许可证的产品,其证书在有效期内的。
(三)已实施产品安全认证,企业持有的产品安全认证证书在有效期内的。
第三条申请第二、三类医疗器械生产企业质量体系考核,均由所在地省、自治区、直辖市药品监督管理部门受理并组织考核。
国家规定的部分三类医疗器械,由所在地省、自治区、直辖市药品监督管理部门受理后,报国家药品监督管理局,由国家药品监督管理局组织考核。
部分三类医疗器械目录由国家药品监督管理局确定并公布。
质量体系的考核,可委托下一级药品监督管理部门或具有相应资格的第三方机构进行。
质量体系考核结果由委托方负责。
第四条企业在申请产品准产注册前,应填写《医疗器械生产企业质量体系考核申请书》(见附件1),向省级以上药品监督管理部门提出企业质量体系考核申请。
国家规定的部分三类医疗器械的质量体系考核,企业提出质量体系考核申请的同时,向国家药品监督管理局提交被考核产品的《质量保证手册》和《程序文件》。
其它产品的质量体系考核,企业提出质量体系考核申请前,应按《质量体系考核企业自查表》(见附件1的附表)进行自查,填写自查表。
自查表填写内容应如实、准确,以备现场考核时查验。
第五条对二类医疗器械,省、自治区、直辖市药品监督管理部门应对企业填写的《质量体系考核企业自查表》和提供的相关资料进行审核,经审核后签署意见,必要时可对申请企业进行现场查验。
医疗器械EMC检验的送检要求及说明

承诺书广东省医疗器械质量监督检验所:本公司所提供的样机、配件及文件资料证书全部真实有效,并与今后生产的产品相一致,若有任何不一致,本公司愿承担由此产生的一切法律责任;公司公章年月日表1 样品的适用范围表2 样品的工作频率、生理模拟频率和响应时间表3 样品的信息注:填写相关信息,并在符合的可选项中打;表4 样品的构成表5 样品的运行模式表6 样品电缆信息表7 样品骚扰源表8 样品的EMC关键元器件清单1、送检样品主机一台,附件包括产品配套使用的患者电缆、互连电缆、脚踏开关、适配器、显示器、电脑、测试软件等;当送检产品为医疗器械附件时如有创血压传感器、血氧探头等,企业应提供符合电磁兼容标准要求的主机和辅助设备;2、当送检产品有覆盖型号时应提供覆盖申请,说明主检型号与覆盖型号的差异,并提供所有覆盖型号的样机;覆盖型号差异表样式见“三、承诺书、覆盖型号差异表及产品相关资料表格”;以下情况不允许覆盖:a.按产品种类划分,种类不同的产品不能互相覆盖;b.按产品工作原理划分,工作原理不同的产品不能互相覆盖;c.按影响产品电磁兼容性的关键件划分,关键件、印刷电路图、电气结构不同的产品不能互相覆盖;d.同一商标、同一规格型号的产品,由不同产地生产的不能互相覆盖;e.台式设备与落地式设备之间不能互相覆盖;3、申请中文报告检验时,医疗器械注册产品标准中应包含电磁兼容性的条款信息,英文报告不需要提供;根据国家规定不再要求企业提供注册产品标准时,企业只需提供技术要求,技术要求中应包含电磁兼容性的信息;4、承诺书样式见“三、承诺书、覆盖型号差异表及产品相关资料表格”;5、一般使用说明书和技术说明书合并,说明书内容中必须包含EMC相关信息的提示,详见YY0505IEC60601-1-2或GB/T IEC 61326-2-6标准的条款要求,该部分如有疑问可与我所业务人员联系;出具中文报告需提供中文说明书,出具英文报告需提供英文说明书;6、电路图包括网电源部分、应用部分、电路板等图纸;由于特殊原因不能提供电路图如该电路是外购部件,需将该电路作为关键元器件写到关键元器件清单中;7、样品连接图,需要体现主机与其他部件的连接关系,例如适配器,探头等;医疗系统需要体现设备间的连接关系;只有主机没有其他附件的产品不需要提供连接图;8、提供产品风险分析报告,利于根据分析报告中确认送检产品的基本性能,作为 EMC抗扰度测试结果的判定依据;9、对于进口检测设备,若在国外已经进行EMC检测,需提供相关检测报告;10、EMC关键元器件清单详见表8,通过认证的元器件提供纸质版证书;11、产品相关资料表格,出具中文报告需提供中文表格,出具英文报告需提供英文表格;表1.产品的适用范围产品的适用范围指产品预期使用的环境和场所;常见的适用范围有医院、家庭、大诊所、小诊所、医生办公室、急救室、手术室、车辆、飞机、救护车、血站、工业场所等,测试人员需要根据产品适用范围来确定测试的限值;表2.样品的工作频率、生理模拟频率和响应时间工作频率是指在设备或系统中设定用来控制某种生理参数的电信号或非电信号的基频;例如呼吸机的工作频率基频可能是每分钟6次的呼吸率;生理模拟频率是指用于模拟生理参数的电信号或非电信号的基频,使得设备或系统以一种与用于患者时相一致的方式运行;例如,心电监护仪的生理模拟频率基频可能是每分钟55次搏动的心率;响应时间指设备或系统对输入信号的反应的速度,例如脉搏血氧计需要在几个心电周期内显示一个平均值,测试人员将根据产品的响应时间来确定EMC抗扰度试验的驻留时间,以评估试验期间的产品性能;表3.样品的信息屏蔽场所指具有射频屏蔽效能的场所,如屏蔽室;样品尺寸中,若为多部件系统,则列出每个部件使用时的最大尺寸;表4.样品的构成列出样品的主要组成结构和配件,例如:主机、适配器、脚踏开关、电脑、探头,电极等,要求与说明书和企业标准中的组成结构一致;若部件为硬件,填写硬件的型号,样品包含软件部分,应填写软件的版本号;表5.样品的运行模式列出送检样品的工作模式,例如:对于高频电刀,其运行模式包括电切模式、电凝模式等工作模式,测试人员根据提供的工作模式进行测试;模式描述包括具体的一些设置和运行参数,连接模拟器状况等;表6.样品的电缆信息指送检样品外部的所有电缆,例如:电源线、适配器电缆、USB通讯线和串口线等各端口连接导线、部件间的连接线、电位均衡导线及各种患者电缆;样品的气管和内部电缆不需要列出;若无具体名称,可用连接部件代替,例如:控制连接扫描架电缆;电缆长度,单位为米,保留小数点后一位;表7.样品搔扰源例如:开关电源、晶振、时钟频率、电机等,主要针对射频范围9 KHz 到 3000GHz的部件;表8.样品的EMC关键元器件清单EMC关键元器件清单,指与样品EMC设计和EMC测试结果密切相关的元器件或部件;已经获得认证的元器件在备注栏填写证书类型和编号;例如: 带磁环的电源线、滤波电容、电感、磁珠、磁环、瞬变干扰吸收器件气体放电管、固体放电管、压敏电阻、瞬变电压吸收二极管、滤波器、开关电源、电源适配器、变压器、晶振、芯片、继电器、电抗器、电磁阀、可控硅、变频器、霍尔元件、机箱、电池、IC芯片、电动机、压缩机、整流器、显示器、镇流器、各种集成电路及外购电路主板等,企业可根据各自样品情况进行填写;位置指相关元器件在产品内的具体位置;若未获得证书等对应内容,请填写“/”;。
医疗器械检测资格认可范围及限制要求1

医疗器械检测资格认可范围及限制要求摘要医疗器械的使用是与人类健康息息相关的,因此,医疗器械的安全性、有效性和质量是必须保障的。
对于医疗器械检测实验室,必须具备相应的检测资格认证,以确保检测结果的准确性和可靠性,从而保证其检测结果的真实性和可信性。
本文主要介绍了医疗器械检测资格认可的范围及限制要求。
一、医疗器械检测资格认可的范围医疗器械检测资格认可的范围包括检测实验室、检测人员、检测方法、检测设备等。
在进行医疗器械检测资格认证时,需要对检测实验室、检测人员等进行审核,并要求其满足特定的认证标准和要求,以确保其通过了认证后能够独立完成医疗器械检测工作。
1. 检测实验室医疗器械检测实验室需要经过国家相关机构的认证审核,包括但不限于:国家食品药品监督管理总局、中国合格评定国家认可委员会等。
审核主要针对实验室的检测能力、人员素质、设备、质量保障体系等方面。
实验室需要具备完善的质量管理体系和文件管理系统,建立健全的校准和检验体系,对设备进行定期检验和校准,维护设备的正常运转状态。
实验室还需要建立规范的实验室环境,包括通风、照明、温湿度等。
2. 检测人员医疗器械检测人员需要具备相关的资格认证和培训,确保其具备足够的检测技能和专业知识。
相关的认证机构主要有国家高级资格认证机构、中国合格评定国家认可委员会、国家食品药品监督管理总局等。
为确保检测人员的工作能力和素质,相关的认证机构会对检测人员的进行考核和审核,包括考核其理论知识、实验技能和操作规范等,同时也会对检测人员的聘用合同、福利待遇等进行审核和评估。
3. 检测方法医疗器械检测方法是指从医疗器械性能、安全性、有效性等多个方面进行检测的方法。
检测方法主要包括定性和定量两种。
定性测试主要用于评价医疗器械的性能、安全性等方面,例如耐冲击性测试、耐高温测试等。
定量测试主要用于评估医疗器械的定量特性,例如医疗器械的准确性、重复性、灵敏度等。
检测人员需要按照标准化流程进行检测,并记录检测结果。
【管理管理办法】广东省医疗器械管理条例

广东省医疗器械管理条例颁布单位:广东省九届人大(第38号)颁布日期:1999年3月1日实施日期:1999年3月1日第一章总则第一条条例。
第二条第三条第四条第二章第五条效性必须严格控制的医疗器械。
第六条省药品监督管理部门定期公布医疗器械产品分类目录,并可根据我省实际情况调整第一、第二类目录。
对标明具有本条例第三条所规定功能、但分类目录中未列出的产品,其生产者应报省药品监督管理部门确认。
第七条第一、第二类医疗器械由省药品监督管理部门管理,市药品监督管理部门受省药品监督管理部门委托,可对第一类医疗器械进行管理;第三类医疗器械按照国家药品监督管理部门的要求进行管理。
第三章医疗器械生产、经营的管理第八条企业生产医疗器械,必须经所在市药品监督管理部门审核并向省药品监督管理部门提出申请,经审查批准取得医疗器械生产准许证后,再向工商行政管理部门申领营业执照。
省药品监督管理部门应在收到企业全部申报材料后四十五个工作日内作出是否批准的决定。
第九条生产医疗器械的企业必须具备以下条件:(一)具有与所生产医疗器械相适应的质量保证体系;第十条再(四)具有与所经营医疗器械相适应的进货验收和质量保证管理制度。
第十二条医疗器械生产准许证、经营准许证不得涂改、伪造、转让、转借、出租。
第十三条医疗器械生产准许证、经营准许证有效期为五年,由所在市药品监督管理部门组织年审,并报省药品监督管理部门备案。
持证单位和个人应在有效期满六个月前,向原发证机关申办换证。
第四章医疗器械产品管理第十四条企业必须严格按标准生产医疗器械,凡有强制性标准的必须执行强制性标准。
企业生产的医疗器械产品,没有国家标准或行业标准的,应当制定相应的企业标准,作为组织生产的依据。
第一类医疗器械企业标准应报所在市药品监督管理部门和技术监督部门备案。
第二、第三类医疗器械企业标准应报省药品监督管理部门和省技术监督部门备案。
第十五条医疗器械产品实行注册审批制度。
第一、第二类医疗器械产品由省药品监督管理部门审查发给注册证和注册号;第三类医疗器械产品由省药品监督管理部门审核,并报国家药品监督管理部门审查发给注册证和注册号。
医疗器械检测资格认可范围及限制要求-医疗器械技术审评中心
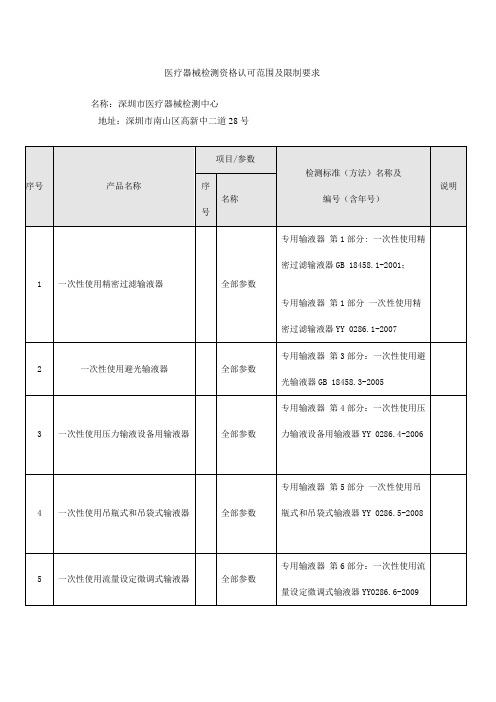
常规生化复合定值质控品
全部参数
常规生化复合定值质控品
YZB/粤0707-2010
91
肌酸激酶同工酶校准品
全部参数
肌酸激酶同工酶校准品
YZB/粤0712-2010
92
肌酸激酶同工酶质控品
全部参数
肌酸激酶同工酶质控品
YZB/粤0706-2010
93
乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)
全部参数
人工心肺机体外循环管道YY 1048-2007
24
敷布生产用非织造布
全部参数
医用非织造敷布试验方法第1部分:敷布生产用非织造布YY/T 0472.1-2004
25
成品敷布
全部参数
医用非织造敷布试验方法第2部分:成品敷布YY/T 0472.2-2004
26
石膏绷带
全部参数
石膏绷带粉状型YY/T 1117-2001
47
一次性使用静脉采血针
全部参数
一次性使用静脉采血针
YZB/国3285-2011
48
一次性使用聚乙烯薄膜手套
全部参数
一次性使用聚乙烯薄膜手套
YZB/粤惠0001-2009
49
中心静脉导管包
全部参数
中心静脉导管包
YZB/国0238-2010
50
一次性使用压力传感器
全部参数
一次性使用压力传感器
YZB/粤0012-2009
全部参数
可控射频消融电极导管
YZB/国0210-2009
41
一次性使用引流导管包
全部参数
一次性使用引流导管包
YZB/国1730-2009
42
改性甲壳素生物修复膜
2022年广东省医疗器械质量监督检验所招聘公告

2022年广东省医疗器械质量监督检验所招聘公告一、根本条件
(一)遵守国家法律、法规和规章制度;
(二)爱岗敬业,具有良好的职业道德,认真履行岗位职责;
(三)工作踏实、积极肯干,具团队协作精神;
(四)具备岗位所需的学历和专业技能;
(五)具有较强的学习领悟能力,具有实验动手能力、独立分析和解决问题的能力。
二、岗位职责:
(一)生物性能室检验员(广州)
(1)医疗器械微生物检测;
(2)实验室日常管理和维护;
(3)参与标准起草和科研工程。
(二)生物性能室检验员(东莞)
(1)医疗器械动物实验和病理学制片;
(2)协助科室质量负责人编制SOP;
(3)参与医疗器械生物学评价科研工程;
(4)实验室日常管理和维护。
(三)报告装订员
主要负责报告的整理、排版以及装订。
三、学历要求
生物性能室检验员(广州):全日制大学本科及以上微生物、医学检验
相关专业;
生物性能室检验员(东莞):全日制大学本科及以上病理学、动物医学、兽医、预防医学、临床医学或生物技术相关专业;
报告装订员(广州):中专及以上,不限专业。
四、应聘材料
五、薪酬待遇
按本单位合同制人员薪酬管理执行,具体面谈。
六、工作地址
(一)广州市黄埔区光谱西路一号;
(二)东莞市松山湖高新产业技术开发区金美济大厦七楼。
通讯地址:广州市黄埔区光谱西路一号广东省医疗器械质量监督检验
所人事科
:510663
个人简历。
根据《医疗器械监督管理条例》及《医疗器械检测机构资格认可办法
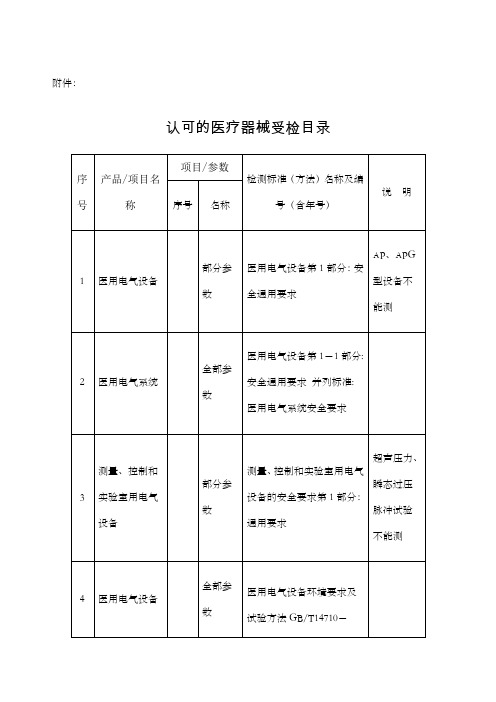
7
医用电气设备
全部参数
电磁兼容 家用电器、电动工具和类似器具的要求 第1部分:发射GB
8
医用电气设备
部分参数
信息技术设备抗扰度限值和测量方法GB/T17618-1998
X射线机不能测;大于1米×1米的设备不能测
9
医用电气设备
全部参数
电磁兼容 试验和测量技术 电压暂降、短时中断和电压变化抗扰度试验GB/
98
多参数母亲/胎儿监护仪
全部参数
多参数母亲/胎儿监护仪YZB/苏0298-2008
99
多参数中央监护系统
全部参数
多参数中央监护系统YZB/苏0339-2003
100
心电遥测监护系统
全部参数
心电遥测监护系统YZB/苏0372-2006
101
动态心电记录仪
全部参数
动态心电监护仪YZB/苏0802-2007
48
一次性使用痣上粘膜环切吻合器辅件
全部参数
一次性使用痔上粘膜环切吻合器辅件 YZB/苏0778-2007
49
一次性使用直线型吻(缝)合器
全部参数
一次性使用直线型吻(缝)合器YZB/苏0755-2007
50
一次性使用直线型吻(缝)合器组件
全部参数
一次性使用直线型吻(缝)合器组件YZB/苏0779-2007
71
一次性使用无菌注射器用活塞
全部参数
一次性使用无菌注射器用活塞YY/T0243-2003
72
一次性使用无菌胰岛素注射器
全部参数
一次性使用无菌胰岛素注射器YY0497-2005
73
自毁型固定剂量疫苗注射器
全部参数
广东省医疗器械质量监督检验所_企业报告(代理机构版)

本报告于 2023 年 08 月 31 日 生成
2 / 14
1.3 代理项目规模
1.3.1 代理项目规模结构 近 1 年广东省医疗器械质量监督检验所的代理项目数量主要分布于 100-200 万区间,占总代理项目数 量的 42.9%。500 万以上大额项目 3 个。 近 1 年(2022-09~2023-08):
657.0 657.0 500.0
2021-05-17 2022-07-09 2022-11-15
本报告于 2023 年 08 月 31 日 生成
5 / 14
序号
项目名称
招标单位
预算金额(万元) 公告时间
4
2022 年广东省医疗器械质量监督检 验所仪器设备采购项目
广东省医疗器械质量 监督检验所
172.5
*平均节支率是指,项目节支金额与预算金额的比值的平均值。(节支金额=项目预算金额-中标金额)
本报告于 2023 年 08 月 31 日 生成
1 / 14
1.2 代理项目趋势
近 3 月(2023-06~2023-08):
近 1 年(2022-09~2023-08):
近 3 年(2020-09~2023-08):
目录
企业基本信息 .................................................................................................................................1 一、代理项目 .................................................................................................................................1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
扩项
43m1m“-”J520Gm01m24“492k-Z(1)g2L3-”3060@k%3-g“/1”7mD2%BJ/Tg0d1-ZP318¬-A_2"o70)Xc0?y258z6n”217 NE)
可视性多功能宫内取环
11
1 全部参数
器
可视性多功能宫内取环器 YZB/粤 1308-2011
扩项
12 硬性气管内窥镜
3
1 全部参数
肤治疗仪
激光产品的安全 第 1 部分:设备分 类、要求 GB 7247.1-2012
激光产品的安全 第 14 部分:用户 指南 GB/T 7247.14-2012 激光治疗设备 半导体激光光动力治 疗机 YY 0845-2011 308nm 准分子紫外光皮肤治疗仪 YZB/粤 0130-2010
标准变更
标准变更 扩项 扩项 扩项
—5—
项目/参数
序
号
检测对象
1 全部参数
合器
一次性使用镜下切割吻合器 YZB/ 粤 0618-2012
扩项
Ⅱ 眼科手术器械(6804)
1 泪道探针
1 全部参数
泪道探针 YY 0075-2005
扩项
43m1m“-”J520Gm01m24“492k-Z(1)g2L3-”3060@k%3-g“/1”7mD2%BJ/Tg0d1-ZP318¬-A_2"o70)Xc0?y258z6n”217 NE)
Ⅴ 注射穿刺器械(6815)
一次性使用动静脉内瘘
1
1 全部参数
穿刺针
2 一次性使用套管穿刺针 1 全部参数
一次性使用动静脉穿刺
3
1 全部参数
针
一次性使用动静脉内瘘穿刺针 YZB/ 国 1189-2011 一次性使用套管穿刺针 YZB/粤 0588-2008 一次性使用动静脉穿刺针 YZB/国 0218-2011
1 全部参数
硬性气管内窥镜专用要求 YY 0069-2009
Ⅷ 医用超声仪器及有关设备(6823)
标准变更
1 医用超声雾化器
1 全部参数
医用超声雾化器 YY 0109-2013
Ⅸ 医用激光仪器设备(6824)
1 激光产品
1 全部参数 2 全部参数
2 激光治疗设备
1 全部参数
308nm 准分子紫外光皮
数码电子阴道镜 YZB/粤 1246-2012
眼科光学相干断层扫描仪 YZB/粤 0896-2009 肛肠内窥镜诊疗仪 YZB/粤 06882011 手持式验光仪 YZB/粤 0752-2011
扩项 扩项 扩项 扩项 扩项 扩项 扩项 扩项
10 立体阴道镜系统
1 全部参数
立体阴道镜系统 YZB/粤 0753-2011
2 眼用剪
1 全部参数
眼用剪 YY/T 0176.9-2011
标准变更
3 眼科镊
1 全部参数
眼科镊 YY/T 0819-2010
Ⅲ 口腔科手术器械 (6806)
1 银汞合金分离器
1 全部参数
银汞合金分离器 YY 0835-2011
Ⅳ 妇产科用手术器械(6812)
一次性使用子宫颈取样
1
1 全部参数
刷
一次性使用子宫颈取样刷 YZB/粤 0588-2011
标准变更 扩项 扩项
扩项 扩项 扩项
—3—
项目/参数
序
号
检测对象
序
名称
号
1 全部参数 4 一次性使用无菌注射器
2 全部参数
一次性使用高压造影注
5 射器及附件
1 全部参数
检测标准(方法)名称及 限制
编号(含年号)
范围
说明
一次性使用无菌注射器第 3 部分: 自毁型固定剂量疫苗注射器 YY 0573.3-2005 一次性使用无菌注射器 第 4 部分: 防止重复使用注射器 YY 0573.42010 一次性使用高压造影注射器及附件 YY 0614-2007
扩项 扩项 扩项
6 牙筒式注射器
1 全部参数
牙科筒式注射器 YY/T 0820-2010
扩项
一次性使用配药用注射
7
1 全部参数
器
一次性使用配药用注射器 YY/T 0821-2010
扩项
8 内镜微量注液器
1 全部参数
内镜微量注液器 YZB/粤 0911-2013
Ⅵ 医用电子仪器设备(6821)
红外人体表面温度快速
1
1 全部参数
筛查仪
43m1m“-”J520Gm01m24“492k-Z(1)g2L3-”3060@k%3-g“/1”7mD2%BJ/Tg0d1-ZP318¬-A_2"o70)Xc0?y258z6n”217 NE)
红外人体表面温度快速筛查仪 GB/T19146-2010
连续无创型血压监测系
2
1 全部参数
8 肛肠内窥镜诊疗仪
1 全部参数
9 手持式验光仪
1 全部参数
检测标准(方法)名称及 限制
编号(含年号)
范围
说明
内镜器械 第 1 部分:腹腔镜用穿刺 器 YY 0672.1-2008 眼科仪器 裂隙灯显微镜 YY 00652007 眼底图像检验系统 YZB/粤 11022012 医用内窥镜摄像系统 YZB 粤 0947-2012
附件
医疗器械检测资格认可范围及限制要求
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)
地址:广州市萝岗区科学城光谱西路 1 号
项目/参数
序
检测标准(方法)名称及 限制
号
检测对象
序
名称
编号(含年号)
范围
号
Ⅰ 基础外科手术器械(6801)
说明
一次性使用镜下切割吻
1
扩项
扩项
扩项 取消受限:能量 的减少、X 射线 辐射 扩项 扩项
6 静脉输注中央站
1 全部参数
静脉输注中央站 YZB/粤 0676-2013
扩项
7 红外乳腺检查仪
1 全部参数
红外乳腺检查仪 YZB/粤 0766-2012
扩项
8 血管显影仪
1 全部参数
血管显影仪 YZB/粤穗 0015-2003
扩项
Ⅶ 医用光学器具、仪器及内窥镜设备(6822)
统
连续无创型血压监测系统 YZB/GJCNS-2012
3 脑电图机
1 全部参数
医用电气设备-第 2-26 部分:脑电图 机安全专用要求 GB 9706.26-2005
4 肺功能仪
1 全部参数
一次性使用压力传感器
5
1 全部参数
系统
肺功能仪 YZB/GRG03-2013 一次性使用压力传感器系统 YZB/国 0698-2010
1 角膜曲率计
1 全部参数
角膜曲率计 YY 0579-2005
扩项
—4—
序 检测对象
号
2 腹腔镜用穿刺器
项目/参数 序
名称 号
1 全部参数
3 裂隙灯显微镜
1 全部参数
4 眼底图像检验系统
1 全部参数
5 医用内窥镜摄像系统 1 全部参数
6 数码电子阴道镜
1 全部参数
眼科光学相干断层扫描
7 仪
1 全部参数
