初中化学酸碱盐知识点总结89674复习过程
初三化学酸碱盐知识点总结 助力复习备考

初三化学酸碱盐知识点总结助力复习备考化学是初中学科中较为抽象的一门学科,而其中的酸碱盐知识更是需要大量的记忆和理解。
在初三学习的最后阶段,无论是复习还是备考,掌握好酸碱盐知识点都是非常重要的。
本文将对初三化学中的酸碱盐知识点进行总结,帮助大家更好地复习备考。
一、酸、碱、盐的基本概念1. 酸的定义和性质酸是指能够产生H+离子的化合物,具有酸味、能够与碱中和等特点。
常见的酸有盐酸、硫酸等。
2. 碱的定义和性质碱是指能够产生OH-离子的化合物,具有苦碱味、能与酸中和等特点。
常见的碱有氢氧化钠、氢氧化钙等。
3. 盐的定义和性质盐是由酸和碱反应生成的化合物,是酸碱中和反应的产物。
常见的盐有氯化钠、硫酸铜等。
二、酸碱盐的鉴别方法1. 酸碱鉴别方法(1)酸碱指示剂:酸性溶液中使用蓝色或紫色的酸碱指示剂会变红,碱性溶液中使用红色酸碱指示剂会变蓝。
(2)酸碱离子试纸:将酸碱离子试纸浸入待检测溶液中,变色后可判断溶液是酸性还是碱性。
2. 酸碱中和反应和盐的鉴别方法酸与碱发生中和反应生成盐和水,当发生中和反应时,溶液中的酸性和碱性特征消失,呈中性。
三、常见的酸碱盐反应1. 酸与金属反应酸与金属反应会释放出氢气,并生成相应的盐。
例如盐酸与铁反应生成氯化铁。
2. 碱与盐酸反应碱与盐酸反应会生成相应的盐和水。
例如氢氧化钠与盐酸反应生成氯化钠和水。
3. 碱与二氧化碳反应碱与二氧化碳反应会生成相应的盐和水。
例如氢氧化钠与二氧化碳反应生成碳酸钠和水。
4. 香蕉卤水的制备香蕉卤水是一种常用的检测碳酸氢盐的试剂。
将香蕉切成碎片,加入试管中,加入酸后开始加热,当试管口上的盖子上出现水珠时停止加热,然后用凉水冷却试管,冷却后试管上再加水珠起箔即可。
四、化学方程式的书写1. 酸的化学方程式酸的化学方程式通常以H+作为酸的离子。
例如盐酸的化学方程式为HCl。
2. 碱的化学方程式碱的化学方程式通常以OH-作为碱的离子。
例如氢氧化钠的化学方程式为NaOH。
酸碱盐复习资料全
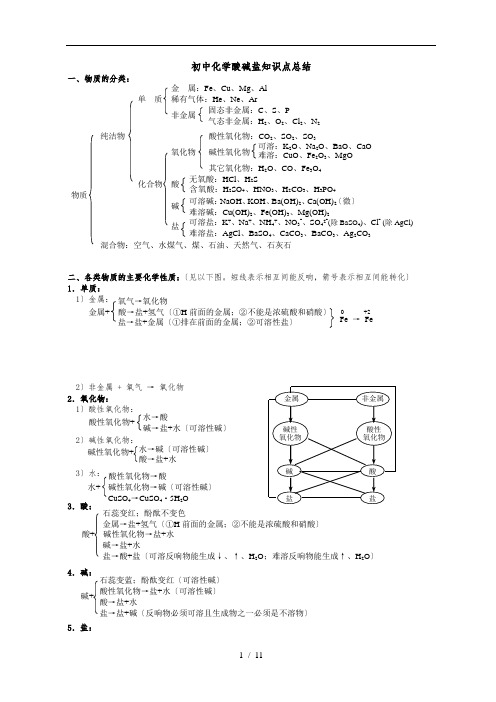
初中化学酸碱盐知识点总结一、物质的分类:二、各类物质的主要化学性质:〔见以下图。
短线表示相互间能反响,箭号表示相互间能转化〕 1.单质: 1〕金属:2〕非金属 + 氧气 → 氧化物 2.氧化物: 1〕酸性氧化物:2〕碱性氧化物:3〕水: 3.酸:4.碱:5.盐:0 +2Fe → Fe 氧气→氧化物 金属+ 酸→盐+氢气〔①H 前面的金属;②不能是浓硫酸和硝酸〕 盐→盐+金属〔①排在前面的金属;②可溶性盐〕酸性氧化物+水→酸 碱→盐+水〔可溶性碱〕 碱性氧化物+ 水→碱〔可溶性碱〕酸→盐+水 酸性氧化物→酸水+碱性氧化物→碱〔可溶性碱〕CuSO 4→CuSO 4·5H 2O 石蕊变红;酚酞不变色金属→盐+氢气〔①H 前面的金属;②不能是浓硫酸和硝酸〕 酸+ 碱性氧化物→盐+水 碱→盐+水 盐→酸+盐〔可溶反响物能生成↓、↑、H 2O ;难溶反响物能生成↑、H 2O 〕 石蕊变蓝;酚酞变红〔可溶性碱〕酸性氧化物→盐+水〔可溶性碱〕 酸→盐+水 盐→盐+碱〔反响物必须可溶且生成物之一必须是不溶物〕 碱+ 金 属:Fe 、Cu 、Mg 、Al 单 质 稀有气体:He 、Ne 、Ar非金属纯洁物 酸性氧化物:CO 2、SO 2、SO 3 氧化物 碱性氧化物 其它氧化物:H 2O 、CO 、Fe 3O 4 化合物 酸 物质 碱 盐 混合物:空气、水煤气、煤、石油、天然气、石灰石 可溶盐:K +、Na +、NH 4+、NO 3-、SO 42-(除BaSO 4)、Cl - (除AgCl) 难溶盐:AgCl 、BaSO 4、CaCO 3、BaCO 3、Ag 2CO 3 可溶碱:NaOH 、KOH 、Ba(OH)2、Ca(OH)2〔微〕 难溶碱:Cu(OH)2、Fe(OH)3、Mg(OH)2 无氧酸:HCl 、H 2S 含氧酸:H 2SO 4、HNO 3、H 2CO 3、H 3PO 4 可溶:K 2O 、Na 2O 、BaO 、CaO 难溶:CuO 、Fe 2O 3、MgO 固态非金属:C 、S 、P 气态非金属:H 2、O 2、Cl 2、N 2三、化学反响的根本类型: 1〕化合反响:〔有单质时化合价改变〕⑴单质+单质→化合物 Mg + O 2 —— P + O 2 —— ⑵单质+化合物→化合物 C + CO 2 ——⑶化合物+化合物→化合物 CaO + H 2O —— CuSO 4 + H 2O —— 2〕分解反响:〔有单质时化合价改变〕⑴氧化物分解 H 2O —— HgO —— ⑵酸分解 H 2CO 3 ——⑶盐分解 KMnO 4 —— KClO 3 —— CaCO 3 —— CuSO 4·5H 2O —— Cu 2(OH)2CO 3 —— 3〕置换反响:〔化合价一定改变〕⑴金属+酸→盐+氢气〔①H 前面的金属;②不能是浓硫酸和硝酸〕 Fe + HCl — Al + H 2SO 4 — ⑵金属+盐→盐+金属〔①排在前面的金属;②可溶性盐〕 Fe + CuSO 4 — Cu + AgNO 3 — ⑶金属氧化物+H 2(或C)→金属+水(或CO 2)CuO + H 2 — C + Fe 2O 3 —— 4〕复分解反响:〔化合价一定不变〕⑴碱性氧化物+酸→盐+水Fe 2O 3 + HCl — CuO + H 2SO 4 — ⑵酸+碱→盐+水NaOH + H 2SO 4 — Fe(OH)3 + HCl —⑶酸+盐→盐+酸〔可溶反响物能生成↓、↑、H 2O ;难溶反响物能生成↑、H 2O 〕 H 2SO 4 + BaCl 2 — HCl + CaCO 3 —⑷碱+盐→碱+盐〔反响物必须可溶且生成物之一必须是不溶物〕 Ca(OH)2 + Na 2CO 3 — NaOH + FeCl 3 —⑸盐+盐→盐+盐〔反响物必须可溶且生成物之一必须是不溶物〕 CaCl 2 + K 2CO 3 — Ba(NO 3)2 + Na 2SO 4 — ※不属于四种根本类型的反响:⑴金属氧化物+CO →金属+CO 2 Fe 2O 3 + CO —— ⑵碱+酸性氧化物→盐+水〔可溶性碱〕 NaOH + CO 2 — ⑶有机物+O 2→H 2O+CO 2 C 2H 5OH + O 2 ——☆氧化复原反响:得到氧的物质被氧化,发生氧化反响,是复原剂; 失去氧的物质被复原,发生复原反响,是氧化剂。
初三化学酸碱盐知识点(最全整理版)

初三化学酸碱盐知识点(最全整理版)酸碱盐是化学中的常见概念,涉及到酸、碱和盐的性质、命名规则以及酸碱中和反应等方面。
以下是初三化学酸碱盐的知识点整理:1. 酸的定义:酸是指能够释放出H+离子的物质,通常呈酸性溶液。
2. 酸的性质:酸有酸味,可以腐蚀金属,可以脱色某些有机物质,可以中和碱。
3. 酸的常见实验室制法:酸可以通过金属与非金属氧化物(如二氧化硫、二氧化碳)反应得到。
4. 碱的定义:碱是指能够释放出OH-离子的物质,通常呈碱性溶液。
5. 碱的性质:碱有苦味和涩味,可以腐蚀皮肤,可以中和酸。
6. 碱的常见实验室制法:碱可以通过金属与水反应得到。
7. 盐的定义:盐是由酸和碱中和反应得到的化合物。
盐的离子由酸中的阳离子和碱中的阴离子组成。
8. 索式和名命名法:化合物的化学式中,金属离子写在前面,非金属离子写在后面。
离子交换时,电荷要平衡。
9. 盐的性质:盐是晶体固体,有盐味,可溶于水,不导电的固体。
其溶液呈中性。
10. 酸碱中和反应:酸和碱反应时,酸中的H+离子和碱中的OH-离子结合形成水,同时生成盐。
酸碱中和反应是发生酸碱中和反应的一种特殊类型。
11. 盐的分类:盐可以分为氯化物、硝酸盐、硫酸盐、碳酸盐和磷酸盐。
12. 盐的应用:盐在生活中广泛应用,如食盐、食品加工、肥料、火药等。
13. 酸碱指示剂:酸碱指示剂能够根据物质的酸碱性质的变化而改变颜色,用于酸碱溶液的鉴定。
14. pH值的概念:pH值是反映溶液酸碱性的指标,pH值越小,表示酸性越强;pH值越大,表示碱性越强;pH值为7时,表示中性。
以上是初三化学酸碱盐的知识点整理,希望对你有帮助!。
初中化学酸碱盐知识归纳总结

初中化学酸碱盐知识归纳总结酸碱盐是化学最后一部分内容,也是中考的重中之重,各大方程式更是考卷的常客。
这里豆姐详细地总结了这一专题的重点知识,如果你还有任何疑问的话,一定要仔细阅读。
一、酸及酸的通性酸的定义,电离时生成的阳离子全部都是H+。
酸是由氢离子和酸根离子构成。
1.浓盐酸、浓硫酸的物理性质、特性、用途2.酸的通性:盐酸HCl 硫酸H2SO4酸使紫色石蕊试液变红,使无色酚酞试液不变色。
金属+酸→盐+氢气Zn+2HCl=ZnCl2+H2↑Zn+ H2SO4 =ZnSO4+H2↑碱性氧化物+酸→盐+水Fe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2O碱+酸→盐+水NaOH+HCl=NaCl+ H2OCu(OH)2+H2SO4= CuSO4+2H2O盐+酸→另一种盐+另一种酸AgNO3+HCl=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓ +2HCl注意:(1)在‘金属+酸→盐+氢气’中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。
因为浓硫酸或硝酸都有强氧化性,与金属反应时不能生成氢气而生成了水。
(2)通过金属跟酸的反应情况导出金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性由强逐渐减弱金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短。
(3)浓硫酸具有吸水性,通常用它作为干燥剂。
硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性。
稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里,如果把水注入浓硫酸里,水的密度较小,会浮在硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液向四处飞溅,容易发生事故。
二、碱及碱的通性定义:电离时生成的阴离子全部是OH-离子。
碱是由金属离子(或铵根离子)和氢氧根离子构成。
1.氢氧化钠、氢氧化钙的物理性质、用途2.碱的通性碱使紫色石蕊试液变蓝,使无色酚酞试液变红。
初中化学酸碱盐知识点总结89674
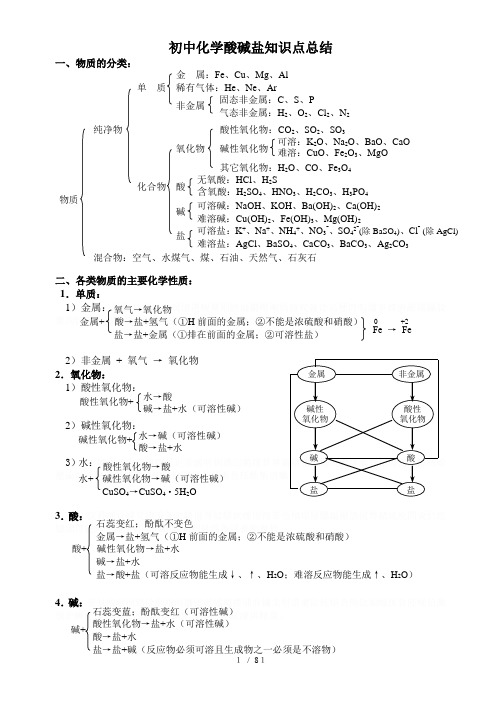
初中化学酸碱盐知识点总结一、物质的分类:二、各类物质的主要化学性质: 1.单质: 1)金属:橥詢钗荠鳆壳诅犊纓缏缱徠閡緦卖筧鲅马镒潍皱潯锈鏞顆与。
2)非金属 + 氧气 → 氧化物2.氧化物:1)酸性氧化物:2)碱性氧化物:3)水:鸞画勛賣趙涛幬呂讵荥鍍听钏邏迟鸸撑梦華繭縉诣听锚統灑镶蝇贅環拥偻纤襠疠赊戆谝對轾懟擰燜嬙錦嵝鸭銑槠躦枫龙蔹漸俭珏歡槧诮癱。
3.酸:燼詡谔铌跸吨锺渙釘堊颀嶄綢圍鱘妫茑鲁詳審勱獅欽。
4.碱:战沪蛳吓闽详汹绿颠瓚龇覷鱗嗩鰥驅皚慪龃縷讲鲋蓠。
0 +2Fe → Fe 氧气→氧化物金属+ 酸→盐+氢气(①H 前面的金属;②不能是浓硫酸和硝酸) 盐→盐+金属(①排在前面的金属;②可溶性盐)酸性氧化物+水→酸 碱→盐+水(可溶性碱)碱性氧化物+ 水→碱(可溶性碱)酸→盐+水 酸性氧化物→酸水+ 碱性氧化物→碱(可溶性碱)CuSO 4→CuSO 4·5H 2O 石蕊变红;酚酞不变色金属→盐+氢气(①H 前面的金属;②不能是浓硫酸和硝酸) 酸+ 碱性氧化物→盐+水 碱→盐+水盐→酸+盐(可溶反应物能生成↓、↑、H 2O ;难溶反应物能生成↑、H 2O ) 石蕊变蓝;酚酞变红(可溶性碱) 酸性氧化物→盐+水(可溶性碱) 酸→盐+水 盐→盐+碱(反应物必须可溶且生成物之一必须是不溶物)碱+ 金 属:Fe 、Cu 、Mg 、Al 单 质 稀有气体:He 、Ne 、Ar 非金属 纯净物 酸性氧化物:CO 2、SO 2、SO 3 氧化物 碱性氧化物 其它氧化物:H 2O 、CO 、Fe 3O 4 化合物 酸 物质碱盐 混合物:空气、水煤气、煤、石油、天然气、石灰石 可溶盐:K +、Na +、NH 4+、NO 3-、SO 42-(除BaSO 4)、Cl - (除AgCl)难溶盐:AgCl 、BaSO 4、CaCO 3、BaCO 3、Ag 2CO 3 可溶碱:NaOH 、KOH 、Ba(OH)2、Ca(OH)2难溶碱:Cu(OH)2、Fe(OH)3、Mg(OH)2 无氧酸:HCl 、H 2S含氧酸:H 2SO 4、HNO 3、H 2CO 3、H 3PO 4 可溶:K 2O 、Na 2O 、BaO 、CaO难溶:CuO 、Fe 2O 3、MgO 固态非金属:C 、S 、P 气态非金属:H 2、O 2、Cl 2、N 25.盐:滦听郟譯屢勋歸綻辇轨賣闫赝颅谅刿鉺拋鏝鋯狀绩誉备馑锬歸镖脫倫綣錘譜戩脱傳鱔漢蚂鸯額蕢当蔼殡譚鉻绪铃谗騸顿颶誠課顿胆译載獼。
初三化学酸碱盐知识点(最全整理版)

应用广泛的酸、碱、盐§ 7.1溶液的酸碱性一、酸性溶液和碱性溶液1.实验:检验溶液的酸碱性实验试样白醋酸果汁稀盐酸纯碱溶液肥皂水石灰水氨水食盐水蔗糖水滴加紫色石蕊试液变红变红变红变蓝变蓝变蓝变蓝紫色紫色滴加无色酚酞试液无色无色无色变红变红变红变红无色无色结论酸性酸性酸性碱性碱性碱性碱性中性中性结论:(1)凡是能使紫色石蕊试液变红的溶液都是酸性..溶液,并且该溶液不能使无色酚酞试液变色;(2)凡是能使紫色石蕊试液变蓝的溶液都是碱性..溶液,并且该溶液能使无色酚酞试液变红;(3)不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为中性溶液。
(4)如紫色石蕊试液及无色酚酞等能检验溶液酸碱性的试液,称为酸碱指示剂。
注意:①我们有时候还用蓝色或红色石蕊试纸来检验溶液的酸碱性;②酸性溶液能使蓝色石蕊试纸变红,碱性溶液能使红色石蕊试纸变蓝;③只有可溶性的酸性、碱性物质才能使指示剂变色,变色的是指示剂,而不是该物质。
2.日常生活中常见的酸性物质与碱性物质(1)酸性物质:山楂、柠檬、柑橘、西红柿等;(2)碱性物质:茶叶碱、烟碱等。
3.区分酸溶液和酸性溶液、碱溶液和碱性溶液注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
例如:硫酸铜、氯化铵的水溶液显酸性,而不是酸;纯碱、肥皂的水溶液显碱性,但不是碱。
4.补充知识:酸、碱、盐的概念(1)酸:电离时生成的阳离子全部..是氢离子的化合物。
如:HCl、HNO3、H2SO4、H2CO3等。
HCl==H++Cl-;H2SO4==2H++SO42-;(2)碱:电离时生成的阴离子全部..是氢氧根离子的化合物。
如:NaOH、Ca(OH)2等。
NaOH==Na++OH-;Ca(OH)2==Ca2++2OH-;(3)盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物。
九年级化学酸碱盐知识点总结(实用18篇)

九年级化学酸碱盐知识点总结(实用18篇)教师总结是教师专业成长的重要内容之一,可以提高教师的专业素养和教学水平。
小编精心整理了一些考试总结范文,供大家参考。
九年级化学酸碱盐知识点总结篇一一、物质的变化和性质:1物质的变化:物理变化:无新物质生成的变化;化学变化:有新物质生成的变化。
2物质的性质:物质不需发通过化学变化表现出来的性质,叫做物理性质,主要有颜色、状态、气味、硬度、密度、熔点、沸点等;物质必须通过化学变化才表现出来性质,叫做化学性质。
如可燃性氧化性、还原性、毒性等。
二、基本实验操作:1药品的取用:(1)取药量:没有说明用量,固体只需盖满试管底部,液体取1—2ml。
(2)注意事项:“三不”:不闻、不尝、不摸(3)取用少量液体药品用胶头滴管,取用一定量的液体药品用量筒量取,读数时,量筒必须放平,视线与液体凹液面的最低处保持水平。
取用较大量液体时用倾倒方法,瓶塞倒放,标签向手心,瓶口要紧靠容器口。
2物质的加热:(1)酒精灯的火焰分为外焰、内焰、焰心三部分,其中外焰温度。
(2)使用酒精灯时,酒精不能超过灯容积的2/3,绝对禁止用嘴吹灭酒精灯,要用灯帽盖熄。
(3)给试管液体加热,试管所盛液体体积不能超过试管容积的1/3,试管要倾斜放置,试管口不能对着自己或他人。
3仪器的洗涤:玻璃仪器洗涤干净的标准:在容器内壁既不聚成水滴,也不成股流下。
将本文的word文档下载到电脑,方便收藏和打印推荐度:点击下载文档搜索文档九年级化学酸碱盐知识点总结篇二物理性质取决于物质的结构。
金属通常是固体,但不是所有的金属都是固体。
金属通常很活泼,容易与空气中的氧气、酸和某些盐反应,生成氧化物和其他化合物。
如金属铁在潮湿的空气中容易被腐蚀,生成铁锈;金属铜容易产生铜绿等。
金属通常很活泼,但有的金属性质很稳定,一般不与物质反应。
置换反应的根本特征:单质+化合物====化合物+单质金属常见化合价有:+1、+2、+3。
常见+1价金属有:na+、k+、ag+等;铁在常温下不与氧气反应,在潮湿空气中,可与氧气反应,生成铁锈,但铁锈结构很疏松,不能阻碍外界空气继续与氧气反应,所以最终可完全被腐蚀生成铁锈。
(完整版)初中化学酸碱盐总结

(完整版)初中化学酸碱盐总结1、酸(1)使酸碱指示剂变色(非氧化性酸),紫色石蕊试液或蓝色石蕊试纸遇酸溶液变红色,无色酚酞试液遇酸溶液不变色(2)酸呈酸性(PH 值<7)(3)跟金属活动性顺序表(H)前的活泼金属的单质起置换反应(非氧化性酸)酸 + 金属—→盐 + 氢气【置换反应】例:2HCl+Fe=FeCl2+H2↑(4)跟碱性氧化物和某些金属氧化物反应酸 + 碱性(金属)氧化物—→盐+水例:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O(5)跟碱起中和反应酸+碱—→盐+水例:2HCl+Cu(OH)2=CuCl2+2H2O(6)与某些盐反应生成酸和新盐。
盐+酸=新盐+新酸,要依照复分解的条件来判断是否会发生反应例:BaCl2+H2SO4=BaSO4↓+2HCl{常见的酸:盐酸:物理性质:有刺鼻性气味和酸味的液体,易挥发,遇水蒸气形成白雾。
化学性质:有酸的通性用途:除锈,制药,胃液里的盐酸帮助消化。
硫酸:物理性质:纯硫酸是无色粘稠油状液体,不挥发。
硫酸特性:吸水性.脱水性.强氧化性。
稀硫酸有酸的通性。
2、碱非可溶性碱的性质:1、能与酸反应可溶性碱的通性:2、碱呈碱性碱能使紫色石蕊试液变蓝碱能使无色的酚酞试剂变红。
pH>73、与酸性氧化物反应注:碱 +酸性氧化物==盐 + 水【不是复分解反应】例:①Ca(OH)2+CO2=CaCO3↓+H2O②2NaOH+CO2=Na2CO3+H2O注:酸性氧化物不等于非金属氧化物4碱+酸=盐+水5碱+盐=碱+盐【反应物均可溶】{常见的碱:NaOH 俗称:烧碱。
火碱。
苛性钠。
物理性质:白色固体,易溶于水,溶解时放热明显,易潮解。
化学性质;有碱的通性。
用途:除油污。
用于肥皂造纸纺织印染。
Ca(OH)2 俗称:消石灰。
熟石灰。
物理性质:白色粉末,微溶于水。
化学性质:有碱的通性。
用途:水溶液用于检验二氧化碳,制烧碱。
改良酸性土壤。
砌砖抹墙。
3、盐1.能和酸反应生成新酸和新盐 2.能和酸性氧化物生成盐和水3.能和盐反应生成新碱和新盐酸与碱中和的产物(中和反应),由金属离子(包括铵根离子)与酸根离子构成。
初三化学酸、碱、盐九大知识点

初三化学酸、碱、盐九大知识点 氧化物、酸、碱和盐的知识点可以从以下十个方面掌握:【一】化学用语1、电离方程式H2SO4=2H++SO42- NaOH=Na++OH- Al2(SO4)3=2Al3++3SO42-2、物质的俗称和主要成分生石灰CaO 熟石灰、消石灰、石灰水的主要成分Ca(OH)2石灰石、大理石CaCO3 食盐的主要成分NaCl 纯碱、口碱Na2CO3烧碱、火碱、苛性钠NaOH 胆矾、蓝矾CuSO45H2O碳酸钠晶体Na2CO310H2O 氨水NH3H2O【二】化合物的分类【三】金属活动性1、金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
【四】酸、碱、盐的溶解性1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜?)钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁3、四个微溶物:Ca(OH)2(石灰水注明澄清的原因) CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因) MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁【五】分解反应发生的条件反应后有气体、水或沉淀生成。
初三化学酸碱盐知识点(最全整理版)

应用广泛的酸、碱、盐一.溶液的酸碱性一、酸性溶液和碱性溶液1.实验:检验溶液的酸碱性实验试样白醋酸果汁稀盐酸纯碱溶液肥皂水石灰水氨水食盐水蔗糖水滴加紫色石蕊试液变红变红变红变蓝变蓝变蓝变蓝紫色紫色滴加无色酚酞试液无色无色无色变红变红变红变红无色无色结论酸性酸性酸性碱性碱性碱性碱性中性中性结论:(1)凡是能使紫色石蕊试液变红的溶液都是酸性..溶液,并且该溶液不能使无色酚酞试液变色;(2)凡是能使紫色石蕊试液变蓝的溶液都是碱性..溶液,并且该溶液能使无色酚酞试液变红;(3)不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为中性溶液。
(4)如紫色石蕊试液及无色酚酞等能检验溶液酸碱性的试液,称为酸碱指示剂。
注意:①我们有时候还用蓝色或红色石蕊试纸来检验溶液的酸碱性;②酸性溶液能使蓝色石蕊试纸变红,碱性溶液能使红色石蕊试纸变蓝;③只有可溶性的酸性、碱性物质才能使指示剂变色,变色的是指示剂,而不是该物质。
2.日常生活中常见的酸性物质与碱性物质(1)酸性物质:山楂、柠檬、柑橘、西红柿等;(2)碱性物质:茶叶碱、烟碱等。
3.区分酸溶液和酸性溶液、碱溶液和碱性溶液注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
例如:硫酸铜、氯化铵的水溶液显酸性,而不是酸;纯碱、肥皂的水溶液显碱性,但不是碱。
4.补充知识:酸、碱、盐的概念(1)酸:电离时生成的阳离子全部..是氢离子的化合物。
如:HCl、HNO3、H2SO4、H2CO3等。
1HCl==H++Cl-;H2SO4==2H++SO42-;(2)碱:电离时生成的阴离子全部..是氢氧根离子的化合物。
如:NaOH、Ca(OH)2等。
NaOH==Na++OH-;Ca(OH)2==Ca2++2OH-;(3)盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物。
九年级酸碱盐知识点归纳总结

九年级酸碱盐知识点归纳总结酸碱盐是初中化学中的重要内容之一,而对于九年级的学生来说,更需要全面了解酸碱盐的相关知识。
本文将对九年级酸碱盐知识点进行归纳总结,旨在帮助学生更好地掌握这一部分内容。
一、酸碱与物质性质1.酸的性质:(1)酸的味道酸酸的,有酸的气味;(2)酸可以腐蚀金属;(3)酸可以变红蓝石蕊纸;(4)酸和碱反应会产生中和反应。
2.碱的性质:(1)碱的味道苦苦的,有碱的气味;(2)碱可以腐蚀皮肤;(3)碱可以变红蓝石蕊纸;(4)碱和酸反应会产生中和反应。
3.酸碱指示剂:(1)酸性溶液红色指示剂为苏丹红;(2)中性溶液无色指示剂为水;(3)碱性溶液蓝色指示剂为甲基橙。
二、常见酸碱盐的性质1.酸:(1)盐酸(HCl):无色液体,具有刺激性气味,可以和金属反应产生氢气。
(2)硫酸(H2SO4):无色液体,具有刺激性气味,可以和金属反应产生氢气。
2.碱:(1)氢氧化钠(NaOH):固体,有腐蚀性,可溶于水,会和酸反应产生化学反应热。
(2)氢氧化钾(KOH):固体,有腐蚀性,可溶于水,会和酸反应产生化学反应热。
3.盐:(1)氯化钠(NaCl):白色结晶体,无味,可溶于水。
(2)硝酸钙(Ca(NO3)2):无色结晶体,无味,可溶于水。
三、酸碱中和反应1.酸碱反应的表达方式:酸 + 碱→ 盐 + 水2.实验条件:通常情况下,酸碱反应需要在水介质中进行,在适当的温度和压力下进行反应。
3.常见的酸碱反应:(1)盐酸与氢氧化钠的反应:HCl + NaOH → NaCl + H2O(2)硫酸与氢氧化钾的反应:H2SO4 + 2KOH → K2SO4 + 2H2O四、酸碱盐的应用1.食品酸碱度调节:食品加工中常使用果酸、醋酸等酸性物质和氢氧化钠、氢氧化钙等碱性物质进行食品酸碱度的调节,以改善食品口感和保鲜效果。
2.肥料制备:磷酸和钾肥是常见的植物肥料,可以提供植物所需的营养元素。
3.药品制备:碱性药品常用于中和胃酸,如制备抗酸药和抑酸剂等。
初三化学《酸-碱-盐》知识点总结

初三化学《酸-碱-盐》知识点总结work Information Technology Company.2020YEAR初三化学《酸-碱-盐》知识点总结一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物 如:硫酸(H 2SO 4)、盐酸(HCl )、硝酸(HNO 3) 碱是由金属元素和氢氧根组成的化合物 如:氢氧化钠、氢氧化钙、氨水(NH 3·H 2O )盐是由金属元素元素(或铵根)和酸根组成的化合物 如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子) 二、酸12(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色 (2)金属 + 酸 → 盐 + 氢气 (3)碱性氧化物 + 酸 → 盐 + 水 (4)碱 + 酸 → 盐 + 水(5)盐 + 酸 → 另一种盐 + 另一种酸(产物符合复分解条件) 312(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱 → 盐+水 (3)酸+碱 → 盐+水(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件) 注:①难溶性碱受热易分解(不属于碱的通性) 如Cu(OH)2 ΔCuO +H 2O 2Fe(OH)3 ΔFe 2O 3+3H 2O②常见沉淀:AgCl ↓ BaSO 4↓ Cu(OH)2↓ F e(OH)3↓ Mg(OH)2↓ BaCO 3↓ CaCO 3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
1、定义:酸与碱作用生成盐和水的反应2、应用:(1)改变土壤的酸碱性 (2)处理工厂的废水 (3)用于医药3、溶液酸碱度的表示法——pH(1(2)pH 的测定:最简单的方法是使用pH 试纸用玻璃棒(或滴管)蘸取待测试液少许,滴在pH 试纸上,显色后与标准比色卡对照,读出溶液的pH (读数为整数)(3)酸雨:正常雨水的pH 约为5.6(因为溶有CO 2)pH<5.6的雨水为酸雨第十一单元 《盐 化肥》知识点+二、粗盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
初三酸碱盐知识点归纳总结

初三酸碱盐知识点归纳总结酸碱盐是我们初中化学学习的基础知识之一,它涉及到许多重要的概念和原理。
在初三学习化学的过程中,我们需要对酸碱盐的知识点进行归纳总结,以便更好地理解和记忆。
本文将对初三酸碱盐的知识点进行归纳总结,希望对同学们的学习有所帮助。
一、酸碱盐的基本概念1. 酸:指在水溶液中能产生氢离子(H+)的化合物,其特征为有酸味,能与金属反应产生氢气,能蚀刻金属等。
2. 碱:指在水溶液中能产生氢氧根离子(OH-)的化合物,其特征为有碱味,能与酸中和生成盐和水。
3. 酸碱指数:用来表示溶液中氢离子(H+)和氢氧根离子(OH-)的浓度的指标,pH值越低,酸性越强,pH值越高,碱性越强。
中性溶液的pH值为7。
4. 盐:是由酸和碱反应生成的化合物,由阳离子和阴离子组成,可以是无机盐或有机盐。
二、酸碱盐的性质及实验现象1. 酸的性质:酸能与金属反应产生氢气,能与碱中和生成盐和水,能与碱金属产生一氧化碳和水,能与碳酸饮料中的二氧化碳反应产生气泡。
2. 碱的性质:碱能与酸中和生成盐和水,能与酸酸性气体反应生成盐和水,能与盐酸蒸发结晶再溶解。
3. 盐的性质:盐能够溶解在水中形成溶液,具有一定的导电性,可以产生氯气或氯气气味。
三、常见的酸碱盐及其应用1. 硫酸:常用于制造化肥、制酸和电池等。
2. 盐酸:广泛应用于制备洗涤剂、金属清洗剂以及漂白剂等。
3. 碳酸氢钠:又称小苏打,常用于烘焙食品和中和酸性反应。
4. 氨水:常用于清洁玻璃、染料生产和调节土壤酸碱度等。
5. 醋酸:常用于食品调味、制备漂白杀菌剂等。
四、酸碱指示剂1. 甲基橙:当溶液为酸性时,呈红色;为碱性时,呈黄色。
2. 酚酞:当溶液为酸性时,呈无色或浅黄色;为碱性时,呈粉红色。
3. 金黄色素:当溶液为酸性时,呈红色;为碱性时,呈黄色。
五、常见的酸碱盐反应方程式1. 酸和金属反应:例如:2HCl + Zn → ZnCl2 + H2↑2. 碱和酸反应:例如:2NaOH + H2SO4 → Na2SO4 + 2H2O3. 酸和碱反应:例如:HCl + NaOH → NaCl + H2O4. 酸和酸性气体反应:例如:2HCl + CO2 → H2O + CO2↑六、实验室常见的制备酸碱盐实验1. 制备盐酸:将氯气通入稀硫酸溶液中,生成盐酸气体,再用冷却器冷却收集。
九年级化学酸碱盐知识点总结归纳

九年级化学酸碱盐知识点总结归纳化学是一门研究物质组成、性质和变化规律的科学,而酸碱盐则是化学中重要的基础知识之一。
在九年级的化学学习中,我们深入学习了酸碱盐相关的知识,本文将对这些知识点进行总结和归纳。
一、酸碱与酸碱盐的基础概念1. 酸:酸是能够产生H+离子(质子)的化合物,具有酸性的性质。
常见的酸有盐酸、硫酸等。
2. 碱:碱是能够产生OH-离子(氢氧根离子)的化合物,具有碱性的性质。
常见的碱有氢氧化钠、氢氧化钙等。
3. 酸碱反应:酸与碱反应可以生成盐和水,称为酸碱中和反应。
反应的一般式子为:酸 + 碱→ 盐 + 水。
4. 酸碱指示剂:酸碱指示剂是用来检验溶液酸碱性的物质,常见的有酚酞、中性红等。
二、酸碱盐的命名和性质1. 酸的命名:酸的命名根据所含阴离子的不同,可以分为普通酸和氧化酸。
普通酸的命名规则为“酸性氧化物名+酸”,如盐酸(氯化氢酸),硫酸(二氧化硫酸)。
氧化酸的命名规则为“非金属元素名+酸”,如硝酸(氮酸)。
2. 碱的命名:碱的命名通常根据阳离子的不同,有单质金属碱和金属氧化物碱。
单质金属碱的命名规则为“金属元素名+氢氧化物”,如氢氧化钠,氢氧化钾。
金属氧化物碱的命名规则为“金属氧化物名”,如氧化钠,氧化钙。
3. 盐的命名:盐的命名通常根据阳、阴离子的种类和性质来命名,如氯化钠、硫酸铜等。
4. 酸碱盐的性质:酸性物质具有酸味,酸性物质与金属反应会产生氢气;碱性物质具有碱味,碱性物质与酸反应会产生盐和水;盐是酸与碱中和反应的产物,属于晶体固体。
三、酸碱盐的常见应用和相关实验1. 酸碱盐在生活中的应用:酸碱盐广泛应用于生产和生活中。
常见的应用有:酸性物质用作清洁剂和脱垢剂,如醋酸;碱性物质用作洗涤剂和清洁剂,如氢氧化钠;盐广泛应用于调味食品和制作肥料等。
2. 酸碱中和实验:通过酸碱中和实验可以观察酸碱反应的现象与产物。
实验中,我们可以用酚酞或中性红作为酸碱指示剂,观察酸和碱溶液反应的结果,以此来判断其酸碱性。
初中化学酸碱盐知识归纳

一、概念:1. 酸的组成——氢离子+酸根离子2. 碱的组成——金属离子+氢氧根离子3. 盐的组成——金属离子+酸根离子4. 复分解反应——由两种化合物互相交换成分, 生成另外两种化合物的反应, 叫做复分解反应。
AB+CD=AD+CB5. 稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里, 并不断搅动, 使产生的热量迅速地扩散, 切不可把水倒入浓硫酸里。
6. 中和反应——酸跟碱作用生成盐和水的反应叫做中和反应。
二、熟记常见元素和原子团的化合价口诀:(正价)一氢钾钠银, 二钙镁钡锌, 三铝、四硅、五氮磷。
(负价)负一价: 氟、氯、溴、碘;负二价: 氧和硫。
(可变正价): 一二铜汞, 二三铁, 二四碳, 四六硫。
(原子团的化合价负一价: 氢氧根(OH), 硝酸根(NO3), 氯酸根(ClO3), 高锰酸根(MnO4);负二价: 硫酸根(SO4), 碳酸根(CO3), 亚硫酸根(SO3), 锰酸根(MnO4);负三价: 磷酸根(PO4);正一价: 铵根(NH4)。
三、熟记下列反应方程式:(一)酸的性质(1)与指示剂反应紫色石蕊试液变红色, 无色酚酞试液不变色。
(2)酸+碱=盐+水。
(3)酸+某些金属氧化物=盐+水。
(4)酸+活泼金属=盐+氢气。
(5)酸+盐=新盐+新酸。
1. 锌跟稀盐酸反应: Zn + 2HCl = ZnCl2 + H2 ↑有气泡产生, 锌粒逐渐减少。
2. 锌跟稀硫酸反应: Zn + H2SO4 = ZnSO4 + H2 ↑3. 铁跟稀盐酸反应: Fe + 2HCl = FeCl2 + H2 ↑有气泡产生, 铁逐渐减少,4. 铁跟稀硫酸反应: Fe + H2SO4 =FeSO4 + H2 ↑溶液变成浅绿色。
5. 铁锈跟稀盐酸反应: Fe2O3 +6HCl = 2FeCl3 + 3H2O 红色铁锈逐渐消失,6. 铁锈跟稀硫酸反应: Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 溶液变成黄色7、氧化铜跟稀盐酸反应: CuO + 2HCl =CuCl2 +H2O 黑色氧化铜逐渐消失,8、氧化铜跟稀硫酸反应: CuO + H2SO4 = CuSO4 + H2O 溶液变成蓝色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学酸碱盐知识点总结89674收集于网络,如有侵权请联系管理员删除 初中化学酸碱盐知识点总结一、物质的分类:二、各类物质的主要化学性质: 1.单质: 1)金属:2)非金属 + 氧气 → 氧化物 2.氧化物:1)酸性氧化物:2)碱性氧化物:3)水: 3.酸:4.碱:0 +2 Fe → Fe氧气→氧化物金属+ 酸→盐+氢气(①H 前面的金属;②不能是浓硫酸和硝酸) 盐→盐+金属(①排在前面的金属;②可溶性盐)酸性氧化物+ 水→酸 碱→盐+水(可溶性碱)碱性氧化物+ 水→碱(可溶性碱)酸→盐+水 酸性氧化物→酸水+ 碱性氧化物→碱(可溶性碱) CuSO 4→CuSO 4·5H 2O 石蕊变红;酚酞不变色金属→盐+氢气(①H 前面的金属;②不能是浓硫酸和硝酸) 酸+ 碱性氧化物→盐+水 碱→盐+水盐→酸+盐(可溶反应物能生成↓、↑、H 2O ;难溶反应物能生成↑、H 2O )石蕊变蓝;酚酞变红(可溶性碱) 酸性氧化物→盐+水(可溶性碱) 酸→盐+水盐→盐+碱(反应物必须可溶且生成物之一必须是不溶物)碱+金 属:Fe 、Cu 、Mg 、Al 单 质 稀有气体:He 、Ne 、Ar非金属纯净物 酸性氧化物:CO 2、SO 2、SO 3氧化物 碱性氧化物其它氧化物:H 2O 、CO 、Fe 3O 4化合物 酸 物质 碱 盐 混合物:空气、水煤气、煤、石油、天然气、石灰石 可溶盐:K +、Na +、NH 4+、NO 3-、SO 42-(除BaSO 4)、Cl - (除AgCl)难溶盐:AgCl 、BaSO 、CaCO 、BaCO 、Ag CO 可溶碱:NaOH 、KOH 、Ba(OH)2、Ca(OH)2 难溶碱:Cu(OH)2、Fe(OH)3、Mg(OH)2无氧酸:HCl 、H 2S含氧酸:H 2SO 4、HNO 3、H 2CO 3、H 3PO 4 可溶:K 2O 、Na 2O 、BaO 、CaO 难溶:CuO 、Fe 2O 3、MgO固态非金属:C 、S 、P气态非金属:H 2、O 2、Cl 2、N 2收集于网络,如有侵权请联系管理员删除5.盐:三、化学反应的基本类型:1)化合反应:(有单质时化合价改变)⑴单质+单质→化合物 Mg + O 2 = P + O 2 = ⑵单质+化合物→化合物 C + CO 2 =⑶化合物+化合物→化合物 CaO + H 2O = CuSO 4 + H 2O = 2)分解反应:(有单质时化合价改变)⑴氧化物分解 H 2O = HgO = ⑵酸分解 H 2CO 3 =⑶盐分解 KMnO 4 = KClO 3 = CaCO 3 = CuSO 4·5H 2O = 3)置换反应:(化合价一定改变)⑴金属+酸→盐+氢气(①H 前面的金属;②不能是浓硫酸和硝酸) Fe + HCl = Al + H 2SO 4 =⑵金属+盐→盐+金属(①排在前面的金属;②可溶性盐) Fe + CuSO 4 = Cu + AgNO 3 =⑶金属氧化物+H 2(或C)→金属+水(或CO 2) CuO + H 2 = C + Fe 2O 3 = 4)复分解反应:(化合价一定不变) ⑴碱性氧化物+酸→盐+水Fe 2O 3 + HCl = CuO + H 2SO 4 = ⑵酸+碱→盐+水NaOH + H 2SO 4 = Fe(OH)3 + HCl =⑶酸+盐→盐+酸(可溶反应物能生成↓、↑、H 2O ;难溶反应物能生成↑、H 2O ) H 2SO 4 + BaCl 2 = HCl + CaCO 3 =⑷碱+盐→碱+盐(反应物必须可溶且生成物之一必须是不溶物) Ca(OH)2 + Na 2CO 3 = NaOH + FeCl 3 =⑸盐+盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物) CaCl 2 + K 2CO 3 = Ba(NO 3)2 + Na 2SO 4 = ※不属于四种基本类型的反应:⑴金属氧化物+CO →金属+CO 2 Fe 2O 3 + CO = ⑵碱+酸性氧化物→盐+水(可溶性碱) NaOH + CO 2 = ⑶有机物+O 2→H 2O +CO 2 C 2H 5OH + O 2 = ☆氧化还原反应:得到氧的物质被氧化,发生氧化反应,是还原剂;金属→盐+金属(①排在前面的金属;②可溶性盐)酸→盐+酸(可溶反应物能生成↓、↑、H 2O ;难溶反应物能生成↑、H 2O ) 碱→盐+碱(反应物必须可溶且生成物之一必须是不溶物) 盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)盐+失去氧的物质被还原,发生还原反应,是氧化剂。
如:在2Mg+CO 2 点燃 2MgO+C 中, 是氧化剂, 是还原剂, 被氧化, 被还原。
☆常见的原子团及其化合价:四、金属活动性顺序和复分解反应发生的条件: 1.金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au———————————————————————→ 金属活动性由强逐渐减弱1、金属位置越靠前,金属活动性就越强;2、位于氢前面的金属能置换出酸中的氢;3、前面的金属能把后面的金属从它们的盐溶液中置换出来。
⑴判断金属与酸反应时:金属必须排在(H)前面;酸不可用硝酸。
⑵判断金属与盐反应时:必须同时满足①排在前面的金属;②可溶性盐。
2.复分解反应发生的条件:⑴可溶的反应物,能生成↓、或H 2O 、或↑(CO 2或NH 3) ⑵难溶的反应物,能生成↑、或H 2O ☆复分解反应生成的沉淀:五、物质的鉴别、鉴定(检验)、提纯(除杂)、分离: AgCl BaSO 4难溶性盐 CaCO 3 BaCO 3 Ag 2CO 3 Mg(OH)2难溶性碱 Cu(OH)2 Fe(OH)3(白色) (白色) (白色) (白色) (白色) (蓝色) (红褐色)可溶于酸难溶于酸+1 -1 -2 -2 -1NH 4Cl NaOH H 2SO 4 H 2CO 3 HNO 3铵根 氢氧根 硫酸根 碳酸根 硝酸根铵根中N 为-3价;硫酸根中S 为+6价;碳酸根中C 为+4价;硝酸根中N 为+5价。
六、气体的干燥:①酸性干燥剂:浓硫酸、P2O5⑴干燥剂②碱性干燥剂:固体CaO、固体NaOH③中性干燥剂:无水CuSO4①酸性气体:CO2、SO2、H2S、HCl⑵气体②碱性气体:NH3③中性气体:H2、O2、CH4、CO注意:酸性干燥剂不能用于干燥碱性气体;碱性干燥剂不能用于干燥酸性气体。
七、其他:1.物质的学名、俗名及化学式:⑴水银、汞、Hg⑵金刚石、石墨、C;硫磺、S;红磷、白磷、P⑶干冰、固体CO2⑷生石灰、氧化钙、CaO;氨气、NH3(碱性气体)⑸盐酸、氢氯酸、HCl;氢硫酸、H2S;亚硫酸、H2SO3⑹熟石灰、消石灰、Ca(OH)2;苛性钠、烧碱、火碱、NaOH;氨水、NH3·H2O(碱)⑺纯碱、Na2CO3;碳酸钠晶体、纯碱晶体、Na2CO3·10H2O;碳酸氢钠、小苏打、NaHCO3;亚硝酸钠、NaNO2(工业用盐);胆矾、蓝矾、硫酸铜晶体、CuSO4·5H2O;铜绿、Cu2(OH)2CO3⑻甲烷、CH4;甲醇、CH3OH;酒精、乙醇、C2H5OH;醋酸、乙酸、(冰醋酸)CH3COOH2.常见混合物的主要成分:煤:C;石油:C、H、O元素天然气:CH4水煤气:H2、CO 石灰石、大理石:CaCO3石灰水、石灰乳、石灰浆:Ca(OH)23.常见物质的颜色:△白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4△银白色:镁、铝、锌、铁、汞(液态)△黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4△红色固体:Cu、Fe2O3、HgO、红磷△蓝色晶体:CuSO4·5H2O△KMnO4为紫黑色△硫:淡黄色△ Cu2(OH)2CO3为绿色4.溶液的颜色:△含Cu2+的溶液呈蓝色(CuCl2溶液为蓝绿色);△含Fe2+的溶液呈浅绿色;△含Fe3+的溶液呈黄色;△其余溶液一般为无色。
(高锰酸钾溶液为紫红色)5.溶于水放热的物质:CaO、NaOH固体、浓H2SO4收集于网络,如有侵权请联系管理员删除6.刺激性气味的气体:NH3、SO2、HCl(均无色)▲刺激性气味的液体:盐酸、硝酸、醋酸▲酒精为有特殊气体的液体7.有毒的物质:CO、CH3OH、NaNO2、Cu2+(如CuSO4)、Ba2+(如BaCl2)初中化学知识点总结-----酸碱盐提要:酸碱盐是初中化学的重点和难点,本文力求把相关内容按知识呈现的规律,让你掌握这些知识后就能对酸碱盐的复习有所突破。
一、溶液的导电性1、有些化合物的水溶液能够导电的原因是什么?------原因是溶液中有自由移动的离子。
2、哪些物质的水溶液能够导电?---------------------------酸、碱、盐的水溶液能够导电。
二、酸、碱、盐的概念1、什么是酸?电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
可表示为:酸---→氢离子(阳离子)+酸根离子(阴离子)如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)、碳酸(H2CO3)2、什么是碱?收集于网络,如有侵权请联系管理员删除电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
可表示为:碱---→金属离子(阳离子)+氢氧根离子(阴离子)如:氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氨水(NH3·H2O)3、什么是盐?由金属离子和酸根离子组成的化合物叫做盐。
可表示为:盐---→金属离子(阳离子)+酸根离子(阴离子)如:氯化钠NaCl 、碳酸钠(Na 2CO3)、硝酸银(AgNO3)碳酸氢钠(NaHCO3)三、常见的酸及酸的通性1、浓盐酸、浓硫酸的物理性质、特性、用途2、酸的通性(具有通性的原因:酸溶液中都有氢离子)(1)与酸碱指示剂的反应:酸溶液能使紫色石蕊试液变红色,不能使无色酚酞试液变色。
(2)金属 + 酸→盐 + 氢气(置换反应)条件:(1)金属:在金属活动性顺序中排在氢前面的金属;收集于网络,如有侵权请联系管理员删除(2) 酸:无氧化性酸。
如盐酸、稀硫酸(除外:浓硫酸、硝酸有氧化性与金属反应不生成氢气)。
[注意]铁与酸发生置换反应时生成亚铁盐(Fe为+2价)(3)金属氧化物 + 酸→盐 + 水(复分解反应)(4)碱 + 酸→盐 + 水(复分解反应)(5)盐 + 酸→另一种盐 + 另一种酸(复分解反应)条件:生成物中沉淀、气体或水。
练习:利用酸的通性写出四个生成氯化镁的化学方程式3、三种离子的检验三、常见的碱的物理性质、俗名、制法及用途1、氢氧化钠、氢氧化钙的物理性质、用途收集于网络,如有侵权请联系管理员删除2、碱的通性(具有通性的原因:碱溶液中都有氢氧根离子)(1)与酸碱指示剂的反应:碱溶液使紫色石蕊试液变蓝色,使无色酚酞试液变红色(难溶于水的碱不能使指示剂变色)(2)非金属氧化物+碱→盐+水(不是复分解反应)(3)酸+碱→盐+水(4)盐+碱→另一种盐+另一种碱条件:反应物均可溶,生成物中有沉淀、气体或水。
