判断几何构型
几何构型的判断方法

几何构型的判断方法一、引言几何构型是指由几何图形或形状组成的特定模式或结构。
在几何学中,判断几何构型的方法多种多样。
本文将介绍几种常见的几何构型判断方法,包括对称性、相似性、共线性、垂直性和平行性等。
二、对称性判断方法对称性是指物体或图形在某个轴线或平面上具有镜像对称的特性。
判断对称性的方法主要有以下几种:1. 轴对称法:通过寻找轴线来判断图形是否具有对称性。
如果图形可以沿某条直线折叠后两部分完全重合,则该图形是轴对称的。
2. 中心对称法:通过寻找中心点来判断图形是否具有对称性。
如果图形的每个点关于中心点对称,则该图形是中心对称的。
3. 线对称法:通过寻找线段来判断图形是否具有对称性。
如果图形的每个点关于一条线段对称,则该图形是线对称的。
三、相似性判断方法相似性是指两个图形在形状上具有相似比例关系的特性。
判断相似性的方法主要有以下几种:1. 角度相等法:如果两个图形的对应角度相等,则它们是相似的。
2. 边长比例法:如果两个图形的对应边长之比相等,则它们是相似的。
3. 直角边比例法:如果两个直角三角形的斜边比相等,则它们是相似的。
四、共线性判断方法共线性是指三个或更多个点在同一条直线上的特性。
判断共线性的方法主要有以下几种:1. 三点共线法:如果三个点在同一条直线上,则它们是共线的。
2. 共线向量法:如果两个向量共线,则它们所表示的点也是共线的。
3. 斜率相等法:如果两条直线的斜率相等,则它们是共线的。
五、垂直性判断方法垂直性是指两条直线或线段之间的相互垂直关系。
判断垂直性的方法主要有以下几种:1. 斜率互为负倒数法:如果两条直线的斜率互为负倒数,则它们是垂直的。
2. 两条直线的乘积为-1法:如果两条直线的斜率的乘积为-1,则它们是垂直的。
3. 两条线段的内积为0法:如果两个线段的向量的内积为0,则它们是垂直的。
六、平行性判断方法平行性是指两条直线或线段之间的相互平行关系。
判断平行性的方法主要有以下几种:1. 斜率相等法:如果两条直线的斜率相等,则它们是平行的。
分子几何构型判断3

一、 轨道杂化理论 ( Pauling, 1931) Hybridization Theory
1、轨道的杂化 、 在同一个原子中能量相近的不同类型的几 个原子轨道在成键时可以相互叠加而组成同等 个原子轨道在成键时可以相互叠加而组成同等 数量的能量完全相同的杂化原子轨道 数量的能量完全相同的杂化原子轨道 原子形成杂化轨道的一般过程 激发 杂化 轨道重叠
• 孤对电子相对来说带有较多的负电荷。受孤 孤对电子相对来说带有较多的负电荷。 对电子云的排斥, 分子中N- 键间的夹 对电子云的排斥,NH3分子中 -H键间的夹 角被压缩为107º,H2O分子中 分子中O—H键间的夹 角被压缩为 , 分子中 键间的夹 角被压缩到104º40¹。 角被压缩到 。 • 含有孤对电子的杂化被称为不等性杂化。 含有孤对电子的杂化被称为不等性杂化。 不等性杂化 NH3和H2O分子中 和O都发生了不等性 3杂 分子中N和 都发生了不等性 都发生了不等性sp 分子中 化
• 四个 3 杂化轨道在空间均匀对称地分布 四个sp 杂化轨道在空间均匀对称地分布— —以碳原子核为中心,伸向正四面体的四个 以碳原子核为中心, 以碳原子核为中心 顶点。 顶点。这四个杂化轨道的未成对电子分别与 氢原子的1s电子配对成键 电子配对成键, 氢原子的 电子配对成键,这就形成了甲烷 分子。 分子。
②sp2杂化
分子时, • 碳原子在形成乙烯(C2H4)分子时,每个碳原 碳原子在形成乙烯( 子的2S轨道与两个 轨道发生杂化,称为sp 轨道与两个2p轨道发生杂化 子的 轨道与两个 轨道发生杂化,称为 2杂 杂化后形成3个杂化轨道 它们的形状与sp 个杂化轨道。 化。杂化后形成 个杂化轨道。它们的形状与 3 杂化轨道相似, 杂化轨道相似,在空间以碳原子梭为中心指向平 面正三角形的三个顶点。 面正三角形的三个顶点。 • 未杂化的 个2p轨道则垂直于杂化轨道所在的平 未杂化的l个 轨道则垂直于杂化轨道所在的平 面。3个sp2杂化轨道与未杂化的 1个2p轨道各有 个 个 轨道各有 1个未成对电子。两个碳原子分别以 个sp2杂化 个未成对电子。 个未成对电子 两个碳原子分别以1个 轨道互相重叠形成σ 两个碳原子的另外4个 轨道互相重叠形成σ键,两个碳原子的另外 个 sp2杂化轨道分别与氢原子结合。 杂化轨道分别与氢原子结合。
价层电子对互斥理论

a ) 键角 角度小时,电对距离近,斥力大 ; b ) 电子对的种类 角度相同时,
孤对电子 —— 孤对电子 斥力最大 因为负电集中。
孤对电子 —— 成键电对 斥力居中
成键电对 —— 成键电对 斥力最小 因为有配体原子 核会分散电对的负电。
结论 要尽量避免具有较大斥力的电子对分布在互成 90°
的方向上。
2
● 确定电子对的空间排布方式
中心原子上不含孤对电子的共价分子的几何形状
通式 AB2
共用 电子对
2
原子A在原子B周围的排列方式 (理想的BAB键角)
直线(180°)
结构
AB3
3
平面三角形(120°)
AB4
4
正四面体(109°28’)
AB5
5
AB6
6
三角双锥(BaABa, 180°) (BeABe, 120°) (BeABa, 90°) Ba–轴向B原子,Be平伏B原子
19
5 对电子,4 个配体,1 对孤对电子,有 2 种情况供选择 :
甲
乙
孤对 - 孤对
0
0
孤对 - 成键
2
3
成键 - 成键
4
3
从 90 °方向上的分布情况看,‘ 甲 ’ 稳定,称变形四面体。
5 对电子,3 个配体,2 对孤对电子,有 3 种情况供选择 :
甲
乙
丙
孤对 - 孤对 0
0
1
孤对 - 成键 6
化,由原子核间产生相对位移,即键长,键角变化引起的。
诱导极化又称形变极化,对于极性分子还有定向极化,极性
分子在电场中永久偶极矩转到与电场方向反平行,采取择优
引起的,诱导极化产生诱导偶极矩 ,
选修二2.2.3 解题策略 分子的空间结构及判断方法

sp
1个ns和 1个np
轨道夹角 180°
实例
CO2
sp2
1个ns和 2个np
120°
BF3
sp3
1个ns和 3个np
109°28 ′ CH4
【典例1】下列分子中,中心原子杂化轨道类型相同,分子的空间结构也相
同的是( )
A.H2O、SO2 答案 B
B.BeCl2、CO2
C.H2O、NH3
D.NH3、CH2O
VSEPR模型
分子或离子的立体构型。
2.确定分子或离子的立体构型。
①若中心原子A无孤电子对,则分子或离子的立体构型为价层电子对的立体构
型—VSEPR模型。
②若中心原子A有孤电子对,则分子或离子的立体构型为略去中心原子孤电子
对后的成键电子对的立体构型。
【三言两语话重点】
(1)1个公式:
1
中心原子的价层电子对数=σ键电子对数+ 2 (a-xb)。
空间结构 间结构
直线形 直线形
三角形
三角形 V形
正四面体形
四面体形 三角锥形
V形
实例
BeCl2 BF3
SnBr2 CH4 NH3 H2O
3.利用键角判断 一般来说,高中阶段知道了多原子分子中的键角数据,就可确 定该分子的空间几何构型。常见分子的键角与分子构型如下表:
分子 硫化氢
水
氨
甲烷
二氧化碳
键角 约90° 105°
107° 109°28′
180°
分子构型 V形
V形 三角锥形 正四面体形 直线形
分子 白磷 三氯化硼 乙烯
乙炔
苯
键角 60° 120°
120°
结构化学题库与答案(9)

结构化学题库与答案(9)《结构化学》第五章习题5001 NF 3和NH 3分⼦中,键⾓∠FNF ⽐∠HNH 要(a ),这是因为(b )。
5002 写出下列分⼦的结构式(标明单键和多重键等键型)和⽴体构型:(1) Al 2Cl 6 ,(2) HN 3 ,(3) Fe(CO)3(η4- C 4H 4) ,(4) XeOF 4 ,(5) XeF 4 5003 NH 3和PH 3分⼦键⾓值⼤者为___________________分⼦。
5004 ⽤价电⼦对互斥理论推断: PF 4+的构型为_________________,中⼼原⼦采⽤的杂化轨道为_____________________: XeF 4的构型为___________________,中⼼原⼦采⽤的杂化轨道为________________________。
5005 写出下述分⼦中中⼼原⼦的杂化⽅式及分⼦的⼏何构型:HgCl 2_________________: Co(CO)4-__________________:BF 3___________________: Ni(CN)42-__________________。
5006 sp 2(s ,p x ,p y )等性杂化轨道中,若1ψ和x 轴平⾏,2ψ和y 轴成30°,1ψ,2ψ,3ψ互成120°。
请写出满⾜正交归⼀化条件的三个杂化轨道表达式:1ψ______________________________:2ψ______________________________:3ψ______________________________。
5007 O 3的键⾓为116.8°,若⽤杂化轨道ψ=c 1s 2ψ+c 2p 2ψ描述中⼼O 原⼦的成键轨道,试按键⾓与轨道成分关系式cos θ=-c 12/c 22,计算:(1) 成键杂化轨道中c 1和c 2值;(2) ψ2s 和ψ2p 轨道在杂化轨道ψ中所占的⽐重。
中级无机化学王明召-第四章习题答案-配位化学

教材第三章 配位化学习题及答案3.1 试判断下列配离子的几何构型和电子结构:[Co (CN )6]3-(抗磁性);[NiF 6]4-(两个成单电子); [CrF 6]4-(4个成单电子);[AuCl 4]-(抗磁性); [FeCl 4]-(5个成单电子);[NiF 6]2-(抗磁性)答案:[Co (CN )6]3-(抗磁性):八面体,O h 强场,低自旋,电子结构为t 2g 6e g 0; [NiF 6]4-(两个成单电子):八面体,O h 弱场,高自旋,电子结构为t 2g 6e g 2; [CrF 6]4-(4个成单电子):八面体,O h 弱场,高自旋,电子结构为t 2g 3e g 1; [AuCl 4]-(抗磁性):平面正方形,D 4h 场,电子结构为(d xz 2,d yz 2 )d z22d xy 2d x2-y20; [FeCl 4]-(5个成单电子):四面体,T d 场,电子结构为e 2t 23; [NiF 6]2-(抗磁性):八面体,O h 强场,低自旋,电子结构为 t 2g 6 e g 0 。
3.2 画出下列各配合物(配离子)所有可能的异构体:[CoCl 2(NH 3)4]+,[Be (gly )2],[RhBr 2(en )2]+,[PtBr 2Cl 2(en )], [Ir (C 2O 4)2Cl 2]3-,[Cr (gly )3],[Pt (gly )2](gly =glycine ,甘氨酸) 答案:[CoCl 2(NH 3)4]+:ClNH 3H 3NH 3NCoClNH 3NH 3NH 3H 3NH 3NCoClClcis - trans -[Be (gly )2] gly =甘氨酸,NH 2CH 2COOH :NONOBeONN O Becis - trans - [RhBr 2(en )2]+:NNNNRhBrBrNBrNNRhNBrNNNBrRhNBrtrans - cis - cis - [PtBr 2Cl 2(en )]:BrBrNNPtClClClClNNPtBrBrBrClNNPtBrClBrClNNPtBrCl[Ir (C 2O 4)2Cl 2]3-:OOOIrClClOClOOIrOClOClOOIrOCltrans - cis - cis - [Cr (gly )3]:NOONCrNONOONCrNON ON OCrNON ON OCrNOmer - mer - fac - fac - [Pt (gly )2]:NNOPtONNO Ptcis - trans -3.3 (a )已知配合物[M (A -B )2]和[M (A -B )2X 2]型的配合物都是旋光活性的,请分别画出它们的几何结构。
高中化学 第二章 分子结构与性质 2-1 形形色色的分子 价层电子对互斥理论教学案 新人教版选修3-

第一课时形形色色的分子价层电子对互斥理论学习目标:1. 认识共价分子结构的多样性和复杂性。
2.能根据有关理论判断简单分子或离子的构型。
3.能说明简单配合物的成键情况。
[知识回顾]1.键能:气态基态原子形成1_mol化学键释放的最低能量。
键能越大,化学键越稳定。
2.键长:形成共价键的两个原子之间的核间距。
键长越短,键能越大,共价键越稳定。
3.键角:在原子数超过2的分子中,两个共价键的夹角。
键角是描述分子立体结构的重要参数。
4.等电子体是指原子总数相等、价电子总数相同的微粒,其电子总数不一定相同。
[要点梳理]1.形形色色的分子(1)三原子分子(AB2型)(2)四原子分子(AB3型)(3)五原子分子(AB4型)最常见的为正四面体形,如CH4、CCl4等,键角为109°28′。
价层电子对互斥理论(1)内容价层电子对互斥理论认为,分子的立体结构是“价层电子对”相互排斥的结果。
价层电子对是指分子中的中心原子上的电子对,包括σ键电子对和中心原子上的孤电子对。
(2)价层电子对数的确定σ键电子对数可由分子式确定。
而中心原子上的孤电子对数,确定方法如下:中心原子上的孤电子对数=12(a-xb);a为中心原子的价电子数;x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数。
(3)VSEPR模型和分子的立体结构H2O的中心原子上有2对孤电子对,与中心原子上的σ键电子对相加等于4,它们相互排斥形成四面体形VSEPR模型。
略去VSEPR模型中的中心原子上的孤电子对,因而H2O的立体结构为V形。
知识点一常见分子的立体构型1.分子的键角和空间结构[问题探究]1.四原子分子都为平面三角形或三角锥形吗?[答案]不是。
H2O2分子的构型类似于一本打开的书,两个氧原子在两页书的交接处,两个H原子分别在翻开的书的两页上,如图1所示:再如白磷(P4)分子为正四面体形,如图2所示。
2.五原子分子都是正四面体结构吗?[答案]不是,如CH3Cl、CH2Cl2、CHCl3等,虽为四面体结构,但由于碳原子所连的四个原子不相同,四个原子电子云的排斥力不同,使四个键的键角不全相等,所以并不是正四面体结构。
分子结构

H-N=N=N
H-N-N≡N
(3) 可以判断原子之间键长的长短 一般来说键级越大,键能越大,键长越短 在HN3中,N(a)-N(b) 的键长>N(b)-N(c) 的键长 在C6H6中,C-C键的键长都是一样的,都可以通 过键级来判断。
6、Lewis八电子结构式的例外(Special conditions)
形式电荷与元素性质没有任何直接联系,它是共价 键形成的平等与否的标志。
(2) QF的计算公式:
QF = 原子的价电子数 键数 孤电子数 在CO中: QF(C) = 4 3 2 = 1 QF(O) = 6 3 2 = +1
0 0 0
H N N N
H N N N
2
H N N N
(二)共价键的类型
1、σ键 原子轨道沿键轴(两原子核间联线)方向以 “头碰头” 方式重叠所形成的共价键称为σ键。 形成σ键时,原子轨道的重叠部分对于键轴呈圆 柱形对称,沿键轴方向旋转任意角度,轨道的形 状和符号均不改变。
2、π键 原子轨道垂直于键轴以 “肩并肩” 方式重叠 所形成的共价化学键称为π键。形成π键时,原子 轨道的重叠部分对等地分布在包括键轴在内的平面 上、下两侧,形状相同,符号相反,呈镜面反对称。
Positive overlap
Negative overlap Zero overlap
σ bond
π bond
δ bond
综上所述,形成共价键的条件: (i) 要有单电子 (ii) 原子轨道能量相近 (iii) 电子云最大重叠 (iv) 必须相对于键轴具有相同对称性原子轨道(即 波函数角度分布图中的 +、+ 重叠, 、 重叠, 称为对称性一致的重叠)。
(1) 对于奇电子化合物,如NO、NO2等,只能用 特殊的方法表示:
分子结构与性质:分子的几何构型

3
S
F F
2
结论:LP占据水平方向三角形, 稳定 分子构型为变形四面体(跷跷板形)。
电子对的
VP LP 空间构型 5 1 三角双锥 5 2 三角双锥 5 3 三角双锥
分子的
例
空间构型
变形四方体 SF4
T形
ClF3
直线形
XeF2
进一步讨论影响键角的因素:
①π键的存在,相当于孤对电子排斥成
键电子,使键角变小。例如:
强,形成化学键的键能大,生成的分子 稳定。
由于成键原子轨道杂化后.轨道角度分布图的形状发生 了变化(一头大,一头小),杂化轨道在某些方向上的角 度分布,比未杂化的P轨道和s轨道的角度分布大得多, 成键时从分布比较集中的一方(大的一头)与别的原子成 键轨道重叠,能得到更大程度的重叠,因而形成的化 学键比较牢固。
6-3-2 杂化轨道理论
为解决价键理论的局限性,鲍林在价键 理论中引入了杂化轨道的概念。
6-3-2 杂化轨道理论
杂化轨道理论的要点
原子成键时, 参与成键的若干个能级相近的原 子轨道相互“混杂”, 组成一组新轨道 (杂化 轨道),这一过程叫原子轨道的“杂化”。
杂化轨道理论的要点
有几个原子轨道参与杂化,就形成几个杂 化轨道 。 杂化轨道比原来未杂化的轨道成键能力
实例
22
例2BeCls2、(gp) 180° 直线形 σ键 直线形 BeCl2、CO2
Be
激发
sp杂化
2p 2s
2p 2s
sp 2p
能量近似原则 Cl—Be—Cl
Cl
Be
Cl
思考题:为什么不形成BeCl4分子?直线形
杂化类型
sp2杂化——1个s 轨道+2个p 轨道
几何构型的判断方法

几何构型的判断方法引言:几何构型是指在几何学中,由一组点、线、面等几何元素构成的特定形状或结构。
判断几何构型的方法可以帮助我们理解和解决与几何有关的问题。
本文将介绍几种常见的判断几何构型的方法,帮助读者更好地理解和应用几何知识。
一、几何构型的分类几何构型可以分为点、线、面和立体四种基本形式。
其中,点是最简单的几何构型,它没有长度、宽度和高度;线由无数个点连接而成,具有长度但没有宽度和高度;面由无数个线连接而成,具有长度和宽度但没有高度;立体则是由无数个面连接而成,具有长度、宽度和高度。
二、判断点的位置1. 垂直距离:给定两个点A和B,可以通过计算其在坐标系中的垂直距离来判断它们是否重合。
如果垂直距离为0,则表示两点重合。
2. 坐标关系:给定一个点P(x, y),可以根据其坐标在坐标系中的位置判断它所在的象限或坐标轴上。
三、判断线的性质1. 线段长度:给定两个点A和B,可以通过计算线段AB的长度来判断线段的长短。
2. 平行关系:给定两条线段AB和CD,可以通过计算它们的斜率来判断它们是否平行。
如果两条线段的斜率相等,则表示它们平行。
3. 垂直关系:给定两条线段AB和CD,可以通过计算它们的斜率来判断它们是否垂直。
如果两条线段的斜率互为倒数,则表示它们垂直。
四、判断面的性质1. 面积:给定一个多边形,可以通过计算其面积来判断其大小。
常见的计算面积的方法有海伦公式和分割成三角形计算各个三角形面积再求和的方法。
2. 边长关系:给定一个多边形,可以通过计算其各条边的长度来判断各个边的关系。
如果各边的长度相等,则表示该多边形为正多边形。
五、判断立体的性质1. 体积:给定一个立体体积,可以通过计算其体积来判断其大小。
常见的计算体积的方法有计算棱柱、棱锥和球等立体的体积公式。
2. 表面积:给定一个立体体积,可以通过计算其表面积来判断其大小。
常见的计算表面积的方法有计算棱柱、棱锥和球等立体的表面积公式。
六、结论几何构型的判断方法可以帮助我们理解和解决与几何有关的问题。
键类型、分子构型、分子极性判断方法

谓价层电子对包括成键的σ电子对和孤电子对。价层电子对各自占据的
位置倾向于彼此分离得尽可能地远些,这样电子对彼此之间的排斥力最 小,整个分子最为稳定。这样也就决定了分子的空间结构。也正因此, 我们才可以用价层电子对很方便地判断分子的空间结构。例如:甲烷分 子(CH4),中心原子为碳原子,碳有4个价电子,4个氢原子各有一个 电子,这样在中心原子周围有8个电子,4个电子对,所以这4个电子对 互相排斥,为了使排斥力最小,分子最稳定,它们只能按正四面体的方 式排布。这样就决定了CH4的正四面体结构。
用,它们趋向于尽可能的相互远离。于是价层电子对的空间构型与价层
电子对数目的关系如下表所示:
这样已知价层电子对的数目,就可及确定它们的空间构型。 ③分子空间构型的确定。价层电子对有成键电子对和孤电子对之分。
中心原子周围配位原子(或原子团)数,就是健对数,价层电子对的总 数减去键对数,得孤对数。根据键对数和孤对敌,可以确定相应的较稳 定的分子几何构型,如下表所示:
而 SO32-离子却是呈三角锥体,硫是锥顶,三个氧原子是三个锥角,象 一架撑开的照相用的三角架。又例如SO2的三个原子不在一条直线上, 而CO2却是直线分子等等。价层电子对互斥理论用以预测简单分子或离 子的立体结构,我们不难学会用这种理论来预测和理解分子或离子的立
体结构,并用来进一步确定分子或离子的结构。 价层电子对互斥理论认为,在一个共价分子中,中心原子周围电子
成
电
孤
电子 键
子
电
对的 电
对
子
空间 子
数
对
构型 对
目
数
数
电子对的 排列方式
分子的 空间构 实 例
判断分子空间几何构型的简单方法
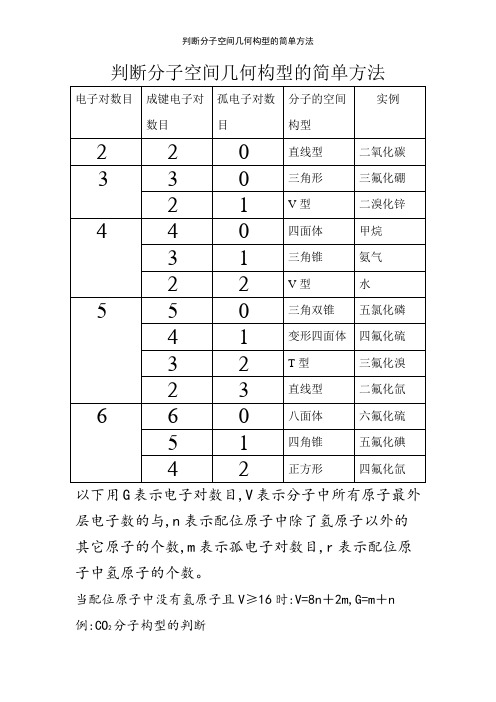
判断分子空间几何构型的简单方法以下用G表示电子对数目,V表示分子中所有原子最外层电子数的与,n表示配位原子中除了氢原子以外的其它原子的个数,m表示孤电子对数目,r表示配位原子中氢原子的个数。
当配位原子中没有氢原子且V≥16时:V=8n+2m,G=m+n 例:CO2分子构型的判断V=4+6×2=8n+2m,这里n=2,∴m=0,∴G=m+n=0+2=2,所以CO2的分子构型为直线型BF3分子构型的判断V=3+7×3=8n+2m,这里n=3,∴m=0,∴G=m+n=0+3=3,所以BF3的分子构型为三角形PCl5分子构型的判断V=5+7×5=8n+2m,这里n=5,∴m=0,∴G=m+n=0+5=5,所以PCl5的分子构型为三角双锥SF4分子构型的判断V=6+7×4=8n+2m,这里n=4,∴m=1,∴G=m+n=1+4=5,所以SF4的分子构型为变形四面体BrF3分子构型的判断V=7+7×3=8n+2m,这里n=3,∴m=2,∴G=m+n=2+3=5,所以BrF3的分子构型为T型SF6分子构型的判断V=6+7×6=8n+2m,这里n=6,∴m=0,∴G=m+n=0+6=6,所以SF6的分子构型为八面体XeF4分子构型的判断V=8+7×4=8n+2m,这里n=4,∴m=2,∴G=m+n=2+4=6,所以XeF4的分子构型为正方形当配位原子中有氢原子且V<16时:V=2r+8n+2m, G=m+n+r。
例:CH4分子构型的判断V=4+1×4=2r+8n+2m,这里r=4,n=0,∴m=0, ∴G=m+n+r=0+0+4=4,所以CH4的分子构型为四面体NH3分子构型的判断V=5+1×3=2r+8n+2m,这里r=3,n=0,∴m=1,∴G=m+n+r=1+0+3=4,所以NH3的分子构型为三角锥 H2O分子构型的判断V=6+1×2=2r+8n+2m,这里r=2,n=0,∴m=2,∴G=m+n+r=2+0+2=4,所以H2O的分子构型为V型HClO分子构型的判断V=1+7+6=2r+8n+2m,这里r=1,n=1,∴m=2,∴G=m+n+r=2+1+1=4,所以HClO的分子构型为V型HNO分子构型的判断V=1+5+6=2r+8n+2m,这里r=1,n=1,∴m=1,∴G=m+n+r=1+1+1=3,所以HNO的分子构型为V型HCN分子构型的判断V=1+4+5=2r+8n+2m,这里r=1,n=1,∴m=0,∴G=m+n+r=0+1+1=2,所以HCN的分子构型为直线型注:以上所介绍的方法只有当V为偶数时才适用,当V为奇数时,只需将V与G瞧成比它们大1的偶数即可!。
2020届高三化学选修三物质结构和性质常考题型——立体结构和杂化类型判断

2020届高三化学选修三物质结构与性质常考题型——立体结构和杂化类型判断.DOC【方法和规律】1、立体构型的判断方法——价层电子对互斥理论(1) 中心原子价层电子对数===σ键电子对数+孤电子对数中心原子的价电子数配位原子的化合价的总和(2)中心原子的价层电子对数2中心原子的最外层电子数配位原子的化合价的总和中心原子的价层电子对数2【微点拨】① 配位原子是指中心原子以外的其它原子(即与中心原子结合的原子)② 若是离子,则应加上或减去与离子所带的电荷数(阴加阳减)③氧、硫原子若为配位原子,则其化合价规定为" 零”,若为中心原子,则价电子数为6 (3)价层电子对互斥理论判断分子空间构型的具体方法PO43—H3O+2、中心原子的杂化类型判断规律:杂化轨道数==价层电子对数==σ键电子对数+孤电子对数价层电子对数杂化方式4sp3杂化3sp2杂化2sp 杂化用中心原子的价层电子对数中心原子的价电子数配位原子的化合价的总和,2来迅速判断(见上表)技巧2:若有多个中心原子时,则根据:“ 杂化轨道数==价层电子对数==σ键电子对数+孤电子对数”来判断如:三聚氰胺分子的结构简式如图所示,分析氮原子、碳原子的杂化类型杂化类型价层电子对数σ键电子对数孤电子对数孤电子对数确定方法环外氮原子sp3431氮原子最外层有5 个电子,形成了3环上氮原子sp2321对共用电子对,则有一对孤对电子环上碳原子sp2330碳原子最外层4 个电子,形成了4 对共用电子对,所以碳上无孤对电子技巧3:根据杂化轨道的空间分布构型判断①若杂化轨道在空间的分布为正四面体形或三角锥形,则分子的中心原子发生sp3杂化②若杂化轨道在空间的分布呈平面三角形,则分子的中心原子发生sp2杂化③若杂化轨道在空间的分布呈直线形,则分子的中心原子发生sp 杂化技巧4:根据杂化轨道之间的夹角判断①若杂化轨道之间的夹角为109°28,′则分子的中心原子发生sp3杂化②若杂化轨道之间的夹角为120°,则分子的中心原子发生sp2杂化③若杂化轨道之间的夹角为180°,则分子的中心原子发生sp 杂化技巧5:根据等电子原理进行判断CO 2是直线形分子,CNS -、N3-与CO 2是等电子体,所以分子构型均为直线形,中心原子均采用sp 杂化技巧6:根据分子或离子中有无π键及π键数目判断没有π键为sp3杂化,含一个π键为sp2杂化,含两个π键为sp 杂化【真题感悟】1、[2019·全国卷Ⅰ ·节选]乙二胺(H 2NCH 2CH 2NH 2)是一种有机化合物,分子中氮、碳的杂化类型分别是 _______________2、[2019 ·全国卷Ⅱ ·节选]元素As与N 同族。
VSEPR模型判别分子构型

电子对的空间分布
空间分布
几何构型
2
直线
3
在角形
4
四面体
5
三角双锥
6
八面体
VSEPR模型简朴通俗,应用简单易行,显现了它的独特魅力并引人入胜。
3、VSEPR模型判别分子构型的基本程序
中心原子的价层如果没有孤电子对,那么每一个电子对就代表一个共价键,此时电子对的空间分布就是分子的几何构型。例如,BeCl2分子中Be原子的两个价电子分别与两个Cl原子形成的两个共价键,没有孤电子对,故它是直线型结构。又如CH4分子中的C原子价层有四个电子对,这四个价电子对代表了四条C-H健,C原子价层无孤电子对,故CH4属四面体结构。
6、根据价层电子对斥力最小原则确定分子或离子的实际几何构型
对于含有5个及5个以上价层电子对、其中并含有孤电子对的分子或离子,如何根据价层电子对斥力最小原则判断其实际构型,是VSEPR应用的又一难点。
例如,SF4属于AX4L1=AY5,其VSEPR理想模型为三角双锥体,排除孤对电子的分子立体结构(由于孤对电子的位置不同)有两种可能的模型:
VSEPR模型判别分子构型
2009-4-6 14:38:13作者- hongzhi来源-录入 阅读634次 【字体:小大】返回前页
1940年,西奇威克(Sidgwick)等在总结实验事实的基础上提出了一种简单的模型,用于预测简单分子或离子的立体结构。六十年代初,吉列斯比(RJ.Gillespie)和尼霍尔姆(Nyholm)等发展了这一模型。因该模型思想方法质朴浅显,在预见分子结构方面简单易行,而成为大学基础化学的基本教学内容,并于新一轮课程改革中引入高中化学教学。这就是价层电子对互斥模型(Valence Shell Electron Pair Repulsion),常以其英文的缩写形式VSEPR来表示。
判断分子空间几何构型的简单方法
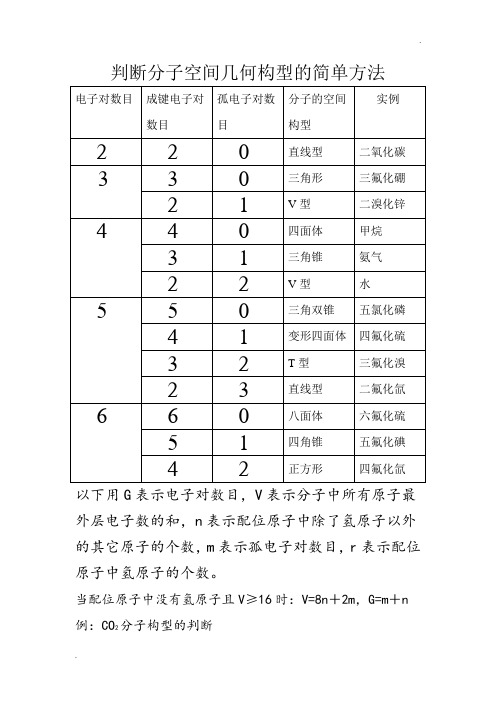
判断分子空间几何构型的简单方法以下用G表示电子对数目,V表示分子中所有原子最外层电子数的和,n表示配位原子中除了氢原子以外的其它原子的个数,m表示孤电子对数目,r表示配位原子中氢原子的个数。
当配位原子中没有氢原子且V≥16时:V=8n+2m,G=m+n 例:CO2分子构型的判断V=4+6×2=8n+2m,这里n=2,∴m=0,∴G=m+n=0+2=2,所以CO2的分子构型为直线型BF3分子构型的判断V=3+7×3=8n+2m,这里n=3,∴m=0,∴G=m+n=0+3=3,所以BF3的分子构型为三角形PCl5分子构型的判断V=5+7×5=8n+2m,这里n=5,∴m=0,∴G=m+n=0+5=5,所以PCl5的分子构型为三角双锥SF4分子构型的判断V=6+7×4=8n+2m,这里n=4,∴m=1,∴G=m+n=1+4=5,所以SF4的分子构型为变形四面体BrF3分子构型的判断V=7+7×3=8n+2m,这里n=3,∴m=2,∴G=m+n=2+3=5,所以BrF3的分子构型为T型SF6分子构型的判断V=6+7×6=8n+2m,这里n=6,∴m=0,∴G=m+n=0+6=6,所以SF6的分子构型为八面体XeF4分子构型的判断V=8+7×4=8n+2m,这里n=4,∴m=2,∴G=m+n=2+4=6,所以XeF4的分子构型为正方形当配位原子中有氢原子且V<16时:V=2r+8n+2m, G=m+n+r。
例:CH4分子构型的判断V=4+1×4=2r+8n+2m,这里r=4,n=0,∴m=0,∴G=m+n+r=0+0+4=4,所以CH4的分子构型为四面体NH3分子构型的判断V=5+1×3=2r+8n+2m,这里r=3,n=0,∴m=1,∴G=m+n+r=1+0+3=4,所以NH3的分子构型为三角锥 H2O分子构型的判断V=6+1×2=2r+8n+2m,这里r=2,n=0,∴m=2,∴G=m+n+r=2+0+2=4,所以H2O的分子构型为V型HClO分子构型的判断V=1+7+6=2r+8n+2m,这里r=1,n=1,∴m=2,∴G=m+n+r=2+1+1=4,所以HClO的分子构型为V型HNO分子构型的判断V=1+5+6=2r+8n+2m,这里r=1,n=1,∴m=1,∴G=m+n+r=1+1+1=3,所以HNO的分子构型为V型HCN分子构型的判断V=1+4+5=2r+8n+2m,这里r=1,n=1,∴m=0,∴G=m+n+r=0+1+1=2,所以HCN的分子构型为直线型注:以上所介绍的方法只有当V为偶数时才适用,当V 为奇数时,只需将V和G看成比它们大1的偶数即可!。
判断分子空间几何构型的简单方法

判断分子空间几何构型的简单方法
分子空间几何的构型是研究分子的化学性质和关联性质的重要参考,由此可以知道物质的密度、电荷密度分布特征和电子激发态的迁移以及分子的位移和变形,从而能够更好的预测分子的后续反应特性。
在实际的研究过程中,如何判断分子空间几何构型,是一个关于分子结构与功能之间关系的重要步骤。
最常用的方法是通过实验观察,采用X射线衍射或NMR技术,对分子中的原子进行测看和定位,获取分子空间几何构型的具体信息,从而判断该物质的构型模式。
但是,随着科技的发展,计算机模拟技术也在不断完善,它将实验所需的大量重复工作,转化为电脑的模拟运算,从而使得对分子构型的判断非常简单。
另一种常用的方法是对分子的构型进行理论推演,根据分子中所包含的原子及其电子表象力、共价键角以及化学键长等特征,以某种特定斥力场下的极限决定方程来预测分子的几何构型、结构和性质,从而进行判断。
而这种方法的优势在于可以较为直观的得到分子的轨道构型,而对于复杂的分子构型来说也是一种很直接的判断方法。
综上所述,判断分子空间几何构型的简单方法有实验观察和计算理论推演两种。
实验观察可以采用X射线衍射或NMR技术,而理论推演则是根据分子中所包含的原子及其相关特征,利用某种特定斥力场下的极限决定方程来判断分子的构型。
虽然这两种方法都能够较快得到预期结果,但在实际中,如何根据判断出来的结果应用到研究中还需要仔细结合该分子特性深入思考。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
价层电子对理论(VSEPR theory)预测分子空间构型步骤为:
1.确定中心原子中对数
中心原子的价层电子数和配体所提供的共用电子数的总和减去离子带电荷数除以2[价电子对数=1/2(中心原子的价电子数+配位原子提供的σ电子数-离子电荷代数值)],即为中心原子的价层电子对数。规定:(1)作为配体,卤素原子和H原子提供1个电子,氧族元素的原子不提供电子;(2)作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;(3)对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数;(4)计算电子对数时,若剩余1个电子,亦当作1对电子处理。(5)?双键、叁键等多重键作为1对电子看待。
平面正方形
ICl4
实例分析:试判断PCl5?离子的空间构型。
解:P离子的正电荷数为5,中心原子P有5个价电子,Cl原子各提供1个电子,所以P原子的价层电子对数为(5+5-0)/2 = 5,其排布方式为三角双锥。因价层电子对中无孤对电子,所以PCl5为三角双锥构型。
实例分析:试判断H2O分子的空间构型。
:面体
0
AB4
正四面体
CH4
1
:AB3
三角锥
NH3
2
. .
:AB2
V型
H2O
5
三角双锥
0
AB5
三角双锥
PCL5
1
:?AB4
变形四面体
TeCl4
2
. .
:AB3
T型
ClF3
3
. .
:?AB2
. .
直线
I3-
6
正八面体
0
AB6
正八面体
SF6
1
:AB5
四方锥
IF5
2
. .
:AB4
解:O是H2O分子的中心原子,它有6个价电子,与O化合的2个H原子各提供1个电子,所以O原子价层电子对数为(6+2)/2 = 4,其排布方式为四面体,因价层电子对中有2对孤对电子,所以H2O分子的空间构型为V形。
2.判断分子的空间构型
根据中心原子的价层电子对数,从表9-4中找出相应的价层电子对构型后,再根据价层电子对中的孤对电子数,确定电子对的排布方式和分子的空间构型。
电子对数
电子对空间排布
孤电子对数
分子类型
分子形状(分子空间构型)
实例
2
直线
0
AB2
直线
BeCl2
3
平面三角形
0
AB3
平面三角形
BF3
1
. .
